БИОХИМИЯ, 2023, том 88, вып. 7, с. 1254 - 1267
УДК 577.1
БЕЛОК-БЕЛКОВЫЕ ИНТЕРФЕЙСЫ КАК МИШЕНИ ЛЕКАРСТВ:
ОБЩИЙ ДЛЯ ПИРИДОКСАЛЬ-5′-ФОСФАТ-ЗАВИСИМЫХ
ФЕРМЕНТОВ МОТИВ ДЛЯ ПОЛУЧЕНИЯ КОФЕРМЕНТА
ОТ ЕГО ПРОДУЦЕНТОВ
© 2023 В.А. Алешин1,2, В.И. Буник1,2,3*
1 Московский государственный университет имени М.В. Ломоносова,
НИИ физико-химической биологии имени А.Н. Белозерского, отдел биокинетики,
119234 Москва, Россия; электронная почта: bunik@belozersky.msu.ru
2 Сеченовский Университет, кафедра биохимии, 119048 Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119234 Москва, Россия
Поступила в редакцию 08.02.2023
После доработки 22.03.2023
Принята к публикации 10.04.2023
Пиридоксаль-5′-фосфат (PLP), фосфорилированная форма витамина B6, является кофермен-
том многочисленных реакций, включая те, что меняются и/или имеют прогностическое значение
при раке. Вследствие высокой реакционной способности PLP, в том числе к клеточным белкам,
предполагается, что он может напрямую передаваться от белков-доноров к использующим его
акцепторам. Цель данной работы состоит в идентификации предполагаемого данной гипотезой
интерфейса для связывания ограниченного числа доноров PLP, а именно пиридоксалькиназы
(PdxK), пиридокс(ам)ин-5′-фосфатоксидазы (PNPO) и PLP-связывающего белка (PLPBP), мно-
жеством PLP-зависимых ферментов. Экспериментально подтвержденные комплексы между доно-
рами и акцепторами PLP показывают взаимодействие PdxK и PNPO с наиболее представленными
структурными типами акцепторов PLP (типы I и II), а PLPBP - с акцепторами редких структур-
ных типов III и V. Общий мотив во множестве PLP-зависимых ферментов типов I и II определен
путем выравнивания последовательностей и трехмерных структур экспериментально подтвер-
жденных партнеров PdxK и PNPO. Мотив простирается от поверхности PLP-зависимых фермен-
тов до центров связывания PLP и представлен поверхностной альфа-спиралью, частично скрытым
бета-тяжом и неупорядоченными участками структуры. Патогенность мутаций ферментов чело-
века в мотиве или рядом с ним, но вне активных центров подтверждает функциональное значение
мотива, который может быть интерфейсом для переноса кофермента в комплексах PLP-зависимых
ферментов с ферментами синтеза PLP. Специфические аминокислотных остатки этого общего мо-
тива могут быть использованы для создания селективных ингибиторов доставки кофермента PLP-
зависимым ферментам, критически важным для пролиферации опухолевых клеток.
КЛЮЧЕВЫЕ СЛОВА: CBS, PdxK, PNPO, PLPBP, пиридоксаль-5′-фосфат-зависимый фермент, TAT,
метаболизм витамина B6, метаболизм аминокислот, метаболизм одноуглеродных фрагментов.
DOI: 10.31857/S0320972523070138, EDN: FYKHQZ
ВВЕДЕНИЕ
EC-классов [1]. Многие из этих реакций, в осо-
бенности те, которые связаны с метаболизмом
Ферменты, использующие пиридоксаль-5′-
аминокислот, имеют решающее значение не
фосфат (PLP) в качестве кофермента, имеют
только для метаболических перестроек, лежа-
более 300 различных каталитических функций
щих в основе злокачественной трансформации,
и принадлежат к пяти из семи существующих но и для элиминации злокачественных клеток.
Принятые сокращения: ABAT - ГАМК-трансаминаза; CBS - цистатионин β-синтаза; dpaL - диаминопропионат-
аммиак-лиаза; GOT - аспартатаминотрансфераза; PdxK - пиридоксалькиназа; PL - пиридоксаль; PLP - пиридок-
саль-5′-фосфат; PLPBP - PLP-связывающий белок, также известный как PROSC; PNPO - пиридокс(ам)ин-5′-фосфат-
оксидаза; SHMT - серингидроксиметилтрансфераза; SDSL - сериндегидратаза-подобный белок; SRR - серинрацемаза;
ТАТ - тирозинаминотрансфераза.
* Адресат для корреспонденции.
1254
МОТИВ ДЛЯ ПЕРЕНОСА ПИРИДОКСАЛЬФОСФАТА
1255
Например, PLP-зависимые трансаминазы управ-
злокачественной трансформации нормальных
ляют активацией и дифференцировкой Т-кле-
клеток, стимулируя повреждение в них ДНК
ток, необходимых для противоопухолевого от-
и ослабляя иммунный ответ [15]. Фармако-
вета
[2]. Снижение уровня PLP-зависимой
логическая регуляция специфических PLP-
тирозинаминотрансферазы (TAT), кодируемой
зависимых реакций может предоставить новые
геном TAT, определяет патогенность гепато-
инструменты для селективной борьбы с раз-
целлюлярной карциномы [3], при этом низ-
личными видами рака, поскольку они суще-
кая экспрессия катаболических ферментов
ственно зависят от некоторых из этих реакций.
тирозина предсказывает неблагоприятный ис-
Несмотря на ряд известных ингибиторов PLP-
ход [4]. Различные типы рака демонстрируют
зависимых ферментов, создание новых инги-
изменения в экспрессии PLP-зависимой ци-
биторов для эффективной регуляции PLP-за-
статионин-β-синтазы (CBS), связанные с не-
висимых процессов in vivo продолжается [16].
благоприятным прогнозом, что соответствует
И PLP, и его каталитически неактивный
существенной роли фермента в метаболизме
предшественник PL представляют собой ре-
одноуглеродных фрагментов, включающих ре-
акционноспособные альдегиды, которые мо-
акции метилирования и транссульфурилиро-
гут модифицировать группы -NH2 в белках и
вания [5, 6].
низкомолекулярных соединениях. Последние
PLP является основным компонентом пула
включают аминоксиуксусную кислоту, широко
витамеров B6, содержание которого в сыво-
используемую для ингибирования PLP-зави-
ротке крови и эритроцитах соответствует диа-
симых трансаминаз. Химическая реакционная
пазону микромолярных концентраций [7, 8].
способность объясняет токсичность PLP и PL в
PLP гидролизуется до пиридоксаля (PL) либо
чрезмерных концентрациях. Например, в кон-
неферментативно, либо с помощью многочис-
центрации 0,5 мМ эти витамеры намного эф-
ленных фосфатаз, включая PLP-специфиче-
фективнее убивают различные раковые клетки,
скую фосфатазу (PLPP или хронофин), кото-
чем пиридоксамин или пиридоксин [17]. В этой
рая находится под контролем индуцируемого
связи было высказано предположение, что в
гипоксией транскрипционного фактора HIF1,
биосистемах PLP передается непосредствен-
регулирующего метаболизм Т-клеток [2]. В ка-
но от белков-доноров к ферментам, исполь-
честве белков-доноров PLP известны два про-
зующим PLP в качестве кофермента (акцеп-
дуцирующих PLP фермента - пиридоксаль-
торам PLP) [18-20]. Однако среди ферментов,
киназа (PdxK, ген PDXK) и пиридокс(ам)ин-5′-
использующих PLP в качестве кофермента,
фосфатоксидаза (PNPO, ген PNPO) - и PLP-
выделяют до семи структурных типов без зна-
связывающий белок (PLPBP, ген PLPBP), ко-
чительной гомологии [1, 21]. Таким образом,
торый связывает PLP ковалентно с образова-
в рамках гипотезы о прямой передаче PLP три
нием основания Шиффа между альдегидной
известных белка-донора PLP - PdxK, PNPO
группой PLP и остатком лизина PLPBP [9-11].
и PLPBP - должны образовывать специфи-
При раке изменяются как PLP-зависи-
ческие комплексы со множеством структурно
мые реакции, так и метаболизм витамина B6.
разных белков-акцепторов PLP. Другими сло-
Маркеры вызванной воспалением деградации
вами, гипотеза подразумевает существование
предшественника PLP пиридоксаля коррели-
подмножеств акцепторов PLP с общими струк-
руют с заболеваемостью раком, особенно для
турными мотивами, позволяющими каждому
рака легкого, в значительной степени обуслов-
подмножеству связывать PdxK, и/или PNPO,
ленного воспалением [12]. Образование PLP
и/или PLPBP. Цель данной работы - обнару-
из PL с помощью PdxK и активности PLP-за-
жить такие структурные мотивы, подразумевае-
висимой орнитиндекарбоксилазы (ген ODC1)
мые гипотезой о прямом переносе PLP от его
и митохондриальной аспартатаминотрансфе-
доноров к акцепторам, в множестве структурно
разы (ген GOT2) являются ключевыми для про-
различных акцепторов PLP. Для этого после
лиферации клеток миелоидного лейкоза [13].
идентификации экспериментально подтвер-
В отличие от уровня мРНК PdxK, уровень
жденных взаимодействий между акцепторами и
самого фермента увеличивается при раке лег-
донорами PLP мы определили локальное сход-
кого, и это увеличение коррелирует с хоро-
ство негомологичных белков-акцепторов PLP,
шим прогнозом [14]. В целом, анализ изме-
взаимодействующих с тем или иным донором,
нений метаболизма витамина В6 в различных
используя информацию о последовательностях
раковых клетках указывает на очень сложную
и трехмерных структурах акцепторов. В резуль-
взаимосвязь между его изменениями и про-
тате был обнаружен общий мотив наиболее
гнозом заболевания. Так, дефицит B6 вреден
представленных структурных типов PLP-зави-
для раковых клеток, но он также способствует
симых ферментов (типы I и II), который может
БИОХИМИЯ том 88 вып. 7 2023
1256
АЛЕШИН, БУНИК
служить интерфейсом для связывания PdxK
Для получения последовательностей белков
или PNPO с последующим переносом PLP от
структурного типа II млекопитающих, соответ-
этих доноров к акцепторам типов I и II.
ствующих мотиву белка диаминопропионат-
Функциональная значимость найденного
аммиак-лиазы (dpaL), использовали выравни-
мотива подтверждается патогенными мутация-
вание структур в программе PyMOL. Последо-
ми аминокислотных остатков внутри мотива
вательности, соответствующие мотиву dpaL, в
или рядом с ним, не входящих в активные цен-
дальнейшем использовались для подготовки
тры ферментов. Такие мутации известны для
«лого» с помощью GLAM2.
моногенных заболеваний, связанных с вари-
Множественное выравнивание последова-
антами PLP-зависимой цистатионин-β-син-
тельностей. Множественное выравнивание пос-
тазы или тирозинаминотрансферазы челове-
ледовательностей Сlustal Omega [26] приме-
ка [22, 23]. Поскольку измененная экспрессия
нялось для выравнивания последовательнос-
этих ферментов связана со злокачественной
тей гомологичных белков (общая идентич-
трансформацией и плохим прогнозом, фарма-
ность >30%).
кологическая регуляция белок-белковых взаи-
модействий, участвующих в переносе PLP
в активные центры этих ферментов, может
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
представлять собой новую стратегию разра-
ботки специфических ингибиторов отдельных
Взаимодействия PNPO, PdxK и PLPBP с
PLP-зависимых реакций. Такая стратегия мо-
PLP-зависимыми ферментами. Наш поиск по
жет быть основана на существовании специ-
публикациям и находящимся в открытом до-
фических для отдельных PLP-зависимых фер-
ступе базам данных белок-белковых взаимо-
ментов аминокислотных остатков в структуре
действий (BioGrid [27], IntAct [28], String [29])
общего для типов I и II мотива.
выявил экспериментально подтвержденные
физические взаимодействия между PLP-свя-
зывающими белками и тремя известными бел-
МАТЕРИАЛЫ И МЕТОДЫ
ками-донорами PLP (таблица).
Девять из двенадцати подтвержденных
Биоинформатический поиск мотива. Для по-
взаимодействий относятся к PLP-зависимым
иска консервативных мотивов в PLP-зави-
ферментам структурного типа I, т.е. к наибо-
симых ферментах на основе последователь-
лее распространенному типу, включающему
ностей использовали программу GLAM2,
более 75% PLP-зависимых белков [1]. Одна-
версии 5.4.1 [24], доступную на онлайн-сер-
ко среди подтвержденных партнеров доно-
ров PLP есть и представители PLP-зависимых
на 25 сентября 2022 г.). Получая в качестве
белков менее распространенных структурных
входных данных выбранные последователь-
типов II, III и V (таблица). Найденные взаи-
ности, этот алгоритм находит мотивы через
модействия показывают, что белки структур-
локальные выравнивания с гэпами. Входные
ного типа I взаимодействуют с PdxK, PNPO
последовательности были определены нашим
или с обоими ферментами, синтезирующи-
поиском опубликованных данных об экспери-
ми PLP (таблица). С другой стороны, наиболее
ментально выявленных взаимодействиях с до-
изученный донор PLP - PdxK, для которой
норами PLP. Использовались рекомендуемые
выявлено наибольшее количество белков-
параметры алгоритма, но мотив должен был
партнеров, демонстрирует связывание PLP-
находиться во всех последовательностях.
зависимых ферментов структурно различных
Визуализация и выравнивание структур.
типов I и II (таблица). Наконец, два извест-
PyMOL v1.7 (PyMOL Molecular Graphics Sys-
ных партнера PLPBP, включая самого PLPBP,
tem, Schrödinger, LLC.) использовалась для ви-
претерпевающего гомоолигомеризацию, от-
зуализации белков, как описано в подписях
носятся к разным структурным типам III и V.
к соответствующим рисункам. Белки пред-
Кодируемый PLPBP белок и его бактериальные
ставлены в виде моделей с разными цепями,
ортологи демонстрируют высокое структур-
показанными разными оттенками серого. Для
ное сходство с N-концевым доменом некоторых
ионов или лигандов используется стандартный
PLP-зависимых ферментов, таких как бактери-
цветовой код. Структуры загружаются из бан-
альная аланинрацемаза и эукариотическая орни-
ка данных белков PDB. При необходимости
тиндекарбоксилаза, но для PLPBP не было обна-
использовали Protein-BLAST [25] для иденти-
ружено ферментативной активности [34, 35].
фикации гомологов белков, имеющихся в базе
Таким образом, опубликованные данные
данных.
о подтвержденных взаимодействиях между
БИОХИМИЯ том 88 вып. 7 2023
МОТИВ ДЛЯ ПЕРЕНОСА ПИРИДОКСАЛЬФОСФАТА
1257
Экспериментально подтвержденные взаимодействия PLP-зависимых ферментов с белками-донорами PLP
Донор
№
PLP-зависимый фермент
Организм, метод идентификации
Тип
Ссылка
PLP
4-аминобутиратаминотрансфераза,
человек, ко-фракционирование
1
I
[30]
ABAT, P80404, EC: 2.6.1.19
и масс-спектрометрия
орнитинаминотрансфераза,
человек, ко-фракционирование
2
I
[30]
OAT, P04181, EC: 2.6.1.13
и масс-спектрометрия
аспартатаминотрансфераза,
овца, эмиссионная анизотропия
3
I
[31]
GOT1, W5PS88, EC: 2.6.1.1
и аффинная хроматография
аланинаминотрансфераза,
свинья, поляризация флуоресценции
PdxK
4
I
[20]
GPT, A0A287BMB4, EC: 2.6.1.2
и поверхностный плазмонный резонанс
глутаматдекарбоксилаза,
свинья, поляризация флуоресценции
5
I
[20]
GAD1, P48319, EC: 4.1.1.15
и поверхностный плазмонный резонанс
серингидроксиметилтрансфераза,
Geobacillus stearothermophilus,
6
I
[32]
glyA, Q7SIB6, EC: 2.1.2.1
поверхностный плазмонный резонанс
Dдиаминопропионат-аммиак-лиаза,
Salmonella typhimurium,
7
II
[32]
dpaL, P40817, EC: 4.3.1.15
поверхностный плазмонный резонанс
серингидроксиметилтрансфераза,
кролик, поляризация
8
I
[33]
SHMT1, P07511, EC: 2.1.2.1
и кинетика флуоресценции
аспартатаминотрансфераза,
Escherichia coli, поляризация
PNPO
9
I
[33]
aspC, P00509, EC: 2.6.1.1
флуоресценции и кинетика
L-треонинальдолаза,
E. coli, поляризация флуоресценции
10
I
[33]
ltaE, P75823, EC: 4.1.2.48
и кинетика
гликогенфосфорилаза,
человек, химическая сшивка
11
V
[34]
PYGB, P11216, EC: 2.4.1.1
и масс-спектрометрия
PLPBP
белок гомеостаза PLP,
человек, химическая сшивка
12
III
[34]
PLPBP, O94903
и масс-спектрометрия
Примечание. PLP-зависимые ферменты приведены вместе с названиями кодирующих их генов и идентификаторами
Uniprot.
белками-донорами и акцепторами PLP пока-
ров и PNPO, и PdxK (рис. 1, б). В этом случае
зывают: (1) PdxK может направлять свой про-
мотив становится на пять остатков короче на
дукт PLP к ферментам-акцепторам структур-
N-конце и на два остатка длиннее - на С-кон-
ных типов I и II; (2) PdxK и PNPO могут иметь
це (рис. 1, панель б в сравнении с панелью а).
общих партнеров среди ферментов-акцепто-
То есть объединение партнеров PdxK и PNPO
ров структурного типа I; (3) PLPBP взаимо-
слегка модифицирует лишь концевые части
действует с белками-акцепторами PLP более
мотива, не затрагивая его основную часть.
редких структурных типов III и V.
Сравнение рис. 1, г и 1, д показывает, что
Анализ последовательностей на пред-
найденный мотив, общий для всех партне-
мет локального сходства с использованием
ров PdxK и PNPO, имеет сходную вторичную
GLAM2 (версия 5.4.1) [24] выявил мотив, об-
структуру в PLP-зависимых ферментах разных
щий для всех PLP-зависимых партнеров PdxK
структурных типов I и II. Мотив представлен
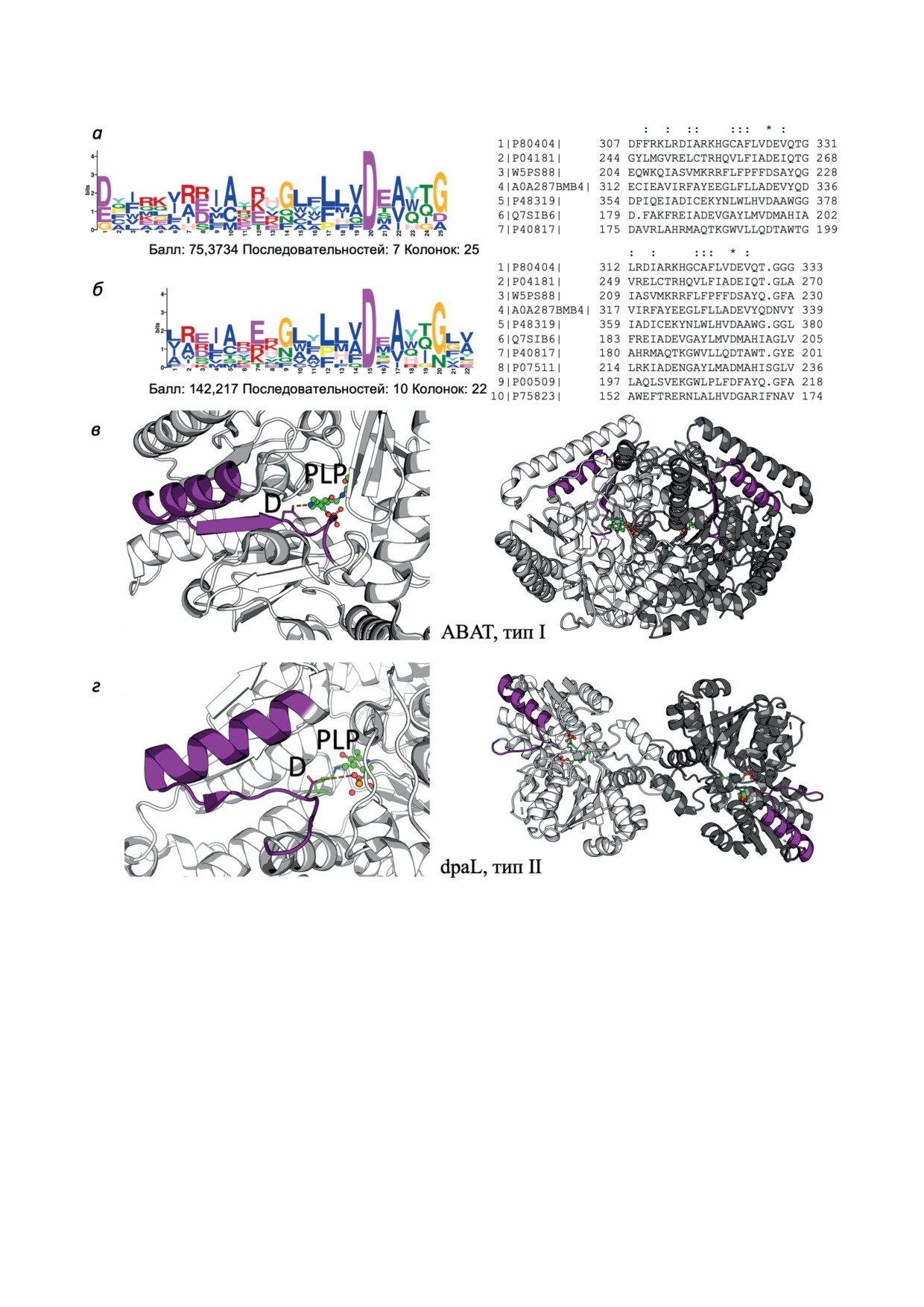
(таблица, №№ 1-7), показанный на рис. 1, а.
альфа-спиралью, бета-цепью и соединитель-
В хорошем соответствии с существованием
ной и С-концевой петлями. Мотив в структу-
общих партнеров PdxK и PNPO, таких как
рах всех перечисленных в таблице партнеров,
серингидроксиметилтрансфераза (SHMT) и
взаимодействующих с PdxK и PNPO, показан
аспартатаминотрансфераза (GOT) (таблица),
на дополнительном рис. S1 в Приложении.
сходный мотив был обнаружен при поиске с
Примечательно, что в ферментах структур-
использованием последовательностей партне-
ного типа I обнаруженный мотив был ранее
БИОХИМИЯ том 88 вып. 7 2023
1258
АЛЕШИН, БУНИК
Рис. 1. Общий идентифицированный GLAM2 мотив PLP-связывающих ферментов, которые взаимодействуют с до-
норами PLP - PdxK и PNPO. а - Логотип и последовательности мотива, обнаруженные в связывающихся с PdxK
ферментах млекопитающих и бактерий; б - логотип и последовательности мотива, обнаруженного в связывающихся
с PdxK и PNPO ферментах млекопитающих и бактерий. в - Детальный вид мотива (слева) и его локализации в ди-
мерной структуре (справа) ГАМК-трансаминазы (ABAT, тип I, структура: 4ZSW); г - детальный вид мотива (слева)
и его локализация в димерной структуре (справа) диаминопропионат-аммиак-лиазы (dpaL, тип II, структура: 5YGR).
Номера последовательностей на панелях (а) и (б) идентичны таковым в таблице
идентифицирован как специфический именно
что и ферменты структурного типа I (табли-
для этого типа структурный элемент, причем
ца, рис. 1). Важно отметить, что спираль и
у этих ферментов конец бета-тяжа включает
петли мотива доступны окружающей среде и
консервативный остаток аспартата, который
в димерных формах ферментов (рис. 1, г и д;
взаимодействует с PLP [21, 36]. В результате
дополнительный рис. S1 в Приложении), что
нашей работы этот общий мотив был найден
указывает на возможность участия обнаружен-
и в ферментах структурного типа II, которые
ного общего мотива в гетерологических белок-
взаимодействуют с теми же донорами PLP,
белковых взаимодействиях.
БИОХИМИЯ том 88 вып. 7 2023
МОТИВ ДЛЯ ПЕРЕНОСА ПИРИДОКСАЛЬФОСФАТА
1259
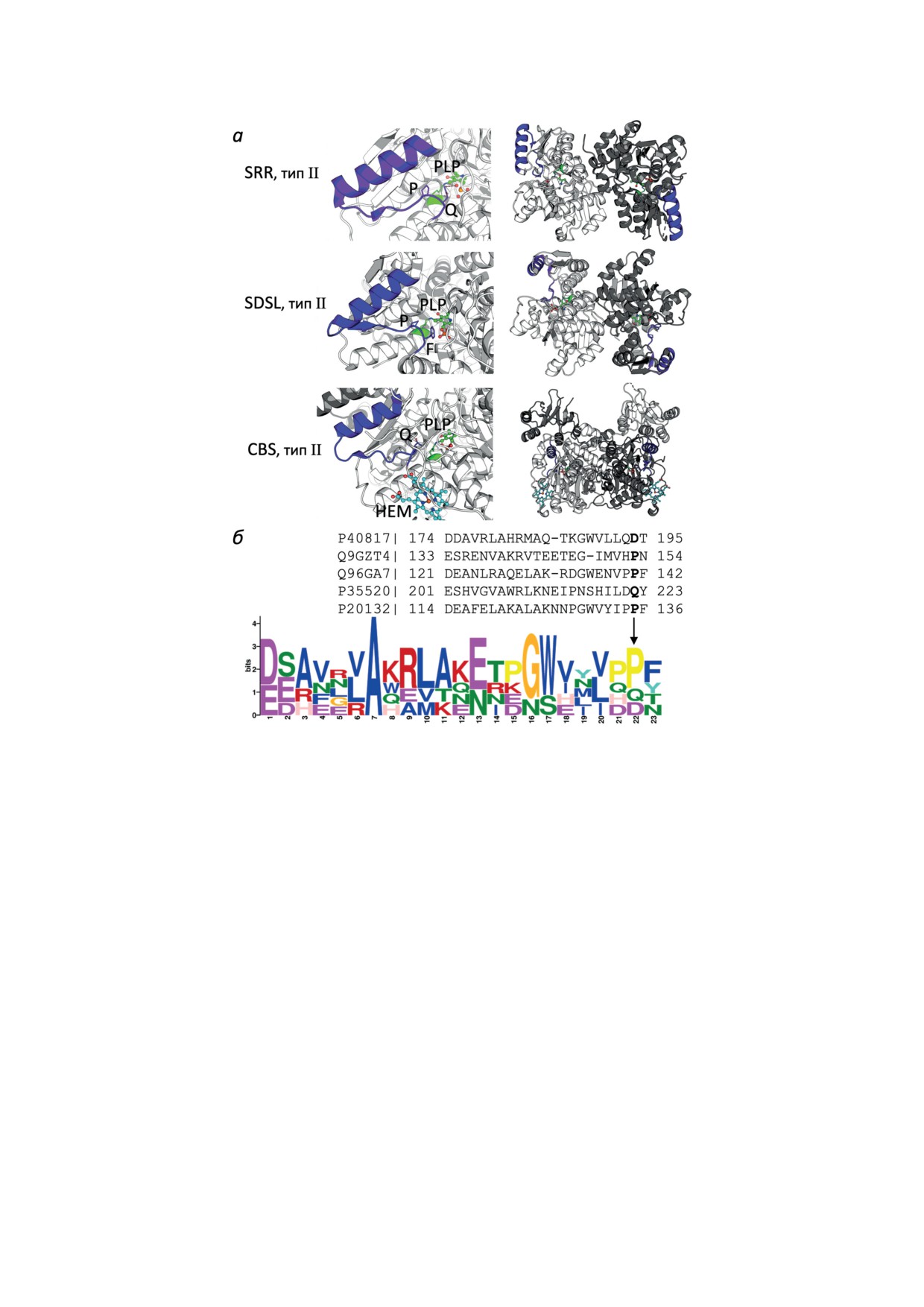
Рис. 2. Идентификация общего мотива PLP-зависимых ферментов в белках структурного типа II млекопитающих с
использованием мотива, обнаруженного во взаимодействующем с PdxK бактериальном белке структурного типа II dpaL.
а - Общий мотив белков структурного типа II млекопитающих, показанный синим, соответствует фиолетовому мо-
тиву в белке dpaL, показанном на рис. 1. В явном виде показаны остатки, выровненные с консервативным аспартатом
в мотиве PLP-зависимых ферментов структурного типа I. PLP в активном центре показан зеленым, гем в CBS (HEM)
показан голубым. Увеличенное изображение мотива в мономерах (слева) сопровождается визуализацией мотива в ди-
мерах ферментов (справа). Используются следующие структуры PDB: серинрацемаза (SRR) - 6ZSP; сериндегидратаза-
подобный белок (SDSL) - 2RKB; цистатионин-β-синтаза (CBS) - 4COO. б - Последовательности, соответствующие
мотиву белка dpaL, полученные после структурного выравнивания PLP-зависимых ферментов структурного типа II,
и логотип мотива. Для получения логотипа в качестве известного PLP-зависимого фермента структурного типа II чело-
века использована и L-сериндегидратаза/L-треониндезаминаза (61% идентичности с SDSL), для которой не получена
кристаллическая структура. Последовательность L-сериндегидратазы/L-треониндезаминазы добавлена с использо-
ванием множественного выравнивания последовательностей Clustal Omega с гомологичными белками структурного
типа II. Остатки мотива PLP-зависимых ферментов структурного типа II, выровненные с консервативным остатком
аспартата в мотиве PLP-зависимых ферментов структурного типа I и в белке dpaL типа II, выделены жирным шриф-
том и отмечены стрелкой на логотипе мотива. Использованные на рисунке идентификаторы Uniprot: P40817 - dpaL;
Q9GZT4 - SRR; Q96GA7 - SDSL; P35520 - CBS; P20132 - L-сериндегидратаза/L-треониндезаминаза
На следующем этапе исследования были
аспартата активного центра [36]. Добавление
разработаны процедуры для идентификации
последовательностей ферментов структур-
мотива в PLP-зависимых ферментах структур-
ного типа I тирозинтрансаминазы (P17735) и
ного типа I и II, физическое взаимодействие
кинуренинтрансаминазы 1 (Q16773) к после-
которых с продуцентами PLP неизвестно. Как
довательностям 10 известных партнеров PdxK
упоминалось выше, во всех ферментах струк-
и PNPO, показанным в таблице, с последую-
турного типа I этот мотив был идентифици-
щим повторным поиском локального сходства
рован ранее как общий структурный элемент,
с помощью GLAM2 позволяет не только обна-
соседствующий с PLP-связывающим остатком
ружить мотив в целевых белках, для которых
БИОХИМИЯ том 88 вып. 7 2023
1260
АЛЕШИН, БУНИК
взаимодействие с донорами PLP эксперимен-
нием доступных данных о трех партнерах
тально не установлено, но и улучшить пара-
PNPO (таблица). Из-за малого количества
метры результатов поиска GLAM2 (дополни-
белков-партнеров параметры достоверности
тельный рис. S2 в Приложении).
найденного мотива были ожидаемо низкими.
Выявление общего мотива партнеров PdxK
Более того, найденный таким образом мотив
среди ферментов структурного типа II являет-
не сохранялся при добавлении в поиск после-
ся более сложной задачей, поскольку взаимо-
довательностей гомологичных ферментов, та-
действующая с PdxK бактериальная dpaL не
ких как серингидроксиметилтрансфераза че-
имеет ортологов у млекопитающих. Поэтому
ловека, аспартатаминотрансфераза Bacillus sp.
для идентификации общего мотива, найденно-
и L-треонинальдолаза из Preudomonas sp.
го в диаминопропионат-аммиак-лиазе, были
Наконец, обнаруженные таким образом мо-
выбраны известные человеческие PLP-зави-
тивы не имеют единой вторичной структуры,
симые ферменты структурного типа II, такие
несмотря на принадлежность анализируемых
как серинрацемаза (SRR, Q9GZT4), серинде-
белков одному и тому же структурному типу I.
гидратаза-подобный белок (SDSL, Q96GA7)
Таким образом, количество известных PLP-
и цистатионин-β-синтаза (CBS, P35520) (рис. 2).
зависимых партнеров PNPO (таблица) не-
Их последовательности были добавлены к
достаточно для надежной идентификации
тем, что показаны на рис. 1, по отдельности
специфического для PNPO интерфейса взаи-
или все вместе. Запуск GLAM2 для этих набо-
модействия. То же самое относится и к поиску
ров последовательностей снижает качество
мотива партнеров PLPBP, для которого из-
результатов. Более того, такой поиск не по-
вестны лишь два партнера.
зволяет надежно идентифицировать мотив с
Патогенные мутации в тирозинаминотранс-
характерной вторичной структурой. Плохой
феразе (тип I) и цистатионин-β-синтазе (тип II)
результат GLAM2 может быть связан с тем,
внутри или вблизи найденного общего мотива
что белки структурного типа II могут иметь
указывают на его функциональную значимость.
очень разные последовательности. Например,
Согласно гипотезе прямого переноса PLP от
последовательность CBS имеет удлинение,
белков-доноров к акцепторам, общий мотив
соответствующее связывающему гем участку,
PLP-зависимых ферментов может участвовать
которое отсутствует у других ферментов струк-
в таком переносе, формируя интерфейс для ге-
турного типа II (рис. 2, а). Проблема реша-
терологического взаимодействия. В этом слу-
ется с помощью структурного выравнивания
чае точечные мутации внутри мотива или по-
белка dpaL и ферментов структурного типа II
близости от него должны быть патогенными,
человека. Применение этого подхода позво-
несмотря на их локализацию вне активного
ляет идентифицировать общий структурный
центра. Скрининг человеческих вариантов на
мотив у бактериального белка dpaL и белков
патогенность таких мутаций был проведен для
структурного типа II млекопитающих: SRR,
ТАТ (тип I) и CBS (тип II). Как было показано
SDSL и CBS (рис. 2, а). Примечательно, что и
во введении, эти ферменты вовлечены в зло-
в ферментах структурного типа II С-конец об-
качественную трансформацию клеток.
щего мотива находится вблизи PLP (рис. 2, а),
Из 20 точечных мутаций ТАТ, вызываю-
аналогично белкам структурного типа I, где
щих синдром Рихнера-Хэнхарта (тирози-
консервативный остаток аспартата на С-кон-
немия II типа) [38-44], три находятся в пре-
це мотива взаимодействует с атомом азо-
делах мотива (A237P) или близки к нему
та PLP (рис. 1). В SRR и N-концевая часть
(L201R, L273P) (рис. 3, а). Повышенный уро-
мотива является частью активного центра.
вень тирозина в плазме крови и болезненные
Так, аминокислотные остатки в начале (R135)
гиперкератотические бляшки возникают у
и конце (петля H152-P153-N154) структурного
пациентов с мутациями L201R и L273P TAT,
мотива SRR, общего для PLP-зависимых фер-
локализованными в пределах 5 Å от мотива в
ментов структурных типов I и II, участвуют в
альфа-спирали и бета-листе соответственно.
связывании субстрата SRR и стабилизации
Введение положительного заряда (L201R) или
PLP-имина соответственно [37]. Участие кон-
нарушение вторичной структуры интерфейса,
цевых частей общего мотива в формировании
показанное на рис. 3, а фиолетовым цветом,
активного центра подтверждает роль мотива в
при замене остатка лейцина бета-листа на
доставке PLP к активным центрам акцепторов
пролин (L273P) может мешать правильному
от доноров кофермента.
межбелковому взаимодействию. В случае му-
Возможность существования у акцеп-
тации ТАТ A237P [41] повышенный уровень ти-
торов PLP специфического мотива для свя-
розина сопровождается не поражением кожи,
зывания PNPO была изучена с использова-
а умеренными психическими расстройствами.
БИОХИМИЯ том 88 вып. 7 2023
МОТИВ ДЛЯ ПЕРЕНОСА ПИРИДОКСАЛЬФОСФАТА
1261
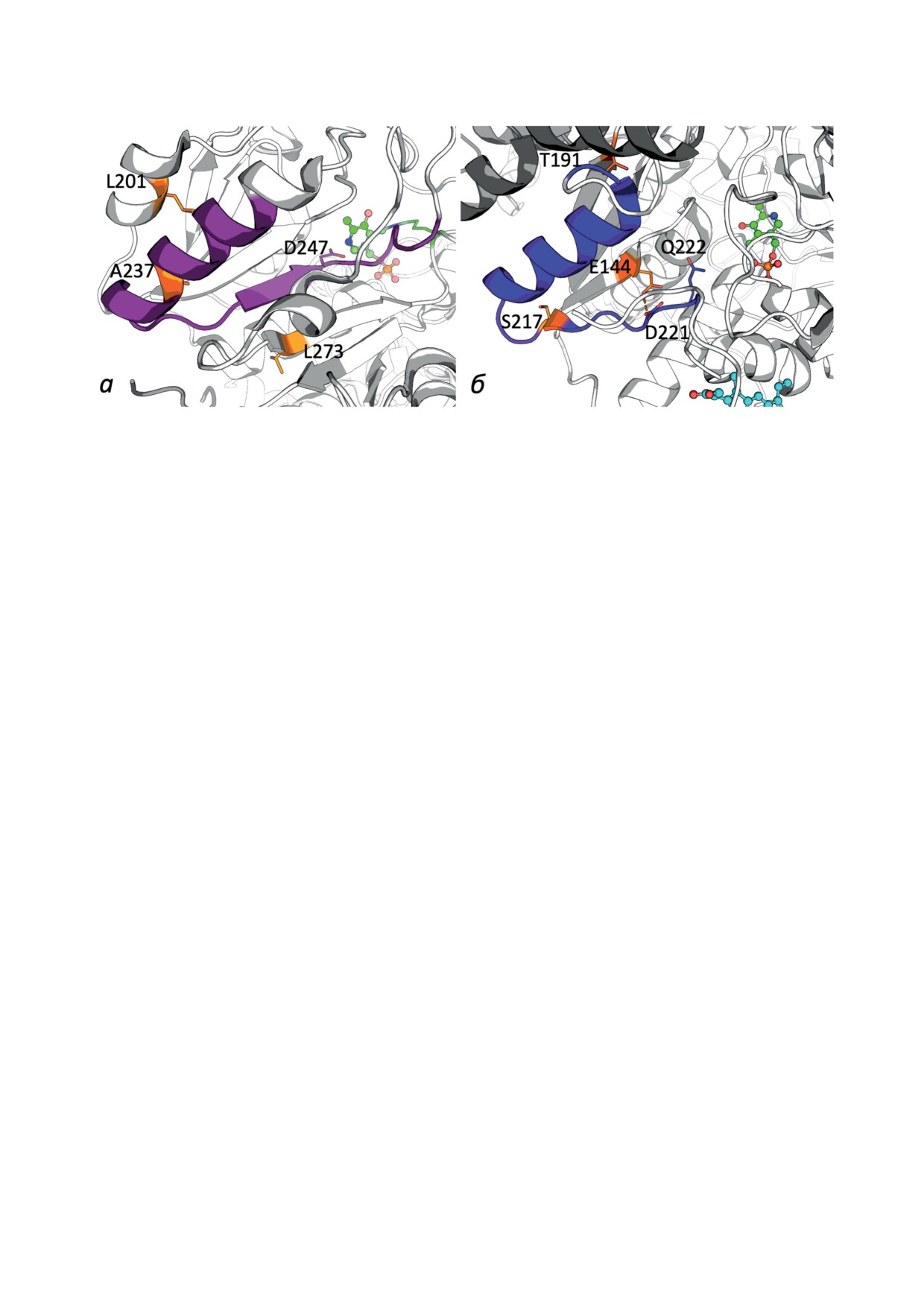
Рис. 3. Патогенные мутации TAT и CBS внутри или рядом с общим мотивом PLP-зависимых белков. а - Мутации TAT
внутри альфа-спирали мотива (A237P) и в пределах 5 Å от мотива (L201R и L273P). б - Мутации CBS внутри бета-тяжа
мотива (S217F) и вблизи него (T191M - в 3,5 Å от мотива и E144K - в 2,9 Å от мотива). В нативной CBS E144 образует
водородную связь с N-атомом D221 мотива, предшествующего остатку Q222 вблизи центра связывания PLP
Таким образом, структурное нарушение альфа-
мечательно, что пациенты с заменой T191M
спирали мотива у мутанта A237P более кри-
не реагируют на терапию витамином B6. Та-
тично для физиологии, чем косвенные эф-
кая невосприимчивость ожидаема для мута-
фекты мутаций L201R и L273P вблизи мотива.
ций, нарушающих не биосинтез PLP, а его
Тот факт, что все три мутации сильно влияют
доставку от доноров к акцепторам посред-
на катализ, но расположены близко к поверх-
ством гетерологичных белок-белковых взаи-
ности белка и далеко от активного центра, хо-
модействий, в которых предполагается уча-
рошо согласуется с предполагаемой функцио-
стие идентифицированного общего мотива.
нальной ролью идентифицированного мотива
Мутация E144K CBS изменяет заряд на корот-
в качестве интерфейса для переноса PLP.
ком расстоянии от петли мотива, содержащей
Из более чем
130 точечных мутаций
несколько заряженных остатков (рис.
3, в),
CBS [22, 45-48] одна (S217F) находится в по-
что может нарушать ионные взаимодействия,
верхностной части общего мотива PLP-зави-
потенциально участвующие в переносе PLP.
симых ферментов (рис. 3, б). Несмотря на
Интересно, что у пациентов с E144K CBS
локализацию вне активного центра, эта мута-
наблюдается положительный ответ на вве-
ция приводит к 25-кратному снижению ак-
дение B6. Вероятно, повышенная продук-
тивности CBS по сравнению с диким типом
ция PLP при большем насыщении продуцен-
и гомоцистинурией [48]. Существенная роль
тов PLP их субстратом может стимулировать
остатка S217 в функционировании CBS хоро-
PLP-зависимую модификацию остатка K144
шо согласуется с его участием в формирова-
в комплексе мутантной CBS с продуцента-
нии белкового комплекса для доставки PLP от
ми PLP, приводя к частичной компенсации
его доноров в активный центр CBS. Другими
вызываемых мутацией электростатических эф-
патогенными мутациями CBS вблизи моти-
фектов, нарушающих перенос. Восстановле-
ва и за пределами активного сайта являются
ние нарушенного переноса PLP в модифи-
T191M и E144K (рис. 3, б). Их патогенность
цированной таким образом мутантной CBS
можно также объяснить нарушением предпо-
может объяснить терапевтический эффект
лагаемого гетерологического взаимодействия с
введения B6 у этого мутанта, отсутствующий у
донорами PLP и/или процесса переноса PLP.
мутанта T191M. Другие механизмы терапевти-
В случае мутации T191M это может быть свя-
ческого действия В6 при мутациях, нарушаю-
зано с более объемным и более гидрофобным
щих гетерологические взаимодействия, могут
остатком метионина по сравнению с остатком
быть основаны на аллостерической регуляции
тирозина в нативной CBS. Мутация T191M,
продуцентов PLP их субстратами и продук-
широко распространенная в Испании, Порту-
тами [18, 49], поскольку такая регуляция бел-
галии и Южной Америке, характеризуется раз-
ков-доноров может усиливать нарушенные
нообразными фенотипическими симптомами,
мутациями гетерологические взаимодействия
поражающими скелет, глаза и ЦНС [46]. При-
с акцепторами PLP.
БИОХИМИЯ том 88 вып. 7 2023
1262
АЛЕШИН, БУНИК
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
зультате в партнерах PdxK/PNPO был найден
общий для PLP-зависимых ферментов струк-
PLP-зависимые ферменты принадлежат
турных типов I и II мотив с характерной вто-
семи структурным типам [1], при этом 76% от-
ричной структурой, который может выступать в
носятся к структурному типу I, за которым сле-
качестве интерфейса при взаимодействии дан-
дует структурный тип II (12%), тип III (5%) и
ного множества белков с PLP-донорами PdxK
другие типы (7%) (рис. 4). Такое распределение
и PNPO. У структурного типа I данный мотив
сохраняется и для экспериментально опреде-
включает консервативный остаток аспартата,
ленных взаимодействий акцепторов PLP с до-
участвующий в связывании PLP в активных
норами PLP (таблица). Так, 75% (9 из 12 белков)
центрах PLP-зависимых ферментов [21]. Од-
принадлежат типу I, а остальные 25% распре-
нако в ферментах структурного типа II остаток
деляются между структурными типами II, III
аспартата не консервативен, так как способ
и V (8% для каждого из структурных типов,
взаимодействия с коферментом PLP отличается
представленных 1 из 12 белков). Таким обра-
от такового в ферментах структурного типа I.
зом, подтвержденные взаимодействия соот-
Тем не менее и в ферментах структурного
ветствуют встречаемости структурных типов
типа II С-концевая часть общего мотива вно-
PLP-зависимых белков. Все основные типы
сит вклад в связывание PLP. Такая особенность
структур, включая редкий тип V, взаимодей-
предоставляет дополнительное свидетельство
ствуют с донорами PLP, что свидетельствует в
в пользу участия общего мотива в перено-
пользу гипотезы о переносе PLP в гетерологи-
се PLP. Имеющиеся данные о связывании PLP
ческих акцепторно-донорных комплексах.
с его донорами и акцепторами не противоре-
Существование общих партнеров PdxK
чат переносу PLP из сайтов его синтеза в PdxK
и PNPO, т.е. серингидроксиметилтрансферазы
или PNPO в каталитические центры, использу-
и аспартатаминотрансферазы (таблица), сви-
ющие PLP. В соответствии с общим представ-
детельствует в пользу участия общего мотива
лением о том, что продукты ферментативных
акцепторов PLP в связывании как PdxK, так
реакций связаны со своими продуцентами не
и PNPO (рис. 1). Однако ввиду ограниченного
так прочно, как коферменты, взаимодействие
числа подтвержденных взаимодействий PNPO
PLP с ферментами млекопитающих, продуци-
мы не можем исключить специфических цен-
рующими PLP, характеризуется константами от
тров связывания PdxK и PNPO белками-ак-
10-7-10-6 M (PNPO) до 10-5 M (PdxK) [50-52],
цепторами.
в то время как животные белки-акцепторы PLP
Представленные в таблице взаимодей-
имеют более высокое сродство к PLP: ГАМК-
ствия показывают, что партнеры PdxK и PNPO
трансаминаза имеет Kd ≈ 10-9 M [53], орнитин-
принадлежат к структурным типам I и II. В ре-
аминотрансфераза - Kd ≈ 10-7 M [54].
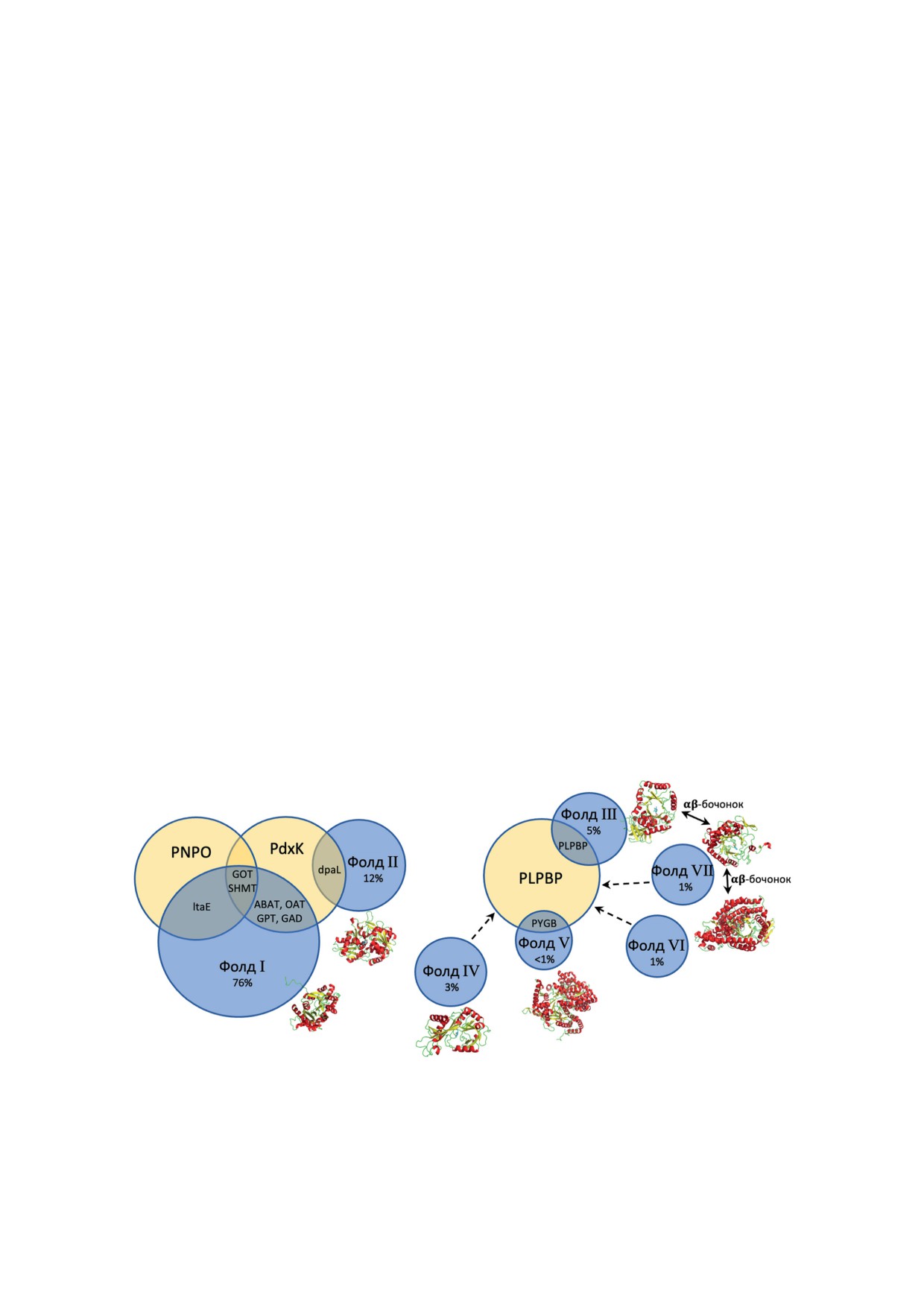
Рис. 4. Образование гетерологических комплексов между белками-акцепторами PLP (синие круги) и тремя потен-
циальными донорами PLP (желтые круги). Структурные типы репрезентативных белков-акцепторов PLP показаны
рядом с синими кругами. Процент акцепторов PLP, принадлежащих каждому структурному типу, указан согласно
Percudani et al. [1]. Охарактеризованные белок-белковые взаимодействия (таблица) обозначены аббревиатурами отдель-
ных белков: LTA - L-треонинальдолаза; GOT - аспартатаминотрансфераза; SHMT - серингидроксиметилтрансфера-
за; ABAT - 4-аминобутиратаминотрансфераза; OAT - орнитинаминотрансфераза; GPT - аланинаминотрансфераза;
GAD - глутаматдекарбоксилаза; dpaL - диаминопропионат-аммиак-лиаза; PYGB - гликогенфосфорилаза. Гипотети-
ческое взаимодействие PLPBP с белками редких структурных типов IV, VI и VII указано пунктирными стрелками
БИОХИМИЯ том 88 вып. 7 2023
МОТИВ ДЛЯ ПЕРЕНОСА ПИРИДОКСАЛЬФОСФАТА
1263
В отличие от партнеров PdxK и PNPO,
торов PLP, способствуя межбелковому пере-
представленных наиболее многочисленными
носу кофермента. Патогенность человеческих
структурными типами I и II, третий донор PLP
мутаций вне активного сайта, но внутри или
млекопитающих, PLPBP, взаимодействует с
рядом с идентифицированным мотивом сви-
PLP-зависимыми белками редких структурных
детельствует в пользу такой функции моти-
типов V (гликогенфосфорилаза) и III (ауто-
ва. Поскольку компоненты белковых ком-
олигомеризация) (таблица, рис. 4). Структур-
плексов, связанных с базовыми функциями
ные типы VI и VII, характерные для очень не-
клеток, обычно коэкспрессируются [56], об
большого числа акцепторов PLP [1] и потому
образовании белковых комплексов может кос-
отсутствующие в исходной классификации
венно свидетельствовать сопряженная экс-
PLP-зависимых ферментов [21], имеют ту же
прессия продуцентов и PLP-зависимых бел-
структуру альфа-бета-бочонка, что и тип III.
ков. Действительно, в гепатоцеллюлярной
Отсюда можно предположить, что эти акцеп-
карциноме, для которой характерно сни-
торы PLP также получают PLP от PLPBP,
жение функций PLP-зависимых ферментов
как показано на рис. 4 пунктирными стрел-
структурного типа I (ТАТ) и структурного
ками. Таким образом, в отличие от PdxK
типа II (CBS) [4, 57], подавляется и продуцент
и PNPO, передающих PLP белкам наиболее
PLP PNPO [58].
распространенных структурных типов I и II,
Хотя идентифицированный общий мотив
PLPBP может быть нужен для передачи кофер-
разных ферментов-акцепторов PLP обладает
мента акцепторам PLP редких структурных ти-
сходной структурой и консервативными остат-
пов, таких как типы III-VII (рис. 4).
ками, необходимыми для взаимодействия с
Недавнее исследование партнеров PLPBP
донорами PLP, в каждом белке-акцепторе
показало, что среди них преобладают белки,
имеются и специфические для него остатки.
участвующие в организации цитоскелета и
Это открывает возможности для разработки
клеточном делении, а не PLP-зависимые фер-
пептидных препаратов, избирательно блоки-
менты [34]. Поэтому основная функция PLPBP
рующих интерфейс доставки PLP в представ-
не обязательно включает доставку PLP к апо-
ляющих терапевтический интерес ферментах,
ферментам. Участие PLP в организации цито-
таких как CBS, усиление функции которой
скелета и клеточных делений подтверждается
при некоторых видах рака связано с плохим
и связью с этими процессами фосфатазы PLP,
прогнозом [5, 6].
известной как хронофин. Помимо гидроли-
за PLP до PL, хронофин является фосфатазой
кофилина [55] - ключевого регулятора контро-
ЗАКЛЮЧЕНИЕ
лируемой фосфорилированием динамики ак-
тинового цитоскелета. Ассоциация как PLPBP,
Экспериментально установленные белок-
так и PLP фосфатазы с организацией цитоске-
белковые взаимодействия и имеющиеся в
лета и делением клеток [34, 55] предполагает
настоящее время структурные данные позво-
недооцененную в настоящее время роль вита-
лили идентифицировать общий для множе-
мина B6 в этих процессах.
ства PLP-зависимых ферментов структурных
Таким образом, мы идентифицировали
типов I и II мотив, который может служить
общий для большинства PLP-зависимых фер-
интерфейсом между этими ферментами и про-
ментов мотив, простирающийся от белковой
дуцирующими PLP PdxK или PNPO. Функ-
поверхности до сайтов связывания PLP. Кон-
циональное значение мотива в межбелковом
формационная динамика мотива при связы-
переносе PLP объясняет патогенность мута-
вании доноров PLP может обеспечить обра-
ций внутри или вблизи мотива вне активного
зование канала для обмена PLP. Например,
центра. Взаимодействия PLPBP свидетель-
участвующая в переносе PLP открытая кон-
ствуют о его связывании с PLP-зависимыми
формация активного центра глутаматдекарб-
белками редких структурных типов III-VII.
оксилазы [19] может стабилизироваться белок-
белковыми взаимодействиями с донором PLP.
Вклад авторов. В.А. Алешин провел по-
Структурно сходный в очень разных белках,
иск литературы и исследовательскую работу,
использующих PLP, мотив может быть интер-
проанализировал и графически представил
фейсом для присоединения множества бел-
результаты, написал начальный вариант ста-
ков-акцепторов PLP к ограниченному числу
тьи; В.И. Буник руководила исследованием,
PLP-доноров. Конформационные изменения
анализировала результаты, создала концеп-
в гетерологическом комплексе могут сближать
цию и написала окончательный вариант
активные центры белков-доноров и акцеп-
статьи.
БИОХИМИЯ том 88 вып. 7 2023
1
264
АЛЕШИН, БУНИК
Финансирование. Работа выполнена при фи-
следований с участием людей или животных в
нансовой поддержке Российского фонда фунда-
качестве объектов, не считая общедоступной
ментальных исследований (грант № 20-54-7804).
из баз данных информации.
Конфликт интересов. Авторы заявляют об
Дополнительные материалы. Приложение к
отсутствии конфликта интересов.
статье на английском языке опубликовано на
Соблюдение этических норм. Настоящая
статья не содержит описания каких-либо ис- journal/10541), том 88, вып. 7, 2023.
СПИСОК ЛИТЕРАТУРЫ
1.
Percudani, R., and Peracchi, A. (2009) The B6
PipY shed light on structure, potential functions, and
database: a tool for the description and classification of
vitamin B6-dependent epilepsy, FEBS Lett.,
591,
vitamin B6-dependent enzymatic activities and of the
3431-3442, doi: 10.1002/1873-3468.12841.
corresponding protein families, BMC Bioinformatics,
10.
Ramos, R. J., Albersen, M., Vringer, E., Bosma, M.,
10, 273, doi: 10.1186/1471-2105-10-273.
Zwakenberg, S., Zwartkruis, F., Jans, J. J. M., and
2.
Bargiela, D., Cunha, P. P., Veliça, P., Foskolou, I. P.,
Verhoeven-Duif, N. M. (2019) Discovery of pyridoxal
Barbieri, L., Rundqvist, H., and Johnson, R. S. (2022)
reductase activity as part of human vitamin B6
Vitamin B6 metabolism determines T cell anti-tumor
metabolism, Biochim. Biophys. Acta Gen. Subj., 1863,
responses, Front. Immunol., 13, 837669, doi: 10.3389/
1088-1097, doi: 10.1016/j.bbagen.2019.03.019.
fimmu.2022.837669.
11.
Wilson, M. P., Plecko, B., Mills, P. B., and
3.
Fu, L., Dong, S.-S., Xie, Y.-W., Tai, L.-S., Chen, L.,
Clayton, P. T. (2019) Disorders affecting vitamin B6
Kong, K. L., Man, K., Xie, D., Li, Y., Cheng, Y.,
metabolism, J. Inherit. Metab. Disease, 42, 629-646,
Tao, Q., and Guan, X.-Y. (2010) Down-regulation
doi: 10.1002/jimd.12060.
of tyrosine aminotransferase at a frequently deleted
12.
Zuo, H., Ueland, P. M., Eussen, S. J. P. M., Tell, G. S.,
region
16q22 contributes to the pathogenesis of
Vollset, S. E., Nygård, O., Midttun, Ø., Meyer, K.,
hepatocellular carcinoma, Hepatology, 51, 1624-1634,
and Ulvik, A. (2014) Markers of vitamin B6 status
doi: 10.1002/hep.23540.
and metabolism as predictors of incident cancer: The
4.
Nguyen, T. N., Nguyen, H. Q., and Le, D. H.
Hordaland Health Study, Int. J. Cancer, 136, 2932-
(2020) Unveiling prognostics biomarkers of tyrosine
2939, doi: 10.1002/ijc.29345.
metabolism reprogramming in liver cancer by cross-
13.
Chen, C.-C., Li, B., Millman, S. E., Chen, C.,
platform gene expression analyses, PLoS One, 15,
Li, X., Morris, J. P., Mayle, A., Ho, Y.-J., Loizou, E.,
e0229276, doi: 10.1371/journal.pone.0229276.
Liu, H., Qin, W., Shah, H., Violante, S., Cross,
5.
Ascenção, K., and Szabo, C.
(2022) Emerging
J. R., Lowe, S. W., and Zhang, L. (2020) Vitamin B6
roles of cystathionine β-synthase in various forms
addiction in acute myeloid leukemia, Cancer Cell, 37,
of cancer, Redox Biol., 53, 102331, doi: 10.1016/
71-84.e77, doi: 10.1016/j.ccell.2019.12.002.
j.redox.2022.102331.
14.
Galluzzi, L., Vitale, I., Senovilla, L., Olaussen, K. A.,
6.
Zhu, H., Blake, S., Chan, K. T., Pearson, R. B.,
Pinna, G., Eisenberg, T., Goubar, A., Martins, I.,
and Kang, J. (2018) Cystathionine β-synthase in
Michels, J., Kratassiouk, G., Carmona-Gutierrez, D.,
physiology and cancer, BioMed Res. Int.,
2018,
Scoazec, M., Vacchelli, E., Schlemmer, F., Kepp, O.,
3205125, doi: 10.1155/2018/3205125.
Shen, S., Tailler, M., Niso-Santano, M., Morselli, E.,
7.
Van den Eynde, M. D. G., Scheijen, J. L. J. M.,
Criollo, A., et al. (2012) Prognostic impact of Vitamin
Stehouwer, C. D. A., Miyata, T., and Schalkwijk, C. G.
B6 metabolism in lung cancer, Cell Rep., 2, 257-269,
(2021) Quantification of the B6 vitamers in human
doi: 10.1016/j.celrep.2012.06.017.
plasma and urine in a study with pyridoxamine as an
15.
Contestabile, R., di Salvo, M. L., Bunik, V., Tramonti, A.,
oral supplement; pyridoxamine as an alternative for
and Verni, F.
(2020) The multifaceted role of
pyridoxine, Clin. Nutr., 40, 4624-4632, doi: 10.1016/
vitamin B6 in cancer: Drosophila as a model system
j.clnu.2021.05.028.
to investigate DNA damage, Open Biol, 10, 200034,
8.
Vasilaki, A. T., McMillan, D. C., Kinsella, J.,
doi: 10.1098/rsob.200034.
Duncan, A., O’Reilly, D. S. J., and Talwar, D. (2008)
16.
Tran, J. U., and Brown, B. L. (2022) Structural basis
Relation between pyridoxal and pyridoxal phosphate
for allostery in PLP-dependent enzymes, Front. Mol.
concentrations in plasma, red cells, and white cells
Biosci., 9, 884281, doi: 10.3389/fmolb.2022.884281.
in patients with critical illness, Am. J. Clin. Nutr.,
17.
Matsuo, T., and Sadzuka, Y. (2019) In vitro anti-
88, 140-146, doi: 10.1093/ajcn/88.1.140.
cancer activities of B6 vitamers: a Mini-review,
9.
Tremino, L., Forcada-Nadal, A., Contreras, A., and
Anticancer Res.,
39,
3429-3432, doi:
10.21873/
Rubio, V. (2017) Studies on cyanobacterial protein
anticanres.13488.
БИОХИМИЯ том 88 вып. 7 2023
МОТИВ ДЛЯ ПЕРЕНОСА ПИРИДОКСАЛЬФОСФАТА
1265
18.
Barile, A., Battista, T., Fiorillo, A., di Salvo, M. L.,
Chatr-Aryamontri, A., Dolinski, K., and Tyers, M.
Malatesta, F., Tramonti, A., Ilari, A., and Contest-
(2021) The BioGRID database: a comprehensive
abile, R. (2021) Identification and characterization of
biomedical resource of curated protein, genetic, and
the pyridoxal 5′-phosphate allosteric site in Escherichia
chemical interactions, Protein Sci.,
30,
187-200,
coli pyridoxine 5′-phosphate oxidase, J. Biol. Chem.,
doi: 10.1002/pro.3978.
296, 100795, doi: 10.1016/j.jbc.2021.100795.
28.
Hermjakob, H., Montecchi-Palazzi, L., Lewing-
19.
Giardina, G., Montioli, R., Gianni, S., Cellini, B.,
ton, C., Mudali, S., Kerrien, S., Orchard, S., Vingron,
Paiardini, A., Voltattorni, C. B., and Cutruzzola, F.
M., Roechert, B., Roepstorff, P., Valencia, A., Mar-
(2011) Open conformation of human DOPA decarbox-
galit, H., Armstrong, J., Bairoch, A., Cesareni, G.,
ylase reveals the mechanism of PLP addition to Group
Sherman, D., and Apweiler, R. (2004) IntAct: an open
II decarboxylases, Proc. Natl. Acad. Sci. USA, 108,
source molecular interaction database, Nucleic Acids
20514-20519, doi: 10.1073/pnas.1111456108.
Res., 32, D452-455, doi: 10.1093/nar/gkh052.
20.
Cheung, P. Y., Fong, C. C., Ng, K. T., Lam, W. C.,
29.
Szklarczyk, D., Gable, A. L., Nastou, K. C., Lyon, D.,
Leung, Y. C., Tsang, C. W., Yang, M., and Wong,
Kirsch, R., Pyysalo, S., Doncheva, N. T., Legeay, M.,
M. S. (2003) Interaction between pyridoxal kinase
Fang, T., Bork, P., Jensen, L. J., and von Mering, C.
and pyridoxal-5-phosphate-dependent enzymes,
(2021) The STRING database in 2021: customizable
J. Biochemistry, 134, 731-738, doi: 10.1093/jb/mvg201.
protein-protein networks, and functional charac-
21.
Grishin, N. V., Phillips, M. A., and Goldsmith, E. J.
terization of user-uploaded gene/measurement sets,
(1995) Modeling of the spatial structure of eukaryotic
Nucleic Acids Res., 49, D605-D612, doi: 10.1093/
ornithine decarboxylases, Protein Sci., 4, 1291-1304,
nar/gkaa1074.
doi: 10.1002/pro.5560040705.
30.
Wan, C., Borgeson, B., Phanse, S., Tu, F., Drew, K.,
22.
Poloni, S., Sperb-Ludwig, F., Borsatto, T., Weber
Clark, G., Xiong, X., Kagan, O., Kwan, J.,
Hoss, G., Doriqui, M. J. R., Embirucu, E. K., Boa-
Bezginov, A., Chessman, K., Pal, S., Cromar, G.,
Sorte, N., Marques, C., Kim, C. A., Fischinger Moura
Papoulas, O., Ni, Z., Boutz, D. R., Stoilova, S.,
de Souza, C., Rocha, H., Ribeiro, M., Steiner, C. E.,
Havugimana, P. C., Guo, X., Malty, R. H., et al.
Moreno, C. A., Bernardi, P., Valadares, E., Artigalas, O.,
(2015) Panorama of ancient metazoan macromolecular
Carvalho, G., Wanderley, H. Y. C., Kugele, J., et al.
complexes, Nature,
525,
339-344, doi:
10.1038/
(2018) CBS mutations are good predictors for B6-
nature14877.
responsiveness: a study based on the analysis of 35
31.
Kim, Y. T., Kwok, F., and Churchich, J. E. (1988)
Brazilian Classical Homocystinuria patients, Mol.
Interactions of pyridoxal kinase and aspartate amino-
Genet. Genomic Med.,
6,
160-170, doi:
10.1002/
transferase emission anisotropy and compartmentation
mgg3.342.
studies, J. Biol. Chem., 263, 13712-13717, doi: 10.1016/
23.
Natt, E., Kida, K., Odievre, M., Di Rocco, M., and
s0021-9258(18)68299-7.
Scherer, G. (1992) Point mutations in the tyrosine
32.
Deka, G., Kalyani, J. N., Jahangir, F. B., Sabharwal, P.,
aminotransferase gene in tyrosinemia type II, Proc.
Savithri, H. S., and Murthy, M. R. N. (2019) Structural
Natl. Acad. Sci. USA, 89, 9297-9301, doi: 10.1073/
and functional studies on Salmonella typhimurium
pnas.89.19.9297.
pyridoxal kinase: the first structural evidence for the
24.
Frith, M. C., Saunders, N. F., Kobe, B., and Bailey,
formation of Schiff base with the substrate, FEBS J.,
T. L.
(2008) Discovering sequence motifs with
286, 3684-3700, doi: 10.1111/febs.14933.
arbitrary insertions and deletions, PLoS Comput. Biol.,
33.
Ghatge, M. S., Karve, S. S., David, T. M., Ahmed,
4, e1000071, doi: 10.1371/journal.pcbi.1000071.
M. H., Musayev, F. N., Cunningham, K., Schirch, V.,
25.
Altschul, S. F., Madden, T. L., Schaffer, A. A.,
and Safo, M. K. (2016) Inactive mutants of human
Zhang, J., Zhang, Z., Miller, W., and Lipman, D. J.
pyridoxine 5′-phosphate oxidase: a possible role for
(1997) Gapped BLAST and PSI-BLAST: a new
a noncatalytic pyridoxal 5′-phosphate tight binding
generation of protein database search programs,
site, FEBS Open Bio,
6,
398-408, doi:
10.1002/
Nucleic Acids Res., 25, 3389-3402, doi: 10.1093/
2211-5463.12042.
nar/25.17.3389.
34.
Fux, A., and Sieber, S. A. (2020) Biochemical and
26.
Sievers, F., Wilm, A., Dineen, D., Gibson, T. J.,
proteomic studies of human pyridoxal 5′-phosphate-
Karplus, K., Li, W., Lopez, R., McWilliam, H.,
binding protein (PLPBP), ACS Chem. Biol.,
15,
Remmert, M., Soding, J., Thompson, J. D., and
254-261, doi: 10.1021/acschembio.9b00857.
Higgins, D. G. (2011) Fast, scalable generation of high-
35.
Ito, T., Iimori, J., Takayama, S., Moriyama, A.,
quality protein multiple sequence alignments using
Yamauchi, A., Hemmi, H., and Yoshimura, T.
Clustal Omega, Mol. Syst. Biol., 7, 539, doi: 10.1038/
(2013) Conserved pyridoxal protein that regulates ile
msb.2011.75.
and val metabolism, J. Bacteriol., 195, 5439-5449,
27.
Oughtred, R., Rust, J., Chang, C., Breitkreutz, B. J.,
doi: 10.1128/jb.00593-13.
Stark, C., Willems, A., Boucher, L., Leung, G., Kolas, N.,
36.
Schneider, G., Käck, H., and Lindqvist, Y.
Zhang, F., Dolma, S., Coulombe-Huntington, J.,
(2000) The manifold of vitamin B6 dependent
15
БИОХИМИЯ том 88 вып. 7 2023
1266
АЛЕШИН, БУНИК
enzymes, Structure, 8, R1-R6, doi: 10.1016/s0969-
in Northern Tunisia: identification and structural
2126(00)00085-x.
characterization of two novel TAT mutations,
37.
Graham, D. L., Beio, M. L., Nelson, D. L., and
Mol. Genet. Metab.,
88,
184-191, doi:
10.1016/
Berkowitz, D. B. (2019) Human serine racemase: key
j.ymgme.2006.02.006.
residues/active site motifs and their relation to enzyme
45.
Moat, S. J., Bao, L., Fowler, B., Bonham, J. R.,
function, Front. Mol. Biosci., 6, 8, doi: 10.3389/
Walter, J. H., and Kraus, J. P. (2004) The molecular
fmolb.2019.00008.
basis of cystathionine beta-synthase (CBS) deficiency
38.
Pasternack, S. M., Betz, R. C., Brandrup, F., Gade,
in UK and US patients with homocystinuria, Hum.
E. F., Clemmensen, O., Lund, A. M., Christensen, E.,
Mutat., 23, 206, doi: 10.1002/humu.9214.
and Bygum, A. (2009) Identification of two new
46.
Urreizti, R., Asteggiano, C., Bermudez, M., Cordoba, A.,
mutations in the TAT gene in a Danish family with
Szlago, M., Grosso, C., de Kremer, R. D., Vilarinho, L.,
tyrosinaemia type II, Br. J. Dermatol., 160, 704-706,
D’Almeida, V., Martinez-Pardo, M., Pena-Quintana, L.,
doi: 10.1111/j.1365-2133.2008.08888.x.
Dalmau, J., Bernal, J., Briceno, I., Couce, M. L.,
39.
Bouyacoub, Y., Zribi, H., Azzouz, H., Nasrallah, F.,
Rodes, M., Vilaseca, M. A., Balcells, S., and Grin-
Abdelaziz, R. B., Kacem, M., Rekaya, B., Messaoud, O.,
berg, D. (2006) The p.T191M mutation of the CBS
Romdhane, L., Charfeddine, C., Bouziri, M., Bouziri, S.,
gene is highly prevalent among homocystinuric
Tebib, N., Mokni, M., Kaabachi, N., Boubaker, S.,
patients from Spain, Portugal and South America,
and Abdelhak, S. (2013) Novel and recurrent mutations
J. Hum. Genet., 51, 305-313, doi: 10.1007/s10038-
in the TAT gene in Tunisian families affected with
006-0362-0.
Richner-Hanhart syndrome, Gene,
529,
45-49,
47.
Kraus, J. P. CBS mutation database. URL: https://
doi: 10.1016/j.gene.2013.07.066.
cbs.lf1.cuni.cz/.
40.
Gokay, S., Kendirci, M., Ustkoyuncu, P. S., Kardas, F.,
48.
Katsushima, F., Oliveriusova, J., Sakamoto, O.,
Bayram, A. K., Per, H., and Poyrazoğlu, H. G. (2016)
Ohura, T., Kondo, Y., Iinuma, K., Kraus, E.,
Tyrosinemia type II: Novel mutations in TAT in a boy
Stouracova, R., and Kraus, J. P. (2006) Expression
with unusual presentation, Pediatrics Int., 58, 1069-
study of mutant cystathionine β-synthase found
1072, doi: 10.1111/ped.13062.
in Japanese patients with homocystinuria, Mol.
41.
Peña-Quintana, L., Scherer, G., Curbelo-Estévez,
Genet. Metab., 87, 323-328, doi: 10.1016/j.ymgme.
M. L., Jiménez-Acosta, F., Hartmann, B., La Roche, F.,
2005.09.013.
Meavilla-Olivas, S., Pérez-Cerdá, C., García-Se-
49.
Barile, A., Nogues, I., di Salvo, M. L., Bunik, V.,
garra, N., Giguère, Y., Huppke, P., Mitchell, G. A.,
Contestabile, R., and Tramonti, A. (2020) Molecular
Mönch, E., Trump, D., Vianey-Saban, C., Trim-
characterization of pyridoxine 5′-phosphate oxidase
ble, E. R., Vitoria-Miñana, I., Reyes-Suárez, D.,
and its pathogenic forms associated with neonatal
Ramírez-Lorenzo, T., and Tugores, A. (2017) Ty-
epileptic encephalopathy, Sci. Rep.,
10,
13621,
rosinemia type II: Mutation update, 11 novel muta-
doi: 10.1038/s41598-020-70598-7.
tions and description of 5 independent subjects with
50.
Musayev, F. N., Di Salvo, M. L., Ko, T.-P., Schirch, V.,
a novel founder mutation, Clin. Genetics, 92, 306-317,
and Safo, M. K. (2003) Structure and properties of
doi: 10.1111/cge.13003.
recombinant human pyridoxine 5′-phosphate oxidase,
42.
Hühn, R., Stoermer, H., Klingele, B., Bausch, E.,
Protein Sci., 12, 1455-1463, doi: 10.1110/ps.0356203.
Fois, A., Farnetani, M., Di Rocco, M., Boué, J.,
51.
Di Salvo, M. L., Mastrangelo, M., Nogués, I.,
Kirk, J. M., Coleman, R., and Scherer, G. (1998)
Tolve, M., Paiardini, A., Carducci, C., Mei, D.,
Novel and recurrent tyrosine aminotransferase gene
Montomoli, M., Tramonti, A., Guerrini, R.,
mutations in tyrosinemia type II, Hum. Genetics, 102,
Contestabile, R., and Leuzzi, V. (2017) Pyridoxine-
305-313, doi: 10.1007/s004390050696.
5′-phosphate oxidase (Pnpo) deficiency: Clinical and
43.
Maydan, G., Andresen, B. S., Madsen, P. P.,
biochemical alterations associated with the C.347g > A
Zeigler, M., Raas-Rothschild, A., Zlotogorski, A.,
(P.·Arg116gln) mutation, Mol. Genet. Metab., 122,
Gutman, A., and Korman, S. H. (2006) TAT gene
135-142, doi: 10.1016/j.ymgme.2017.08.003.
mutation analysis in three Palestinian kindreds with
52.
Kwok, F., and Churchich, J. E. (1979) Brain pyridoxal
oculocutaneous tyrosinaemia type II; characterization
kinase. Mobility of the Substrate pyridoxal and binding
of a silent exonic transversion that causes complete
of inhibitors to the nucleotide site, Eur. J. Biochem.,
missplicing by exon 11 skipping, J. Inherit. Metab. Dis.,
93, 229-235, doi: 10.1111/j.1432-1033.1979.tb12815.x.
29, 620-626, doi: 10.1007/s10545-006-0407-8.
53.
Choi, S. Y., Churchich, D. R., and Churchich,
44.
Charfeddine, C., Monastiri, K., Mokni, M.,
J. E. (1985) Binding of new plp analogs to the
Laadjimi, A., Kaabachi, N., Perin, O., Nilges, M.,
catalytic domain of gaba transaminase, Biochem.
Kassar, S., Keirallah, M., Guediche, M. N., Kamoun,
Biophys. Res. Commun., 127, 346-353, doi: 10.1016/
M. R., Tebib, N., Ben Dridi, M. F., Boubaker, S.,
s0006-291x(85)80165-0.
Ben Osman, A., and Abdelhak, S. (2006) Clinical
54.
Montioli, R., Zamparelli, C., Borri Voltattorni, C.,
and mutational investigations of tyrosinemia type II
and Cellini, B. (2017) Oligomeric state and thermal
БИОХИМИЯ том 88 вып. 7 2023
МОТИВ ДЛЯ ПЕРЕНОСА ПИРИДОКСАЛЬФОСФАТА
1267
stability of apo- and holo- human ornithine
57. Kim, J., Hong, S. J., Park, J. H., Park, S. Y., Kim,
δ-aminotransferase, Protein J.,
36,
174-185,
S. W., Cho, E. Y., Do, I. G., Joh, J. W., and Kim,
doi: 10.1007/s10930-017-9710-5.
D. S. (2009) Expression of cystathionine beta-syn-
55. Gohla, A., Birkenfeld, J., and Bokoch, G. M. (2005)
thase is downregulated in hepatocellular carcinoma
Chronophin, a novel HAD-type serine protein phos-
and associated with poor prognosis, Oncol. Rep., 21,
phatase, regulates cofilin-dependent actin dynamics,
1449-1454, doi: 10.3892/or_00000373.
Nat. Cell Biol., 7, 21-29, doi: 10.1038/ncb1201.
58. Mei, M., Liu, D., Tang, X., You, Y., Peng, B., He, X.,
56. Webb, E. C., and Westhead, D. R. (2009) The tran-
and Huang, J. (2022) Vitamin B6 metabolic pathway is
scriptional regulation of protein complexes; a
involved in the pathogenesis of liver diseases via Multi-
cross-species perspective, Genomics,
94,
369-376,
Omics analysis, J. Hepatocell Carcinoma, 9, 729-750,
doi: 10.1016/j.ygeno.2009.08.003.
doi: 10.2147/JHC.S370255.
PROTEIN-PROTEIN INTERFACES AS DRUGGABLE TARGETS:
A COMMON MOTIF OF THE PYRIDOXAL-5′-PHOSPHATE-DEPENDENT
ENZYMES TO RECEIVE THE COENZYME FROM ITS PRODUCERS
V. A. Aleshin1,2 and V. I. Bunik1,2,3*
1 Department of Biokinetics, A. N. Belozersky Institute of Physicochemical Biology,
Lomonosov Moscow State University,
119234 Moscow, Russia; e-mail: aleshin_vasily@mail.ru; bunik@belozersky.msu.ru
2 Department of Biochemistry, Sechenov University, 119048 Moscow, Russia
3 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University, 119234 Moscow, Russia
Pyridoxal-5′-phosphate (PLP), a phosphorylated form of vitamin B6, acts as a coenzyme for numerous
reactions, including those changed in cancer and/or associated with the disease prognosis. Since highly
reactive PLP may modify cellular proteins, it is hypothesized to be directly transferred from its donors to
acceptors. Our goal is to validate the hypothesis by finding common motif(s) in a multitude of the PLP-
dependent enzymes for binding the limited number of the PLP donors, namely pyridoxal kinase (PdxK),
pyridox(am)in-5′-phosphate oxidase (PNPO) and the PLP-binding protein (PLPBP). Experimentally
confirmed interactions between the PLP donors and acceptors reveal that PdxK and PNPO interact with
the PLP acceptors of folds I and II, while PLPBP - with those of folds III and V. Aligning the sequences
and 3D structures of the identified interactors of PdxK and PNPO, we have found a common motif in the
PLP-dependent enzymes of folds I and II. The motif extends from the enzyme surface to the neighborhood
of the PLP binding site, represented by an exposed alfa-helix, a partially buried beta-strand and residual
loops. Pathogenicity of mutations in human PLP-dependent enzymes within or in the vicinity of the motif,
but outside of the active sites, supports functional significance of the motif that may provide an interface
for the direct transfer of PLP from the sites of its synthesis to those of the coenzyme binding. The enzyme-
specific amino acid residues of the common motif may be used to develop selective inhibitors blocking PLP
delivery to the PLP-dependent enzymes critical for proliferation of malignant cells.
Keywords: CBS, PdxK, PNPO, PLPBP, pyridoxal-5′-phosphate-dependent enzyme, TAT, vitamin B6 metabolism,
amino acid metabolism, 1-carbon metabolism
БИОХИМИЯ том 88 вып. 7 2023
15*