ЭНТОМОЛОГИЧЕСКОЕ ОБОЗРЕНИЕ, 99, 3, 2020
УДК 595.429.2
АДАПТИВНАЯ РАДИАЦИЯ ЧЕТЫРЕХНОГИХ КЛЕЩЕЙ
СЕМ. PHYTOPTIDAE (ACARIFORMES, ERIOPHYOIDEA)
НА ДВУДОЛЬНЫХ: ПАРАЗИТО-ХОЗЯИННЫЕ СВЯЗИ
И СПОСОБНОСТЬ К ИНДУКЦИИ ГАЛЛОГЕНЕЗА
© 2020 г. С. И. Сухарева, 1* Ф. Е. Четвериков 2**
1 Санкт-Петербургский государственный университет
Университетская наб., 7-9, С.-Петербург, 199034 Россия
* e-mail: s_sukhareva@mail.ru
2 Зоологический институт РАН
Университетская наб., 1, С.-Петербург, 199034 Россия
** e-mail: philipp-chetverikov@yandex.ru
Поступила 14.07.2020 г.
После доработки 2.08.2020 г.
Принята к публикации 2.08.2020 г.
Четырехногие клещи сем. Phytoptidae представлены на двудольных 31 видом двух подсе-
мейств: Phytoptinae (1 род, 19 видов) и Sierraphytoptinae (7 родов, 12 видов). Большинство видов,
способных вызывать аномальные ростовые реакции тканей растений-хозяев (галлы, войлочки,
разрастания почек и другие повреждения), относится к подсем. Phytoptinae. Анализ количествен-
ных признаков фитоптид показал, что выделить группы близких видов фитоптид с двудольных
на основе доступных в настоящее время морфометрических данных не удается. Рассмотрена
связь характера рисунка дорсального щитка и наличия тибиального соленидия с географиче-
ским распространением клещей. Выделены группы видов фитоптин со сходной топографией
дорсального щитка. Анализ паразито-хозяинных связей фитоптид с двудольными показал их мо-
заичное распределение по двудольным. Высказано предположение, что фитоптиды произошли
в тропическом поясе южного полушария. Современное деление фитоптид на подсемейства по
типу жизненной формы, вероятно, искусственно и не отражает филогенез группы. Классифика-
ция фитоптид нуждается в пересмотре. Для решения этой задачи необходимо реконструировать
филогению сем. Phytoptidae методами молекулярно-филогенетического анализа.
Ключевые слова: эриофиоидеи, двудольные, галлы, Rosaceae, Betulaceae.
DOI: 10.31857/S0367144520030168
Четырехногие клещи (надсем. Eriophyoidea) - аберрантная группа фитопаразитиче-
ских хелицеровых. Для эриофиоидей характерны отсутствие двух задних пар ног, вы-
тянутое тело, покрытое кольцевыми складками, высокая степень редукции структур,
используемых в качестве морфологических признаков (в частности хетома), и микро-
скопические размеры (100-300 мкм). Ископаемые остатки четырехногих клещей из-
вестны из триаса, а происхождение Eriophyoidea относят к позднему палеозою
(Sidorchuk et al., 2015) и связывают с древней группой почвенных клещей Nemata-
697
lycidae (Bolton et al., 2017; Klimov et al., 2018). В настоящее время описано примерно
5000 видов эриофиоидей, связанных с тремя группами высших растений - папоротни-
ками, голосеменными и цветковыми (Amrine et al., 2003). В ходе эволюции многие
виды эриофиоидных клещей приобрели способность вызывать различные новообра-
зования в тканях растений-хозяев (галлы, войлочки, разрастания почек и другие),
за что получили свое второе название - галловые клещи. Способность к индукции
галлогенеза, а также перенос различных фитопатогенов определяют вредоносность
и высокое экономическое значение эриофиоидей.
Согласно современной классификации Eriophyoidea, разработанной американскими
акарологами, всё многообразие рецентных форм распределяется между тремя семей-
ствами: Phytoptidae, Eriophyidae и Diptilomiopidae (Amrine et al., 2003). В результате
молекулярно-филогенетических исследований, проведенных в последние годы, посте-
пенно формируется альтернативная система Eriophyoidea (Li et al., 2014; Chetverikov
et al., 2015). Примечательно, что она почти в точности повторяет деление на семей-
ства, принятое в работах авторов второй половины XX в. (Boczek et al., 1989;
Shevchenko et al., 1991; Bagnjuk et al., 1998). В этих работах название «Phytoptidae»
относится лишь к фитоптоидным клещам, связанным с покрытосеменными растения-
ми. Молекулярные данные и результаты сравнительного анализа строения внутренних
половых органов подтверждают монофилию этой группы (Chetverikov et al., 2015).
В настоящей статье мы рассматриваем сем. Phytoptidae именно в этом смысле - как
кладу фитоптид с цветковых.
На двудольных растениях паразитируют представители двух подсемейств фитоп-
тид: Phytoptinae Murray, 1877 и Sierraphytoptinae Keifer, 1944. Морфологически эти
подсемейства различаются по признакам, характеризующим два главных морфотипа
эриофиоидных клещей (рис. 1). Виды подсем. Phytoptinae - равнокольчатые черве-
образные клещи (скрытоживущая жизненная форма): их покровы формируют едино-
образные узкие кольца (рис. 1, а). Виды подсем. Sierraphytoptinae имеют более
компактное тело, а их покровы образуют дорсальные и вентральные полукольца, раз-
личающиеся по ширине и количеству (открытоживущая жизненная форма, рис. 1, г).
Ранее нами были рассмотрены паразито-хозяинные связи фитоптид и высказаны
предположения о возможных путях эволюции этого семейства (Sukhareva, 1994;
Bagnjuk et al., 1998). На основе компонентного анализа морфологических признаков
выделились три группировки клещей, связанные с разными группами хозяев: пальма-
ми, лилиидами и двудольными. Группировка клещей с пальм оказалась ближе к кле-
щам с двудольных, чем к таковым с лилиид. К тому времени было известно лишь
16 видов фитоптид с двудольных. В течение последних 15 лет появилось много новых
данных о фитоптидах и их растениях-хозяевах, расширились представления о разно-
образии и биогеографии фитоптид. Цель настоящей работы - обзор клещей сем.
Phytoptidae с двудольных на основе новейших данных по морфологии и таксономии,
а также о связях фитоптид с растениями-хозяевами. Нами были 1) проанализированы
данные по паразито-хозяинным отношениям фитоптид с двудольными, включая спо-
собность фитоптид вызывать образование галлов; 2) проведена оценка признаков,
применяемых в макросистематике фитоптид; 3) рассмотрено разнообразие морфоти-
пов фитоптид, а также 4) проведена оценка гипотез о филогенезе фитоптид с учетом
современных данных по географии и филогении их растений-хозяев.
698
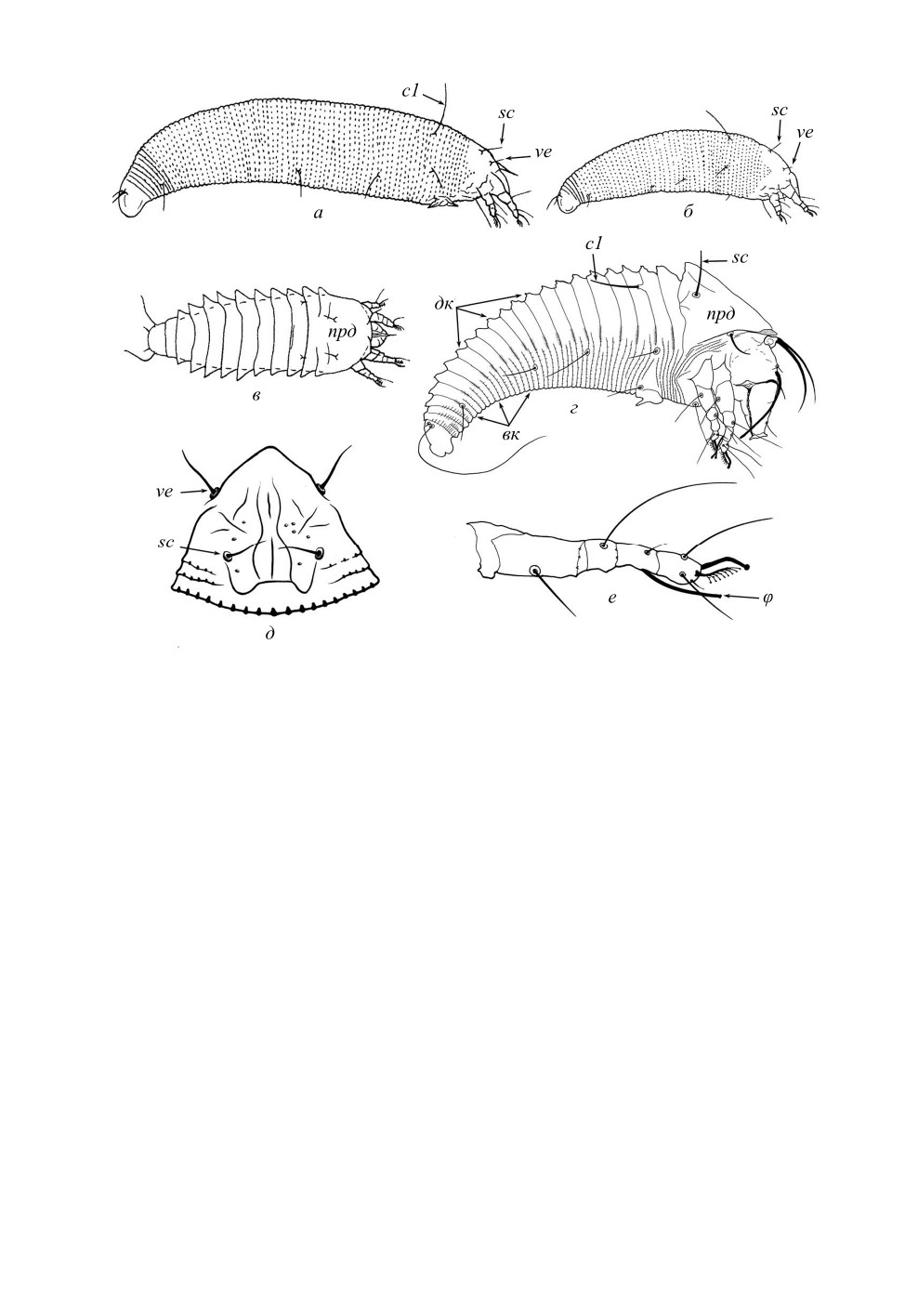
Рис. 1. Скрытоживущая (а, б) и открытоживущая (в, г) жизненные формы фитоптид.
а - орешниковый клещ Phytoptus avellanae Nalepa (подсем. Phytoptinae), самка; б - Ph. avellanae, типичная
нимфа; в - Ph. avellanae, аберрантная нимфа; г - Solenocristus sp. (подсем. Sierraphytoptinae); д - парные
щетинки дорcального щитка; е - нога I c тибиальным соленидием. вк - вентральные кольца («стерниты»),
дк - дорcальные кольца («тергиты»), прд - продорcум (дорcальный щиток); c1 - субдорcальная
щетинка, sc и ve - щетинки дорcального щитка, φ - тибиальный соленидий.
По: Ozman, 2000 (а, б, в); Chetverikov et al., 2018 (г, е); Chetverikov, 2016 (д), с изменениями.
МАТЕРИАЛ И МЕТОДИКА
В обзоре были учтены все имеющиеся литературные данные о фитоптидах с двудольных,
включая описания видов, а также немногочисленные работы по сравнительной морфологии
и молекулярной филогении эриофиоидей, в которых был использован материал по сем.
Phytoptidae. Был составлен полный список видов фитоптид с двудольных (табл. 1). На кладо-
грамму, отображающую филогению цветковых растений (Byng et al., 2016), мы нанесли все из-
вестные к настоящему времени виды фитоптид с двудольных. Филогения растений (включая
названия клад - monocots, eudicots, rosids, malvids, fabids, asterids, lamiids, campanulids) приво-
дится в соответствии с системой цветковых, разработанной группой APG (Angiosperm Phylogeny
Group: Byng et al., 2016). Для анализа морфологических признаков клещей в первую очередь
были рассмотрены виды фитоптид, представленные в коллекции лаборатории паразитических
членистоногих Зоологического института РАН; были также проанализированы литературные
данные (только по тем видам, для которых доступно адекватное описание). Всего было рассмо-
трено 19 видов из подсем. Phytoptinae и 12 видов из подсем. Sierraphytoptinae. На основе данных
по 30 морфометрическим признакам (включая размеры дорсального щитка, тела, гнатосомы,
ног, длину щетинок опистосомы, а также число опистосомальных колец) в программе Statistica
699
10 был проведен факторный анализ по методу главных компонент. Отдельно нами учитывались
наличие или отсутствие тибиального соленидия. Было проведено также визуальное сравнение
рисунков дорсального щитка с целью выделения групп видов со сходной топографией продорсу-
ма.
АНАЛИЗ МОРФОЛОГИЧЕСКИХ ПРИЗНАКОВ ФИТОПТИД С ДВУДОЛЬНЫХ
Из 31 вида фитоптид, найденного на двудольных, 19 принадлежат к подсем. Phyt-
optinae и 12 - к подсем. Sierraphytoptinae (табл. 2). Первое подсемейство представлено
на двудольных лишь родом Phytoptus Dujardin, 1851 с 19 видами, тогда как второе на-
считывает 8 небольших родов (Austracus Keifer, 1944, Fragariocoptes Roivainen, 1951,
Neopropilus Huang, 1992, Neoprothrix Reis et Navia, 2014, Sierraphytoptus Keifer, 1939,
Solenocristus Chetverikov et al., 2018, Solenoplatilobus Chetverikov et Craemer, 2016),
включающих от 1 до 3 видов и принадлежащих к одной трибе - Sierraphytoptini Keifer
1944 (вторая триба, Mackiellini Keifer, 1946, объединяет сьеррафитоптин, утративших
щетинки c1 и связанных преимущественно с пальмами).
Морфометрические признаки
Статистический анализ ожидаемо показал деление всех анализируемых видов на
две группы в соответствии с их жизненной формой: 1 - червеобразные равнокольча-
тые клещи (в эту группу попали все фитоптины) и 2 - компактные разнокольчатые
клещи (в эту группу попали все сьеррафитоптины). При этом никаких четких группи-
ровок внутри подсемейств Phytoptinae и Sierraphytoptinae выявить не удалось. Более
того, при исключении из анализа признаков, связанных с морфотипом (число вен-
тральных и дорсальных опистосомальных колец, длина и направление гнатосомы), де-
ление на две группы, соответствующие разным подсемействам, нарушалось.
Следовательно, количественные признаки оказались непригодными для анализа об-
суждаемой группы клещей, поэтому дальнейшие изыскания с целью кластеризации
фитоптид с двудольных на основе анализа доступной в настоящее время морфометрии
представляются бесперспективными.
Тибиальный соленидий (шпора)
Интересные данные были получены при сравнении видов в подсемействах фитоп-
тин и сьеррафитоптин по таким качественным признакам, как наличие/отсутствие ти-
биального соленидия и рисунок дорсального щитка. Соленидии у клещей - это
видоизмененные хемочувствительные щетинки конечностей. У всех эриофиоидных
клещей есть тарзальные соленидии (ω) на обеих парах ног, при этом в отдельных
группах также присутствуют шпоры - тибиальные соленидии (φ) на ногах I (тибиаль-
ный соленидий II исходно утрачен у всех Eriophyoidea). Наличие φ I - плезиоморфный
признак, сохраняющийся лишь в трех семействах эриофиоидей: Pentasetacidae,
Nalepellidae и Phytoptidae. При этом в обоих подсемействах фитоптид с двудольных
(Phytoptinae, Sierraphytoptinae) встречаются виды, утратившие его. Очевидно, что
утрата тибиального соленидия свидетельствует о каких-то изменениях, происшедших
в процессе эволюции фитоптид на двудольных. По признаку наличия тибиального со-
ленидия клещи подсем. Phytoptinae с двудольных (виды рода Phytoptus) делятся на две
группы - у 8 видов он есть, у 11 его нет (табл. 1, 2). В подсем. Sierraphytoptinae тиби-
альный соленидий есть у 5 видов и отсутствует также у 5 (см. табл. 1).
704
Таблица 2. Группы видов рода Phytoptus Dujardin с двудольных
Клада двудольных,
Естественный
N
Рисунок щитка (рис. 2)
φ I
Виды клещей
включающая вид
ареал хозяев
растения-хозяина
1
Наиболее полный:
-
Ph. crinitus
Superrosids
Южная Африка
m полная или непол-
‒
Ph. ellipticus
Superrosids
Южная Африка
ная, ad всегда полные,
‒
Ph. swazilandicus
Superrosids
Южная Африка
одна из sm полная (за
исключением Ph. cri-
+
Ph. monthalensis
Rosids: fabids
Южная Африка
nitus, у которого обе
-
Ph. dentatae
Asterids
Южная Африка
неполные)
+
Ph. hedericola
Asterids: campanulids
Европа
2
Хорошо выражен:
+
Ph. lineatus
Rosids: fabids
Калифорния
m всегда неполная,
+
Ph. chamaebatiae
Rosids: fabids
Калифорния
ad всегда полные,
+
Ph. potentillae
Rosids: fabids
Евразия
обе sm короткие,
в передней четверти
+
Ph. alchemillae
Rosids: fabids
Евразия
щитка
+
Ph. argenteus
Rosids: fabids
Евразия
+
Ph. serbicus
Rosids: fabids
Европа
3
Неполный: m отсут-
‒
Ph. avellanae
Rosids: fabids
Голарктика
ствует, ad полные или
‒
Ph. tetratrichus
Rosids: malvids
Голарктика
неполные, не дохо-
‒
Ph. abnormis
Rosids: malvids
Голарктика
дящие до переднего
края щитка
4
Щиток гладкий, есть
+
Ph. corniseminis
Asterids
Калифорния
лишь короткие штри-
+
Ph. garryana
Asterids
Калифорния
хи в его задней части
+
Ph. leucothonis
Asterids
Калифорния
П р и м е ч а н и е. N - номер группы видов. Обозначения линий дорсального щитка: ad - адмедиальная,
m - медиальная, sm - субмедиальная. Названия клад двудольных даны по: Byng et al., 2016.
Ранее нами было высказано предположение, что утрата φ I может маркировать пере-
ход клещей к открытому образу жизни (Sukhareva, 1994; Сухарева и др., 2017). Однако
можно привести ряд примеров, противоречащих этой гипотезе. В частности, тибиаль-
ный соленидий сохранился у многих открытоживущих видов сьеррафитоптин южного
полушария. С другой стороны, у скрытоживущих южноафриканских представителей
рода Phytoptus, связанных с растениями рода Trichocladus (сем. Hamamelididae), соле-
нидий отсутствует. Можно предположить, что виды рода Phytoptus без соленидия - де-
риваты каких-то не сохранившихся открытоживущих предков. Однако нельзя
исключить, что тибиальный соленидий может утрачиваться клещами независимо от
их образа жизни. Ответа на этот вопрос пока нет, но надо отметить, что виды и фитоп-
тин, и сьеррафитоптин, имеющие соленидий, обитают на растениях, которые распро-
странены в тропиках и в южном полушарии, либо являются третичными реликтами
в субтропическом поясе северного полушария. Данный факт, возможно, свидетель-
ствует о том, что «шпороносные» и «бесшпорные» фитоптиды представляют две гра-
705
ды, отражающие ступени морфологической эволюции фитоптид на двудольных.
В этом случае наличие или отсутствие шпоры может маркировать связь фитоптид
с более древней или с более молодой флорой. С этих позиций связь удерживающих
соленидий фитоптид с эндемичными и реликтовыми хозяевами представляется весьма
логичной.
Рисунок дорсального щитка
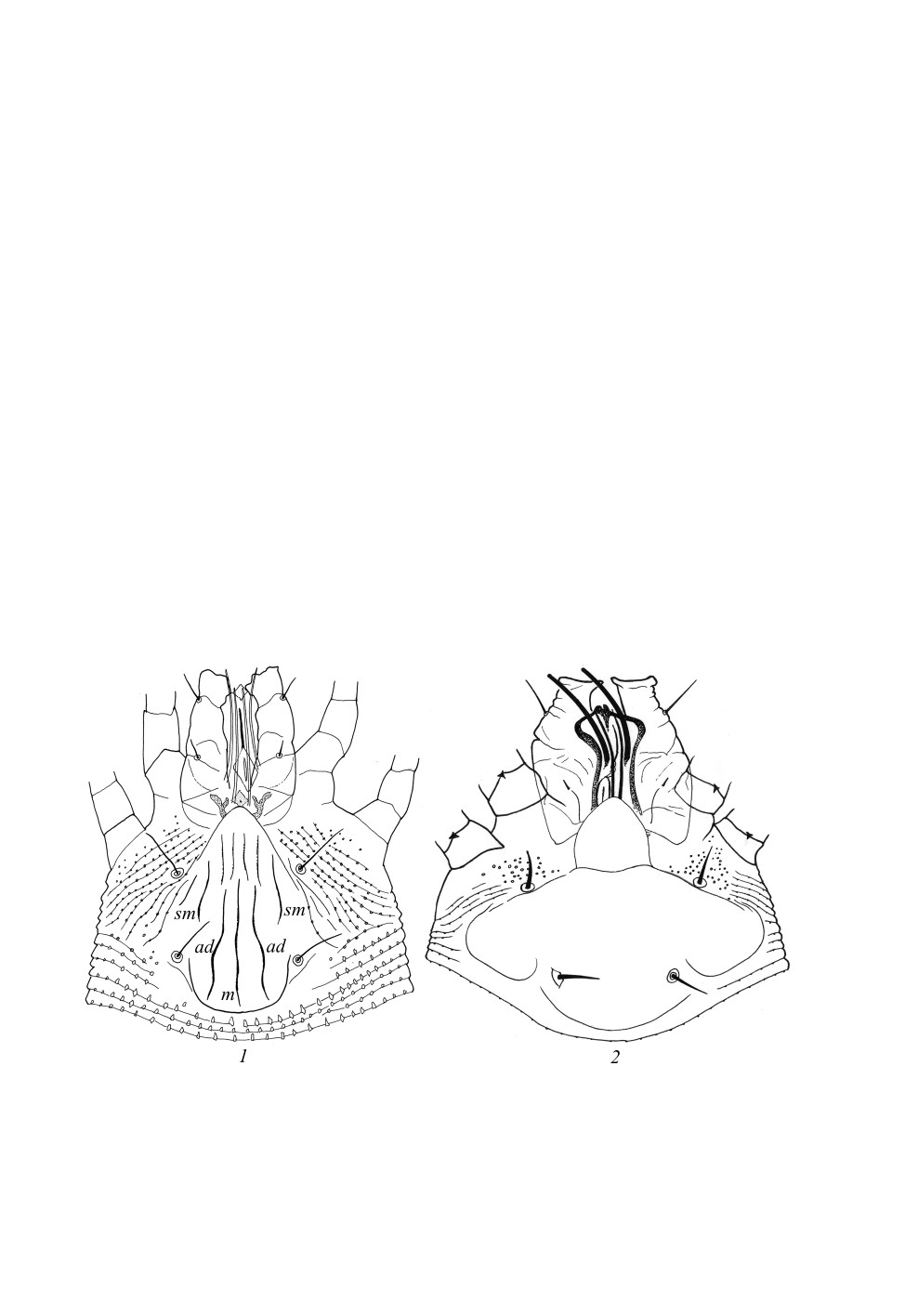
Рисунок дорсального щитка обычно состоит из продольных линий - медиальной,
а также парных адмедиальных и субмедиальных (рис. 2). Длина этих линий варьиру-
ет: они могут идти от заднего края продорсума до переднего, а могут быть и значи-
тельно короче, доходя или не доходя до его середины, или вовсе отсутствовать.
Соответственно рисунок щитка может быть полным (все линии присутствуют, хорошо
выражены), или неполным, когда часть элементов рисунка продорсума отсутствует.
Реже встречаются другие варианты рисунка щитка, когда он представлен отдельными
ячейками (например, у многих представителей сем. Diptilomiopidae), но у фитоптид
такой рисунок не встречается. В целом у представителей сем. Phytoptidae рисунок
дорсального щитка варьирует от полного или почти полного (с хорошо выраженными
медиальной, адмедиальными и субмедиальными линиями) до его полного отсутствия.
У большинства видов клещей подсем. Phytoptinae c двудольных (виды рода
Phytoptus) основные линии рисунка щитка присутствуют, хотя могут быть выражены
в разной степени. На основании сходства рисунка щитка мы выделили 4 группы видов
фитоптин с двудольных (табл. 2). Наиболее полный рисунок у следующих 6 видов:
Рис. 2. Основные элементы рисунка дорсального щитка фитоптид на примере родов Phytoptus
Dujardin (1) и Solenoplatilobus Chetverikov et Craemer (2).
ad - адмедиальные, m - медиальная, sm - субмедиальные линии. По: Chetverikov et al., 2018 (1)
и Chetverikov, Craemer, 2016 (2), с изменениями.
706
Ph. crinitus, Ph. ellipticus, Ph. swazilandicus, Ph. monthalensis, Ph. dentatae и Ph. hederi-
cola (группа 1). Все эти виды, кроме последнего, были собраны с южноафриканских
эндемичных растений. Phytoptus hedericola живет на плюще, имеющем широкое рас-
пространение и естественно произрастающем в лиственных лесах Западной, Цен-
тральной и Южной Европы, Кавказа и Юго-Западной Азии (Metkalfe, 2005). Три вида
из перечисленных (Ph. crinitus, Ph. ellipticus, Ph. swazilandicus) имеют наиболее пол-
ный рисунок щитка среди всех видов рода Phytoptus с эудикот. По степени выражен-
ности рисунка щитка к первой группе близки клещи группы 2: это 6 видов, связанных
с розоцветными (Rosaceae). Рисунок щитка без медиальной линии, представленный
только полными или неполными адмедиальными линиями и дополнительными мелки-
ми штрихами на боковых полях (группа 3), характерен для двух голарктических ви-
дов - Ph. avellanae и Ph. tetratrichus - и североамериканского вида Ph. abnormis,
связанных с широко распространенными древесными двудольными - лещиной и ли-
пой. Полностью отсутствует рисунок щитка у 3 видов: Ph. corniseminis, Ph. garryana
и Ph. leucothonis (группа 4). Примечательно, что все эти три вида обитают в Калифор-
нии, а их растения-хозяева относятся к кладе asterids и эндемичны для штата.
Частично характер рисунка дорсального щитка можно связать с систематическим
положением растений-хозяев. Наиболее полно он выражен у фитоптусов на трихокла-
дусах (группа 1), а также у видов, связанных с розоцветными (группа 2). Сглаженный
рисунок щитка у клещей с голарктических двудольных из клады rosids (группа 3).
И, наконец, полное отсутствие рисунка продорсума мы видим у обитателей растений
из клады астерид (группа 4).
У большинства видов клещей подсем. Sierraphytoptinae рисунок дорcального щитка
выражен слабо. Медиальная и адмедиальные линии есть только у видов рода
Fragariocoptes. У остальных представителей подсемейства дорсальный щиток глад-
кий или его рисунок представлен двумя неотчетливыми продольными линиями, кото-
рые с уверенностью нельзя отнести ни к адмедиальным, ни к субмедиальным. Кроме
рисунка дорсального щитка представители подсем. Sierraphytoptinae c двудольных
различаются по числу щетинок продорсума и опистосомы, при этом у представителей
некоторых родов наблюдается тенденция к утрате и тех, и других. Так, у видов
Neoprothrix hibiscus и Neopropilus jatrophus утрачены щетинки sc на продорсуме
и опистосомальные щетинки d и e.
Таким образом, полный рисунок щитка характерен только для фитоптин рода
Phytoptus, хотя у некоторых видов этого рода он может быть сильно редуцирован.
У сьеррафитоптин рисунок щитка никогда не бывает полным и имеет тенденцию к ре-
дукции. С одной стороны, полный рисунок щитка может быть плезиоморфным при-
знаком, а его редукция - апоморфным. С этих позиций сьеррафитоптин можно было
бы трактовать как более продвинутую или быстрее эволюционирующую группу; на-
блюдающаяся в этом подсемействе тенденция к редукции хетома согласуется с такой
трактовкой. С другой стороны, рисунок щитка фитоптид с двудольных может быть
адаптивным признаком, связанным с образом жизни клещей. Очевидно, что продоль-
ные линии щитка создают ребра жесткости и укрепляют передний конец тела. Такое
укрепление щитка может быть особенно важно для скрытоживущих форм (обитателей
галлов и иных укрытий) для облегчения передвижения в узких пространствах между
растительными тканями. Этим могут объясняться различия в рисунке щитка между
фитоптинами и сьеррафитоптинами, правда, такие исключения, как виды фитоптусов
707
с гладкими щитками на калифорнийских эндемичных растениях (группа 4), противо-
речат данному объяснению.
ПАРАЗИТО-ХОЗЯИННЫЕ ОТНОШЕНИЯ ФИТОПТИД С ДВУДОЛЬНЫМИ
На покрытосеменных растениях насчитывается около 70 видов фитоптид. Многие
региональные флоры все еще остаются неисследованными эриофиидологами, и опи-
сание новых видов продолжается до сих пор. Только в начале XXI в. было описано
более 20 видов фитоптид. Особенно слабо исследованы Южная Америка, Сибирь,
Восточная Азия, Африка, Австралия, острова Тихого океана. Среди фитоптид есть
и свободноживущие виды, и виды, вызывающие различные новообразования (галлы,
войлочки, разрастания верхушечной точки роста). Из двух подсемейств фитоптид на
двудольных (фитоптины и сьеррафитоптины) большинство видов, вызывающих ано-
мальные ростовые реакции тканей растений-хозяев, принадлежит к подсем. Phyto-
ptinae (табл. 3). Среди сьеррафитоптин галлообразователей только два: Fragariocoptes
setiger, вызывающий листовые галлы на землянике зеленой (Fragaria viridis) в Евро-
пе, и Austracus havrylenkonis, вызывающий плодовые галлы на южных буках
(Nothofagus dombeyi) в Чили и Аргентине (Keifer, 1944). Предположительно еще один
вид, Fragariocoptes gansuensis, способен повреждать розетки лапчаток, вызывая куще-
ние побегов, однако это предположение нуждается в подтверждении (Chetverikov,
2016).
Способностью вызывать различные новообразования в первую очередь отличаются
клещи рода Phytoptus (см. табл. 1). Все представители этого рода ведут скрытый образ
жизни, заселяя пространства между генеративными или вегетативными частями рас-
тений. На поверхности листовых пластинок они встречаются лишь в период рассели-
тельной миграции или после зимовки, когда перезимовавшие самки заселяют молодые
побеги растений. Многие виды не оказывают влияния на нормальный рост растений,
обитая в пазухах листьев или прицветников (Ph. chamaebatiae) и в основании розеточ-
ных листьев (Ph. alchemillae), другие же так или иначе оказывают влияние на расте-
ние, вызывая разрастание почек (Ph. аvellanae), деформацию верхушек побегов
(Ph. hedericola) или образование рожковидных галлов (Ph. abnormis) либо войлочков
(Ph. dentatae). Интересно, что многие виды фитоптид на двудольных топически часто
связаны с генеративными частями растений - цветочными почками, прицветниками,
защищенными пространствами в соцветиях или соплодиях.
Из подсем. Phytoptinae наиболее полно изучены в силу своего широкого распростра-
нения и отчасти хозяйственного значения Phytoptus avellanae на орешнике
и Ph. tetratrichus на липе. Phytoptus avellanae известен как возбудитель почковых гал-
лов на нескольких видах орешника (Corylus americana, C. avellana, C. colurna). Недав-
ние исследования с применением методов молекулярного анализа последовательностей
двух генов (COI и 28S рРНК) показали, что Phytoptus avellanae - это комплекс из двух
гостально не специализированных криптических видов. Морфологически они почти
неразличимы, при этом только один из них образует почковые галлы, тогда как другой
живет свободно под чешуями сережек и повреждений не вызывает (Cvrković et al.,
2016). Основное различие между этими двумя криптическими видами заключается
в том, что нимфы и половозрелые стадии почковых галловых клещей имеют одинако-
вый габитус (= морфотип; рис. 1, а, б), в то время как нимфы свободноживущих кле-
щей (из сережек) сильно отличаются от половозрелых самок (рис.
1, в): эти
708
Таблица 3. Взаимоотношения фитоптид с двудольными растениями-хозяевами
Не вызывают
Вызывают новообразования
новообразований
Подсемейство
Открыто-
Скрыто-
Почковые
Плодовые
Листовые
живущие
живущие
Войлочки
галлы
галлы
галлы
виды
виды
Phytoptinae
-
6
3
1
2
5
Sierraphytoptinae
10
-
-
1
-
1
аберрантные нимфы имеют разнокольчатую уплощенную опистосому с немногочис-
ленными широкими спинными полукольцами.
Аберрантные нимфы орешниковых клещей - уникальный для Eriophyoidea случай,
когда в жизненном цикле червеобразных равнокольчатых скрытоживущих клещей
нимфы имеют габитус компактных разнокольчатых клещей. В данном случае абер-
рантная нимфа по габитусу очень похожа на взрослых особей Sierraphytoptus
alnivagrans, живущих открыто на листьях ольхи. Ранее нами было высказано предпо-
ложение, что наличие аберрантных нимф в цикле Ph. avellanae (Sukhareva, 1994; Суха-
рева, Четвериков, 2013) может свидетельствовать о том, что предки фитоптид
с лещины жили открыто, подобно Sierraphytoptus alnivagrans. Другое возможное объ-
яснение предполагает, что анцестральный жизненный цикл фитоптид мог включать
несколько поколений клещей, среди которых были гетероморфные нимфы и взрослые
особи; независимое упрощение такого сложного цикла в ходе эволюции могло приве-
сти к формам, отнесенным в настоящее время к разным подсемействам (фитоптины
и сьеррафитоптины).
Особенность другого широко распространенного вида рода Phytoptus (Ph. tetratrichus
с лип) заключается в том, что характер вызываемых им новообразований на разных
видах хозяев может быть различным. Этот вид был описан А. Налепой (Nalepa, 1890)
с Tilia platyphyllos Scop. и T. сordata L. как вызывающий галлы в виде закручивания
края листа. Позже представители этого же вида были найдены им на других видах ли-
пы, на которых они вызывали повреждения другого характера. В связи с этим А. Нале-
пой был описан ряд подвидов этого вида: Ph. tetratrichus subsp. erinotes, вызывающий
круглые выпуклые войлочки на Tilia tomentosa; Ph. tetratrichus subsp. bursarius, вызы-
вающий округлые листовые галлы на Tilia platyphyllos; Ph. tetratrichus subsp. typicus
и Ph. tetratrichus subsp. stenoporus, вызывающие краевые галлы на Tilia platyphyllos,
и, наконец, Ph. tetratrichus subsp. abnormis, вызывающий рожковидные листовые гал-
лы на Tilia americana (Nalepa, 1918, 1920).
В настоящее время полностью полагаться на данные А. Налепы нельзя, так как его
описания (и клещей, и повреждений) не позволяют однозначно установить соответ-
ствие между тем, что находил и описывал А. Налепа, и тем материалом, который до-
ступен в природе современным исследователям. Так, по данным Сойки и Козака
(Soika, Kozak, 2011), в Европе на липах Tilia platyphyllos и T. cordata L. клещи
Ph. tetratrichus вызывают краевые галлы, на T. tomentosa - выпуклые войлочки, а на
T. americana - рожковидные галлы. Североамериканские клещи, вызывающие такие
же галлы в форме рожка на T. americana в США, были описаны сначала Гарменом как
709
Ph. abnormis (Garman, 1883). Вероятно, именно этот вид А. Налепа рассматривал в ка-
честве одного из подвидов европейского липового клеща - Ph. tetratrichus subsp.
abnormis. Однако остается неясным, какой именно вид вызывает рожковидные галлы
на T. americana в Европе: американский вид, который был завезен в Европу вместе со
своим растением-хозяином, или на интродуцированной T. americana поселился мест-
ный вид Ph. tetratrichus, перешедший с европейских лип на американскую. Морфоло-
гические различия между этими клещами с разных видов лип настолько малы, что
пока нет ответа на вопрос, являются ли клещи рода Phytoptus на разных видах лип ви-
дами-двойниками или же разными кормовыми расами одного вида (Ph. tetratrichus),
связанными с разными видами растений-хозяев. Ответы на эти вопросы, вероятно,
удастся получить только с применением молекулярных методов исследования и экспе-
риментально путем пересадок клещей с одного вида липы на другой.
РАСПРЕДЕЛЕНИЕ ТАКСОНОВ ФИТОПТИД ПО КЛАДАМ ЦВЕТКОВЫХ РАСТЕНИЙ
Широкое применение методов молекулярного филогенетического анализа суще-
ственно изменило представления о филогении цветковых растений, сложившиеся
в науке к началу XXI века. В результате исследований международной группы APG
(Angiosperm Phylogeny Group) базальное ветвление и основные клады древа
Magnoliophyta к настоящему времени можно считать полностью реконструированны-
ми. На рис. 3 приведена схема, отражающая взаимоотношения между основными кла-
дами цветковых. На эту схему нанесены таксоны фитоптид, чтобы показать
распределение и объем родов фитоптид с двудольных.
Не обнаружено фитоптид, паразитирующих на видах базальных групп цветковых
(«early angiosperms», включая магнолиид). Все хозяева фитоптид принадлежат к двум
кладам: однодольные (monocots) и эудикоты (eudicots). На однодольных к настоящему
времени известно 42 вида этих клещей, причем их хозяева относятся исключительно
к порядкам Poales, Liliales, Arecales и Zingiberales. Галлообразователей среди них нет,
за исключением единичных видов рода Oziella Amrine, Stasney et Flechtmann, индуци-
рующих разрастание мешочков в соцветиях осок. Другие повреждения (в основном
некроз тканей листьев и стеблей) вызывают виды рода Retracrus Keifer с пальм, а так-
же эндопаразиты рода Novophytoptus Roivainen с однодольных трав порядка Poales.
На эудикотах фитоптиды представлены меньшим числом видов, чем на однодоль-
ных: их всего три десятка, однако именно на двудольных наблюдается основное раз-
нообразие фитоптид-галлообразователей. Растения-хозяева фитоптид с двудольных
принадлежат к 12 семействам из 12 порядков эудикот (см. табл. 1, рис. 3). Эти расте-
ния занимают разное положение в системе - от древнего порядка Trochodendrales, от-
ветвившегося от основного ствола раньше, чем произошло формирование основных
клад эудикот (rosids и asterids), до порядка Apiales - одного из наиболее эволюционно
продвинутых в кладе campanulids (в составе asterids) (рис. 3). Подавляющее большин-
ство видов фитоптид связано с кладой rosids (19 видов), значительно меньше - с кла-
дой asterids (6 видов). При этом на одном виде растения-хозяина, как правило,
встречается только один вид фитоптид.
Интересно отметить, что на растениях клады rosids одновременно со скрытоживу-
щими клещами подсем. Phytoptinae зачастую развиваются и открытоживущие виды
подсем. Sierraphytoptinae, тогда как на растениях клады asterids пока найдены только
представители подсем. Phytoptinae. К общим чертам, характерным для фитоптин
710
Рис. 3. Распределение фитоптин (●) и сьеррафитоптин (♦) по кладам двудольных растений.
Система цветковых с сокращениями приводится по: Byng et al., 2016; порядки растений - по: Stevens,
2001. Даны названия только тех порядков двудольных, которые заселены фитоптидами. Знаком «+»
обозначено присутствие тибиального соленидия. Зачерненные фигуры (●♦) - фитоптиды
из южного полушария и тропических поясов, незачерненные фигуры (○◊) - фитоптиды
из внетропических поясов северного полушария.
с астерид, относятся отсутствие рисунка дорсального щитка и наличие тибиального
соленидия. Исключение составляет только Phytoptus hedericola с плюща Hedera helix,
имеющий полный рисунок дорсального щитка. Род Hedera включает около 16 видов
в субтропическом поясе Старого света. Естественный ареал Hedera helix связан c За-
падной, Центральной и Южной Европой и Кавказом, а также с Юго-Западной Азией
711
(Metkalfe, 2005), однако сейчас благодаря участию человека плющ распространен
практически на всех материках, что сказалось и на ареале клеща Ph. hedericola: в на-
стоящее время он зарегистрирован в Европе (Болгария, Сербия), Южной Африке
(ЮАР) и Северной Америке (США). Hedera helix - единственный представитель
крупной клады campanulids (в составе asterids), заселенный фитоптидами. Отсутствие
других находок фитоптид на кампанулидах и явное несходство рисунка дорсального
щитка Ph. hedericola с рисунком у других фитоптусов с астерид позволяют предполо-
жить, что предки Ph. hedericola могли перейти на плющ с каких-то других растений,
тогда как кампанулиды изначально не имели фитоптидной фауны.
В целом распределение фитоптид по таксонам эудикот на кладограмме Magnoliophyta
(см. рис. 2) на первый взгляд выглядит случайным. Однако можно заметить, что поми-
мо находок единичных видов на филогенетически далеких группах растений клещи
отдают предпочтение некоторым кладам двудольных так, что виды оказываются
сгруппированными на соседних ветвях. Такие группировки видны, например, на рас-
тениях порядков Fagales, Rosales и Fabales (клада fabids). С одной стороны, сгущения
таксонов фитоптид на древе цветковых могут быть отражением параллельной эволю-
ции в разных филогенетических линиях фитоптид, связанных с крупными кладами
эудикот. С другой стороны, такая картина не исключена и при переходе с одного расте-
ния на другое, филогенетически близкое, особенно, если они оказываются близкими
соседями в природе. И, наконец, сгущения таксонов могут указывать на благоприят-
ные для фитоптид условия на растениях-хозяевах, принадлежащих к упомянутым кла-
дам двудольных, в которых клещи могли эволюционировать длительное время, тогда
как на других группах хозяев фитоптиды были менее успешны - они либо полностью
вымерли, либо оказались представлены единичными видами, зачастую связанными
с узкоареальными или реликтовыми хозяевами.
ОБЗОР ДАННЫХ ПО ГЕОГРАФИЧЕСКОМУ РАСПРОСТРАНЕНИЮ
ФИТОПТИД С ДВУДОЛЬНЫХ
Особенности растений-хозяев фитоптид
Бóльшая часть хозяев фитоптид - деревья и кустарники, травы составляют исключе-
ние. Интересно, что все травянистые хозяева фитоптид относятся исключительно
к сем. Rosaceae; это преимущественно палеарктические виды родов Alchemilla,
Potentilla и Fragaria. Почти все виды фитоптид, данными по которым мы располага-
ем, были собраны в местах естественного произрастания своих растений-хозяев. Эти
растения в большинстве случаев имеют ограниченные ареалы и являются реликтовы-
ми или трансформационными элементами флоры (Краснов, 1888; Levin, 2000). К та-
ким растениям можно, например, отнести характерные для калифорнийской флоры
эндемичные виды Chamaebatia foliolosa, Benthamidia nuttali, Garrya elliptica, Leucothoe
davisiae, а также виды рода Cercocarpus (Topel et al., 2012; Ex et al., 2011). В Южной
Африке хозяева фитоптид - местные эндемики, такие как Curtisia dentata, Schotia
brachypetala, Sch. afra, Searsia lucida и виды рода Trichocladus (Coates-Palgrave et al.,
2002; Yembaturova et al., 2009). Соответственно, и сами клещи, связанные с этими рас-
тениями, имеют локальные ареалы, особенно, если эндемизм хозяев проявляется даже
не на видовом, а на родовом уровне (как в случае с Curtisia). Примечательно, что на
многих других южноафриканских растениях, имеющих обширные афро-европейские
и афро-азиатские ареалы, фитоптиды не зарегистрированы, несмотря на многолетние
исследования фауны эриофиоидей ЮАР, проводимых группой акарологии института
712
защиты растений Претории (ARC PPRI) под руководством M. Смит-Мейер (M. Smith-
Meyer).
В местах произрастания растения-хозяева фитоптид зачастую не относятся к ред-
ким видам, более того, часто это - лесообразующие породы, такие как церкокарпусы
в Северной Америке, нотофагусы в Южной Америке, трихокладусы и куртисия в Юж-
ной Африке. Некоторые из них, такие как церкокарпусы или нотофагусы, к тому же
относятся к долгоживущим растениям (DeRose, 2011; Howard, 1973). Возможно, при-
веденные выше особенности растений-хозяев способствовали сохранению стабиль-
ных условий, необходимых для успешного выживания популяций фитоптид в течение
длительного времени. Кроме того, почти для всех перечисленных растений характер-
но обитание невысоко в горах (как правило, на высоте в среднем от 300 до 2000 м).
Именно такие местообитания служили рефугиями для многих третичных реликтов
(Svenning et al., 2008; Topel et al., 2012). Это, несомненно, также способствовало и со-
хранению на них фитоптидной фауны.
Фитоптиды на растениях северного полушария
Фитоптиды на растениях северного полушария изучены гораздо подробнее, чем на
представителях флоры южного полушария. Комплексы видов фитоптид, связанных
с широко распространенными родами и видами растений-хозяев, описаны из бореаль-
ной области. В состав таких комплексов, как правило, входят фитоптиды разных мор-
фотипов, обитающие на представителях одного надвидового таксона (семейство,
триба, род) двудольных. Наиболее яркие примеры - это фитоптиды на березовых и на
розоцветных трибы Potentilleae. Растения-хозяева клещей в каждой из этих групп
представлены близкими видами (а иногда одним и тем же видом) в бореальном и суб-
тропическом поясах Старого и Нового Света, причем значительные части их ареалов
занимают территории, заселенные после отступления ледника. Такие растения-хозяе-
ва на большей части своего ареала относят к представителям миграционной флоры.
1. Фитоптиды на растениях сем. Betulaceae. Сем. Betulaceae насчитывает около
150 видов в составе 6 родов, распространенных преимущественно в северном полу-
шарии, и разделяется на 2 подсемейства: Coryloideae с родами Corylus, Carpinus,
Ostrya и Ostryopsis и Betuloideae с родами Betula и Alnus. Палеонтологические и моле-
кулярные данные свидетельствуют о том, что формирование семейства началось
в верхнем мелу, а разделение на 2 подсемейства - в палеоцене 15-25 млн лет назад пе-
ред среднемиоценовым климатическим оптимумом (Grimm, Renner, 2013). На пред-
ставителях подсем. Betuloideae отмечены только открытоживущие виды рода
Sierraphytoptus (подсем. Sierraphytoptinae). На ольхе (род Alnus) Sierraphytoptus
alnivagrans зарегистрирован в Европе (Сербия) и Северной Америке. Европейские
и американские виды ольхи, являющиеся хозяевами клеща S. alnivagrans, относятся
к комплексу Alnus incana из номинативного подрода и имеют голарктическое распро-
странение (Chen, Li, 2004). На березах (род Betula), широко распространенных по всей
Голарктике, сьеррафитоптины известны лишь по единственной находке Sierraphytoptus
sp. 1 на туркестанской березе (Betula turkestanica) в горах Киргизии (Пономарева,
1978). На представителях подсем. Coryloideae зарегистрированы скрытоживущие
фитоптины рода Phytoptus, образующие комплекс криптических видов Phytoptus
avellanae s. l. на орешнике (виды рода Corylus), а также открытоживущие сьеррафито-
птины Sierraphytoptus sp. 2, найденные на листьях граба Carpinus betulus в Боснии
713
и Герцеговине (Petanović, 1988). Как уже было сказано, наличие в жизненном цикле
одного из криптических видов комплекса Ph. avellanae s. l. аберрантных нимф, морфо-
логически сходных со взрослыми особями рода Sierraphytoptus, может рассматривать-
ся аргументом в пользу монофилии группы фитоптид на березовых (Phytoptus
avellanae s. l. + Sierraphytoptus spp.).
2. Фитоптиды на розоцветных трибы Potentilleae. Все хозяева фитоптид из трибы
Potentilleae относятся к трем родам: Potentilla (лапчатка), Fragaria (земляника)
и Alchemilla (манжетка). Эти три рода обширны и полиморфны, разделены на множе-
ство подродов, видов и разнообразных внутривидовых форм. Они имеют евразиатское
происхождение и в настоящее время широко распространены в северном полушарии
на всех континентах. (Staudt, 1989; Gehrke et al., 2008; Paule, 2010). Род Alchemilla
в Европе отличается высоким уровнем эндемизма, особенно это относится к обитате-
лям горных массивов - с ними связано до 60 % эндемичных видов (Gerold, 2006;
Kurtto et al., 2009). Заселенные фитоптидами лапчатки (Potentilla bifurca и P. argentea),
а также виды рода Fragaria (F. vesca и F. viridis) широко распространены по всей Евра-
зии и встречаются преимущественно в составе равнинных луговых и степных фитоце-
нозов, хотя оба вида лапчаток могут подниматься в горы, а земляника лесная обычна
на лесных опушках в бореальной Голарктике (Staudt, 1989; Басаргин, 2007). Alchemilla
hoppeana и Potentilla tommasiniana (хозяева клещей рода Phytoptus) - растения цен-
тральноевропейского происхождения и имеют естественный ареал на территории гор-
ных систем (Альпы, Балканы, Пиренеи) Центральной и Южной Европы (Redzic, 1994;
Kurtto et al., 2009). Эти виды, связанные с горными массивами, включают большое ко-
личество подвидов и представлены множеством локальных популяций.
В группу фитоптид с розоцветных входят как скрытоживущие (род Phytoptus), так
и открытоживущие (род Fragariocoptes) клещи. При этом в отличие от фитоптид с бе-
резовых (Phytoptus avellanae и Sierraphytoptus spp.) морфологические различия между
фитоптусами и фрагариокоптесами с розоцветных выражены заметно слабее,
а Phytoptus potentillae по одним признакам ближе к видам рода Phytoptus, а по дру-
гим - к роду Fragariocoptes. Возможно, как и в случае с фитоптидами на березовых,
с растениями трибы Potentilleae связана обособленная ветвь фитоптид, представлен-
ная видами родов Phytoptus и Fragariocoptes.
Фитоптиды тропических поясов и областей южного полушария
Данные по фитоптидам - обитателям тропических поясов и южного полушария
весьма скудны. Изучение эриофиоидных клещей в этих географических областях на-
чалось гораздо позже, чем в северном полушарии (примерно на сотню лет), что, воз-
можно, объясняет, почему материала по фитоптидам накоплено гораздо меньше.
С тропическим поясом и южным полушарием связаны 5 видов фитоптин из рода
Phytoptus и 5 родов сьеррафитоптин, тогда как с северным полушарием связано почти
в три раза больше видов фитоптин (14 видов рода Phytoptus) и только 2 рода сьеррафи-
топтин. Сьеррафитоптины южного и северного полушарий относятся к разным родам,
при этом таксономическое разнообразие сьеррафитоптин в южном полушарии замет-
но богаче, чем в северном. В северном полушарии известны 3 вида рода Sierraphytoptus
и 3 вида рода Fragariocoptes, при этом виды в каждом из этих родов связаны с филоге-
нетически близкими растениями-хозяевами: виды рода Sierraphytoptus - с растениями
сем. Betulaceae, а виды рода Fragariocoptes
- с растениями трибы Potentilleae
714
(сем. Rosaceae). В южном полушарии большинство родов сьеррафитоптин монотип-
ные (Austracus, Neoprothrix, Neopropilus, Solenoplatilobus), и лишь южноафриканский
род Solenocristus включает 2 вида.
Род A u s t r a c u s. Единственный вид этого рода, A. havrilenkonis, обнаружен на двух
видах нотофагусов в Южной Америке. Род Nothofagus (южный бук) распространен
в южном полушарии и имеет дизъюнктивный ареал. В настоящее время этот род раз-
делен на 4 подрода: Nothofagus, Fuscospora, Brassospora и Lophozonia (Heenan et al.,
2013). Виды первого произрастают исключительно в Южной Америке, виды подродов
Fuscospora и Lophozonia распространены также в Новой Зеландии и Австралии, под-
род же Brassospora встречается только на островах Индийского океана. Austracus
havrilenkonis обнаружен только на видах южноамериканского подрода Nothofagus. На
видах подродов Fuscospora и Lophozonia фитоптиды не найдены, хотя с них описано
немало представителей другого семейства эриофиоидных клещей (Eriophyidae) из Но-
вой Зеландии и Австралии (Manson, 1984). Клещи с видов подрода Brassospora неиз-
вестны, поскольку сборы на островах Океании не проводились. Согласно
молекулярным датировкам, дивергенция южных буков на подроды произошла в верх-
нем мелу, а южноамериканский подрод Nothofagus ответвился от общего ствола Notho-
fagaceae раньше других (Heenan et al., 2013). Возможно, именно к раннему мелу
относится становление фитоптидной фауны на покрытосеменных растениях южноа-
мериканского континента.
Род S o l e n o p l a t i l o b u s. Открытоживущий вид S. taiwanensis был описан
с Trochodendron aralioides с Тайваня. Троходендрон имеет ограниченное распростра-
нение на островах Японии, Тайване и в Корее, ставших рефугиями для этого реликто-
вого растения, которое в предыдущие эпохи было широко распространено в северном
полушарии (Huang, Lin, 2006).
Монотипные роды N e o p r o p i l u s и N e o p r o t h r i x. Neopropilus jatrophus
и Neoprothrix hibiscus были найдены вне естественного ареала своих растений-хозяев.
Neopropilus jatrophus был описан с молочая Jathropha curcas с о. Тайвань, хотя место
естественного распространения этого растения - Центральная Америка (Li et al.,
2017). Neoprothrix hibiscus найден в Бразилии на гибискусе Hibiscus rosasinensis, при
этом происхождение самогó растения связано с Юго-Восточной Азией (Pfeil et al.,
2002). Неясно, были эти виды клещей занесены на Тайвань и в Бразилию вместе со
своими интродуцированными хозяевами или же перешли на них с каких-то местных
растений, поэтому для обоих не исключена возможность как южноамериканского, так
и восточноазиатского происхождения.
Род S o l e n o c r i s t u s. Solenocristus searsius и S. karooensis были собраны в Южной
Африке с достаточно далеких филогенетически хозяев из родов Schotia и Searsia.
Исторические связи эти родов с флорой Юго-Восточной Азии указывают на возмож-
ное происхождение фитоптид на этих растениях в начале миоцена, когда происходил
интенсивный обмен флористическими элементами между биомами тропических ле-
сов Африки и Азии, богатых реликтовыми древесными двудольными, через Гомфоте-
риевый мост (van Hinsbergen et al., 2009; Zhou et al., 2012).
ЗАКЛЮЧЕНИЕ
Проведенный нами анализ паразито-хозяинных связей фитоптид с двудольными по-
казал, что фитоптиды распределены на двудольных мозаично. Они связаны лишь
715
с растениями отдельных клад эудикот, многие из которых являются реликтами и узко-
ареальными эндемиками. Ранее (Bagnjuk et al., 1998) было высказано предположение,
что фитоптиды - реликтовая группа эриофиоидей, остаток более обширной древней
фауны, связанной с древними флористическими комплексами. Наше исследование по-
зволяет дополнить это предположение: фитоптиды, по-видимому, произошли в юж-
ном полушарии или в тропиках, а предок фитоптид, возможно, имеет гондванские
корни. В пользу данной гипотезы говорят следующие факты: а) большее родовое раз-
нообразие фитоптид в южном полушарии по сравнению с северным, б) сохранение
тибиального соленидия у тропических и нотальных сьеррафитоптин и в) наличие наи-
более полного рисунка дорсального щитка у южноафриканских фитоптид (виды рода
Phytoptus с трихокладусов).
Какими были гипотетические предки фитоптид? По нашему мнению, это были рав-
нокольчатые, червеобразные клещи с полным хетомом, тибиальными соленидиями на
первой паре ног и полным рисунком дорсального щитка. Древние цветковые, а может
быть, и их предшественники проангиоспермы, были первичными хозяевами анце-
стральных форм фитоптид. В ходе эволюции цветковых в кайнозое фитоптиды, веро-
ятно, оказались менее адаптированы к обитанию на быстро эволюционирующих
группах растений. В результате они уступили большинство ниш клещам двух других
семейств (Eriophyidae и Diptilomiopidae) и сохранились главным образом на реликто-
вых группах древесных двудольных. Лишь в Голарктике, возможно, под влиянием
многочисленных изменений климата, отдельные группы фитоптид смогли преодолеть
присущую этой группе «инертность», дать несколько молодых кластеров «бесшпор-
ных» форм на листопадных деревьях широколиственных лесов и совершить переход
к обитанию на травянистых розоцветных.
Безусловно, обозначенная выше крупными мазками предполагаемая эволюционная
траектория фитоптид на двудольных может выглядеть достаточно спекулятивной. Тем
не менее, в условиях дефицита данных по этой группе клещей более четкие построе-
ния вряд ли возможны. Продолжая начатую линию логических построений, отметим,
что данные по морфологии и биологии фитоптид четко указывают на ряд тенденций
в эволюции этой группы на двудольных. Во-первых, в разных линиях фитоптид про-
исходило упрощение рисунка дорсального щитка. Во-вторых, на разных группах дву-
дольных у фитоптид независимо утрачивался тибиальный соленидий. Конечно, эти
два признака (рисунок щитка и наличие соленидия) имеют разный вес. Рисунок щит-
ка - это характеристика рельефа дорсальной кутикулы переднего отдела тела клеща,
тогда как соленидий - это щетинка, имеющая собственную иннервацию и важную
сенсорную функцию. На наш взгляд, утрата соленидия - гораздо более весомое мор-
фологическое изменение, чем модификация рисунка на щитке. Анализ данных по
фитоптидам показывает, что редукция рисунка щитка и утрата соленидия наблюдают-
ся как среди скрытоживущих, так и у открытоживущих фитоптид.
Современное деление фитоптид на подсемейства подразумевает, что клещи разных
морфотипов (скрытоживущие червеобразные и открытоживущие разнокольчатые) эво-
люционировали независимо. Именно на этом предположении основано деление фито-
птид с двудольных на подсемейства Phytoptinae и Sierraphytoptinae. Однако, на наш
взгляд, классификация на основе особенностей морфотипа приводит к тому, что си-
стема фитоптид не отражает их филогению. Действительно, скрытоживущие фитоп-
тины и открытоживущие сьеррафитоптины, обитающие на близкородственных
716
растениях-хозяевах, вполне могут формировать обособленные монофилетические
группы. Наличие двух разных морфотипов фитоптид на близких видах растений-хозя-
ев мы рассматриваем как свидетельство параллельной эволюции фитоптид на разных
кладах двудольных. Если это предположение верно, то разделение сем. Phytoptidae на
фитоптин и сьеррафитоптин искусственно, а род Phytoptus в этом случае парафилети-
ческий. К таким же выводам мы пришли ранее относительно габитуального подразде-
ления на подсемейства обширного сем. Eriophyidae в ходе анализа паразито-хозяинных
связей четырехногих клещей с розоцветными (Cухарева и др., 2017).
Построение естественной системы надсем. Eriophyoidea и системы фитоптид в част-
ности - одна из давно назревших проблем в систематике четырехногих клещей. Сей-
час понятно, что на основании только морфологического критерия невозможно
адекватно реконструировать филогенез Eriophyoidea. Основные причины этого - пре-
дельно упрощенное строение четырехногих клещей, обилие гомопластических при-
знаков и отсутствие морфологических маркеров, не подверженных гомоплазии.
Можно констатировать, что очень скоро эриофиоидеи пополнят список групп, в изуче-
нии которых важное место займут методы молекулярной филогении и систематики.
Ближайшим этапом на пути реконструкции филогенеза Eriophyoidea мы видим завер-
шение начатой нами ранее работы по выявлению базальной дивергенции Eriophyoidea
и построению молекулярной филогении фитоптид (Chetverikov et al., 2015).
Фрагментарность данных по фитоптидам определяет необходимость продолжения
целенаправленного сбора материала по этой группе. Особое внимание следует обра-
тить на представителей реликтовых и трансформационных флор, в том числе на так-
соны растений, филогенетически близкие к тем, что уже известны как хозяева
фитоптид. Например, среди видов рода Alnus есть не обследованные на предмет эрио-
фиоидных клещей эндемичные виды с узколокальными ареалами в Юго-Восточной
Азии и Северной Америке. Это виды подрода Cremastogyne из Китая и Гималаев и ви-
ды подрода Cleithropsis из Южного Китая, Японии и с запада Северной Америки
(Chen, Li, 2004). Два рода, входящие в подсем. Tilioidea и имеющие узколокальные
ареалы, Mortoniodendron в Центральной Америке и Craigia в Юго-Восточной Азии
(Nyffeler et al., 2005), несомненно, также заслуживают внимания. Дальнейшие поиски
фитоптид на эндемичных древесных породах в горных экосистемах Южной Африки,
Юго-Восточной Азии и Южной Америки с большой вероятностью принесут новые
находки фитоптид. И наконец, интересные результаты могут быть получены в ходе
сравнительного анализа фауны фитоптид с однодольных и двудольных. Пока нет яс-
ного представления о том, монофилетичны ли группировки фитоптид на этих двух
крупных кладах цветковых или фитоптиды неоднократно меняли хозяев, переходя
с двудольных на однодольные и обратно. Вероятно, ответить на этот вопрос помогут
будущие молекулярно-филогенетические исследования.
ФИНАНСИРОВАНИЕ
Работа выполнена в рамках программы РАН (АААА-А19-119020790133-6) при под-
держке Российского фонда фундаментальных исследований (грант № 19-04-00127).
CПИСОК ЛИТЕРАТУРЫ
Басаргин Е. А. 2007. Эколого-демографическая характеристика ценопопуляций Potentilla bifurca L. Эко-
717
Краснов А. Н. 1888. Опыт истории развития флоры южной части Восточного Тянь-Шаня. Записки Русского
географического общества 19: 1-413.
Пономарева Р. Е. 1978. Четырехногие клещи орехово-плодовых лесов Киргизии. Фрунзе: Илим. 74 с.
Сухарева С. И., Четвериков Ф. E. 2013. Морфологические преобразования при переходе от протогинной
к дейтогинной форме самок у четырехногих клещей (Acari: Eriophyoidea). Вестник Санкт-Петербург-
Сухарева С. И., Паутов А. А., Додуева И. Е., Четвериков Ф. Е. 2017. Четырехногие клещи (Acariformes,
Eriophyoidea) на розоцветных (Rosaceae): таксономическое разнообразие, паразито-хозяинные отно-
item.asp?id=30738756
Amrine J. W., Stasny T. A., Flechtmann C. H. W. 2003. Revised Keys to the World Genera of the Eriophyoidea
(Acari: Prostigmata). Michigan: Indira Publishing House. 244 p.
Bagnjuk I. G., Sukhareva S. I., Shevchenko V. G. 1998. Major trends in the evolution of four-legged mites as
a specialized group (using families Pentasetacidae Shev., Nalepellidae Roiv. and Phytoptidae Murray (Acari:
Tetrapodili) as examples). Acarina 6 (1-2): 59-76.
Boczek J., Shevchenko V. G., Davis R. 1989. Generic key to world fauna of eriophyoid mites (Acarida: Eriophyoidea).
Warsaw: Agricultural University Press, 190 p.
Bolton S. J., Chetverikov P. E., Klompen H. 2017. Morphological support for a clade comprising two vermiform
mite lineages: Eriophyoidea (Acariformes) and Nematalycidae (Acariformes). Systematic and Applied
Byng J. W., Chase M. W., Christenhusz M. J., Fay M. F., Judd W. S., Mabberley D. J., Sennikov A. N., Soltis D. E.,
Soltis P. S., Stevens P. F., Briggs B., Brockington S., Chautems A., Clark J. C., Conran J., Haston E., Möller
M., Moore M., Olmstead R., Perret M., Skog L., Smith J., Tank D., Vorontsova M., Weber A. 2016. An update
of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG
doi.org/10.1111/boj.12385
Chen Z., Li J. 2004 Phylogenetics and biogeography of Alnus (Betulaceae) inferred from sequences of nuclear
ribosomal DNA its region. International Journal of Plant Sciences 165 (2): 325-335.
Chetverikov P. E., Craemer C. 2016. Sierraphytoptines (Eriophyoidea: Phytoptidae) from relict eudicots:
reassignment of Sierraphytoptus taiwanensus to a new genus Solenoplatilobus and refinement of generic
Chetverikov P. E., Cvrković T., Makunin A., Sukhareva S., Vidović B., Petanović R. 2015. Basal divergence of
Eriophyoidea (Acariformes, Eupodina) inferred from combined partial COI and 28S gene sequences and
Coates-Palgrave K., Drummond R. B., Moll E. J., Coates-Palgrave M. 2002. Trees of Southern Africa. Cape Town:
Struik Publishers, 1212 p.
Cvrković T., Chetverikov P., Vidović B., Petanović R. 2016. Cryptic speciation within Phytoptus avellanae s. l.
(Eriophyoidea: Phytoptidae) revealed by molecular data and observations on molting Tegonotus-like nymphs.
org/10.1007/s10493-015-9981-5
Douda J., Doudova J., Drasnarova A., Kunes P., Hadincova V., Krak K., Zakravsky P., Mandac B. 2014. Migration
patterns of subgenus Alnus in Europe since the last glacial maximum: a systematic review. PLOS ONE 9 (2):
Ex S. A., DeRose R. J., Long J. N. 2011. Stand development and population dynamics of curlleaf mountain
mahogany (Cercocarpus ledifolius Nutt.) woodlands in Utah’s Bear River Mountains. Western Journal of
Gehrke B., Bräuchler C., Romoleroux K., Lundberg M., Heubl G., Eriksson T. 2008. Molecular phylogenetics of
Alchemilla, Aphanes and Lachemilla (Rosaceae) inferred from plastid and nuclear intron and spacer DNA
sequences, with comments on generic classification. Molecular Phylogenetics and Evolution 47: 1030-1044.
Hügin G. 2006. Die Gattung Alchemilla im Schwarzwald und seinen Nachbargebirgen (Vogesen, Nord-Jura,
Schwäbische Alb). In: Berichte der Botanischen Arbeitsgemeinschaft Südwestdeutschland Karlsruhe. Beiheft
2. Karlsruhe: Botanische Arbeitsgemeinschaft Südwestdeutschland, p. 2-18.
Grimm G. W., Renner S. S. 2013. Harvesting Betulaceae sequences from Genbank to generate a new chronogram
Hall C. C. Jr. 1967. The Eriophyoidea of Kansas. The University of Kansas Science Bulletin XLVII (9): 601-675.
718
Heenan P. B., Smissen R. D. 2013. Revised circumscription of Nothofagus and recognition of the segregate genera
phytotaxa.146.1.1
Howard T. M. 1973. Studies in the ecology of Nothofagus cunninghamii Oerst. I. Natural regeneration on the Mt.
Huang S. F., Lin T. P. 2006. Migration of Trochodendron aralioides (Trochodendraceae) in Taiwan and its adjacent
areas. Botanical Studies 47: 83-88.
Keifer H. H. 1939. Eriophyid studies III. Bulletin of the California Department of Agriculture 28: 144-163.
Keifer H. H. 1944. Eriophyid Studies XIV. Bulletin of the California Department of Agriculture 33: 18-38.
Klimov P. B., O’Connor B. M., Chetverikov P. E., Bolton S. J., Pepato A. R., Mortazavi A. L., Tolstikov A. V.,
Bauchan G. R., Ochoa R. 2018. Comprehensive phylogeny of acariform mites (Acariformes) provides
insights on the origin of the four-legged mites (Eriophyoidea), a long branch. Molecular Phylogenetics
and Evolution
119:
ympev.2017.10.017
Kurtto A., Uotila P., Sennikov A. 2009. Alchemilla in Mediterranean Europe as revealed by Atlas Florae Europaeae.
Bocconea 23: 221-235.
Levin D. A. 2000. The Origin, Expansion, and Demise of Plant Species. New York-London: Oxford University
Li H., Tsuchimoto S., Harada K., Yamasaki M., Sakai H., Wada N., Alipour A., Sasai T., Tsunekawa A., Tsujkumoto
H., Ando T., Tomemori H., Sato S., Hirakawa H., Quintero V., Zamarripa A., Santos P., Hegazy A., Ali A. M.,
Fukui K. 2017. Genetic tracing of Jatropha curcas L. from its Mesoamerican origin to the World. Frontiers
Manson D. C. M. 1984. Eriophyinae (Arachnida: Acari: Eriophyoidea). Fauna of New Zealand № 5. Wellington:
Department of Science and Industrial Research, 123 p.
Metkalfe D. J. 2005. Biological flora of the British Isles. Hedera helix L. Journal of Ecology (British Ecological
Society) 93 (3): 632-648.
Nalepa A. 1890. Zur Systematik der Gallmilben. Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften,
Mathematische-Naturwissenschaftliche Klasse 99 (2): 40-69.
Nalepa A. 1918. Neue Gallmilben, Fortsetzung 36. Anzeiger der Akademie der Wissenschaften Wien 55: 351-352.
Nalepa A. 1920. Die Phytoptocecidien von Tilia und ihre Erzeuger. Verhandlungen der Kaiserlich-Königlichen
Zoologisch-Botanischen Gesellschaft in Wien 70: 49-68.
Nyffeler R., Bayer C., Alverson W. S., Yen A., Whitlock B. A., Chase M. W., Baum D. A. 2005. Phylogenetic
analysis of the Malvadendrina clade (Malvaceae s. l.) based on plastid DNA sequences. Organisms Diversity
Paule J., Sharbel T. F., Dobeš C. 2011. Apomictic and sexual lineages of the Potentilla argentea L. group (Rosaceae):
Petanović R. 1988. Eriophidne grinje u Jugoslaviji. Beograd: Naucna knjiga, 159 p.
Pfeil B. E., Brubaker C. L., Craven L. A., Crisp M. D. 2002. Phylogeny of Hibiscus and the tribe Hibisceae
(Malvaceae) using chloroplast DNA sequences of ndhF and the rp116 intron. Systematic Botany 27 (2):
Pigg K. B., Wehr W. C., Ickert-Bond S. M. 2001. Trochodendron and Nordenskioldia (Trochodendraceae) from the
middle Eocene of Washington State, USA. International Journal of Plant Sciences 162 (5): 1187-1198.
Sidorchuk E. A., Schmidt A. R., Ragazzi E., Roghi G., Lindquist E. 2015. Plant-feeding mite diversity in Triassic
Redzic S. 1994. Morphological variability, ecological, chorologic and phenological characteristics of the populations
of the species Potentilla tommasiana F. W. Schultz in Bosnia and Herzegovina. Studia Botánica 12: 219-235.
Soika G., Kozak M. 2011. Problems with the taxonomy of Phytoptus tetratrichus Nalepa 1890 (Acari: Eriophyoidea
inhabiting Tilia spp.: Analysis based on morphological variation among individuals. Zootaxa 2988: 37-52.
Shevchenko V. G., Bagnyuk I. G., Sukhareva S. I. 1991. A new family of Pentasetacidae (Acariformes, Tetrapodili)
and its role in treatment of the origin and evolution of the group. Zoologicheskii Zhurnal 70 (5): 47-53.
Staudt G. 1989. The species of Fragaria, their taxonomy and geographical distribution. Acta Horticultura 265:
23-34.
MOBOT/research/APweb/
Sukhareva S. I. 1994. Family Phytoptidae Murray, 1877 (Acari: Tetrapodili), its consisting, structure and suggested
ways of evolution. Acarina 2 (1-2): 47-72.
719
Svenning J. C., Normand S., Kageyama M. 2008. Glacial refugia of temperate trees in Europe: insights from species
Tang Y., Zhuge R. 1996. Geographical distribution of Tilia Linn. Acta Phytotaxonomica Sinica 34 (3): 254-264.
Topel M., Antonelli A., Yesson C., Eriksen B. 2012. Past climate change and plant evolution in Western North
van Hinsbergen D. J. J., Edwards D. J. J., Govers R. (Eds) 2009. Collision and Collapse at the Africa-Arabia-
Eurasia Subduction Zone. London: Geological Society, special publication 311. 369 p.
Yembaturova E. Y., van Wyk B. E., Tilney P. M. 2009. A review of the genus Curtisia (Curtisiaceae). Bothalia 39
Zhou L., Su Y. C., Thomas D. C., Saunders R. M. 2012. ‘Out-of-Africa’ dispersal of tropical floras during the
Miocene climatic optimum: evidence from Uvaria (Annonaceae). Journal of Biogeography 39 (2): 322-335.
ADAPTIVE RADIATION OF THE FOUR-LEGGED MITES
(ACARIFORMES, ERIOPHYOIDEA) ON DICOTYLEDONS:
HOST-PARASITE RELATIONSHIPS AND ABILITY
OF INDUCING GALLOGENESIS
S. I. Sukhareva, F. E. Chetverikov
Key words: eriophyoids, dicotyledons, galls, Rosaceae, Betulaceae
SUMMARY
Mites of this family Phytoptidae (Acariformes, Eriophyoidea) are represented on dicotyledons by
31 species of two subfamilies: Phytoptinae (1 genus, 19 species) and Sierraphytoptinae (7 genera,
12 species). Most phytoptid species that are capable for inducing various growth abnormalities on
plants (galls, felt, bud growth, and other injuries) belong to the subfamily Phytoptinae. The analysis of
quantitative traits has shown that no groups of phytoptid species associated with dicotyledons can be
identified based on currently available morphometrical characters. Correlation between ornamentation
of the prodorsal shield, presence/absence of tibial solenidion, and geographical distribution of
phytoptid mites is analyzed, and groups of phytoptine species with similar topography of the prodorsum
are discussed. An analysis of the host association of phytoptids from dicotyledons revealed no
cophylogenetic patterns. Additionally, many hosts of phytoptids are narrow-range endemics and relicts.
It has been suggested that phytoptids have originated in the Southern hemisphere or in the tropics. The
current classification of phytoptids is probably artificial; it does not reflect the phylogeny of this group
and needs a revision based on molecular phylogenetic methods.
720