ЭНТОМОЛОГИЧЕСКОЕ ОБОЗРЕНИЕ, 99, 4, 2020
УДК 595.7, 565.7
ДЛИННОХОБОТКОВЫЕ НАСЕКОМЫЕ-НЕКТАРОФАГИ
В ПАЛЕОНТОЛОГИЧЕСКОЙ ЛЕТОПИСИ
© 2020 г. А. В. Храмов,* А. С. Башкуев,** Е. Д. Лукашевич***
Палеонтологический институт им. А. А. Борисяка РАН
Профсоюзная ул., 123, Москва, 117647 Россия
*e-mail: a-hramov@yandex.ru, **e-mail fossilmec@gmail.com,
***e-mail elukashevich@hotmail.com
Поступила в редакцию 13.08.2020 г.
После доработки 31.10.2020 г.
Принята к публикации 31.10.2020 г.
В статье рассмотрены находки ископаемых насекомых с длинным хоботком или рострумом,
предназначенными для питания цветочным нектаром и опылительными каплями голосеменных.
Впервые подтверждено наличие хоботков у пермских скорпионниц, относящихся к семействам
Permochoristidae и Permotanyderidae, а также отмечено присутствие длиннохоботковых скорпи-
онниц Mesopsychidae в верхней юре Казахстана. Опубликована находка головы длиннохоботко-
вой мухи-нектарофага из нижнего мела Забайкалья. Выделены три этапа радиации длиннохо-
ботковых нектарофагов: палеозойская, мезозойская и кайнозойская. Первая из них была связана
с палеозойскими семенными папоротниками, вторая - с беннеттитовыми и другими мезозойски-
ми энтомофильными голосеменными, третья - с цветковыми растениями. Древнейшие длинно-
хоботковые нектарофаги известны из нижней перми Приуралья и относятся к сем. Protomerop-
idae (stem-Amphiesmenoptera). В палеозое опылительными каплями могли питаться также
длиннохоботковые скорпионницы сем. Permochoristidae. Начиная со средней юры, разнообразие
специализированных нектарофагов резко возрастает: насчитывается около 70 мезозойских ви-
дов с сохранившимися хоботками в составе 12 семейств из 3 отрядов (Neuroptera, Mecoptera и
Diptera). Показано, что по относительной и абсолютной длине хоботка мезозойские нектарофаги
делятся на 3 морфогруппы. В кайнозое ведущее место среди длиннохоботковых нектарофагов
занимают Hymenoptera и Lepidoptera, пришедшие на смену вымершим хоботковым Neuroptera и
Mecoptera, тогда как Diptera в целом сохраняют свои позиции. Обилие длиннохоботковых нек-
тарофагов, существовавших до появления цветков с глубоким околоцветником, доказывает, что
сложные опылительные системы складывались уже на базе голосеменных. Следовательно, эн-
томофилия не была ключевой инновацией цветковых растений и не может служить объяснением
их эволюционного успеха.
Ключевые слова: нектарофагия, энтомофилия, опыление, цветковые растения, опылительные
капли.
DOI: 10.31857/S0367144520040012
737
Введение
738
Основная часть
741
I. Protomeropidae («stem-Amphiesmenoptera»)
741
II. Mecoptera
743
II. Neuroptera
755
IV. Diptera
768
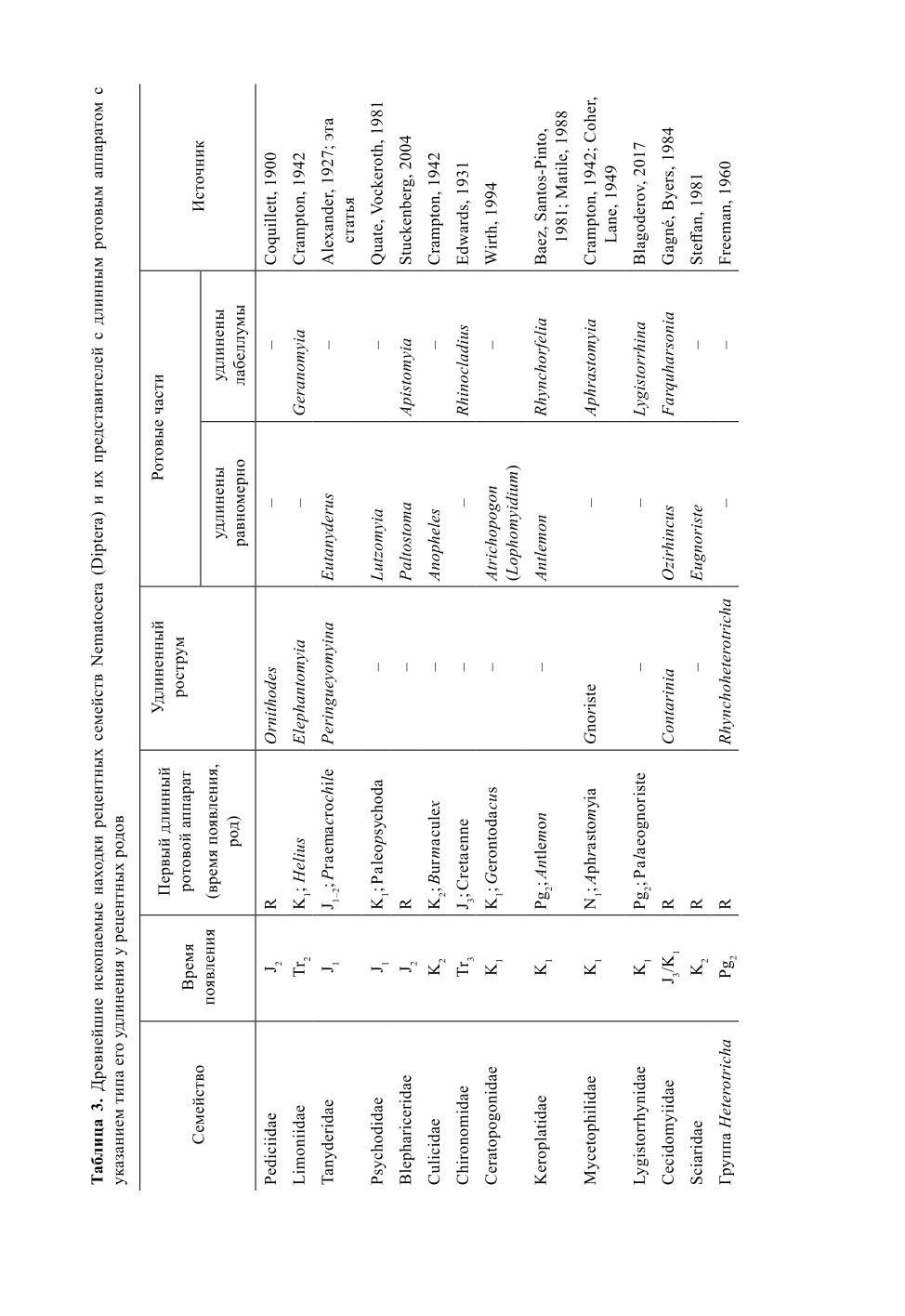
1) Nematocera
771
2) Brachycera
789
V. Lepidoptera
803
VI. Hymenoptera
806
Обсуждение
810
I. Три этапа радиации длиннохоботковых нектарофагов
810
II. Было ли насекомоопыление залогом успеха цветковых?
820
Список литературы
822
«Присутствие большого количества насекомых
с хоботками, приспособленными для высасы-
вания нектара, будет нам служить доказатель-
ством, что были растительные органы, приспо-
собленные для таких насекомых».
Проф. М. И. Голенкин (1927, с. 11).
ВВЕДЕНИЕ
Коэволюция растений и насекомых-опылителей со времен Дарвина служит пред-
метом пристального интереса ученых. Особое значение для ее понимания имеют па-
леонтологические свидетельства, которые относятся к ведению двух дисциплин - па-
леоботаники и палеоэнтомологии (Crepet,
1979). Первая ищет признаки
насекомоопыляемости главным образом в строении пыльцевых зерен и репродук-
тивных органов ископаемых растений, тогда как вторая работает с находками самих
предполагаемых насекомых-опылителей. Наиболее очевидное указание на взаимодей-
ствие древних насекомых с репродуктивными органами растений - пыльца, которую
находят в их кишечниках (Krassilov et al., 2007), а также на поверхности тела (Bao
et al., 2019). Древнейшие находки такого рода относятся к ранней перми (Расницын,
Красилов, 1996). Во всех остальных случаях выводы о питании древних насекомых на
стробилах и цветках, а также об их возможном участии в опылении, приходится де-
лать по косвенным данным, таким как морфологические признаки и систематическая
принадлежность этих насекомых.
При отсутствии других независимых свидетельств сама по себе принадлежность ис-
копаемых насекомых к антофильным семействам далеко не всегда может служить на-
дежным основанием для реконструкции их диеты. Даже если та или иная группа в на-
738
стоящее время тесно связана с цветами, это не означает, что ее представители вели
такой же образ жизни и в прошлом. Например, переходу к нектарофагии могло пред-
шествовать питание медвяной падью (Downes, Dahlem, 1987), а переходу к палино-
фагии - поедание грибных спор, а также спор папоротников и других споровых рас-
тений (Labandeira,
2000). С особой осторожностью принцип актуализма надо
использовать, если речь идет о насекомых палеозоя и большей части мезозоя, когда
экосистемы современного типа с преобладанием цветковых растений еще не сформи-
ровались.
В связи с этим при изучении ранних этапов эволюции насекомоопыления в первую
очередь следует ориентироваться на наличие у ископаемых насекомых характерных
адаптаций для питания пыльцой и нектаром. Одна из самых явных таких адаптаций -
это длинный хоботок, т. е. комплекс удлиненных ротовых частей с пищевым каналом
внутри, предназначенный для поглощения различных жидкостей, включая нектар.
Длинным здесь и далее мы будем считать любой хоботок, превосходящий по длине
(высоте) голову насекомого или равный ей. Некоторые двукрылые также используют
для нектарофагии рострум, то есть вытянутую часть головной капсулы с относительно
короткими ротовыми частями на конце. Находкам ископаемых насекомых с сохранив-
шимися длинными хоботками и рострумами, пригодными для извлечения трудно-
доступного нектара, и посвящен настоящий обзор.
Разумеется, не каждый длинный хоботок свидетельствует о нектарофагии. Прежде
всего, этот способ питания характерен для насекомых с сосущими (= сифонными,
siphonate) хоботками, лишенными жестких заостренных стилетов и других элементов,
пригодных для проделывания отверстий в растительных тканях или покровах жи-
вотных. По принципу работы такие хоботки традиционно делятся на лижущие
(lapping) (у пчел), губчатые (sponging) у двукрылых, собственно сосущие (у чешуе-
крылых) и т. д., но пока вынесем эти различия за скобки и будем называть сосущим
любой хоботок, лишенный функции прокалывания или проскребывания (последнее
характерно для цеце и мух-жигалок и осуществляется с помощью зубцов на лабел-
лумах).
Короткий сосущий хоботок, как у многих двукрылых и примитивных Glossata,
может использоваться для всасывания воды, медвяной пади, экстрафлоральных расти-
тельных выделений и других жидкостей, доступных с поверхности, однако у д л и -
нение сосущего хоботка практически всегда связано с необходимостью добираться
до труднодоступного нектара (Krenn et al., 2005). Иногда длинные хоботки сосущего
типа могут вторично приобретать иную специализацию и даже превращаться в ко-
лющие, как у совок, питающихся соком фруктов и кровью (Zenker et al., 2011), но от-
правной точкой эволюции таких хоботков все равно было питание нектаром, скрытым
в глубине цветов или стробилов. Таким образом, ископаемое насекомое с длинным
хоботком, явственно лишенным колющих стилетов и иных приспособлений для сквоз-
ного проникновения, по умолчанию должно рассматриваться как облигатный некта-
рофаг, если не доказано обратное.
Насекомые с колющими хоботками также могут практиковать нектарофагию, со-
вмещая ее с хищничеством или кровососанием, что типично для многих двукрылых
(см. далее). Однако по неясным причинам за пределами Holometabola колющие хо-
ботки двойного предназначения почти не встречаются. Практически полное отсут-
ствие факультативных нектарофагов среди Hemiptera, наиболее разнообразной группы
739
хоботковых Exopterygota, воистину «кажется удивительным» (Wardhaugh, 2015),
особенно если учесть, что конструкция колющего хоботка полужесткокрылых вполне
позволяет прибегать к нектарофагии как к дополнительной опции. Это доказывает
пример некоторых клопов-хищнецов, охотящихся на цветах и в случае недостатка до-
бычи потребляющих цветочный нектар (Yong, 2003). Чаще клопы питаются экс-
трафлоральным нектаром, при этом иногда даже участвуя в опылении (Ishida et al.,
2009; Portillo et al., 2012). Однако такие исключительные случаи не дают оснований
предполагать нектарофагию для ископаемых Hemiptera и остальных экзоптеригот
с длинным колющим хоботком, таких как палеодиктиоптероиды, предположительно
специализировавшиеся на прокалывании семязачатков палеозойских голосеменных
(Шаров, 1973).
В нашем обзоре насекомые-нектарофаги с длинными хоботками и рострумами, из-
вестные в ископаемом состоянии, будут рассмотрены поотрядно, в соответствии
с хронологическим порядком их появления в палеонтологической летописи. По-
скольку разброс по длине ротовых частей и их строению может быть очень суще-
ственным даже в пределах одного семейства, изолированные крылья и другие фраг-
ментарные находки часто непригодны для ответа на вопрос об отношении ископаемых
насекомых к нектарофагии. Основной упор поэтому будет сделан на находки специа-
лизированных нектарофагов с сохранившимся хоботком. Беглое упоминание таких на-
ходок можно найти в более ранних обзорах, посвященных эволюции насекомоопы-
ления (Grimaldi, 1999; Zherikhin, 2002; Labandeira, 2010). За прошедшее время они
успели значительно устареть, особенно учитывая то обилие хоботковых нектарофагов,
которые были описаны из бирманского янтаря в последние годы (Peñalver et al., 2015;
Lu et al., 2016a; Liu et al., 2018a; Khramov et al., 2019; Zhao et al., 2020).
Для краткости мы будем называть нектарофагами всех насекомых, питающихся или
питавшихся сладковатыми выделениями репродуктивных органов растений, но этот
термин не совсем точен. В строгом смысле слова цветочный нектар - это продукт нек-
тарников, т. е. специальных органов, которые у разных цветковых развиваются на ос-
нове различных частей цветка, таких как тычинки, плодолистики, лепестки или цвето-
ложе. Однако до появления цветковых длиннохоботковые насекомые, как считается,
питались опылительными каплями, выделявшимися на микропиле семязачатков,
скрытых в стробилах голосеменных (Labandeira et al., 2007). У анемофильных голосе-
менных опылительные капли предназначены для улавливания пролетающей пыльцы,
а у энтомофильных, таких как современные гнетовые, они выполняют ту же роль, что
и нектар покрытосеменных, т. е. привлекают опылителей (Von Aderkas et al., 2018).
Несмотря на похожий химический состав (раствор сахаров и аминокислот), опыли-
тельные капли голосеменных по происхождению отличаются от нектара, поскольку их
выделяет неспециализированная ткань нуцеллуса, у цветковых лишенная секреторной
активности (Nepi et al., 2009). Но из-за отсутствия специального термина для потреби-
телей опылительных капель нам приходится называть их нектарофагами.
Мы сознательно сосредоточились на находках нектарофагов со специализиро-
ванным ротовым аппаратом как на надежных реперных точках для реконструкции эво-
люционных взаимоотношений насекомых и растений. Но следует сразу подчеркнуть,
что ряды нектарофагов и опылителей отнюдь не исчерпываются хоботковыми насеко-
мыми. Трипсы с их ротовым конусом и многие насекомые с обычными грызущими
ротовыми частями, прежде всего жуки, а также перепончатокрылые, прямокрылые,
740
тараканообразные, уховертки и пр. питаются пыльцой и нектаром на цветках, уча-
ствуя в их опылении. В частности, жуки имеют большое значение для опыления ряда
современных цикадовых (Shneider et al., 2002), а также могли быть одними из клю-
чевых опылителей первых цветковых (Гринфельд, 1978). Но, как уже было сказано,
без прилипшей пыльцы ископаемые находки таких морфологически неспециализиро-
ванных антофилов не поддаются однозначной интерпретации, что снижает их цен-
ность для понимания эволюции насекомоопыления.
Наконец, необходимо оговориться, что морфологическая специализация в виде
длинного хоботка не всегда влечет за собой трофическую специализацию. Наоборот,
длиннохоботковые насекомые склонны к генерализму, поскольку длинный хоботок
дает им возможность посещать широкий спектр цветков, как с мелким, так и с глу-
боким околоцветником (Borell, 2005). Более того, длинный хоботок не делает из насе-
комого хорошего опылителя, а, как правило, имеет прямо противоположный эффект.
Если нектарофаги с короткими ротовыми частями вынуждены забираться в цветки, то
длиннохоботковые насекомые способны извлекать нектар на расстоянии, вообще не
контактируя с пыльцой. Такие нектарофаги, не участвующие в переносе пыльцы и тем
самым нарушающие принцип «нектар в обмен на опыление», в литературе называ-
ются нектарными ворами (nectar thieves) (не путать с нектарными грабителями (nectar
robbers), которые для похищения нектара «взламывают» цветок, например, проде-
лывая отверстия в лепестках) (Nicolson, 2007). Нектарные воры эксплуатируют уже
сложившиеся опылительные системы, похищая нектар у «законных» опылителей
(Bauder et al., 2015). Поэтому даже если некоторые ископаемые длиннохоботковые не-
ктарофаги в действительности были лишь нектарными ворами, сам факт их существо-
вания указывает на активную вовлеченность насекомых-опылителей в репродук-
тивную жизнь растений соответствующей эпохи.
ОСНОВНАЯ ЧАСТЬ
I. Protomeropidae («stem-Amphiesmenoptera»)
Древнейшие хоботковые насекомые-нектарофаги были найдены в раннепермском
местонахождении Чекарда (кунгурский ярус) и относятся к роду Marimerobius
Zalessky, 1946 из сем. Protomeropidae (Сукачева, 1976; Sukatsheva et al., 2007). Эти на-
секомые обладали сосущим хоботком длиной 1.5-2.5 мм, который был примерно в два
раза длиннее их головы и состоял из 5- или 4-члениковых щупиков, предположительно
максиллярных (Расницын, 1980: табл. III, рис. 8; Новокшонов, 1997а: рис. 31, a, б;
рис. 1). Сцепление между щупиками было непрочным, так что на некоторых отпе-
чатках Marimerobius они частично расходятся в стороны. Тем не менее, у большинства
экземляров Marimerobius с сохранившимися ротовыми частями щупики образуют
единое целое. Это позволяет исключить версию о том, что щупики Marimerobius скле-
ились посмертно случайным образом, а при жизни не были сцеплены и выполняли,
например, сенсорную функцию, как у имаго рецентных Trichoptera, для которых также
характерно значительное удлинение максиллярных щупиков. Уровень сохранности не
позволяет выяснить, была ли внутренняя поверхность щупиков Marimerobius во-
гнутой и образовывала ли она хорошо выраженный пищевой канал. Из-за отсутствия
запирающего механизма хоботка, необходимого для создания герметичности, всасы-
вание у Marimerobius, скорее всего, происходило не за счет работы мышечной помпы,
741
Рис. 1. Длиннохоботковые Marimerobius sp. (Protomeropidae) из нижней перми
местонахождения Чекарда (Россия, Приуралье).
1, 2 - ПИН 1700/2249; 3, 4 - ПИН 1700/2276, отпечаток (3) и противоотпечаток (4).
p - максиллярный или лабиальный щупик, pr - хоботок.
Масштабная линейка: 1, 3 - 2 мм; 2, 4 - 0.5 мм.
а за счет капиллярного эффекта, как у современных насекомых с хоботками аналогич-
ного строения (Houston, 1983; Wilhelmi, Krenn, 2012).
Хоботки, состоящие, как и у Marimerobius, из удлиненных максиллярных или лаби-
альных щупиков, многократно возникали у целого ряда перепончатокрылых: у неко-
торых пилильщиков сем. Pergidae (Houston, 1983), пчел сем. Colletidae (Laroca et al.,
1989), у наездников семейств Braconidae и Ichneumonidae (Jervis, 1998). Хоботок, обра-
зованный максиллярными щупиками, есть также у антофильных жуков Leptopalpus
Guérin de Méneville, 1844 (Meloidae) (Wilhelmi, Krenn, 2012). У всех этих насекомых
щупиковый хоботок используется для высасывания труднодоступного нектара - для
кровососания, энтомофагии или прокалывания растительных тканей он очевидно не
742
пригоден, поскольку лишен колющих элементов. Кроме того, наличие сочленений
между члениками щупиков лишает такой хоботок монолитности, необходимой для
внедрения в плотный субстрат. На этом основании можно с уверенностью заключить,
что Marimerobius высасывал с помощью хоботка сладковатые выделения генера-
тивных органов голосеменных растений. Примечательно, что пельтаспермовые, де-
монстрирующие признаки энтомофильности, были найдены в том же местонахож-
дении Чекарда (Naugolnykh, Oskolski, 2010). Всего оттуда известно около десятка
экземпляров Marimerobius с сохранившимся хоботком, что свидетельствует об их зна-
чительной численности в тогдашней экосистеме.
Систематическое положение сем. Protomeropidae остается не вполне ясным - в жил-
ковании крыльев его представители сочетают признаки отрядов Neuroptera, Mecoptera
и Trichoptera. Примечательно, что некоторые протомеропиды, включая Marimerobius,
изначально описывались в качестве Neuroptera (Zalessky, 1946; Sukatsheva et al., 2007).
Наличие анальной петли в передних крыльях протомеропид рассматривается как се-
рьезный аргумент в пользу их принадлежности к Trichoptera (Сукачева, 1976). Прото-
меропиды были довольно разнообразны и широко распространены: из пермских отло-
жений Евразии, Австралии и Южной Африки описано 7 родов и 14 видов (Sukatsheva
et al., 2007). Монотипический род протомеропид описан из среднего карбона Франции,
что является древнейшей находкой этого семейства и одновременно одной из древ-
нейших находок Holometabola (Nel et al., 2007). Самые поздние находки протомеропид
приходятся на позднюю пермь (Sukatsheva et al., 2007). Кроме Marimerobius, все
остальные протомеропиды известны только по изолированным крыльям, так что
о строении их ротовых частей ничего сказать нельзя.
Хоботковое насекомое из Чекарды (Labandeira, 2010: fig. 3), определенное К. Лабан-
дейрой как сетчатокрылое “Tschekardithonopsis ?oblivius” (sic) Vilesov, 1995 (Permithon-
idae), судя по жилкованию крыльев и строению тела, в действительности относится к
Protomeropidae. Несмотря на обилие в Чекарде настоящих сетчатокрылых с сохранив-
шимся телом, ни у одного из них хоботок обнаружить не удалось.
II. Mecoptera
Скорпионницы (Mecoptera) - небольшой отряд насекомых, насчитывающий чуть
более 700 ныне живущих видов в 9 семействах (Bicha, 2018), половина из которых
имеет ярко выраженный реликтовый характер. Богатая палеонтологическая летопись
скорпионниц показывает, что их современный семейственный состав в целом сформи-
ровался еще в мезозое и представляет лишь малую часть былого разнообразия.
Однако, говоря об ископаемых, следует помнить, что представления неонтологов и па-
леонтологов об объеме отряда очень сильно различаются, тогда как выбранная класси-
фикация непосредственно определяет все дальнейшие рассуждения об эволюции ро-
тового аппарата в этой группе.
Отряд Mecoptera включает монофилетический подотряд Pistillifera, к которому от-
носится большинство рецентных семейств, а также филогенетически обособленные
Nannomecoptera (Nannochoristidae) и Neomecoptera (Boreidae), которые в последние
годы принято выделять в самостоятельные отряды (Beutel, Friedrich, 2019). В то же
время, при традиционном для палеонтологов некладистическом (эволюционном) под-
ходе отряд Mecoptera понимается значительно шире (Novokshonov, 2002) и включает
помимо этих трех подотрядов целый ряд предковых групп. Так, включение в состав
743
отряда пермохористид, составлявших основную массу палеозойских мекоптер и
давших начало как мезозойским предкам всех современных семейств, так и, по всей
видимости, отряду двукрылых, с неизбежностью делает мекоптер парафилетической
группой. В настоящей работе отряд Mecoptera принимается в полном объеме, т. е.
включая Nannomecoptera, Aneuretopsychina, а также Permochoristidae и другие перм-
ские и триасовые семейства, не отнесенные к конкретным подотрядам. Для Mecoptera
в узком смысле, т. е. подотряда Pistillifera (по: Willmann, 1989), который в целом соот-
ветствует надсем. Panorpoidea в системе Новокшонова (Novokshonov, 2002) (но с до-
бавлением бореид), мы условно будем использовать название «панорпоиды», относя к
ним также некоторые базальные ископаемые таксоны, такие как Parachoristidae.
Большинство современных скорпионниц - сапрофаги (Panorpidae, Apteropanorpidae,
Choristidae, Eomeropidae, Meropeidae) или хищники (Bittacidae), реже филлофаги
(Panorpodidae), включая бриофагов (Boreidae) (Palmer, 2010). Для первых характерно
питание преимущественно мертвыми насекомыми и другими членистоногими, но на-
ряду с этим могут потребляться и другие ресурсы: мякоть плодов, лепестки, нектар и,
возможно, пыльца (обыкновенную панорпу часто можно видеть кормящейся на
цветках), медвяная падь, экскременты птиц и т. д. Во всех случаях поглощается лишь
жидкая фракция, будь то частично переваренные мягкие ткани, растительные соки и
прочие субстанции. Режущие мандибулы служат для прогрызания твердых покровов
или измельчения кусочков листьев. Такой тип питания, по-видимому, был характерен
и для большинства мезозойских и кайнозойских панорпоидных скорпионниц из подо-
тряда Pistillifera.
Интересно, что среди мекоптер, в отличие от сетчатокрылых, отсутствуют специа-
лизированные палинофаги. Будучи в целом полифагами, многие скорпионницы могут
потреблять пыльцу, особенно в отсутствие других источников пищи, но в общем
случае она составляет лишь небольшую долю в их рационе. Пыльца указывалась как
основная диета имаго Panorpodes paradoxa (Panorpodidae) в горных районах Цен-
тральной Японии (Iwasaki, 1987), однако если это и так, то, по-видимому, лишь как
единичный случай, не характерный для всего семейства. Морфология ротового аппа-
рата, больше приспособленного к высасыванию растительных соков, и прямые лабо-
раторные наблюдения над китайскими видами Panorpodes показывают, что по способу
питания они не отличаются от листоядных Brachypanorpa (Ma et al., 2013). Неиз-
вестны достоверные примеры палинофагии и среди ископаемых скорпионниц, хотя
в литературе можно встретить мнение о том, что в палеозое и мезозое многие
мекоптеры питались пыльцой (Beattie, 2007).
Среди насекомых с полным превращением современные скорпионницы по стро-
ению ротового аппарата считаются одними из наименее специализированных. За ис-
ключением самого базального сем. Nannochoristidae, ротовой аппарат скорпионниц -
грызущий с сохранением всех основных элементов, как правило, расположенных на
конце более или менее вытянутого рострума, или «клюва». Иногда наличие рострума
сочетается со значительным удлинением ротовых частей, как у хищных Bittacidae с их
вытянутыми мандибулами, напоминающими лезвия ножниц (Ma et al., 2014). Хорошо
развитый рострум, мало отличающийся от такового у современных скорпионниц, по-
является в среднем-позднем триасе у ранних панорпоморф сем. Parachoristidae (Но-
вокшонов, 1997). Однако древнейшие мекоптеры с сохранившимися телами, ранне- и
среднепермские Permochoristidae и Permopanorpidae, отличались еще не модифициро-
744
ванной головной капсулой без рострума и короткими грызущими ротовыми частями
(Новокшонов, 1994, 1997а).
Наннохористиды же по строению ротовых частей во многом сходны с двукрылыми:
у них редуцирована одна из частей максиллы (галеа), лабрум и эпифаринкс образуют
пищевой канал, хорошо развит лабиум, особенно лабиальные щупики. Мандибулы
при этом сохраняются, но не функционируют из-за утраты соответствующей мускула-
туры. Строение ротовых частей наннохористы предполагает питание жидкостью, ве-
роятнее всего, нектаром (Beutel, Baum, 2008), хотя прямых наблюдений на этот счет
нет.
В позднем палеозое и в мезозое существовали хоботковые скорпионницы с совер-
шенно иными типами питания и строением ротовых частей, не имеющим ничего об-
щего ни с классическим панорпоидным «клювом», ни с сосущим ротовым аппаратом
наннохористид. Ископаемые находки скорпионниц с сохранившимися хоботками
(табл. 1) распадаются на две временные когорты: позднепермскую и мезозойскую.
Первая представлена семействами Nedubroviidae, Permotanyderidae и Permochoristidae,
вторая - семействами Aneuretopsychidae, Pseudopolycentropodidae и Mesopsychidae,
объединяемыми в отдельный подотряд Aneuretopsychina (= Mesopsychoidea). Не ис-
ключено, что в дальнейшем к мезозойской когорте могут добавиться и некоторые
другие «непанорпоидные» мекоптеры, у которых хоботок пока не найден, такие как
Choristopsychidae и Liassophilidae.
По своему составу позднепермская и мезозойская когорты не равны. Находки позд-
непермских скорпионниц с хоботками единичны, тогда как мезозойские аневретопси-
хиновые хоботковые скорпионницы, напротив, очень обильны и разнообразны. Стоит
подчеркнуть, что хотя аневретопсихиновые с сохранившимися хоботками практи-
чески одновременно появились в палеонтологической летописи во второй половине
юры, сами эти семейства существовали и ранее, но о строении ротовых частей у их
представителей ничего неизвестно. Древнейшие находки Pseudopolycentropodidae
происходят из среднего триаса Франции и Германии (Papier et al., 1996; Bashkuev et al.,
2012), а самые первые Mesopsychidae, а также вероятные базальные Aneuretopsychidae
найдены в северодвинских отложениях России - вместе с первыми недубровиидами и
пермотанидеридами (Bashkuev, 2011a, 2011b, 2016; Aristov et al., 2013. Это означает,
что основная диверсификация аневретопсихиновых семейств началась не позднее на-
чала верхней или даже конца средней перми.
Далее мы рассмотрим ротовые части всех 6 семейств хоботковых скорпионниц, сна-
чала из позднепермской, затем - из мезозойской когорты.
Permochoristidae - это обширная и со всей очевидностью парафилетическая группа,
ключевая для эволюции всего отряда, которая, как считается, дала начало всем
крупным таксонам мезо-кайнозойских скорпионниц. Древнейшие пермохористиды
известны из ранней перми США и Бразилии (Carpenter, 1930; Pinto, 1972). Как уже
было сказано, грызущий ротовой аппарат ранне- и среднепермских представителей
еще оставался немодифицированным. Расцвет и диверсификация пермохористид при-
ходятся на позднюю пермь. По всей видимости, именно тогда в одной или нескольких
группах внутри семейства возникает сосущий ротовой аппарат, унаследованный нан-
нохористидами, аневретопсихиновыми и двукрылыми.
745
Тем не менее, о ротовом аппарате позднепермских (как и триасовых) скорпионниц
известно немного. Несмотря на обилие местонахождений, находки с сохранившейся
головой исключительно редки: нам известны лишь три таких экземпляра, и у всех
есть хоботок. Один из этих экземпляров (два другие относятся к Nedubroviidae и
Permotanyderidae, см. далее) - изученная нами пермохористида из пермо-триасового
рода Prochoristella Riek, 1953, найденная в верхней перми Бельмонта (рис. 2, 5, 6).
В ее хоботке, немного превышающем по длине голову, различимы как минимум три
жестких стилетовидных элемента (один из них, возможно, лабрум), свободные на
конце, если не по всей длине, т. е. не образующие единой трубки. Такой хоботок мог
служить как для высасывания нектароподобных выделений из генеративных органов
каких-либо голосеменных, так и для прокалывания чего-либо, например, покровов на-
секомых или пыльцевых зерен. Информация о каких-либо других находках хобот-
ковых пермохористид отсутствует.
Nedubroviidae и Permotanyderidae. В отличие от пермохористид, которые просу-
ществовали до средней юры (Новокшонов, 1997б), два родственных семейства хобот-
ковых скорпионниц, недубровииды и пермотанидериды, последнее из которых долгое
время считалось близким к предкам двукрылых, известны только из верхней перми и
не переступают границу перми и триаса (Bashkuev, 2013). Найдено лишь по одному
экземпляру недубровиид и пермотанидерид с сохранившимся хоботком. Первый - не-
дубровиида из северодвинских отложений европейской России, Nedubrovia
shcherbakovi Bashkuev, 2011, очень мелкое насекомое с коротким хоботком длиной
около 0.35 мм (рис. 2, 3, 4). Первоначально хоботок этого вида был описан как
сплошная трубка с пищевым каналом, однако такая интерпретация основана лишь на
аналогии с мезозойскими длиннохоботковыми скорпионницами. Во-вторых, очень по-
хожий хоботок был обнаружен нами при переизучении одного из экземпляров пермо-
танидериды Choristotanyderus nanus Riek, 1953 из верхней перми Австралии (Бель-
монт) (рис. 2, 1, 2). К сожалению, мелкие размеры обоих экземпляров и сохранность
отпечатков не дают возможности надежно идентифицировать отдельные структуры
хоботка, так что об их функции остается только догадываться.
Pseudopolycentropodidae. Это небольшое семейство включает две габитуально не-
похожие, но все же близкородственные группы, которые, возможно, стоило бы рассма-
тривать в ранге подсемейств. К первой из этих групп относятся известные только по
отпечаткам триасово-юрские псевдополицентроподиды (рис. 3, 1-3), а ко второй - два
близких рода из мелового бирманского янтаря, Parapolycentropus Grimaldi et Rasnitsyn,
2005 и Dualula Lin et al., 2019 (рис. 3, 4-6), а также неописанное крыло из нижнего
мела Англии (Coram, Jepson, 2012).
Несмотря на значительное сходство в схеме жилкования крыльев, строении хоботка
и общей тенденции к редукции задних крыльев, эти группы производят впечатление
совершенно разных насекомых. Если первая включает бабочкоподобных насекомых с
широкими треугольными передними крыльями и уменьшенными задними, то вторая -
это грацильные, длиннокрылые двойники комаров с полностью утраченной задней
парой крыльев.
Первая группа насчитывает 12 видов в 3 родах (Grimaldi et al., 2005; Lin et al., 2019),
из них 10 видов относятся к типовому роду Pseudopolycentropus Handlirsch, 1906, ко-
торый был известен из юрских местонахождений Европы и Средней Азии еще с конца
XIX в., но большей частью лишь по изолированным крыльям или малоинформа-
748
Рис. 2. Пермские длиннохоботковые Mecoptera, общий вид и ротовые части.
1, 2 - Choristotanyderus nanus Riek, 1953 (Permotanyderidae), BMNHP 45444; фото В. А. Благодерова;
3, 4 - Nedubrovia shcherbakovi Bashkuev, 2011 (Nedubroviidae), голотип ПИН 3840/1337 (отображен
зеркально); 5, 6 - Prochoristella sp. (Permochoristidae), BMNHP 45417.
Масштабная линейка: 1, 5 - 2 мм; 2, 4, 6 - 0.5 мм; 3 - 1 мм.
749
Рис. 3. Мезозойские длиннохоботковые Pseudopolycentropodidae (Mecoptera).
1 - Pseudopolycentropus daohugouensis Zhang, 2005, Даохугоу, средняя юра, голотип DHG 200301; фото
А. П. Расницына; 2, 3 - Ps. latipennis Martynov, 1927, Каратау, верхняя юра, ПИН 2066/1290 (отпечаток и
противоотпечаток); 4, 5 - Parapolycentropus paraburmiticus Grimaldi et Rasnitsyn, 2005, бирманский янтарь,
ПИН 5608/39; 6 - Dualula kachinensis Lin et al., 2019, бирманский янтарь, ПИН 5608/68.
an - антенна, ga - галеа, hy - гипофаринкс, lbr - лабрум, mp - максиллярный щупик, mt - ментум.
Масштабная линейка: 1 - 3 мм; 2 - 2 мм; 3, 5 - 0.5 мм; 4, 6 - 1 мм.
750
тивным остаткам тел плохой сохранности. В. Г. Новокшонов, переизучая дополни-
тельный экземпляр P. latipennis Martynov, 1927 из Каратау, впервые обнаружил у него
длинный прямой хоботок, хотя и не вполне ясного строения (Новокшонов, 1997б)
(рис. 3, 2, 3). Позднее многочисленные находки Pseudopolycentropodinae с сохранив-
шимися ротовыми частями были сделаны в средней юре Китая (Даохугоу) (Grimaldi
et al., 2005; Ren et al., 2009, 2010b; Shih et al., 2011), откуда описаны 3 вида Pseudo-
polycentropus (впрочем, различия между ними столь ничтожны, что речь, скорее,
может идти лишь об одном виде), а также монотипический род Sinopolycentropus Shih
et al., 2011.
Одновременно с находками в Даохугоу были описаны и первые псевдополицентро-
подиды из бирманского янтаря: Parapolycentropus burmiticus Grimaldi et Rasnitsyn,
2005 и P. paraburmiticus Grimaldi et Rasnitsyn, 2005 - двукрылые комароподобные на-
секомые с тонким «колющим» хоботком, состоящим из 3 стилетовидных элементов
(Grimaldi et al., 2005). Высказывались предположения о максиллярно-мандибулярной
(центральный стилет состоит из сдвоенных мандибул, боковые створки образованы из
лациний (Grimaldi et al., 2005)) или лабиальной природе хоботка (стилетообразный ла-
брум и пара лабиальных створок (Ren et al., 2009)). Впоследствии оказалось, что
P. paraburmiticus - один из самых массовых видов насекомых в бирманском янтаре
(рис. 3, 4, 5). Если первые описания были выполнены на основе 3 плохо сохранив-
шихся инклюзов, то сейчас, полтора десятилетия спустя, доступный материал исчис-
ляется сотнями экземпляров, а строение хоботка изучено досконально. Согласно
Д. Гримальди и Э. Джонстону (Grimaldi, Johnston, 2014), хоботок Parapolycentropus
состоит из двух внешних створок, гомологичных галеа и служащих чехлом для вну-
треннего зазубренного гипофарингеального стилета, на котором дорсально располага-
ется тонкий полуоткрытый пищевой канал. Эта интерпретация была существенно до-
работана после обнаружения очень близкого к Parapolycentropus, но более крупного и
редкого вида Dualula kachinensis Lin et al., 2019 (рис. 3, 6). Согласно новой рекон-
струкции, латеральные створки хоботка Dualula и Parapolycentropus, застегиваясь как
«молния», образовывали герметичную пищевую трубку, в вентральной части которой
находился гипофаринкс со слюнным каналом. Сами галеа, по-видимому, были ли-
шены мускулатуры, и подвижность хоботка обеспечивалась за счет гипофаринкса. Во-
преки прежним реконструкциям, гипофаринкс едва ли мог выполнять колющую
функцию, а пильчатая насечка с вентральной стороны, вероятнее всего, служила для
сцепления с внутренней поверхностью пищевой трубки. Всасывание производилось
посредством цибариального насоса, маркированного небольшим вздутием под клипе-
усом. Подобная реконструкция хоботка и отсутствие каких-либо иных жестких сти-
летов, подходящих для прокалывания, делают маловероятными высказывавшиеся
ранее предположения о возможности хотя бы факультативного кровососания (Grimaldi
et al., 2005) или энтомофагии (Grimaldi, Johnston, 2014). Не вызывает сомнений, что
питание Parapolycentropus и Dualula было связано с генеративными органами рас-
тений, что косвенно подтверждается также присутствием пыльцевых зерен формаль-
ного рода Cycadopites вблизи хоботка у некоторых экземпляров P. paraburmiticus (Lin
et al., 2019). Существенная разница в длине хоботка (у Parapolycentropus 0.6-1.5 мм,
у Dualula 1.8-3.2 мм) свидетельствует о различной трофической специализации: более
крупные Dualula, вероятно, высасывали опылительные капли каких-то энтомо-
фильных голосеменных, в то время как более мелкие Parapolycentropus могли
питаться нектаром уже на мелких цветках ранних покрытосеменных типа Tropidogyne
751
Chambers et al., 2010, встречающихся в бирманском янтаре (Lin et al., 2019, Suppl.
Note 4).
Строение хоботка псевдополицентроподид первой группы долгое время оставалось
менее изученным, поскольку по сохранности каменный материал несопоставим с ян-
тарным и не позволяет обнаружить и идентифицировать отдельные ротовые части.
У большинства экземпляров хоботок сохранился в виде длинной (в 2-3 раза больше
длины головы) трубки, чаще всего сплошной, но в некоторых случаях разошедшейся
вдоль на 2 или 3 видимые продольные лопасти, интерпретированные как стилеты
(Новокшонов, 1997б; Grimaldi et al., 2005). Лишь недавно на отпечатках китайских
Pseudopolycentropodus было показано принципиальное сходство в строении створок
хоботка с Parapolycentropus и Dualula (Lin et al., 2019, Suppl. Note 3).
Aneuretopsychidae. Первая мезозойская группа скорпионниц, у которых найден хо-
боток, впервые была описана из мезозойских отложениий Каратау и Байсы (Расницын,
Козлов, 1990). Это крайне редкое и малоразнообразное семейство (всего 9 описанных
видов) демонстрирует совершенно иное направление морфологической эволюции: в
противоположность грацильным псевдополицентроподидам, это были крупные
(длина крыла до 30 мм), массивные цикадоподобные насекомые с широкими задними
крыльями с обширной складывающейся анальной областью (рис. 4). Хоботок аневре-
топсихид опистогнатный, достигает середины груди и представляет собой сплошную
гибкую трубку без стилетов, армированную по всей длине кольчатыми кутикуляр-
ными утолщениями и предположительно имеющую на конце пару мягких губчатых
образований - так называемых псевдолабеллумов (pseudolabellae), которые могли слу-
жить для первоначального капиллярного всасывания жидкости (рис. 4, 3). Щупики
либо полностью утрачены, либо настолько сильно редуцированы, что неразличимы на
отпечатках. Такая конструкция хоботка с очевидностью предполагает сильное упро-
щение и редукцию части элементов ротового аппарата. Предполагалось, что хоботок
аневретопсихид, так же как и других хоботковых скорпионниц, представляет собой
модифицированный лабиум (Ren et al. 2009; Labandeira, 2010). Ситуация прояснилась
лишь недавно, когда были открыты аневретопсихиды в бирманском янтаре (Zhao et al.,
2020). Описанный из него род Burmopsyche Zhao et al., 2020 имеет опистогнатный хо-
боток, по строению очень сходный с хоботком Parapolycentropus (и наверняка гомоло-
гичный ему): две створки (вероятно, галеа) образуют пищевую трубку, внутри которой
находится гибкий нитеобразный гипофаринкс (рис. 4, 4-6). Максиллярные щупики
рудиментарны и скорее всего не функциональны (на реконструкции на рис. 4, 6 изо-
бражены преувеличенными). Скорпионницы Burmopsyche намного крупнее, чем
Parapolycentropus и даже Dualula, длина их хоботка достигает 4 мм. Предполагалось,
что аневретопсихиды могли дополнять нектарофагию охотой на мелких насекомых
(Zhao et al., 2020), однако их хоботок еще менее пригоден для этого, чем хоботок
Parapolycentropus и Dualula; кроме того, у Burmopsyche отсутствуют какие-либо иные
адаптации к хищному образу жизни.
Mesopsychidae. Самое многочисленное и распространенное из 3 семейств мезозой-
ских хоботковых скорпионниц (рис. 5), при этом их расцвет приходится на триас,
почти все находки из которого представлены изолированными крыльями. Юрские и
меловые мезопсихиды более редки, но гораздо лучше изучены благодаря целым насе-
комым прекрасной сохранности в китайских местонахождениях Даохугоу и Исянь.
В отличие от аневретопсихид и псевдополицентроподид, чьи последние находки при-
752
Рис. 4. Длиннохоботковые Aneuretopsychidae (Mecoptera).
1 - Aneuretopsyche rostrata Rasnitsyn et Kozlov, 1990, Каратау, верхняя юра, голотип ПИН 2904/1198;
2, 3 - Jeholopsyche liaoningensis Ren, Shih et Labandeira, 2011, формация Исянь, нижний мел, голотип
CNU-M-LB-2005-002 (2 - общий вид, 3 - голова с хоботком; по: Ren et al., 2011 с изменениями);
4-6 - Burmopsyche bella Zhao et al., 2020, бирманский янтарь (4, 5 - паратип NIGP 166159;
фото С.-Д. Чжао; 6 - реконструкция ротовых частей, по: Zhao et al., 2020 с изменениями).
plb - псевдолабеллум, sd - слюнной канал; остальные обозначения как на рис. 3.
Масштабная линейка: 1 - 5 мм; 2 - 10 мм; 4 - 2 мм; 5 - 1 мм; для 3 отсутствует.
753
Рис. 5. Длиннохоботковые Mesopsychidae (Mecoptera) из верхней юры Каратау.
1, 2 - Lichnomesopsyche sp., ПИН 2997/4185; 3, 4 - Mesopsychidae gen. sp., ПИН 2239/1807;
5 - реконструкция ротовых частей Lichnomesopsyche (по: Ren et al., 2009, с изменениями).
leg - передние бедро и голень, остальные обозначения как на рис. 1-4.
Масштабная линейка: 1 - 10 мм; 2 - 1 мм; 3 - 2 мм; 4 - 0.5 мм; для 5 отсутствует.
754
ходятся на бирманский янтарь, мезопсихиды до сих пор неизвестны из бирмита, как и
из какого-либо другого янтаря, а самые поздние представители этого семейства проис-
ходят из раннего мела Исяня и Байсы (Lin et al., 2016).
Хоботок мезопсихид прогнатный и самый длинный среди скорпионниц: у неко-
торых юрских видов рода Lichnomesopsyche Ren et al., 2010 его длина достигает
10-11 мм, составляя до половины длины тела (рис. 5, 1, 2). Хоботок снаружи густо
покрыт направленными вперед, не собранными в кольца микротрихиями и лишен
кольцевых кутикулярных утолщений, что, возможно, связано с отказом от молние-
образного механизма сцепления створок, развитого в других семействах, для обеспе-
чения большей жесткости. Почти у всех сохранившихся экземпляров хоботок
цельный, лишь в одном случае (Ren et al., 2009: fig. 1, P, Q) он разошелся продольно на
3 лопасти, возможно, из-за посмертного разложения.
Общая черта в строении ротовых частей всех аневретопсихиновых скорпионниц
«мезозойской тройки» - частичная или полная утрата целого ряда структур: лабиума,
включая лабиальные щупики, лациний и, вероятно, мандибул; в некоторых случаях
сильно редуцированы лабрум и максиллярные щупики. Несмотря на бросающиеся в
глаза внешние различия между всеми 3 семействами, структурно и функционально их
хоботки достаточно сходны. Пока неясно, был ли хоботок унаследован от общего
предка (вероятно, еще в поздней перми) или же сформировался в каждой группе неза-
висимо. В пользу второй гипотезы может свидетельствовать находка юрской мезопси-
хиды, не имевшей длинного хоботка, - Epicharmesopsyche pentavenulosa Shih et al.,
2013, - однако этот род по целому ряду признаков сильно отличается от всех остальных
представителей семейства и, возможно, не относится к мезопсихидам. Кроме того, не
исключена и возможность вторичной утраты хоботка.
III. Neuroptera
Сетчатокрылые (Neuroptera) - небольшой отряд насекомых с полным превраще-
нием, существующий, как и скорпионницы, с ранней перми и в настоящее время на-
считывающий около 6000 видов в составе 14 семейств. В строении ротовых частей
между личинками и имаго современных сетчатокрылых наблюдается резкий контраст.
У личинок имеется ротовой аппарат уникальной конструкции, основу которого со-
ставляют две сосательные трубочки, образованные попарно соединенными мандибу-
лами и максиллами. Такое устройство личиночных ротовых частей считается важ-
нейшей апоморфией отряда (Zimmermann et al.,
2019). Напротив, для имаго
современных сетчатокрылых, большинство из которых составляют хищники или все-
ядные, характерен грызущий ротовой аппарат без ярко выраженных специализаций.
Это можно сказать и о тех имаго, которые питаются преимущественно или исключи-
тельно на цветах - такой тип питания отмечается для некоторых видов Berothidae и
Myrmeleontidae, златоглазок подсем. Nothochrysinae, а также нитекрылок (Nemopter-
idae). Эти сетчатокрылые поедают главным образом пыльцу, в некоторых случаях в их
рацион входит также нектар (Devetak, Klokočovnik, 2016). У нитекрылок, которые де-
монстрируют наибольшее число адаптаций к палинофагии, удлинены максиллы, уча-
ствующие в сборе пыльцы, а мандибулы утратили грызущую функцию и использу-
ются для удаления пыльцевой массы, прилипшей к другим ротовым частям. Тем не
менее, даже у нитекрылок не утрачен ни один из элементов, характерных для стан-
дартного грызущего ротового аппарата (Krenn et al., 2008).
755
В противоположность современным видам, на мезозойском этапе эволюции сетча-
токрылые, как и скорпионницы (см. выше), были куда менее консервативны в стро-
ении ротовых частей имаго. Судя по палеонтологическим данным, как минимум
4 группы мезозойских сетчатокрылых отказались от грызущего ротового аппарата в
пользу хоботка сосущего типа с полностью редуцированными мандибулами (табл. 2).
К таким вымершим хоботковым группам относятся, во-первых, семейства
Kalligrammatidae и Aetheogrammatidae, и, во-вторых, подсемейства Cretanallachiinae и
Paradoxosisyrinae, второе из которых входит в состав современного сем. Sisyridae,
тогда как семейственная принадлежность первого дискуссионна. В противополож-
ность каллиграмматидам и этеограмматидам, известным исключительно в виде ка-
менных отпечатков, кретаналлахины и парадоксосизирины найдены только в янтаре,
причем исключительно в бирманском - в других меловых янтарях они отсутствуют.
Рассмотрим все эти 4 группы в вышеобозначенном порядке.
Kalligrammatidae - самая разнообразная и наиболее широко распространенная
группа хоботковых сетчатокрылых. Представителей каллиграмматид иногда называют
«мезозойскими бабочками» за внешнее сходство с дневными чешуекрылыми, которое
проявляется в форме крыльев, наличии глазчатых пятен и хоботка (Labandeira et al.,
2016). Известно около 50 видов каллиграмматид в составе 18 родов, которые описыва-
лись из мезозойских отложений Германии, Англии, российского Забайкалья, Китая,
Казахстана и Бразилии (Liu et al., 2015; Bechly, Makarkin, 2016; Labandeira et al., 2016,
Suppl. Mat.; Ansorge, Makarkin, 2020). Каллиграмматиды были также найдены в
нижнем мелу Монголии, Испании и Южной Кореи. Древнейшие находки семейства
были сделаны в нижней юре Германии (Ansorge, Makarkin, 2020). Последние по воз-
расту и одновременно самые крупные каллиграмматиды (длина переднего крыла
14-16 см) найдены в бразильской формации Крато (ранний мел, апт) (Bechly, Makarkin,
2016). Другие каллиграмматиды также характеризуются крупными размерами, их
крылья имели в длину в среднем 5-10 см.
Первую каллиграмматиду, Kalligramma haeckeli Walther, 1904 из верхнеюрских золь-
нхофенских известняков Южной Германии (титонский ярус) описал немецкий геолог
и палеонтолог Иоганнес Вальтер, сразу же опознав в ней представителя неуроптеро-
идов (Walther, 1904). Два года спустя австрийский палеэнтомолог Антон Гандлирш
выделил каллиграмматид в отдельное семейство в составе отряда Neuroptera, и он же
описал, также из Зольнхофена, еще
3 монотипических рода этих насекомых
(Handlirsch, 1906-1908; Handlirsch, 1919). Однако ни у одной из зольнхофенских кал-
лиграмматид голова не сохранилась. Впервые изучить строение ротовых частей у
представителей этого семейства стало возможным после того, как в верхнеюрском ме-
стонахождении Каратау (Южный Казахстан) в 1966 г. была найдена практически целая
каллиграмматида, лежащая на боку со сложенными крыльями (рис. 6, 1, 3). Изобра-
жения этой каллиграмматиды были опубликованы Панфиловым (1980), который отнес
ее к зольнхофенскому роду Meioneurites Handlirsch, 1906 без указания видовой при-
надлежности; позднее она была описана как Meioneurites spectabilis Engel, 2005.
На отпечатке M. spectabilis хорошо видны густо опушенные щупики, которые по
длине чуть превышают голову. Согласно одной из точек зрения, у M. spectabilis при-
сутствует лишь пара максиллярных щупиков, которые наложены на другие ротовые
части, образовывавшие хоботок (Labandeira et al., 2016, Suppl.: fig. 1, l). Согласно
другой интерпретации, которая представляется нам верной, у M. spectabilis имелись
756
Рис. 6. Юрские длиннохоботковые Kalligrammatidae (Neuroptera), общий вид (1, 2)
и ротовые части (3, 4).
1, 3 - Meioneurites spectabilis Engel, 2005, Каратау, верхняя юра; 2, 4 - ?Kalligramma sp., Даохугоу,
средняя юра, NIGP 164470.
ant - антенна, lp - лабиальный щупик, mp - максиллярный щупик, остальные обозначения
как на рис. 1-3.
Масштабная линейка: 1, 2 - 10 мм; 3, 4 - 2 мм.
757
как максиллярные, так и лабиальные щупики (Engel, 2005: fig. 2) - переизучение эк-
земпляра показало, что на нем различимы концы как минимум 3 наложенных друг на
друга щупиков. А. П. Расницын предполагал, что щупики, складываясь, образовывали
у M. spectabilis «подобие хоботка» (Расницын, 1980, с. 38). В. Н. Макаркин (2016)
также считает, что хоботок Meioneurites был «щупиковым». В таком случае всасы-
вание сладковатых выделений у M. spectabilis должно было происходить за счет ка-
пиллярного эффекта, создававшегося благодаря многочисленным волоскам на щу-
пиках. Хоботок похожей конструкции, образованный двумя парами щупиков и
предназначенный для извлечения нектара, есть у рецентной бракониды Agathis
longipalpus (Cresson, 1865). Примечательно, что по относительной длине хоботок у
этого наездника значительно превосходит хоботок M. spectabilis, будучи в 4.4 раза
длиннее головы у самок и в 2.3 раза - у самцов (Jervis, 1998).
За исключением M. spectabilis из Каратау, все остальные каллиграмматиды с сохра-
нившимися ротовыми частями были найдены в мезозойских отложениях Китая - в
среднеюрских слоях Даохугоу и нижнемеловой формации Исянь. Впервые их изобра-
жения появились в работе К. Лабандейры (Labandeira, 2010), где фигурируют две кал-
лиграмматиды с хоботком - одна в виде небольшого рисунка (fig. 2.2), обозначенного
видовым названием «Heterokallihemerobius myrioneurus» без какого-либо описания и
привязки к местонахождению, так что данное название следует рассматривать как
nomen nudum, тогда как вторая каллиграмматида (там же: fig. 8), происходящая из
формации Исянь, осталась неназванной и впоследствии была описана как Oregramma
aureolosa Yang et al., 2014. В этой же работе К. Лабандейра высказал предположение,
что хоботок каллиграмматид был устроен так же, как и хоботок чешуекрылых, так что
его сосущая часть была образована двумя удлиненными галеа.
Всего к настоящему моменту было описано 4 вида каллиграмматид с сохранивши-
мися хоботками из формации Исянь, и еще 5 - из Даохугоу (см. табл. 2). Кроме того,
известно еще по меньшей мере 7 экземпляров хоботковых каллиграмматид, не опреде-
ленных до вида (Labandeira, Currano, 2013: fig. 6f; Yang et al., 2014: figs. 6, 9, 12, 15; Liu
et al., 2018a, Suppl.: fig. 10; рис. 6, 2, 4; 7, 1, 2). Но хоботки были не у всех представи-
телей семейства, доказательством чему служит раннемеловой род Sophogramma Ren et
Guo, 1996. В формации Исянь было найдено как минимум 3 полностью сохранив-
шихся экземпляра, относящихся к этому роду (Yang et al., 2009; Yang et al., 2014:
fig. 16; Zhang, 2007: p. 106-107), но ни у одного из них нельзя заметить ни малейшего
следа наличия хоботка. Помимо этого, есть неописанный экземпляр Sophogramma,
также из Исяня, на котором различимы мандибулы и другие элементы грызущего ап-
парата без признаков какого-либо удлинения (В. Н. Макаркин, личное сообщение).
Подсем. Sophogrammatinae, включающее помимо Sophogramma также юрский род
Protokalligramma Yang et al., 2011, известный только по крыльям, считается самой
базальной группой каллиграмматид (Yang et al., 2014). Возможно, хоботков не было
также и у некоторых других базальных родов. В любом случае, при создании палеоэ-
кологических реконструкций надо соблюдать известную осторожность, анализируя
находки изолированных крыльев каллиграмматид, поскольку их обладатели отнюдь не
всегда могли обладать хоботками. С учетом Sophogramma, к настоящему времени
строение ротовых частей известно для 8 родов каллиграмматид из 17, из них 7 родов
были хоботоковыми (см. табл. 2).
760
Рис. 7. Длиннохоботковые Neuroptera из нижнего мела формации Исянь.
1, 2 - ?Oregramma sp. (Kalligrammatidae), STMN48-1614 (1 - общий вид, 2 - ротовые части);
3, 4 - Aetheogramma glycophila Khramov et Chen, 2010 (Aetheogrammatidae), STMN48-1621
(3 - общий вид, 4 - ротовые части; все фото Цз. Чэня).
?p - предположительно максиллярный или лабиальный щупик, ?s - стилетовидный элемент
неясной природы, остальные обозначения как на рис. 1-6.
Масштабная линейка: 1, 3 - 10 мм; 2 - 2 мм; 4 - 1 мм.
761
Ротовые части многих уже описанных видов каллиграмматид из Китая нуждаются в
переизучении, необходимо также привлечение нового материала. Тем не менее, уже
сейчас очевидно, что каллиграмматиды обладали двумя парами удлиненных ротовых
щупиков, а также как минимум одной парой стилетовидных структур (возможно,
галеа), приблизительно равных по длине щупикам (см. рис. 6, 2, 4; 7, 1, 2). Из-за нало-
женных друг на друга щупиков стилетовидные структуры не всегда хорошо видны.
Возможно, по этой же причине в хоботке Meioneurites spectabilis из Каратау неразли-
чимы какие-либо иные элементы помимо щупиков, но это не означает, что он действи-
тельно был чисто «щупиковым». Длина хоботка некоторых каллиграмматид состав-
ляла свыше 18 мм (Labandeira et al., 2016, Suppl. inf.), у отдельных видов хоботок по
длине почти в 3 раза превосходил голову, но в целом по сравнению с крупными кры-
льями и телом он был относительно коротким. В отличие от дневных бабочек, у кал-
лиграмматид за почти 70 млн лет эволюции так и не возник механизм скручивания
хоботка, что, возможно, препятствовало его удлинению.
Нектарофагия рассматривается как основной способ питания хоботковых калли-
грамматид (Labandeira et al., 2016). Недавно было высказано предположение, что кал-
лиграмматиды могли дополнять нектарофагию энтомофагией (Zhao et al., 2020), но, на
наш взгляд, оно не выдерживает критики. Такие бабочковидные и маломаневренные
насекомые, как каллиграмматиды, могли бы охотиться только на сидячую добычу в
виде тлей и других Sternorrhyncha, как это делают имаго современных сетчатокрылых,
в том числе крупные муравьиные львы (Devetak, Klokočovnik, 2016). Однако трудно
вообразить, каким образом каллиграмматиды прокалывали бы своим крупным хо-
ботком мелких равнокрылых - для поимки и поедания такой добычи гораздо больше
подходит обычный грызущий ротовой аппарат. Отсюда следует, что энтомофагию
могли практиковать лишь представители Sophogramma и других мандибулярных кал-
лиграмматид, но никак не хоботковые виды.
Aetheogrammatidae. В мезозойских местонахождениях Казахстана и Китая, из ко-
торых известны каллиграмматиды, встречаются также другие хоботковые сетчато-
крылые - этеограмматиды. Главным отличительным признаком данного семейства
служит строение апикальной части жилки Sc, которая несет ветви наподобие ветвей
Rs, тогда как число последних сокращено. Такая конфигурация Sc и Rs весьма нети-
пична для отряда Neuroptera в целом, однако в остальном, включая форму крыльев и
обилие поперечных жилок, этеограмматиды близки к каллиграмматидам и, скорее
всего, их следует рассматривать как сестринские семейства. В. Н. Макаркин (2016)
предполагает даже, что этеограмматиды могут быть всего лишь «специализированной
ветвью» каллиграмматид. Этеограмматиды значительно уступают каллиграмматидам
по числу находок, разнообразию и распространению. Известно всего 6 видов этео-
грамматид в составе 5 родов из средней юры Даохугоу, верхней юры Каратау и ниж-
него мела Исяня (Yang et al., 2015), за пределами Азии семейство не обнаружено. По
размерам этеограмматиды были сопоставимы с некрупными каллиграмматидами,
длина их передних крыльев достигала 4-5 см.
Известны всего два экземпляра этеограмматид с сохранившимися ротовыми ча-
стями, оба относятся к роду Aetheogramma Ren et Engel, 2008 и происходят из фор-
мации Исянь. Фотография одного из этих экземпляров опубликована в китайском ка-
талоге окаменелостей, где вид неверно отнесен к каллиграмматидам (Zhang, 2007:
p. 104). На фотографии хорошо заметен хоботок, состоящий из 4 придатков приблизи-
762
тельно равной длины, которые почти в два раза длиннее головы. В. Н. Макаркин ин-
терпретирует эти придатки как максиллярные и лабиальные щупики (Makarkin, 2016),
в другом месте он утверджает, что у этеограмматид имелся щупиковый хоботок (Ма-
каркин, 2016). Тем не менее, судя по фотографии, внутренняя пара придатков заметно
уже наружной и загнута на концах, так что, возможно, она представляет собой не щу-
пики, а пару каких-то других ротовых частей. К сожалению, место хранения данного
экземпляра неизвестно, и изучить его пока не представляется возможным.
У Aetheogramma glycophila Khramov et Chen, 2020, другого представителя этеограм-
матид с сохранившимися ротовыми частями, по центру хоботка различимы два
длинных элемента, отходящих от общего основания и обрамленных парой плохо со-
хранившихся наружных придатков (рис. 7, 3, 4). Длина сохранившейся части хоботка
равна 5.4 мм. Возможно, структура с общим основанием и двумя придатками - един-
ственная сохранившаяся максилла, несущая удлиненные галеа и лацинию. Не исклю-
чено также, что центральную структуру следует интепретировать как лабиум с двумя
удлиненными придатками, тогда как внешние придатки соответствуют максиллярным
или лабиальным щупикам (Khramov, Chen, 2020). Так или иначе, хоботок этеограм-
матид нельзя считать чисто щупиковым, он был устроен сложнее, но чтобы сказать
что-то более определенное по этому поводу требуются новые находки хорошей со-
хранности.
Cretanallachiinae и Cretadilarinae (Fam. indet.) - это наиболее разнообразная
группа хоботковых сетчатокрылых в бирманском янтаре. Ее таксономический статус
до сих пор остается неясным. Первый представитель кретаналлахин, Cretanallachius
magnificus Huang et al., 2015, был описан в составе современного сем. Dilaridae и от-
несен к современному же подсем. Nallachiinae (Huang et al., 2015). Позднее В. Н. Ма-
каркин выделил род Cretanallachius вместе с родом Burmopsychops Lu et al., 2016,
ранее описанным в составе надсем. Psychopsoidea без указания семейственной при-
надлежности (Lu et al., 2016b), в особое подсем. Cretanallachiinae, также в составе
Dilaridae (Makarkin, 2017). В этой же работе В. Н. Макаркин установил и другое
вымершее подсемейство диларид, Cretadilarinae, отнеся к нему монотипический род
Cretadilar Makarkin, 2017. Основным аргументом в пользу отнесения 3 этих родов к
диларидам было строение жилок Sc и R1, которые впадают в край крыла, не сливаясь,
а также наличие гребенчатых антенн у самцов (Huang et al., 2015; Makarkin, 2017). Но,
как было справедливо отмечено, у самцов современных диларид антенны односто-
ронне гребенчатые (флагелломеры несут только по одному длинному выросту), тогда
как у самцов Cretanallachiinae и Cretadilarinae антенны двусторонне гребенчатые (фла-
гелломеры несут по два выроста), так что данное сходство могло возникнуть конвер-
гентно как адаптация к феромонной коммуникации (Lu et al., 2016a). По этим сообра-
жениям некоторые авторы в дальнейшем описывали кретаналлахин в надсем.
Psychopsoidea без отнесения к какому-то определенному семейству (Chang et al., 2018).
Вторая попытка найти для кретаналлахин место в существующей классификации
отряда была предпринята после обнаружения в бирманском янтаре относительно
крупнокрылых представителей данной группы, внешне похожих на каллиграмматид и
получивших название Burmogramma liui Liu et al., 2018. Подобно «классическим» кал-
лиграмматидам, B. liui несет характерные глазчатые пятна на крыльях, длина его пе-
редних крыльев составляет 26-32 мм (Liu et al., 2018a). Это обстоятельство заставило
авторов находки поместить B. liui вместе с остальными кретаналлахинами в сем.
763
Kalligrammatidae (Liu et al., 2018a). Всего в составе подсем. Cretanallachiinae к калли-
грамматидам было отнесено 5 родов и 8 видов (см. табл. 2). Таксономический статус
двух монотипических родов, Cretadilar и Fiaponeura Lu et al., 2016, в целом близких к
кретаналлахинам, но изначально описанных как Dilaridae - Cretadilarinae и Psych-
opsoidea fam. indet. соответственно, авторы данной работы оставили непроясненным.
На наш взгляд, отнесение кретаналлахин к Kalligrammatidae не более обосновано,
чем к Dilaridae. За исключением B. liui, все кретаналлахины - это мелкие насекомые с
длиной переднего крыла 8-12 мм, что в несколько раз меньше, чем у самых мелких
каллиграмматид. Далее, у кретаналлахин поперечные жилки не бывают плотно распо-
ложены, что столь типично для каллиграмматид. В свою очередь, ни у одной «класси-
ческой» каллиграмматиды нет гребенчатых антенн. На наш взгляд, кретаналлахины и
близкие к ним формы из бирманского янтаря представляют собой независимую ветвь
сетчатокрылых и заслуживают отнесения к отдельному семейству. Глазчатые пятна и
хоботок, скорее всего, возникли у кретаналлахин независимо от каллиграмматид как
адаптация к сходному образу жизни.
Тем не менее, по строению ротовых частей кретаналлахины напоминают калли-
грамматид - у них также имелись две пары длинных лабиальных и максиллярных щу-
пиков, в чем согласны все исследователи (Lu et al., 2016a; Makarkin, 2017; Liu et al.,
2018a). Строение других элементов хоботка могло варьировать; кроме того, суще-
ствуют разногласия по части интерпретации этих структур. У Burmogramma liui,
Cretanallachius magnificus и Oligopsychopsis groehni (Makarkin, 2017) в состав ротового
аппарата помимо 4 щупиков входят также 4 удлиненных стилетовидных элемента
(рис. 8, 1-3). Их интерпретируют либо как галеа и парную лигулу (Lu et al., 2016a; Liu
et al., 2018a; Chang et al., 2018), либо как галеа и лацинии (Makarkin,
2017).
У Fiaponeura penghiani Lu et al., 2016 наряду с двумя галеа есть только непарная ли-
гула (Lu et al., 2016a), у Oligopsychopsis penniformis Chang et al., 2018 помимо галеа
есть два парных элемента (вероятно, лацинии), однако они гораздо короче, чем галеа.
У других кретаналлахин строение хоботка известно хуже, но, по-видимому, все пред-
ставители данной группы обладали удлиненными ротовыми частями.
Функционирование хоботка кретаналлахин пока остается загадкой. Предполагается,
что галеа, смыкаясь с другими удлиненными ротовыми частями, могли образовывать
временный пищевой канал (Lu et al., 2016a), однако неясно, как именно это происхо-
дило. Известно, что у Fiaponeura в непарной лигуле прослеживается желобок, ко-
торый мог входить в состав пищевого канала (Lu et al., 2016a). У всех описанных эк-
земпляров кретаналлахин ротовые части торчат в разные стороны, не образуя подобия
какой-либо трубки. Этот факт может свидетельствовать о том, что в прижизненном
состоянии створки хоботка кретаналлахин были сомкнуты неплотно, будучи лишены
каких-либо специальных запирающих структур, которые есть в хоботках современных
чешуекрылых и других хоботковых насекомых. Тем не менее, кретаналлахины могли
всасывать нектар и другие сладковатые выделения за счет капиллярного эффекта, как
это делают, в частности, бабочки-парусники и белянки с искусственно разомкнутыми
створками хоботка (Lehnert et al., 2014) или же самцы пядениц с редуцированным хо-
ботком (Grant et al., 2012). Однако отсутствие герметично замкнутого пищевого канала
не позволяло кретаналлахинам создать перепад давления, необходимый для всасы-
вания с помощью мышечного насоса (глоточного или цибариального), что замедляло
процесс потребления жидкой пищи и не давало возможности увеличить длину хо-
764
Рис. 8. Длиннохоботковые Neuroptera из бирманского янтаря.
1-3 - Oligopsychopsis groehni (Makarkin, 2017) (Psychopsoidea fam. indet.: Cretanallachiinae) (1 - передние
и задние крылья; 2, 3 - ротовые части; фото В. Н. Макаркина, реконструкция ротовых частей по: Liu et al.,
2018a, с изменениями); 4-6 - Buratina truncata Khramov, 2019 (Sisyridae: Paradoxosisyrinae) (4 - общий вид,
5 - ротовые части, 6 - реконструкция ротовых частей).
lc - лациния, lg - лигула, pmt - прементум, остальные обозначения как на рис. 1-6.
Масштабная линейка: 1 - 1 мм; 2-5 - 0.5 мм; 6 - 0.2 мм.
ботка. Из всех кретаналлахин самые длинные хоботки имелись у Burmogramma liui,
но и их длина составляла всего 3.2 мм, у остальных видов она варьировала от 0.6 до
1.9 мм (Liu et al., 2018a, Suppl.; см. табл. 2)
Paradoxosisyrinae (Sisyridae) - вторая по числу описанных видов группа хобот-
ковых сетчатокрылых в бирманском янтаре. К настоящему моменту известно 5 моно-
типических родов парадоксосизирин (см. табл. 2), однако, по-видимому, этим их раз-
нообразие далеко не исчерпывается. На основании строения терминалий самок
парадоксосизирины были отнесены к сизиридам в статусе отдельного подсемейства
765
(Makarkin, 2016). По сравнению с современными сизиридами, для парадоксосизирин
характерно более обильное жилкование с большим числом ветвей Rs и с терминально
ветвящимися CuP и анальными жилками (Makarkin, 2016; Khramov et al., 2019). Пара-
доксосизирины - это самые мелкие из всех хоботковых сетчатокрылых, длина их пе-
редних крыльев варьирует от 3.5 до 4.4 мм, длина хоботка - от 0.6 до 1.1 мм (см.
табл. 2). Таким образом, по размерам они в 2-3 раза уступают кретаналлахинам, и на
порядок - каллиграмматидам и этеограмматидам.
Личинки современных сизирид паразитируют на пресноводных губках, и вместе с
сем. Nevrorthidae, у которых личинки также ведут водный образ жизни, сизириды рас-
сматриваются как одно из самых базальных семейств сетчатокрылых (Aspöck et al.,
2012). Напротив, кретаналлахины близки к психопсоидным сетчатокрылым, которые,
в свою очередь, примыкают к наиболее продвинутому подотряду Myrmeleontiformia.
Таким образом, эти две группы хоботковых сетчатокрылых занимают совершенно
разное положение на филогенетическом древе отряда. Тем примечательнее, что и у
кретаналлахин, и у парадоксосизирин независимо возник хоботок очень сходной кон-
струкции. А именно, как и у ряда кретаналлахин, хоботок парадоксосизирин органи-
зован в соответствии с формулой «4 + 4»: 4 длинных щупика и 4 длинных стилето-
видных элемента, которые рассматриваются как галеа и лацинии. У ряда
парадоксосизирин имелись также длинная игловидная лигула и удлиненный лабрум
(последний сохранился только у Buratina truncata Khramov, 2019) (Khramov et al.,
2019).
В отличие от кретаналлахин, которые до сих пор встречались лишь с полностью де-
зинтегрированными ротовыми частями, известны экземпляры парадоксосизирин, у
которых галеа и лацинии попарно соединены в две трубочки (рис. 8, 4-6). Предполага-
ется, что через две эти трубочки происходило всасывание жидкой пищи. Таким об-
разом, единого пищевого канала у парадоксосизирин не было. Такое строение хоботка
заставляет вспомнить о ротовом аппарате личинок сетчатокрылых, основу которого,
как уже говорилось выше, также составляют две сосательные трубочки, хотя и образо-
ванные из других элементов. Два независимых пищевых канала в хоботке есть также у
мелких примитивных чешуекрылых сем. Neopseustidae (Kristensen, Nielsen, 1981).
Чтобы при сосании трубочки в хоботке парадоксосизирин были направлены в одну
сторону, их придерживал сверху крышевидный лабрум с загнутыми краями (Khramov
et al., 2019). Похожую роль лабрум играет и в ротовом аппарате личинок Coniopteryg-
idae. Из-за того, что у парадоксосизирин, как и у кретаналлахин, вероятно, не было
специальных «застежек», соединяющих створки хоботка, трубочки при попадании в
смолу легко разваливались на две половинки (галеа и лацинию). Хоботок с такими
торчащими в разные стороны ротовыми элементами виден у Sidorchukatia gracilis
Khramov, 2019, а у Protosiphoniella anthophila Khramov, 2019 в собранном виде сохра-
нилась одна из трубочек хоботка, тогда как другая разъехалась почти до основания.
Принимая во внимание слабую консолидированность хоботка, можно предположить,
что парадоксосизирины, подобно кретаналлахинам, всасывали жидкость за счет ка-
пиллярного эффекта, а не за счет работы мышечного насоса.
Высказывалось предположение, что парадоксосизирины могли использовать свой
хоботок не только для нектарофагии, но и для кровососания или энтомофагии, причем
роль колющего стилета отводилась игловидной лигуле (Makarkin, 2016). Эта точка
зрения, однако, была оспорена на том основании, что в хоботке у парадоксосизирин
766
отсутствует внешний поддерживающий чехол, который бы предотвращал изгибание
колющего стилета при прокалывании, в то время как такой чехол есть у комаров сем.
Culicidae, полужесткокрылых и других насекомых с настоящим колюще-сосущим хо-
ботком. Стилетовидные лацинии и галеа парадоксосизирин, хотя их вершина кажется
заостренной, также не могли использоваться для прокалывания, поскольку по всей
длине были покрыты щетинками, отходящими почти под прямым углом. Такие ще-
тинки, очевидно, препятствовали бы проникновению стилетов в плотный субстрат,
поэтому нектарофагия представляется единственно возможной опцией для парадоксо-
сизирин (Khramov et al., 2019). Хотя никто не проводил точных подсчетов, складыва-
ется впечатление, что по обилию находок парадоксосизирины занимают второе место
среди сетчатокрылых в бирманском янтаре после Berothidae, в коллекциях хранятся
десятки этих насекомых (Yang et al., 2018). Благодаря своей многочисленности пара-
доксосизирины могли играть важную роль в опылении растений.
Итак, палеонтологическая летопись свидетельствует о том, что эпоха хоботковых
сетчатокрылых продлилась по меньшей мере 65 млн лет, с середины юры до середины
мела. За это время сосущий хоботок у сетчатокрылых независимо возникал трижды:
один раз у общего предка Kalligrammatidae и Aeotheogrammatidae, один раз у
Cretanallachiinae (Psychopsoidea fam. indet.) и близких к ним видов, и один раз
у Paradoxosisyrinae (Sisyridae). Во всех трех случаях общий план строения ротового
аппарата хоботковых сетчатокрылых был примерно одинаков - его неотъемлемыми
составляющими были, во-первых, максиллярные и лабиальные щупики, по длине пре-
восходящие хоботок или равные ему, и, во-вторых, удлиненные стилетовидные эле-
менты, исполнявшие функцию всасывания (хоботок в собственном смысле слова).
В то же время состав и способ соединения стилетовидных элементов существенно
варьировали как от семейства к семейству, так и в их пределах.
Особенно примечателен тот факт, что у хоботковых сетчатокрылых были одинаково
хорошо развиты обе пары щупиков, тогда как у конвергентно сходных с ними хобот-
ковых чешуекрылых в строении щупиков наблюдается резкая асимметрия. А именно,
у зубатых молей сем. Micropterigidae длинные максиллярные щупики участвуют в
сборе пыльцы (Krenn et al., 2005), однако у хоботковых чешуекрылых, к питанию
жидкой пищей, они демонстрирует тенденцию к сильной редукции, за исключением
юкковых молей, которые используют вторично удлиненные максиллярные щупики
для переноса пыльцы в рамках облигатного опылительного симбиоза. Напротив, лаби-
альные щупики у хоботковых чешуекрылых остаются более или менее развитыми и
играют сенсорную роль (Krenn, 2010). Остается неясным, почему хоботковые сетчато-
крылые не пошли по этому же пути, ведь для хеморецепции и осязания им наверняка
хватило бы одной пары щупиков. Возможно, обе пары щупиков хоботковых сетчато-
крылых в равной степени избежали редукции потому, что у них было какое-то допол-
нительное, неизвестное нам назначение. Нельзя исключать, что они функционировали
как поддерживающие структуры, не давая стилетовидным элементам разъезжаться в
стороны.
Нет никаких серьезных оснований полагать, что хоботковые сетчатокрылые исполь-
зовали ротовые части для чего-либо помимо нектарофагии. Отсутствие мандибул де-
лало невозможным для них питание твердой пищей. Кровососание, хищничество и
питание соками растений также можно заведомо исключить, так как рыхлый, слабо
интегрированный хоботок сетчатокрылых не подходил для прокалывания. Кроме того,
767
большинство хоботковых сетчатокрылых имело широкие крылья, явно не предназна-
ченные для маневренного полета и преследования добычи; наличие глазчатых пятен
на крыльях у некоторых каллиграмматид и кретаналлахин говорит о том, что они по-
лагались на пассивную защиту и могли, подобно современным чешуекрылым, надолго
задерживаться на репродуктивных органах растений в дневное время. Как уже говори-
лось, длина ротовых частей каллиграмматид и этеограмматид при крупных размерах
тела была непропорционально маленькой. Мезозойские мухи и скорпионницы с хо-
ботками сопоставимой длины, но гораздо более миниатюрным телом и крыльями
могли легче добираться до репродуктивных органов растений, скрытых в густых за-
рослях.
Прямые свидетельства пищевого поведения хоботковых сетчатокрылых отсут-
ствуют, если не считать пыльцы хейролепидиевых Classopollis, обнаруженной рядом
со щупиками Meioneurites spectabilis из Каратау (Labandeira et al., 2016). Однако в
данном местонахождении эта пыльца широко рассеяна по поверхности породы, так
что ее связь с отпечатком каллиграмматиды, по всей видимости, случайна. Тем не
менее, поскольку каллиграмматиды и этеограмматиды возникли в юрском периоде, за-
долго до появления цветковых растений, можно с уверенностью сказать, что первона-
чально они были связаны с голосеменными растениями, такими как беннеттитовые и
кейтониевые (Labandeira et al., 2016), и могли сохранять с ними тесную связь вплоть
до своего исчезновения в середине мелового периода.
С кретаналлахинами и парадоксосизиринами ситуация менее ясная - поскольку их
появление в палеонтологической летописи пришлось на период радиации покрытосе-
менных, они могли с самого начала питаться нектаром из цветков с мелким венчиком,
тогда как глубоко расположенные источники нектара для них были недоступны
(Makarkin, 2016; Khramov et al., 2019). Но нельзя исключать, что они, подобно калли-
грамматидам, посещали голосеменные растения. Неизвестно также, почему находки
кретаналлахин и парадоксосизирин ограничиваются бирманским янтарем. С одной
стороны, эти две группы могли пережить стремительный всплеск разнообразия (на-
пример, в связи с появлением цветковых) и столь же стремительный упадок, так что
ограниченность их палеонтологической летописи объясняется кратковременностью
их существования. С другой стороны, кретаналлахины и парадоксосизирины могли
быть специфическим продуктом островной изоляции, в условиях которой, как предпо-
лагается, формировалась энтомофауна бирманского янтаря (Zhang et al., 2018;
Westerweel et al., 2019), так что отсутствие данных сетчатокрылых в других местона-
хождениях может говорить об ограниченности их ареала. Если к середине мела
прежние хоботковые сетчатокрылые в лице каллиграмматид уже вымерли на большой
земле под давлением внешних факторов, таких как экспансия цветковых и вытеснение
голосеменных, то крупные острова все еще оставались тем местом, где сетчатокрылые
могли какое-то время позволить себе «экспериментировать» с хоботками.
IV. Diptera
Двукрылые - один из самых крупных отрядов насекомых с полным превращением,
насчитывающий более 150 рецентных семейств и 160 000 видов (Pape et al., 2011;
Lambkin et al., 2013; система отряда здесь и далее в целом принята по: Wiegmann,
Yeates, 2017). Самые древние двукрылые найдены в начале среднего триаса; триа-
совые находки очень малочисленны, но уже в триасе этот отряд был распространен
768
всесветно, а в юре начинает занимать важное (часто - доминирующее) место в ком-
плексах ископаемых насекомых (Калугина, Ковалев, 1985; Blagoderov et al., 2002).
Одно из важнейших приобретений Diptera - видоизмененный ротовой аппарат имаго,
в котором, если говорить о базовой комплектации Nematocera и низших Brachycera,
сохраняется только одна из двух максиллярных лопастей - лациния, лабрум участвует
в образовании пищевого канала, а лабиум превращается в чехол для парных ротовых
частей и гипофаринкса, тогда как лабиальные щупики трансформируются в лабел-
лумы (Crampton, 1942; Wood, Borkent, 1989). Как уже было сказано, потеря одной из
лопастей максиллы одновременно с преобразованием лабрума и лабиума происходят
и у скорпионниц сем. Nannochoristidae (Crampton, 1942; Beutel, Baum, 2008). Ис-
ходным для двукрылых считается подобный сосущий ротовой аппарат, в котором ци-
бариальный и глоточный насосы сочетаются с подвижными лабеллумами, которые
втягивают жидкости в основном за счет капиллярного эффекта.
Хоботок двукрылых может служить для всасывания воды, продуктов разложения
органических веществ, предварительно растворенных слюной твердых веществ, тка-
невых жидкостей животных, медвяной пади, различных растительных выделений и,
наконец, цветочного нектара. Многие антофильные двукрылые питаются исключи-
тельно или преимущественно нектаром как высококалорийным источником угле-
водов. Больше половины рецентных семейств Nematocera и низших Brachycera вклю-
чают антофилов и нектарофагов. Многочисленные примеры нектарофагии известны и
среди Cyclorrhapha, и именно высшие мухи - самые известные опылители, хотя доля
семейств, включающих нектарофагов, среди них гораздо ниже (менее 20 %) (Kevan,
Baker, 1983; Larson et al., 2001; Woodcock et al., 2014). Помимо нектара в рацион анто-
фильных двукрылых может входить пыльца. Иногда двукрылые прокалывают и выса-
сывают отдельные пыльцевые зерна, как некоторые Ceratopogonidae, но обычно по-
глощают их целиком (Bombyliidae, некоторые Syrphidae и др.).
Двукрылые стоят на втором месте после пчел как по числу опыляемых ими видов
растений (Ollerton, 2017), так и по объему переносимой пыльцы (Willmer et al., 2017).
Например, на двукрылых приходится 67 % от общего числа всех насекомых, посеща-
ющих цветы на английских сельхозугодиях (Orford et al., 2015). Хотя по численности
двукрылые обычно превосходят пчел, они считаются менее эффективными опылите-
лями. Там же, где пчел мало или нет вовсе из-за экстремальных климатических
условий, роль Diptera в опылении особенно важна, как это наблюдается в высокой
Арктике, холодных высокогорьях чилийских Анд или альпийских лугах Новой Зе-
ландии (Kevan, 1972; Primack, 1978; Arroyo et al., 1982). Среди двукрылых наиболее
важными нектарофагами и опылителями считаются мухи сем. Syrphidae, за ними сле-
дуют Bombyliidae и Muscoidea (Larson et al., 2001), но таксономическое разнообразие
нектарофагов и опылителей не ограничивается этими хорошо известными примерами.
Мокрецы (сем. Ceratopogonidae) опыляют плантации таких тропических культур, как
какао, гевея и авокадо (de Meillon, Wirth, 1991; Arnold et al., 2019). В умеренных и суб-
тропических районах грибные комары сем. Mycetophilidae и Sciaridae эффективно
опыляют лесные миофильные цветковые растения по крайней мере 8 семейств (Mesler
et al., 1980; Mochizuki, Kawakita, 2018).
Ротовые части у большинства антофильных двукрылых относительно короткие, по-
этому эти насекомые чаще ограничиваются посещением цветков с открытым или c
коротким трубчатым венчиком. Мелкие двукрылые в поисках скрытого нектара могут
769
проникать также в сложно устроенные цветки Orchidaceae и цветки-ловушки
Apocynaceae, Araceae и Aristolochiaceae (Kevan, Baker, 1983; Vogel, Martens, 2000;
Larson et al., 2001; Ollerton et al., 2009). Нередко для извлечения труднодоступного не-
ктара двукрылые используют удлиненные ротовые части. Самым ярким примером
такой специализации служат некоторые Acroceridae, Nemestrinidae и Tabanidae, чьи хо-
ботки могут в несколько раз превосходить по длине тело. В одном из часто цитиру-
емых обзоров утверждается, что виды с удлиненным ротовым аппаратом есть в 20 се-
мействах антофильных двукрылых (Gilbert, Jervis, 1998), однако по нашим подсчетам
таких семейств не менее 30; за исключением Rhagionidae, все эти неучтенные Ф. Гил-
бертом и М. Джервисом семейства относятся к Nematocera. Ранг семейств давно
принят для 5 из них (Limoniidae, Tanyderidae, Blephariceridae, Ceratopogonidae и
Cecidomyiidae), а остальные повышены до ранга семейства относительно недавно
(Pediciidae, Keroplatidae, Lygistorrhinidae, группа Heterotricha).
Далее мы подробно остановимся только на длиннохоботковых семействах дву-
крылых, отследив время появления в палеонтологической летописи находок их пред-
ставителей с сохранившимся хоботком. При таком подходе вне рассмотрения оказыва-
ются многие несомненные нектарофаги с короткими ротовыми частями, хотя для
некоторых из них существуют ископаемые свидетельства участия в опылении. На-
пример, в бирманском янтаре обнаружено бибиономорфное двукрылое Cascoplecia
Poinar, 2010 (перенесено в Bibionidae: Pape et al., 2011), на лапках которого найдены
два типа пыльцы (Poinar, 2010); правда, пока остается непонятным, относится ли она к
голо- или к покрытосеменным (Grimaldi et al., 2019).
Nematocera - одна из самых недооцененных групп нектарофагов. К примеру, в не-
давней обширной сводке при обзоре длиннохоботковых двукрылых, сосущих жид-
кости, обсуждаются исключительно Brachycera, а из комаров упомянуты лишь Culic-
idae (Krenn, 2019: Table 3.4). Поэтому мы рассмотрим палеонтологическую летопись
всех семейств Nematocera, включающих длиннохоботковые виды, даже если такие
виды не найдены в ископаемом состоянии. Из Brachycera мы сосредоточимся только
на семействах, для которых известны ископаемые представители с сохранившимся
длинным хоботком, бегло упомянув также Syrphidae и антофильных Schizophora в
связи с важностью этих групп. Такие семейства низших Brachycera, как Apioceridae,
Mydidae и Vermileonidae, включающие длиннохоботковых нектарофагов, останутся за
пределами настоящего обзора по причине отсутствия в палеонтологической летописи
их представителей с длинными хоботками.
Длинный хоботок у двукрылых не всегда следует расценивать как указание на нек-
тарофагию, поскольку этот орган часто служит также для хищничества или кровосо-
сания (известны и более экзотические варианты, например, у кулицид и галлиц - пи-
тание жидкостью, отрыгиваемой муравьями). Проблема интерпретации приобретает
особую остроту, когда ископаемый вид относится к тем группам двукрылых, в ко-
торых в настоящее время эти типы питания практикуются в различных сочетаниях,
как в случае Culicidae, Ceratopogonidae, Tabanidae, Empididae и др. На исключи-
тельную нектарофагию у Nematocera и низших Brachycera указывают лишь отсут-
ствие или заметная редукция мандибул, хотя наличие функциональных мандибул не
препятствует потреблению нектара в дополнение к другим видам пищи (Nagatomi,
Soroida, 1985). На палеонтологическом материале, разумеется, невозможно ни дока-
зать, ни опровергнуть подобное совместительство. Cостав и тонкое строение ротовых
770
частей, необходимые для реконструкции пищевого поведения, далеко не всегда разли-
чимы даже на янтарных инклюзах (Лукашевич, Мостовский, 2003). Иногда жесткие
мандибулярные стилеты у ископаемых экземпляров все же видны, что позволяет отли-
чить длиннохоботковых хищников и кровососов, возможно, примешивавших к своей
диете нектар, от чистых нектарофагов.
1. Nematocera
Удлинение ротового аппарата у Nematocera может достигаться двумя принципи-
ально разными путями (Crampton, 1942).
1. Удлиняется клипеус (часть головной капсулы) и, сливаясь с геной и связанными
головными склеритами, образует неподвижную склеротизованную трубку - рострум,
а собственно ротовые части располагаются на вершине рострума и остаются корот-
кими (Elephantomyia, Limoniidae; Gnoriste, Mycetophilidae).
2. Клипеус сравнительно короткий, а удлиняются сами ротовые части - либо боль-
шинство элементов более или менее равномерно (Anopheles, Culicidae), либо удлиня-
ются только лабеллумы, далеко заходя за вершину лабрума (Geranomyia, Limoniidae;
Neocurupira, Blephariceridae).
У Nematocera оба варианта могут встречаться в пределах одного семейства (табл. 3),
различаясь даже на ископаемом материале благодаря максиллярным щупикам, осно-
вание которых расположено у вершины клипеуса и маркирует начало собственно ро-
товых частей.
Limoniidae - единственное современное семейство комаров, известное из самого
древнего местонахождения двукрылых Вогезы во Франции (средний триас;
Lukashevich, Ribeiro, 2019). Это одно из самых крупных семейств Nematocera, включа-
ющее почти 11 000 видов (Pape et al., 2011) и имеющее всесветное распространение.
Лимонииды были широко распространены уже в триасе: они известны не только из
Европы, но и из Азии и Северной Америки (Shcherbakov et al., 1995; Blagoderov et al.,
2007).
Многие долгоножки - афаги, среди них есть также антофилы и, вероятно, нектаро-
фаги, однако удлиненные хоботки в этом огромном семействе известны всего у 4 ре-
центных родов, хотя некоторые из них относятся к самым крупным. Встречаются оба
варианта удлинения: у Helius Lepeletier et Serville, 1828, Elephantomyia Osten Sacken,
1860 и Toxorhina Loew, 1850 развит длинный рострум, а у Geranomyia Haliday, 1933 уд-
линены сами ротовые части с довольно длинными гипофаринксом, лабрумом и лаби-
умом, а очень длинные лабеллумы далеко выдаются за вершину всех остальных ро-
товых частей (табл. 3), при этом, как и во всем семействе, ни мандибул, ни лациний
нет. Все 3 рода с рострумом известны из эоценового балтийского янтаря (Geranomyia
не обнаружен; табл. 4), а вся «длинноносая четверка» найдена в миоценовом домини-
канском янтаре (Podenas, Poinar, 2001; Kopeć et al., 2016). Geranomyia относится к
подсем. Limoniinae, а 3 рода с рострумом многие авторы считают близкородствен-
ными, но объединяют их в группы разного ранга в разных подсемействах (Савченко,
1983; Ribeiro, Amorim,
2002; Ribeiro,
2008) вплоть до выделения подсем.
Elephantomyiinae (Petersen et al., 2010). Вероятно, эти два типа ротовых аппаратов
сформировались независимо друг от друга.
771
Helius - космополитный род, включающий более 230 рецентных видов (здесь и
ниже видовой состав родов долгоножек принят по: Oosterbroek, 2020). Мало какой
ныне живущий род может похвастаться настолько богатой палеонтологической лето-
писью. Еще в середине XIX в. первый вымерший вид Helius был описан из эоценового
балтийского янтаря (Loew, 1850), из которого к настоящему времени известно 9 видов
(Kania, 2014), а всего из кайнозойских местонахождений Евразии и Северной Аме-
рики описано уже 22 вида этого рода (Podenas, 2002; Podenas, Poinar, 2012; Wu et al.,
2019; Krzemiński et al., 2019). Род известен с раннего мела и уже в мезозое он был ши-
роко распространен (Rayner, Waters, 1990; Ribeiro, 2002; Kania et al., 2018). Вымершие
виды Helius, как и рецентные, заметно различаются по длине ротового аппарата (Kania
et al., 2016): он может быть длинным, в 3-5 раз длиннее головы (H. fossils Kania, 2014),
или коротким, вдвое короче головы (H. krzeminskii Ribeiro, 2002). В мезозое самый
длинный относительно тела рострум описан у раннемелового H. ewa Krzemiński et al.,
2014 (достигает трети длины тела: рис. 9, 1; см. табл. 4), но из того же ливанского ян-
таря известен другой вид, чей рострум не длиннее головы (Kania et al., 2013;
Krzemiński et al., 2014). Среди долгоножек это единственный длиннохоботковый род,
существовавший уже в мезозое, а среди Nematocera - единственный мезозойский нек-
тарофаг с длинным хоботком, известный с раннего мела, для которого можно исклю-
чить кровососание и хищничество из-за наличия рострума, неизвестного при таком
способе питании, и в связи с отсутствием мандибул у рецентных видов.
Elephantomyia - широко распространенный род, включает около 130 рецентных
видов. У рода один из самых длинных рострумов среди лимониид: и у рецентных, и у
вымерших видов рострум может быть длиннее головы в 6-10 раз и даже длиннее тела
(Alexander, 1931; Zhang et al., 2015; см. табл. 4). Относительно длинный рострум
встречается и у мелких, и у крупных видов: у E. baltica Alexander, 1931 рострум
длиной 8.5 мм равен по длине крылу, а у E. grata Podenas, Poinar, 2001 трехмиллиме-
тровый рострум равен по длине телу (Kopeć et al., 2016; рис. 9, 2). Род слабо пред-
ставлен в ископаемой летописи: хотя 3 первых вымерших вида были описаны еще в
середине XIX в. из балтийского янтаря (рис. 9, 3), в котором Elephantomyia довольно
часто встречается, сейчас известны всего 7 видов и все - из кайнозойских янтарей:
6 из балтийского и 1 из доминиканского (Podenas, Poinar, 2001; Kania, 2015a).
Род Toxorhina включает около 150 рецентных видов, у которых рострум нередко до-
стигает длины тела. Именно этот род (в статье Р. Сингера ошибочно указан как
Leptotarsus) не только является нектарофагом, но участвует в сложном процессе опы-
ления орхидеи Habenaia parviflora в Бразилии наряду с бабочками-огневками (сем.
Pyralidae; Singer, 2001). Род известен с кайнозоя, самый древний вид Toxorhina
(Ceratocheilus) eridana (Meunier, 1917) описан из балтийского янтаря, его рострум
примерно равен по длине брюшку (Alexander, 1931), как и у Toxorhina (Ceratocheilus)
mexicana Kopeć et al., 2016.
Geranomyia - один из самых крупных космополитных родов, включает около 350 ре-
центных видов; хоботок может быть и коротким, но часто достигает половины длины
тела (Hancock, 2011; Lantsov, 2015). Geranomyia - обычный нектарофаг на цветках с
трубчатым венчиком, часто встречается на сложноцветных. Вымершие представители
очень редки и ограничены кайнозоем, самый древний - G. euchara Podenas et Poinar,
2001 описан из доминиканского янтаря по единственному самцу. Это единственный
773
Рис. 9. Длиннохоботковые Tipulomorpha и Psychodomorpha (Diptera) из янтарей.
1 - Helius ewa Krzemiński et al., 2014 (Limoniidae), ливанский янтарь, нижний мел; фото И. Кани;
2 - Elephantomyia grata Podenas et Poinar, 2001 (Limoniidae), доминиканский янтарь, миоцен; фото
И. Кани; 3 - E. longirostris (Loew, 1851) (Limoniidae), балтийский янтарь, эоцен; фото И. Кани;
4 - Trentepohlia (Onutia) damzeni Podenas, 2003 (Limoniidae), балтийский янтарь, эоцен; фото С. Поденаса;
5 - Macrochile spectrum Loew, 1850 (Tanyderidae), балтийский янтарь, эоцен; фото В. Вихарда.
la - лабеллум, r - рострум, остальные обозначения как на рис. 1-6.
Стрелка указывает на границу лабрума.
777
вид рода, к настоящему времени описанный из янтарей; известны еще две находки в
олигоцене и миоцене Европы (Evenhuis, 2020).
Особняком стоит Trentepohlia Bigot, 1854 - крупный космополитный род, объединя-
ющий около 300 рецентных видов. Удлиненный хоботок не характерен для этого рода.
У единственного мезозойского вида, T. (Paramongoma) dzeura Podenas et Poinar, 2009
(бирманский янтарь), как и у остальных 10 вымерших кайнозойских видов из ре-
центных подродов, ротовые части короткие или не сохранились (Podenas, Poinar, 1999,
2001, 2009; Podenas, 2005; Kania, 2015b; Krzemiński et al., 2019; Ngô-Muller et al., 2019).
Но у одного вида, T. (Onutia) damzeni Podenas, 2003 (балтийский янтарь) из вымер-
шего подрода удлиненные ротовые части у обоих полов (Podenas, 2003, 2005); это
редкий пример наличия хоботка в таксоне родовой группы, у современных представи-
телей которого его нет. Строение ротовых частей сходно с таковым у Geranomyia
(рис. 9, 4): вытянутый клипеус сочетается с вытянутым лабиумом с длинными лабел-
лумами, но лабрум заметно короче, а ротовой аппарат оказывается в два раза длиннее
головы - подобное соотношение неизвестно нам у рецентных видов этого рода.
Странно, что при таком обилии и разнообразии специализированных рецентных не-
ктарофагов до сих пор неизвестны представители каких-либо вымерших родов долго-
ножек с длинным хоботком.
Pediciidae
- небольшое семейство долгоножек, известное с середины юры
(Lukashevich, 2009). Только один рецентный род Ornithodes Coquillett, 1900 с двумя
видами имеет удлиненный ротовой аппарат (Coquillett, 1900), причем длинный ро-
струм (в 1.5 раза длиннее головы) обнаружен лишь у типового вида. В ископаемом
состоянии ни Ornithodes, ни какие-либо другие педицииды с рострумом не обнару-
жены (Alexander, 1931; Podenas, 2001; Gao et al., 2015; Лукашевич, 2020).
Tanyderidae - небольшое реликтовое семейство, насчитывающее в современной
фауне всего полсотни видов (Eskov, Lukashevich, 2015). По многим признакам семей-
ство считается одним из самых примитивных в отряде, однако из триасовых отло-
жений до сих пор неизвестно, первые находки - из ранней юры (Ansorge, 1994).
Прямых наблюдений за питанием танидерид до сих пор нет, но для некоторых со-
временных родов можно уверенно предполагать нектарофагию на основании особен-
ностей строения удлиненного ротового аппарата с сильно редуцированными или утра-
ченными мандибулами (Е. Л., личные данные). Известны оба типа удлинения
(см. табл. 3): длинный склеротизованный рострум и короткие собственно ротовые
части у южноафриканского эндемика Peringueyomyina Alexander, 1921 (Alexander,
1927) или равномерно удлиненные ротовые части и заметный клипеус у австралий-
ского Eutanyderus Alexander, 1928. Эти роды принадлежат к разным подсемействам,
Nannotanyderinae и Tanyderinae, которые известны из мезозоя, однако рострум у
вымерших танидерид пока не обнаружен, несмотря на довольно многочисленные на-
ходки. Второй вариант с удлиненными ротовыми частями известен в палеонтологиче-
ской летописи давно: у первой описанной танидериды из балтийского янтаря,
Macrochile spectrum Loew, 1850, хорошо развитый клипеус примерно равен по длине
голове, а сами равномерно удлиненные ротовые части могут быть в два раза длиннее
головы (Crampton, 1926: fig. 3; Alexander, 1931: fig. 1; Wichard et al., 2009: fig. 10.09;
рис. 9, 5). Подобный ротовой аппарат известен у Eutanyderus и предполагает нектаро-
фагию. Промеры ротовых частей балтийских танидерид были сделаны только Ч. Алек-
778
сандером для M. spectrum, но, судя по опубликованным иллюстрациям и личным на-
блюдениям, у M. hornei Krzemiński et al., 2013 ротовой аппарат тоже сильно удлинен
(Krzemiński et al., 2013: fig. 13), а у Podemacrochile baltica (Podenas, 1997) он нена-
много длиннее головы (Podenas, 1997: fig. 1).
Удлиненные ротовые части, заметно превышающие по длине голову, встречаются у
мезозойских родов танидерид не позже средней юры, например, у нескольких азиат-
ских видов Praemacrochile Kalugina,
1985 (Калугина, Ковалев,
1985, рис.
2;
Lukashevich, Krzemiński, 2009: figs.1 A; 4 B, F, G; Dong et al., 2015: figs. 7, 8; см. табл. 4).
Самый древний вид с удлиненнным хоботком, P. stackelbergi Kalugina, 1985, описан из
ранней или средней юры Сибири (Калугина, Ковалев, 1985), и это первая находка хо-
ботка у двукрылых. Отсутствие данных о тонком строении этих хоботков не позволяет
делать выводы о питании юрских танидерид. Только в отношении Dachochile Poinar
et Brown, 2004 из мелового бирмита есть некоторая определенность: судя по фото
(ни промеров, ни рисунков нет), у самок ротовые части немного длиннее головы
(у самцов - короче), с зазубренными мандибулами (Poinar, Brown, 2004, 2006: fig. 5).
Для этого рода логично предположить кровососание или хищничество (очень редкий
вариант среди Nematocera) как основной тип питания, а не потребление свободных
жидкостей, одним из вариантов которого является нектарофагия. По аналогии с мо-
скитами можно предполагать у мезозойских танидерид только комбинированное пи-
тание, причем источником углеводов могла быть и медвяная падь, а специализацию к
нектарофагии можно реконструировать лишь у кайнозойских танидерид.
Psychodidae известны с ранней юры (Ansorge, 1994). Эти близкие родственники та-
нидерид оказались гораздо более успешными и широко распространенными - в совре-
менной фауне их более 3000 видов (Pape et al., 2011). Удлиненные ротовые части с хо-
рошо развитыми стилетами известны у москитов (подсем. Phlebotominae) (Quate,
Vockeroth, 1981). Эти печально знаменитые кровососы позвоночных, например
Phlebotomus papatasi (Scopoli, 1786) и Lutzomyia longipalpis (Lutz, Neiva, 1912), могут
протыкать и высасывать зеленые части растений, а также дополнительно питаться и
медвяной падью, и нектаром цветов из разных семейств, проявляя при этом избира-
тельность (Petts et al., 1997; Müller et al., 2011). Найти сведения об исключительной
нектарофагии у каких-либо родов с удлиненным хоботком не удалось. Вероятно, не
является кровососом типовой род подсем. Horaiellinae с длинным хоботком (Tonnoir,
1933; Curler, Priyadarsanan, 2015), но данных о питании представителей этого рода нет,
а по длинным мандибулам и укороченным максиллам у самок Horaiella Tonnoir,
1933 можно предположить хищничество на насекомых. Horaiellinae обнаружены в
мелу, у самцов обоих видов из бирманского янтаря ротовые части короткие, самки их
неизвестны (Curler et al., 2019).
Phlebotominae неплохо представлены в палеонтологической летописи. Род Lutzomyia
França, 1924 известен с миоцена, представители рода разнообразны и многочисленны
в доминиканском и мексиканском янтарях, их ротовые части вместе с клипеусом бы-
вают в два раза длиннее головы, длинные мандибулы хорошо развиты, исключительно
у самок отмечено гранулированное содержимое желудков, а в качестве сининклюзов
обнаружена шерсть млекопитающих, так что кровососание на млекопитающих, по
крайней мере, у нескольких видов, несомненно (Peñalver, Grimaldi, 2006; Ibáñez-Bernal
et al., 2014). Род Phlebotomus Rondani et Berté, 1840 известен с середины мела, ротовые
части вида из бирманского янтаря примерно равны по длине голове, а ротовые части
779
других меловых родов Phlebotominae бывают и короче, и длиннее головы (Hennig,
1972; Poinar, 2004; Ain Malak et al., 2013; Stebner et al., 2015).
С раннего мела и в других подсемействах психодид известны хоботки, примерно
равные по длине голове, а именно среди мелового подсем. Datziinae и у вымерших
родов неясной систематической принадлежности (Azar et al., 1999, 2003, 2007; Stebner
et al., 2015; см. табл. 4). Часто у этих меловых инклюзов видны мандибулы, поэтому
для них реконструируется кровососание, но комбинированное питание исключать
нельзя.
Blephariceridae обнаруживаются с середины юры (Lukashevich et al., 2006), однако
ископаемые находки чрезвычайно редки. Известно всего 30 современных родов, ро-
товые части их представителей редуцированы или хорошо развиты: самки многих
видов с длинными зазубренными мандибулами хищничают, высасывая гемолимфу
других насекомых, способ питания самцов и самок без мандибул неизвестен, но пред-
полагается афагия либо нектарофагия (Courtney, 2017). У вероятных нектарофагов
встречаются два варианта удлинения собственно ротовых частей (см. табл. 3). В трибе
Paltostomini (Blepharicerinae) в пределах одного рода Paltostoma Schiner, 1866 обнару-
жены удивительно разнообразные, но всегда равномерно удлиненные ротовые части: с
выраженным половым диморфизмом или без него, с мандибулами и без них, чаще
длинные, но иногда короткие (Edwards, 1929; Stuckenberg, 2004). В другой трибе этого
же подсемейства Apistomyiini лишь лабиум сильно удлинен за счет лабеллумов (в не-
сколько раз длиннее головы), лабрум гораздо короче лабиума, максиллы очень ко-
роткие (Crampton, 1942: fig. 3d; Stuckenberg, 2004). Мандибулы обычно отсутствуют,
но обнаружены у некоторых родов; склеротизация их всегда ослаблена, и размеры
обычно уменьшены (Zwick, 1998). Кажется, опубликовано лишь одно наблюдение за
питанием имаго Apistomyiini - типовой вид Apistomyia elegans Bigot, 1862 не раз на-
блюдали на цветах (в интернете можно найти множество фотографий этого европей-
ского вида на дуднике), но, вероятно, триба полностью состоит из нектарофагов, судя
по удлиненным лабеллумам с густой сетью псевдотрахей, приспособленных для ка-
пиллярного втягивания жидкостей (Zwick, 1998). Ископаемых находок Paltostomini и
Apistomyiini пока нет.
Ни у одной из 4 мезозойских блефарицерид удлиненные ротовые части не обнару-
жены (Lukashevich, Shcherbakov, 1997; Lukashevich et al., 2006; Zhang, Lukashevich,
2007), напротив, есть свидетельства хищного образа жизни: типичный «хищный»
клюв, пучок щетинок на вздутом основании последнего членика лапки (calcipala) и
зазубренные коготки. Не описанный формально комар из бирманского янтаря (Grimaldi
et al., 2002: fig. 35b), судя по фотографии, может относиться к хищному роду Philorus
Kellogg, 1903 (Blepharicerini; Zhang, Lukashevich, 2007). Достоверные находки ископа-
емых блефарицерид кайнозойского возраста отсутствуют.
Culicidae - это, вероятно, самое известное семейство Nematocera с длинным хо-
ботком, включающее почти 3600 ныне живущих видов (Harbach, 2020). В мезозое се-
мейство появилось поздно, в середине мела, и мезозойские находки очень редки, опи-
саны всего 3 монотипических рода по 4 инклюзам из бирманского и канадского
янтарей (Poinar et al., 2000; Borkent, Grimaldi, 2004, 2016; Poinar et al., 2019). У ме-
ловых кулицид хоботки короткие по меркам семейства, по крайней мере, у 2 из 3 родов
(см. табл. 4; рис. 10, 1). У Burmaculex Borkent et Grimaldi 2004 и Priscoculex Poinar
et al., 2019 из бирманского янтаря хоботок удлинен незначительно (примерно в 2 раза
780
длинее головы), лабеллумы короткие, мандибулы не видны. У Paleoculicis Poinar et al.,
2000 из канадского янтаря строение и длина хоботка неизвестны из-за неполной со-
хранности единственного инклюза.
Кайнозойских находок заметно больше: известно около 3 десятков ископаемых ку-
лицид этого возраста, относящихся как к вымершим, так и к рецентным родам
(Edwards, 1923; Szadziewski, 1998; Solórzano Kraemer, 2007; Szadziewski, Gilka, 2011;
Harbach, Greenwalt, 2012; Krzemiński et al., 2019; Szadziewski et al., 2019c). Хоботки
кайнозойских видов очень длинные, типичные кулицидные, обычно в 3.5-5 раз
длиннее головы (см. табл. 4) и состоят из равномерно удлиненных ротовых частей.
Неоднократно сообщалось, что кровососущие Culicidae обоих полов посещают ре-
продуктивные органы покрытосеменных для питания, причем диапазон растений
очень широк, а форма цветков не имеет решающего значения. Комары были замечены
на цветах
17 семейств растений, включая орхидеи (Grimstad, deFoliart,
1974;
Magnarelli, 1983; Woodcock et al., 2014). Так, в опылении бореальной орхидеи
Platanthera obtusata участвуют комары Ochlerotatus communis (De Geer, 1776) и
O. canadensis (Theobald, 1901) (Thien, 1969) - широко распространенные массовые
виды, активные кровососы позвоночных. Нектарофагия самок - постоянное допол-
нение к белковому питанию, но нельзя исключить и временное или даже постоянное
замещение кровососания в определенные периоды или на определенных территориях.
В любом случае, очевидно, что типичный кулицидный ротовой аппарат хорошо при-
способлен и для кровососания, и для нектарофагии.
Toxorhynchites Theobald, 1901 - единственный рецентный род из обнаруженных в
кайнозое, самки которого не пьют кровь, а оба пола сосут нектар и другие сахаристые
выделения растений. Прямых наблюдений за питанием немного, но самки разных
видов отмечены на цветках Apiaceae, Asteraceae, Hydrangeaceae, Lamiaceae и Rubiaceae
(Knab, 1911 и др.). Длинный хоботок имеет нестандартную форму - он жесткий в ба-
зальной половине, не прямой и не торчит вперед, как обычно у комаров, а согнут посе-
редине почти под прямым углом, поскольку тонкая дистальная часть отогнута вниз и
назад (Coetzee, 2017: figs 29, 31.1). У Toxorhynchites (Toxorhynchites) mexicanus
Zavortink, Poinar, 2008 из мексиканского янтаря такая же форма хоботка (Zavortink,
Poinar, 2008: fig. 2), что позволяет уверенно реконструировать нектарофагию и для
этого миоценового вида.
Chironomidae - это одно из самых разнообразных ныне семейств двукрылых, вклю-
чает почти 7000 видов (Pape et al., 2011). Семейство известно начиная с позднего
триаса (Krzemiński, Jarzembowski, 1999), в мезозое было широко распространено (Ка-
лугина, Ковалев, 1985).
Имаго рецентных хирономид короткоживущие, имеют очень короткие ротовые
части (заметно короче головы) и обычно не питаются. Однако, как в любом большом
семействе, из этого правила есть исключения, например, в подсемействах Podonominae
(см. далее) и Orthocladiinae. Некоторые виды рода Smittia Holmgren,
1869
(Orthocladiinae) оказались самыми частыми посетителями цветков примитивных по-
крытосеменных сем. Winteraceae в Новой Зеландии (Lloyd, Wells, 1992), а в арктиче-
ских районах Канады виды Smittia, в том числе вид с говорящим названием
S. longirostris Goetghebuer, 1937, были собраны на цветках камнеломки (род Saxifraga)
(Kevan, 1972). Ротовые аппараты этих несомненных нектарофагов по длине не превы-
781
Рис. 10. Длиннохоботковые Culicomorpha и Bibionomorpha (Diptera).
1 - Burmaculex antiquus Borkent et Grimaldi, 2004 (Culicidae), бирманский янтарь, верхний мел; фото
А. Боркента; 2 - Cretaenne rasnicyni Lukashevich et Przhiboro, 2011 (Chironomidae), Шар Тэг (Монголия),
верхняя юра; 3 - Culicoides bojarskii Szadziewski et Dominiak, 2019 (Ceratopogonidae), бирманский янтарь,
верхний мел; фото Р. Шадзевского; 4 - Palaegnoriste affine Meunier, 1912 (Lygistorrhinidae), балтийский
янтарь, эоцен; фото В. А. Благодерова; 5 - Antlemon sp. (Keroplatidae), балтийский янтарь, эоцен;
фото К. и Г. Хоффайнсов.
Обозначения как на рис. 1-9.
Стрелка указывает на границу лабрума.
782
шают высоты головы и могут считаться заметными только на фоне большинства видов
этого семейства. Действительно впечатляющие хоботки обнаружены у других орто-
кладиин, в двух близких родах Rhinocladius Edwards, 1931 и Pseudorthocladius
Goetghebuer, 1943.
Хоботок Rhinocladius очень длинный, может в 4 раза превосходить высоту головы и
на первый взгляд напоминает хоботок Culicidae. Удлинение ротовых частей у видов
этого рода происходит исключительно за счет лабиума, причем почти вся эта немалая
длина приходится на лабеллумы, тогда как другие ротовые части остаются короткими
(Edwards, 1931), как у блефарицерид трибы Apistomyiini. У всех 3 известных видов
Rhinocladius лабеллумы удлиненные, но самые впечатляющие они у Rh. longirostris
Edwards, 1931: у обоих полов лабеллумы почти равны по длине телу и составляют
3/4 длины крыла (Edwards, 1931; Saether, Andersen, 2003). Хоботок сходного строения
с удлиненными лабеллумами (и без мандибул) обнаружен и у Pseudorthocladius
macrostomus Soponis, 1980, хотя у большинства остальных видов этого рода ничего
подобного нет. Вероятно, хоботки этих мелких ортокладиин, не превышающие 1.5 мм,
приспособлены для втягивания нектара, но точных данных на этот счет до сих пор нет
(Soponis, 1980; Saether, Andersen, 2003).
В ископаемом состоянии подобные хоботки с очень длинными лабеллумами, при-
способленные только для нектарофагии, у Chironomidae не найдены. Удлиненные ро-
товые части описаны у кайнозойских Tanypodinae из балтийского янтаря (Meunier,
1916; Szadziewski et al., 2018): у Cricotopiella rostrata Meunier, 1916 они равны по
длине голове, а у Eoprocladius hoffeinsorum Szadziewski et al., 2018 хоботок вместе с
клипеусом в 1.4-1.5 раза длиннее головы. Лабрум у этих двух видов удлинен, а состав
остальных ротовых частей неясен, виден только лабиум с хорошо развитыми, мяси-
стыми недлинными лабеллумами. В недавней статье подробно разбираются почти все
известные примеры удлинения ротовых частей у вымерших и ныне живущих хиро-
номид (Szadziewski et al., 2018). Остается, однако, непонятным, почему авторы
убеждены в отсутствии парных стилетов у этих кайнозойских видов, ведь у обоих ти-
повых экземпляров Eo. hoffeinsorum ротовые части плотно сомкнуты, т. е. внутренние
стилеты не могут быть видны. Похожее удлинение ротовых частей отмечено также
у хирономид, предположительно отнесенных к мезозойскому подсем. Aenneinae:
у позднеюрской Cretaenne rasnicyni Lukashevich et Przhiboro, 2011 хоботок вместе с
клипеусом в 1.5 раза длиннее головы (Lukashevich, Przhiboro, 2011; рис. 10, 2). Этот
род не обсуждается Р. Шадзиевским с соавторами, хотя, судя по всему, мандибулы
были зазубрены и функционировали у всех мезозойских видов Cretaenne Azar et al.,
2008 и у некоторых меловых родов из подсем. Tanypodinae (Azar et al., 2008). По-
добные зазубренные мандибулы найдены у современных родов Podonominae с хорошо
развитыми ротовыми частями, Archeochlus Brundin, 1966 и Austrochlus Cranston, 2002,
для которых предполагают хищничество на насекомых, хотя прямых наблюдений и
доказательств этого пока нет (Cranston et al., 2002). Похожие ротовые части (вместе с
клипеусом в 1.3 раза длиннее головы), описаны недавно у меловой подономины,
Burmochlus madmaxi Giłka et al., 2020, которую авторы считают близкой к Archeochlus,
однако мандибулы у единственного самца не различимы (Giłka et al., 2020).
Таким образом, пока говорить о специализированных нектарофагах среди вымерших
хирономид преждевременно, хотя для длиннохоботковых видов нельзя исключить
двойной характер питания, как у мокрецов и кулицид. Присутствие в янтаре рядом с
783
Eo. hoffeinsorum многочисленной пыльцы (между прочим, лишь рядом с инклюзом
самца) дает основание предполагать нектарофагию, но определенно свидетельствует
только о том, что лёт этих хирономид происходил во время цветения, и не может счи-
таться доказательством до обнаружения экземпляров с хорошо сохранившимися рото-
выми частями.
Ceratopogonidae
- крупное, всесветно распространенное семейство (почти
6200 ныне живущих и 300 вымерших видов), известное с раннего мела (Szadziewski,
1996; Borkent, Dominiak, 2020). Это семейство сегодня умеет все, т. е. демонстрирует
практически весь спектр пищевого поведения. Среди мокрецов есть хищники мелких
насекомых и эктопаразиты крупных насекомых и пауков, кровососы разнообразных
позвоночных, некрофаги и нектарофаги. Редкие мокрецы не сосут ни кровь, ни гемо-
лимфу, а питаются исключительно на растениях - медвяной падью, нектаром и слад-
кими выделениями, например, весь род Dasyhelea Kieffer, 1911, у представителей ко-
торого мандибулы отсутствуют или лишены зубцов, а ротовой аппарат короткий, что
не мешает этому роду быть важным опылителем какао и гевеи (Gad, 1951; Глухова,
1981; de Meillon, Wirth, 1991; Borkent, 2017). Dasyhelea известен с эоцена (балтийский
янтарь), длинные ротовые части не обнаружены ни у одного вымершего его вида
(Szadziewski, 1988; 1993).
Обычно две пищевые стратегии у мокрецов наблюдаются в пределах одного рода и
даже вида. Среди Forcipomyiinae преобладают энтомофаги (Szadziewski, 2018), многие
из которых - антофилы и опылители, например, какао, гевеи и авокадо, а некоторые
прокалывают и высасывают пыльцевые зерна (de Meillon, Wirth, 1991). В подсемей-
стве известно несколько примеров удлиненных ротовых частей: в подродах
Lophomyidium рода Atrichopogon Kieffer, 1906 и Rhinohelea рода Forcipomyia Meigen,
1818 длина ротовых частей вместе с сильно развитым клипеусом в 2-2.5 раза превос-
ходит высоту головы. В обоих подродах хорошо развиты зазубренные мандибулы, при
этом оба отмечены на цветах, например, Forcipomyia (Rh.) briani de Meillon et Wirth,
1979 - на трубчатых цветках Erica (Ericaceae), что свидетельствует о двойном харак-
тере питания (de Meillon, Wirth, 1979, 1991; Wirth, 1994).
Оба рода, Forcipomyia и Atrichopogon, известны в палеонтологической летописи с
эоцена, Forcipomyia присутствует во многих кайнозойских янтарях, Atrichopogon -
лишь в балтийском и доминиканском (Szadziewski, 1988, 2018; Szadziewski, Grogan,
1998). При этом в ископаемом состоянии не отмечены ни обсуждаемые подроды, ни
какие-либо вымершие виды с очень длинным хоботком. Иногда в описании кайнозой-
ских мокрецов упоминаются длинные ротовые части, но без промеров и иллюстраций
трудно оценить их размеры. Вероятно, ротовые части обычно не превышают по длине
голову, как можно судить по опубликованной фотографии F. nadicola Szadziewski,
2013 из среднеэоценового сахалинского янтаря (Szadziewski, Sontag, 2013). Изредка
все же попадаются виды с ротовыми частями, которые немного длиннее головы, как у
F. miocenica Szadziewski, 1993 и F. tuberculosa Szadziewski, 1993 из саксонского янтаря
(Szadziewski, 1993). В составе Forcipomyiinae описан также монотипический меловой
род Burmahelea Szadziewski et Sontag, 2019 из бирманского янтаря, у единственного
вида которого ротовые части заметно длиннее головы и позволяют предположить ком-
бинированное питание, так как строение мелкозазубренных лациний свидетельствует
о питании гемолимфой насекомых (Szadziewski et al., 2019b).
784
Culicoides Latreille, 1809 (подсем. Ceratopogoninae) - злостный кровосос и самый
крупный космополитный род в семействе, включает 1400 видов, из которых полсотни
вымерших (Borkent, Dominiak, 2020). Среди хозяев Culicoides в основном млекопита-
ющие и птицы, изредка рептилии и даже рыбы, а один из подродов Trithecoides Wirth
et Hubert, 1959 питается кровью и, вероятно, гемолимфой из насосавшихся комаров
Culicidae и москитов Psychodidae (Borkent, 2017). Но и в этом роде есть явно «некро-
вожадные» виды c редуцированными зубцами на мандибулах или вовсе без мандибул,
для которых предполагается нектарофагия (Wirth, Hubert, 1962). Culicoides известен
из янтарей позднего мела и кайнозоя, причем описано несколько меловых видов с
длинными ротовыми частями (Remm, 1976; Szadziewski, 1996; Borkent, 2000b;
Szadziewski et al., 2019a). Самые длинные ротовые части, в два раза превышающие по
длине голову, обнаружены у Culicoides filipalpis Remm, 1976, C. yoosti Borkent, 2000 и
C. bojarskii Szadziewski et Dominiak, 2019 (см. табл. 4; рис. 10, 3). Для многих меловых
видов, в том числе для C. filipalpis из канадского янтаря, по ротовым частям рекон-
струируется кровососание (Borkent, 1995), которое, как и у рецентных видов этого
рода, вероятно, совмещалось с нектарофагией у обоих полов.
У раннемеловых родов Archiculicoides Szadziewski, 1996 и Gerontodacus Borkent,
2019 и у позднемелового рода Alautunmyia Borkent, 1996, чье положение в семействе
не определено, ротовые части не короче (Borkent, 1996), а часто - заметно длиннее го-
ловы, например у G. punctus (Borkent, 2000) и A. unus (Borkent, 2000) из ливанского
янтаря (Borkent, 2000a) и у G. skalskii (Szadziewski et Arillo, 1998) из испанского ян-
таря (родовая принадлежность видов по: Borkent, 2019). По тонкозазубренным манди-
булам и зазубренным лациниям для обоих родов уверенно реконструируется кровосо-
сание, но детали ротовых частей испанского вида неясны (Szadziewski, Arillo, 1998;
Pérez-de la Fuente et al., 2011).
Получается, что удлиненные ротовые части довольно обычны у меловых мокрецов,
однако почти всегда можно предполагать комбинированное питание, а не исключи-
тельную нектарофагию.
Keroplatidae - космополитное семейство грибных комаров почти c 1000 видов (Pape
et al., 2011), известное с раннего мела и особенно хорошо представленное в кайнозой-
ских янтарях (Blagoderov, Arillo, 2002). Ротовые части обычно короткие, но варьируют
от очень коротких до длинных у нескольких родов, изредка в несколько раз превы-
шают длину головы, например у Antlemon Loew, 1871 и Rhynchoplatyura de Meijere
(Baez, Santos-Pinto, 1981; Vockeroth, 1981).
У родов Rhynchoplatyura и Rhynchorfelia Matile, 1988 самая длинная часть ротовых
частей - это тонкие лабеллумы, которые далеко выдаются за вершину лабрума и со-
ставляют около половины длины хоботка. Максиллярные щупики при этом многочле-
никовые, но короткие (Edwards, 1925; Matile, 1988; Hippa et al., 2005). Чаще хоботок
кероплатид состоит из равномерно удлиненных ротовых частей, причем лабиум удли-
няется за счет прементума, который в несколько раз длиннее лабеллумов (Antlemon),
но иногда удлинены массивные и мясистые лабеллумы (Asindulum Latreille, 1805). Оба
этих рода отмечены на цветках Apiaceae, Asteraceae и Saxifragaceae (Bechev, 2010).
У эоценового Antlemon sp. из балтийского янтаря (см. табл. 4; рис. 10, 5) обнаружен
длинный хоботок такого же строения, как и у рецентных видов этого рода, с равно-
мерно удлиненными лабрумом и лабиумом и короткими лабеллумами, но с длинными
785
максиллярными щупиками (Hoffeins et al., 2010). Ни у каких других ископаемых керо-
платид удлинение ротовых частей не прослеживается.
Mycetophilidae - космополитное семейство грибных комаров, включающее более
4500 видов (Pape et al., 2011) и известное с раннего мела (Благодеров, 1995). Ротовой
аппарат иногда редуцирован, обычно развит нормально, но изредка удлинен; самый
известный пример - Gnoriste Meigen, 1818 c очень длинным рострумом, в 5-7 раз
длиннее головы и почти равным по длине телу (Crampton, 1942; Vockeroth, 1981). Не-
которые виды камнеломковых, как с открытыми, так и с закрытыми цветками, опыля-
ются исключительно или преимущественно представителями этого рода (Goldblatt
et al., 2004; Okuyama et al., 2008).
У Mycetophilidae могут удлиняться не только рострум, но и собственно ротовые
части. У Aphrastomyia Coher et Lane, 1949 ротовые части бывают короткими, но
обычно они в два раза длиннее головы. У этого рода нет рострума, лабрум, лабиум и
гипофаринкс удлинены одинаково, лацинии короче, а несклеротизованные лабеллумы
длиннее лабиума, к которому причленены подвижно и обычно подвернуты внутрь
(Coher, Lane, 1949; Jaschhof, Kallwein, 2004; Hippa et al., 2005). Самцы типового вида
Aphrastomyia были пойманы на гниющих фруктах, других данных о питании рода нет.
У единственного ископаемого представителя рода, A. planistylus Baxter, 1994 из доми-
никанского янтаря, ротовые части имеют типичное строение, у самца длина их не-
много превышает высоту глаз; на фото виден характерный подгиб лабеллумов внутрь
(Baxter, Poinar, 1994: fig. 13).
Mycetophilidae - одни из самых многочисленных двукрылых в ископаемой лето-
писи, описано около 400 вымерших видов, львиная доля из них (около 2/3) - из бал-
тийского янтаря и, как обычно в кайнозое, это большей частью представители ре-
центных родов (Evenhuis, 1994). Странно, что среди многочисленных балтийских
инклюзов не нашлось ни одного Gnoriste, хотя ныне этот род широко распространен в
Голарктике. Давно описаны два экземпляра кайнозойских Gnoriste: из эоцена
США (Scudder, 1877; ротовые части в описании не упомянуты, рисунка нет) и из оли-
гоцена Франции (Curtis, 1829; Heer, 1856; Théobald, 1937). Французский экземпляр
описан и дважды переописан, но родовая принадлежность осталась под вопросом, по-
скольку жилкование крыла близко к жилкованию Gnoriste, но не идентично ему, а ха-
рактерного для рода рострума Н. Теобальд не нашел (Théobald, 1937: 324, Pl. XX:
fig. 22). У остальных кайнозойских (Meunier, 1904) и мезозойских мицетофилид (Бла-
годеров, 1997, 1998; Blagoderov, Grimaldi, 2004) не удалось обнаружить никаких упо-
минаний о длинных хоботках, обычно ротовые части у них заметно короче головы.
Lygistorrhinidae - это широко распространенное в тропиках и субтропиках не-
большое семейство грибных комаров, включающее 16 родов, из которых половина
вымершие. Это единственное семейство специализированных нектарофагов среди
Nematocera. Хоботок состоит из короткого лабрума, длинных гипофаринкса и ла-
биума, удлиненного за счет лабеллумов, но иногда - и за счет прементума. Уникальная
черта ротового аппарата этих комаров - очень длинные одночлениковые максил-
лярные щупики (Thompson, 1975; Hippa et al., 2005; Blagoderov, 2017). Прямых наблю-
дений за питанием Lygistorrhinidae мало. Вероятно, по большей части это нектарофа-
ги-генералисты. Представители семейства замечены на разнообразных Asteraceae и
единичных Adoxaceae, Anacardiaceae, Diapensiaceae и Hydrangeaceae (Thompson, 1975;
786
Berton, 2018), а также в колбовидных «цветках-ловушках» Apocynaceae (Ollerton et al.,
2009).
Длина хоботка Lygistorrhinidae сильно варьирует и среди рецентных, и среди
вымерших родов - от очень короткого (1/10 высоты головы) до очень длинного, в
3-6 раз длиннее головы, что характерно для рецентного рода Lygistorrhina Skuse, 1890.
Этот космополитный род известен с кайнозоя; у вымерших видов, найденных в ин-
дийском и доминиканском янтарях, ротовые части длинные, в 2-3 раза длиннее го-
ловы, а длинные одночлениковые максиллярные щупики составляют около 2/3 общей
длины хоботка (Grunt, 2012; Stebner et al., 2017). У эоценовых родов Palaeognoriste
Meunier, 1904 (балтийский и индийский янтари; рис. 10, 4) и Indorrhina Stebner et
Grimaldi, 2017 (индийский янтарь) ротовые части умеренно удлиненные, в 1.3-2.3 раза
длиннее высоты головы (см. табл. 4), а максиллярные щупики составляют от поло-
вины до 2/3 длины хоботка (Grimaldi, Blagoderov, 2001; Blagoderov et al., 2010; Stebner
et al., 2017; Blagoderov, 2020).
Короткие ротовые части среди Lygistorrhinidae можно встретить у рецентного рода
Seguyola Matile, 1990 (Blagoderov, 2017), у эоценового рода Parisognoriste Blagoderov
et al., 2010 (парижский янтарь) и у всех 5 родов из меловых янтарей. У всех у них ро-
товые части гораздо короче головы, а максиллярные щупики обычные, короткие и
многочлениковые (Blagoderov, Grimaldi, 2004; Blagoderov et al., 2010). Таким образом,
у Lygistorrhinidae удлинение ротовых частей и одночлениковых максиллярных щу-
пиков произошло лишь в кайнозое.
Cecidomyiidae - одно из самых крупных семейств двукрылых, включает более
6300 видов (Pape et al., 2011). Большинство взрослых галлиц не питаются и имеют
очень короткие ротовые части, но, как обычно, есть несколько исключений (см.
табл. 3).
Род Ozirhincus Rondani, 1840 - несомненный антофил, связанный с цветками
Anthemideae (Asteraceae). У 3 из 4 видов рода обнаружены заметные ротовые части,
превосходящие по длине голову, функция которых до сих пор неясна (Dorchin et al.,
2015). Уникальная комбинация длинного рострума, примерно равного по длине го-
лове, и таких же длинных узких лабеллумов, которые в два раза длиннее лабрума и
гипофаринкса, обнаружена у Contarinia prolixa Gagné et Byers, 1984, единственного из
300 видов рода; данных о питании этого вида нет. У Farquharsonia rostrata Collin,
1922 - третий вариант развития длинных ротовых частей, где основную роль играют
очень крупные опушенные лабеллумы, превышающие по длине голову. Эти галлицы
питаются жидкостью, которую отрыгивают муравьи (Gagné, Byers, 1984). Интересно,
что у комаров рода Malaya Leicester, 1908, ведущих аналогичный образ жизни, колен-
чатый длинный хоботок тоже густо опушен и дистально расширен (Coetzee, 2017:
fig. 31.30).
Галлицы известны начиная с границы юры и мела (Ковалев, 1990). Семейство
обильно представлено практически во всех янтарях мелового возраста (Arillo, Nel,
2000). Из балтийского янтаря их описывают с начала XX в. (Meunier, 1904), обнару-
жены галлицы и в других кайнозойских янтарях, например в мексиканском и домини-
канском (Fedotova, Perkovsky, 2019). Тем не менее, никаких указаний на наличие
длинных ротовых частей у вымерших галлиц нам обнаружить не удалось.
787
Sciaridae - широко распространенное семейство, включает чуть менее 2500 видов
(Pape et al., 2011). Ротовые части обычно короткие, как исключение - удлиненнные у
Eugnoriste Coquillett, 1896, причем у типового вида Eu. occidentalis Coquillett, 1896 хо-
боток в 3 с лишним раза длиннее головы, но у других видов может быть и короче го-
ловы. Ротовые части удлинены равномерно, с небольшими лабеллумами (Steffan, 1981:
fig. 3). Этот небольшой род (7 видов) отмечен на цветках, например, Adoxaceae и раз-
нообразных Asteraceae (Cockerell, 1897; Mohrig, Kauschke, 2017).
Самый древний представитель семейства описан из мелового бирманского янтаря, а
подавляющее большинство ископаемых сциарид известно из кайнозойских янтарей
(Camier, Nel, 2019). Никаких указаний на длинные ротовые части у вымерших сци-
арид нам обнаружить не удалось, а род Eugnoriste неизвестен в ископаемом состо-
янии.
Группа Heterotricha включает десяток редких родов Sciaroidea, большинство видов
в составе которых описано по единичным типовым экземплярам (Chandler, 2002).
Только у рода Rhynchoheterotricha Freeman, 1960 обнаружен очень длинный рострум,
при этом у типового вида Rh. stuckenbergae Freeman, 1960 рострум в 3 раза длиннее
головы (Jaschhof, 2017: fig. 23.1), тогда как у второго вида, Rh. chandeleri Hippa et
Vilkamaa, 2006 рострум отсутствует, а ротовые части короткие (Hippa, Vilkamaa, 2006).
Отмечено питание самцов Rh. stuckenbergae на цветках Ericaceae (Freeman, 1960),
других сведений о питании видов этого рода нет (Jaschhof, 2017). В ископаемом состо-
янии род Rhynchoheterotricha неизвестен. В составе этой группы описаны лишь
3 вымерших (эоценовых) вида Heterotricha Loew, 1850, все - с короткими ротовыми
частями (Meunier, 1904; Chandler, 2002).
Стоит упомянуть, что Rh. stuckenbergae обитает в финбоше - поясе вечнозеленой
кустарниковой растительности средиземноморского типа, растущей на бедных пес-
чаных почвах в Капской области ЮАР. В финбоше сконцентрировано небывалое коли-
чество длиннохоботковых родов, причем часто это уникумы в своих семействах, на
что обратил внимание Б. Штукенберг (Stukenberg, 1998). Именно здесь обитают и
другие уже упомянутые Nematocera (танидериды Peringueyomyina, мокрецы
Forcipomyia (Rhinohelea) briani) и низшие Brachycera: Arthroteles - единственный род
рагионид с очень длинными ротовыми частями, Moegistorhynchus longirostris - длин-
нохоботковая неместринида-рекордсмен, несколько видов длиннохоботковых слепней
Philoliche и вермилеонид Leptynoma Westwood, 1876.
Как ясно из приведенного обзора, удлиненные рострумы и хоботки у вымерших
Nematocera встречаются в тех же семействах, в которых они есть и сейчас. Нет ни од-
ного примера, когда какое-либо семейство обладало такими приспособлениями в про-
шлом, но не обладало бы им в настоящее время. Недавно длинный хоботок был указан
для юрской Chaoboridae (Labandeira, 2019: fig. 17.11а), но это сообщение основано на
ошибочной интерпретации рисунка при первоописании: без пересмотра материала за
хоботок была принята нога Dixamima villosa Rohdendorf, 1964 (Родендорф, 1964).
У большинства мезозойских хаоборид действительно довольно заметные ротовые
части (Лукашевич, 1996), но никаких хоботков ни у вымерших, ни у рецентных видов
пока не обнаружено.
Удлиненные ротовые аппараты, предназначенные для нектарофагии, возникали у
Nematocera от случая к случаю, на разной морфологической основе, часто в пределах
788
семейства в неродственных таксонах, иногда - только у единичных видов рода. В ходе
исторического развития Nematocera подобные морфологические инновации много-
кратно воспроизводились в разных семействах, но не приводили к мощной эволюци-
онной радиации, за исключением, возможно, Helius и нескольких других крупных
родов длиннохоботковых Limoniidae. Среди Nematocera есть лишь одно семейство
специализированных длиннохоботковых нектарофагов - Lygistorrhinidae, но и оно на-
считывает меньше десятка рецентных родов, причем длиннохоботковые формы появ-
ляются в этом семействе лишь в кайнозое.
2. Brachycera
В отличие от Nematocera, длинный склеротизованный рострум для Brachycera не ха-
рактерен, для нектарофагии им служат только удлиненные ротовые части, т. е. хоботок
в узком смысле слова. Хоботки Brachycera, предназначенные для извлечения трудно-
доступного нектара, можно опознать не только по относительной длине, но и по узким
лабеллумам с небольшим числом псевдотрахей (Зайцев, 1992; Gilbert, Jervis, 1998;
Krenn et al., 2005). В противоположность Nematocera, у Brachycera лабеллумы никогда
не вносят существенный вклад в удлинение хоботка, эту роль берет на себя прементум,
но, как и у Nematocera, ротовые части могут быть или равномерно удлиненными
(Empididae), или с коротким лабрумом и длинным лабиумом (Acroceridae). У коротко-
усых двукрылых наличие длинных и очень длинных хоботков характерно главным об-
разом для парафилетической группы прямошовных (Orthorrhapha), или низших
Brachycera. Для круглошовных (Cyclorrhapha) наиболее типичны короткие мясистые
хоботки с широкими лабеллумами, изобилующие псевдотрахеями. Такие хоботки
больше подходят для потребления нектара в открытых цветках, а также для сбора
пыльцы и подлизывания пищи с различных поверхностей. Виды с хоботками подоб-
ного строения (а также с редуцированным ротовым аппаратом) часто встречаются и
среди низших Brachycera, причем в тех же семействах, что и длиннохоботковые виды,
так что сама по себе принадлежность вымерших двукрылых к определенному семей-
ству при отсутствии сохранившихся ротовых частей мало что может сказать о способе
их питания.
Мы рассмотрим лишь те семейства Brachycera, чьи представители с удлиненными
ротовыми частями присутствуют в палеонтологической летописи.
Rhagionidae - единственное современное семейство мух, известное из самого древ-
него местонахождения двукрылых Вогезы во Франции (средний триас; Krzemiński,
Krzemińska, 2003). Это единственная находка семейства в триасе, а ее неполная со-
хранность может вызывать сомнения в принадлежности именно к этому семейству
(Blagoderov et al., 2007). Однако уже в ранней юре рагиониды были широко распро-
странены (известны из Германии и Индии; Ansorge, 1996; Mostovski, Jarzembowski,
2000; Krzemiński, Ansorge, 2005), а весь юрский период можно смело назвать временем
рагионид - они очень разнообразны и обычно доминируют по численности среди мух,
а в мелу постепенно сдают доминирующие позиции (Mostovski, 2009). Это реликтовое
семейство ныне включает лишь 16 родов, тогда как вымерших родов описано в два
раза больше, но они еще ожидают ревизии (Kerr, 2010; Pape et al., 2011; Zhang, 2013).
Данных о питании многих современных рагионид нет, но среди них встречаются
энтомофаги, гематофаги и единственный специализированный нектарофаг - длинно-
хоботковый южноафриканский эндемик Arthroteles Bezzi, 1926. Хоботок c равномерно
789
удлиненными ротовыми частями у большинства видов Arthroteles в 1.5-2 раза длиннее
головы вместе с клипеусом, но у A. longipalpis Nagatomi et Nagatomi, 1990 хоботок
чуть длиннее головы (Stuckenberg, 1956; Nagatomi, Nagatomi, 1990). Древнейший
представитель рагионид с относительно длинным хоботком, Elliprhagio macrosiphonius
Han et al., 2019, описан недавно из средней юры Китая. Хоботок у него довольно
тонкий, чуть короче головы. Авторы предполагают для этого вида кровососание (Han
et al., 2019), что сомнительно, поскольку мандибулы у него не обнаружены, а у ре-
центных рагионид-гематофагов Spaniopsis White, 1915 и Symphoromyia Frauenfeld,
1867 ротовые части мясистые и несут широкие лабеллумы, изобилующие псевдотра-
хеями (Kerr, 2010). Похожие мясистые ротовые части были описаны и у предполагае-
мого мезозойского гематофага Palaeoarthroteles mesozoicus Kovalev et Mostovski, 1997
(Ковалев, Мостовский, 1997; Лукашевич, Мостовский, 2003; рис. 11, 2, 3). Ничего по-
хожего не видно на опубликованной фотографии головы E. macrosiphonius (Han et al.,
2019: fig. 1B), а хоботок этого вида с узкими лабеллумами гораздо больше напоминает
хоботок A. longipalpis (Nagatomi, Nagatomi, 1990: fig. 6). Из этого же китайского место-
нахождения описана еще одна рагионида, Trichorhagio gregarius Zhang, 2013, с хо-
ботком и узкими лабеллумами, опушенными телом и ногами и максиллярными щупи-
ками, покрытыми длинными волосками (Zhang, 2013: fig. 1), - все эти признаки
характерны также для Arthroteles, поэтому нектарофагия у этих двух юрских родов
кажется гораздо более вероятным типом питания, чем гематофагия.
Tabanidae - космополитное семейство, насчитывающее более 4400 видов и из-
вестное с раннего мела (Мостовский и др., 2003; Pape et al., 2011). Слепни - хорошо
известные кровососы, пьют кровь млекопитающих, птиц и рептилий, при этом ак-
тивно посещают цветы. В семействе нередки и строгие нектарофаги (González, Floras,
2004), но исключительной длины достигают лишь хоботки видов с комбинированной
диетой. Род Philoliche Wiedemann, 1820 совмещает гематофагию с высокоспециализи-
рованной нектарофагией благодаря разделению хоботка на две функциональные
части: в состав базальной входят короткие колющие стилеты (включающие манди-
булы), а дистальная образована удлиненным прементумом, который погружается в
венчик цветка и отгибается в сторону при прокалывании кожи (Панов, 2008; Karolyi
et al., 2014). По абсолютной и относительной длине хоботка, который в 1.5-3 раза
длиннее тела, слепни рода Philoliche могут соперничать с длиннохоботковыми
Nemestrinidae, занимая в Южной Африке ту же экологическую нишу (Goldblatt,
Manning, 2000). Cамые обычные слепни, такие как Chrysops Meigen, 1803, у которых
колющий хоботок просто удлинен, но не подразделен на две части, тоже могут исполь-
зовать его двояким образом: чтобы добираться сквозь густую шерсть к коже и чтобы
извлекать нектар из глубоких околоцветников (Lall, Davies, 1971).
В связи с этими фактами не удивляет существование разноречивых интерпретаций
питания длиннохоботковых мезозойских Tabanomorpha. Так, длиннохоботковый вид
Palaepangonius eupterus Ren, 1998 из нижнего мела Китая изначально был отнесен
к подсем. слепней Pangoniinae, которое содержит вышеупомянутый род Philoliche, и
причислен к нектарофагам (Ren, 1998b). Д. Гримальди счел предположение об анто-
фильности Palaepangonius «неубедительным», указав, что данный род, скорее всего,
относится не к Pangoniinae (Tabanidae), а к Rhagionidae, для которых характерно хищ-
ничество и кровососание (Grimaldi, 1999). Но, очевидно, отнесение Palaepangonius к
рагионидам ничего не меняет в вопросе о его возможном типе питания, поскольку, как
и среди слепней, среди современных рагионид также есть нектарофаги. Позднее род
790
Рис. 11. Мезозойские длиннохоботковые Brachycera (Diptera).
1 - Buccinatormyia gangnami Khramov et Nam, 2019 (Zhangsolvidae), формации Чинджу (Южная Корея),
нижний мел; фото Г. С. Нама; 2, 3 - Palaeoarthroteles mesozoicus Kovalev et Mostovski, 1997 (Rhagionidae),
глушковская свита, верхняя юра (Россия, Читинская обл.).
ma - мандибула, остальные обозначения как на рис. 1-9.
Масштабная линейка: 1- 3 мм; 2 - 2 мм; 3 - 0.5 мм.
791
Palaepangonius вместе с некоторыми другими пробовали поместить в Athericidae (ан-
тофильное семейство; Larson et al., 2001), а сейчас Д. Гримальди рассматривает его
как базальную группу Tabanomorpha fam. indet. (Grimaldi, 2016). В недавней работе
Гримальди уже считает меловых Palaepangonius Ren, 1998 и Galloatherix Nel et al.,
2014 (почему-то без Atherhagious Grimaldi, 2016 с похожим хоботком) опылителями
(несмотря на обнаружение обеих пар колющих стилетов) и приводит в одном ряду с
Kalligrammatidae и Zhangsolvidae (Grimaldi et al., 2019: fig. 3).
Жесткие колющие стилеты обнаружены в хоботках несомненных Tabanidae этого
возраста (Мостовский и др., 2003, Grimaldi, 2016). Тем не менее, наличие колющих
элементов, предназначенных для хищничества или кровососания, не могло помешать
древнейшим хоботковым Tabanidae посещать и репродуктивные органы растений, так
что нет оснований исключать их из числа возможных нектарофагов. Это же можно
сказать и про длиннохоботковых Tabanidae кайнозойского возраста, таких как неопи-
санный слепень из эоценового ровенского янтаря (Pielowska et al., 2018: fig. 1F) и
слепни Stenotabanus Lutz, 1913 из миоценового мексиканского янтаря (Strelow et al.,
2013).
Nemestrinidae - космополитное семейство, включающее 300 видов (Pape et al.,
2011), прослеживается с ранней юры, но его самые древние представители, известные
по изолированным крыльям из Германии, остаются неописанными (Ansorge,
Mostovski, 2000). В этом рецентном семействе личинки паразитоидные, а имаго - об-
лигатные нектарофаги, часто с длинным хоботком, причем некоторые виды по его раз-
мерам затмевают всех остальных двукрылых. Самый яркий пример гипертрофирован-
ного удлинения ротовых частей - южноафриканский эндемик Moegistorhynchus
longirostris (Wiedemann, 1891), длина хоботка которого составляет 35-100 мм и может
в 4 раза превосходить длину остального тела. Этот вид опыляет (иногда - только он)
около 20 видов растений из семейств Iridaceae, Geraniaceae и Orchidaceae с глубоким
вытянутым венчиком, изредка конкурируя с длиннохоботковыми слепнями рода
Philoliche (Goldblatt, Manning, 2000; Bauder, Karolyi, 2019). У другой неместриниды
рода Prosoeca Schiner, 1867 из того же региона отношение длины хоботка к длине тела
колеблется от 1.5 до 2 (Karolyi et al., 2012; Barraclough et al., 2018).
Древнейшая неместринида с сохранившимся длинным хоботком найдена в верхней
юре Казахстана (Мостовский, 1998), правда, ротовые части у нее лежат не впереди го-
ловы, а вдоль груди, а потому сохранились плохо (рис. 12, 2, 3). Целые неместриниды
с хоботками найдены также в нижнемеловых отложениях Китая и Испании (Ren,
1998a; Mostovski, Martínez-Delclòs, 2000), но строение их ротовых частей нуждается в
переизучении. Стоит отметить, что в мезозое, как и сейчас, неместриниды были пред-
ставлены не только длиннохоботковыми, но и короткохоботковыми видами, что свиде-
тельствует о существовании различных трофических специализаций (Ansorge,
Mostovski, 2000; Liu, Huang, 2019).
Длиннохоботковые Nemestrinidae известны и из кайнозойских отложений, например,
Prosoeca florigera (Scudder, 1878) из эоцена Флориссанта (Bequaert, Carpenter, 1936).
Можно констатировать, что Nemestrinidae на протяжении всей своей длительной эво-
люционной истории (около 160 млн лет) никогда не покидали экологическую нишу,
связанную с эксплуатацией труднодоступных источников нектара, хотя спектр их кор-
мовых растений постоянно менялся, в особенности по мере вытеснения мезозойских
энтомофильных голосеменных современными группами цветковых.
792
Рис. 12. Длиннохоботковые Brachycera (Diptera) из верхней юры Каратау.
1 - Archocyrtus kovalevi (Nartshuk, 1996) (Acroceridae); 2, 3 - Protonemestrius rohdendorfi Mostovski, 1998
(Nemestrinidae), отпечаток (2) и противоотпечаток (3).
Стрелками отмечены хоботки.
Масштабная линейка: 1, 3 - 1 мм; 2 - 2 мм.
Сем. Acroceridae включает около 400 видов, резко различающихся по строению
ротовых частей имаго. У части акроцерид хоботки очень короткие или вообще отсут-
ствуют, а у других видов, напротив, хоботки могут по длине превосходить тело и
служат для питания на цветках с длинным шпорцем и глубоким венчиком (Borkent
et al., 2016). Древнейший представитель семейства, Archocyrtus kovalevi (Nartshuk,
1996) из верхней юры Казахстана, не уступал по длине хоботка наиболее длиннохо-
793
ботковым современным акроцеридам: 12-миллиметровый хоботок этого юрского вида
превышал по длине тело в 1.8 раза (Khramov, Lukashevich, 2019; рис. 12, 1). По отно-
сительной длине хоботка Archocyrtus превосходит всех остальных мезозойских насе-
комых, хотя абсолютная длина хоботков некоторых меловых каллиграмматид больше
(Khramov, Lukashevich, 2019). Archocyrtus kovalevi - это единственное известное длин-
нохоботковое двукрылое юрского возраста с хоботком, превосходящим по длине тело.
Из балтийского янтаря были описаны вымершие роды акроцерид Eulonchiella Meunier,
1912 и Prophilopota Hennig, 1966 с хоботками заметно длиннее головы, но не длиннее
брюшка (Gillung, Winterton, 2018). Наряду с Nemestrinidae, акроцериды, также ве-
дущие паразитоидный образ жизни на личиночной стадии, - это древнейшая группа
специализированных насекомых-нектарофагов, дожившая до настоящего времени,
хотя причины ее эволюционного долгожительства не вполне ясны.
Hilarimorphidae - монотипическое рецентное семейство, положение которого
среди Brachycera остается неопределенным. Рецентные виды рода Hilarimorpha
Schiner, 1860 встречаются на ивах и зонтичных, однако среди них нет обладателей
длинных хоботков. В составе Hilarimorphidae была описана двухмиллиметровая муха
Cretahilarimorpha lebanensis Myskowiak et al., 2016, единственный представитель
длиннохоботковых Brachycera, найденный к настоящему времени в меловом ливан-
ском янтаре (Myskowiak et al., 2016). Принадлежность этой мухи к данному семейству
вызывает сомнения (Grimaldi, 2016), а другие находки семейства в ископаемом состо-
янии неизвестны. Если принадлежность Cretahilarimorpha lebanensis к Hilarimorph-
idae подтвердится, это будет первый случай обнаружения длинного хоботка у
вымерших представителей рецентного короткохоботкового семейства Diptera
Brachycera.
Zhangsolvidae - единственное вымершее длиннохоботковое семейство Diptera. Оно
появилось в первой половине мелового периода и пережило кратковременный, но
бурный расцвет, превосходя по числу длиннохоботковых видов всех остальных мезо-
зойских Brachycera (табл.
5).
Джангсольвиды относятся к инфраотряду
Stratiomyomorpha, известному с ранней юры (Ansorge, Krzemiński, 1994). В состав
Stratiomyomorpha входят три ныне живущих семейства: Stratiomyidae, Xylomyidae и
Pantophthalmidae (Arillo et al., 2015). Среди современных стратиомиид, самого круп-
ного из этих семейств, есть множество антофильных видов, однако длинные хоботки
для них не характерны за редкими исключениями, такими как некоторые виды рода
Nemotelus Geoffroy, 1762 (Melander, 1903). У Zhangsolvidae ситуация прямо противо-
положная - хоботки длинные у всех 10 известных видов этого семейства (Khramov
et al., 2020).
Ни у одной из джангсольвид стилеты не обнаружены, что свидетельствует о некта-
рофагии как единственном способе их питания. Cratomyia mimetica Grimaldi, 2016 из
бирманского янтаря и Buccinatormyia gangnami Khramov et Nam, 2019 из нижнего
мела Южной Кореи несли на сегментах брюшка рисунок из светлых и темных пятен
(рис. 11, 1). Похожий рисунок украшает многих антофильных стратиомиид, сирфид и
других Brachycera, которые подражают жалящим перепончатокрылым, питающимся
на цветах (Grimaldi, 2016; Khramov et al., 2020). Наличие этого рисунка, как и пыльца
на теле (Peñalver et al., 2015), подтверждает, что джангсольвиды тоже были нектарофа-
гами, активными в дневное время. В некоторых местонахождениях джангсольвиды
достаточно многочисленны - например, в нижнемеловой формации Чинджу (Южная
794
Корея) по числу находок (15) они стоят среди двукрылых на втором месте после
Chaoboridae (А. Х., личные данные). Это говорит о том, что роль джангсольвид как
опылителей могла быть достаточно важной. Предполагается, что вымирание
джангсольвид во второй половине мелового периода было связано с исчезновением
пищевой базы - энтомофильных голосеменных (Zhang, Wang 2017), однако неясно,
почему по той же причине не вымерли также другие древние облигатные нектаро-
фаги - акроцериды и неместриниды.
Bombyliidae - одно из самых крупных семейств антофильных двукрылых, включа-
ющее почти 5400 видов. Их имаго сегодня - облигатные нектарофаги, чей рацион до-
полняет пыльца (Панов, 2007), а на личиночной стадии бомбилииды, так же как акро-
цериды и неместриниды, ведут паразитоидный образ жизни. Утверждается, что среди
современных двукрылых по опылительной активности сем. Bombyliidae стоит на
втором месте после Syrphidae (Grimaldi, 1999). В Кении бомбилииды превосходят всех
остальных двукрылых по количеству переносимой за один визит пыльцы (Willmer
et al., 2017). В умеренном климате бомбилииды выступают в роли опылителей-генера-
листов (Kastinger, Weber, 2001). Длина хоботка у различных видов бомбилиид варьи-
рует «чрезвычайно» (Yeates, 1994), однако никогда не бывает экстремальной. Обычно
у длиннохоботковых бомбилиид хоботок всего в 2.4-4.8 раза превышает по длине го-
лову (Зайцев, 1992, с. 152), изредка превышая длину тела (Marshall, Kirk-Spriggs, 2017:
fig. 4.1). Это можно объяснить тем, что бомбилииды, в отличие от акроцерид и не-
местринид, из-за особенностей строения головной капсулы не могут подгибать хо-
боток под тело и даже в полете вынуждены держать его торчащим вперед (Зайцев,
1992, с. 163), что делает невозможным чрезмерное удлинение этого органа. Впрочем,
данное объяснение работает лишь отчасти, поскольку Pangoniinae (Tabanidae) также
неспособны подгибать хоботок (Karolyi et al., 2012), однако это не помешало неко-
торым из них, как было сказано выше, удлинить его до чрезвычайной степени.
Несмотря на обилие длиннохоботковых видов в современной фауне, не обнаружено
ни одного мезозойского представителя бомбилиид с удлиненными ротовыми частями,
хотя эти мухи известны со средней юры (Калугина, Ковалев, 1985), найдены в раннем
мелу (Монголия; Ковалев, 1986), и более десятка видов описано из таймырского и
бирманского меловых янтарей (Зайцев, 1986; Grimaldi et al., 2011; Grimaldi, 2016; Ye
et al., 2019; Ngô-Muller et al., 2020). Подсемейственная принадлежность некоторых ме-
зозойских бомбилиид неясна, но большинство относится к базальному подсем.
Mythicomyiinae. Как и среди более продвинутых бомбилиид, среди современных
Mythicomyiinae также встречаются виды с длинным хоботком (Evenhuis, 2007), так
что если бы не отсутствие находок, существование таких видов теоретически можно
было бы предположить и для мезозоя.
Полное отсутствие длиннохоботковых бомбилиид в мезозое резко контрастирует с
их обилием в кайнозое (рис. 13, 1, 3, 4), когда появляются другие современные подсе-
мейства (Nel, de Ploëg, 2004; Nel, 2006, 2008; Wedmann, Yeates, 2008; Maheu, Nel,
2020). Бомбилииды с хоботком длиннее головы присутствуют в эоценовых француз-
ском и балтийском янтарях (Hennig, 1966; Nel, 2006) и разнообразны в эоцене
США (Cockerell, 1909; Melander, 1949; Evenhuis, 1984; Labandeira, 2005: fig. 9.6;
Greenwalt et al., 2015). Как и у пчел, быстрая радиация продвинутых (не относящихся
к Mythicomyiinae) бомбилиид в кайнозое стала ответом на экспансию цветковых рас-
тений (Nel, 2008). Возможно также, что одновременный эволюционный «взлет» двух
795
Рис. 13. Кайнозойские длиннохоботковые Brachycera (Diptera).
1 - Pachysystropus rohweri Cockerell, 1909 (Bombyliidae), Флориссант (США), терминальный эоцен,
YPM IP 026175; фото Г. В. Мейера; 2 - Empis sp. (Empididae) (определение И. В. Шамшева), Флориссант
(США), терминальный эоцен; фото Р. Вольфа; 3 - Eoanomala melas Greenwalt et Evenhuis, 2015 (Bombyli-
idae), формация Кишенен (США), средний эоцен, фото Д. Гринволта; 4 - Elektrophthiria magnifica
Nel, 2006 (Bombyliidae), янтарь Уазы (Франция), нижний эоцен; фото Г. Дойте.
Обозначения как на рис. 1-9.
Масштабная линейка: 1 - 3 мм; 3 - 2 мм; 4 - 1 мм; для 2 отсутствует.
этих антофильных групп был не просто совпадением, поскольку пчелы выступают в
качестве основного хозяина для паразитоидных личинок многих бомбилид (Yeates,
Greathead, 1997), и, следовательно, расцвет первых мог повлечь за собой и расцвет
вторых. Интересно, что современные бомбилииды наиболее разнообразны и обильны
в тех же засушливых и жарких биотопах средиземноморского типа, что и пчелы, и по-
добно пчелам исчезают в высоких широтах и в высокогорьях, уступая место другим
семействам антофильных Brachycera (Kearns, 1992).
Empididae s. l. - это наиболее обычные длиннохоботковые антофилы из числа
низших Brachycera в умеренном поясе. Этих некрупных и среднего размера мух, чей
хоботок по длине в 2-3 раза превосходит голову (например, у рода Empis), можно в
большом количестве встретить на самых разных цветах (Гринфельд, 1978, с. 122-123),
хотя степень их участия в опылении и питании нектаром до сих пор остается малоизу-
ченной. Некоторые толкунчики совмещают хищничество с нектарофагией, используя
хоботок как для прокалывания покровов других насекомых, так и для извлечения нек-
798
тара и пыльцы (Downes, Smith, 1969), причем обнаружены и нектарные грабители
(Sinclair, Daugeron, 2017: fig. 51.6).
Вымершее подсемейство Protempidinae, известное с юры (Mostovski, 1999), вряд ли
относится к Empididae (Grimaldi, Cumming, 1999; И. В. Шамшев, личное сообщение).
Настоящие Empididae становятся многочисленными и разнообразными в раннем мелу,
часто доминируя среди Brachycera (Coram et al., 2000; Mostovski, 2009). Из позднего
мела описаны представители подсем. Empidinae (Grimaldi, Cumming, 1999), в котором
сейчас сосредоточена основная масса длиннохоботковых форм, включая антофильный
длиннохоботковый род Empis L., известный по отпечатку мухи без головы (Waters,
1989), а также экземпляр Empididae incertae sedis с относительно длинным хоботом,
по-видимому, равным по длине голове (Mostovski, 2009: fig. 2D). Несмотря на обилие
эмпидид в меловом периоде, среди них до сих пор не найдено ни одного вида с хо-
ботком длиннее головы, хотя в кайнозое такие находки достаточно обычны
(рис. 13, 2). Например, у Rhamphomyia craterae Melander, 1949 из терминального
эоцена Флориссанта хоботок в 3 раза длиннее головы (Melander, 1949), длиннохобот-
ковые толкунчики Empis есть и в балтийском янтаре (Penney, Jepson, 2014: fig. 205).
Можно предположить, что возникновение длиннохоботковых форм среди Empididae,
как и среди Bombyliidae, было связано с распространением цветковых растений. Для
прокалывания тонкой кутикулы насекомых длинный хоботок не требуется: многие со-
временные энтомофаги из числа двукрылых (например, Asilidae) обходятся коротким
хоботком, как это было характерно и для Empididae до того, как нектар стал важным
дополнением к их плотоядной диете. Впрочем, не очень понятно, почему Empididae и
Bombyliidae не обзавелись длинными хоботками еще в мезозое и не начали кормиться
на энтомофильных мезозойских голосеменных, как это сделали их ровесники
Nemestrinidae, Acroceridae и Zhangsolvidae.
Изолированные головы длиннохоботковых низших Brachycera. Находки изоли-
рованных крыльев, по которым можно с некоторыми оговорками определить система-
тическую принадлежность, но нельзя установить тип питания, - это привычное яв-
ление для палеоэнтомологов. С изолированными головами длиннохоботковых
Brachycera ситуация прямо противоположная - остается только догадываться, к каким
семействам принадлежали соответствующие двукрылые, однако в их нектарофагии
сомневаться не приходится. Одна из таких голов (ПИН 5340/2662) в 2019 г. была най-
дена авторами настоящей статьи в нижнемеловом местонахождении Хасурты (Россия,
Забайкалье). Она несет хоботок длиной 5.7 мм, который в 2.3 раза превосходит по
длине голову (рис. 14, 1). Лабрум достаточно короткий, лабеллумы узкие, что типично
для нектарофагов, а дистальная часть хоботка образована прементумом, как у многих
низших Brachycera, в частности у длиннохоботковых неместринид (Karolyi et al.,
2012). Из этого местонахождения известна единственная неместринида, относящаяся
к роду Protonemestrius Rohdendorf, 1968, у позднеюрских представителей которого об-
наружен длинный хоботок (Мостовский, 1998), но у Protonemestrius sp. из Хасурты
голова не сохранились. Кроме того, лабиум неместринид обычно склеротизован, а для
антенн характерен тонкий стилус, тогда как на отпечатке видна одна антенна с до-
вольно гомономными многочисленными (5?) члениками, а прементум несомненно
был слабосклеротизованный и опушен редкими короткими волосками, что при по-
добном удлинении встречается довольно редко. Подобное сочетание признаков из-
вестно в другом семействе, Austroleptidae, у рода Austroleptis Hardy, 1920 (Fachin et al.,
2018), например, у длиннохоботкового вида A. longirostris Fachin et al., 2018. Этот род
799
Рис. 14. Головы длиннохоботковых Brachycera (Diptera) из нижнего мела Забайкалья.
1 - ?Austroleptidae, Хасурты, ПИН 5340/2662; 2 - Mydidae, по: Labandeira et al., 2007, Байса,
ПИН 3064/9930; 3 - Apioceridae, по: Labandeira, 2005, Байса, ПИН 4210/6380; 4 - Nemestrinidae,
по: Mostovski, Martínez-Delclòs, 2000 или Mydidae, по: Labandeira et al., 2007, Байса, ПИН 3064/9690.
Обозначения как на рис. 1-9.
Масштабная линейка: 1, 2, 4 - 1 мм; 3 - 2 мм.
800
ныне выделяется в монотипическое семейство, но еще совсем недавно рассматривался
в рамках Rhagionidae (Kerr, 2010). При многочисленности и разнообразии крыльев ра-
гионидного типа в местонахождении Хасурты эта версия не кажется неправдопо-
добной и нуждается в дальнейшей проверке.
Несколько изолированных голов c хоботками разной длины уже были описаны из
нижнего мела Забайкалья. Вначале без каких-либо объяснений одна голова (рис. 14, 3)
отнесена к Nemestrinidae (Mostovski, Martínez-Delclòs, 2000: fig. 22), позже она и две
другие (рис. 14, 2, 3) - к Apioceridae или Mydidae (Labandeira, 2005: fig. 9.5, D-G;
Labandeira et al., 2007: fig. 4, J-L). Хотя во всех 3 семействах немало длиннохобот-
ковых нектарофагов, оснований для таких отнесений пока явно недостаточно и при-
надлежность голов остается под вопросом до обнаружения целых экземпляров.
Cyclorrhapha. На круглошовных мух приходятся, по некоторым подсчетам, 91 из
117 семейств и две трети видового разнообразия современных Brachycera (Wiegmann
et al., 2011). В отличие от прямошовных Brachycera, хоботок круглошовных мух в со-
стоянии покоя способен полностью втягиваться в головную капсулу, даже если он
в развернутом виде по длине существенно превосходит голову, как, например, у
Rhingia Scopoli, 1763 и ряда других Syrphidae. Это происходит благодаря вворачиваю-
щейся мембранозной вставке между стенкой головной капсулы и прементумом. В по-
смертном состоянии хоботок круглошовных мух чаще всего втянут, так что его ре-
альную длину довольно затруднительно установить даже у наколотых современных
экземпляров, не говоря уже об ископаемых находках.
Лишь у некоторых Cyclorrhapha подвижный и мясистый хоботок, в целом харак-
терный для этой группы, благодаря сильной склеротизации и одновременному удли-
нению гаустеллума и лабеллумов становится жестким и невтяжным, в этом отно-
шении приближаясь к хоботку длиннохоботковых низших Brachycera. Длинные
жесткие хоботки среди Cyclorrhapha встречаются не только у кровососущих видов,
таких как хорошо известные Glossina Wiedemann, 1830 и Stomoxys Geoffroy, 1762, но у
и ряда нектарофагов, питающихся на цветах с глубоким венчиком. В особенности
длиннохоботковость типична для Tachinidae (Allen, 1929; Andersen, 1982; Gilbert,
Jervis, 1998) - это семейство благодаря сочетанию паразитоидных личинок и анто-
фильных длиннохоботковых имаго, характерных для ряда родов, можно рассматри-
вать как своеобразный аналог Nemestrinidae и Bombyliidae среди Cyclorrhapha. Некта-
рофаги с длинным склеротизованным хоботком есть также среди Conopidae и Phoridae
(Гринфельд, 1978, с. 124-125; Gilbert, Jervis, 1998). Теоретически, ротовые части таких
длиннохоботковых Cyclorrhapha должны хорошо сохраняться в ископаемом виде.
В большинстве современных экосистем антофильные круглошовные мухи по
обилию и активности превосходят низших Brachycera. Во многом первенство
Cyclorrhapha в этой экологической нише достигается за счет мух-журчалок (Syrph-
idae), которые по значимости стоят на первом месте среди всех антофильных дву-
крылых (Larson et al., 2011). Например, на журчалок приходится 16 % совокупной
массы пыльцы, транспортируемой всеми двукрылыми на английских сельхозугодиях
(Orford et al., 2015). Журчалки сопоставимы с пчелами, не относящимися к Apis
melifera, по числу визитов к цветам целого ряда сельскохозяйственных культур (Rader
et al., 2016). Высшие Cyclorrhapha также очень часто посещают цветы - например,
представители Calyptratae, такие как Muscidae, Tachinidae, Calliphoridae и Anthomyi-
801
idae, доминируют в качестве опылителей в арктических и альпийских экосистемах
(Kearns, 1992; Larson et al., 2011).
По сравнению с современной диптерофауной в мезозое доля представителей
Cyclorrhapha среди Brachycera была пренебрежимо мала. Древнейшие круглошовные
мухи известны с раннего мела, однако вплоть до начала кайнозоя они были представ-
лены лишь базальными семействами, объединяемыми в парафилетическую группу
Aschiza, такими как Opetiidae, Platypezidae, Phoridae и Lonchopteridae (Grimaldi,
Cumming, 1999; Coram et al., 2000). Выраженных антофильных адаптаций среди этих
меловых Aschiza не отмечалось. Сирфиды также относятся к Aschiza и, теоретически,
они могли появиться в рамках меловой радиации данной группы, а их обнаружение в
позднем мелу было недавно предсказано (Grimaldi, 2018). Тем не менее, до сих пор не
найдено ни одной сирфиды мелового возраста, в ископаемом состоянии они известны
лишь с эоцена (Nidergas et al., 2018). Из бирманского янтаря по единственному самцу
описан род Prosyrphus Grimaldi, 2018, который относят к предковой группе Syrphidae
из-за отсутствия у него некоторых апоморфий семейства в жилковании (Grimaldi,
2018). Единственная предполагаемая меловая сирфида из таймырского янтаря - это
экземпляр плохой сохранности с отсутствующими крыльями, относящийся предполо-
жительно к Platypezoidea (Popov, 2015). Отсутствие сирфид в мелу резко контрасти-
рует с их обилием и разнообразием в кайнозое. К настоящему моменту описано более
100 видов кайнозойских сирфид (Nidergas et al., 2018), только в коллекциях балтий-
ского янтаря насчитывается более 150 мух этого семейства (Hull, 1945).
Радиация круглошовных мух из группы Schizophora пришлась на кайнозой
(Wiegmann et al., 2011). Палеонтологическая летопись основных антофильных се-
мейств из числа Schizophora весьма скудна, что, по-видимому, означает сравнительно
недавнее происхождение этих семейств. В частности, древнейшие Conopidae и древ-
нейшие Calyptratae в лице Anthomyiidae известны из балтийского янтаря (Michelsen,
2000; Rocha et al., 2015). Если не считать кровососущих мух рода Glossina из терми-
нального эоцена Флориссанта (Smith, Moe-Hoffman, 2007, fig. 3F), ископаемые кругло-
шовные мухи с сохранившимися длинными хоботками, насколько нам известно, до
сих пор не обнаружены. В любом случае не вызывает сомнений, что длиннохоботко-
вость у Cyclorrhapha возникла в кайнозое и связана с питанием на цветковых расте-
ниях.
Из вышесказанного очевидно, что в ходе эволюции Brachycera длинные хоботки для
питания нектаром возникали неоднократно, зачастую по нескольку раз в пределах од-
ного и того же семейства. В мезозое экологическая ниша длиннохоботковых нектаро-
фагов была занята исключительно низшими Brachycera, такими как Nemestrinidae,
Acroceridae, Zhangsolvidae и, возможно, Tabanomorpha. Эта когорта длиннохоботковых
Brachycera возникновением удлиненных ротовых частей почти наверняка обязана ме-
зозойским энтомофильным голосеменным. Вторая когорта длиннохоботковых
Brachycera появилась в кайнозое и с самого начала была связана с цветковыми. По-
мимо всех антофильных Cyclorrhapha в эту кайнозойскую когорту входит ряд низших
Brachycera (Bombyliidae, Empididae), которые обзавелась длинными хоботками с
большим запозданием, хотя их эволюционная история простирается далеко в мезозой.
Отмечалось, что частота находок Bombyliidae в кайнозое возрастает, тогда как находки
Nemestrinidae идут на спад (Nel, 2008). Действительно, хотя некоторые представители
мезозойской длиннохоботковой когорты (Nemestrinidae, Acroceridae, Tabanomorpha)
802
смогли переключиться на питание нектаром цветковых растений, по сравнению с кай-
нозойской когортой нектарофагов в настоящее время они играют подчиненную роль.
V. Lepidoptera
Чешуекрылые (Lepidoptera) - самая разнообразная группа ныне живущих хобот-
ковых нектарофагов (Wardhaugh, 2015). Этот отряд, в ископаемом виде известный с
терминального триаса и ранней юры, включает 124 семейства и около 160 000 опи-
санных видов (Kristensen et al., 2007), больше 99.9 % из которых относятся к группе
Glossata, чьим главным отличительным признаком служит наличие хоботка. Если
у перепончатокрылых, сетчатокрылых и скорпионниц в ходе эволюции хоботки неза-
висимо появлялись несколько раз, то у чешуекрылых возникновение хоботка было од-
нократным событием (Krenn et al., 2005). Поэтому, в отличие от многих других хобот-
ковых нектарофагов, хоботки которых в пределах отряда значительно варьируют по
набору составных элементов, их пропорциям и функциональной роли, план строения
хоботка у всех Glossata единообразен и включает две удлиненных галеа, формиру-
ющих единый пищевой канал (за исключением базальных семейств, таких как
Neopseustidae и Eriocraniidae, у которых галеа отстоят друг от друга при питье). Име-
ются также лабиальные и максиллярные щупики (последние чаще всего редуциро-
ваны). Все остальные элементы ротовые частей, включая мандибулы, у Glossata под-
верглись редукции. Хорошо развитые, функциональные мандибулы есть только у
бесхоботковых (non-Glossatan) молей, в настоящее время представленных 3 неболь-
шими семействами: Micropterigidae, Agathiphagidae и Heterobathmiidae.
Важная особенность хоботковых чешуекрылых - способность спирально сверты-
вать хоботок в нерабочем состоянии. У наиболее базальных Glossata, таких как
Eriocraniidae, скручивание хоботка достигается лишь за счет эластичной кутикулы,
тогда как у всех остальных семейств, объединяемых в группу Myoglossata, хоботок
многократно скручивается за счет внутренней мускулатуры галеа (Krenn, Kristensen,
2004). Благодаря такой мускулатуре Myoglossata получили возможность практически
неограниченного удлинения хоботка, не сталкиваясь с неудобствами, какие мог бы вы-
зывать этот орган, оставаясь все время в распрямленном состоянии, как у некоторых
длиннохоботковых мух (Nemestrinidae, Acroceridae, Tabanidae: Pangoniinae) и пчел
(Apidae: Euglossini). Кроме того, продвинутые Myoglossata приобрели дополни-
тельный ряд вентральных легул (зубцов) на галеа, что обеспечило более герметичное
замыкание пищевого канала и открыло новые возможности для нектарофагии. Чешуе-
крылых с таким усовершенствованным запирающим механизмом хоботка объединяют
в группу Eulepidoptera, в которую входят практически все Myoglossata, за исключе-
нием десяти базальных семейств, таких как Nepticulidae (Krenn, Kristensen, 2000;
Krenn, 2010).
Благодаря вышеперечисленным особенностям современные продвинутые
Eulepidoptera из группы Apoditrysia по абсолютной и относительной длине хоботка
превосходят всех остальных насекомых-нектарофагов, что дает им доступ к труднодо-
ступным источникам нектара, таким как очень длинные шпорцы тропических ор-
хидей. У южноамериканского бражника Amphimoea walkeri (Boisduval, 1875), рекорд-
смена в данном отношении, предельная длина хоботка составляет 280 мм, у ряда
других тропических бражников хоботки достигают сравнимых значений, в расправ-
ленном виде в 3-4 раза превосходя остальное тело по длине (Miller, 1997) и в состо-
803
янии покоя скручиваясь не менее чем в 20 оборотов (Müller, 1873). У южноамерикан-
ского вида Damas immaculata Nicolay, 1973 (Hesperiidae), дневной бабочки с самым
длинным хоботком, длина этого органа достигает 52 мм, что в 2.4 раза превышает
длину тела (Bauder et al., 2014). Количество оборотов хоботка у Hesperiidae в состо-
янии покоя достигает 7.5 (Krenn, Bauder, 2017).
Скудость палеонтологической летописи чешуекрылых уже давно стала притчей во
языцех (Козлов, 1988). Крыловые чешуйки препятствует быстрому намоканию и по-
гружению этих насекомых на дно, что необходимо для захоронения в виде каменных
отпечатков. Эта же особенность затрудняет прилипание чешуекрылых к натекам
смолы, что снижает их встречаемость в янтарях. Кроме того, из-за чешуек на ископа-
емых чешуекрылых плохо различимо жилкование и другие диагностические при-
знаки, что усложняет их определение. В результате по числу описанных ископаемых
видов отряд Lepidoptera в 10 раз уступает Hymenoptera и в 16 раз - Diptera, хотя совре-
менное видовое разнообразие этих трех отрядов сопоставимо (Pape et al., 2011; Aguiar
et al., 2013; Sohn et al., 2015). Относительная немногочисленность ископаемых чешуе-
крылых всегда делала их благодатным материалом для подготовки многочисленных
обзорных статей (Shields, 1976; Whalley, 1986; Козлов, 1988; Skalski, 1990). Самые
свежие из таких обзоров были опубликованы совсем недавно (Sohn et al., 2012; Sohn,
Lamas, 2013; Sohn et al., 2015; De Jong, 2017), что избавляет нас от необходимости
прослеживать палеонтологическую летопись отдельных надсемейств, ограничившись
обсуждением ключевых моментов эволюции ротовых частей отряда в целом. В своем
обзоре мы будем следовать схеме классификации чешуекрылых, разработанной
Н. П. Кристенсеном с соавт. (Kristensen et al., 2007).
Древнейшие чешуекрылые, известные по отпечаткам тел и крыльев, найдены в
ранней юре - как и большинство мезозойских представителей отряда, они относятся к
бесхоботковым молям (Sohn et al., 2012). Свидетельства существования Glossata до на-
чала мелового периода крайне незначительны. Предполагаемые крыловые чешуйки
Glossata обнаружены в терминальном триасе вместе с чешуйками бесхоботковых
молей (Van Eldijk et al., 2018). Древнейшей описанной находкой Glossata с сохранив-
шимся телом считается Protolepis cuprealata Kozlov, 1989 неясной семейственной при-
надлежности из верхней юры Каратау. Тем не менее, переизучение голотипа данного
вида не позволило с уверенностью подтвердить наличие у него хоботка (М. Хейккила,
личное сообщение).
Начиная с раннего мела, находки Glossata становятся более многочисленными и
определенными. Представители базального сем. Eriocraniidae с удлиненными галеа,
не соединенными в общий хоботок, описаны из нижнего мела Забайкалья (Kopylov
et al., 2020). Неописанная гусеница хоботковых бабочек найдена в ливанском янтаре
(Grimaldi, 1999: fig. 12e), там же обнаружены крыловые чешуйки, возможно, принад-
лежащие представителю сем. Incurvariidae (Whalley, 1986), хотя их идентификация
вызывает вопросы (Козлов, 1988). Неописанные имаго Lophocoronidae и Incurvariidae
указывались из верхнемелового таймырского янтаря (Skalski, 1979). Головная капсула
гусеницы, предположительно относящейся к Tineoidea (Скальски, 1979), найдена в ка-
надском янтаре (Mackay, 1970). В США фрагмент оболочки яйца совки (Noctuidae)
найден при просеивании верхнемеловых глин (Gall, Tiffney, 1983), однако единич-
ность этой находки заставляет подозревать современное загрязнение. Неописанные
Glossata с сохранившимся коротким хоботком присутствуют как в бирманском янтаре
804
Рис. 15. Ископаемые и субфоссильные Papilionoidea (Lepidoptera) с сохранившимися
хоботками.
1 - Oligodonta florissantensis Brown, 1976 (Nymphalidae), Флориссант, терминальный эоцен,
FLFO-108/UF-21998; фото Г. В. Мейера; 2 - ?Pieridae, танзанийский копал, плейстоцен (определение
А. В. Крупицкого), YPM IP 238406; фото С. Х. Батс; 3 - Voltinia dramba Hall et al., 2004 (Riodinidae),
доминиканский янтарь, миоцен; фото Дж. П. В. Холла.
Стрелками отмечены хоботки.
Масштабная линейка: 1, 3 - 5 мм; 2 - 3 мм.
805
(Grimaldi et al., 2002: fig. 42d), так и в верхнемеловом янтаре Нью-Джерси (Grimaldi,
1999: fig. 12e). Также из бирмита было описано чешуекрылое Tanyglossus orectometopus
Poinar, 2017, отнесенное к Douglasiidae (Gracillarioidea). Утверждается, что оно обла-
дало хоботком длиной 1.6 мм, превосходящим по длине тело (Poinar, 2019). Однако
длинная прямая структура, тянущаяся под брюшком, которую Дж. Пойнар считает хо-
ботком, не похожа на хоботок чешуекрылых, полностью или частично свернутый в
состоянии покоя или post mortem. Кроме того, хоботки таких пропорций, насколько
нам известно, никогда не встречаются у современных базальных Microlepidoptera.
Чтобы уточнить строение ротовых частей данного чешуекрылого и определить его си-
стематическое положение, необходимо переизучение голотипа.
Помимо телесных остатков имаго и личинок на существование Glossata в мелу ука-
зывают также ихнологические данные. Многочисленные следы минирования гусени-
цами Nepticulidae были найдены на листьях покрытосеменных из верхнего мела
США и Казахстана (Doorenweerd et al., 2015). Повреждения листьев, связанные с дея-
тельностью гусениц Incurvarioidea, отмечены из верхнего мела Израиля (Krassilov,
Shuklina, 2008). Из этих же местонахождений указывалась также листовая флора с хо-
дами минеров из надсем. Gracillarioidea - мины Bucculatricidae из верхнего мела Ка-
захстана (Козлов, 1988) и мины Gracillariidae из верхнего мела США (Labandeira et al.,
1994), хотя надежность идентификации последних ставилась под сомнение (Grimaldi,
1999).
Пищевое поведение имаго современных низших Glossata изучено недостаточно. Не-
многие имеющиеся наблюдения свидетельствуют, что эти чешуекрылые используют
свои короткие хоботки не для высасывания труднодоступного нектара, а для погло-
щения различных жидкостей, выступающих на поверхность, таких как вода и расти-
тельный сок в случае Eriocraniidae (Krenn, Kristensen, 2000) или выделения экстрафло-
ральных нектарников в случае Nepticulidae (Downes, 1968). Предполагается поэтому,
что изначально хоботок появился у чешуекрылых не в связи с нектарофагией, а как
средство для быстрого восполнения дефицита воды (Стекольников, Корзеев, 2007).
Если двигаться в восходящем направлении по системе отряда, то нектарофагия у че-
шуекрылых наблюдается лишь с уровня Incurvarioidea, т. е. с самых базальных
Eulepidoptera (Krenn, Kristensen, 2000). Однако эта группа, в мезозое представленная
надсемействами Incurvarioidea, Tineoidea и Gracillarioidea, как явствует из только что
приведенного обзора ископаемых находок, отмечается лишь с верхнего мела, причем
только по косвенным свидетельствам, весьма фрагментарным и ненадежным - пока
достоверно не описано ни одного имаго мезозойских Eulepidoptera. Таким образом,
можно констатировать, что в мезозое чешуекрылые еще не освоили нишу хоботковых
нектарофагов или же их роль в этом качестве была крайне незначительна.
Практически полное отсутствие хоботковых чешуекрылых, в особенности
Eulepidoptera, в крупных мезозойских лагерштеттах нельзя полностью списать на их
низкий тафономический потенциал, поскольку в кайнозое в тех же обстановках они
представлены уже гораздо лучше, хотя, конечно, не так обильно, как другие насе-
комые. По числу экземпляров мезозойские чешуекрылые составляют всего 2 % от
более чем 4200 представителей этого отряда, найденных в ископаемом состоянии -
остальные 98 % приходятся на кайнозой (Sohn et al., 2015). Именно в кайнозое, судя
по ископаемым данным, появилось большинство эулепидоптерных надсемейств из
группы Ditrysia, которая в настоящее время включает 98 % видов всех чешуекрылых.
806
Если верить редким косвенным и весьма небесспорным свидетельствам на этот счет,
то в мезозое Ditrysia были представлены лишь базальными надсемействами Tineoidea
и Gracillarioidea, тогда как уже с раннего эоцена по отпечаткам тел и крыльев известны
продвинутые представители этой группы, объединяемые в группу Apoditrysia, куда от-
носятся все макролипедоптеры. За счет дополнительной мускулатуры хоботок
Apoditrysia отличается повышенной подвижностью, необходимой для антофилии
(Стекольников, Корзеев, 2007). В большинстве случае хоботок у этой группы чешуе-
крылых используется для потребления нектара, однако он также может применяться
для сбора пыльцы, прокалывания фруктов, кровососания, клептопаразитизма, а также
для высасывании пота, мочи, слезных выделений и при посещении грязи, трупов, от-
крытых ран и экскрементов (Downes, 1973; Büttiker et al., 1996).
Не считая балтийского янтаря, из всех кайнозойских местонахождений ископае-
мыми чешуекрылыми наиболее богата датская формация Фур, датируемая поздним
палеоценом - ранним эоценом. Из нее происходят древнейшие находки ряда надсе-
мейств Apoditrysia, таких как Pyraloidea (Heikkilä et al., 2018) и Papilionoidea (De Jong,
2016), причем первые - с сохранившимся хоботком. В балтийском янтаре преобла-
дают микролепидоптеры, среди которых попадаются длиннохоботковые формы, такие
как Tortricidae (Козлов, 1988). Бабочки сем. Nymphalidae с сохранившимися хобот-
ками, Lethites reynesii (Scudder, 1872) и Oligodonta florissantensis Brown, 1976, найдены
в верхнем олигоцене Франции и терминальном эоцене США соответственно (Scudder,
1875, Pl. I: fig. 2; De Jong, 2017: fig. 8; рис. 15, 1). Бабочка Voltinia dramba Hall et al.,
2004 (Riodinidae) с длинным хоботком описана из доминиканского янтаря (Hall et al.,
2004; рис. 15, 3). Неописанный представитель предполагаемой Pieridae с хорошо со-
хранившимся хоботком найден в танзанийском копале (рис. 15, 2). Поскольку хоботки
ископаемых бабочек, как правило, находятся полностью или частично в свернутом со-
стоянии, их точную длину установить затруднительно. В любом случае эти и другие
находки красноречиво свидетельствуют, что чешуекрылые, включая макролепидоптер,
все-таки регулярно попадают в палеонтологическую летопись. Поэтому сделанный на
основе молекулярных данных вывод о том, что основная радиация Ditrysia (включая
даже дневных бабочек!) произошла уже в раннем мелу в ходе коэволюции с ранними
покрытосеменными (Wahlberg et al., 2013), опровергается полным отсутствием иско-
паемых находок соответствующего возраста. Вместо коэволюционного сценария для
Ditrysia надо предполагать быструю колонизацию уже имевшегося разнообразия по-
крытосеменных, сложившегося к началу кайнозоя.
VI. Hymenoptera
Перепончатокрылые - это один из наиболее разнообразных отрядов насекомых, на-
считывающий более 152 000 описанных видов в составе 130 семейств (Aguiar et al.,
2013) и существующий с позднего триаса (Расницын, 1980). Нектар и пыльца состав-
ляют основу рациона многих, если не большинства, взрослых перепончатокрылых,
включая группы с паразитоидными и плотоядными личинками. Особенность строения
ротового аппарата перепончатокрылых заключается в том, что даже при наличии хо-
ботка у них сохраняются функциональные грызущие мандибулы.
Длинные хоботки различного строения, предназначенные для эксплуатации трудно-
доступных источников нектара, неоднократно возникали в разных ветвях этого отряда
на основе лабиомаксиллярного комплекса. В частности, длинные хоботки имеются у
807
отдельных родов пилильщиков семейств Pergidae и Tenthredinidae (Houston, 1983;
Jervis, Vilhelmsen, 1999; Smith, Naito, 2015), у некоторых наездников сем. Braconidae
(Jervis, 1998), а также у целого ряда жалящих, таких как веспиды (Krenn et al., 2002;
Mauss et al., 2019) и сфекоидные осы (Gillaspy, 1963; Krenn et al., 2005). Тем не менее,
эпизодическое появление форм с удлиненными ротовыми частями не оказало значи-
тельного влияния на эволюционную судьбу ни одной из перечисленных групп. Из всех
длиннохоботковых перепончатокрылых значительного видового разнообразия до-
стигли только пчелы (Apiformes), насчитывающие около 20 000 рецентных видов в со-
ставе нескольких семейств, число и состав которых дискуссионны (Michener, 2007).
Помимо пчел в ископаемом состоянии неизвестны какие-либо другие перепончато-
крылые с хоботками, из чего следует, что в прошлом, как и в настоящее время, такие
формы были большой редкостью.
Если у большинства перепончатокрылых длинные хоботки появлялись от случая к
случаю, то у пчел тенденция к удлинению ротовых частей стала определяющей. Инте-
ресно, что длиннохоботковыми формами изобилуют также цветочные осы (Vespidae:
Masarinae), которые, как и пчелы, заготовляют для личинок пыльцу, а не животную
пищу: длинные хоботки возникали в этом подсемействе дважды и есть по меньшей
мере у 9 из 14 родов (Krenn et al., 2002; Hermes, Melo, 2006; Garcette-Barrett, Klassen
Dück, 2010). Тем не менее, несмотря на сходную биологию, цветочные осы не смогли
повторить успех пчел, которые в силу своего обилия и распространенности стоят на
первом месте среди опылителей современных цветковых. Например, в английских
садах 80 % посещений цветков приходится на долю пчел, для вересковых пустошей
этот показатель еще выше - 94 %, в кенийской саванне он ниже, но тоже очень значи-
телен - 55 % (Willmer et al., 2017). В тропическом поясе, центре растительного разно-
образия, пчелы в среднем опыляют 45 % видов растений, причем в лесах на
Коста-Рике и Борнео доля таких видов достигает 70 % (Wardhaugh, 2015). Значение
пчел ощутимо падает только в условиях низких температур, например, в некоторых
альпийских и арктических экосистемах, где на первое место среди опылителей вы-
ходят двукрылые (Kearns, 1992; Pont, 1993; Tiusanen et al., 2016).
Хотя современная флора цветковых непредставима без пчел, на первых этапах эво-
люции их взаимодействие с пчелами, по-видимому, имело гораздо меньший масштаб.
Предположение о существенном влиянии пчел на меловую радиацию эудикот (дву-
дольных), основанное на данных молекулярной филогении (Cardinal, Danforth, 2013),
не находит поддержки на палеонтологическом материале. В то время как сфекоидные
осы, от которых ведут происхождение пчелы, известны с раннего мела (Расницын,
1980: с. 116-117), самые ранние бесспорные находки самих пчел датируются лишь
началом кайнозоя: речь идет о пчелах из палеоценовых отложений французского ме-
стонахождения Мена (Nel, Petrulevičius, 2003; Michez et al., 2009). Пчелы из Мена от-
носятся к продвинутым длинноязычковым семействам Apidae и Megachilidae, поэтому
логично предположить, что радиация более базальных семейств пчел произошла еще
в конце мелового периода. Однако это предположение можно подкрепить лишь кос-
венными свидетельствами, такими как норки в верхнемеловых палеопочвах США и
Аргентины, которые напоминают подземные гнезда современных Halictidae (Elliott,
Nations, 2008; Genise et al., 2020), а также цветы Clusiaceae со смолопродуцирующими
стаминодиями (туронская флора Нью-Джерси), предположительно предназначавши-
мися для привлечения пчел (Crepet, Nixon, 1998). В то же время все попытки обнару-
жить телесные остатки меловых пчел пока остаются безрезультатными.
808
Рис. 16. Anthophora melfordi Cockerell, 1908 (Apidae), Флориссант, терминальный эоцен;
фото Г. В. Мейера.
Стрелкой отмечен хоботок.
Масштабная линейка: 3 мм.
Перепончатокрылое Melittosphex burmensis Poinar et Danforth, 2006 из мелового бир-
манского янтаря, объявленное «древнейшей пчелой» из-за наличия ветвистых воло-
сков (Poinar, Danforth, 2006), лишено других пчелиных апоморфий, таких как расши-
ренные задние базитарзусы, и впоследствии было классифицировано как сфекоидная
оса, близкая к Crabronidae (Michez et al., 2011; Danforth, Poinar, 2011). По этим же при-
чинам к сфекоидным осам следует отнести и перепончатокрылое Discoscapa apicula
Poinar, 2020, описанное недавно в качестве базальной пчелы из того же бирманского
янтаря (Poinar, 2020). Не считая этих двух находок, на сегодня единственный потенци-
альный кандидат в меловые пчелы - Cretotrigona prisca (Michener et Grimaldi, 1988),
однако возраст данного экземпляра вызывает сомнения. Янтарный фрагмент, в ко-
тором заключена эта пчела, на основании старой музейной этикетки и химического
анализа был идентифицирован в качестве верхнемелового янтаря Нью-Джерси
(Michener, Grimaldi, 1988). Тем не менее, вид C. prisca относится к очень продвинутой
группе тропических безжальных пчел (Apidae: Meliponini) и настолько похож на со-
временных ее представителей, что изначально был включен в рецентный род Trigona
Jurine, 1807 (Michener, Grimaldi, 1988; Engel, 2000), что уже само по себе неожиданно
на фоне полного отсутствия в мелу других, более базальных пчел. Кроме того, переиз-
учение C. prisca показало, что в том же янтарном блоке присутствуют высшие тер-
миты, характерные для миоценового доминиканского янтаря, но отсутствующие в
809
мелу (Rasnitsyn, Michener, 1991). Таким образом, C. prisca нельзя рассматривать как
надежное указание на меловую радиацию пчел.
Даже с поправкой на общую скудость находок верхнемеловых насекомых полное
отсутствие остатков пчел этого возраста свидетельствует либо об их малочисленности
в тогдашних экосистемах, либо о крайне быстрых темпах их радиации в терминальном
мелу. Наконец, если предположить, что длинноязычковые пчелы, появившиеся в пале-
онтологической летописи первыми, вопреки распространенному мнению являются
одними из самых базальных, то гипотеза о скрытой радиации пчел в мелу вообще ста-
новится ненужной (Danforth et al., 2006). Так или иначе, все известные находки иско-
паемых пчел приходятся на кайнозой. Сводный список, опубликованный 10 лет назад,
включает 184 вида ископаемых пчел (Michez et al., 2011); с учетом новых публикаций
(Engel et al., 2012, 2013, 2018; Engel, Breitkreuz, 2013; Engel, Michener, 2013; Dehon
et al., 2014, и др.) это число уже превысило две сотни. Однако стоит отметить, что па-
леонтологическая летопись пчел довольно неравномерна: большинство описанных
видов происходит всего из 3 источников: из эоценового балтийского янтаря, из терми-
нального эоцена Флориссанта (США) и из миоценового доминиканского янтаря
(Michez et al., 2011).
По строению хоботка пчелы традиционно подразделяются на две группы: длинноя-
зычковых, в число которых входят Apidae и Megachilidae, и короткоязычковых, к ко-
торым относятся все остальные семейства (Michener, 2007: p. 92). У длинноязычковых
пчел язычок (сросшиеся глоссы) длиннее, чем остальной лабиум (прементум), и нахо-
дится внутри пищевого канала, дорсальная часть которого образована удлиненными
галеа, а вентральная - уплощенными и вытянутыми 1-м и 2-м члениками лабиальных
щупиков. У короткоязычковых пчел лабиальные щупики не видоизменены, а длина
язычка невелика по сравнению с хоботком в целом, что соответствует предковому со-
стоянию ротовых частей. За некоторыми исключениями, такими как орхидные пчелы
(Apidae: Euglossini) с преимущественно сосущим хоботком, втягивание нектара у
большинства пчел сопровождается лижущими движениями язычка, так что его стро-
ение напрямую сказывается на функциональных свойствах хоботка. У небольших
пчел относительная длина язычка не влияет на скорость поглощения нектара, однако
при возрастании размеров тела длинноязычковые виды получают преимущество
(Harder, 1983).
Доля длинноязычковых пчел была высокой уже с самого начала кайнозоя - к ним
принадлежат обе древнейшие пчелы, описанные из палеоцена Мена (Nel, Petrulevičius,
2003; Michez et al., 2009). Из балтийского янтаря известно 38 видов пчел, представ-
ленных 160 экземплярами, и из них только 4 экземпляра 3 видов относятся к коротко-
язычковым семействам (Michez et al., 2011). В раннеэоценовом индийском янтаре
встречаются исключительно длинноязычковые пчелы (Engel et al., 2013). В более мо-
лодом доминиканском янтаре пропорция иная: только 9 видов пчел из 21 являются
длинноязычковыми (Engel et al., 2012). Важно отметить, что сама по себе принадлеж-
ность той или иной ископаемой пчелы к короткоязычковой группе не позволяет
судить, какие источники нектара она эксплуатировала. Короткоязычковые пчелы, во-
преки своему названию, не всегда обладают коротким хоботком. Ряд современных
видов Halictidae, Melittidae, Andrenidae и Colletidae могут дополнительно наращивать
длину ротовых частей за счет прементума, максиллярных или лабиальных щупиков
или же язычка (в последнем случае, однако, лабиальные щупики не входят в состав
810
пищевого канала, как у длинноязычковых пчел) и таким образом получать доступ к
нектару в цветах с длинным венчиком (Laroca et al., 1989).
Находки пчел с сохранившимся хоботком очень редки: даже у целых экземпляров
хоботок, как правило, в момент смерти был сложен под голову и потому трудно раз-
личим. В числе немногих исключений следует упомянуть Anthophora melfordi
Cockerell, 1908 (Apidae: Anthophorini) из эоцена Флориссанта. На отпечатке этой
пчелы хорошо сохранился 4.5-миллиметровый хоботок, чуть превосходящий по длине
голову, в котором различимы галеа и выступающий из-под них язычок (рис. 16). В пер-
воначальном описании говорилось о наличии на язычке обильных длинных волосков
(Cockerell, 1908), однако при переизучении экземпляра это не подтвердилось (Zeuner,
Manning,
1976). Другие каменные отпечатки пчел демонстрируют значительно
худшую сохранность ротовых частей (в тех случаях, когда те вообще присутствуют).
Например, от хоботка Probombus hirsutus Piton, 1940 (Megachilidae) из палеоцена
Мена уцелела только двухсегментная длинная структура, лежащая книзу от правой
мандибулы, которая предположительно соответствует двум удлиненным членикам ла-
биального щупика (Nel, Petrulevičius, 2003). Отдельные элементы хоботков также раз-
личимы у некоторых пчел из балтийского янтаря, например у Protobombus indecisus
(Cockerell, 1908) и Melissites trigona Engel, 2001 (Apidae), а также у Paleomelitta
nigripennis Engel, 2001 (Paleomelittidae) (Engel, 2001, Pl. 6 a, b, d, fig. 17). Как и в
других случаях, надежды на получение дополнительной информации о строении хо-
ботка ранних пчел остается возлагать прежде всего на новые янтарные находки.
ОБСУЖДЕНИЕ
I. Три этапа радиации длиннохоботковых нектарофагов
1. Палеозой
Хоботок был и остается одним из важнейших орудий в арсенале адаптаций кры-
латых насекомых с момента их появления в конце раннего карбона. Древнейшие обла-
датели хоботка, палеодиктиоптероиды, использовали его как колющий инструмент, и
в таком же качестве он служил предковым равнокрылым Archescytinidae и другим па-
леозойским хоботковым экзоптериготам. У всех последующих экзоптеригот, включая
современных, хоботок сохранил исходную колющую функцию, специализированных
нектарофагов среди них не возникло. Возможно, этот факт напрямую связан с не-
полным метаморфозом, который затрудняет резкую дифференциацию по типу стро-
ения ротовых частей между нимфами и имаго (даже у стрекоз она ограничивается
лишь различиями в устройстве лабиума). Нектар - богатая сахарами, но бедная бел-
ками пища - хорошо подходит для взрослого насекомого, нуждающегося в источнике
энергии для полета, но не годится для роста и развития личинки. Поэтому у насе-
комых с полным превращением взрослой стадии хоботкового нектарофага всегда
предшествует личиночная стадия с иным ротовым аппаратом и типом питания -
таким как паразитизм (Bombyliidae, Acroceridae, Nemestrinidae, Tachinidae и т. д.),
хищничество (например, Vermileonidae и некоторые Syrphidae), растительноядность
(Lepidoptera) и палинофагия (Apoidea). У экзоптеригот же, у которых радикальная пе-
рестройка ротового аппарата в ходе индивидуального развития невозможна, специа-
лизированный хоботок для всасывания нектара нельзя закрепить только за имаго, что
исключает существование такой специализации в принципе.
811
Впервые сосущий хоботок, пригодный исключительно для нектарофагии, возник у
раннепермских Holometabola - ручейникоподобных Permomeropidae. В конце перми
ряды хоботковых нектарофагов, вероятно, пополнили некоторые скорпионницы,
главным образом Permochoristidae, хотя их хоботок, судя по наличию стилетов, мог
предназначаться также для хищничества. Эта первая и очень скромная по разноо-
бразию радиация длиннохоботковых нектарофагов (рис. 17) могла быть связана с па-
леозойскими семенными папоротниками, некоторые группы которых сдвигались от
анемофилии к энтомофилии. В частности, об энтомофильности некоторых
Medullosales свидетельствуют очень крупные пыльцевые зерна (Taylor, Millay, 1979), а
в случае Peltaspermales - закрытые семеносные диски, мало пригодные для ветроопы-
ления (Naugolnykh, Oskolski, 2010). Для пыльцы семенных папоротников, извлеченной
из кишечников раннепермских палинофагов, характерна сильно скульптурированная
поверхность, что предположительно облегчало ее распознавание насекомыми-перено-
счиками и, следовательно, тоже может рассматриваться как адаптация к энтомофилии
(Krassilov et al., 2007).
2. Мезозой
Вторая, мезозойская радиация длиннохоботковых нектарофагов была гораздо более
масштабной, чем первая. Судя по палеонтологическим данным, эта радиация началась
в средней юре и длилась около 70 млн лет, до начала позднего мела включительно.
В реальности она могла начаться еще раньше, в ранней юре или позднем триасе, вслед
за появлением Bennettitales и других групп мезозойских голосеменных, включающих
в себя энтомофильные виды. Находки крыльев свидетельствуют о существовании всех
3 семейств мезозойских длиннохоботковых скорпионниц уже со среднего триаса, в
ранней юре к ним добавились каллиграмматиды и неместриниды (рис. 18). Однако
подтвердить наличие длинных хоботков у насекомых этого возраста достаточно
сложно, поскольку в триасе и ранней юре практически отсутствуют лагерштетты, где
насекомые сохранялись бы целиком. За исключением североамериканской верхнетри-
асовой формации Кау Бранч, большинство крупных местонахождений насекомых, ко-
торые приходятся на этот интервал (Вогезы, Мадыген, Сай-Сагул, лейас Европы и
др.), приносят почти исключительно изолированные крылья.
Рис. 17. Группы длиннохоботковых насекомых-нектарофагов, чьи представители
с удлиненным ротовым аппаратом известны в ископаемом состоянии, а также Syrphidae
и антофильные Schizophora, находки которых с сохранившимся длинным хоботком
пока не отмечались.
1, 2 - Cretanallachiinae (Psychopsoidea), Paradoxosisyrinae (Sysiridae); 3 - Cretahilarimorpha lebanensis
(?Hilarimorphidae).
П, М, К - палеозойская, мезозойская и кайнозойская радиации длиннохоботковых нектарофагов.
Звездочки (*) означают, что в дополнение к находкам из подписанного местонахождения на том же уровне
отмечены находки из близкого по возрасту местонахождения: камбейский янтарь показан вместе с янтарем
из Уазы (Oise amber), формация Грин-Ривер - вместе с формацией Кишенен (Kishenehn), балтийский
янтарь - вместе с ровенским янтарем, доминиканский янтарь вместе с мексиканским янтарем.
Сплошные серые полосы обозначают временные интервалы между первыми и последними находками.
Штрихованными серыми линиям обозначены интервалы существования групп, известные на основании
ихнофоссилий. Сплошные точки обозначают находки нектарофагов с длинным (длиннее головы)
сосущим хоботком, бело-черные точки - находки кровососов и энтомофагов с длинным колющим
хоботком, который мог использоваться и для питания нектаром.
813
Рис. 18. Длина и пропорции ротовых частей 59 описанных и 5 неописанных видов
мезозойских длиннохоботковых нектарофагов.
Для видов, известных более чем в одном экземпляре, приведены средние значения
(см. табл. 1, 2, 4, 5). Виды, известные только по голотипу с сильно поврежденными ротовыми
частями, не учитывались. По горизонтальной оси - длина хоботка в мм, по вертикальной
оси - отношение длины хоботка к длине головы. Римскими цифрами I-III обозначены
соответствующие морфогруппы (см. текст).
В мезозое питание труднодоступным нектаром монополизировали 3 отряда насе-
комых: Mecoptera, Neuroptera и Diptera. К настоящему времени известно не менее
67 видов мезозойских длиннохоботковых нектарофагов с сохранившимися ротовыми
частями, относящихся к 12 семействам в составе этих 3 отрядов (табл. 6). По относи-
тельной и абсолютной длине хоботка их можно разделить на 3 морфогруппы (рис. 18).
К 1-й относятся почти все скорпионницы сем. Mesopsychidae и многие Aneuretopsych-
idae, а также некоторые мухи. Они пошли по пути относительного увеличения длины
хоботка, тогда как тело насекомых при этом оставалось сравнительно некрупным.
Предельным случаем такой тенденции служат юрская муха-акроцерида Archocyrtus
kovalevi c хоботком почти в 2 раза длиннее тела (Khramov, Lukashevich, 2019) и совре-
менные ей мезопсихиды, чей хоботок по длине равен почти половине тела (Ren et al.,
2010a). С одной стороны, небольшие общие размеры облегчали перемещение насе-
комых 1-й морфогруппы в густых зарослях, но, с другой стороны, манипулировать
таким непропорционально длинным и к тому же нескладывающимся хоботком было
непросто.
2-я морфогруппа длиннохоботковых нектарофагов состоит исключительно из ба-
бочкоподобных каллиграмматид. По абсолютной длине ротовых частей они сопоста-
вимы с представителями 1-й морфогруппы и изредка превосходят их, что достигается
главным образом не за счет удлинения самого хоботка, а за счет укрупнения всего на-
секомого. Например, юрские каллиграмматиды в 1.5-2.5 раза превосходят в размахе
814
Таблица 6. Число описанных видов мезозойских длиннохоботковых нектарофагов с сохранив-
шимися ротовыми частями
Отряд
Семейство (подсемейство)
Число длиннохоботковых видов
Mecoptera
Pseudopolycentropodidae
8
Aneuretopsychidae
8
Mesopsychidae
6
Neuroptera
Kalligrammatidae
10
Aetheogrammatidae
1
Cretanallachiinae, Cretadilarinae
10
(Psychopsoidea)
Paradoxosysirinae (Sisyridae)
5
Diptera
Limoniidae
4
Nemestrinidae
4
Acroceridae
1
?Hilarimorphidae
1
Zhangsolvidae
9
крыльев одновозрастных мезопсихид с хоботком такой же длины. Из-за крупных раз-
меров каллиграмматиды, видимо, были вынуждены держаться открытых пространств,
но могли питаться на тех же растениях, что и нектарофаги 1-й морфогруппы, по-
скольку стробилы голосеменных были достаточно крупными и могли обеспечить «по-
садочные места» для насекомых всех размерных категорий. Любопытно, что лишь не-
многие представители 1-й и 2-й морфогрупп при удлинении хоботка преодолевали
отметку в 10-11 мм - видимо, это объясняется устройством стробилов энтомофильных
голосеменных, которые редко скрывали сладковатые выделения на большей глубине.
Наконец, 3-я морфогруппа включает в себя большинство мезозойских нектарофагов.
Их хоботки характеризуются весьма скромными пропорциями (не более чем в 3.5 раза
длиннее головы) и длиной до 5 мм (для сравнения: функциональная длина хоботка
современной медоносной пчелы в среднем составляет 7 мм (Waddington, Herbst,
1987)). Очевидно, нектарофаги 3-й морфогруппы посещали иной спектр растений, не-
жели насекомые из двух других морфогрупп. Более трех десятков известных видов
мезозойских двукрылых с длинными колющими хоботками, предположительно соче-
тавшие нектарофагию с кровососанием или хищничеством (Tanyderidae, Psychodidae,
Culicidae, Chironomidae, Ceratopogonidae, Rhagionidae, Tabanidae), также попадают в
3-ю морфогруппу. Примечательно, что кулициды с хоботками большей относительной
длины, чем в 3-й морфогруппе, начинают встречаться в ископаемом состоянии лишь с
кайнозоя, что может указывать либо распространение цветковых растений с длинным
венчиком, пришедших на смену голосеменным с более доступным нектаром, либо же
на появление млекопитающих с более длинной шерстью. Длиннохоботковые кома-
ры-нектарофаги сем. Limoniidae демонстрируют такую же эволюционную тенденцию:
815
в мезозое все они находятся в пределах 3-й морфогруппы, тогда как в кайнозое отно-
сительная и абсолютная длина хоботков у них возрастает.
Находки длиннохоботковых мух в верхнеюрских отложениях (позднее оказавшихся
нижнемеловыми) первоначально интерпретировались как указание на существование
цветковых (Ren, 1998b). Однако, как уже тогда отмечал К. Лабандейра, с тем же
успехом подобные насекомые могли питаться и на репродуктивных органах вымерших
энтомофильных голосеменных (Labandeira, 1998). За прошедшие 20 лет справедли-
вость второй точки зрения стала еще очевиднее. Многочисленные попытки найти ка-
кие-либо остатки цветковых в отложениях древнее раннего мела не увенчались
успехом (Herendeen et al., 2017), поэтому можно с уверенностью говорить, что все
длиннохоботковые двукрылые, скорпионницы и сетчатокрылые юрского возраста
были связаны с голосеменной флорой, поскольку другой в их время просто не было.
Однако с раннемеловыми представителями этих же групп ситуация в первом прибли-
жении выглядит менее однозначной. Древнейшее свидетельство существования цвет-
ковых растений - однобороздная пыльца с колумеллятной экзиной - датируется ва-
ланжином (Coiro et al., 2019). Таким образом, все раннемеловые длиннохоботковые
нектарофаги были ровесниками цветковых и, на первый взгляд, могли питаться также
и на них.
Тем не менее, можно утверждать, что, как и в юре, в раннем мелу длиннохоботковые
нектарофаги по-прежнему находились в тесной ассоциации с голосеменными. В от-
личие от крупных стробилов раннемеловых голосеменных, околоцветник всех без ис-
ключения цветков этого возраста, в том случае, если он вообще имелся, был простым,
мелким (в среднем 0.5-5 мм в диаметре), плоским или чашеобразным, а вознагражде-
нием для опылителей служила пыльца, а не нектар (Friis et al., 2006, 2010, 2011: p. 434,
436). Длинный хоботок был совершенно бесполезен для питания на таких цветках -
скорее всего, их посещали насекомые с короткими ротовыми частями, прежде всего
жуки, а также мелкие двукрылые, что характерно и для самых базальных современных
цветковых из группы ANITA (Thien et al., 2009).
Усложнение архитектуры цветка произошло лишь в позднем мелу с диверсифика-
цией основных групп настоящих двудольных (core eudicots). Древнейшие цветки с не-
ктарниками и околоцветником, дифференцированным на венчик и чашечку, известны
из бирманского янтаря (Liu et al., 2018b) и альб-сеноманских отложений североамери-
канской формации Дакота (Basinger, Dilcher, 1984; Friis et al., 2011, p. 437; Manchester
et al., 2018), однако и они были открытыми и, следовательно, доступными без длин-
ного хоботка. Считается, что древнейшие сростнолепестные цветы с трубчатым осно-
ванием, ограничивающим доступ для нектарофагов, принадлежат верескоцветным из
сантона-кампана Швеции (Friis, 1985; Schönenberger, Friis, 2001; Friis et al., 2011,
p. 400, 439, 442). Наличие сростнолепестности и трубчатого венчика постулировалось
также для верескоцветных из туронской флоры Нью-Джерси (Nixon, Crepet, 1993;
Crepet, 1996). Поскольку все раннемеловые длиннохоботковые насекомые значительно
древнее, их пищевая специализация была по-прежнему направлена на энтомофильные
голосеменные, тогда как нектар цветковых в лучшем случае мог служить источником
пищи для нектарофагов 3-й морфогруппы, живших в начале позднего мела (прежде
всего это относится к длиннохоботковой энтомофауне бирманского янтаря).
Прямым доказательством связи мезозойских длиннохоботковых насекомых с голо-
семенными растениями служит пыльца, прилипшая к их телу. Так, пыльца голосе-
816
менных, предположительно относящаяся к вильямсониевым беннеттитовым, была об-
наружена на мухе-джангсольвиде из раннемелового испанского янтаря (Peñalver et al.,
2015). Пыльца голосеменных, как уже говорилось, найдена также рядом со скорпион-
ницей Parapolycentropus в бирманском янтаре (Lin et al., 2019). Пыльцу же покрытосе-
менных до сих пор находили только на меловых насекомых с короткими ротовыми
частями, таких как жуки и осы (Bao et al., 2019; Grimaldi et al., 2019), а также в кишеч-
никах сеноедоподобных пермопсоцид (Huang et al., 2016).
Предположения о пищевых предпочтениях мезозойских нектарофагов строятся
также на основе изучения репродуктивных структур одновозрастных им растений.
Традиционно в качестве основного кандидата на роль энтомофильных голосеменных
рассматриваются беннеттитовые (Расницын, Козлов,
1990; Мостовский,
1998;
Labandeira et al., 2016; Khramov, Lukashevich, 2019). В цветкоподобных стробилах ви-
льямсониевых беннеттитовых, таких как Williamsonia и Williamsoniella, брактеи (видо-
изменные прицветные листья), смыкаясь над рецептакулом (семяложем), ограничи-
вают доступ к семязачаткам, что делает необходимым использование длинного
хоботка для высасывания опылительных капель (Friis et al., 2011: p. 430-432; Khramov,
Lukashevich, 2019). Репродуктивные органы с узким входом, потенциально привлека-
тельные для длиннохоботковых нектарофагов, отмечались также у Caytoniales и
Pentoxylales, близких к цветковым, а также у Gnetales, Czekanowskiales и хвойных
Cheirolepidiaceae (Ren et al., 2009, Table S6).
Но даже если бы о мезозойских голосеменных с энтомофильным синдромом было
ничего неизвестно, то находки насекомых с длинными сосущими хоботками в любом
случае дали бы веский повод предполагать их существование. Действительно, специа-
лизация в виде длинного хоботка, предназначенного для высасывания опылительных
капель, могла быть полезной только в том случае, если эти капли были обогащены са-
харами и скрыты в глубине стробилов. Ни то, ни другое не сочетается с анемофилией.
У современных анемофильных голосеменных опылительные капли содержат гораздо
меньше сахаров, чем энтомофильные (1-2 % у сосны против 25 % у эфедры (Bolinder
et al., 2016)), что делает их малопривлекательными для нектарофагов. Кроме того,
когда пыльца переносится ветром, опылительные капли должны быть выставлены на
поверхность, что устраняет необходимость в длинном хоботке. Таким образом, мезо-
зойские голосеменные не просто эксплуатировались длиннохоботковыми нектарофа-
гами, не получая ничего взамен, но активно привлекали и использовали их в качестве
опылителей.
Стимулом для удлинения хоботка у мезозойских нектарофагов могла быть эволюци-
онная гонка растений и опылителей, на которую Ч. Дарвин впервые указал в своей
работе об опылении орхидей, и чье существование подтвердили последующие иссле-
дования (Nilsson, 1988; Pauw et al., 2009). Эта гонка возникает из-за того, что опыли-
тели и растения преследуют прямо противоположные цели, несмотря на существу-
ющий между ними мутуализм. Чтобы эффективно питаться нектаром, насекомое
нуждается в хоботке, который превышает по длине венчик цветка. Напротив, растение
должно иметь венчик, чуть превосходящий по длине хоботок, поскольку лишь в этом
случае насекомое вынуждено глубоко погружать голову в цветок, измазываясь в
пыльце. Слишком длинный хоботок привел бы к тому, что насекомое выпивало бы
нектар, но не участвовало в опылении, превращаясь в нектарного вора. Вот почему в
процессе эволюции опылители постепенно удлиняли хоботок, а растения, в свою оче-
817
редь, шаг за шагом удлиняли трубки венчиков, шпорцы и т. д. Надо полагать, этот
процесс шел и в мезозое, с той поправкой, что вместо околоцветника увеличивалась
длина брактей и межсеменных чешуй, скрывающих семязачатки с опылительными ка-
плями. Появление мезозойских длиннохоботковых нектарофагов, относящихся к 1-й и
2-й морфогруппам, могло стать непосредственным результатом этой «дарвиновской
гонки».
В отличие от цветковых, для большинства которых характерны обоеполые цветки,
репродуктивным органам голосеменных, за исключением беннеттитовых
Cycadeoidaceae и некоторых Williamsoniaceae, свойственна раздельнополость. Следо-
вательно, энтомофильные голосеменные, опылявшиеся длиннохоботковыми нектаро-
фагами, должны были как-то привлекать их не только на женские, но и на мужские
стробилы, где нет семязачатков и опылительных капель. У всех 3 родов современных
энтомофильных гнетовых в мужских стробилах есть стерильные семязачатки - функ-
циональный аналог нектарников цветковых растений, единственная роль которых за-
ключается в выделении сладковатой жидкости, привлекательной для опылителей
(Kato et al., 1995; Wetschnig, Depisch, 1999; Bolinder et al., 2016). Возможно, подобные
структуры имелись и в мужских стробилах вымерших энтомофильных голосеменных.
Предполагается, что функцию привлечения опылителей могли исполнять многочис-
ленные желёзки, расположенные на внутренней поверхности Weltrichia, мужских
стробилов вильямсониевых беннеттитовых (Friis et al., 2011, p. 430; Popa, 2019).
Некоторые вымершие энтомофильные голосеменные могли также прибегать к об-
манному или ошибочному опылению (deceit/mistake pollination), подобно многим со-
временным энтомофильным цветковым с однополыми цветами. Например, у Jacaratia
dolichaula (Caricaceae) женские цветки не выделяют нектар, однако длиннохоботковые
опылители (бражники) регулярно посещают их, из-за внешнего сходства принимая за
мужские, которые продуцируют нектар в изобилии (Bawa, 1980). Рассуждая по ана-
логии, можно представить, что у ряда энтомофильных голосеменных мужские стро-
билы по запаху и внешним параметрам были похожи на женские, благодаря чему
длиннохоботковые насекомые наведывались к ним регулярно.
Следует подчеркнуть, что для немногочисленных энтомофильных голосеменных из
числа ныне существующих Gnetales и Cycadales репродуктивные органы со скрытой
внутри сладковатой жидкостью не характерны. У современных энтомофильных гне-
товых опылительные капли находятся на поверхности стробилов и легко доступны
для насекомых с короткими ротовыми частями, таких как муравьи и осы, хотя их при
случае потребляют также насекомые с длинным хоботком, например, чешуекрылые и
мухи-сирфиды (Kato et al., 1995; Wetschnig, Depisch, 1999; Bolinder et al., 2016). Опы-
лители же саговниковых - долгоносикообразные жуки и трипсы - питаются тканями
стробилов и пыльцой и вообще не имеют отношения к нектарофагии (Schneider et al.,
2002). Интересно, что в женские стробилы энтомофильные саговниковые привлекают
опылителей обманным путем (Terry et al., 2004).
3. Кайнозой
Третья радиация длиннохоботковых нектарофагов пришлась на кайнозой и, без со-
мнения, была связана с распространением цветковых с глубоким венчиком. Отсчиты-
вать начало этой радиации надо как минимум с позднего палеоцена - раннего эоцена,
когда в отложениях появляются первые остатки тел пчел и дитризных чешуекрылых.
818
Но, как и в случае с мезозойской радиацией, здесь надо сделать поправку на особен-
ности палеонтологической летописи насекомых, которая в конце мела и в палеоцене
очень скудна. Соответственно, истоки кайнозойской фауны длиннохоботковых некта-
рофагов могут скрываться уже во второй половине позднего мела, о чем свидетель-
ствуют и некоторые ихнофоссилии, указывающие на существование в это время
Apoidea и Ditrysia (см. выше). С другой стороны, полное отсутствие Apoidea и Ditrysia
в многочисленных раннемеловых лагерштеттах опровергает выводы молекулярных
исследований, согласно которым основная радиация двух этих групп на уровне се-
мейств будто бы завершилась уже к середине мелового периода (Cardinal, Danforth,
2013; Wahlberg et al., 2013).
Фауна длиннохоботковых нектарофагов принимает современный облик к раннему
кайнозою. К этому времени от мезозойской длиннохоботковой «тройки» остаются
только двукрылые. К ним прибавляются дитризные чешуекрылые и пчелы, которые
как бы приходят на смену вымершим длиннохоботковым скорпионницам и сетчато-
крылым. Состав длиннохоботковых двукрылых в кайнозое при этом существенно из-
меняется. С одной стороны, вымирают некоторые мезозойские семейства (Zhangsolv-
idae). С другой стороны, к длиннохоботковых двукрылым, появившимся в мезозое
(Limoniidae, Acroceridae, Nemestrinidae), добавляются новые семейства, ставшие ча-
стью масштабной радиации Cyclorrhapha в кайнозое (Syrphidae, Conopidae, Phoridae,
Tachinidae и др.). Наконец, в кайнозое длинные хоботки и рострумы впервые появля-
ются как у древних групп двукрылых, известных с юры (Bombyliidae), так и у более
молодых, существующих с мела (Empididae, Keroplatidae, Mycetophilidae, Lygistorrhin-
idae).
Среди двукрылых внимание обращают на себя Acroceridae и Nemestrinidae, которые
удерживаются в экологической нише длиннохоботковых нектарофагов, начиная с
юры, несмотря на радикальные перемены в составе растительности, произошедшие с
того времени. Как и некоторые жуки-палинофаги (Peris et al., 2017), эти семейства
смогли переориентироваться с голосеменных на цветковые, что, однако, было не одно-
моментным переходом, а результатом длинной серии эволюционных изменений.
В частности, в процессе адаптации к цветковым произошло вымирание мезозойских
длиннохоботковых неместринид подсем. Archinemestrininae, тогда как их кайнозой-
ские аналоги возникли уже в рамках другого, современного подсемейства Nemestrin-
inae.
В отличие от двукрылых, у сетчатокрылых и скорпионниц вымирание длиннохобот-
ковых нектарофагов произошло на уровне целых семейств, вследствие чего эта жиз-
ненная форма в двух данных отрядах не просто сменила «место прописки» на филоге-
нетическом древе, а полностью исчезла. Возможно, сетчатокрылые и скорпионницы
не выдержали прямой конкуренции за цветочный нектар с появившимися в конце
верхнего мела пчелами и дитризными чешуекрылыми. Более вероятно, однако, что ла-
бильность поведения длиннохоботковых сетчатокрылых и скорпионниц была меньше,
чем у двукрылых, в силу чего они до конца оставались верны энтомофильным голосе-
менным и исчезли после их окончательного вымирания.
Таким образом, цветковые, без сомнения, оказали определяющее влияние на эво-
люцию насекомых-нектарофагов. Но были ли нектарофаги и опылители, со своей сто-
роны, драйвером эволюции цветковых?
819
II. Было ли насекомоопыление залогом успеха цветковых?
Как продемонстрировал настоящий обзор, коэволюция насекомых-нектарофагов и
растений началась задолго до появления цветковых растений. В раннем мелу первые
цветковые с их мелкими цветками с простым, слаборазвитым околоцветником, на ко-
торых питались морфологически неспециализированные насекомые, сосуществовали
с энтомофильными голосеменными со сложноустроенными стробилами, опылявши-
мися с участием продвинутых длиннохоботковых нектарофагов. На фоне отлаженных
опылительных систем, свойственных беннеттитовым и другим группам мезозойских
голосеменных, репродуктивная биология ранних цветковых выглядела хаотичной и
примитивной. Тем не менее, в верхнем мелу цветковым удалось выбиться в лидеры,
тогда как мутуалистические отношения с насекомыми-опылителями, складывавшиеся
многие миллионы лет, не спасли энтомофильные голосеменные от вымирания. Это
ставит под сомнение распространенную точку зрения, согласно которой своим эволю-
ционным успехом и колоссальным видовым разнообразием покрытосеменные обя-
заны насекомоопыляемости.
Из 350 000 видов цветковых примерно 87.5 % опыляются животными, главным об-
разом насекомыми (Ollerton et al., 2011). Напротив, около 60 % из 1000 с небольшим
видов современных голосеменных составляют хвойные, опыляемые исключительно
ветром, а остальные 40 % приходятся на гнетовые и цикадовые, среди которых доля
энтомофильных видов не слишком значительна (Wang, Ran, 2014). Такой контраст
между преимущественно энтомофильными, молодыми и очень разнообразными цвет-
ковыми и в основном анемофильными и бедными видами, но древними голосемен-
ными естественно наводит на мысль о решающем вкладе насекомых-опылителей в
преобладание первых над вторыми, которое особенно заметно в тропических ши-
ротах.
Считается, что периодическая смена специализированных опылителей, вызванная
небольшими изменениями в строении цветка, способствует репродуктивной изоляции
и тем самым - ускоренному видообразованию (Van der Niet, Johnson, 2012). Особенно
эффективно этот процесс идет с участием длиннохоботковых насекомых: рода цвет-
ковых с нектарными шпорцами, которые опыляются такими насекомыми, в десятки
раз превышают по числу видов сестринские рода с открытыми цветками (Hodges,
1997). Кроме того, если анемофильные виды вынуждены расти кучно, то благодаря
насекомым-опылителям, адресно доставляющим пыльцу, энтомофилы получают воз-
можность существовать в виде дисперсных популяций, лучше застрахованных от на-
падений фитофагов и патогенов и от внутривидовой конкуренции. Из множества
таких рассредоточенных популяций и складывается совокупное видовое разнообразие
тропического леса и других сообществ с преобладанием цветковых (Janzen, 1971).
Представление о насекомоопылении как о ключевой инновации цветковых рас-
тений, позволившей им быстро вырваться вперед, восходит еще к Ч. Дарвину и его
единомышленнику-эволюционисту, французскому палеоботанику Гастону де Сапорта.
В письме к Дарвину за 1877 г. Сапорта писал о поразительном «отсутствии сосущих
[= хоботковых] насекомых в юре», с которым была связана «ранняя скудость расти-
тельного царства, <...>долгое время ограничивавшегося одними анемофильными рас-
тениями, чье число и разнообразие никогда не могли достичь определенного уровня».
В ответном письме Ч. Дарвин горячо поддержал это предположение: «Ваша идея, что
двудольные растения не вошли в силу до того, как появились сосущие насекомые,
820
представляется мне великолепной. Я удивляюсь, как сам не додумался до нее» (цит.
по: Friedman, 2009).
Учитывая все вышесказанное, нет нужды доказывать, насколько ошибочными ока-
зались эти представления в свете открытий палеоэнтомологии, совершенных за по-
следние 30 лет. Вопреки Ч. Дарвину, Г. Сапорта и всем последующим авторам, рас-
суждавшим в аналогичном русле, длиннохоботковые насекомые-нектарофаги были в
изобилии представлены еще в юре, что указывает на расцвет энтомофилии среди голо-
семенных, наблюдавшийся задолго до возникновения цветковых. Таким образом,
цветковые растения в этом отношении не изобрели ничего нового. Все те преимуще-
ства, которые несет насекомоопыление, должны были ощущать на себе уже мезозой-
ские голосеменные, и если их оказалось недостаточно, чтобы выиграть конкуренцию
у цветковых, значит, на стороне последних были какие-то дополнительные факторы,
которыми и надо объяснять их успех.
Впервые на этот недочет энтомофильной гипотезы указал в своей книге «Победи-
тели в борьбе за существование» (1927) отечественный ботаник М. И. Голенкин
(1864-1941). Хотя о существовании длиннохоботковых нектарофагов, предшество-
вавших возникновению цветковых, в его время никто не догадывался, свидетельства
в пользу энтомофилии беннеттитовых уже были известны палеоботаникам. Тот факт,
что «огромное большинство энтомофильных голосеменных вымерло, а анемофильные
сохранились в живых», подрывает представление о решающем преимуществе энтомо-
филии, писал М. И. Голенкин (1927, с. 27). Кроме того, он справедливо указывал, что
анемофилия не помешала злакам, пальмам и ряду других цветковых добиться значи-
тельного эволюционного успеха. На основании этих соображений М. И. Голенкин
предположил, что причины успеха цветковых, вопреки очевидности, надо искать не в
наличии цветка и даже не в покрытосемянности как таковой (возникновение у цвет-
ковых завязи, защищающей семязачатки), а в строении их вегетативных органов и
действии внешних климатических факторов. Независимо от М. И. Голенкина сходная
критика в адрес энтомофильной гипотезы позднее высказывалась и другими специа-
листами (Midgley et al., 1991; Gorelick, 2001; Augusto et al., 2014).
Настоящей инновацией покрытосеменных, давшей им преимущество над голосе-
менными, была не энтомофилия, а усовершенствованная проводящая система (воз-
никновение сосудов и ситовидных трубок) вкупе с более сложно организованными
листьями. Листья покрытосеменных в среднем в 4 раза превышают листья голосе-
менных по плотности расположения жилок на единицу площади, что в 3-5 раз увели-
чивает скорость транспирации и поглощения CO2 (Boyce et al., 2009). Как результат, у
покрытосеменных выше скорость роста и репродукции, благодаря чему голосеменные
могут успешно конкурировать с ними только в стесненных условиях, где отсутствуют
возможности для быстрого роста (бедные почвы, холодный климат, малое количество
осадков) (Bond, 1989; Augusto et al., 2014). Наиболее примитивные покрытосеменные
по строению проводящей системы и обилию жилок в листьях принципиально не отли-
чались от голосеменных и, вероятно, по этой причине были незначительным эле-
ментом в раннемеловых флорах. Судя по палеоботаническим данным, резкое увели-
чение плотности жилок в листьях покрытосеменных произошло в альбе-сеномане, и
тогда же началось их повсеместное распространение (Feild et al., 2011).
Таким образом, кайнозойская радиация пчел, дитризных чешуекрылых и других на-
секомых, специализирующихся на питании цветочным нектаром, была не причиной, а
821
следствием экспансии цветковых, произошедшей в силу превосходства их вегета-
тивных органов. Будем надеяться, что дальнейшее изучение особенностей строения и
функционирования ротовых частей ископаемых и современных хоботковых насе-
комых поможет еще детальнее прояснить эволюционные закономерности их взаимо-
действия с растительным миром.
БЛАГОДАРНОСТИ
Мы выражаем искреннюю благодарность за предоставленные иллюстрации и за
разрешение их использовать В. А. Благодерову (V. A. Blagoderov, Edinburgh, UK),
В. Н. Макаркину (ФНЦ Биоразнообразия Восточной Азии ДВО РАН, Владивосток),
А. П. Расницыну (ПИН РАН, Москва), Бо Вану (Bo Wang, Nanjing, China), Сяньдуну
Чжао (Xiangdong Zhao, Nanjing, China), Герберту Мейеру (Herbert Meyer, Colorado,
U.S.A.), Андре Нелю (André Nel, Paris, France), Цзюнь Чэню (Jun Chen, Linyi, China),
Ришарду Шадзевскому (Ryszard Szadziewski, Gdansk, Poland), Кристель и Гансу Хоф-
файнсам (Christel and Hans Hoffeins, Hamburg, Germany), Ивоне Кане (Iwona Kania,
Rzeszow, Poland), Сигитасу Поденасу (Sigitas Podenas, Vilnius, Lithuania), Артуру Бор-
кенту (Art Borkent, Salmon Arm, Canada), Сюзане Батс (Susan Butts, New Haven,
Connecticut, U.S.A.), Джейсону Холлу (Jason Hall, Washington, DC, U.S.A.), Ги-Со
Наму (Gi-Soo Nam, Gongju, South Korea) и Вильфреду Вихарду (Wilfried Wichard,
Cologne, Germany). Мы благодарим за консультации И. В. Шамшева (Зоологический
институт РАН, С.-Петербург), Марию Хейккиле (Maria Heikkilä, Helsinki, Finland),
Йорга Анзорге (Jorg Ansorge, Greifswald, Germany), З. А. Федотову (ВНИИ защиты
растений РАН, С.-Петербург), М. Г. Коваленко и А. В. Крупицкого (Московский госу-
дарственный университет им. М. В. Ломоносова, Москва). Мы очень признательны
рецензентам, А. П. Расницыну и В. Д. Иванову (Санкт-Петербургский государ-
ственный университет, С.-Петербург), а также главному редактору журнала
“Энтомологическое обозрение” Б.А. Коротяеву (Зоологический институт РАН,
С.-Петербург) за ценные советы и замечания, позволившие значительно улучшить эту
работу. Разумеется, вся ответственность за возможные ошибки и неточности полно-
стью лежит на нас.
ФИНАНСИРОВАНИЕ
Исследование выполнено при финансовой поддержке Российского фонда фундамен-
тальных исследований в рамках научных проектов № 19-14-50222 и 18-04-00322.
FUNDING
The reported study was funded by RFBR, project numbers 19-14-50222 and 18-04-00322.
СПИСОК ЛИТЕРАТУРЫ
Благодеров В. А. 1995. Грибные комарики трибы Sciophilini (Diptera, Mycetophilidae) из раннего мела Забай-
калья. Палеонтологический журнал 1: 55-63. [Blagoderov V. A. 1995. Fungus gnats of the tribe Sciophilini
(Diptera, Mycetophilidae) from the Early Cretaceous of Transbaikalia. Paleontological Journal 29 (1):
72-83].
Благодеров В. А. 1997. Грибные комарики трибы Gnoristini (Diptera, Mycetophilidae) из раннего мела Забай-
калья. Палеонтологический журнал 6: 44-49. [Blagoderov V. A. 1997. Fungus gnats of the tribe Gnoristini
(Diptera, Mycetophilidae) from the Lower Cretaceous of Transbaikalia. Paleontological Journal 31 (6):
609-615].
Благодеров В. А. 1998. Грибные комарики триб Gnoristini и Leiini (Diptera, Mycetophilidae) из раннего мела
Забайкалья. Палеонтологический журнал 1: 58-62. [Blagoderov V. A. 1998. Fungus gnats of the tribe
822
Gnoristini (Diptera, Mycetophilidae) from the Early Cretaceous of Transbaikalia. Paleontological Journal 32
(1): 54-59].
Глухова В. М. 1981. Сравнительно-морфологический обзор ротового аппарата самок и самцов мокрецов
подсемейств Dasyheleinae и Forcipomyiinae (Diptera, Ceratopogonidae). Энтомологическое обозрение
60 (1): 61-76. [Glukhova V. M. 1982. A comparative morphological review of the mouthparts of females and
males in the subfamilies Dasyheleinae and Forcipomyiinae (Diptera, Ceratopogonidae). Entomological
Review 60 (1): 59-72].
Голенкин М. И. 1927. Победители в борьбе за существование. Исследование причин и условий завоевания
Земли покрытосеменными растениями в середине мелового периода. М.: Издательство Ассоциации
научно-исследовательских институтов при физико-математическом факультете 1-го МГУ, 101 с.
Гринфельд Э. К. 1978. Происхождение и развитие антофилии у насекомых. Л.: Издательство Ленинградского
университета, 206 c.
Зайцев В. Ф. 1986. Новые виды ископаемых меловых мух-жужжал и обзор палеонтологических данных по
сем. Bombyliidae (Diptera). Энтомологическое обозрение 65 (4): 815-824. [Zaitzev V. F. 1987. New
species of Cretaceous fossil bee flies and a review of paleontological data on Bombyliidae (Diptera).
Entomological Review 66 (3): 150-160].
Зайцев В. Ф. 1992. Эволюционные тенденции морфофункциональных адаптаций (на примере надсемейства
Bombyloidea, Diptera). Труды Зоологического института РАН 185: 1-188.
Калугина Н. С., Ковалев В. Г. 1985. Двукрылые насекомые юры Сибири. М.: Наука, 198 с.
Ковалев В. Г.1986. Двукрылые. Инфраотряды Bibionomorpha и Asilomorpha. В кн.: А. П. Расницын (ред.).
Насекомые в раннемеловых экосистемах Западной Монголии. Труды совместной Советско-Монголь-
ской палеонтологической экспедиции, М.: Наука, т. 28, с. 125-154.
Ковалев В. Г.1990. Двукрылые. Muscida. В кн.: А. П. Расницын (ред.). Позднемезозойские насекомые Вос-
точного Забайкалья. Труды Палеонтологического института. М.: Наука, т. 239, с. 123-177.
Ковалев В. Г., Мостовский М. Б. 1997. Новый род мух-рагионид (Diptera, Rhagionidae) из мезозойских отло-
жений Восточного Забайкалья. Палеонтологический журнал 5: 86-90. [Kovalev V. G., Mostovski M. B.
1997. A new genus of snipe flies (Diptera, Rhagionidae) from the Mesozoic of eastern Transbaikalia.
Paleontological Journal 31 (5): 523-527.].
Козлов М. В. 1988. Палеонтология чешуекрылых и вопросы филогении отряда Papilionida. В кн.: А. Г. Поно-
маренко (ред.). Меловой биоценотический кризис и эволюция насекомых. М.: Наука, с. 16-69.
Лукашевич Е. Д. 1996. Новые хаобориды из мезозоя Монголии (Diptera: Chaoboridae). Палеонтологический
журнал 4: 55-60. [Lukashevich E. D. 1996. New chaoborids from the Mesozoic of Mongolia (Diptera:
Chaoboridae). Paleontological Journal 30 (5): 551-558.].
Лукашевич Е. Д. 2020. Редкие длинноусые двукрылые (Insecta: Diptera) из местонахождения Хасурты, Забай-
калье. Палеонтологический журнал 54 (6): 43-54. [Lukashevich E. D. 2020. Rare Nematoceran Dipterans
(Insecta: Diptera) from the Khasurty locality, Transbaikalia. Paleontological Journal 54 (6): 600-612]. doi:
10.31857/S0031031X20060045
Лукашевич Е. Д., Мостовский М. Б. 2003. Насекомые-гематофаги в палеонтологической летописи. Палеон-
тологический журнал 2: 48-53. [Lukashevich E. D., Mostovski M. B. 2003. Hematophagous insects in the
fossil record. Paleontological Journal 37 (2): 153-161].
Макаркин В. Н. 2016. Удивительное разнообразие меловых сетчатокрылых (Neuroptera). В кн.: Чтения памя-
ти Алексея Ивановича Куренцова. Владивосток: Дальнаука, выпуск 27, с. 27-47.
Мостовский М. Б. 1998. Ревизия мух-неместринид (Diptera, Nemestrinidae), описанных Б. Б. Родендорфом, и
новые таксоны неместринид из верхней юры Казахстана. Палеонтологический журнал 4: 47-53.
[Mostovski M. B. 1998 A revision of the nemestrinid flies (Diptera, Nemestrinidae) described by
B. B. Rohdendorf, and a description of new taxa of the Nemestrinidae from the Upper Jurassic of Kazakhstan.
Paleontological Journal 32 (4): 369-375].
Мостовский М. Б., Яржембовский Э. А., Корам Р. 2003. Слепни и атерициды (Diptera: Tabanidae, Athericidae)
из нижнего мела Англии и Забайкалья. Палеонтологический журнал 2: 57-64. [Mostovski M. B.,
Jarzembowski E. A., Coram R. A. 2003. Horseflies and athericids (Diptera: Tabanidae, Athericidae) from the
Lower Cretaceous of England and Transbaikalia. Paleontological Journal 37 (2): 162-169].
Новокшонов В. Г. 1994. Скорпионницы Permochoristidae - ближайшие общие предки современных скорпи-
онниц (Insecta, Panorpida = Mecoptera). Зоологический журнал 73 (7-8): 58-70. [Novokshonov V. G.
1995. Scorpion flies of the family Permochoristidae, the closest common ancestors of extant scorpion flies
(Insecta, Panorpida = Mecoptera). Entomological Review 74 (2): 84-97].
Новокшонов В. Г. 1997а. Ранняя эволюция скорпионниц (Insecta: Panorpida). М.: Наука, 140 с.
Новокшонов В. Г. 1997б. Некоторые мезозойские скорпионницы (Insecta: Panorpida = Mecoptera) семейств
Mesopsychidae, Pseudopolycentropodidae, Bittacidae, Permochoristidae. Палеонтологический журнал 1:
65-71. [Novokshonov V. G. 1997. Some Mesozoic scorpionflies (Insecta: Panorpida = Mecoptera) of the
823
families Mesopsychidae, Pseudopolycentropodidae, Bittacidae, and Permochoristidae. Paleontological
Journal 31 (1): 65-71].
Панов А. А. 2007. О половой специфичности питания Bombylius major и некоторых других бомбилиид
(Diptera, Bombyliidae). Зоологический журнал 86 (10): 1221-1230. [Panov A. A. 2007. Sex-related diet
specificity in Bombylius major and some other Bombyliidae (Diptera). Entomological Review 87 (7):
Панов А. А. 2008. Гистологическое строение ротового аппарата, клипео-цибариальной системы и головного
отдела передней кишки у Philoliche rondani (Diptera, Tabanidae, Pangoniinae). Зоологический журнал
87 (7): 799-812. [Panov A. A. 2008. Histological structure of the mouthparts, clypeo-cibarial system, and
cephalic foregut in Philoliche rondani (Diptera, Tabanidae, Pangoniinae). Entomological Review 88 (7):
Панфилов Д. В. 1980. Новые представители сетчатокрылых (Neuroptera) из юры Каратау. В кн.: В. Г. Долин,
Д. В. Панфилов, А. Г. Пономаренко, Л. Н. Притыкина. Ископаемые насекомые мезозоя. Отв. ред.
В. А. Топачевский. Киев: Наукова думка, с. 82-111.
Расницын А. П. 1980. Происхождение и эволюция перепончатокрылых насекомых. М.: Наука, 191 с.
Расницын А. П., Козлов М. В. 1990. Новая группа ископаемых насекомых: скорпионница с адаптациями
цикад и бабочек. Доклады Академии наук СССР 310 (4): 973-976. [Rasnitsyn A. P., Kozlov M. V. 1990.
A new group of fossil insects: scorpion[flie]s with cicad[a] and butterfly adaptations. Transactions of the
USSR Academy of Sciences. Earth Science Sections 310: 233-236].
Расницын А. П., Красилов В. А. 1996. Первая находка пыльцы в кишечнике нижнепермских насекомых.
Палеонтологический журнал 3: 119-124. [Rasnitsyn A. P., Krassilov V. A. 1996. First find of pollen grains
in the gut of Permian insects. Paleontological Journal 30 (4): 484-490].
Ремм Х. Я. 1976. Позднемеловые мокрецы (Diptera, Ceratopogonidae) ископаемых смол Хатангской впадины.
Палеонтологический журнал 3: 107-116. [Remm H. 1976. Midges (Diptera, Ceratopogonidae) from the
Upper Cretaceous fossil resins of the Khatanga Depression. Paleontological Journal 10 (3): 344-351].
Родендорф Б. Б. 1964. Историческое развитие двукрылых насекомых. Труды Палеонтологического институ-
та. М.: Наука, т. 100, 311 с.
Савченко Е. Н. 1983. Комары-лимонииды Южного Приморья. Киев: Наукова думка, 156 с.
Скальски А. В. 1979. Новый представитель семейства Micropterigidae (Lepidoptera) из нижнего мела Забай-
калья. Палеонтологический журнал 2: 90-97. [Skalski A. W. 1979. A new member of the family
Micropterigidae (Lepidoptera) from the Lower Cretaceous of Transbaikalia. Paleontological Journal 13:
206-214].
Стекольников А. А., Корзеев А. И. 2007. Экологический сценарий эволюции чешуекрылых (Insecta:
Lepidoptera). Энтомологическое обозрение 86 (3): 508-520. [Stekolnikov A. A., Korzeev A. I. 2007. The
ecological scenario of Lepidopteran evolution. Entomological Review
87
(7):
doi.org/10.1134/S0013873807070056].
Сукачева И. Д. 1976. Ручейники подотряда Permotrichoptera. Палеонтологический журнал 2: 94-105.
[Sukatscheva I. D. 1976. Caddis-flies of the suborder Permotrichoptera. Paleontological Journal 10 (2):
198-209].
Шаров А. Г. 1973. Морфологические особенности и образ жизни палеодиктиоптер. В кн.: Г. Я. Бей-Биенко,
Э. П. Нарчук (ред.). Доклады на двадцать четвертом ежегодном чтении памяти Н. А. Холодковского,
1-2 апреля 1971 г. Вопросы палеонтологии насекомых. Л.: Наука, с. 49-62.
Aguiar A. P., Deans A. R., Engel M. S., Forshage M., Huber J. T., Jennings J. T., Johnson N. F., Lelej A. S., Longino
J. T., Lohrmann V., Mikó I., Ohl M., Rasmussen C., Taeger A., Dicky S. K. 2013. Order Hymenoptera.
Ain Malak M., Salamé Y., Azar D. 2013. New phlebotomine flies from Burmese amber (Diptera: Psychodidae:
Phlebotominae). Terrestrial Arthropods Reviews 6 (1-2): 81-101. doi: 10.1163/18749836-06021060
Alexander C. P. 1927. Diptera fam. Tanyderidae. In: P. Wytsman (ed.), Genera Insectorum, vol. 189, p. 1-13.
Alexander C. P. 1931. Crane-flies of the Baltic amber (Diptera). Bernstein-Forschungen 2: 1-135.
Allen H. W. 1929. An annotated list of the Tachinidae of Mississippi. Annals of the Entomological Society of
Andersen S. 1982. Revision of European species of Siphona Meigen (Diptera: Tachinidae). Insect Systematics &
Ansorge J. 1994. Tanyderidae and Psychodidae (Insecta: Diptera) from the Lower Jurassic of northeastern Germany.
Ansorge J. 1996. The Upper Liassic insects of Grimmen (Pomerania, north Germany). Neue Paläontologische
Abhandlungen 2: 1-132.
Ansorge J., Krzemiński W. 1994. Oligophrynidae, a Lower Jurassic dipteran family (Diptera, Brachycera). Acta
Zoologica Cracoviensia 37 (2): 115-119.
824
Ansorge J., Makarkin V. N. 2020. The oldest giant lacewings (Neuroptera: Kalligrammatidae) from the Lower
Ansorge J., Mostovski M. B. 2000. Redescription of Prohirmoneura jurassica Handlirsh, 1906 (Diptera: Nemestrin-
idae) from the Lower Tithonian lithographic limestone of Eichstätt (Bavaria). Neues Jahrbuch für Geologie
und Paläontologie: Monatshefte 4: 235-243.
Arillo A., Nel A. 2000. Two new fossil cecidomyiids flies from the Lower Cretaceous amber of Alava (Spain)
(Diptera, Cecidomyiidae). Bulletin de la Société Entomologique de France 105 (3): 285-288.
Arillo A., Peñalver E., Pérez-de la Feunte R., Delclòs X., Criscione J., Barden P. M., Ricco M. L., Grimaldi D. A.
2015. Long-proboscid brachyceran flies in Cretaceous amber (Diptera: Stratiomyomorpha: Zhangsolvidae).
Aristov D. S., Bashkuev A. S., Vassilenko D. V. 2013. The Severodvinian locality of Isady (= Mutovino) in Vologda
Region: Review of the Entomofauna. In: D. S. Aristov (ed.). Fossil insects of the Middle and Upper Permian
Arnold S. E. J., Forbes S. J., Hall D. R., Farman D. I., Bridgemohan P., Spinelli G. R., Bray D. P., Perry G. B., Grey
L., Belmain S. R., Stevenson P. C. 2019. Floral odors and the interaction between pollinating ceratopogonid
midges and cacao. Journal of Chemical Ecology 45 (10): 869-878. doi: 10.1007/s10886-019-01118-9
Arroyo M. T. K., Primack R., Armesto J. 1982. Community studies in pollination ecology in the high temperate
Andes of Central Chile. I. Pollination mechanisms and altitudinal variation. American Journal of Botany 69
(1): 82-97.
Aspöck U., Haring E., Aspöck H. 2012. The phylogeny of the Neuropterida: long lasting and current controversies
and challenges (Insecta: Endopterygota). Arthropod Systematics and Phylogeny 70 (2): 119-129.
Augusto L., Davies T. J., Delzon S., Schrijver A. 2014. The enigma of the rise of angiosperms: can we untie the knot?
Azar D., Adaymeh C., Jreich N. 2007. Paleopsychoda zherikhini, a new Cretaceous species of moth flies from
Taimyr amber (Diptera: Psychodidae: Psychodinae). African Invertebrates 48 (1): 163-168.
Azar D., Nel A., Solignac M., Paicheler J.-C., Bouche F. 1999. New genera and species of psychodoid flies from the
4983.00112
Azar D., Perrichot V., Neradeau D., Nel A. 2003. New psychodids from the Cretaceous ambers of Lebanon and
France, with a discussion of Eophlebotomus connectens Cockerell, 1920 (Diptera, Psychodidae). Annals of
the Entomological Society of America 96 (2): 117-126.
Azar D., Veltz I., Nel A. 2008. Mandibulate chironomids: primitive or derived? (Diptera: Chironomidae). Systematic
Baez M., Santos-Pinto E. 1981. Revisión de los géneros Macrocera y Antlemon en las Islas Canarias (Dipt.,
Mycetophilidae, Keroplatinae). Boletín de la Asociación Española de Entomologia 4: 37-42.
Bao T., Wang B., Li J., Dilcher D. 2019. Pollination of Cretaceous flowers. Proceedings of the National Academy of
Barraclough D. A., Colville J. F., Karolyi F., Krenn H. W. 2018. A striking new species of Prosoeca Schiner, 1867
(Diptera: Nemestrinidae): an important pollinator from the Bokkeveld Plateau, Northern Cape Province,
Bashkuev A. S. 2011a. Nedubroviidae, a new family of Mecoptera: the first Paleozoic long-proboscid scorpionflies.
Bashkuev A. S. 2011b. The earliest Mesopsychidae and revision of the family Mesopanorpodidae (Mecoptera).
Bashkuev A. S. 2013. New Mecoptera from the end-Permian intertrappean deposits of the Tunguska Basin. Russian
Entomological Journal 22 (1): 1-4.
Bashkuev A. S. 2016. Insights into the origin and evolution of the long-proboscid scorpionfly family Aneuretopsych-
idae (Mecoptera) based on new Mesozoic and Palaeozoic records. In: D. Penney, A. J. Ross (eds). Abstracts
of the 7th International Conference on Fossil Insects, Arthropods and Amber. Edinburgh: Siri Scientific Press,
National Museum of Scotland, p. 64.
Bashkuev A. S., Sell J., Aristov D., Ponomarenko A., Sinitshenkova N., Mahler H. 2012. Insects from the
Buntsandstein of Lower Franconia and Thuringia. Paläontologische Zeitschrift 86 (2): 175-185. doi: 10.1007/
s12542-011-0119-8
Basinger J. F., Dilcher D. L. 1984. Ancient bisexual flowers. Science 224 (4648): 511-513. doi: 10.1126/
science.224.4648.511
Bauder J. A. S., Karolyi F. 2019. Superlong proboscises as co-adaptations to flowers. In: H. W. Krenn (ed.). Insect
Mouthparts. Form, Function, Development and Performance. Zoological Monographs, vol. 5. Cham
(Switzerland): Springer Nature, p. 479-527.
Bauder J. A.-S., Warren A. D., Krenn H. W. 2014. Evolution of extreme proboscis lengths in Neotropical Hesperi-
idae (Lepidoptera). Journal of Research on the Lepidoptera 47: 65-71.
825
Bauder J. A. S., Warren A. D., Krenn H. W. 2015. The ecological role of extremely long-proboscid Neotropical
butterflies (Lepidoptera: Hesperiidae) in plant-pollinator networks. Arthropod-Plant Interactions 9: 415-424.
Bawa K. S. 1980. Mimicry of male by female flowers and intrasexual competition for pollinators in Jacaratia
dolichaula (D. Smith) Woodson (Caricaceae). Evolution
34
(3):
org/10.1111/j.1558-5646.1980.tb04836.x
Baxter J. E., Poinar G. O. 1994. A new genus and new species of fungus gnats (Diptera: Mycetophilidae) from
Dominican amber. Annales de la Société Entomologique de France (N. S.) 30 (1): 93-102.
Beattie R. 2007. The geological setting and palaeoenvironmental and palaeoecological reconstructions of the Upper
Permian insect beds at Belmont, New South Wales, Australia. African Invertebrates 48 (1): 41-57.
Bechev D. 2010. Flower visitation of fungus gnats from the genera Antlemon, Asindulum and Macrorrhyncha
(Diptera: Keroplatidae): published data and a new record. ZooNotes 7: 1-3.
Bechly G., Makarkin V. N. 2016. A new gigantic lacewing species (Insecta: Neuroptera) from the Lower Cretaceous
of Brazil confirms the occurrence of Kalligrammatidae in the Americas. Cretaceous Research 58: 135-140.
doi: 10.1016/j.cretres.2015.10.014
Bequaert J. C., Carpenter F. M. 1936. The Nemestrinidae of the Miocene of Florissant, Colorado, and their relations
to the recent fauna. Journal of Paleontology 10 (5): 395-409.
Bertone M. A. 2018. Field observations of Lygistorrhina sanctaecatharinae Thompson (Diptera: Sciaroidea).
8797.120.2.448
Beutel R. G., Baum E. 2008. A longstanding entomological problem finally solved? Head morphology of
Nannochorista (Mecoptera, Insecta) and possible phylogenetic implications. Journal of Zoological
Beutel R. G., Friedrich F. (Eds.). 2019. Nannomecoptera and Neomecoptera, Handbook of Zoology. Berlin/Boston:
Walter de Gruyter, 176 p.
Bicha W. J. 2018. Biodiversity of Mecoptera. In: R. G. Foottit, P. H. Adler (eds). Insect Biodiversity: Science and
Blagoderov V. 2017. Lygistorrhinidae (long-beaked fungus gnats). In: A. H. Kirk-Spriggs, B. J. Sinclair (eds).
Manual of Afrotropical Diptera, Vol. 2. Nematocerous Diptera and Lower Brachycera. Suricata 5. Pretoria:
South African National Biodiversity Institute, p. 527-531.
Blagoderov V. A., Arillo A. 2002. New Sciaroidea (Insecta: Diptera) in Lower Cretaceous amber from Spain. Studia
Dipterologica 9: 31-40.
Blagoderov V., Grimaldi D. 2004. Fossil Sciaroidea (Diptera) in Cretaceous ambers, exclusive of Cecidomyiidae,
Sciaridae,
and
Keroplatidae.
American
Museum Novitates
3433:
1-76.
doi:
10.1206/0003-0082(2004)433<0001:FSDICA>2.0.CO;2
Blagoderov V. A., Grimaldi D. A., Fraser N. C. 2007. How time fly for flies: diverse Diptera from the Triassic of
Virginia and early radiation of the order. American Museum Novitates
3572:
doi.org/10.1206/0003-0082(2007)509[1:HTFFFD]2.0.CO;2
Blagoderov V., Hippa H., Nel A. 2010. Parisognoriste, a new genus of Lygistorrhinidae (Diptera: Sciaroidea) from
Oise amber with redescription of Palaeognoriste Meunier. ZooKeys 50: 79-90. doi: 10.3897/zookeys.50.506
Blagoderov V. A., Lukashevich E. D., Mostovski M. B. 2002. Order Diptera Linne, 1758. The True Flies (= Muscida
Laicharting, 1781). In: A. P. Rasnitsyn, D. L. J. Quicke (eds). History of Insects. Dordrecht: Kluwer Academic
Publishers, p. 227-240.
Bolinder K., Humphreys A. M., Ehrlén J., Alexandersson R., Ickert-Bond S. M., Rydin C. 2016. From near extinction
to diversification by means of a shift in pollination mechanism in the gymnosperm relict Ephedra
boj.12380
Bond W. J. 1989. The tortoise and the hare: ecology of angiosperm dominance and gymnosperm persistence.
tb00492.x
Borell B. J. 2005. Long tongues and loose niches: Evolution of euglossine bees and their nectar flowers. Biotropica
Borkent A. 1995. Biting Midges in the Cretaceous Amber of North America (Diptera: Ceratopogonidae). Leiden,
The Netherlands: Backhuys Publishers, 237 p.
Borkent A. 1996. Biting midges from Upper Cretaceous New Jersey amber (Diptera: Ceratopogonidae). American
Museum Novitates 3159: 1-29.
Borkent A. 2000a. Biting midges (Ceratopogonidae: Diptera) from Lower Cretaceous Lebanese amber with a
discussion of the diversity and patterns found in other ambers. In: D. Grimaldi (ed.). Studies on Fossils in
826
Amber, with Particular Reference to the Cretaceous of New Jersey. Leiden: Backhuys Publishers,
p. 355-451.
Borkent A. 2000b. Further biting midges (Diptera: Ceratopogonidae) from Upper Cretaceous New Jersey amber. In:
D. Grimaldi (ed.). Studies on Fossils in Amber, with Particular Reference to the Cretaceous of New Jersey.
Leiden: Backhuys Publishers, p. 453-472.
Borkent A. 2017. Ceratopogonidae (biting midges). In: A. H. Kirk-Spriggs, B. J. Sinclair (eds). Manual of
Afrotropical Diptera, Vol. 2. Nematocerous Diptera and Lower Brachycera. Suricata 5. Pretoria: South
African National Biodiversity Institute, p. 733-812.
Borkent A. 2019. The phylogenetic relationships of Cretaceous biting midges, with a key to all known genera
Borkent A., Dominiak P. 2020. Catalog of the biting midges of the World (Diptera: Ceratopogonidae). Zootaxa 4787
Borkent A., Grimaldi D. 2004. The earliest fossil mosquito (Diptera: Culicidae), in mid-Cretaceous Burmese amber.
Annals of the Entomological Society of America 97 (5): 882-888. doi: 10.1603/0013-8746(2004)097[0882:te
fmdc]2.0.co;2
Borkent A., Grimaldi D. 2016. The Cretaceous fossil Burmaculex antiquus confirmed as the earliest known lineage
of mosquitoes (Diptera: Culicidae). Zootaxa 4079 (4): 457-466. doi: 10.11646/zootaxa.4079.4.5
Borkent C. J., Gillung J. P., Winteron S. L. 2016. Jewelled spider flies of North America: a revision and phylogeny
zookeys.619.8249
Boyce C. K., Brodribb T. J., Feild T. S., Zwieniecki M. A. 2009. Angiosperm leaf vein evolution was physiologically
and environmentally transformative. Proceedings of the Royal Society B 276 (1663): 1771-1776. https://doi.
org/10.1098/rspb.2008.1919
Büttiker W., Krenn H. W., Putterill J. F. 1996. The proboscis of eye-frequenting and piercing Lepidoptera (Insecta).
Camier M., Nel A. 2019. A fossil black fungus gnat from the lowermost Eocene amber of France (Diptera: Sciar-
Cardinal S., Danforth B. N. 2013. Bees diversified in the age of eudicots. Proceedings of the Royal Society B 280
Carpenter F. M. 1930. The Lower Permian insects of Kansas. Part I. Introduction and the order Mecoptera. Bulletin
of the Museum of Comparative Zoology at Harvard College 70: 69-101.
Chandler P. 2002. Heterotricha Loew and allied genera (Diptera: Sciaroidea): offshoots of the stem group of
Mycetophilidae and/or Sciaridae? Annales de la Société Entomologique de France (N. S.) 38 (1-2): 101-144.
Chang Y., Fang H., Shih C., Ren D., Wang Y. 2018. Reevaluation of the subfamily Cretanallachiinae Makarkin, 2017
(Insecta, Neuroptera) from Upper Cretaceous Myanmar amber. Cretaceous Research 84: 533-539. doi:
10.1016/j.cretres.2017.10.028
Cockerell T. D. A. 1897. Notes on New Mexican flowers and their insect visitors. Botanical Gazette 24 (2): 104-107.
Cockerell T. D. A. 1908. XXXVI.—Descriptions and records of bees.—XX. The Annals and Magazine of Natural
History, Eighth Series 2 (10): 323-334. doi: 10.1080/00222930808692489
Cockerell T. D. A. 1909. Descriptions of tertiary insects (V): Some new Diptera. American Journal of Science 27
(157): 53-58.
Coetzee M. 2017. Culicidae (mosquitoes). In: A. H. Kirk-Spriggs, B. J. Sinclair (eds). Manual of Afrotropical
Diptera, Vol. 2. Nematocerous Diptera and Lower Brachycera. Suricata 5. Pretoria: South African National
Biodiversity Institute, p. 677-692.
Coher E. I., Lane J. 1949. A new Neotropical genus of “Mycetophilidae” (Diptera, Nematocera). Revista Brasileira
de Biologia 9 (4): 485-488.
Coiro M., Doyle J. A., Hilton J. 2019. How deep is the conflict between molecular and fossil evidence on the age of
Coquillett D. W. 1900. Papers from the Harriman Alaska expedition. IX. Entomological results (3): Diptera.
Proceedings of the Washington Academy of Sciences 2: 389-464.
Coram R. A., Jarzembowski E. A., Mostovski M. B. 2000. Two rare eremoneuran flies (Diptera: Empididae and
Opetiidae) from the Purbeck Limestone Group. Paleontological Journal 34 (Suppl. 3): 370-373.
Coram R. A., Jepson J. E. 2012. Fossil Insects of the Purbeck Limestone Group of Southern England:
Palaeoentomology from the Dawn of the Cretaceous. Manchester, UK: Siri Scientific Press, 144 p.
Courtney G. W. 2017. Blephariceridae (Net-winged midges or torrent midges). In: A. H. Kirk-Spriggs, B. J. Sinclair
(eds). Manual of Afrotropical Diptera, Vol. 2. Nematocerous Diptera and Lower Brachycera. Suricata 5.
Pretoria: South African National Biodiversity Institute, p. 195-204.
Crampton G. C. 1926. The external anatomy of the primitive tanyderid dipteran Macrochile spectrum Loew,
preserved in Baltic amber. Bulletin of the Brooklyn Entomological Society 21: 1-14.
827
Crampton G. C. 1942. The external morphology of the Diptera. In: The Guide to the insects of Connecticut, Part VI.
The Diptera or true flies of Connecticut, Fasc. 1. State Geological and Natural History Survey of Connecticut.
Bulletin 64: 10-165.
Cranston P. S., Edward D. H. D., Cook L. G. 2002. New status, species, distribution records and phylogeny for
Australian mandibulate Chironomidae (Diptera). Australian Journal of Entomolody 41 (4): 357-366. doi:
10.1046/j.1440-6055.2002.00304.x
Crepet W. L. 1979. Insect pollination: A Paleontological perspective. BioScience 29: 102-108. doi: 10.2307/1307746
Crepet W. L. 1996. Timing in the evolution of derived floral characters: Upper Cretaceous (Turonian) taxa with
tricolpate and tricolpate-derived pollen. Review of Palaeobotany and Palynology 90 (3-4): 339-359. https://
doi.org/10.1016/0034-6667(95)00091-7
Crepet W. L., Nixon K. C. 1998. Fossil Clusiaceae from the Late Cretaceous (Turonian) of New Jersey and
implications regarding the history of bee pollination. American Journal of Botany 85 (8): 1122-1133. doi:
10.2307/2446345
Curler G. R., Krzemiński W., Skibińska K. 2019. The first record of fossil Horaiellinae (Diptera: Psychodidae) from
cretres.2019.02.005
Curler G. R., Priyadarsanan D. R. 2015. Descriptions of Psychodidae (Diptera) from the Western Ghats of India.
Acta Entomologica Musei Nationalis Pragae 55 (2): 473-483.
Curtis J. 1829. Observations upon a collection of fossil insects discovered near Aix in Provence, in the summer of
1828, by R. J. Murchison, esq. and Charles Lyell esq., jun. Edinburgh New Philosophical Journal 7: 293-297.
Danforth B. N., Poinar G. O. 2011. Morphology, classification, and antiquity of Melittosphex burmensis (Apoidea:
Melittosphecidae) and implications for early bee evolution. Journal of Paleontology 85 (5): 882-891. https://
doi.org/10.1666/10-130.1
Danforth B. N., Sipes S., Fang J., Brady S. G. 2006. The history of early bee diversification based on five genes plus
morphology. Proceedings of the National Academy of Sciences
103
doi.org/10.1073/pnas.0604033103
Dehon M., Michez D., Nel A., Engel M. S., Meulemeester T. 2014. Wing shape of four new bee fossils (Hymenoptera:
pone.0108865
De Jong R. 2016. Reconstructing a 55-million-year-old butterfly (Lepidoptera: Hesperiidae). European Journal of
Entomology 113: 423-428. doi: 10.14411/eje.2016.055
De Jong R. 2017. Fossil butterflies, calibration points and the molecular clock (Lepidoptera: Papilionoidea). Zootaxa
4270 (1): 1-63. doi: 10.11646/zootaxa.4270.1.1.
Devetak D., Klokočovnik V. 2016. The feeding biology of adult lacewings (Neuroptera): a review. Trends in
Entomology 12: 30-42.
Dong F., Shih C., Skibińska K., Krzemiński W., Ren D. 2015. New species of Tanyderidae (Diptera) from the
Jiulongshan Formation of China. Alcheringa: An Australian Journal of Palaeontology 39 (4): 494-507.
doi: 10.1080/03115518.2015.1041308
Doorenweerd C., van Nieukerken E. J., Sohn J.-C., Labandeira C. C. 2015. A revised checklist of Nepticulidae
fossils (Lepidoptera) indicates an Early Cretaceous origin. Zootaxa 3963 (3): 295-334. https://doi.
org/10.11646/zootaxa.3963.3.2
Dorchin N., Astrin J. J., Bodner L., Harris K. M. 2015. Morphological and molecular revision of the genus Ozirhincus
(Diptera: Cecidomyiidae) - long-snouted seed-feeding gall midges on Asteraceae. PLoS ONE 10 (7):
Downes J. A. 1968. A nepticulid moth feeding at the leaf-nectaries of poplar. Canadian Entomologist 100 (10):
Downes J. A. 1973. Lepidoptera feeding at puddle-margins, dung, and carrion. Journal of the Lepidopterists’ Society
27 (2): 89-99.
Downes J. A., Smith S. M. 1969. New or little known feeding habits in Empididae (Diptera). The Canadian
Downes W. L. Jr., Dahlem G. A. 1987. Keys to the evolution of Diptera: role of Homoptera. Environmental
Edwards F. W. 1923. Oligocene mosquitoes in the British Museum; with a summary of present knowledge concerning
fossil Culicidae. Quarterly Journal of Geological Society of London 79: 139-155.
Edwards F. W. 1925. British fungus-gnats (Diptera, Mycetophilidae). With a revised generic classification of the
family. Transactions of the Entomological Society of London
72
(3-4):
doi.org/10.1111/j.1365-2311.1925.tb03369.x
Edwards F. W. 1929. Fasc. 2. Blepharoceridae. In: Diptera of Patagonia and South Chile, Part 2. London: British
Museum, p. 33-75.
828
Edwards F. W. 1931. Fasc. 5. Chironomidae. In: Diptera of Patagonia and South Chile, Part 2. London: British
Museum, p. 233-324.
Elliott D. K., Nations J. D. 2008. Bee burrows in the late cretaceous (Late Cenomanian) Dakota formation,
Engel M. S. 2000. A new interpretation of the oldest fossil bee (Hymenoptera, Apidae). American Museum Novitates
3296: 1-11.
Engel M. S. 2001. A monograph of the Baltic amber bees and evolution of the Apoidea (Hymenoptera). Bulletin of
1:AMOTBA%3E2.0.CO;2
Engel M. S. 2005. A remarkable kalligrammatid lacewing from the Upper Jurassic of Kazakhstan (Neuroptera:
Kalligrammatidae). Transactions of the Kansas Academy of Science 108: 59-62. doi: 10.1660/0022-
8443(2005)108[0059:ARKLFT]2.0.CO;2
Engel M. S., Breitkreuz L. C. V. 2013. A male of the bee genus Agapostemon in Dominican amber (Hymenoptera:
Engel M. S., Breitkreuz L. C. V., Ohl M. 2014. The first male of the extinct bee tribe Melikertini (Hymenoptera:
Engel M. S., Grimaldi D. A., Gonzalez V. H., Hinojosa-Díaz I. A., Michener C. D. 2012. An exomalopsine bee in
Early Miocene amber from the Dominican Republic (Hymenoptera: Apidae). American Museum Novitates
Engel M. S., Michener C. D. 2013. A minute stingless bee in Eocene Fushan amber from northeastern China
Engel M. S., Ortega-Blanco J., Nascimbene P. C., Singh H. 2013. The bees of Early Eocene Cambay amber
Engel M. S., Wang B., Alqarni A. S., Jia L.-B., Su T., Zhou Z., Wappler T. 2018. A primitive honey bee from the
Middle Miocene deposits of southeastern Yunnan, China (Hymenoptera, Apidae). Zookeys 775: 117-129.
doi: 10.3897/zookeys.775.24909
Eskov K. Y., Lukashevich E. D. 2015. On the history of ranges of two relict nematoceran families, Ptychopteridae
and Tanyderidae (Insecta: Diptera): a biogeographical puzzle. Russian Entomological Journal 24 (3):
257-270.
Evenhuis N. L. 1984. A reassessment of the taxonomic position of the fossil species Protophthiria palpalis and
P. atra (Diptera: Bombyliidae). International Journal of Entomology 26: 157-161.
Evenhuis N. L. 1994. Catalogue of the Fossil Flies of the World (Insecta: Diptera). Leiden: Backhuys, 600 p.
Evenhuis N. L. 2007. A remarkable new species of Empidideicus (Diptera: Mythicomyiidae) from Madagascar.
Evenhuis N. L. 2020. Catalog of the fossil flies of the world (Insecta: Diptera) (Version 2.0) [URL: http://
hbs.bishopmuseum.org/fossilcat] (accessed June 2020).
Fachin D. A., Santos C. M. D., Amorim D. 2018. First two species of Austroleptis Hardy (Diptera: Brachycera:
Fedotova Z. A., Perkovsky E. E. 2019. First findings of gall midges (Diptera, Cecidomyioidea, Cecidomyiidae) of
the tribes Karshomyiini (Mexican amber) and Bremiini (Dominican amber). Paleontological Journal 53 (10):
Feild T. S. et al. 2011. Fossil evidence for Cretaceous escalation in angiosperm leaf vein evolution. Proceedings of
Freeman P. 1960. A new genus and species of Sciaridae (Diptera, Nematocera) from South Africa. Annals of the
Natal Museum 15 (6): 75-77.
Friedman W. E. 2009. The meaning of Darwin’s ‘abominable mystery’. American Journal of Botany 96 (1): 5-21.
Friis E. M. 1985. Actinocalyx gen. nov., sympetalous angiosperm flowers from the Upper Cretaceous of southern
6667(85)90001-6
Friis E. M., Raunsgaard Pedersen K., Crane P. R. 2006. Cretaceous angiosperm flowers: Innovation and evolution in
plant reproduction. Palaeogeography, Palaeoclimatology, Palaeoecology 232 (2-4): 251-293. https://
doi.org/10.1016/j.palaeo.2005.07.006
Friis E. M., Raunsgaard Pedersen K., Crane P. R. 2010. Diversity in obscurity: fossil flowers and the early history of
angiosperms. Philosophical Transactions of the Royal Society B 365 (1539): 369-382. doi: 10.1098/
rstb.2009.0227
Friis E. M., Raunsgaard Pedersen K., Crane P. R. 2011. Early Flowers and Angiosperm Evolution. Cambridge:
Gad A. M. 1951. The head-capsule and mouth-parts in the Ceratopogonidae. Bulletin de la Société Fouad Premier
d’Entomologie 35: 17-75.
829
Gagné R. J., Byers G. 1984. A remarkable new Neotropical species of Contarinia (Diptera: Cecidomyiidae). Journal
of Kansas Entomological Society 57: 736-738.
Gall L. F., Tiffney B. H. 1983. A fossil noctuid moth egg from the Late Cretaceous of Eastern North America.
Science 219 (4584): 507-509. doi: 10.1126/science.219.4584.507
Gao J., Shih C., Kopeć K., Krzemiński W., Ren D. 2015. New species and revisions of Pediciidae (Diptera) from the
zootaxa.3963.2.5
Gao T., Shih C., Labandeira C. C., Santiago-Blay J. A., Yao Y., Ren D. 2016. Convergent evolution of ramified
antennae in insect lineages from the Early Cretaceous of Northeastern China. Proceedings of the Royal
Garcette-Barrett B. R., Klassen Dück C. H. 2010. Biological observations on the genus Ceramiopsis Zavattari
(Insecta: Hymenoptera: Vespidae: Masarinae). Boletín del Museo Nacional de Historia Natural del Paraguay
16: 8-17.
Genise J. F., Bellosi E. S., Sarzetti L. C., Krause J. M., Dinghi P. A., Sánchez M. V., Umazano A. M., Puerta P., Cantil
L. F., Jicha B. R. 2020. 100 Ma sweat bee nests: Early and rapid co-diversification of crown bees and
Gilbert F., Jervis M. 1998. Functional, evolutionary and ecological aspects of feeding-related mouthpart
specializations in parasitoid flies. Biological Journal of the Linnean Society 63 (4): 495-535. https://
doi.org/10.1111/j.1095-8312.1998.tb00327.x
Giłka W., Zakrzewska M., Makarchenko E. A. 2020. Burmochlus gen. nov., the first Cretaceous member of
Archaeochlus cluster (Diptera: Chironomidae: Podonominae). Cretaceous Research
106:
104261.
doi: 10.1016/j.cretres.2019.104261
Gillaspy J. E. 1963. A revisionary study of the genus Steniolia (Hymenoptera: Sphecidae: Bembicini). Transactions
of the American Entomological Society 89 (1/2): 1-117.
Gillung J. P., Winterton S. L. 2018. A review of fossil spider flies (Diptera: Acroceridae) with descriptions of new
genera and species from Baltic amber. Journal of Systematic Palaeontology 16 (4): 325-350. doi:
10.1080/14772019.2017.1289566
Goldblatt P., Bernhardt P., Vogan P., Manning J. C. 2004. Pollination by fungus gnats (Diptera: Mycetophilidae) and
self-recognition sites in Tolmiea menziesii (Saxifragaceae). Plant Systematics and Evolution 244: 56-67.
Goldblatt P., Manning J. S. 2000. The long-proboscid fly pollination system in Southern Africa. Annals of the
Missouri Botanical Garden 87 (2): 146-170. doi: 10.2307/2666158
González C. R., Flores P. 2004.Comparative study of mouthparts of three species of horse flies of the tribe Pangoniini
Gorelick R. 2001. Did insect pollination cause increased seed plant diversity? Biological Journal of the Linnean
Society 74: 407-427. doi:10.1006/bijl.2001.0602
Grant J. I., Djani D. M., Lehnert M. S. 2012. Functionality of a reduced proboscis: Fluid uptake by Phigalia
strigataria (Minot) (Geometridae: Ennominae). Journal of the Lepidopterists’ Society 66 (4): 211-215.
Greenwalt D. E., Wingerath J. G., Evenhuis N. L. 2015. Two new and disparate fossil bee flies (Bombyliidae:
Anthracinae) from the Americas and reassessment of Anthrax dentoni Lewis, 1969. Palaeontologia
Grimaldi D. 1999. The co-radiations of pollinating insects and angiosperms in the Cretaceous. Annals of the Missouri
Botanical Garden 86 (2): 373-406. doi: 10.2307/2666181
Grimaldi D. A. 2016. Diverse orthorrhaphan flies (Insecta: Diptera: Brachycera) in amber from the Cretaceous of
Myanmar: Brachycera in Cretaceous amber, Part VII. Bulletin of the American Museum of Natural History
Grimaldi D., Blagoderov V. 2001. A new genus of Lygistorrhinidae from Vietnam (Diptera: Sciaroidea), and
phylogenetic relationships in the family. Studia Dipterologica 8: 43-57.
Grimaldi D., Johnston M. A. 2014. The long-tongued Cretaceous scorpionfly Parapolycentropus Grimaldi and
Rasnitsyn (Mecoptera: Pseudopolycentropodidae): New data and interpretations. American Museum
Novitates 3793: 1-24. doi: 10.1206/3793.1
Grimaldi D. A. 2018. Basal Cyclorrhapha in amber from the Cretaceous and Tertiary (Insecta: Diptera), and their
relationships: Brachycera in Cretaceous amber, Part IX. Bulletin of the American Museum of Natural History
Grimaldi D. A., Arillo A., Cumming J. M., Hauser M. 2011. Brachyceran Diptera (Insecta). In: Cretaceous ambers,
Part IV, Significant new orthorrhaphous taxa. ZooKeys 148: 293-332. doi: 10.3897/zookeys.148.1809
Grimaldi D. A., Cumming J. 1999. Brachyceran Diptera in Cretaceous ambers and Mesozoic diversification of the
Eremoneura. Bulletin of the American Museum of Natural History 239: 1-124.
830
Grimaldi D. A., Engel M. S., Nascimbene P. C. 2002. Fossiliferous Cretaceous amber from Myanmar (Burma): Its
rediscovery, biotic diversity, and paleontological significance. American Museum Novitates 3361: 1-72. doi:
10.1206/0003-0082(2002)3612.0.CO;2
Grimaldi D. A., Junfeng Z., Fraser N. C., Rasnitsyn A. 2005. Revision of the bizarre Mesozoic scorpionflies in the
Pseudopolycentropodidae (Mecopteroidea). Insect Systematics and Evolution 36 (4): 443-458. https://
doi.org/10.1163/187631205794761021
Grimaldi D. A., Peñalver E., Barrón E., Herhold H. W., Engel M. S. 2019. Direct evidence for eudicot pollen-feeding
in a Cretaceous stinging wasp (Angiospermae; Hymenoptera, Aculeata) preserved in Burmese amber.
Grimstad P. R., DeFoIiart G. R. 1974. Nectar sources of Wisconsin mosquitoes. Journal of Medical Entomology 11
(3): 331-341. doi: 10.1093/jmedent/11.3.331
Grund M. 2012. A long-beaked fungus gnat in Dominican amber. Annales Zoologici 62 (4): 639-642. https://doi.
org/10.3161/000345412X659704
Hall J. P. W., Robbins R. K., Harvey D. J. 2004. Extinction and biogeography in the Caribbean: New evidence
from a fossil riodinid butterfly in Dominican amber. Proceedings of the Royal Society B 271: 789-801.
doi: 10.1098/rspb.2004.2691
Han Y. E., Cai Y., Ren D., Wang Y. 2019. A new fossil snipe fly with long proboscis from the Middle Jurassic of Inner
Mongolia, China (Diptera: Rhagionidae). Zootaxa
4691
(2):
zootaxa.4691.2.4
Hancock E. G. 2011. Order Diptera, family Limoniidae. Arthropod Fauna of the United Arab Emirates 4: 684-695.
Handlirsch A. 1906-1908. Die fossilen Insekten und die Phylogenie der rezenten Formen, Vol. 1-3. Leipzig:
Wilhelm Engelmann, 1430 p.
Handlirsch A. 1919. Eine neue Kalligrammide (Neuroptera) aus dem Solnhofener Plattenkalke. Senckenbergiana 1:
61-63.
2020).
Harbach R. E., Greenwalt D. 2012. Two Eocene species of Culiseta (Diptera: Culicidae) from the Kishenehn
Harder L. D. 1983. Functional differences of the proboscides of short- and long-tongued bees (Hymenoptera,
Heer O. 1856. Ueber die fossilen Insekten von Aix in der Provence. Vierteljahrsschrift der Naturforschenden
Gesellschaft in Zürich 1: 1-40.
Heikkilä M., Simonsen T. J., Solis M. А. 2018. Reassessment of known fossil Pyraloidea (Lepidoptera) with
descriptions of the oldest fossil pyraloid and a crambid larva in Baltic amber. Zootaxa 4483 (1): 101-127.
Hennig W. 1966. Bombyliidae im Kopal und im baltischen Bernstein (Diptera: Brachycera). Stuttgarter Beiträge zur
Naturkunde 166: 1-20.
Hennig W. 1972. Insektenfossilien aus der Unteren Kreide. IV. Psychodidae (Phlebotominae), mit einer kritischen
Übersicht über das phylogenetische System der Familie und die bisher beschriebenen Fossilien (Diptera).
Stuttgarter Beiträge zur Naturkunde 241: 1-69.
Herendeen P. S., Friis E. M., Pedersen K. R., Crane P. R. 2017. Palaeobotanical redux: revisiting the age of the
Hermes M. G., Melo G. A. R. 2006. Two new species of Trimeria de Saussure from Brazil, with biological notes and
a key to the Brazilian taxa (Hymenoptera, Vespidae, Masarinae). Zootaxa 1155 (1): 61-68. https://
doi.org/10.11646/zootaxa.1155.1.6
Hippa H., Mattsson I., Vilkamaa P. 2005. New taxa of the Lygistorrhinidae (Diptera: Sciaroidea) and their
implications for a phylogenetic analysis of the family. Zootaxa 960: 1-34.
Hippa H., Vilkamaa P. 2006. Recharacterization of Rhynchoheterotricha Freeman (Diptera, Sciaroidea), with
description of R. chandleri sp. n. from South Africa. Zootaxa 1167: 61-68.
Hodges S. A. 1997. Floral nectar spurs and diversification. International Journal of Plant Sciences 158 (S6): 81-88.
Hoffeins C., Hoffeins H. W., Jaschhof M. 2010. First record of Antlemon Loew (Diptera: Keroplatidae) in Baltic
amber. Studia Dipterologica 17: 143-149.
Houston T. F. 1983. An extraordinary new bee and adaptation of palpi for nectar-feeding in some Australian Collet-
idae and Pergidae (Hymenoptera). Australian Journal of Entomology
22
(3):
263-270.
doi: 10.1111/j.1440-6055.1983.tb01894.x
Huang D., Azar D., Cai C., Garrouste R., Nel A. 2015. The first Mesozoic pleasing lacewing (Neuroptera: Dilaridae).
Cretaceous Research 56: 274-277. doi: 10.1016/j.cretres.2015.06.001
831
Huang D. et al. 2016. New fossil insect order Permopsocida elucidates major radiation and evolution of suction
feeding in hemimetabolous insects (Hexapoda: Acercaria). Scientific Reports
6:
doi.org/10.1038/srep23004
Hull F. M. 1945. A revisional study of the fossil Syrphidae. Bulletin of the Museum of Comparative Zoology 95:
251-355.
Ibáñez-Bernal S., Solórzano Kraemer M., Stebner F., Wagner R. 2014. A new fossil species of Phlebotominae sand
fly from Miocene amber of Chiapas, Mexico (Diptera: Psychodidae). Paläontologische Zeitschrift 88 (2):
227-233. doi: 10.1007/s12542-013-0191-3
Ishida C., Kono M., Sakai S. 2009. A new pollination system: brood-site pollination by flower bugs in Macaranga
Iwasaki Y. 1987. Distribution and bionomics of the short-winged type of Panorpodes paradoxa MacLachlan
(Mecoptera, Panorpodidae) in the mountainous regions of Central Japan. Bulletin of the Sugadaira Montane
Research Center, University of Tsukuba 8: 73-82.
Janzen D. H. 1971. Euglossine bees as long-distance pollinators of tropical plants. Science 171 (3967): 203-205.
doi: 10.1126/science.171.3967.203
Jaschhof M. 2017. Heterotricha-group (Sciaroidea, unassigned to family). In: A. H. Kirk-Spriggs, B. J. Sinclair
(eds). Manual of Afrotropical Diptera, Vol. 2. Nematocerous Diptera and Lower Brachycera. Suricata 5.
Pretoria: South African National Biodiversity Institute, p. 601-605.
Jaschhof M., Kallweit U. 2004. The genus Aphrastomyia Coher & Lane, 1949 in Costa Rica (Insecta: Diptera:
Mycetophilidae). Faunistische Abhandlungen 25: 107-123.
Jervis M. 1998. Functional and evolutionary aspects of mouthpart structures in parasitoid wasps. Biological Journal
Jervis M., Vilhelmsen L. 2000. Mouthpart evolution in adults of the basal, ‘symphytan’, hymenopteran lineages.
Kania I. 2014. Subfamily Limoniinae Speiser, 1909 (Diptera, Limoniidae) from Baltic amber (Eocene): the genus
Kania I. 2015a. Subfamily Limoniinae Speiser, 1909 (Diptera, Limoniidae) from Baltic amber (Eocene): the genus
Elephantomyia Osten Sacken, 1860. PLoS ONE
10
pone.0117434
Kania I. 2015b. The taxonomy of selected genera of the subfamily Limoniinae (Diptera: Limoniidae) from Baltic
0034541ANZ2015.65.1.007
Kania I., Krzemiński W., Arillo A. 2016. First representative of the genus Helius Lepeletier and Serville, 1828
(Diptera, Limoniidae) from the Lower Cretaceous Álava amber (Spain). Cretaceous Research 63: 33-38.
doi: 10.1016/j.cretres.2016.02.018
Kania I., Krzemiński W., Arillo A. 2018. A new peculiar species of the genus Helius Lepeletier & Serville, 1828
(Diptera, Limoniidae) from Cretaceous Álava amber (Spain). Earth and Environmental Science Transactions
of the Royal Society of Edinburgh 107 (2-3): 231-237. doi: 10.1017/S1755691017000299
Kania I., Krzemiński W., Azar D. 2013. The oldest representative of Helius Lepeletier & Serville 1828 (Limoniidae,
Diptera) from Lebanese amber (Early Cretaceous). Insect Systematics and Evolution 44 (2): 231-238. doi:
10.1163/1876312X-44032093
Karolyi F., Colville J. F., Handschuh S., Metscher B. D., Krenn H. W. 2014. One proboscis, two tasks: Adaptations
to blood-feeding and nectar-extracting in long-proboscid horse flies (Tabanidae, Philoliche). Arthropod
Karolyi F., Szucsich N. U., Colville J. F., Krenn H. W. 2012. Adaptations for nectar-feeding in the mouthparts of
long-proboscid flies (Nemestrinidae: Prosoeca). Biological Journal of the Linnean Society 107 (2): 414-424.
doi: 10.1111/j.1095-8312.2012.01945.x
Kastinger C., Weber A. 2001. Bee-flies (Bombylius spp., Bombyliidae, Diptera) and the pollination of flowers. Flora
Kato M., Inoue T., Nagamitsu T. 1995. Pollination biology of Gnetum (Gnetaceae) in a lowland mixed dipterocarp
tb15702.x
Kearns C. A. 1992. Anthophilous fly distribution across an elevation gradient. The American Midland Naturalist 127
(1): 172-182. doi: 10.2307/2426332
Kerr P. H. 2010. Phylogeny and classification of Rhagionidae, with implications for Tabanomorpha (Diptera:
Kevan P. G. 1972. Insect pollination of High Arctic flowers. Journal of Ecology 60 (3): 831-847. doi: 10.2307/2258569
Kevan P. G., Baker H. G. 1983. Insects as flower visitors and pollinators. Annual Review of Entomology 28:
832
Khramov A. V., Chen J. 2020. A new species of Aetheogrammatidae (Insecta: Neuroptera) with a preserved proboscis
from the Lower Cretaceous of NE China. Acta Geologica Sinica (English Edition) 94 (5): 1714-1715. https://
doi.org/10.1111/1755-6724.14593
Khramov A. V., Lukashevich E. D. 2019. A Jurassic dipteran pollinator with an extremely long proboscis. Gondwana
Research 71: 210-215. doi: 10.1016/j.gr.2019.02.004
Khramov A. V., Nam G.-S., Vasilenko D. V. 2020. First long-proboscid flies (Diptera: Zhangsolvidae) from the
Lower Cretaceous of South Korea. Alcheringa: An Australasian Journal of Palaeontology 44 (1): 160-168.
Khramov A. V., Yan E., Kopylov D. S. 2019. Nature’s failed experiment: Long-proboscid Neuroptera (Sisyridae:
Paradoxosisyrinae) from Upper Cretaceous amber of northern Myanmar. Cretaceous Research 104: 104180.
Knab F. 1911. The food-habits of Megarhinus. Psyche 18: 80-82.
Kopeć K., Kania I., Krzemiński W. 2016. New and little known crane-fly species of the genera Helius, Elephantomyia
and Toxorhina (Diptera, Limoniidae) from Dominican and Mexican amber. Palaeontologia Electronica
19.2.25A: 1-14.
Kopylov D. S. et al. 2020. The fossil insect Lagerstätte Khasurty. Paleontological Journal 54 (11): 1221-1394
[в печати].
Krassilov V. A., Rasnitsyn A. P., Afonin S. A. 2007. Pollen eaters and pollen morphology: co-evolution through the
Permian and Mesozoic. African Invertebrates 48 (1): 3-11.
Krassilov V., Shuklina S. 2008. Arthropod trace diversity on fossil leaves from the mid-Cretaceous of Negev, Israel.
Alavesia 2: 239-245.
Krenn H. W. 2010. Feeding mechanisms of adult Lepidoptera: Structure, function, and evolution of the mouthparts.
Annual Review of Entomology 55: 307-327. doi: 10.1146/annurev-ento-112408-085338
Krenn H. W. 2019. Fluid-feeding mouthparts. In: H. W. Krenn (ed.). Insect Mouthparts. Form, Function, Development
and Performance. Zoological Monographs, vol. 5. Cham (Switzerland): Springer Nature, p. 47-99. https://
doi.org/10.1007/978-3-030-29654-4_3
Krenn H. W., Bauder J. A.-S. 2018. Morphological fine tuning of the feeding apparatus to proboscis length in
Krenn H., Gereben-Krenn B., Steinwender B., Popov A. 2008. Flower visiting Neuroptera: Mouthparts and feeding
behaviour of Nemoptera sinuata (Nemopteridae). European Journal of Entomology 105 (2): 267-277. doi:
10.14411/eje.2008.037
Krenn H. W., Kristensen N. P. 2000. Early evolution of the proboscis of Lepidoptera (Insecta): External morphology
of the galea in basal glossatan moths lineages, with remarks on the origin of the pilifers. Zoologischer
Anzeiger - A Journal of Comparative Zoology 239 (2): 179-196.
Krenn H. W., Mauss V., Plant J. 2002. Evolution of the suctorial proboscis in pollen wasps (Masarinae, Vespidae).
Krenn H. W., Plant J. D., Szucsich N. U. 2005. Mouthparts of flower-visiting insects. Arthropod Structure &
Development 34: 1-40. doi: 10.1016/j.asd.2004.10.002
Kristensen N. P., Nielsen E. S. 1981. Double-tube proboscis configuration in neopseustid moths (Lepidoptera:
Neopseustidae). International Journal of Insect Morphology and Embryology 10 (5-6): 483-486. https://
doi.org/10.1016/0020-7322(81)90027-1
Kristensen N. P., Scoble M. J., Ole K. 2007. Lepidoptera phylogeny and systematics: the state of inventorying moth
Krzemiński W., Ansorge J. 2005. A new rhagionid fly from the Lower Jurassic of Germany. Polskie Pismo
Entomologiczne 74: 369-372.
Krzemiński W., Blagoderov V., Azar D., Lukashevich E., Szadziewski R., Wedman S., Nel A., Collomb F.-M.,
Waller A., Nicholson D. B. 2019. True flies (Insecta: Diptera) from the late Eocene insect limestone
(Bembridge Marls) of the Isle of Wight, England, UK. Earth and Environmental Science Transactions of the
Royal Society of Edinburgh 110 (3-4): 495-554. doi: 10.1017/S1755691018000464
Krzemiński W., Jarzembowski E. 1999. Aenne triassica sp. n., the oldest representative of the family Chironomidae
(Insecta: Diptera). Polskie Pismo Entomologiczne 68: 445-449.
Krzemiński W., Kania I., Azar D. 2014. The Early Cretaceous evidence of rapid evolution of the genus Helius
Lepeletier & Serville, 1828 (Limoniidae, Diptera). Cretaceous Research 48: 96-101. doi: 10.1016/j.
cretres.2013.12.001
Krzemiński W., Krzemińska E. 2003. Triassic Diptera: descriptions, revisions and phylogenetic relations. Acta
Zoologica Cracoviensia 46 (Supplement): 153-184.
Krzemiński W., Krzemińska E., Kania I., Ross A. J. 2013. New taxa of Tanyderidae (Diptera) from Eocene Baltic
amber. Zootaxa 3599 (1): 59-66.
Krzemiński W., Krzemińska E., Papier F. 1994. Grauvogelia arzvilleriana sp. n. - the oldest Diptera species (Lower/
Middle Triassic of France). Acta Zoologica Cracovensia 37: 95-99.
833
Labandeira C. C. 1998. How old is the flower and the fly? Science 280: 57-59.
Labandeira C. C. 2000. The paleobiology of pollination and its precursors. In: R. A. Gastaldo, W. A. DiMichele
(eds). Phanerozoic Terrestrial Ecosystems. Paleontological Society Papers
6:
doi.org/10.1017/S1089332600000784
Labandeira C. C. 2005. Fossil history and evolutionary ecology of Diptera and their associations with plants. In: D.
K. Yeates, B. M. Wiegmann (eds). The Evolutionary Biology of Flies. New York: Columbia University Press,
p. 217-273.
Labandeira C. C. 2010. The pollination of mid mesozoic seed plants and the early history of long-proboscid insects.
Labandeira C. C. 2019. The fossil record of insect mouthparts: innovation, functional convergence, and associations
with other organisms. In: H. W. Krenn (ed.). Insect Mouthparts. Form, Function, Development and
Performance. Zoological Monographs, vol. 5. Cham (Switzerland): Springer Nature, p. 567- 670. https://
doi.org/10.1007/978-3-030-29654-4_17
Labandeira C. C., Currano E. D. 2013. The fossil record of plant-insect dynamics. Annual Review of Earth and
Labandeira C. C., Dilcher D. L., Davis D. R., Wagner D. L. 1994. Ninety-seven million years of angiosperm-insect
association: Paleobiological insights into the meaning of co-evolution. Proceedings of the National Academy
Labandeira С. С., Kvaček J., Mostovski M. B. 2007. Pollination drops, pollen, and insect pollination of Mesozoic
gymnosperms. Taxon 56 (3): 663-695. doi: 10.2307/25065853
Labandeira C. C., Yang Q., Santiago-Blay J. A., Hotton C. L., Monteiro A., Wang Y., Goreva Y., Shih C., Siljeström
S., Rose T. R., Dilcher D. L., Ren D. 2016. The evolutionary convergence of mid-Mesozoic lacewings and
Cenozoic butterflies. Proceedings of the Royal Society B 283 (1824): 20152893. doi: 10.1098/rspb.2015.2893
Lall S. B., Davies D. M. 1971. An intergeneric comparison of cephalic structure in tabanids (Diptera) in relation to
Lambkin C., Sinclair B., Pape T., Courtney G. W., Skevington J. H., Meier R., Yeates D. K., Blagoderov V.,
Wiegmann B. 2013. The phylogenetic relationships among infraorders and superfamilies of Diptera based on
morphological evidence. Systematic Entomology 38: 164-179. doi: 10.1111/j.1365-3113.2012.00652.x
Lantsov V. I. 2015. A new species of the genus Geranomyia Haliday, 1833 (Diptera: Limoniidae) from Transcaucasia.
Caucasian Entomological Bulletin 11 (2): 411-415. doi: 10.23885/1814-3326-2015-11-2-411-414
Laroca S., Michener C. D., Hofmeister R. M. 1989. Long mouthparts among “short-tongued” bees and the fine
structure of the labium in Niltonia (Hymenoptera, Colletidae). Journal of the Kansas Entomological Society
62 (3): 400-410.
Larson B. M. H., Kevan P., Inouye D. 2001. Flies and flowers: Taxonomic diversity of anthophiles and pollinators.
Lehnert M. S., Mulvane C. P., Brothers A. 2014. Mouthpart separation does not impede butterfly feeding. Arthropod
Structure & Development 43 (2): 97-102. doi: 10.1016/j.asd.2013.12.005
Lin X., Labandeira C. C., Shih C., Hotton C. L., Ren D. 2019. Life habits and evolutionary biology of new two-
winged long-proboscid scorpionflies from mid-Cretaceous Myanmar amber. Nature Communications 10 (1):
Lin X., Shih M. J. H., Labandeira C. C., Ren D. 2016. New data from the Middle Jurassic of China shed light on the
phylogeny and origin of the proboscis in the Mesopsychidae (Insecta: Mecoptera). BMC Evolutionary
Liu Q., Khramov A. V., Zhang H., Jarzembowski E. A. 2015. Two new species of Kalligrammula Handlirsch, 1919
(Insecta, Neuroptera, Kalligrammatidae) from the Jurassic of China and Kazakhstan. Journal of Paleontology
Liu Q., Lu X., Zhang Q., Chen J., Zheng X., Zhang W., Liu X., Wang B. 2018a. High niche diversity in Mesozoic
Liu Y., Huang D. 2019. A large new nemestrinid fly from the lower Cretaceous Yixian formation at Liutiaogou,
cretres.2018.11.018
Liu Z. J., Huang D., Cai C., Wang X. 2018b. The core eudicot boom registered in Myanmar amber. Scientific Reports
Lloyd D. G., Wells M. S. 1992. Reproductive biology of a primitive angiosperm, Pseudowintera colorata
(Winteraceae), and the evolution of pollination systems in the Anthophyta. Plant Systematics and Evolution
Loew H. 1850. Ueber den Bernstein und Bernsteinfauna. Programm der Königlichen Realschule zu Meseritz.
Berlin: E. S. Mittler und Sohn, 44 p.
834
Lu X. M., Zhang W. W., Liu X. Y. 2016a. New long-proboscid lacewings of the mid Cretaceous provide insights into
ancient plant-pollinator interactions. Scientific Reports 6: 25382. doi: 10.1038/srep25382
Lu X. M., Zhang W. W., Liu X. Y. 2016b. Nomenclatural validation of new genera and species of the superfamily
Psychopsoidea (Insecta: Neuroptera) from the mid-Cretaceous amber of Myanmar. Zoological Systematics
41 (3): 323-326. doi: 10.11865/zs.201636
Lukashevich E. D. 2009. Limoniidae (Diptera) in the Upper Jurassic of Shar Teg, Mongolia. Zoosymposia 3: 131-
Lukashevich E. D., Huang D.-Y., Lin Q.-B. 2006. Rare families of nematoceran Diptera (Hennigmatidae,
Blephariceridae, Perissommatidae) from the Jurassic of China. Studia Dipterologica 13: 127-143.
Lukashevich E. D., Krzemiński W. 2009. New Jurassic Tanyderidae (Diptera) from Asia with first find of larva.
Zoosymposia 3: 155-172.
Lukashevich E. D., Przhiboro A. A. 2011. New Chironomidae (Diptera) with elongated proboscises from the Late
Jurassic of Mongolia. ZooKeys 130: 307-322. doi: 10.3897/zookeys.130.1555
Lukashevich E. D., Ribeiro G. C. 2019. Mesozoic fossils and the phylogeny of Tipulomorpha (Insecta: Diptera).
Journal of Systematic Palaeontology 17 (2): 635-652. doi: 10.1080/14772019.2018.1448899
Lukashevich E. D., Shcherbakov D. E. 1997. A first find of net-winged midges (Blephariceridae, Diptera) in the
Mesozoic. Neues Jahrbuch für Geologie und Paläontologie, Monatshefte 1997 (11): 639-646.
Ma N., Huang J., Hua B. 2013. Functional morphology and sexual dimorphism of mouthparts of the short-faced
scorpionfly Panorpodes kuandianensis (Mecoptera: Panorpodidae). PLoS ONE 8: e60351. https://
doi.org/10.1371/journal.pone.0060351
Ma N., Huang J., Hua B. Z. 2014. Fine structure and functional morphology of the mouthparts of Bittacus planus
and Terrobittacus implicatus (Insecta: Mecoptera: Bittacidae). Zoologischer Anzeiger 253 (6): 441-448.
Mackay M. R.
1970. Lepidoptera in Cretaceous amber. Science
167
(3917):
379-380. doi:
10.1126/
science.167.3917.379
Magnarelli L. A. 1983. Nectar sugers and caloric reserves in natural populations of Aedes canadensis and Aedes
stimulans (Diptera: Culicidae). Environmental Entomology 12 (5): 1281-1286.
Maheu A., Nel A. 2020. The oldest representative of the bombyliid bee fly in the earliest Eocene French amber. Acta
Maheu A., Nel A. 2020. The oldest representative of the bombyliid bee fly in the earliest Eocene French amber. Acta
Makarkin V. N. 2016. Enormously long, siphonate mouthparts of a new, oldest known spongillafly (Neuroptera,
Sisyridae) from Burmese amber imply nectarivory or hematophagy. Cretaceous Research 65: 126-137.
doi: 10.1016/j.cretres.2016.04.007
Makarkin V. N. 2017. New taxa of unusual Dilaridae (Neuroptera) with siphonate mouthparts from the mid-
Manchester S. R., Dilcher D. L., Judd W. S., Corder B., Basinger J. F. 2018. Early eudicot flower and fruit:
Dakotanthus gen. nov. from the Cretaceous Dakotat Formation of Kansas and Nebraska, USA. Acta
Palaeobotanica 58 (1): 27-40. doi: 10.2478/acpa-2018-0006
Marshall S. A., Kirk-Spriggs A. H. 2017. Natural history of Diptera. In: A. H. Kirk-Spriggs, B. J. Sinclair (eds).
Manual of Afrotropical Diptera, Vol. 1. Introduction Chapters and Keys to Diptera Families. Suricata 4.
Pretoria: South African National Biodiversity Institute, p. 135-152.
Matile L. 1988. Dipteres Mycetophiloidea de Nouvelle-Caledonie 2. Keroplatidae. In: S. Tillier (ed.). Zoologia
Neocaledonica. Vol. l. Mémories du Museum national d’Histore naturelle Sér. A - Zoologie 142. Paris:
Muséum national d’Histoire naturelle, p. 89-135.
Mauss V., Kuba K., Krenn H. W. 2019. Evolution of the multifunctional mouthparts of adult Vespidae. In: H. W.
Krenn (ed.). Insect Mouthparts. Form, Function, Development and Performance. Zoological Monographs 5.
Mazzarolo L. A., Amorim D. S. 2000. Cratomyia macrorrhyncha, a Lower Cretaceous brachyceran fossil from the
Santana Formation, Brazil, representing a new species, genus and family of the Stratiomyomorpha (Diptera).
Insect Systematics & Evolution 31: 91-102.
Meillon B. de, Wirth W. W. 1979. Subsahar Ceratopogonidae (Diptera) IV. Rhinohelea, a new subgenus of
Forcipomyia from the south-west Cape Province, South Africa. Annals of the Natal Museum 23 (3): 881-
886.
Meillon B. de, Wirth W. W. 1991. The genera and subgenera (excluding Culicoides) of the Afrotropical biting
midges (Diptera: Ceratopogonidae). Annals of the Natal Museum 32: 27-147.
Melander A. L. 1903. A review of the North American species of Nemotelus. Psyche 10: 171-183. https://doi.
org/10.1155/1903/48943
835
Melander A. L., Cockerell T. D. A., Cockerell W. P. 1949. A report on some Miocene Diptera from Florissant,
Colorado. American Museum Novitates 1407: 1-63.
Mesler M. R., Ackerman J. D., Lu K. L. 1980. The effectiveness of fungus gnats as pollinators. American Journal of
Meunier F. 1904. Monographie des Cecidomyidae, des Sciaridae, des Mycetophilidae et des Chironomidae de
Meunier F. 1916. Sur quelques diptères (Bombylidae, Leptidae, Dolichopodidae, Conopidae et Chironomidae)
d’ambre de la Baltique. Tijdschrift voor Entomologie 59: 274-286.
Michelsen V. 2000. Oldest authentic record of a fossil calyptrate fly (Diptera): a species of Anthomyiidae from early
Coenozoic Baltic amber. Studia Dipterologica 7: 11-18.
Michener C. D. 2007. The Bees of the World. 2nd Edition. Baltimore: John Hopkins University Press, 953 p.
Michener C. D., Grimaldi D. A. 1988. The oldest fossil bee: Apoid history, evolutionary stasis, and antiquity of
social behavior. Proceedings of the National Academy of Sciences
85
doi.org/10.1073/pnas.85.17.6424
Michez D., De Meulemeester T., Rasmont P., Nel A., Patiny S. 2009. New fossil evidence of the early diversification
of bees: Paleohabropoda oudardi from the French Paleocene (Hymenoptera, Apidae, Anthophorini).
Michez D., Vanderplanck M., Engel M. S. 2011. Fossil bees and their plant associates. In: S. Patiny (ed.). Evolution
of Plant-Pollinator Relationships. Cambridge: Cambridge University Press, p.
doi.org/10.1017/CBO9781139014113.006
Midgley J. J., Bond W. J., Jarzembowski E. A., Grubb P. J. 1991. How important is biotic pollination and dispersal
to the success of the angiosperms? [and Discussion]. Philosophical Transactions: Biological Sciences 333
(1267): 209-215.
Miller W. E. 1997. Diversity and evolution of tongue length in hawkmoths (Sphingidae). Journal of the Lepidopterists’
Society 51 (1): 9-31.
Mochizuki K., Kawakita A. 2018. Pollination by fungus gnats and associated floral characteristics in five families of
Mohrig W., Kauschke E. 2017. New black fungus gnats (Diptera, Sciaridae) of North America. Part IV. Genera
Eugnoriste Coquillett and Keilbachia Mohrig. Zootaxa
4319
(1):
zootaxa.4319.1.3
Mostovski M. B. 1999. A brief review of brachycerous flies (Diptera, Brachycera) in the Mesozoic, with descriptions
of some curious taxa. In: P. Vrsansky (ed.). Proceedings of the First Palaeoentomological Conference,
Moscow, 1998. AMBA Projects International, Bratislava, p. 103-110.
Mostovski M. B. 2009. Brachyceran assemblages (Insecta: Diptera) as indicators of terrestrial palaeoenvironments
in the Late Mesozoic. Palaeontologia Africana 44: 121-125.
Mostovski M. B., Jarzembowski E. A. 2000. The first brachycerous flies (Diptera: Rhagionidae) from the Lower
Jurassic of Gondwana. Paleontological Journal 34 (Suppl. 3): 367-369.
Mostovski M. B., Martínez-Delclòs X. 2000. New Nemestrinoidea (Diptera: Brachycera) from the Upper Jurassic -
Lower Cretaceous of Eurasia, taxonomy and palaeobiology. Entomological Problems 31 (2): 137-148.
Müller G. C., Revay E. E., Schlein Y. 2011. Relative attraction of the sand fly Phlebotomus papatasi to local
flowering plants in the Dead Sea region. Journal of Vector Ecology 36 (Suppl. 1. Special Issue: Sand Fly
Müller H. 1873. Probosces capable of sucking the nectar of Anagraecum sesquipedale. Nature 8 (194): 223. doi:
10.1038/008223a0
Myskowiak J., Azar D., Nel A. 2016. The first fossil hilarimorphid fly (Diptera: Brachycera). Gondwana Research
Nagatomi A., Nagatomi H. 1990. A new Arthroteles from South Africa (Diptera, Rhagionidae). South Pacific Study
10 (2): 309-316.
Nagatomi A., Soroida K. 1985. The structure of the mouthparts of the orthorrhaphous Brachycera (Diptera) with
special reference to blood-sucking. Beiträge zur Entomologie 35 (2): 263-368. doi: 10.21248/contrib.
entomol.35.2.263-368
Nagatomi A., Yang D. 1998. A review of extinct Mesozoic genera and families of Brachycera (Insecta, Diptera,
Orthorrhapha). Entomologists’ Monthly Magazine 132: 95-192.
Naugolnykh S. V., Oskolski A. A. 2010. An advanced peltasperm Permoxylocarpus trojanus Naug. from the Lower
Permian of the Urals (Russia): an ancient case of entomophily in gymnosperms? Wulfenia 17: 29-43.
Nel A. 2006. Oldest records of Bombyliidae: Phthiriinae and Mythicomyiidae: Glabellulinae from the Lowermost
Eocene amber of France (Diptera: Bombylioidea). European Journal of Entomology 103 (1): 109-114. doi:
10.14411/eje.2006.016
836
Nel A. 2008. The oldest bee fly in the French Paleocene (Diptera: Bombyliidae). Comptes Rendus Palevol 7 (7):
Nel A., de Ploëg G. 2004. New fossil bee flies (Diptera: Bombylioidea) in the Lowermost Eocene amber of the Paris
Nel A., Petrulevičius J. F. 2003. New Palaeogene bees from Europe and Asia. Alcheringa: An Australasian Journal
Nel A., Roques P., Nel P., Prokop J., Steyer J. S. 2007. The earliest holometabolous insect from the Carboniferous:
A «crucial» innovation with delayed success (Insecta Protomeropina Protomeropidae). Annales de la Société
Entomologique de France 43 (3): 349-355. doi: 10.1080/00379271.2007.10697531
Nepi M., von Aderkas P., Wagner R., Mugnaini S., Coulter A., Pacini E. 2009. Nectar and pollination drops: how
different are they? Annals of Botany 104 (2): 205-219. doi: 10.1093/aob/mcp124
Ngô-Muller V., Garrouste R., Pouillon J.-M., Christophersen V., Christophersen A., Nel A. 2019. The first
representative of the fly genus Trentepohlia subgenus Mongoma in amber from the Miocene of Sumatra
Ngô-Muller V., Jouault C., Garrouste R., Nel A. 2020. Potential new evidences of bee fly parasitoidism on ground-
dwelling insects in ‘mid’-Cretaceous Burmese amber (Diptera: Bombyliidae). Cretaceous Research 114:
Nicolson S. W. 2007. Nectar consumers. In: S. W. Nicolson, M. Nepi, E. Pacini (eds). Nectaries and Nectar.
Dordrecht: Springer, p. 289-342.
Nidergas V., Hadrava J., Garrouste R., Prokop J., Schubnel T., Nel A. 2018. The first pipizine hoverfly from the
app.00500.2018
Nilsson L. A. 1988. The evolution of flowers with deep corolla tubes. Nature 334: 147-149. https://
doi.org/10.1038/334147a0
Nixon K. C., Crepet W. L. 1993. Late Cretaceous fossil flowers of ericalean affinity. American Journal of Botany 80
(6): 616-623. doi: 10.2307/2445430
Novokshonov V. G. 2002. Order Panorpida Latreille, 1802. The scorpionflies. In: A. P. Rasnitsyn, D. L. J. Quicke
(eds). History of Insects. Dordrecht: Kluwer Academic Publishers, p. 194-199.
Okuyama Y., Pellmyr O., Kato M. 2008. Parallel floral adaptations to pollination by fungus gnats within the genus
Mitella (Saxifragaceae). Molecular Phylogenetics and Evolution
46:
560-575. doi:
10.1016/j.
ympev.2007.09.020
Ollerton J. 2017. Pollinator diversity: distribution, ecological function, and conservation. Annual Review of Ecology,
Ollerton J., Masinde S., Meve U., Picker M., Whittington A. 2009. Fly pollination in Ceropegia (Apocynaceae:
Asclepiadoideae): biogeographic and phylogenetic perspectives. Annals of Botany 103 (9): 1501-1514.
doi: 10.1093/aob/mcp072
Ollerton J., Winfree R., Tarrant S. 2011. How many flowering plants are pollinated by animals? Oikos 120 (3):
Oosterbroek P. 2020. Catalogue of the Crane-Flies of the World. (Diptera, Tipuloidea: Pediciidae, Limoniidae,
Orford K. A., Vaughan I. P., Memmott J. 2015. The forgotten flies: the importance of non-syrphid Diptera as
pollinators. Proceedings of the Royal Society B: Biological Sciences 282 (1805): 20142934. https://
doi.org/10.1098/rspb.2014.2934
Palmer C. M. 2010. Diversity of feeding strategies in adult Mecoptera. Terrestrial Arthropod Reviews 3: 111-128.
doi: 10.1163/187498310X519716
Pape T., Blagoderov V., Mostovski M. B. 2011. Order Diptera Linnaeus, 1758. In: Z.-Q. Zhang (ed.). Animal
biodiversity: An outline of higher-level classification and survey of taxonomic richness. Zootaxa 3148 (1):
222-229.
Papier F., Nel A., Grauvogel-Stamm L. 1996. Deux nouveaux insectes Mecopteroidea du Buntsandstein supérieur
(Trias) des Vosges (France). Paleontologia Lombarda, Nuova serie 5: 37-45.
Pauw A., Stofberg J., Waterman R. J. 2009. Flies and flowers in Darwin’s race. Evolution 63 (1): 268-279. https://
doi.org/10.1111/j.1558-5646.2008.00547.x
Peñalver E., Arillo A., Pérez-de la Fuente R., Riccio M. L., Delclòs X., Barrón E., Grimaldi D. A. 2015. Long-
proboscid flies as pollinators of Cretaceous gymnosperms. Current Biology 25 (14): 1917-1923. https://doi.
org/10.1016/j.cub.2015.05.062
Peñalver E., Grimaldi D. 2006. Assemblages of mammalian hair and blood-feeding midges (Insecta: Diptera:
Psychodidae: Phlebotominae) in Miocene amber. Transactions of the Royal Society of Edinburgh: Earth
Sciences 96: 177-195.
837
Penney D., Jepson J. E. 2014. Fossil Insects: An Introduction to Palaeoentomology. Manchester: Siri Scientific
Press, 224 p.
Pérez-de la Fuente R., Delclòs X., Peñalver E., Arillo A. 2011. Biting midges (Diptera: Ceratopogonidae) from the
Early Cretaceous El Soplao amber (N Spain). Cretaceous Research 32 (6): 750-761. doi: 10.1016/j.
cretres.2011.05.003
Peris D., Pérez-de la Fuente R., Penalver E., Delclòs X., Barron E., Labandeira C. C. 2017. False blister beetles and
the expansion of gymnosperm-insect pollination modes before angiosperm dominance. Current Biology 27
Petersen M. J., Berton M. A., Wiegmann B. M. 2010. Phylogenetic synthesis of morphological and molecular data
reveals new insights into the higher-level classification of Tipuloidea (Diptera). Systematic Entomology 35
Petts S. L., Tang Y., Ward R. D. 1997. Nectar from a wax plant, Hoya sp., as a carbohydrate source for Lutzomyia
longipalpis (Diptera: Psychodidae). Annals of Tropical Medicine & Parasitology 91 (4): 443-446. doi:
10.1080/00034989761085
Pielowska A., Sontag E., Szadziewski R. 2018. Haematophagous arthropods in Baltic amber. Annales Zoologici 68
(2): 237-249. doi: 10.3161/00034541ANZ2018.68.2.003
Pinto I. D. 1972. Permian insects from the Paraná Basin, South Brazil - I. Mecoptera. Revista Brasileira de
Geociências 2: 105-116.
Podenas S. 1997. New Marochile Loew, 1950 (Diptera, Tanyderidae) from the Baltic amber. Mitteilungen aus dem
Geologisch-Paläontologischen Institut der Universität Hamburg 80: 173-177.
Podenas S. 2001. New species of Tricyphona crane flies (Diptera: Pediciidae) from Baltic amber (Eocene).
Proceedings of the Academy of Natural Sciences of Philadelphia
151:
31-39.
doi: 10.1635/0097-3157(2001)151[0031:NSOTCF]2.0.CO;2
Podenas S. 2002. New species of Helius crane flies (Diptera: Limoniidae) from Baltic amber (Eocene). Mitteilungen
aus dem Geologisch-Paläontologischen Institut der Universität Hämburg 86: 229-238.
Podenas S. 2003. A new subgenus for Trentepohlia crane flies (Diptera: Limoniidae) with elongated mouth parts,
from Baltic amber (Eocene). Proceedings of the Academy of Natural Sciences of Philadelphia 153 (1): 67-
Podenas S. 2005. Trentepohlia Bigot, 1854, crane flies (Diptera: Limoniidae) from Baltic amber (Eocene). Bulletin
Podenas S., Poinar G. O. 1999. New crane flies (Diptera: Limoniidae) from Dominican amber. Proceedings of the
Entomological Society of Washington 101 (3): 595-610.
Podenas S., Poinar G. O. 2001. New crane flies (Diptera: Tipulidae, Limoniidae) from Dominican and Mexican
ambers. Proceedings of the Entomological Society of Washington 103 (4): 863-878.
Podenas S., Poinar G. O. 2009. New crane flies (Diptera: Limoniidae) from Burmese amber. Proceedings of the
Podenas S., Poinar G. O. 2012. New short-palped crane flies (Diptera: Limoniidae) from Mexican amber. Proceedings
of the Entomological Society of Washington 114 (3): 347-371. doi: 10.4289/0013-8797.114.3.347
Poinar G. Jr. 2004. Palaeomyia burmitis (Diptera: Phlebotomidae), a new genus and species of Cretaceous sand flies
with evidence of blood-sucking habits. Proceedings of the Entomological Society of Washington 106 (3):
598-605.
Poinar G. Jr. 2010. Cascoplecia insulitis (Diptera: Cascopleciidae), a new family, genus and species of flower-
visiting, unicorn fly (Bibionomorpha) in Early Cretaceous Burmese amber. Cretaceous Research 31: 71-76.
Poinar G. Jr. 2019. A new genus of moths (Lepidoptera: Gracillarioidea: Douglasiidae) in Myanmar amber. Historical
Poinar G. O. Jr. 2020. Discoscapidae fam. nov. (Hymenoptera: Apoidea), a new family of stem lineage bees with
associated beetle triungulins in mid-Cretaceous Burmese amber. Palaeodiversity 13 (1): 1-9. https://
doi.org/10.18476/pale.v13.a1
Poinar G. Jr., Brown A. E. 2004. A new genus of primitive crane flies (Diptera: Tanyderidae) in Cretaceous Burmese
amber, with a summary of fossil tanyderids. Proceedings of the Entomological Society of Washington 106
(2): 339-345.
Poinar G. Jr., Brown A. E. 2006. The enigmatic Dacochile microsoma Poinar & Brown: Tanyderidae or
Bruchomyiinae? Zootaxa 1162: 19-31. doi: 10.11646/zootaxa.1162.1.2
Poinar G. O., Danforth B. N. 2006. A fossil bee from Early Cretaceous Burmese amber. Science 314 (5799): 614.
doi: 10.1126/science.1134103
838
Poinar G. O., Zavortink T. J., Brown A. 2019. Priscoculex burmanicus n. gen. et sp. (Diptera: Culicidae: Anophelinae)
from mid-Cretaceous Myanmar amber. Historical Biology
32
(9):
1157-1162. doi:
10.1080/08912963.2019.1570185
Poinar G. O., Zavortink T. J., Pike T., Johnston P. A. 2000. Paleoculicis minutus (Diptera: Culicidae) n. gen., n. sp.,
from Cretaceous Canadian amber, with a summary of described fossil mosquitoes. Acta Geologica Hispanica
35: 119-128.
Pont A. C. 1993. Observations on anthophilous Muscidae and other Diptera (Insecta) in Abisko National Park,
Popa M. E. 2019. Review of the bennettitalean genus Weltrichia. Journal of Palaeogeography 8: 12. https://
doi.org/10.1186/s42501-019-0023-9
Popov G. V. 2015. Syrphidae from the Cretaceous—refuted? In: H. Humphrey-Patton, X. Mengual (eds). 8th
International Symposium on Syrphidae, Monschau, 4-8 June 2015, Germany. Programme and Abstracts.
Bonn: Zoologisches Forschungsmuseum Alexander Koenig, p. 47.
Portillo N., Alomar O., Wäckers F. 2012. Nectarivory by the plant-tissue feeding predator Macrolophus pygmaeus
Rambur (Heteroptera: Miridae): Nutritional redundancy or nutritional benefit? Journal of Insect Physiology
Primack R. B. 1978. Variability in New Zealand montane and alpine pollinator assamblages. New Zealand Journal
of Ecology 1: 66-72.
Quate L. W., Vockeroth J. R. 1981. Psychodidae. In: J. F. McAlpine, D. M. Wood (eds). Manual of Nearctic Diptera.
Vol. 1. Research Branch, Agriculture Canada, Monograph 27. Ottawa, p. 293-300.
Rader R. et al. 2016. Non-bee insects are important contributors to global crop pollination. Proceedings of the
Rasnitsyn A. P., Michener C. D. 1991. Miocene fossil bumblebee from the Soviet Far East with comments on the
chronology and distribution of fossil bees (Hymenoptera: Apidae). Annals of the Entomological Society of
Rayner R. J., Waters S. B. 1990. A Cretaceous crane-fly (Diptera: Tipulidae): 93 million years of stasis. Zoological
Reinert J. F., Harbach R. E., Kitching I. J. 2009. Phylogeny and classification of tribe Aedini (Diptera: Culicidae).
Zoological Journal of the Linnean Society 157: 700-794.
Ren D. 1998a. Late Jurassic Brachycera from Northeastern China (Insecta: Diptera). Acta Zootaxonomica Sinica 23:
65-83.
Ren D. 1998b. Flower-associated Brachycera flies as fossil evidence for Jurassic angiosperm origins. Science 280
(5360): 85-88. doi: 10.1126/science.280.5360.85
Ren D., Labandeira C. C., Santiago-Blay J. A., Rasnitsyn A., Shih C., Bashkuev A., Logan M. A. V., Hotton C. L.,
Dilcher D. 2009. A probable pollination mode before angiosperms: Eurasian long-proboscid scorpionflies.
Science 326: 840-847. doi: 10.1126/science.1178338
Ren D., Labandeira C. C., Shih C. 2010a. New Mesozoic Mesopsychidae (Mecoptera) from Northeastern China.
Ren D., Shih C., Labandeira C. C. 2010b. New Jurassic pseudopolycentropodids from China (Insecta: Mecoptera).
Ribeiro G. C. 2002. A new fossil Helius (Diptera, Limoniidae) from Burmese amber. Studia Dipterologica 9 (2):
403-408.
Ribeiro G. C. 2008. Phylogeny of the Limnophilinae (Limoniidae) and early evolution of the Tipulomorpha
(Diptera). Invertebrate Systematics 22 (6): 627-694. doi: 10.1071/IS08017
Ribeiro G. C., Amorim D. S. 2002. A review of the genus Elephantomyia Osten Sacken in Brazil, with description
zootaxa.46.1.1
Rocha L. S. G., Burt T. O., de Mello-Patiu C. A., Skevington J. H. 2015. The first Stylogaster Macquart, 1835
(Diptera: Conopidae) fossil, from Oligo-Miocene Dominican amber, and some phylogenetic and
Saether O. A., Andersen T. 2003. Redescription of Rhinocladius Edwards (Diptera: Chironomidae: Orthocladiinae).
Zootaxa 217 (1): 1-20. doi: 10.11646/zootaxa.217.1.1
Schneider D., Wink M., Sporer F., Lounibos P. 2002. Cycads: their evolution, toxins, herbivores and insect
Schönenberger J., Friis E. M. 2001. Fossil flowers of ericalean affinity from the Late Cretaceous of Southern
Sweden. American Journal of Botany 88 (3): 467-480. doi: 10.2307/2657112
Scudder S. H. 1875. Fossil butterflies. Memoirs of the American Association for the Advancement of Science 1:
1-99.
839
Scudder S. H. 1877. The first discovered traces of fossil insects in the American Tertiaries. Bulletin of the United
States Geological Survey 3: 741-762.
Shcherbakov D. E., Lukashevich E. D., Blagoderov V. A. 1995. Triassic Diptera and initial radiation of the order.
International Journal of Dipterological Research 6 (2): 75-115.
Shields O. 1976. Fossil butterflies and the evolution of Lepidoptera. Journal of Research on the Lepidoptera 15:
132-143.
Shih C., Yang X., Labandeira C. C., Ren D. 2011. A new long-proboscid genus of Pseudopolycentropodidae
(Mecoptera) from the Middle Jurassic of China and its plant-host specializations. Zookeys 130: 281-297.
Shneider D., Wink M., Sporer F. 2002. Cycads: their evolution, toxins, herbivores and insect pollinators.
Sinclair B. J., Dauderon C. 2017. Empididae (Empidid dance flies or balloon flies). In: A. H. Kirk-Spriggs, B. J.
Sinclair (eds). Manual of Afrotropical Diptera. Vol. 2. Pretoria: South African National Biodiversity Institute,
p. 1221-1235.
Singer R. B. 2001. Pollinaion biology of Habenaria parviflora (Orchidaceae: Habenariinae) in southeastern Brazil.
Darwiniana 39 (3): 201-207.
Skalski A. W. 1979. Records of the oldest Lepidoptera. Nota Lepidopterologica 2 (1 & 2): 61-66.
Skalski A. W. 1990. An annotated review of fossil records of lower Lepidoptera. Bulletin of the Sugadeira Montane
Research Center, Tsukuba University 11: 125-128.
Smith D. M., Moe-Hoffman A. P. 2007. Taphonomy of Diptera in lacustrine environments: A case study from
Smith D. R., Naito T. 2015. Studies on Adelestini (Hymenoptera, Tenthredinidae), particularly the long-tongued
Nipponorhynchus Takeuchi of Japan. Journal of Hymenoptera Research 45 (1398): 1-14. doi: 10.3897/
JHR.45.5442
Sohn J., Labandeira C. C., Davis D. R. 2015. The fossil record and taphonomy of butterflies and moths (Insecta,
Lepidoptera): implications for evolutionary diversity and divergence-time estimates. BMC Evolutionary
Sohn J. C., Labandeira C. C., Davis D., Mitter C. 2012. An annotated catalog of fossil and subfossil Lepidoptera
Sohn J. C., Lamas G. 2013. Corrections, additions, and nomenclatural notes to the recently published world catalog
Solórzano Kraemer M. M. 2007. Systematic, palaeoecology, and palaeobiogeography of the insect fauna from the
Mexican amber. Palaeontographica Abteilung A 282 (1-6): 1-133. doi: 10.1127/pala/282/2007/1
Soponis A. R. 1980. Pseudorthocladius macrostomus, a new species of chironomid (Diptera) with a long proboscis.
Florida Entomologist 63 (4): 485-490. doi: 10.2307/3494533
Stebner F., Singh H., Rust J., Grimaldi D. A. 2017. Lygistorrhinidae (Diptera: Bibionomorpha: Sciaroidea) in early
Eocene Cambay amber. PeerJ 5:e3313. doi: 10.7717/peerj.3313
Stebner F., Solórzano Kraemer M. M., Ibáñez-Bernal S., Wagner R. 2015. Moth flies and sand flies (Diptera:
Psychodidae) in Cretaceous Burmese amber. PeerJ 3: e1254. doi: 10.7717/peerj.1254
Steffan W. A. 1981. Sciaridae. In: J. F. McAlpine, D. M. Wood (eds). Manual of Nearctic Diptera. Vol. 1. Research
Branch, Agriculture Canada, Monograph 27. Ottawa, p. 247-255.
Strelow J., Solórzano Kraemer M. M., Ibáñez-Bernal S., Rust J. 2013. First fossil horsefly (Diptera: Tabanidae) in
Miocene Mexican amber. Paläontologische Zeitschrift 87 (3): 437-444. doi: 10.1007/s12542-013-0171-7
Stuckenberg B. R. 1956. Notes on the genus Arthroteles Bezzi, with descriptions of two new species (Diptera: Errin-
idae). Annals of the Natal Museum 13: 313-335.
Stuckenberg B. 1998. A new Namibian wormlion species, with an account of the biogeography of Leptynoma
Westwood s. str. and its association with anthophily in the Fynbos and Succulent Karoo Biomes (Diptera,
Vermileonidae). Annals of the Natal Museum 39: 165-183.
Stuckenberg B. R. 2000. Namamyia, a new genus of Vermileonidae (Diptera) from Namaqualand, with a conspectus
of the Southern African genera and an account of their adaptations for anthophily. Annals of the Natal
Museum 41: 181—202.
Stuckenberg B. 2004. Labial morphology in Blephariceridae (Diptera: Nematocera): a new interpretation with
phylogenetic implications, and a note on colocephaly. African Invertebrates 45: 223-236.
Sukatsheva I. D., Beattie R., Mostovski M. B. 2007. Permomerope natalensis sp. n. from the Lopingian of South
Africa, and a redescription of the type species of Permomerope (Trichoptera: Protomeropidae). African
Invertebrates 48 (2): 245-251.
Szadziewski R. 1988. Biting midges (Diptera, Ceratopogonidae) from Baltic amber. Polskie Pismo Entomologiczne
58 (1): 3-283.
840
Szadziewski R. 1993. Biting midges (Diptera: Ceratopogonidae) from Miocene Saxonian amber. Acta Zoologica
Cracoviensia 35: 603-656.
Szadziewski R. 1996. Biting midges from Lower Cretaceous amber of Lebanon and Upper Cretaceous Siberian
amber of Taimyr (Diptera, Ceratopogonidae). Studia Dipterologica 3: 23-86.
Szadziewski R. 1998. New mosquitoes from Baltic amber (Diptera: Culicidae). Polskie Pismo Entomologiczne 67:
233-244.
Szadziewski R. 2018. Biting midges (Diptera: Ceratopogonidae) as indicators of biostratigraphy, ecological
reconstructions and identification of amber deposits. Earth and Environmental Science Transactions of the
Royal Society of Edinburgh 107 (2-3): 219-230. doi: 10.1017/S1755691017000378
Szadziewski R., Arillo A. 1998. Biting midges (Diptera: Ceratopogonidae) from the Lower Cretaceous amber from
Alava, Spain. Polskie Pismo Entomologiczne 67: 291-298.
Szadziewski R., Dominiak P., Sontag E., Krzemiński W., Wang B., Szwedo J. 2019a. Haematophagous biting
midges of the extant genus Culicoides Latrielle (Diptera: Ceratopogonidae) evolved during the mid-
Szadziewski R., Gilka W. 2011. A new fossil mosquito, with notes on the morphology and taxonomy of other species
reported from Eocene Baltic amber (Diptera: Culicidae). Polskie Pismo Entomologiczne 80 (4): 765-777.
doi: 10.2478/v10200-011-0057-5
Szadziewski R., Grogan W. L. 1998. Biting midges from Dominican amber. IV. Species of the tribes Dasyheleini and
Forcipomyiini (Diptera: Ceratopogonidae). Polskie Pismo Entomologiczne 67: 255-290.
Szadziewski R., Sontag E. 2013. A new species of Forcipomyia from Paleocene Sakhalin amber (Diptera:
Ceratopogonidae). Polskie Pismo Entomologiczne 82 (1): 59-62. doi: 10.2478/v10200-012-0023-x
Szadziewski R., Sontag E., Dominiak P. 2018. A new chironomid with long proboscis from Eocene Baltic amber
(Diptera: Chironomidae: Tanypodinae). Annales Zoologici 68 (3): 601-608. doi: 10.3161/00034541ANZ20
18.68.3.014
Szadziewski R., Sontag E., Krzemiński W., Szwedo J. 2019b. Two new genera of insectivorous biting midges
(Diptera: Ceratopogonidae) from mid-Cretaceous Burmese amber. Palaeoentomology 2 (6): 657-664. https://
doi.org/10.11646/palaeoentomology.2.6.17
Szadziewski R., Sontag E., Swedo J. 2019c. Mosquitoes of the extant avian malaria vector Coquillettidia Dyar, 1905
palaeoentomology.2.6.16
Szucsich N. U., Krenn H. W. 2000. Morphology and function of the proboscis in Bombyliidae (Diptera, Brachycera)
s004350000025
Taylor T. N., Millay M. A. 1979. Pollination biology and reproduction in early seed plants. Review of Palaeobotany
Terry I., Moore C. J., Walter G. H., Forster P. I., Roemer R. B., Donaldson J. D., Machin P. J. 2004. Association of
cone thermogenesis and volatiles with pollinator specificity in Macrozamia cycads. Plant Systematics and
Tiusanen M., Hebert P. D. N., Schmidt N. M., Roslin T. 2016. One fly to rule them all—muscid flies are the key
rspb.2016.1271
Théobald N. 1937. Les Insectes Fossiles des Terrains Oligocenes de France. Nancy: Imprimerie Georges Thomas,
473 p.
Thien L. B. 1969. Mosquitos and Habenaria obtusata (Orchidaceae). Mosquito News 29: 252-255.
Thien L. B., Bernhardt P., Devall M. S., Chen Z., Luo Y., Fan J. H., Yuan L. C., Williams J. H. 2009. Pollination
biology of basal angiosperms (ANITA Grade). American Journal of Botany 96: 166-182.
Thompson F. C. 1975. Notes on the genus Lygistorrhina Skuse with the description of the first Nearctic species
(Diptera: Mycetophiloidea). Proceedings of the Entomological Society of Washington 77: 434-435.
Tonnoir A. P. 1933. Descriptions of remarkable Indian Psychodidae and their early stages, with a theory of the
evolution of the ventral suckets of dipterous larvae. Records of Indian Museum 35: 53-75.
Van der Niet T., Johnson S. D. 2012. Phylogenetic evidence for pollinator-driven diversification of angiosperms.
Van Eldijk T. J. B., Wappler T., Strother P. K., van der Weijst C. M. H., Rajaei H., Visscher H., van de Schootbrugge
B. 2018. A Triassic-Jurassic window into the evolution of Lepidoptera. Science Advances 4 (1): e1701568.
doi: 10.1126/sciadv.1701568
Vockeroth J. R. 1981. Mycetophilidae. In: J. F. McAlpine, D. M. Wood (eds). Manual of Nearctic Diptera. Vol. 1.
Research Branch, Agriculture Canada, Monograph 27. Ottawa, p. 223-246.
841
Von Aderkas P., Prior N. A., Little S. A. 2018. The evolution of sexual fluids in gymnosperms from pollination drops
Vogel S., Martens J. 2000. A survey of the function of the lethal kettle traps of Arisaema (Araceae), with records of
pollinating fungus gnats from Nepal. Botanical Journal of the Linnean Society 133 (1): 61-100. https://doi.
org/10.1006/bojl.1999.0317
Waddington K. D., Herbst L. H. 1987. Body size and the functional length of the proboscis of honey bees. Florida
Entomologist 70: 124-128.
Wahlberg N., Wheat C. W., Peña C. 2013. Timing and patterns in the taxonomic diversification of Lepidoptera
Walther J. 1904. Die Fauna der Solnhofener Plattenkalke: Bionomisch betrachtet. Denkschriften der Medizinisch-
Naturwissenschaftlichen Gesellschaft zu Jena 11: 133-214.
Wardhaugh C. W. 2015. How many species of arthropods visit flowers? Arthropod-Plant Interactions 9 (6): 547-565.
Wang X. Q., Ran J. H. 2014. Evolution and biogeography of gymnosperms. Molecular Phylogenetics and Evolution
75: 24-40. doi: 10.1016/j.ympev.2014.02.005
Waters S. B. 1989. A Cretaceous dance fly (Diptera: Empididae) from Botswana. Systematic Entomology 14 (2):
Wedmann S., Yeates D. K. 2008. Eocene records of bee flies (Insecta, Diptera, Bombyliidae, Comptosia): their
palaeobiogeographic implications and remarks on the evolutionary history of bombyliids. Palaeontology 51
Westerweel J., Roperch P., Licht A., Dupont-Nivet G., Win Z., Poblete F., Ruffet G., Swe H. H., Thi M. K.,
Aung D. W. 2019. Burma Terrane part of the Trans-Tethyan arc during collision with India according to
palaeomagnetic data. Nature Geoscience 12 (10): 863-868. doi: 10.1038/s41561-019-0443-2
Wetschnig W., Depisch B. 1999. Pollination biology of Welwitschia mirabilis Hook. f. (Welwitschiaceae,
Gnetopsida). Phyton 39 (1): 167-183.
Whalley P. 1986. A review of the current fossil evidence of Lepidoptera in the Mesozoic. Biological Journal of the
Wichard W., Ggohn C., Seredzus F. 2009. Aquatic Insects in Baltic Amber - Wasserinsekten im Baltischen Bernstein.
Remagen-Oberwinter: Verlag Kessel, 336 p.
Wiegmann B. M. et al. 2011. Episodic radiations in the fly tree of life. Proceedings of the National Academy of
Wiegmann B. M., Yeates D. K. 2017. Phylogeny of Diptera. In: A. H. Kirk-Spriggs, B. J. Sinclair (eds). Manual of
Afrotropical Diptera, Vol. 1. Introduction Chapters and Keys to Diptera Families. Suricata 4. Pretoria: South
African National Biodiversity Institute, p. 253-265.
Wilhelmi A. P., Krenn H. W. 2012. Elongated mouthparts of nectar-feeding Meloidae (Coleoptera). Zoomorphology
Willkommen J., Grimaldi D. A. 2007. Diptera: true flies, gnats and crane flies. In: D. M. Martill, G. Bechly, R. F.
Loveridge (eds). The Crato Fossil Beds of Brazil: Window into an Ancient World. Cambridge: Cambridge
University Press, p. 369-387.
Willmann R. 1989. Evolution und phylogenetisches System der Mecoptera (Insecta: Holometabola). Frankfurt
a. M.: W. Kramer, 153 p. (Abhandlungen der Senckenbergischen Naturforschenden Gesellschaft 544).
Willmer P. G., Cunnold H., Ballantyne G. 2017. Insights from measuring pollen deposition: quantifying the pre-
eminence of bees as flower visitors and effective pollinators. Arthropod-Plant Interactions 11: 411-425.
Wirth W. W. 1994. The subgenus Atrichopogon (Lophomyidium) with a revision of the Nearctic species (Diptera:
Ceratopogonidae). Insecta Mundi 8: 17-36.
Wirth W. W., Hubert A. A. 1962. The species of Culicoides related to piliferus Root and Hoffman in Eastern North
America (Diptera, Ceratopogonidae). Annals of the Entomological Society of America 55: 182-195.
Wood D. M., Borkent A. 1989. Phylogeny and classification of the Nematocera. In: J. F. McAlpine, D. M. Wood
(eds). Manual of Nearctic Diptera. Vol. 3. Research Branch, Agriculture Canada, Monograph 32. Ottawa,
p. 1333-1370.
Woodcock T. S., Larson B. M. H., Kevan P. G., Inouye D. W., Linau K. 2014. Flies and flowers II: floral attractants
Wu S., Krzemiński W., Soszyńska-Maj A., Ren D. 2019. New fossil representative of the genus Helius (Diptera,
Limoniidae) from the little known and newly discovered locality Caergen Village of northeastern Tibetan
Yang Q., Makarkin V. N., Shih C., Ren D. 2015. New Aetheogrammatidae (Insecta: Neuroptera) from the Lower
Cretaceous Yixian Formation, China. Cretaceous Research
55:
cretres.2015.01.005
842
Yang Q., Shi C., Ren D., Wang Y., Pang H. 2018. New genus and species of sisyrids (Insecta, Neuroptera) from the
Yang Q., Wang Y., Labandeira C. C., Shih C., Ren D. 2014. Mesozoic lacewings from China provide phylogenetic
insight into evolution of the Kalligrammatidae (Neuroptera). BMC Evolutionary Biology 14: 126. https://doi.
org/10.1186/1471-2148-14-126
Yang Q., Zhao Y., Ren D. 2009. An exceptionally well-preserved fossil kalligrammatid from the Jehol Biota. Chinese
Ye X., Yao G., Shih C., Ren D., Wang Y. 2019. New bee flies from the mid-Cretaceous Myanmar amber (Brachycera:
Yeates D. K. 1994. The cladistics and classification of the Bombyliidae (Diptera: Asiloidea). Bulletin of the American
Museum of Natural History 219: 1-191.
Yeates D. K. 2002. Relationships of extant lower Brachycera (Diptera): a quantitative synthesis of morphological
Yeates D. K., Greathead D. 1997. The evolutionary pattern of host use in the Bombyliidae (Diptera): a diverse family
of parasitoid flies. Biological Journal of the Linnean Society
60
(2):
doi.org/10.1111/j.1095-8312.1997.tb01490.x
Yong T. H. 2003. Nectar-feeding by a predatory ambush bug (Heteroptera: Phymatidae) that hunts on flowers.
Annals of the Entomological Society of America
96
(5):
8746(2003)096[0643:NBAPAB]2.0.CO;2
Zalessky J. M. 1946. A new representative of the Permian Neuroptera. Comptes Rendus (Doklady) de l’Académie
des Sciences de l’URSS. 51 (7): 543-544.
Zavortink T., Poinar G. J. 2008. Toxorhynchites (Toxorhynchites) mexicanus, n. sp. (Diptera: Culicidae) from
Mexican amber: a New World species with Old World affinities. Proceedings of the Entomological Society
of Washington 110 (1): 116-125.
Zenker M. M., Penz C., de Paris M., Specht A. 2011. Proboscis morphology and its relationship to feeding habits in
Zeuner F. E., Manning F. J. 1976. A monograph on fossil bees (Hymenoptera: Apoidea). Bulletin of the British
Museum (Natural History), Geology 27: 149-268.
Zhang H. (ed.). 2007. The Fossils of China. Wuhan: Chinese Geological University Publishing House, 500 p.
Zhang J. 2013. Snipe flies (Diptera: Rhagionidae) from the Daohugou Formation (Jurassic), Inner Mongolia, and the
systematic position of related records in China. Palaeontology
56
(1):
doi.org/10.1111/j.1475-4983.2012.01192.x
Zhang J., Lukashevich E. D. 2007. The oldest known net-winged midges (Insecta: Diptera: Blephariceridae) from
the late Mesozoic of northeast China. Cretaceous Research 28 (2): 302-309. doi: 10.1016/j.cretres.2006.05.012
Zhang K. Y., Yang D., Ren D. 2007. Notes on the extinct family Protapioceridae, with description of a new species
Zhang Q., Chen K., Wang Y., Xue R., Jarzembowski E. A., Wang B. 2019. Long-proboscid zhangsolvid flies in mid-
Cretaceous Burmese amber (Diptera: Stratiomyomorpha). Cretaceous Research 98: 18-25. doi: 10.1016/j.
cretres.2019.01.019
Zhang Q., Rasnitsyn A. P., Wang B., Zhang H. 2018. Hymenoptera (wasps, bees and ants) in mid-Cretaceous
Burmese amber: A review of the fauna. Proceedings of the Geologists’ Association 129: 736-747. doi:
10.1016/j.pgeola.2018.06.004
Zhang Q., Wang B. 2017. Evolution of lower brachyceran flies (Diptera) and their adaptive radiation with
Zhang X., Li Y., Yang D. 2015. A review of the genus Elephantomyia Osten Sacken from China, with descriptions
of two new species (Diptera, Limoniidae). Zootaxa 3919 (3): 553-572. doi: 10.11646/zootaxa.3919.3.6
Zhao X., Wang B., Bashkuev A. S., Aria C., Zhang Q., Zhang H., Tang W., Engel M. S. 2020. Mouthpart homologies
and life habits of Mesozoic long-proboscid scorpionflies. Science Advances 6: eaay1259. doi: 10.1126/
sciadv.aay1259
Zherikhin V. V. 2002. Anthophily and evolution of entomophily. In: A. P. Rasnitsyn, D. L. J. Quicke (eds). History
of Insects. Dordrecht: Kluwer Academic Publishers, p. 353-358.
Zimmermann D., Randolf S., Aspöck U. 2019. From chewing to sucking via phylogeny—from sucking to chewing
via ontogeny: mouthparts of Neuroptera. In: H. W. Krenn (ed.). Insect Mouthparts. Form, Function,
Development and Performance. Zoological Monographs, vol. 5. Cham (Switzerland): Springer Nature,
Zwick P. 1998. Australian net-winged midges of the tribe Apistomyiini (Diptera: Blephariceridae). Australian
843
THE FOSSIL RECORD OF LONG-PROBOSCID NECTARIVOROUS INSECTS
Khramov A. V., Bashkuev A. S., Lukashevich E. D.
Key words: nectarivory, entomophily, pollination, flowering plants, pollination drops.
SUMMARY
The paper overviews the fossil record of insects with long mouthparts and beaks adapted for feeding
on floral nectar and pollination drops of extinct gymnosperms. For the first time the presence of
siphonate mouthparts is demonstrated for the Permian scorpionflies Permochoristidae и Permotanyder-
idae. The long-proboscid scorpionflies Mesopsychidae are newly recorded from the Upper Jurassic
of Kazakhstan. A new finding of a detached head of a long-proboscid nectar-feeding brachyceran fly
is reported from the Lower Cretaceous of Transbaikalian region. Three major radiations of the long-
proboscid nectar feeders - the Paleozoic, the Mesozoic and the Cenozoic - are identified. They were
related to the Paleozoic seed ferns, the Bennettitales and other Mesozoic entomophilous gymnosperms,
and the flowering plants, respectively. The earliest long-proboscid nectar feeders, found in the Lower
Permian deposits of the Cis-Urals, belong to Protomeropidae (stem-Amphiesmenoptera). Among few
other Paleozoic insects specialized for nectarivory probably were also long-proboscid scorpionflies
Permochoristidae. The diversity of long-proboscid nectar feeders shows a dramatic increase since the
Middle Jurassic. About 70 Mesozoic species in 12 families and three orders (Mecoptera, Neuroptera
and Diptera) with preserved long mouthparts are known to date, which could be clustered into three
morphogroups. With the beginning of the Cenozoic the long-proboscid Mecoptera and Neuroptera were
supplanted by Hymenoptera and Lepidoptera in the nectar-feeding niche, while Diptera, on the whole,
continued to stick to this specialization. Abundance of the long-proboscid nectar feeders before the
appearance of flowers with hidden nectar indicates that complex pollination systems first evolved with
gymnosperms. Therefore, insect pollination could not be considered as a key innovation of flowering
plants crucial for their evolutionary success.
844