НЕФТЕХИМИЯ, 2021, том 61, № 2, с. 226-234
УДК 669.283+665.658.2+661.53+533.72
СЕЛЕКТИВНОЕ ИЗВЛЕЧЕНИЕ МОЛИБДЕНА В ПРИСУТСТВИИ
АММИАКА ИЗ ОТРАБОТАННОГО
Mo-Co-Ni/Al2O3-КАТАЛИЗАТОРА ГИДРООБЕССЕРИВАНИЯ ОТХОДОВ
НЕФТЯНОЙ ПРОМЫШЛЕННОСТИ: ОПТИМИЗАЦИЯ ПРОЦЕССОВ И
КИНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ
© 2021 г. Hasan Arslanoğlu1,*
1 Kırşehir Ahi Evran University, Faculty of Engineering and Architecture, Department of Chemical and Process Engineering,
40200 Kırşehir, Turkey
*E-mail: hasan.arslanoglu@ahievran.edu.tr
Поступила в редакцию 25 мая 2020 г.
После доработки 14 августа 2020 г.
Принята к публикации 07 октября 2020 г.
Исследовано извлечение молибдена из отработанных катализаторов методом выщелачивания в ще-
лочной среде (аммиак, NH3) после прокалки. Экспериментальные данные показывают, что основными
параметрами, влияющими на выход молибдена при растворении, являются температура и длительность
прокалки, а также температура и продолжительность выщелачивания. Максимальная скорость растворе-
ния молибдена (92.12%) достигнута при оптимальных условиях выщелачивания: температура прокалки
600°C; время прокалки 120 мин; размер частиц +75-30 мкм; соотношение жидкость/твердое вещество
6 мл/г; концентрация аммиака 1 М; температура выщелачивания 80°C; время выщелачивания 90 мин;
скорость перемешивания 400 об./мин. Кинетические результаты показывают, что реакция растворения
молибдена лимитируется пленочной диффузией. Значение энергии активации (Ea) составило 10.89 кДж/
моль.
Ключевые слова: переработка отработанного катализатора, молибден (Mo), выщелачивание, кинетика,
аммиак
DOI: 10.31857/S0028242121020106
На нефтеперерабатывающих заводах для уско-
руются различными организациями как опасные,
рения химических реакций, происходящих в рам-
вредные для окружающей среды и здоровья чело-
ках различных термохимических каталитических
века [1, 6]. Таким образом, использование или ути-
процессов, используется большое количество не-
лизация отработанных катализаторов, содержащих
органических твердых катализаторов [1]. Эти ка-
молибден, приобретает сегодня все большее зна-
тализаторы, используемые главным образом для
чение. Существуют различные способы хранения,
удаления серы, азота и металлов из фракций, по-
утилизации, регенерации и восстановления этих
лученных из сырой нефти в процессе нефтепере-
драгоценных металлов [7]. В связи с соблюдением
работки, как правило, содержат глинозем и такие
экологических законов и правил, а также необходи-
металлы, как молибден, кобальт и никель [2]. Упо-
мостью наличия большого пространства, хранение
мянутые катализаторы со временем утрачивают
не является предпочтительным [3, 8]. Регенерация
свою активность из-за накопления на поверхности
катализаторов - привлекательный метод, хотя и он
примесей, входящих в состав сырья в различных
не является предпочтительным, поскольку техно-
каталитических процессах [3, 4]. Согласно оцен-
логия регенерации недоступна для нефтеперераба-
кам, количество катализаторов, потребляемых
тывающих заводов и возможна для ограниченного
нефтяной промышленностью в мире, составляет
числа циклов работы катализатора [9]. К тому же
170×103 т в год [5]. Отработанные катализаторы,
процесс регенерации невозможен для катализа-
составляющие лишь 4% от общего объема отходов
торов, утративших свою активность, особенно в
нефтеперерабатывающих заводов, классифици-
процессах термического разложения и фазового
226
СЕЛЕКТИВНОЕ ИЗВЛЕЧЕНИЕ МОЛИБДЕНА В ПРИСУТСТВИИ АММИАКА
227
Таблица 1. Элементный состав отработанного катализатора [17]
Компонент, мас. %
Al
Mo
Co
Ni
Ca
Fe
Zn
Cr
Cu
Cd
Pb
C
S
P
37.42
9.35
2.18
1.72
0.34
0.019
0.008
0.005
0.003
0.015
0.001
13.71
0.73
0.28
разделения [10]. В этой связи извлечение металлов
чтобы драгоценные металлы переходили в раствор
представляется более привлекательным методом,
наиболее эффективно [17, 18].
чем регенерация отработанного катализатора.
В литературе имеются исследования по извле-
Композитные катализаторы, содержащие мо-
чению драгоценных металлов из отработанных
либден, широко используются в нефтеперераба-
катализаторов, в которых в качестве реагентов вы-
тывающей промышленности. Молибден - один из
щелачивания непосредственно используются раз-
важнейших переходных элементов, который широ-
личные кислотные и щелочные растворители [1, 3,
ко применяется в качестве композитного материала
4, 18].
в сталелитейной промышленности, также входит
Цель настоящего исследования:
в состав многих промышленных катализаторов.
- извлечение молибдена из отработанного ка-
Наиболее часто молибденсодержащие композици-
тализатора гидрообессеривания, предварительно
онные катализаторы применяются при обессери-
прокаленного, с использованием растворителя
вании нефтяных, нефтехимических продуктов и
NH3;
материалов на основе угля. Так, при улавливании
- изучение воздействия температуры и времени
серы действие катализатора направлено на сниже-
прокалки, размера частиц, соотношения жидкость/
ние выбросов диоксида серы при сжигании топли-
твердое вещество, концентрации аммиака, темпе-
ва. Другой пример - молибденовые катализаторы,
ратуры выщелачивания, времени выщелачивания
используемые в установках гидрирования, обычно
и скорости перемешивания на эффективность рас-
утилизируют как отходы, которые в настоящее вре-
творения металла;
мя становятся необходимым сырьем для извлече-
- определение оптимальных условий испыта-
ния металлов [11, 12].
ний для максимального извлечения молибдена.
Извлечение металлов из отработанных ката-
лизаторов. Извлечение металлов - весьма удобный
МАТЕРИАЛЫ И МЕТОДЫ
метод для уменьшения загрязнения окружающей
среды, минимизации потребности в складских по-
Отработанный катализатор, использовавшийся
мещениях и удовлетворения потребностей рынка в
в экспериментах по гидрообессериванию, получен
металлах. Кроме того, отработанные катализаторы
с одного из нефтеперерабатывающих предприя-
считаются важным вторичным источником метал-
тий Румынии. Аммиак NH3, ч.д.а., используемый
в качестве реагента выщелачивания, приобретен в
лов, поскольку содержат такие ценные элементы,
Merck (27% NH3). Для получения желаемого разме-
как Co, Mo, Ni и Al [13]. С другой стороны, извле-
ра частиц отработанный катализатор дробили, из-
чение металлов из катализаторов, утративших ак-
мельчали и просеивали. Подготовленные фракции
тивность, может облегчить восстановление ката-
образцов сушили при 105°C в течение 2 ч и хра-
лизаторов [2]. В настоящее время для извлечения
нили в закрытых пластиковых контейнерах для ис-
драгоценных металлов из отработанных катализа-
пользования в экспериментах. Элементный состав
торов используются два различных метода - гидро-
отработанного катализатора приведен в табл. 1.
металлургический и пирометаллургический [14,
15]. Гидрометаллургические процессы являются
Прокаливание проводили при скорости нагре-
более предпочтительными по сравнению с пироме-
ва 10°C/мин в печи с контролируемой атмосферой
таллургическими из-за низкого энергопотребления
при различных температурах (200-800°C) и време-
и низких выбросов газов, а также высокой степени
ни обработки (10-360 мин), а прокаленные образ-
извлечения металлов [16]. В гидрометаллургиче-
цы охлаждали до комнатной температуры.
ских процессах используется предварительная об-
Изображения со сканирующего электронного
работка, например окисление и прокалка, для того,
микроскопа (СЭМ-изображения) твердого остатка,
НЕФТЕХИМИЯ том 61 № 2 2021
228
HASAN ARSLANOĞLU
Рис. 1. СЭМ-изображения и спектры катализаторов до выщелачивания (а), прокаленных (б) и после выщелачивания (в).
остающегося после выщелачивания отработанного
ного катализатора (рис. 2). Структура отработан-
катализатора до и после прокалки, а также в при-
ного катализатора достаточно сложна и аморфна.
сутствии раствора аммиака, показаны на рис. 1. В
Кроме того, видно, что основные характерные
то же время, согласно результатам рентгено-диф-
пики принадлежат оксидам металлов и металли-
ракционного анализа (XRD-анализ), элементы Co,
ческим соединениям серы (Al2O3, NiS2, MoO3).
Ni, Mo и Al присутствуют в структуре отработан-
Сера была найдена в элементарной форме (S), но
Рис. 2. Рентгенограмма отработанного катализатора Co-Mo-Ni/Al2O3.
НЕФТЕХИМИЯ том 61 № 2 2021
СЕЛЕКТИВНОЕ ИЗВЛЕЧЕНИЕ МОЛИБДЕНА В ПРИСУТСТВИИ АММИАКА
229
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакция растворения. В этом исследовании
pH среды для выщелачивания в диапазоне задан-
ных концентраций аммиака равнялся примерно
11.2, следовательно, реакция зависит от pH.
Был проведен ряд предварительных испытаний
прокаленных отработанных катализаторов гидроо-
бессеривания в реакциях [1, 2, 10]:
- прокаливание катализатора с обессериванием:
MoS2 + 3.5O2 → MoO3 + 2SO2,
(1)
– растворение прокаленного отработанного ка-
тализатора раствором аммиака:
MoO3+ 2NH4OH→ (NH4)2MoO4 + H2O.
(2)
На единицу количества необработанного ката-
лизатора было извлечено больше металла, чем из
отработанного катализатора после прокалки; при
прокаливании 25 г катализатора при 600°C потеря
веса составляет около 23.4%. Вероятно, это связа-
но с удалением влаги с поверхности оксида алю-
миния, реакциями карбонизации, сжиганием суль-
фидов металлов и дегидроксилированием оксида
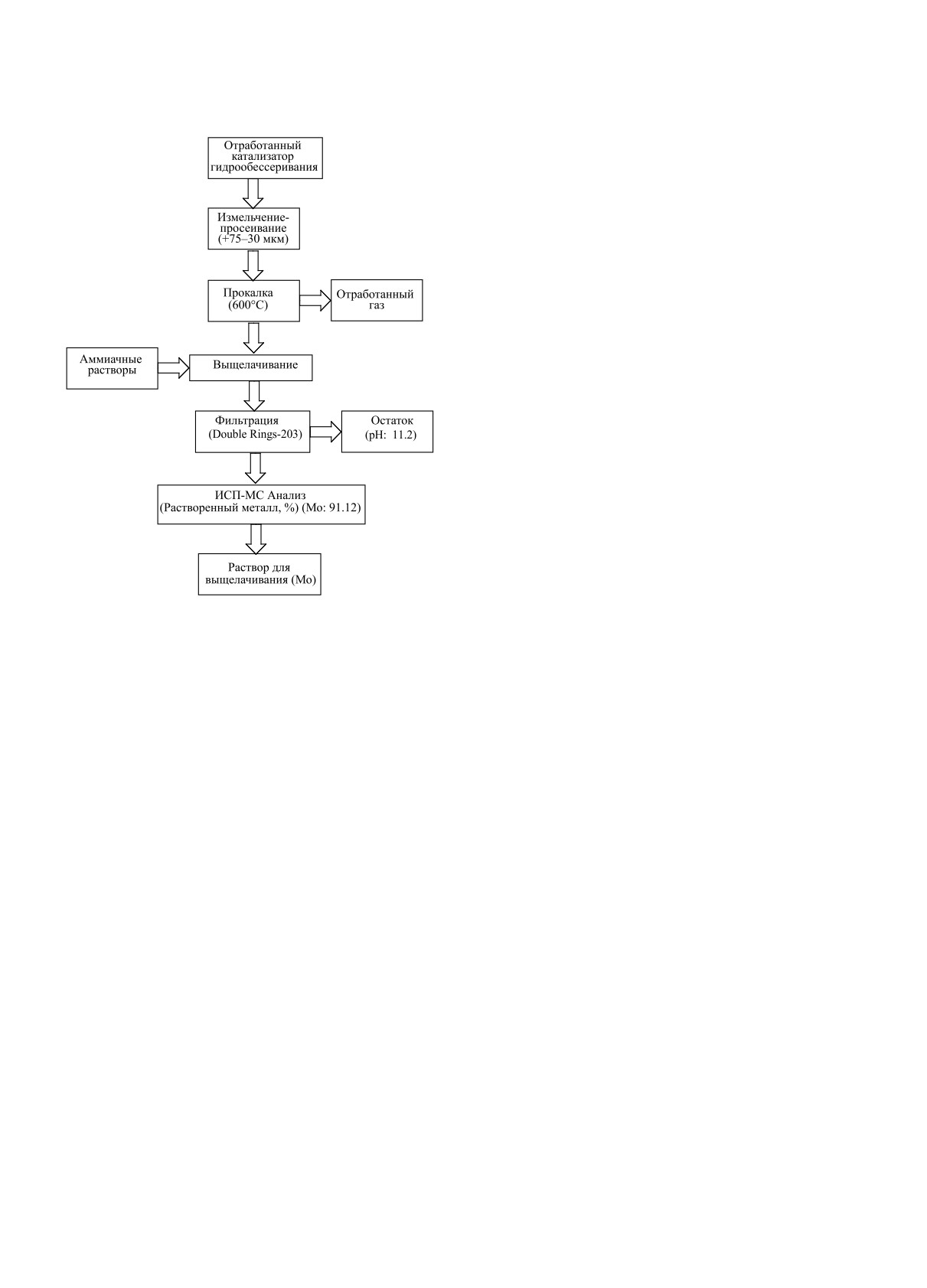
Рис. 3. Технологическая схема процессов прокалки и
алюминия. Кроме того, органические вещества,
выщелачивания отработанного катализатора.
содержащиеся в непрокаленном катализаторе, так-
же переходят в раствор во время выщелачивания.
Однако, в процессе выщелачивания прокаленного
никакие фазы, соответствующие углероду, не были
катализатора было установлено, что раствор имеет
идентифицированы. Однако предполагается, что
более низкое содержание органических веществ, и
углерод может присутствовать в виде углеводоро-
конечный pH раствора равен 11.2. По этой причине
дов или оксидов.
к отработанному катализатору гидрообессерива-
Эксперименты по выщелачиванию проводили с
ния была применена обработка прокалкой, а вли-
яющие на процесс независимые переменные были
использованием шейкера объемом 500 мл (Zhcheng
оптимизированы.
ZHWY-200D) с регулировкой температуры и скоро-
сти перемешивания. Температуру растворов амми-
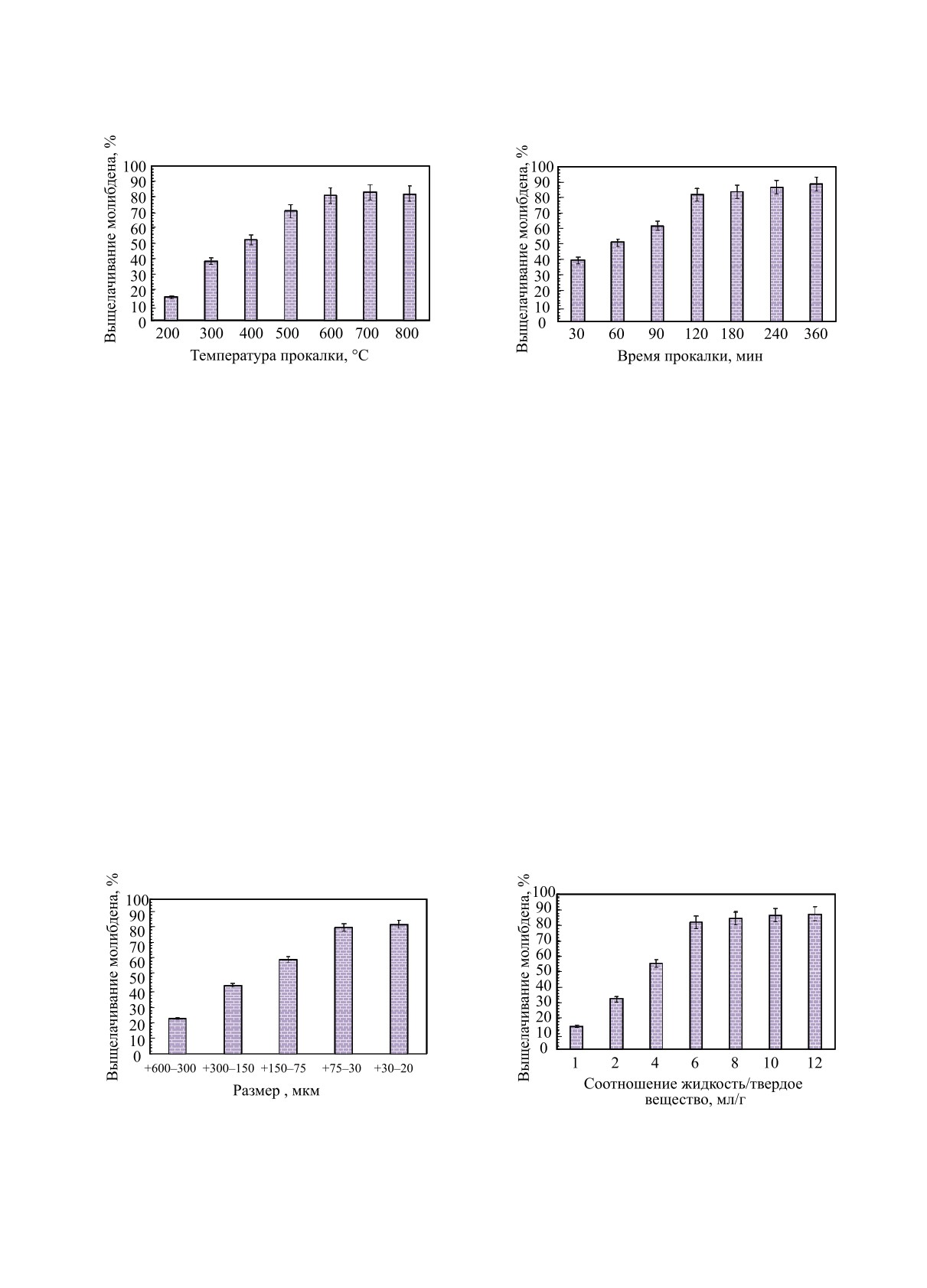
Влияние температуры и времени прокалки.
Результаты экспериментов, проведенных при раз-
ака, приготовленных при различных концентраци-
личных температурах и времени прокалки, пред-
ях (0.25-1.5 М), доводили до требуемых значений.
ставлены на рис. 4 и 5, соответственно. Из рисунков
Затем образцы прокаленного порошка добавляли к
видно, что показатели выщелачивания молибдена,
приготовленным растворам и перемешивали. Об-
как правило, увеличиваются с ростом температуры
разцы, взятые через определенные промежутки
и продолжительности прокалки. Интенсивность
времени, фильтровали и определяли количество ме-
растворения молибдена составила 81.92% при тем-
талла в фильтрате с помощью ИК-спектроскопии-
пературе прокалки 600°C и времени 120 мин. Од-
масс-спектрометрии (ИСП-МС) (Agilent
7500ce
нако, поскольку при дальнейшем увеличении про-
Octopole). Блок-схема процессов прокалки и вы-
должительности процесса роста эффективности
щелачивания, применяемая для извлечения драго-
выщелачивания металлов не наблюдалось, после-
ценных металлов из отработанного катализатора,
дующие эксперименты были проведены при тех же
представлена на рис. 3.
температуре и времени прокалки [15, 17].
НЕФТЕХИМИЯ том 61 № 2 2021
230
HASAN ARSLANOĞLU
Рис. 4. Зависимость эффективности выщелачивания
Рис. 5. Зависимость эффективности выщелачивания
молибдена из катализатора от температуры прокалки.
молибдена из катализатора от времени прокалки.
Влияние размера частиц. На рис. 6 представ-
Влияние соотношения жидкость/твердое ве-
лены результаты экспериментов, проведенных с
щество. На рис. 7 показана зависимость эффектив-
различными размерами частиц в диапазоне +30-
ности выщелачивания металла от различных соот-
20 мкм и +600-300 мкм, для исследования влия-
ношений жидкость/твердое вещество в диапазоне
ния размера частиц на выщелачивание молибдена.
1-12 мл/г. Согласно данным на рис. 7, эффектив-
На рис. 6 ясно видно, что увеличение размера ча-
ность растворения молибдена увеличивалась до
стиц отрицательно влияет на эффективность вы-
6 мл/г; более высокое соотношение жидкость/твер-
щелачивания металлов, а уменьшение их размера
дое вещество не показало значительного увеличе-
приводит к увеличению эффективности процесса.
ния количества выщелачиваемого молибдена. Это
Это можно объяснить высвобождением молибдена
связано с тем, что эффективность выщелачивания
из частиц меньшего размера и максимальным ко-
ограничивается отсутствием достаточного количе-
личеством металла, переходящего в раствор в ре-
ства растворителя для растворения металлов из-за
зультате реакции выщелачивания [19]. Так, эффек-
присутствия большого количество аммиака [20].
тивность выщелачивания молибдена с размером
Следовательно, в следующих экспериментах соот-
частиц +75-30 мкм составила 82.75%. С другой
ношение жидкость/твердое вещество оставалось
стороны, для частиц размером менее +75-30 мкм
на уровне 6 мл/г.
не наблюдалось значительного увеличения эффек-
тивности выщелачивания металла, поэтому после-
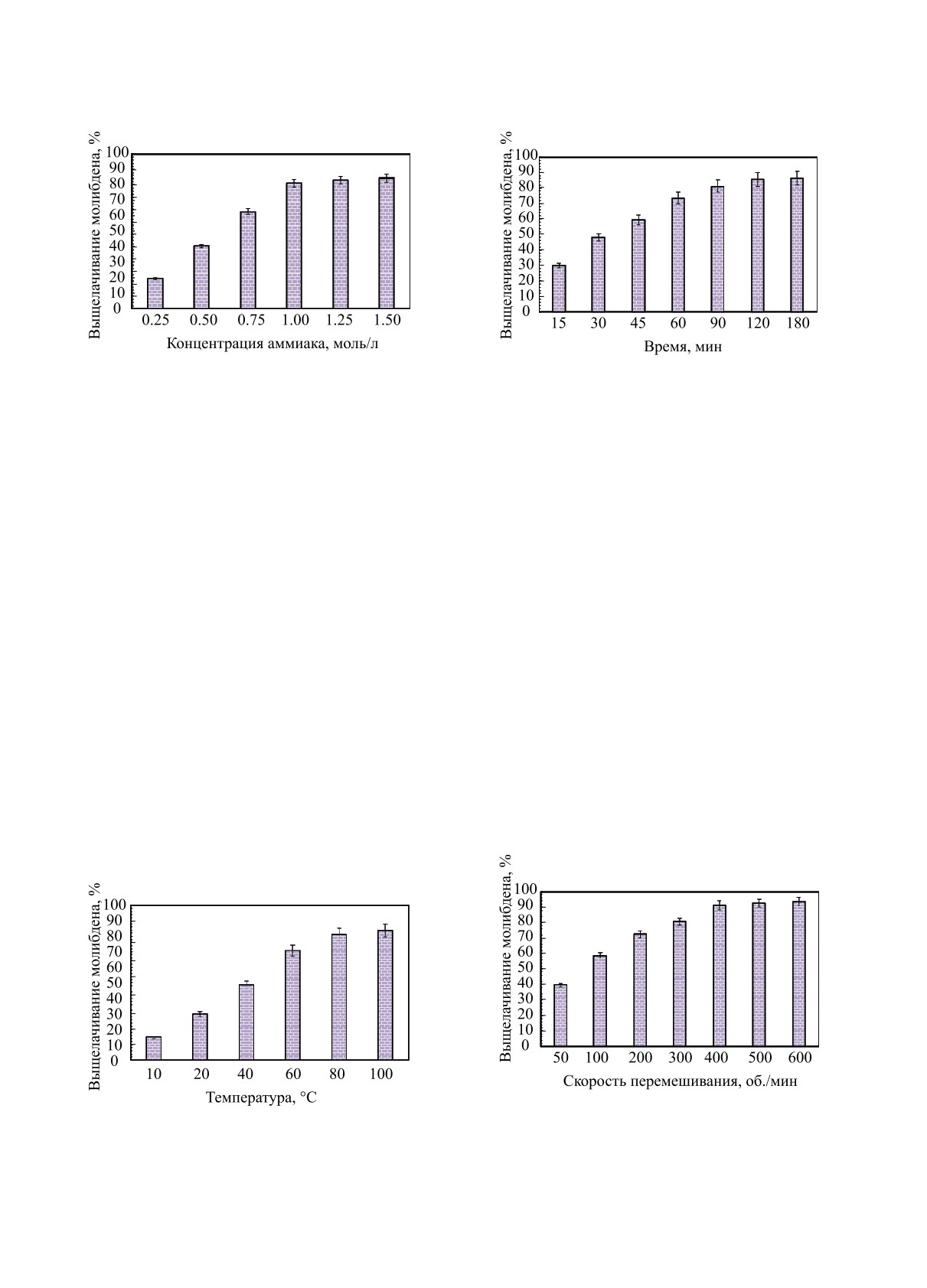
Влияние концентрации аммиака. Результа-
дующие исследования были продолжены с разме-
ты, полученные в результате экспериментов по
ром частиц + 75-30 мкм.
выщелачиванию, выполненных при различных
Рис. 6. Зависимость эффективности выщелачивания
Рис. 7. Влияние соотношения жидкость/твердое веще-
молибдена из катализатора от размеров его частиц.
ство на выщелачивание молибдена.
НЕФТЕХИМИЯ том 61 № 2 2021
СЕЛЕКТИВНОЕ ИЗВЛЕЧЕНИЕ МОЛИБДЕНА В ПРИСУТСТВИИ АММИАКА
231
Рис. 8. Зависимость эффективности выщелачивания
Рис. 9. Зависимость эффективности выщелачивания
молибдена из катализатора от концентрации аммиака.
молибдена от температуры выщелачивания.
концентрациях аммиака (0.25-1.5 M), показаны на
влияния на выходы выщелачивания молибдена; по-
рис. 8. Результаты показывают, что эффективность
лученные результаты представлены на рис. 9 и 10.
выщелачивания молибдена увеличилась при кон-
Результаты показали, что повышение температуры
центрации аммиака 1 М, а самые высокие значе-
приводит к увеличению эффективности выщелачи-
вания металла. Когда температура выщелачивания
ния выщелачивания молибдена при концентрации
повышается с 10 до 80°C, видно, что процент вы-
аммиака на уровне 0.5 М составляли 83.56%. При
щелачивания молибдена значительно увеличивает-
концентрациях аммиака выше 1 М значительного
ся, и через 60 мин молибден переходит в раствор
увеличения эффективности выщелачивания метал-
на 83.27%. С другой стороны, повышение темпе-
лов не наблюдалось [3, 4]. Поскольку известно, что
ратуры выше 80°C приводит лишь к незначитель-
увеличение концентрации растворителя повышает
ному увеличению эффективности выщелачивания
эффективность реакции в любом процессе выщела-
молибдена. Исходя из этих результатов можно
чивания, можно сказать, что в данном случае рост
сказать, что скорость увеличения эффективности
концентрации аммиака увеличит скорость раство-
выщелачивания при температурах выше 80°C от-
рения металлов. Остальные эксперименты прово-
носительно снижается [16]. Для последующих экс-
дились при концентрации аммиака 1 М.
периментов температура и время выщелачивания
Влияние температуры и времени выщела-
были выбраны равными 80°C и 90 мин, соответ-
чивания. Были также проведены эксперименты
ственно.
при различных температурах (10-100°C) и време-
Влияние скорости перемешивания. Экспери-
ни выщелачивания (15-180 мин) для изучения их менты по выщелачиванию проводили в диапазоне
Рис. 11. Зависимость эффективности выщелачивания
Рис. 10. Зависимость эффективности выщелачивания
молибдена из катализатора от скорости перемешивания
молибдена от времени выщелачивания.
раствора.
НЕФТЕХИМИЯ том 61 № 2 2021
232
HASAN ARSLANOĞLU
Таблица 2. Наиболее подходящие уравнения и значения коэффициента корреляции (R2) между временем выщелачи-
вания и значениями извлечения металлов кинетических моделей
Температура, °C
Модель
10
20
40
60
80
100
R2 = 0.9909
R2 = 0.9978
R2 = 0.9900
R2 = 0.9939
R2 = 0.9918
R2 = 0.9952
Контроль диффузии
y = 0.00004 -
y = 0.00009-
y = 0.00010-
y = 0.00025-
y = 0.00045-
y = 0.00075-
жидкой пленки
– 0.055
- 0.074
- 0.063
- 0.088
- 0.099
- 0.084
Контроль поверх-
R2 = 0.9564
R2 = 0.96712
R2 = 0.9826
R2 = 0.9794
R2 = 0.9872
R2 = 0.9802
ностных химических
y = 0.00097-
y = 0.0027-
y = 0.00081-
y = 0.00097-
y = 0.0027-
y = 0.0035 -
реакций
- 0.054
- 0.068
- 0.041
- 0.054
- 0.068
- 0.035
R2 = 0.9819
R2 = 0.9694
R2 = 0.9813
R2 = 0.9909
R2 = 0.9734
R2 = 0.9874
Контроль пленочной
диффузии через слой
y = 0.079-
y = 0.091-
y = 0.066-
y = 0.079-
y = 0.091-
y = 0.097-
продукта
- 0.174
- 0.134
- 0.119
- 0.174
- 0.134
- 0.172
скоростей перемешивания от 50 до 600 об./мин; ре-
держит до 96% молибдена, около 3.5% алюминия и
зультаты представлены на рис. 11. По результатам
0.5% кобальта + никеля.
экспериментов видно, что при увеличении скорости
Кинетические исследования. Кинетика про-
перемешивания с 50 до 400 об./мин эффективность
цессов выщелачивания, протекающих в твердой и
выщелачивания молибдена из использованного ка-
жидкой фазах, объясняется моделями гетерогенных
тализатора повышается до 92.54%. При скорости
реакций [18, 20, 21]. Это исследование проводи-
перемешивания 500 об./мин выход выщелачивания
лось в присутствии реагента для выщелачивания -
молибдена достигает 93.25%. Это может быть свя-
аммиака; для определения кинетики выщелачива-
зано с уменьшением толщины пограничного слоя
ния использовалась модель сжимающегося ядра.
вокруг частицы и увеличением количества метал-
Согласно этой модели, увеличение толщины диф-
ла, поступающего в раствор, вследствие увеличе-
фузионного слоя вокруг твердой частицы во вре-
ния скорости перемешивания [17]. Наивысшие зна-
мя реакции растворения значительно снижает
чения выщелачивания металлического молибдена
скорость растворения. В модели сжимающегося
достигали 94.75% при скорости перемешивания
ядра скорость реакции контролируется такими ме-
600 об./мин.
ханизмами, как диффузия жидкой пленки [уравне-
ние (3)], пленочная диффузия [уравнение (4)] и по-
Известно, что все металлы в структуре отрабо-
верхностная химическая реакция [уравнение (5)].
танного катализатора гидрообессеривания раство-
Соответственно, скорость реакции контролируется
ряются в определенном количестве в кислой среде.
самой медленной стадией из всех реакций выще-
Кроме того, некоторые металлы, такие как Мо и
лачивания.
Al, растворяют в присутствии щелочного выщела-
t = [1 - (1 - x)],
(3)
чивающего агента. Поскольку металлический Мо
является амфотерным, он легко растворяется как в
t = k[1 - 3(1 - x)2/3 + 2(1 - x)],
(4)
кислой, так и в основной выщелачивающей среде.
t = k[1 - (1 - x)1/3].
(5)
Однако, Co и Ni растворяются только в кислых сре-
В приведенных выше уравнениях: k - константа
дах. Эксперименты по выщелачиванию проводили
скорости реакции, мин-1; t - время реакции, мин;
при низких концентрациях аммиака (0.25-1.5 М) и
x - соотношение жидкость/твердое вещество. Кро-
в диапазоне pH 10-13. Для этих условий выщела-
ме того, вводится коэффициент корреляции реак-
чивания растворимость Мо высока, тогда как рас-
ций растворения, который рассчитывается с уче-
творимость Co и Ni довольно низкая. В растворе
том приведенных выше уравнений. Из значений
содержится высокий процент молибдена и мало
коэффициента корреляции следует, что экспери-
растворенного алюминия. Кроме того, кобальт и
ментальные результаты более сопоставимы с урав-
никель переходят в среду раствора до постоянных
нением (4) (R2 = 0.9948) (табл. 2). Соответственно,
равновесных значений. Таким образом, раствор со-
скорость растворения молибдена может быть вы-
НЕФТЕХИМИЯ том 61 № 2 2021
СЕЛЕКТИВНОЕ ИЗВЛЕЧЕНИЕ МОЛИБДЕНА В ПРИСУТСТВИИ АММИАКА
233
Рис. 12. Модель диффузии жидкой пленки [уравне-
ние (4)].
Рис. 13. График зависимости 1/T от ln k.
ражена механизмом пленочной диффузии в модели
но, что влияние температуры и времени прокалки
сжимающегося ядра (рис. 12).
наиболее значимо при выщелачивании металлов.
Самый высокий показатель выщелачивания молиб-
Энергия активации (Ea) процесса выщелачива-
дена (82.58%) был достигнут при температуре про-
ния может быть рассчитана путем построения гра-
калки 500°C и времени прокалки 120 мин. С другой
фика, как показано на рис. 13, с использованием
стороны, из экспериментальных данных видно, что
уравнения Аренниуса [уравнение (6)] и экспери-
время и температура выщелачивания существенно
ментальных результатов при различных темпера-
влияют на эффективность выщелачивания метал-
турах (10-100°C):
лов - максимальные значения растворения молиб-
дена (92.74%) были достигнуты при оптимальных
(6)
условиях испытаний: температура прокалки 600°C,
время прокалки 120 мин, размер частиц +75-
В уравнении Аренниуса: k - константа скорости
30 мкм, соотношение жидкость/твердое вещество
реакции, мин-1; A - предэкспоненциальный мно-
6 мл/г, концентрация аммиака 1 M, температура вы-
- энергия активации реакции, Дж/моль;
житель; Ea
щелачивания 80°C, время выщелачивания 90 мин,
R - универсальная газовая постоянная, Дж/моль K;
скорость перемешивания 400 об./мин. Результаты
дает информацию
Т - температура, K. Величина Ea
кинетических исследований показывают, что реак-
о механизме, с помощью которого контролируют-
ции растворения молибдена в присутствии аммиа-
ся гетерогенные реакции, а именно: гетерогенные
ка контролируются механизмом диффузии жидкой
реакции, контролируемые поверхностной химиче-
пленки. Значение энергии активации для молибде-
> 40 кДж/моль; механизм
ской реакцией, когда Ea
на составило 10.89 кДж/моль. Результаты показы-
< 20 кДж/моль [19,
пленочной диффузии при Ea
вают, что аммиак можно использовать в качестве
21, 22]. В этом исследовании значение энергии
растворителя при выщелачивании молибдена из
активации для молибдена было рассчитано как
отработанных катализаторов.
10.89 кДж/моль. Результаты показывают, что про-
цесс выщелачивания контролируется механизмом
КОНФЛИКТ ИНТЕРЕСОВ
поверхностной химической реакции.
Автор заявляет об отсутствии конфликта инте-
Таким образом, при изучении влияния темпера-
ресов, требующего раскрытия в данной статье.
туры и времени прокалки, размера частиц, соотно-
шения жидкость/твердое вещество, концентрации
аммиака, температуры и времени выщелачивания,
ИНФОРМАЦИЯ ОБ АВТОРЕ
а также параметров скорости перемешивания мо-
Arslanoğlu Hasan, ORCID - 0000-0002-3132-
либдена, используемого в катализаторе, показа-
4468
НЕФТЕХИМИЯ том 61 № 2 2021
234
HASAN ARSLANOĞLU
СПИСОК ЛИТЕРАТУРЫ
.1673412
1.
Akcil A.F., Vegliò F., Ferella F.,Okudan M.D., Tuncuk A.
13.
Motaghed M., Mousavi S.M., Rastegar S.O.,
A review of metal recovery from spent petroleum
Shojaosadati S.A. Platinum and rhenium extraction
catalysts and ash // Waste Manage. 2015. V. 45. P. 420-
from a spent refinery catalyst using bacillus megaterium
as a cyanogenic bacterium: Statistical modeling and
2.
Marafi M., Stanislaus A. Options and processes for spent
process optimization // Bioresour. Technol. 2014. V. 171.
catalyst handling and utilization // J. Hazard. Mater.
P.
biortech.2014.08.032
S0304-3894(03)00145-6
14.
Mishra D., Chaudhury G.R., Kim D.J., Ahn J.G.
3.
Marafi M., Stanislaus A. Spent catalyst waste
Recovery of metal values from spent petroleum
management: a review: Part I. Developments in
catalyst using leaching-solvent extraction technique //
hydroprocessing catalyst waste reduction and use //
Hydrometallurgy. 2010. V. 101. № 1-2. P. 35-40. https://
Resour. Conserv. Recycl. 2008. V. 52. № 6. P. 859-873.
doi.org/10.1016/j.hydromet.2009.11.016
15.
Mohapatra D., Park K.H. Selective recovery of Mo,
4.
Marafi M., Stanislaus A. Spent hydroprocessing
Co and Al from spent Co/Mo/γ-Al2O3 catalyst: Effect
catalyst management: a review: Part II. Advances in
of calcination temperature // J. Environ. Sci. Heal.
metal recovery and safe disposal methods // Resour.
Conserv. Recycl. 2008. V. 53. № 1-2. P. 1-26. https://
org/10.1080/10934520601188409
doi.org/10.1016/j.resconrec.2008.08.005
16.
Chaudhary A.J., Donaldson J.D., Boddington S.C.,
5.
Dufresne P. Hydroprocessing catalysts regeneration
Grimes S.M. Heavy metals in the environment.
and recycling // Appl. Catal. A: General. 2007. V. 322.
Part II: A hydrochloric acid leaching process for
the recovery of nickel value from a spent catalyst //
6.
Liu C., Yu Y., Zhao H. Hydrodenitrogenation of quinoline
Hydrometallurgy. 1993. V. 34. № 2. P.137-150. https://
over Ni-Mo/Al2O3 catalyst modified with fluorine and
doi.org/10.1016/0304-386X(93)90031-8
phosphorus // Fuel Process. Technol. 2005. V. 86. № 4.
17.
Ognyanova A., Ozturk A.T., De Michelis I., Ferella F.,
Taglieri G., Akcil A., Vegliò F. Metal extraction from
7.
Asghari I., Mousavi S.M., Amiri F., Tavassoli S.
spent sulfuric acid catalyst through alkaline and acidic
Bioleaching of spent refinery catalysts: A review // J.
leaching // Hydrometallurgy. 2009. V. 100. № 1-2.
Ind. Eng. Chem. 2013. V. 19. № 4. P. 1069-1081. https://
doi.org/10.1016/j.jiec.2012.12.005
18.
Visaliev M.Y., Shpirt M.Y., Kadiev K.M., Dvorkin V.I.,
8.
Macaskie L.E., Mikheenko I.P., Yong P., Deplanche
Magomadov E.E., Khadzhiev S.N. Integrated conversion
K., Murray A.J., Paterson-Beedle M., Vaughan D.
of extra-heavy crude oil and petroleum residue with the
Today’s wastes, tomorrow’s materials for environmental
recovery of vanadium, nickel, and molybdenum // Solid
protection // Hydrometallurgy. 2010. V. 104. № 3-4.
P.
org/10.3103/S0361521912020127
hydromet.2010.01.018
19.
Arslanoğlu H., Yaraş A. Recovery of precious metals
9.
Pradhan J.K., Kumar S. Metals bioleaching from
from spent Mo-Co-Ni/Al2O3 catalyst in organic acid
electronic waste by Chromobacterium violaceum
medium: process optimization and kinetic studies //
and Pseudomonads sp. // Waste Manage. Res.
Petrol. Sci. Technol. 2019. V. 37. № 19. P. 2081-2093.
10.1177/0734242X12437565
20.
Ferella F., Ognyanova A., De Michelis I., Taglieri G.,
10.
Marafi A., Fukase S., Al-Marri M., Stanislaus A.
Vegliò F. Extraction of metals from spent hydrotreating
A comparative study of the effect of catalyst type on
catalysts: Physico-mechanical pre-treatments and
hydrotreating kinetics of kuwaiti atmospheric residue //
leaching stage // J. Hazardous Materials. 2011. V.
org/10.1021/ef020177+
jhazmat.2011.05.005
11.
Arslanoğlu H., Yaraş A. Recovery of precious metals
21.
Yaraş A., Arslanoğlu H. Leaching behaviour of low-
from spent Mo-Co-Ni/Al2O3 catalyst in organic acid
grade copper ore in the presence of organic acid // Can.
medium: Process optimization and kinetic studies //
Petrol. Sci. Technol. 2019. V. 37. № 19. P. 2081-2093.
org/10.1080/00084433.2018.1473136
22.
Arslanoğlu H., Yaraş A. Chalcopyrite leaching with
12.
Yaraş A., Arslanoğlu H. Extraction of selected metals
hydrogen peroxide in formic acid medium // Trans.
from spent hydrodesulfurization catalyst using alkali
Indian Inst. Met. 2020. V. 73. № 3. P. 785-792 https://
leaching agent // Sep. Sci. Technol. 2020. V. 55. № 11.
doi.org/10.1007/s12666-020-01896-x.
НЕФТЕХИМИЯ том 61 № 2 2021