НЕФТЕХИМИЯ, 2021, том 61, № 4, с. 520-531
УДК 544.4; 544.43
НЕКАТАЛИТИЧЕСКАЯ ПАРОВАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ С1-С4
© 2021 г. В. И. Савченко1, Я. С. Зимин1,2,*, А. В. Никитин1,2, И. В. Седов1, В. С. Арутюнов1,2
1 ФГБУН Институт проблем химической физики РАН, Черноголовка Московской обл., 142432 Россия
2 ФГБУН Исследовательский центр химической физики им. Н.Н. Семенова РАН, Москва, 119991 Россия
*E-mail: iaroslaw.zimin@gmail.com
Поступила в редакцию 11 марта 2021 г.
После доработки 2 апреля 2021 г.
Принята к публикации 25 мая 2021 г.
Представлены результаты кинетического и термодинамического анализа некаталитической паровой кон-
версии (НПК) метана и углеводородов С2-С4 при температурах 1400-1800 K. Определена последователь-
ность конверсии углеводородов в синтез-газ и временные интервалы, соответствующие основным ста-
диям этого процесса. Показано, что начальной стадией является пиролиз углеводородов с образованием
ацетилена и Н2, в котором Н2О практически не принимает участия. Заметная конверсия Н2О начинается
существенно позже термической конверсии углеводородов уже под воздействием образовавшихся при
пиролизе радикалов и приводит к появлению радикалов ОН●, в результате взаимодействия которых с
ацетиленом образуются СО и Н2. Установлено, что ключевой стадией некаталитической паровой конвер-
сии углеводородов С1-С4, также как и их высокотемпературного взаимодействия с СО2 (углекислотной
конверсии), является конверсия ацетилена, образующегося при пиролизе углеводородов. Полученные
результаты важны для оптимизации высокотемпературных процессов получения синтез-газа парциаль-
ным окислением углеводородов.
Ключесвые слова: паровая конверсия, некаталитическая паровая конверсия, метан, углеводороды,
ацетилен, синтез-газ
DOI: 10.31857/S0028242121040079
Паровая конверсия метана (ПКМ) - крупномас-
содержаться в природном газе, приводят к быстрой
штабный промышленный процесс превращения
дезактивации никелевых катализаторов [5-7], по-
природного газа в синтез-газ и водород - основа
этому основной стадии паровой конверсии пред-
современной газохимии, на базе которой помимо
шествует предриформинг. Предриформинг углево-
водорода ежегодно производится более 250 млн т
дородов С2+ также проводят паровой конверсией с
таких крупнотоннажных продуктов, как аммиак,
использованием никелевых катализаторов, но при
метанол, синтетические жидкие углеводороды и
более низкой температуре (ок. 700 K), чем основ-
др. Основные закономерности каталитического ва-
ной процесс ПКМ, и при более низком соотноше-
рианта ПКМ исследованы достаточно подробно.
нии пар : газ (< 0.6). В этих условиях углеводороды
Процесс обычно проводят при температуре около
С2+ превращаются в CH4, СО, CO2 и водород, т.е.
1200 K и давлении до 4 МПа с использованием ни-
газ очищается от гомологов метана, что обеспечи-
келевых катализаторов, имеющих, для снижения
вает условия для его последующей паровой конвер-
диффузионных ограничений, форму колец Рашига
сии без осмоления и закоксовывания катализаторов
или Паля [1-4].
основной стадии получения синтез-газа [8-11].
Для предотвращения образования углерода и
Каталитическая паровая конверсия углеводо-
связанного с этим закоксовывания катализатора,
родов реализуется при температурах ниже 1200-
процесс проводят в избытке водяного пара, под-
1300 K. Но как показано в [12, 13], при паровой
держивая соотношение пар : углерод на уровне
конверсии при 1000-1200 K даже в отсутствие ка-
3 : 1. Примеси углеводородов С2+, которые могут
тализатора углеводороды С2+ подвергаются кре-
520
НЕКАТАЛИТИЧЕСКАЯ ПАРОВАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ С1-С4
521
кингу с образованием метана и непредельных угле-
пиролиз с образованием ацетилена и атомов Н●,
водородов; при этом практически не образуются
протекающий без заметного участия СО2. После-
оксиды углерода, а пары воды не расходуются. В
дующее взаимодействие атомов Н● с СО2 приводит
отсутствие катализаторов паровая конверсия угле-
к образованию радикалов ОН● и конверсии ацети-
водородов становится заметной только при темпе-
лена в реакции с ними, приводящей к образованию
ратурах выше 1300 K. Поскольку закономерности
конечных продуктов.
некаталитического парциального окисления угле-
В работе на основе термодинамического ана-
водородов при температурах 1400-1800 K пока
лиза и кинетического моделирования исследованы
мало изучены, необходимо более детальное ис-
равновесное распределение продуктов, кинетика
следование этого процесса в связи с появлением
и механизм некаталитической паровой конвер-
новых газохимических процессов получения син-
сии углеводородов С1-С4 в диапазоне температур
тез-газа парциальным окислением углеводородов в
1400-1800 K. Понимание закономерностей высо-
матричных конверторах [14], в реакторах с пори-
котемпературной паровой конверсии углеводоро-
стой насадкой [15, 16], в сверхадиабатических ре-
дов С1-С4 имеет большое значение для создания
акторах в режиме фронтального горения [17], при
новых высокоэффективных газохимических про-
совместном получении ацетилена и синтез-газа
цессов парциального окисления углеводородов,
увеличения в них выхода водорода и синтез-газа,
[18] и в ряде других.
снижения сажеобразования.
Получение синтез-газа в матричных конверто-
рах открывает возможность использования мало-
ресурсных и низконапорных источниов углеводо-
МЕТОДИКА ИССЛЕДОВАНИЯ
родных газов, попутного нефтяного газа, биогаза,
Используемые модели и программы
метана угольных пластов, а также жидких углево-
дородов без необходимости их транспортировки
Термодинамический анализ распределения про-
дуктов проводили с использованием программы
на значительные расстояния. Это серьезное пре-
«Терра» [24]. Для кинетических расчетов исполь-
имущество по сравнению с современными техно-
зовали механизм окисления легких углеводоро-
логиями конверсии природного газа в водород и
дов [25, 26], основанный на экспериментальных
синтез-газ [19] даже с учетом возможности их мо-
данных по окислению легких углеводородов в
дификации [20], которые слишком сложны и доро-
ударных трубах и машинах быстрого сжатия при
ги для малотоннажного применения.
T = 770-1580 K, Р = 101-5050 кПа, отношении
При матричной конверсии в результате окисле-
кислород/алкан = 1.0-4.0, близких к условиям
ния богатых углеводород-кислородных смесей в
данного исследования. Надежность механизма
зоне пламени при температурах до 1800 K помимо
подтверждена моделированием производства аце-
Н2, СО, СО2 и Н2О образуется смесь предельных
тилена парциальным окислением метана [27] в
и непредельных углеводородов С1-С3, которые при
условиях, аналогичных условиям данной работы,
высокой температуре постпламенной зоны активно
а также наших экспериментов по селективному
взаимодействуют с образовавшимися Н2О и СО2.
оксикрекингу попутных нефтяных газов [28]. В
Ранее нами было исследовано влияние добавок
обоих случаях было продемонстрировано хорошее
Н2О при матричной конверсии богатых метан-кис-
согласие между экспериментальными результатами
лородных смесей и показана большая роль в этом
и моделированием.
процессе гомогенной паровой конверсии ацетиле-
Моделирование проводили в программной сре-
на, образующегося как промежуточный продукт
де Chemical Workbench для модели проточного
пиролиза метана и других углеводородов [21, 22].
реактора [29] в изотермических условиях. Хотя в
Роль ацетилена как важнейшего промежуточ-
реальных условиях паровой риформинг не явля-
ного продукта конверсии углеводородов показана
ется изотермическим процессом, моделирование
в
[23] при исследовании высокотемпературно-
было выполнено для такого режима, чтобы упро-
го взаимодействия СО2 с углеводородами С1-С4.
стить анализ. Неизотермический характер процес-
Установлено, что первой стадией сухого (углекис-
са не оказывает существенного влияния на общую
лотного) риформинга углеводородов является их
физико-химическую картину процесса, в значи-
НЕФТЕХИМИЯ том 61 № 4 2021
522
САВЧЕНКО и др.
тельной степени изменяя только его временные ха-
мую информацию о равновесном распределении
рактеристики, как это видно из приводимых ниже
продуктов, а выполненные к настоящему времени
данных моделирования процесса при различных
исследования охватывают широкий диапазон усло-
температурах. Помимо существенного упрощения,
вий проведения процесса. Так, в работе [34] тер-
моделирование в изотермических условиях было
модинамический анализ парового риформинга ме-
целесообразно и по той причине, что по данным
тана для получения водорода или синтез-газа был
предварительных исследований максимальная
выполнен методом минимизации свободной энер-
конверсия образующегося C2H2 и максимальный
гии Гиббса системы в диапазонах соотношений
выход синтез-газа достигаются при максималь-
пара и метана от 0.5 до 3, давления реакции от 0.1
ной температуре в послепламенной зоне. Следо-
до 5 МПа и рабочей температуры от 600 до 1200 K.
вательно, для обеспечения максимального выхода
Однако во многих работах не учитывается измене-
синтез-газа желательно сохранять высокую темпе-
ние равновесного распределения продуктов, свя-
ратуру, поддерживая ее возможно более близкой к
занное с появлением в системе твердого углерода
начальной.
(Ств), хотя его образование является важным фак-
Детальное кинетическое моделирование позво-
тором, с которым связаны серьезные технологиче-
ляет проследить кинетику изменения концентрации
ские проблемы. Но для температур выше 1100 K
реагентов и продуктов в ходе процесса некаталити-
при соотношении пар : метан выше единицы при
ческой паровой конверсии (НПК) и последователь-
термодинамическом равновесии твердый углерод
ностью изменений, происходящих в системе:
отсутствует [35].
СnН2n+2 + Н2О → Продукты
В литературе мало работ, посвященных тер-
на ее пути к термодинамическому равновесию.
модинамическому анализу НПК углеводородов
Также как и в нашей предыдущей работе [22],
С2-С4, особенно при температурах выше 1400 K.
для верификации результатов, полученных с ис-
Можно отметить работу [36], в которой представ-
пользованием механизма приведенного в [25], в
лен термодинамический анализ парового рифор-
ряде случаев проводили кинетическое моделирова-
минга пропана и бутана в диапазоне температур
ние с использованием механизмов San-Diego [30] и
T = 550-1300 K и отношений пар : углерод = 0.5-5.
Konnov [31]; при этом установлена независимость
В работе [37] представлены расчеты равновесного
основных выводов о последовательности превра-
выхода продуктов паровой и окислительной кон-
щения продуктов при паровой конверсии метана от
версии смесей метана с углеводородами С2-С3 в
выбора конкретной кинетической модели.
интервале температур 700-1400 K при давлениях
0.1 и 4 МПа и установлены величины минималь-
ных отношений O2 и Н2O к метану, при которых
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
становится термодинамически не-
образование Ств
Термодинамический анализ
возможным. Таким образом, большинство иссле-
НПК углеводородных газов представляет собой
дований не выходит за рамки термодинамического
сложный радикальный процесс, в ходе которого
анализа области температур менее 1400 K.
распределение продуктов определяется кинети-
Ниже рассмотрены некоторые закономерности
ческими закономерностями составляющих его
распределения равновесного выхода продуктов
реакций. Термодинамический анализ позволяет
при ПК углеводородов (в расчете на 1 моль С) при
оценить предельные концентрации продуктов, со-
температурах 1200-1800 K для следующих реакций:
ответствующие достижению равновесия в задан-
СН4 + Н2О → Продукты,
(1)
ных условиях проведения процесса, и таким об-
С2Н6 + 2Н2О → Продукты,
(2)
разом показать степень удаленности реагирующей
С2Н4 + 2Н2О → Продукты,
(3)
системы от равновесного состояния.
С2Н2 + 2Н2О → Продукты,
(4)
В основополагающей работе Wagman [32] и в
С3Н8 + 3Н2О → Продукты,
(5)
последующей работе [33] был проведен всесто-
ронний термодинамический анализ НПК. Имеют-
С3Н6 + 3Н2О → Продукты,
(6)
ся программы, позволяющие получать необходи-
С4Н10 + 4Н2О → Продукты.
(7)
НЕФТЕХИМИЯ том 61 № 4 2021
НЕКАТАЛИТИЧЕСКАЯ ПАРОВАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ С1-С4
523
Таблица 1. Равновесный выход продуктов реакции С + nH + O → Продукты в расчете на 1 моль С при температурах
1200-1800 K и давлении 0.1 МПа
n = 3.0
n = 4.5
n = 6.0
Т, K
1200
1300
1400
1600
1800
1200
1300
1400
1600
1800
1200
1300
1400
1600
1800
СО
0.9717
0.9904
0.9961
0.9988
0.9995
0.9706
0.9881
0.9946
0.9984
0.9994
0.9658
0.9861
0.9936
0.9983
0.9992
Н2
1.4579
1.4803
1.4905
1.4972
1.4986
2.1850
2.2224
2.2369
2.2460
2.2480
2.9197
2.9658
2.9837
2.9952
2.9975
СО2
0.0070
0.0021
0.0005
0.0002
0.0001
0.0058
0.0020
0.0008
0.0002
0.0001
0.0055
0.0019
0.0008
0.0001
0.0001
Н2О
0.0143
0.0055
0.0028
0.0008
0.0004
0.0178
0.0079
0.0039
0.0012
0.0005
0.0231
0.0101
0.0049
0.0016
0.0007
СН4
0.0139
0.0071
0.0033
0.0009
0.0003
0.0236
0.0099
0.0046
0.0013
0.0005
0.0286
0.0120
0.0057
0.0016
0.0006
0.0073
0.0004
-
-
-
-
-
-
-
-
-
-
-
-
-
Ств
Н2/СО
1.500
1.495
1.496
1.499
1.499
2.251
2.249
2.249
2.249
2.249
3.023
3.008
3.003
3.000
3.000
Термодинамические расчеты и выявление об-
Для рассматриваемого интервала температур
щих закономерностей реакций (1)-(7) в расчете на
уже незначительное превышение количества угле-
1 моль С проводили, как и ранее при рассмотрении
водорода над Н2О по сравнению со стехиометрией
термодинамики УК углеводородов С1-С4 [23], пу-
даже при значениях n = 6 из-за пиролиза избытка
тем анализа равновесия в системе:
углеводорода приводит к появлению Ств. Наоборот,
С + nH + O → Продукты,
(8),
даже небольшой избыток Н2О предотвращает об-
разование Ств, что особенно заметно на примере
где n изменяется в пределах от 3 до 6. В качестве
реакции (4), для которой характерно наибольшие
начального состояния выбран синтез компонен-
значение Ств. При избытке Н2О по сравнению со
тов непосредственно из элементов. Например,
стехиометрическим равновесное распределение
для реакции (1) это начальное состояние будет
концентраций (выхода) CO, Н2, СО2 и Н2О соответ-
в расчете на один атом С: С + 6Н + О; для реак-
ствует равновесию реакции водяного газа:
ции (2): С + 5Н + О; для реакции (3): С + 4Н + О; для
реакции (4): С + 3Н + О; для реакции (5): С + 4.67Н + О
СО + Н2О ↔ СО2 + Н2; ΔH°298 = -41 кДж/моль-1.
(9)
и т.д. Таким образом, вместо того, чтобы рассма-
Кинетическое моделирование реакции
тривать равновесие для каждой из реакций (1)-(7),
НПК углеводородов С1-С4 при температурах
можно рассмотреть общие закономерности уста-
1400-1800 K
новления равновесия в реакции (8), где n изменяет-
ся в пределах от 3 до 6.
Некаталитическая паровая конверсия метана.
На рис. 1 и 2 представлены результаты расчетов
Данные по изменению равновесного выхода
конверсии реагентов и выхода основных продук-
продуктов в расчете на 1 моль С при n = 3.0, 4.5 и 6.0
тов в ходе паровой конверсии метана при 1600 K в
при температурах 1200-1800 K приведены в табл. 1.
изотермическом режиме при различных соотноше-
В табл. 1 представлено также расчетное значение
ниях [CH4]:[Н2О].
важного технологического параметра - соотноше-
ния СО/H2. Как видно из таблицы, при 1400-1800 K
Анализ результатов, представленных на рис. 1
равновесный выход СО и Н2 практически соот-
показывает, что скорость конверсии метана прак-
ветствует стехиометрии реакции взаимодействия
тически не зависит от начального соотношения
соответствующего углеводорода и Н2О. Такие ком-
[CH4] : [Н2О]. При этом в начальный период вре-
поненты, как H2О, СО2, СH4 присутствуют в следо-
мени в интервале ~10-4-2×10-2 с конверсия мета-
вых количествах. При температурах ниже 1600 K
на происходит, в основном, за счет его пиролиза с
в составе продуктов появляется Ств (в расчетах -
образованием С2-углеводородов - сначала этилена,
графит), выход которого тем выше, чем меньше n.
затем ацетилена, а Н2О практически не расходует-
НЕФТЕХИМИЯ том 61 № 4 2021
524
САВЧЕНКО и др.
2.5
0.30
1
4
2
0.25
2.0
0.20
3
1.5
4
0.15
2
1.0
0.10
1
3
0.5
0.05
0.0
0.00
-6.0
-5.0
-4.0
-3.0
-2.0
-1.0
0.0
1.0
2.0
lg t, c
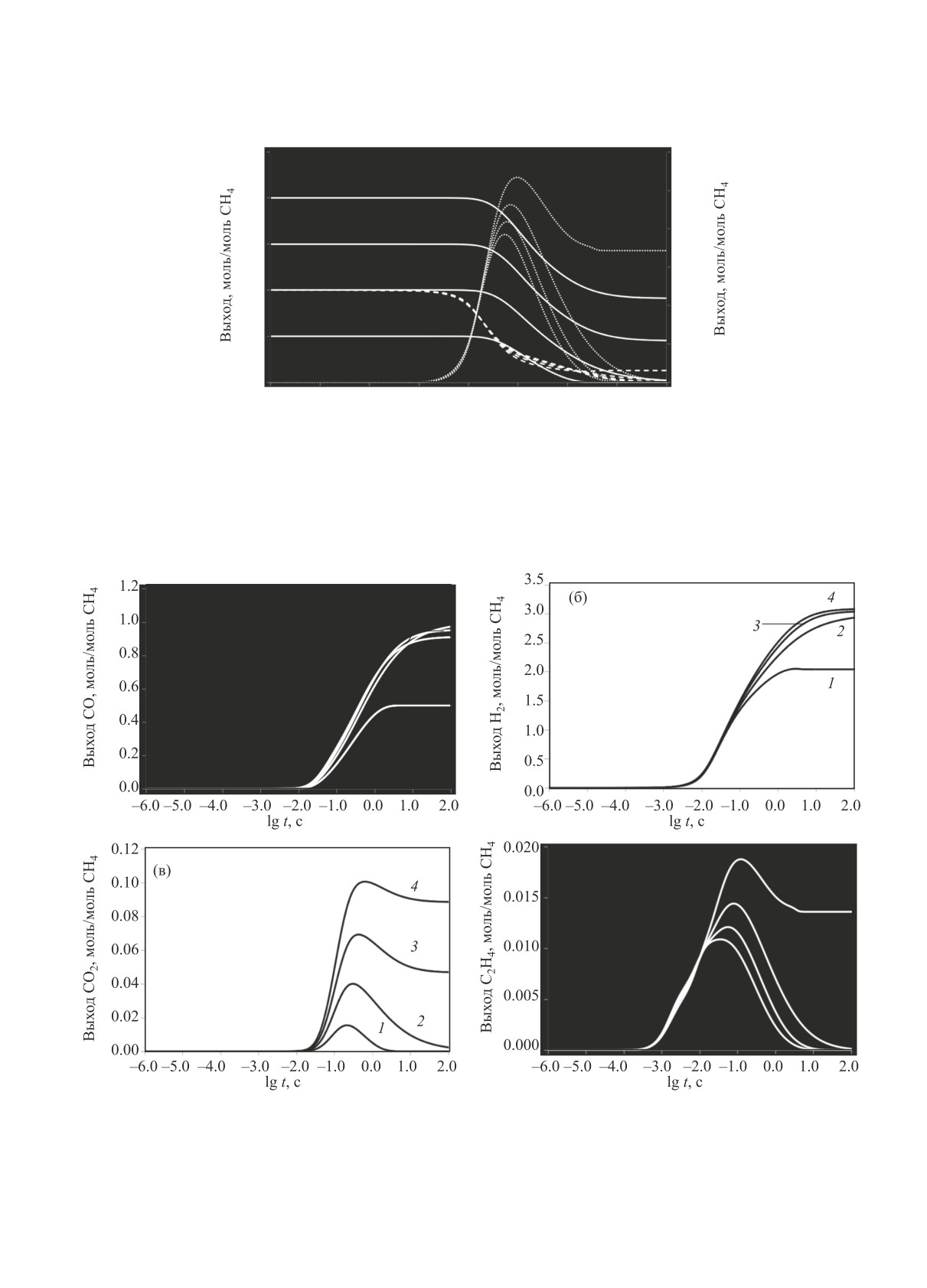
Рис. 1. Конверсия реагентов и выход ацетилена при различных соотношениях [CH4] : [Н2О] при 1600 K в изотермическом
режиме. Сплошные линии - Н2О, пунктирные линии - СН4, точки - С2Н2. 1 - [CH4]:[H2O] = 1:0.5; 2 - [CH4]:[H2O] = 1:1;
3 - [CH4]:[H2O] = 1:1.5; 4 - [CH4] : [H2O] = 1 : 2.
Рис. 2. Изменение выхода СО (а), Н2 (б), СО2 (в) и С2Н4 (г) в ходе паровой конверсии метана при различных соотношениях
[CH4] : [Н2О] при 1600 K в изотермическом режиме. 1 - [CH4]:[H2O] = 1:0.5; 2 - [CH4]:[H2O] = 1:1; 3 - [CH4]:[H2O] = 1:1.5;
4 - [CH4]:[H2O] = 1:2.
НЕФТЕХИМИЯ том 61 № 4 2021
НЕКАТАЛИТИЧЕСКАЯ ПАРОВАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ С1-С4
525
ся. Скорости образования этилена и ацетилена не
зависят от начального соотношения [CH4] : [Н2О].
При всех приведенных на рис. 1 соотношениях
[CH4] : [Н2О] заметная конверсия Н2О начина-
ется при времени реакции >10-2 с, т.е. уже после
заметной конверсии метана и появления в систе-
ме ацетилена. После достижения максимума, при
времени реакции около 10-1 с и конверсии ~70%
метана, концентрация ацетилена снижается. При
этом, чем выше начальная концентрация Н2О,
тем быстрее расходуется ацетилен и ниже пик его
концентрации. При соотношении [CH4] : [Н2О] =
1 : 0.5 Н2О расходуется за ~10 с, после чего реак-
ция прекращается, и остается непрореагировавший
С2Н2. Представленные результаты, а также расчеты
баланса компонентов указывают, что при паровой
конверсии практически весь метан расходуется в
процессе пиролиза на образование С2-углеводоро-
дов, а конверсия Н2О становится заметной только
после их образования, и преимущественно связана
с паровой конверсией образовавшегося ацетилена.
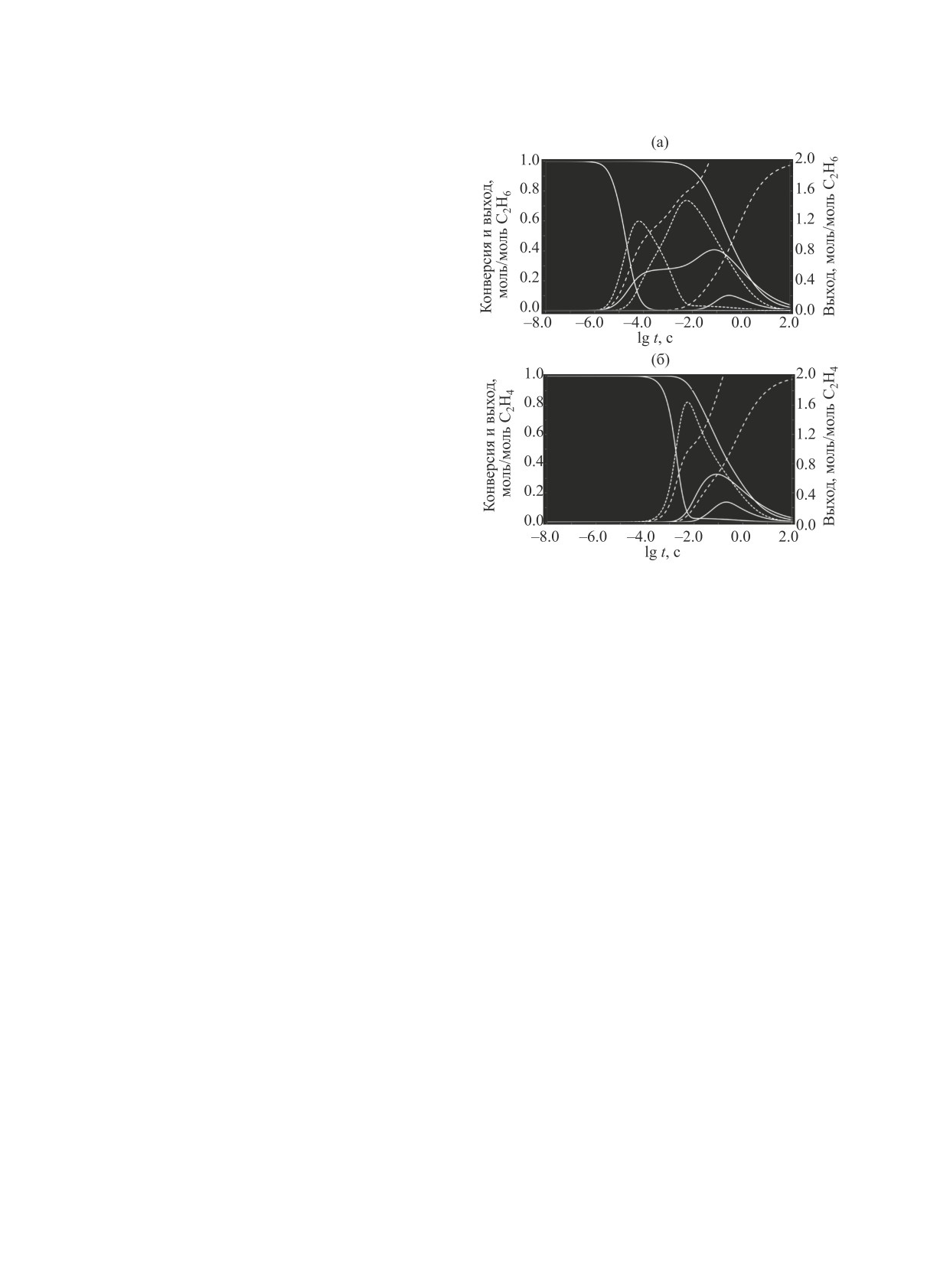
Рис. 3. Конверсия реагентов и выход продуктов паро-
Представленные на рис. 2 результаты расче-
вой конверсии этана (a) и этилена (б) в изотермиче-
та выхода Н2, СО и СО2 в ходе процесса показы-
ских условиях при объемном соотношении Н2О/С2Н6 и
вают его слабую зависимость от соотношения
Н2О/С2Н4 = 2:1 и Т = 1600 K.
[CH4]:[Н2О] при [CH4]:[Н2О] ≤ 1.
Расчеты с использованием других известных
основных промежуточных продуктов конверсии
кинетических механизмов окислительной конвер-
метана образуются этилен и в незначительных ко-
сии углеводородов, в частности механизмов San-
личествах этан, было проведено моделирование
Diego и Konnov [30, 31], показали независимость
кинетики паровой конверсии в данных условиях
сделанных выводов о последовательности превра-
и этих соединений (рис. 3). Этан в интервале от
щения продуктов при паровой конверсии метана от
10-7 < t < 10-4 c практически нацело и без участия
выбора конкретной кинетической модели.
Н2О конвертируется первоначально в этилен и ме-
Отметим, что представленные на рис. 1 данные
тан (рис. 2а). Образовавшийся этилен в интервале
практически совпадают с полученными ранее дан-
3.16×10-5 < t < 3.16×10-3 с практически полностью
ными для системы CH4 : CО2 [23], что свидетель-
и тоже без участия Н2О в результате термического
ствует о близости механизмов высокотемператур-
распада превращается в ацетилен. Превращение
ной некаталитической паровой и углекислотной
и расход Н2О при временах t > 3.16×10-4 с, как и
конверсий метана.
при паровой конверсии метана, связаны с паровой
Таким образом, Н2О преимущественно расходу-
конверсией образовавшегося ацетилена. При паро-
ется в процессе паровой конверсии ацетилена, а не
вой конверсии этилена (рис. 3б) он первоначально
метана, хотя, возможно, небольшая доля метана x
превращается в ацетилен, а расход Н2О, начинаю-
в итоге также подвергается паровой конверсии. Но
щийся при времени t > 3.16×10-4 с, также связан
эта доля x существенно меньше доли метана (1-x),
уходящей на пиролиз, а паровая конверсия ацети-
с паровой конверсией образовавшегося ацетилена.
лена завершается быстрее, чем паровая конверсия
Помимо СО и Н2 в продуктах конверсии появля-
метана (рис. 1, интервал lg t >1).
ются СН4, концентрация которого достигает мак-
Некаталитическая паровая конверсия С2-угле-
симума при времени реакции t ~ 10-1 c и далее сни-
водородов. Так как наряду с ацетиленом в качестве
жается, а затем и СО2. Далее при времени реакции
НЕФТЕХИМИЯ том 61 № 4 2021
526
САВЧЕНКО и др.
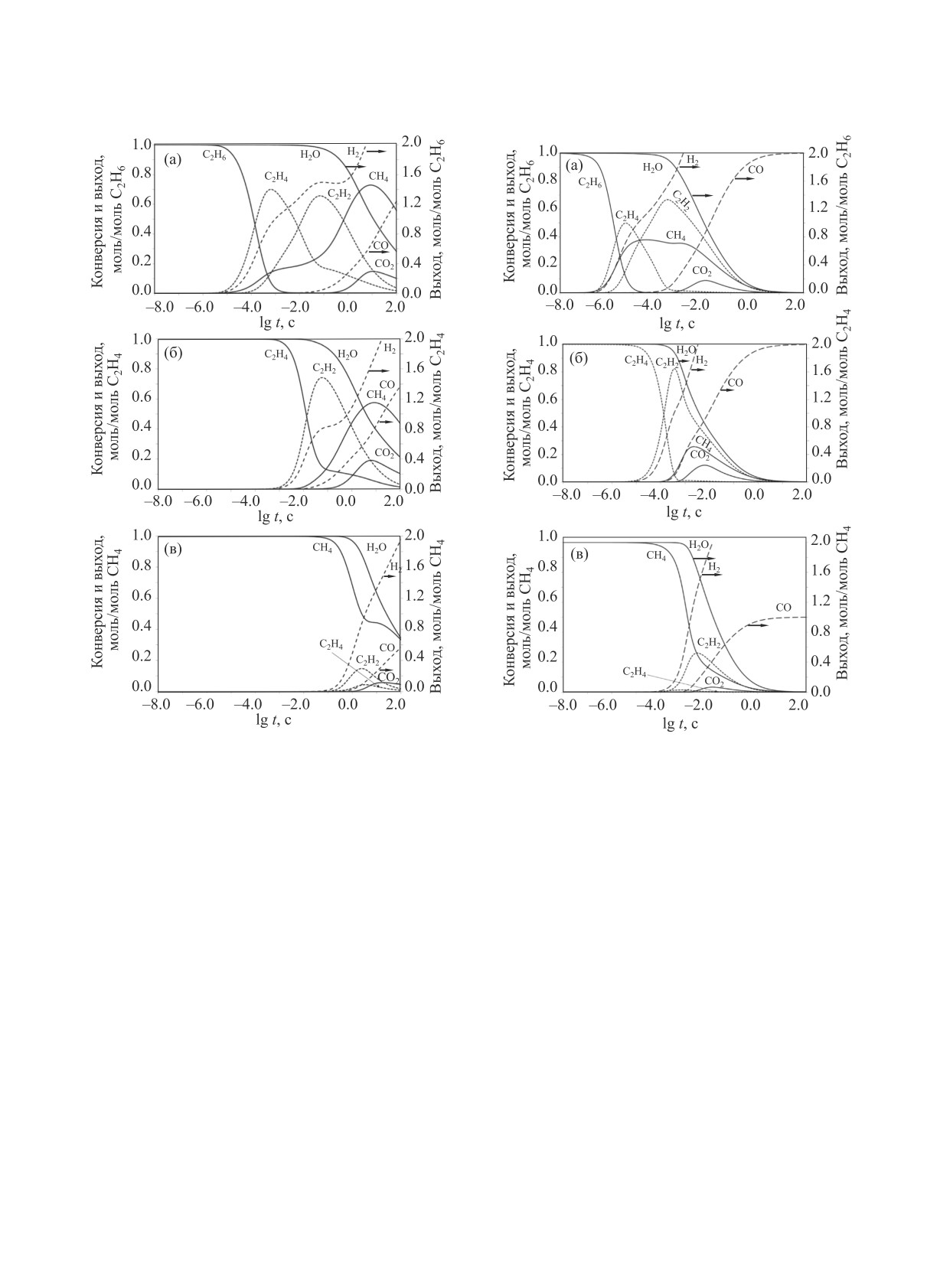
Рис. 4. Конверсия реагентов и выход продуктов паровой
Рис. 5. Конверсия реагентов и выход продуктов паровой
конверсии этана (а), этилена (б) и метана (в) в изотерми-
конверсии этана (а), этилена (б) и метана (в) в изотерми-
ческом режиме при температуре 1400 K и объемных со-
ческом режиме при температуре 1800 K и объемных со-
отношениях Н2О/С2Н6 и Н2О/С2Н4 = 2:1, Н2О/СН4 = 1:1.
отношениях Н2О/С2Н6 и Н2О/С2Н4 = 2:1, Н2О/СН4 = 1:1.
t > 10 с происходит конверсия остаточных углево-
реакции <102 с падает практически до нуля и про-
дородов и система приближается к равновесию.
исходит только пиролиз этана и этилена, что и от-
Аналогичные результаты кинетическое модели-
мечено ранее в [12].
рование паровой конверсии СН4, С2Н6, С2Н4 дает
Некаталитическая паровая конверсия пропана
и при температурах 1400 и 1800 K (рис. 4 и 5).
и пропилена. Проведено моделирование кинетики
Также как и при 1600 K, но при других временных
паровой конверсии пропана и пропилена в изотер-
интервалах, одинакова общая физико-химическая
мическом режиме при температуре 1600 K и объ-
картина процесса, стадиям с участием H2O пред-
емных соотношениях Н2О/С3Н8 и Н2О/С3Н6 = 3:1
шествует пиролиз углеводородов с образованием
(рис. 6).
ацетилена без участия Н2О. Последующий расход
При паровой конверсии пропана (рис. 6а) в ин-
Н2О связан с паровой конверсией образовавшегося
тервале от 10-7 < t < 10-4 с наблюдается практи-
ацетилена.
чески полный его пиролиз с образованием С3Н6,
При температурах ниже 1200 K расход Н2О на
С3Н4, С2Н4 и СН4. Полученные С2 - С3-углеводоро-
паровую конверсию углеводородов при временах ды при времени от 10-5 < t < 10-3 с пиролизуются до
НЕФТЕХИМИЯ том 61 № 4 2021
НЕКАТАЛИТИЧЕСКАЯ ПАРОВАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ С1-С4
527
Рис. 7. Кинетика конверсии реагентов и выхода про-
дуктов паровой конверсии ацетилена в изотермических
условиях при объемном соотношении Н2О/С2Н2 = 2:1 и
Т = 1600 K.
Близкая картина распределения продуктов ха-
рактерна и для ПК бутана (рис. 6в). Быстрые реак-
ции термической конверсии бутана и образующих-
ся пропилена, метилацетилена, аллена и частично
этилена протекают при времени реакции t < 10-3 с.
Далее протекает ПК ацетилена, а после образова-
ния СО2 наблюдается и углекислотная конверсия
ацетилена и метана.
Приведенные результаты показывают, что для
углеводородов С2-С4 временные интервалы харак-
терных областей НПК при Т = 1600 K практически
совпадают, демонстрируя лишь небольшое разли-
чие во времени начала конверсии этих углеводо-
Рис. 6. Кинетика конверсии реагентов и выхода про-
родов в этилен, пропилен, С3Н4 и примеси других
дуктов паровой конверсии пропана (а), пропилена (б)
непредельных углеводородов С3-С4.
и бутана (в) в изотермическом режиме при темпера-
туре 1600 K и объемных соотношениях Н2О/С3Н8 и
Некаталитическая паровая конверсия ацетилена.
Н2О/С3Н6 = 3:1, Н2О/С4Н10 = 4:1.
Представленные выше результаты указывают на
ключевую роль при паровой конверсии углеводо-
родов паровой конверсии ацетилена - наиболее
ацетилена. Указанные превращения осуществля-
стабильного в этих условиях углеводорода. Отно-
ются без участия Н2О. Расход Н2О и образование
сительная стабильность ацетилена при высоких
СО начинаются при времени t < 3.16×10-4 с, когда в
температурах обусловлена его уникальными свой-
системе появляется заметное количество ацетиле-
ствами, в частности тем, что его свободная энер-
на. Дальнейшие превращения в системе аналогич-
гия уменьшается с повышением температуры, в то
ны описанным выше превращениям при ПК этана
время как свободная энергия всех других углеводо-
и этилена при времени t < 3.16×10-4 с.
родов с температурой растет [38]. Таким образом,
Картина ПК пропилена (рис. 6б) после времени
в исследуемом диапазоне температур ацетилен
реакции t > 5×10-3 с аналогична описанным выше
становится наиболее стабильным углеводородом.
превращениям при ПК пропана (рис. 6а), несколько
В связи с этим необходимо исследование кинетики
отличаясь величинами выхода продуктов (меньше
паровой конверсии самого ацетилена.
Н2) и более поздним временем начала расходова-
На рис. 7 представлена кинетика конверсии ре-
ния Н2О.
агентов и выхода продуктов паровой конверсии
НЕФТЕХИМИЯ том 61 № 4 2021
528
САВЧЕНКО и др.
(a)
(б)
CH4
C2H
2
+H•
-H
+OH
2
•
C2H2
C3H2
-CH3
-HCO
•
-H•
+H
CH3•
+M
-M
−M
-M
+M
+M
-H•
-H•
+M
-M
•
•
C3H3
C3H3
•
C2H3
•
•
C2H5
+CH3
-CH4
•
+CH3
-CH4
C2H6
-M
+M
+M
+M
+H•
-H
2
−H•
-M
-M
+H•
-H2
+H•
-H2
C4H
-H•
10
C2H4
C3H4
+M
C2H5•
C2H4
+M
•
-M
−CH3
−M
-M
-H•
•
-H•
+H•
-CH3
-M
+H
•
•
•
+M
•
-CH3
C4H9
−H•
C3H8
n-C3H7
+M
-H2
•
•
C3H6
C2H
5
+H•
−CH3
-M
•
−H
+H•
i-C3H7•
C
−H2
3H6
-H•
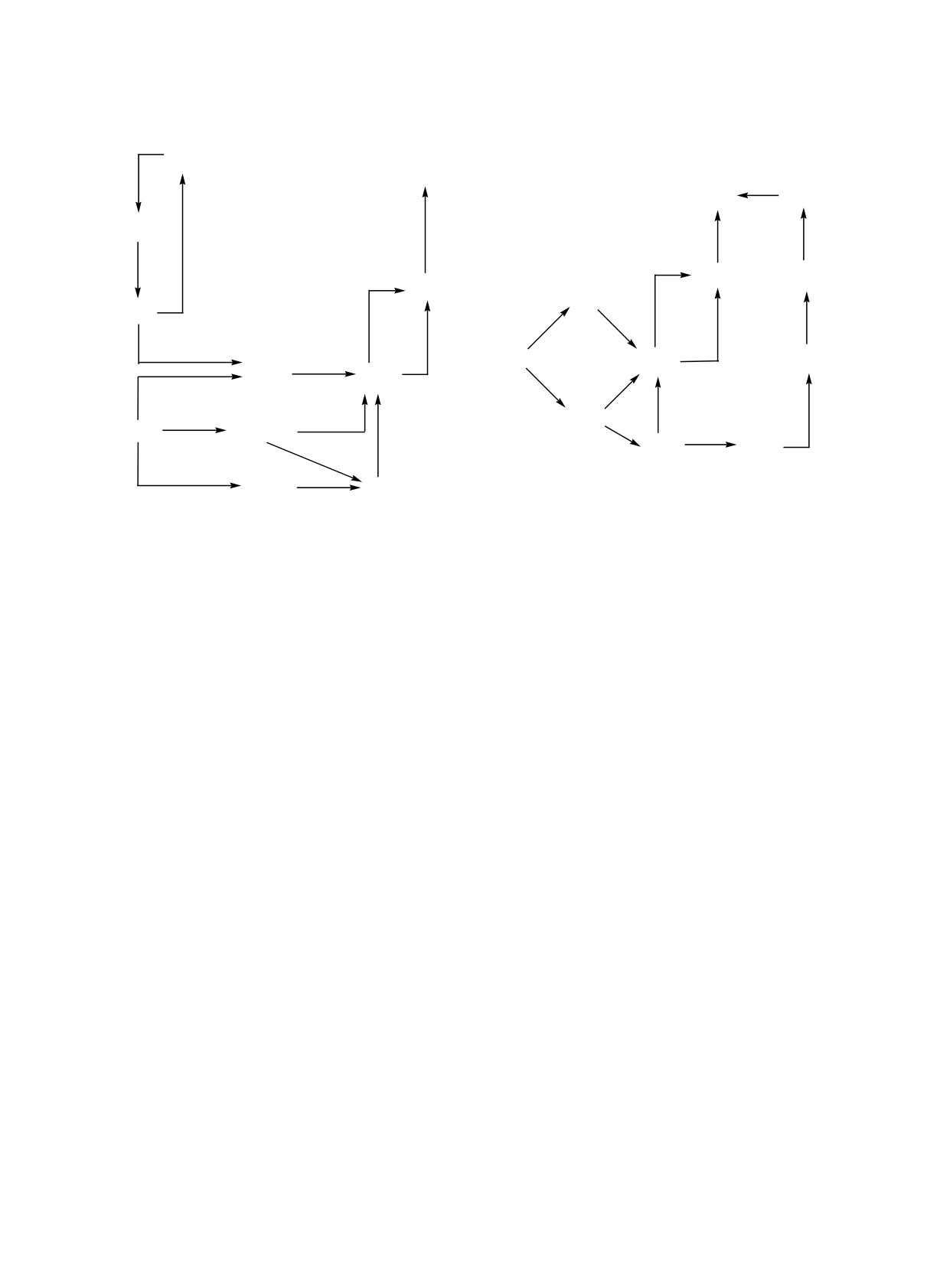
Рис. 8. Маршруты термических превращений: (а) метана, этана и пропана; (б) н-бутана.
индивидуального ацетилена в изотермических ус-
этилена и частично метана в ацетилен при време-
ловиях при объемном соотношении Н2О/С2Н2 = 2:1
нах -3.16×10-5 < t < 3.16×10-3 с (рис. 8). Так, на-
и Т = 1600 K.
пример, в случае н-бутана происходит накопление
в системе пропилена, максимальная концентрация,
Важной отличительной особенностью ПК аце-
которого составляла более 10 об. %.
тилена от ПК других углеводородов является то,
что конверсия С2Н2 и Н2О начинается практически
Высокое содержание пропилена приводит к по-
явлению дополнительного маршрута образования
одновременно при t ~ 2×10-4 с, причем на началь-
ацетилена и СО через С3Н2 (рис. 8б):
ном этапе реакции кроме Н2 и СО наблюдается об-
разование СН4 и СО2, которые по мере расходова-
1. При небольшой конверсии углеводородов
ния С2Н2 также конвертируются в Н2 и СО.
скорость взаимодействия этилена с метильным ра-
дикалом выше, чем с атомом водорода, но по мере
Таким образом при ПК углеводородов С1-С4
увеличения конверсии метана увеличивается вклад
можно выделить определенные характерные этапы
реакции взаимодействия этилена с атомом водорода.
процесса и на основе анализа чувствительности
2. При временах t > 3.16×10-5 с начинается кон-
параметров кинетической модели представить ос-
версия Н2О (для метана при t > 10-2 с):
новные маршруты протекающих рекций:
Н2О + Н• → ОН• + Н2.
(10)
а) в диапазоне 10-3 < t < 3.16×10-2 с термический
3. При 3.16×10-3 < t < 3.16×10-1 с - область ПК:
пиролиз метана и этана приводит к росту концен-
высокая конверсия Н2О, снижение содержания
трации ацетилена, который, согласно результатам
С3Н6 и ацетилена после прохождения максимума
анализа чувствительности, образуется преимуще-
их концентрации; начало образования и достиже-
ственно из этилена по маршруту представленному
ние максимального выхода СО2.
на рис. 8;
Важнейшими на этом этапе процесса являются
б) пиролиз углеводородов С3-С4, протекает с
реакции с участием С3Н2 и С2Н2 и радикалов ОН•:
образованием помимо этилена еще и пропилена,
C2H2 + OH● → CH2CO + H●,
(11)
с последующей его конверсией в С2Н4, СН4 и не-
большие примеси других непредельных углево-
CH2CO + H● → CH3● + CO.
(12)
дородов С3-С4 в интервале (10-7-10-6) < t < 3.16×
При этом, как уже отмечалось ранее, в случае
10-5 с последующим превращением образующихся конверсии С3+-углеводородов появляется «пропи-
НЕФТЕХИМИЯ том 61 № 4 2021
НЕКАТАЛИТИЧЕСКАЯ ПАРОВАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ С1-С4
529
леновый» маршрут образования ацетилена и СО.
чевую роль играет конверсия ацетилена, облада-
Происходит постепенное дегидрирование пропи-
ющего в этих условиях наименьшей свободной
лена до С3Н2:
энергией. Ацетилен является естественным про-
С3Н6 → С3Н4 → С3Н2.
межуточным продуктом термической конверсии
Последний взаимодействует с ОН-радикалами,
углеводородов и в то же время предшественником
которые получились по реакции (12) с образовани-
образования сажи. Полученные результаты важны
ем ацетилена и НСО, который, в свою очередь, в
для оптимизации методов получения синтез-газа
дальнейшем превращается в СО и воду.
в высокотемпературных процессах парциального
C3H2 + OH● → C2H2 + HCO●,
(13)
окисления в матричных конверторах, в реакторах
HCO● + OH●→ Н2О + CO.
(14)
с пористой насадкой, в сверхадиабатических реак-
Увеличение в системе концентрации СО приво-
торах в режиме фронтального горения, в процессах
дит к тому, что начинает играть роль его взаимо-
совместного получения ацетилена и синтез-газа и
действие с радикалами ОН●, приводящее к образо-
ряде других.
ванию СО2:
CO + ОH● → CO2 + H●.
(15)
ИНФОРМАЦИЯ ОБ АВТОРАХ
На заключительном этапе реакции при t >
Савченко Валерий Иванович, д.х.н., проф,
3.16×10-1 с протекают ПК и УК остатков ацетилена
и метана, и система приближается к равновесию.
Приведенные значения интервалов различных
стадий процесса, характерные для углеводородов
org/0000-0002-3645-9361
С2-С4, несколько отличаются для ПК метана, для
Никитин Алексей Витальевич, к.х.н., ORCID:
которого область пиролиза и роста выхода ацетиле-
на лежит в интервале -3.16×10-3 < t < 3.16×10-2 с,
Седов Игорь Владимирович, к.х.н., ORCID:
а область взаимодействия С2Н2 с радикалами ОН●
лежит в интервале 3.16×10-2 < t < 10-1 с.
Арутюнов Владимир Сергеевич, д.х.н., проф,
ЗАКЛЮЧЕНИЕ
Представленные результаты кинетического мо-
делирования некаталитической паровой конверсии
ФИНАНСИРОВНИЕ РАБОТЫ
углеводородов, а также ранее полученные данные
Экспериментальные исследования выполнены
по их некаталитической углекислотной конверсии
в рамках Программы фундаментальных научных
указывают на аналогию этих процессов. Стадиям
иссле-дований государственных академий наук.
с участием H2O и CO2 предшествует стадия пи-
Темы № 0089-2019-0018 (ИПХФ РАН) (Номер
ролиза углеводородов без участия Н2О или CO2, в
гос.регистрации АААА-А19-119022690098-3) и
качестве промежуточных продуктов которой обра-
зуются пропилен и этилен. Эти соединения далее
№ 0082-2019-0014 (ФИЦ ХФ РАН) (Номер гос.
превращаются в ацетилен, а также метан и радика-
регистрации
АААА-А20-120020590084-9) с
лы H●. Последующее взаимодействие H● с Н2О и
использованием оборудования ЦКП “Новые нефте-
CO2 приводит к образованию радикалов ОН●, кото-
химические продукты, полимерные композиты и
рые при взаимодействии с С2Н2 образуют CH2CO.
адгезивы” (№ 77601).
Дальнейшие превращения последнего приводят к
образованию СО. На заключительном этапе ПК и
КОНФЛИКТ ИНТЕРЕСОВ
УК остатков ацетилена и метана протекают одно-
временно, и система приближается к равновесию.
Седов Игорь Владимирович является действу-
Таким образом, при некаталитической паровой
ющим заместителем главного редактора журнала
и углекислотной конверсии углеводородов клю-
«Нефтехимия».
НЕФТЕХИМИЯ том 61 № 4 2021
530
САВЧЕНКО и др.
СПИСОК ЛИТЕРАТУРЫ
11.
Uskov S.I., Potemkin D.I., Shigarov A.B., Snytnikov P.V.,
Kirillov V.A., Sobyanin V.A. Low-temperature steam
1.
Anderson J.R., Boudart M. / Catalysis: Science and
conversion of flare gases for various applications //
Technology. New York: Springer-Verlag, 1984. Р. 1 - 117.
2.
Liu K., Song C., Subramani V. / Hydrogen and Syngas
org/10.1016/j.cej.2019.02.189
Production and Purification Technologies. Blackwell,
12.
Kokka A., Katsoni A., Yentekakis I. V., Panagiotopoulou P.
Oxford: Wiley, 2010. 533 р.
Hydrogen production via steam reforming of propane
3.
LeValley T.L., Richard A.R., Fan M. The progress in
over supported metal catalysts // Int. J. of Hydrogen
water gas shift and steam reforming hydrogen production
Energy. 2020. V. 45. P. 14849-14866. https://
technologies. A review // Int. J. Hydrogen Energy.
doi:10.1016/j.ijhydene.2020.03.194
13.
Schadel B.T., Duisberg M., Deutschmann O. Steam
ijhydene.2014.08.041
reforming of methane, ethane, propane, butane, and
4.
Aasberg-Petersen K., Bak Hansen J.-H., Christensen T.S.,
natural gas over a rhodium-based catalyst // Catal.
Dybkjaer I., Christensen P.S., Stub Nielsen C., Winter
Madsen S.E.L., Rostrup-Nielsen J.R. Technologies for
cattod.2009.01.008
large-scale gas conversion // Appl. Catal. A: Gen. 2001.
14.
Arutyunov V.S., Shmelev V.M., Sinev M.Yu., Shapovalo-
va O.V. Syngas and hydrogen production in a volumetric
860X(01)00811-0
radiation burners // Chem. Eng. J. 2011. V. 176-177.
5.
Laosiripojanaa N., Sangtongkitcharoen W., Assabumrun-
grat S. Catalytic steam reforming of ethane and propane
15.
Wang Y., Zeng H., Banerjee A., Shi Y., Deutschmann O.,
over CeO2-doped Ni/Al2O3 at SOFC temperature:
Cai N. Elementary reaction modeling and experimental
Improvement of resistance toward carbon formation by
characterization on methane partial oxidation
the redox property of doping CeO2 // Fuel. 2006. V. 85.
within catalyst enhanced porous media combustor //
6.
Uskov S.I., Potemkin D.I., Enikeeva L.V., Snytnikov P.V.,
org/10.1021/acs.energyfuels.6b01624
Gubaydullin I.M., Sobyanin V.A. Propane pre-reforming
16.
Nourbakhsh H., Shahrouzi J.R., Ebrahimi H., Zamani-
into methane-rich gas over ni catalyst: experiment and
yan A., Nasr M.R.J. Experimental and numerical study
kinetics elucidation via genetic algorithm // Energies.
of syngas production during premixed and ultra-rich
partial oxidation of methane in a porous reactor // Int. J.
en13133393
7.
Uskov S.I., Enikeeva L.V., Potemkin D.I., Belyaev V.D.,
org/10.1016/j.ijhydene.2019.10.084
Snytnikov P.V., Gubaidullin I.M., Kirillov V.A., Sobya-
17.
Dorofeenko S.O., Polianczyk E.V. Conversion of
nin V.A. Kinetics of low-temperature steam reforming
hydrocarbon gases to synthesis gas in a reversed-
of propane in a methane excess on a Ni-based catalyst //
flow filtration combustion reactor // Chem. Eng. J.
org/10.1134/S2070050417020118
cej.2016.02.013
8.
Christensen T.S. Adiabatic prereforming of hydrocarbons - an
18.
Liu Y., Zhang Q., Wang T. Detailed Chemistry Modeling
important step in syngas production // Appl. Catal. A:
of Partial Combustion of Natural Gas for Coproducing
Acetylene and Syngas // Combust. Sci. Technol. 2017.
org/10.1016/0926-860X(95)00302-9
9.
Aasberg-Petersen K., Christensen T.S., Stub Nielsen C.,
2202.2016.1256879
Dybkjær I. Recent developments in autothermal
19.
Dybkjær I., Aasberg-Petersen K. Synthesis gas
reforming and pre-reforming for synthesis gas production
technology large-scale applications // Can. J. Chem.
in GTL applications // Fuel Process Technol. 2003. V.
cjce.22453
3820(03)00073-0
20.
Amiri T.Y., Ghasemzageh K., Lulianelli A. Membrane
10.
Zyryanova М.М., Snytnikov P.V., Amosov Yu.I., Belya-
reactors for sustainable hydrogen production through
ev V.D., Kireenkov V.V., Kuzin N.A., Vernikovskaya M.V.,
steam reforming of hydrocarbons: a review // Chem.
Kirillov V.A., Sobyanin V.A. Upgrading of associated
petroleum gas into methane-rich gas for power plant
cep.2020.108148
feeding applications. Technological and economic
21.
Savchenko V.I., Nikitin A.V., Ozersky A.V., Zimin Y.S.,
Sedov I.V., Arutyunov V.S. Effect of hydrogen, carbon
org/10.1016/j.fuel.2013.02.047
monoxide, synthesis gas and steam additives on the
НЕФТЕХИМИЯ том 61 № 4 2021
НЕКАТАЛИТИЧЕСКАЯ ПАРОВАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ С1-С4
531
characteristics of matrix conversion of rich methane-
31.
Konnov A.A. Development and validation of a detailed
oxygen mixtures // Petrol. Chemistry. 2020. V. 60.
reaction mechanism for the combustion of small
hydrocarbons // 28-th Symposium (Int.) on Combustion.
22.
Savchenko V.I., Nikitin A.V., Sedov I.V., Ozerskii A.V.,
Arutyunov V.S. The role of homogeneous steam
me.htm
reforming of acetylene in the partial oxidation of
methane to syngas in matrix type converters // Chem.
32.
Wagman D.D., Kilpatrick J.E., Taylor W.J., Pizer K.S.,
Rossini F.D. Heats, free energies, and equilibrium
org/10.1016/j.ces.2019.07.012
constants of some reactions involving O2, H2, H2O,
23.
Savchenko V.I., Zimin Ya.S., Nikitin A.V., Sedov I.V.,
C, CO, CO2, and CH4 // J. Res. Nat. Bur. Stand. 1945.
Arutyunov V.S. Utilization of CO2 in non-catalytic dry
V. 34. P. 143-161.
reforming of C1-C4 hydrocarbons // J. CO2 Util. 2021.
33.
Indarto A., Palguandi J. Syngas: Production,
V. 47. № 5. I. 101490
24.
Trusov B.G. Program system TERRA for simulation
Applications and Environmental / Nova Science
phase and thermal chemical equilibrium // Proc. XIV Int.
Publishers. 2013. P. 99-120.
Symp. on Chemical Thermodynamics. 2002. Р. 483-484/
34.
Tabrizi F. F., Hossein S. A., Mousavi S., Atashi H.
25.
Healy D., Kalitan D.M., Aul C.J., Petersen E.L., Bourque G.,
Thermodynamic analysis of steam reforming of methane
Curran H.J. Oxidation of C1-C5 alkane quinternary
with statistical approaches // Energ. Convers. Manage.
natural gas mixtures at high pressures // Energy Fuel.
ef9011005
enconman.2015.07.005
26.
NUI Galway. Combustion Chemistry Center.
35.
Pashchenko D. Thermodynamic equilibrium analysis of
steam methane reforming based on a conjugate solution
combustionchemistrycentre/mechanismdownloads/ (дата
of material balance and law action mass equations with
обращения 21 декабря 2020)
the detailed energy balance // Int. J. Energ. Res. 2020.
27.
Zhang Q., Wang J.F., Wang T.F. Effect of ethane and
propane addition on acetylene production in the partial
oxidation process of methane // Ind. Eng. Chem. Res.
36.
Cui X., Kær S.K. Thermodynamic analysis of steam
reforming and oxidative steam reforming of propane and
iecr.7b00406
butane for hydrogen production // Int. J/ of Hydrogen
28.
Arutyunov V., Troshin K., Nikitin A., Belyaev A.,
Arutyunov A., Kiryushin A., Strekova L. Selective
org/10.1016/j.ijhydene.2018.05.083
oxycracking of associated petroleum gas into energy
fuel in the light of new data on self-ignition delays of
37.
Савченко В.И., Диденко Л.П., Шеверденкин Е.В.,
methane-alkane compositions // Chem. Eng. J. 2020.
Рудаков В.М., Арутюнов В.С. Равновесный выход
продуктов при паровой и окислительной конверсии
29.
смесей метана с углеводородами С2-С3 // Химиче-
kintechlab.com. (Дата обращения 21 декабря 2020)
ская физика. 2005. Т. 24. № 9. С. 76-83.
30.
Chemical-Kinetic Mechanisms for Combustion
38.
Duff R.E., Bauer S.H. Equilibrium composition of the
combustion/mechanism.html). (Дата обращения 21
C/H system at elevated temperatures // J. Chem. Phys.
декабря 2020).
НЕФТЕХИМИЯ том 61 № 4 2021