НЕФТЕХИМИЯ, 2021, том 61, № 6, с. 820-826
УДК 541. 128
О МЕХАНИЗМЕ ПРЕВРАЩЕНИЯ МЕТАНА
В НЕКАТАЛИТИЧЕСКИХ ПРОЦЕССАХ ЕГО ТЕРМИЧЕСКОЙ,
ПАРОВОЙ И УГЛЕКИСЛОТНОЙ КОНВЕРСИИ
© 2021 г. Э. Бузилло1, В. И. Савченко2, В. С. Арутюнов1,2,3,*
1 Российский государственный университет нефти и газа (национальный исследовательский университет)
имени И.М. Губкина, Москва, 119991 Россия
2 Институт проблем химической физики Российской академии наук, Черноголовка, 142432 Россия
3 Федеральный исследовательский центр химической физики Российской академии наук, Москва, 119991 Россия
*E-mail: v_arutyunov@mail.ru
Поступила в редакцию 23 июня 2021 г.
После доработки 30 июля 2021 г.
Принята к публикации 10 сентября 2021 г.
Проведено детальное кинетическое моделирование некаталитических процессов термического пиролиза
метана, его паровой и углекислотной конверсии. Показана практически полная идентичность кинетики
конверсии метана в этих процессах. Данный факт позволяет утверждать, что в диапазоне температур
1400-1800 K во всех рассматриваемых процессах начальной стадией конверсии метана является его
термический пиролиз. Результаты моделирования хорошо согласуются с экспериментальными данными
по пиролизу метана. Для рассматриваемого температурного интервала в приближении кинетики первого
порядка получены аррениусовские выражения (предэкспоненциальные множители и энергия активации)
для скорости конверсии метана в указанных процессах, которые могут быть полезны для предваритель-
ных оценок и инженерных расчетов.
Ключевые слова: природный газ, метан, синтез-газ, пиролиз, паровая конверсия, углекислотная
конверсия
DOI: 10.31857/S0028242121060071
Природный газ, включая его нетрадиционные
получением ацетилена и синтез-газа [7], некатали-
разновидности, прежде всего, сланцевый газ и га-
тическим окислительным процессам фильтрацион-
зовые гидраты, является основным ресурсом угле-
ной [8, 9] и матричной конверсии [10, 11]. Помимо
водородов для мировой экономики [1, 2], что дик-
собственно парциального окисления метана важ-
тует необходимость повышения эффективности его
нейшими стадиями всех этих газофазных процес-
конверсии в наиболее востребованные химические
сов являются пиролиз метана и его взаимодействие
продукты и моторные топлива. Основой совре-
с продуктами окислительной конверсии - парами
менных крупнотоннажных процессов химической
воды и углекислым газом:
конверсии природного газа являются его пиролиз
СН4 → продукты,
(1)
и конверсия в синтез-газ [3]. Наряду с традицион-
ным процессом каталитической паровой конвер-
СН4 + Н2О → 3Н2 + СО,
(2)
сии природного газа в синтез-газ [4, 5] в последнее
СН4 + СО2 → 2Н2 + 2СО.
(3)
время растет интерес к альтернативным процессам
получения синтез-газа, в том числе автотермиче-
Кинетике и термодинамике каталитических про-
скому риформингу (Auto-thermal Reforming - ATR)
цессов паровой и углекислотной конверсии метана
[6], окислительному пиролизу с одновременным
в последние годы было посвящено большое число
820
О МЕХАНИЗМЕ ПРЕВР
АЩЕНИЯ МЕТАНА
821
работ, например [12, 13]. Гораздо менее исследова-
ны некаталитические процессы паровой и углекис-
лотной конверсии метана. Во всяком случае, нам не
удалось найти сколько-нибудь содержательных ра-
бот по кинетике этих процессов в рассматриваемом
диапазоне условий. Проведенный нами ранее кине-
тический анализ процессов паровой [14] и углекис-
лотной конверсии метана [15] показал, что в обоих
случаях конверсия метана и образование водорода
начинаются значительно раньше конверсии Н2О и
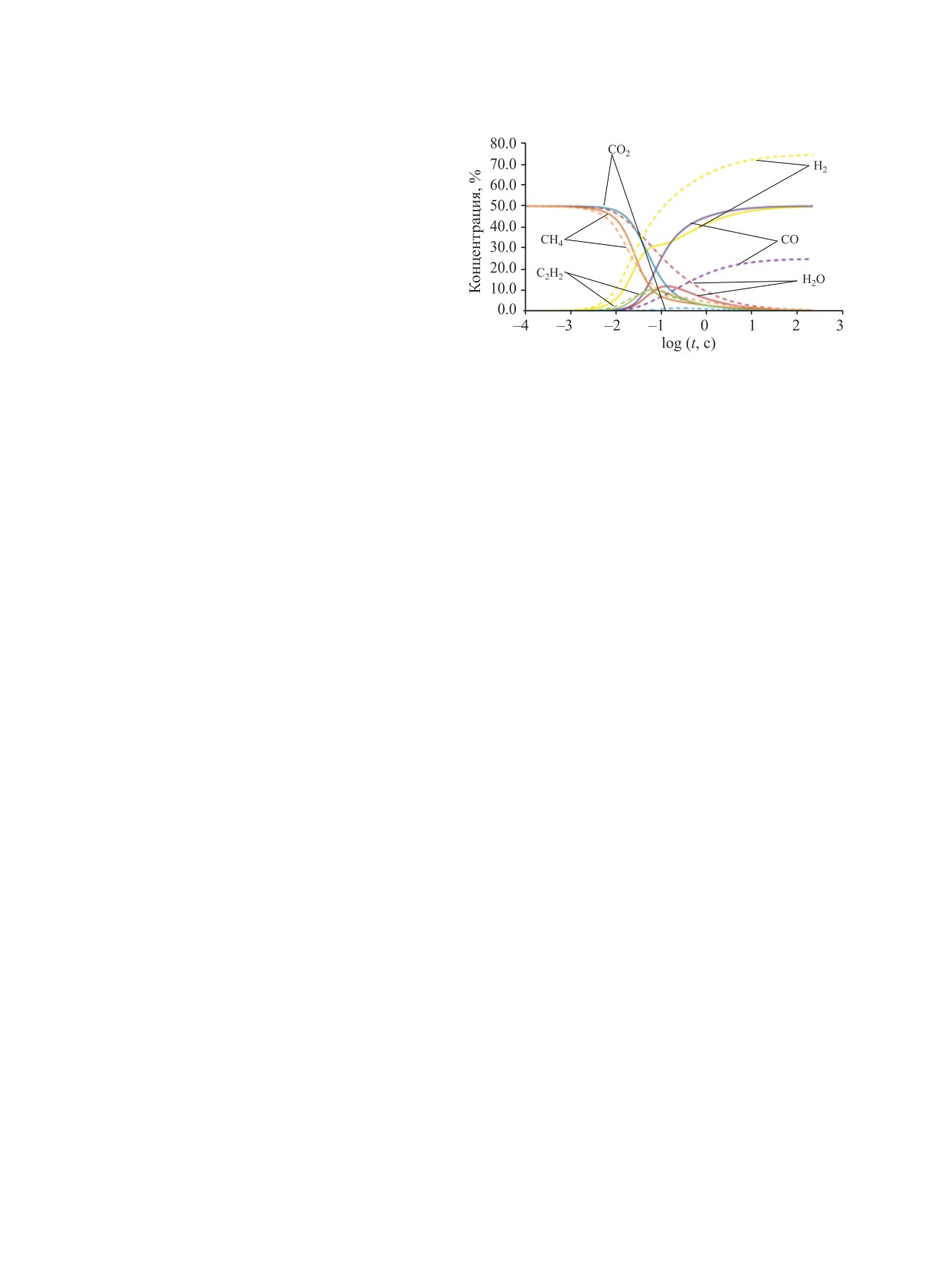
СО2, соответственно (рис. 1).
Рис. 1. Расчет кинетики углекислотной (сплошные
Кинетический анализ этих процессов позво-
линии) и паровой (пунктирные линии) конверсии ме-
лил сделать предположение, что в исследуемом
тана в изотермических условиях при CH4/CO2 = 1:1 и
диапазоне температур 1400-1800 K несмотря на
CH4/H2O = 1:1. T = 1600 K [15].
присутствие Н2О и СО2 первоначальной стадией
конверсии метана является его термический пиро-
лиз с образованием водорода, этилена и ацетиле-
протекании, было проведено их кинетическое мо-
на. Последний, в силу своей термодинамической
делирование при давлении 1 атм в диапазоне тем-
стабильности в данном температурном интервале,
ператур 1400-1800 K с интервалом 100 K. Моде-
является основным углеводородным продуктом пи-
лирование проводили с использованием хорошо
ролиза метана, а в ходе процессов паровой и угле-
зарекомендовавшего себя для данных условий де-
кислотной конверсии его концентрация достигает
тального кинетического механизма AramcoMech3.0
значительной величины. Заметная конверсия паров
[16], используя стандартный программный пакет
воды и углекислого газа начинается только после
ANSYS Chemkin-Pro.
появления ацетилена в продуктах (рис. 1) и проис-
Для получения аррениусовских выражений,
ходит в результате их взаимодействия с атомами Н•,
описывающих скорость конверсии метана в ка-
образующимися при пиролизе метана и в последу-
ждом из рассматриваемых процессов, на осно-
ющей реакции радикалов ОН• с ацетиленом [15].
ве детального расчета его кинетики при каждой
Серьезным аргументом в пользу данного меха-
конкретной температуре подбирали выражение,
низма некаталитического парового и углекислот-
наиболее точно описывающее конверсию метана.
ного риформинга метана может стать сопоставле-
Подбор проводили на основе выражения констан-
ние скорости конверсии метана в этих процессах
ты скорости первого порядка, хорошо выполня-
со скоростью его термического пиролиза в данных
ющегося для конверсии метана в этих условиях
условиях. В настоящей работе такое сопоставле-
[17-19]. С использованием пакета Curve Fitting
ние для давления 1 атм было проведено на основе
Toolbox программного обеспечения MATLAB был
детального кинетического моделирования рассма-
проведен экспоненциальный фитинг кинетики
триваемых процессов. Были также получены ар-
изменения концентрации метана, полученной на
рениусовские выражения для скорости указанных
основе детального кинетического механизма. Для
процессов конверсии метана в рассматриваемом
подбора использован метод наименьших квадра-
температурном интервале, которые могут быть по-
тов, алгоритм «Trust-Region». Для фитинга приме-
лезны для предварительных оценок и инженерных
няли результаты моделирования только в интерва-
расчетов.
ле значений конверсии метана от 20 до 70%, так
как начальная и конечная стадии этих сложных
МЕТОДИКА ИССЛЕДОВАНИЯ
радикальных процессов уже не описываются про-
стой кинетикой первого порядка.
Для анализа кинетики рассматриваемых про-
цессов и получения аррениусовских выражений,
На основании полученных в результате фи-
описывающих скорость конверсии метана при их
тинга выражений для констант скорости конвер-
НЕФТЕХИМИЯ том 61 № 6 2021
822
БУЗИЛЛО и др.
ного графика аррениусовской зависимости с осью
ординат.
ln k = ln k0 -Eэфф/RT,
где k - константа скорости, c-1; k0 - предэкспонен-
циальный фактор, c-1; R - универсальная газовая
постоянная (R = 8.314 Дж/моль K); Т - температу-
ра, K.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Моделирование процессов конверсии метана
В работах [14, 15] нами было сформулирова-
но предположение о том, что процессы паровой и
углекислотной конверсии метана протекают через
стадию его предварительного термического пи-
ролиза в ацетилен. В работах [15, 20] этот вывод
был обобщен и на более тяжелые гомологи мета-
на. Для обоснования этого вывода в данной работе
было проведено сопоставление кинетики конвер-
сии метана в процессах паровой и углекислотной
конверсии метана с кинетикой его конверсии при
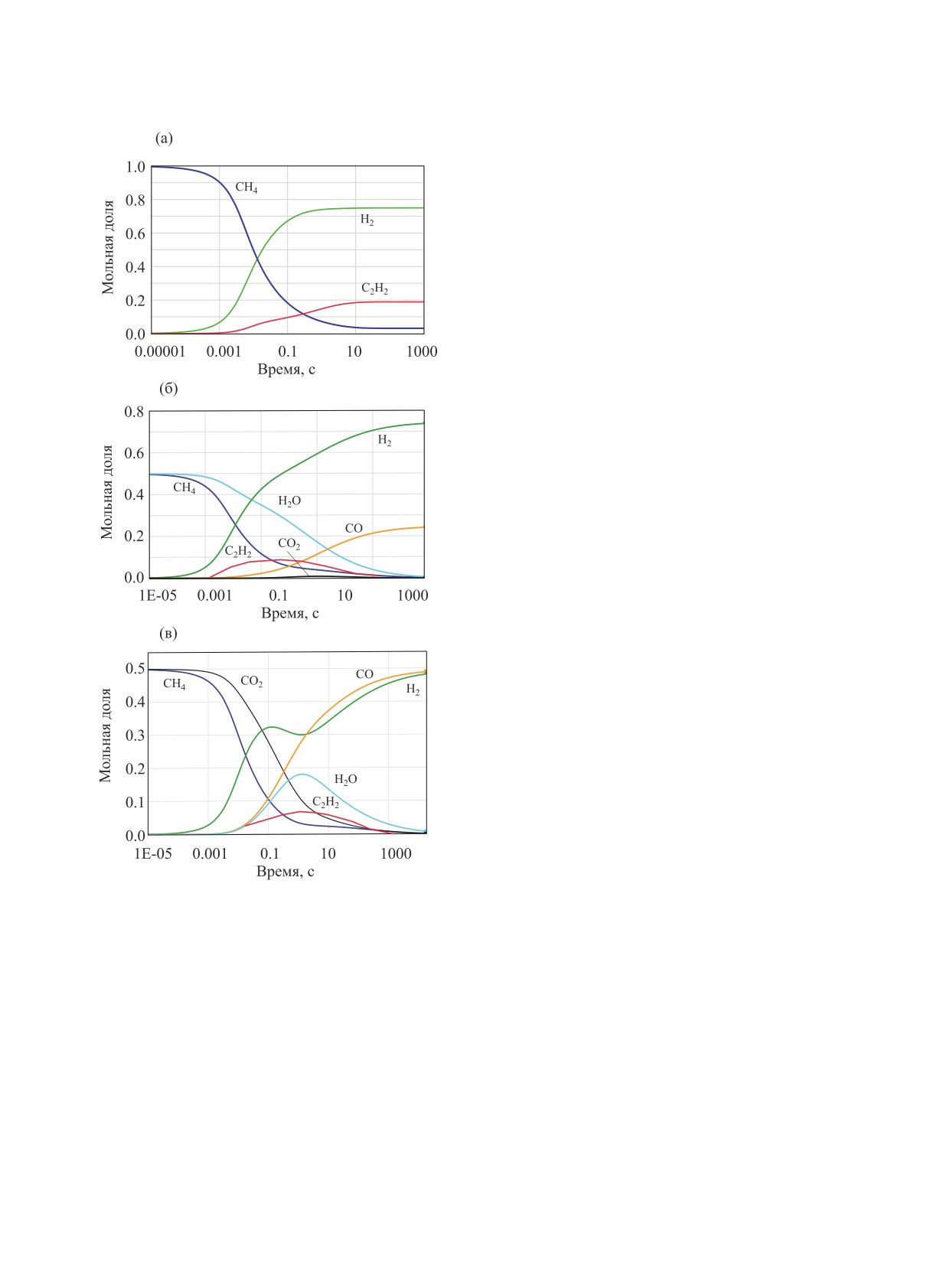
термическом пиролизе. На рис. 2 представлены
рассчитанные зависимости изменения концентра-
ции реагентов и продуктов при пиролизе, паровой
и углекислотной конверсии метана. Их сопостав-
ление показывает, что во всех рассматриваемых
случаях конверсия метана протекает практически
одинаково и за одно и то же время, что более на-
глядно демонстрирует рис. 3, а основным, наряду
с водородом, продуктом, накапливающимся на на-
чальной стадии, является ацетилен.
При паровой и углекислотной конверсии изме-
нение концентрации воды и углекислого газа, соот-
ветственно, протекает с заметным отставанием от
изменения концентрации метана. При углекислот-
ной конверсии метана образовавшийся в результа-
Рис. 2. Кинетика изменения мольной доли реагентов и
те пиролиза метана водород вступает в обратную
продуктов при пиролизе (а), паровой конверсии (б) и
реакцию водяного газа
углекислотной конверсии метана (в). Расчет на основе
механизма AramcoMech 3.0. Т = 1700 K, Р = 1 атм.
Н2 + СО2 → СО + Н2О,
(4)
что приводит к росту концентрации паров воды.
Однако вследствие наличия в системе еще не про-
сии метана в интервале 1400-1800 K для каждого
реагировавшего метана, а также в результате пря-
исследуемого процесса были получены значения
мой реакции водяного газа
эффективной энергии активации Еэфф, и предэкс-
(5)
СО + Н2О → Н2 + СО2,
поненциального фактора k0 как, соответственно,
умноженный на газовую постоянную R угловой
концентрация паров воды проходит через макси-
коэффициент и ордината точки пересечения линей-
мум и затем быстро снижается практически до нуля.
НЕФТЕХИМИЯ том 61 № 6 2021
О МЕХАНИЗМЕ ПРЕВР
АЩЕНИЯ МЕТАНА
823
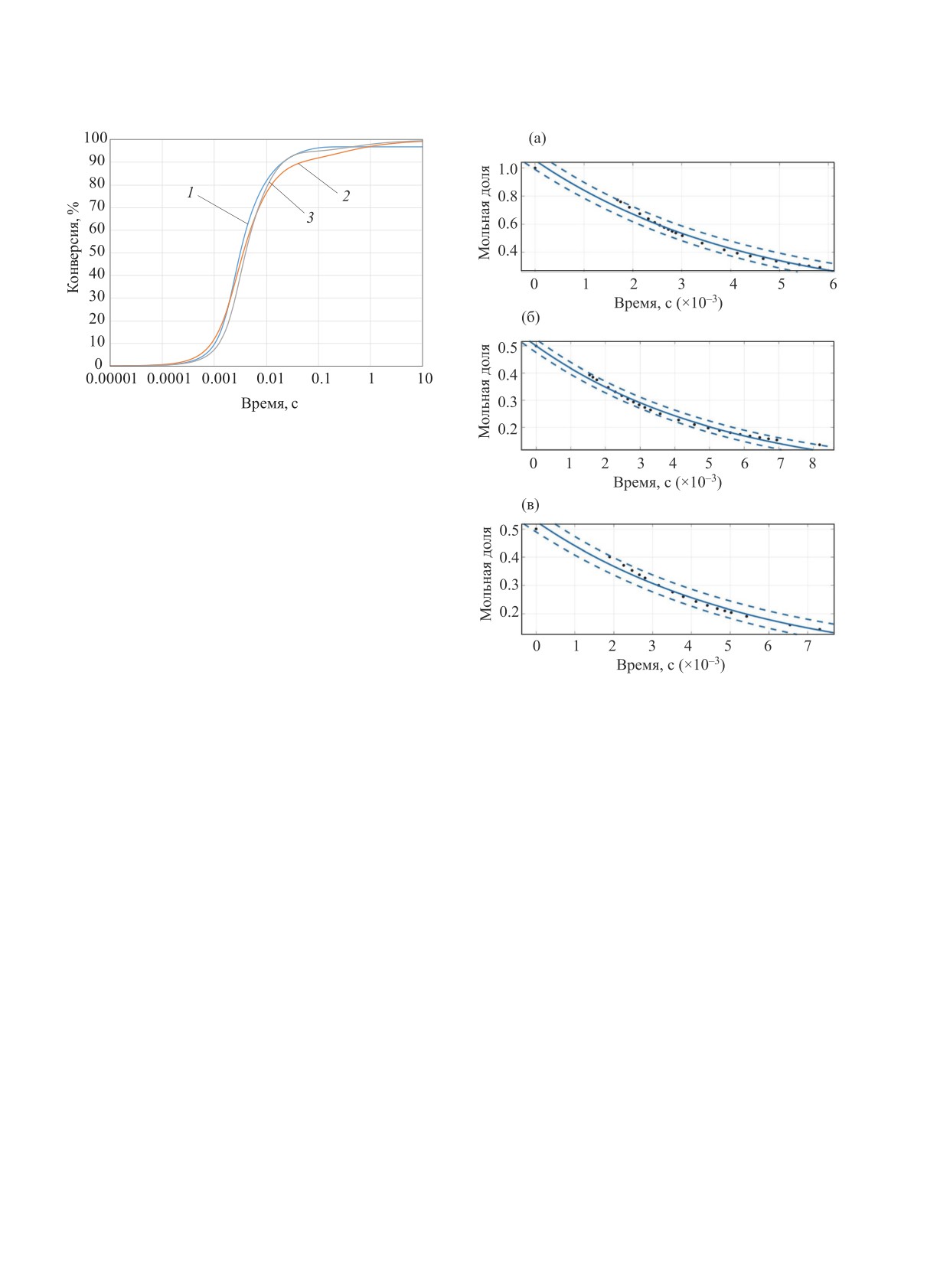
Рис. 3. Конверсия метана при пиролизе (1), паровой (2)
и углекислотной конверсии (3). Расчет на основе модели
AramcoMech 3.0. P = 1 атм. T = 1700 K.
Результаты, аналогичные представленным на
рис. 3, были получены при сопоставлении рассма-
триваемых процессов конверсии метана для всех
температур в диапазоне 1400-1800 K. Сопоставле-
ние кинетики конверсии метана в трех рассматри-
ваемых процессах (рис. 3) не оставляет сомнений в
ее идентичности. Присутствие паров воды и диок-
сида углерода вносит лишь незначительные изме-
Рис. 4. Кинетика изменения мольной доли метана при
нения в конверсию метана в этих процессах.
моделировании процессов его пиролиза (а), паровой
(б) и углекислотной (в) конверсии. Т = 1700 K. Р =
1 атм. Символы - результаты расчета по механизму
Вывод аппроксимирующих выражений
AramcoMech 3.0, сплошная линия - аппроксимирующая
для констант скорости конверсии метана
кривая, пунктирные линии - пределы доверительного
Анализ литературных данных по пиролизу ме-
интервала (95%) аппроксимирующей функции.
тана в рассматриваемом нами диапазоне условий
[17-19] показывает возможность их аппроксима-
в исследуемом интервале температур 1400-1800 K
ции на основе уравнения реакции первого поряд-
при Р = 1 атм был проведен фитинг результатов де-
ка. В наших предыдущих работах [14] и [20] было
тального моделирования на основе температурной
показано, что в присутствии Н2О и СО2 конверсия
зависимости Аррениуса. На рис. 4 представлены
метана не зависит от их концентрации. Это являет-
примеры такого фитинга для всех трех процессов
ся прямым следствием того, что паровая и углекис-
при Т = 1700 K. Как уже отмечалось, для фитинга
лотная конверсия метана протекают не в результате
брали результаты моделирования только в интер-
его непосредственного взаимодействия с Н2О или
вале значений конверсии от 20 до 70%, так как на-
СО2, а при их взаимодействии с продуктами его
чальная и конечная стадии этих сложных радикаль-
термического пиролиза, конверсия метана и в этих
ных процессов не описываются простой кинетикой
процессах допускает аппроксимацию уравнением
первого порядка.
реакции первого порядка.
Приведенные на рис. 4 результаты показывают,
Для получения аппроксимирующих выражений,
что аппроксимация на основе экспоненциального
описывающих температурную зависимость скоро-
фитинга вполне удовлетворительно описывает рас-
сти рассматриваемых процессов конверсии метана
сматриваемые процессы. На основании получен-
НЕФТЕХИМИЯ том 61 № 6 2021
824
БУЗИЛЛО и др.
СН4 → продукты;
k1 = (0.3±0.1)×1013 exp [-(343 100 ± 12 600)/RT], c-1.
Следует отметить, что для скорости конверсии
паров Н2О в процессе паровой конверсии метана
аналогичным фитингом результатов детального
кинетического моделирования в также хорошо вы-
полняющемся в данном случае приближении реак-
ции первого порядка было получено выражение:
kН2О = 0.12×1013 exp (-362 120/RT), c-1.
А для скорости реакции первого порядка кон-
версии СО2 в процессе углекислотной конверсии
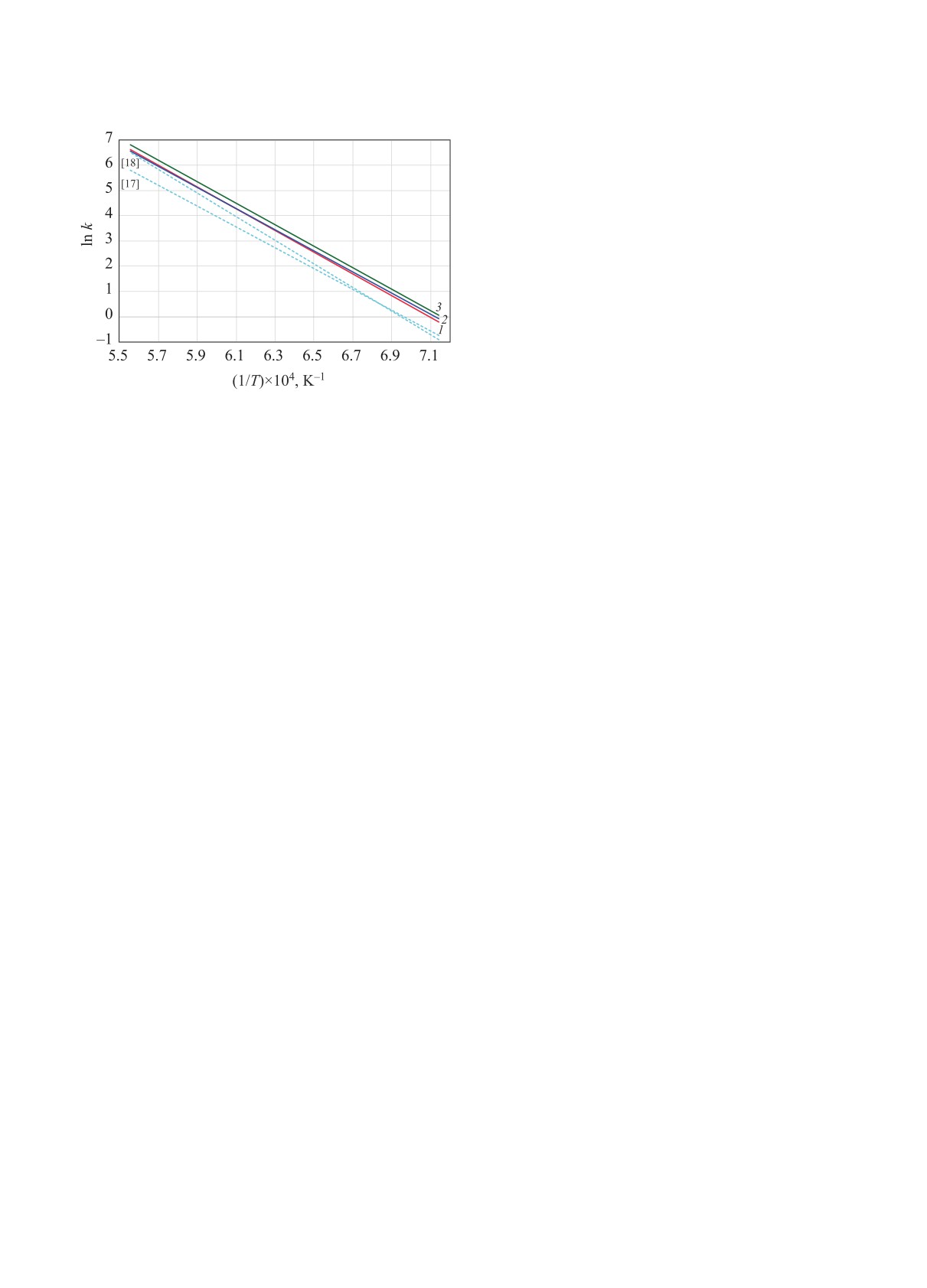
Рис. 5. Сравнение полученной кинетическим моделиро-
метана было получено выражение
ванием температурной зависимости констант скорости
превращения метана (сплошные линии) в процессах
kСО2 = 0.14×1013 exp (-339 720/RT), c-1.
паровой конверсии (1), пиролизе (2) и углекислотной
конверсии (3) c экспериментальной температурной
Константы скорости конверсии обоих реагентов
зависимостью констант скорости пиролиза метана
в соответствующих процессах очень близки, одна-
(пунктирные линии) [17, 18].
ко обращает на себя внимание, что при практиче-
ски одинаковых предэкспоненциальных множи-
телях эффективная энергия активации конверсии
ных для каждой температуры параметров аппрок-
диоксида углерода немного ниже, чем конверсии
симирующей функции в предположении константы
паров воды, несмотря на более благоприятную тер-
скорости первого порядка были получены аррениу-
мохимию паровой конверсии метана по сравнению
совские выражения для скорости рассматриваемых
с углекислотной. Это также является следствием
отсутствия прямого взаимодействия этих молекул
процессов (энергия активации в Дж/моль):
с метаном, что вполне возможно в такой сложной
СН4 → продукты;
кинетической системе.
k1 = 1.73×1013 exp (-354 200/RT), c-1,
На рис. 5 в аррениусовских координатах пред-
ставлены полученные в результате кинетического
СН4 (+Н2О) → 3Н2 + СО;
k2 = 1.88×1013 exp (-358 300/RT), c-1,
моделирования выражения для констант скорости
всех трех исследованных процессов конверсии
СН4 (+СО2) → 2Н2 + 2СО;
метана. Можно отметить, что они практически
k3 = 0.90×1013 exp (-348 200/RT), c-1.
совпадают между собой и в пределах точности их
определения вполне согласуются с результатами
Поскольку в данном случае все рассматривае-
экспериментов по пиролизу метана в данном тем-
мые процессы конверсии метана формально про-
пературном диапазоне.
текают как мономолекулярные, и, при наличии
Очевидно, что полученные кинетическим мо-
второго реагента, их скорость не зависит от его
делированием значения эффективной энергии ак-
концентрации, реагент взят в скобки и только обо-
тивации всех трех рассматриваемых процессов
значает конкретный процесс и баланс образую-
конверсии метана практически совпадают. Неболь-
щихся при этом продуктов.
шое, на уровне ~4 кДж/моль, различие скорее все-
Выражения,, полученные фитингом результатов
го, связано с определенным произволом в выборе
кинетического моделирования, можно сопоставить
конкретных аппроксимирующих выражений для
с выражением для константы скорости пиролиза
описания расчетных результатов, и вряд ли имеет
метана, полученным на основе анализа большого
какой-либо реальный смысл. Таким образом, по-
массива экспериментальных данных в диапазоне
лученные результаты можно рассматривать как ки-
температур 1100-1700 K в работах [18, 19]:
нетическое доказательство выдвинутого в [14, 15]
НЕФТЕХИМИЯ том 61 № 6 2021
О МЕХАНИЗМЕ ПРЕВР
АЩЕНИЯ МЕТАНА
825
предположения о том, что в области температур
пиролиза метана, а также его паровой и углекис-
1400-1800 K все рассматриваемые процессы кон-
лотной конверсии показало практически полную
версии метана протекают через стадию его терми-
идентичность кинетики конверсии метана, что
ческого пиролиза.
позволяет рассматривать это как доказательство
Стоит обратить внимание на то, что во всех
того, что в диапазоне температур 1400-1800 K пер-
воначальной стадией конверсии метана является
рассмотренных случаях эффективная энергия ак-
его термический пиролиз, на который слабо влияет
тивации конверсии метана значительно, почти на
присутствие Н2О и СО2. Полученные результаты
100 кДж/моль, ниже энергии разрыва первой С-Н-
связи в молекуле метана ЕСН3-Н = 432.4 кДж/моль
вполне согласуются с экспериментальными данны-
[21]. Видимо, значительная часть этого различия
ми по пиролизу метана. Получены аррениусовские
выражения для скорости конверсии метана в ука-
связана с радикально-цепным характером пиро-
занных процессах в рассматриваемом температур-
лиза метана в этих условиях, которое приводит к
ном интервале, которые могут быть полезны для
его автоускорению, что отражается на величине
эффективной энергии активации. Ускоряющее вли-
предварительных оценок и инженерных расчетов
при практической реализации процессов перера-
яние на пиролиз метана таких его продуктов, как
ботки природного газа.
ацетилен и этилен, было показано эксперименталь-
но [17].
Более низкое значение энергии активации пи-
ИНФОРМАЦИЯ ОБ АВТОРАХ
ролиза метана, полученное в экспериментальных
Бузилло Эммануэль (Bussilo Emmanuel) - бака-
работах, вполне естественно и может быть вызвано
лавр по спец. «Химическая инженерия», Римский
следующими причинами:
Университет «Сапиенца», магистрант Российского
- наличием в исследуемом реальном газе приме-
государственного университета нефти и газа (на-
си более тяжелых углеводородов, имеющих значи-
ционального исследовательского университета)
тельно более низкую энергию активации пиролиза;
имени И.М. Губкина. ORCID 0000-0002-3456-0351
- вкладом в экспериментальные результаты
Савченко Валерий Иванович, д.х.н., профессор,
имеющих значительно более низкую энергию ак-
гл. научный сотрудник Института проблем химиче-
тивации гетерогенных процессов, протекающих
ской физики. ORCID 0000-0001-9823-6844
на поверхности лабораторных реакторов, которые,
Арутюнов Владимир Сергеевич, д.х.н., проф.,
как правило, имеют небольшие размеры и, соот-
гл. науч. сотрудник Федерального исследователь-
ветственно, высокое отношение площади поверх-
ского центра химической физики им. Н. Н. Семено-
ности к объему.
ва РАН и Института проблем химической физики
Немного более низкая экспериментальная ско-
РАН, проф. Российского государственного универ-
рость пиролиза метана может быть вызвана сни-
ситета нефти и газа (НИУ) имени И.М. Губкина.
жением скорости его конверсии из-за ухода части
ORCID 0000-0003-0339-0297
активных радикалов в процессы образования более
тяжелых продуктов и сажи, которые не учитывает
ФИНАНСИРОВАНИЕ РАБОТЫ
используемая в данном исследовании кинетиче-
Работа выполнена в рамках Программы ФНИ
ская модель.
государственных академий наук. Номер темы
Таким образом, кинетическое моделирование
ИПХФ РАН 0089-2019-0018 (Номер госрегистра-
рассмотренных процессов конверсии метана убе-
ции АААА-А19-119022690098-3). Номер темы
дительно подтверждает единый механизм их на-
ФИЦ ХФ РАН 0082-2019-0014 (Номер госрегистра-
чальной стадии, определяемой процессом пироли-
ции AAAA-A20-120020590084-9).
за метана.
СПИСОК ЛИТЕРАТУРЫ
ЗАКЛЮЧЕНИЕ
1. BP Energy Outlook 2035: February 2015. URL:
Сопоставление результатов детального кинети-
ческого моделирования процессов термического
10.03.2021).
НЕФТЕХИМИЯ том 61 № 6 2021
826
БУЗИЛЛО и др.
2.
Арутюнов В.С., Лисичкин Г.В. Энергетические ре-
сурсы XXI столетия: проблемы и прогнозы. Могут
org/10.2174/1876214X20130729001
ли возобновляемые источники энергии заменить
13.
Nematollahi B., Rezaei M., Lay E.N., Khajenoori M.
ископаемое топливо? // Успехи химии. 2017. Т. 86.
Thermodynamic analysis of combined reforming
№ 8. С. 777-804 [Arutyunov V.S., Lisichkin G.V. Energy
process using Gibbs energy minimization method: In
resources of the 21st century: problems and forecasts.
view of solid carbon formation // J. Nat. Gas Chem.
Can renewable energy sources replace fossil fuels? //
Russ. Chem. Rev. 2017. V. 86. № 8. P. 777-804. https://
9953(11)60421-0
doi.org/10.1070/RCR4723].
14.
Savchenko V.I., Nikitin A.V., Sedov I.V., Ozerskii A.A.,
3.
Савченко В.И., Макарян И.А., Арутюнов В.С. Анализ
Arutyunov V.S. The role of homogeneous steam
зарубежных промышленных технологий по перера-
reforming of acetylene in the partial oxidation of
ботке углеводородных газов и оценка перспектив
methane to syngas in matrix type converters // Chem.
их реализации в нефтегазохимическом комплексе
России // Мир нефтепродуктов. Вестник нефтяных
org/10.1016/j.ces.2019.07.012
компаний. 2013. № 11. С. 3-12.
15.
Savchenko V.I., Zimin Ya.S., Nikitin A.V., Sedov I.V.,
4.
Rostrup-Nielsen J.R. Syngas in perspective // Catal.
Arutyunov V.S. Non-catalytic dry reforming of C1-C4
hydrocarbons at 1400-1800 K // J. of CO2 Utilization.
S0920-5861(01)00454-0
5.
Махлин В.А., Цецерук Я.Р. Современные технологии
16.
NUI Galway. Combustion Chemistry Center.
получения синтез-газа из природного и попутного
Mechanism Downloads. [электронный ресурс]. URL:
газа // Хим. пром. сегодня. 2010. № 3. С. 6-17.
6.
Dybkjær Ib, Aasberg-Petersen K. Synthesis gas
mechanismdownloads/# (дата обращения 09.05.2021)
technology large-scale applications // Can. J. Chem.
17.
Арутюнов В.С., Веденеев В.И. Пиролиз метана в
области температур 1000-1700 K // Успехи химии.
cjce.22453
1991. Т. 60. № 12. С. 2663-2684 [Arutyunov V.S.,
7.
Zhang Q., Wang J., Wang T. Enhancing the acetylene
Vedeneev V.I. Pyrolysis of methane in the temperature
yield from methane by decoupling oxidation and
range 1100-1700 K // Russ. Chem. Reviews.
pyrolysis reactions: A Comparison with the partial
oxidation process // Ind. Eng. Chem. Res. 2016.
RC1991v060n12ABEH001154
18.
Kevorkian V., Heath C.E., Boudart M. The decomposition
iecr.6b00817
of methane in shock waves // J. Phys. Chem. 1960. V. 64.
8.
Kostenko S.S., Ivanova A.N., Karnaukh A.A., Polianc-
zyk E.V. Conversion of methane to synthesis gas in a non-
19.
Арутюнов В.С., Веденеев В.И., Мошкина Р.И., Уша-
premixed reversed-flow porous bed reactor: A kinetic
ков В.А. Пиролиз метана в статических условиях
modeling // Chem. Eng. Proc. Proc. Intensification
в области температур 1100-1400 K // Кинетика и
катализ. 1991. Т. 32. № 2. С. 267-273 [Arutyunov V.S.,
cep.2017.05.014
Vedeneev V.I., Moshikina R.I., Ushakov V.A. Pyrolysis
9.
Fierro M., Requena P., Salgansky E., Toledo M.
of methane under static conditions at 1100-1400 K //
Experimental investigation of reverse flow porous
Kinetics and Catalysis. 1991. V. 32. № 2. P. 234-240].
medium reactor with premixed and non-premixed
20.
Савченко В.И., Зимин Я.С., Никитин А.В., Седов И.В.,
flames // Chem. Eng. J. 2021. V. 425. 130178. https://
doi.org/10.1016/j.cej.2021.130178
Арутюнов В.С. Некаталитическая паровая конвер-
10.
Arutyunov V.S., Shmelev V.M., Rakhmetov A.N.,
сия углеводородов С1-С4 // Нефтехимия. 2021. Т. 61.
№ 4. С. 520-531. [Savchenko V.I., Zimin Ya.S., Niki-
Shapovalova O.V. 3D Matrix Burners: A Method for
small-scale syngas production // Ind. Eng. Chem. Res.
tin A.V., Sedov I.V., Arutyunov V.S. Non-Catalytic Steam
Reforming of C1-C4 Hydrocarbons // Petrol. Chemistry,
ie4022489
11.
Arutyunov V.S., Savchenko V.I., Sedov I.V., Fokin I.G.,
S0965544121070021].
Nikitin A.V., Strekova L.N. New conceptions for small-
21.
Ruscic B. Active thermochemical tables: sequential
scale GTL // Chem. Eng. J. 2015. V. 282. P. 206-212.
bond dissociation enthalpies of methane, ethane, and
methanol and the related thermochemistry // J. Phys.
12.
Al-Sayari S.A. Recent Developments in the Partial
Oxidation of Methane to Syngas // The Open
org/10.1021/acs.jpca.5b01346
НЕФТЕХИМИЯ том 61 № 6 2021