НЕФТЕХИМИЯ, 2021, том 61, № 6, с. 838-847
УДК 546.26, 542.97, 546.72, 542.943, 542.424
СОВМЕСТНОЕ ПРЕВРАЩЕНИЕ МЕТАНА И ЭТАНА НА РЕЗИСТИВНОМ
ФЕХРАЛЕВОМ КАТАЛИЗАТОРЕ В ПРИСУТСТВИИ КИСЛОРОДА
© 2021 г. А. Р. Осипов1, В. А. Борисов1, В. Л. Темерев1, Д. А. Шляпин1,*
1 Центр новых химических технологий ИК СО РАН, Институт катализа СО РАН, Омск, 644040 Россия
*E-mail: dash@ihcp.ru
Поступила в редакцию 19 ноября 2020 г.
После доработки 3 августа 2021 г.
Принята к публикации 1 октября 2021 г.
Изучено совместное превращение метана и этана при раздельной подаче холодных газовых смесей
(30 об. % СН4 + 70 об. % N2 (или N2+O2), 30 об. % С2Н6 + 70 об. % N2 (или N2+O2)) в Т-образный реактор
с резистивным фехралевым катализатором, нагретым до температуры 1000°С. Показано, что одновре-
менная подача в реактор смесей «метан-азот» и «этан-азот» приводит к увеличению селективности
превращения метана по С3-углеводородам. Предложено объяснение наблюдаемых явлений на основе
предположения о реализации основного пути реакции через взаимодействие поверхностных форм метана
и этана, стабилизированных в слое углеродных отложений на поверхности резистивного фехралевого
катализатора. Отмечена роль углеродных отложений, формирующихся на катализаторе, в процессе ста-
билизации радикальных форм СН•, превращение которых протекает в направлении олигомеризации и
полимеризации, в том числе в присутствии кислорода, за счет преимущественного протекания реакций
развития цепи, а не окисления, ввиду того, что основная часть реакционной смеси имеет температуру,
близкую к комнатной.
Ключевые слова: окислительный пиролиз метана, фехраль, резистивные катализаторы, С1-С3-углево-
дороды
DOI: 10.31857/S0028242121060095
Актуальной задачей для развития нефтехимии
емых электрическим током катализаторов при по-
являются поиски оптимальной технологии перера-
даче на них холодной газовой смеси, содержащей
ботки углеводородного сырья в ценные продукты.
метан. Радикалы, образующиеся на поверхности
Широкое распространение CH4 в природе в виде
катализатора, прежде всего метильные, уходящие
природного и попутного нефтяного газов, делает
в пограничный газовый слой, будут инициировать
его перспективным сырьем для нефтехимии. Окис-
цепные процессы. Часть газа, не контактирующая
лительная и паровая конверсия метана, по большей
с разогретым катализатором (проскок), при сме-
части, направлены на получение жидких углеводо-
шении с горячими продуктами, образовавшимися
родов или метанола [1-10] Однако эти процессы
на катализаторе, будет способствовать их охлажде-
протекают при повышенных давлениях и темпера-
нию (закалке) до T < 300°C.
турах, требуют сложного технологического оформ-
В литературе описаны примеры исследования
ления и отличаются низкой энергетической эффек-
пиролиза низших алканов на резистивных катали-
тивностью.
заторах. Так, в работе [11] резистивным катализа-
Одно из перспективных направлений перера-
тором служила платиновая нить. Пиролиз метана
ботки метана и его смесей с низшими алканами
проводили при температурах 1000-1350°С. Макси-
связано с использованием резистивных, нагрева-
мальный выход углеводородов, равный 13.4%, был
838
СОВМЕСТНОЕ ПРЕВР
АЩЕНИЕ МЕТАНА И ЭТАНА
839
достигнут при температуре 1310°С. Авторы работ
[12-14] проводили процесс пиролиза на никелевых
сетках и сетках из монеля. По мнению этих авто-
ров, при низких скоростях потока газовая пленка
(пограничный слой) вокруг проволок затрудняет
диффузию радикалов сквозь нее. Даже если СН
•,
Н• и десорбируются с поверхности, они успевают
рекомбинировать в пленке с образованием вновь
метана, а образующийся при рекомбинации ме-
тильных радикалов этан может легко разложить-
ся в присутствии Н•. Увеличение скорости потока
способствует уменьшению толщины погранично-
го слоя вокруг катализаторных проволок, что об-
легчает выход радикалов в объем. Это приводит к
образованию этана, так как продукты рекомбина-
ции быстро охлаждаются (закаливаются) в потоке
газа. И. Секине и К. Фуджимото [15] пропускали
содержащую метан газовую смесь через иницииру-
ющую метильные радикалы нихромовую спираль,
разогретую до 950°С. Газовая смесь, содержащая
метильные радикалы, натекала затем через капил-
ляр в кварцевую трубку, через которую проходил
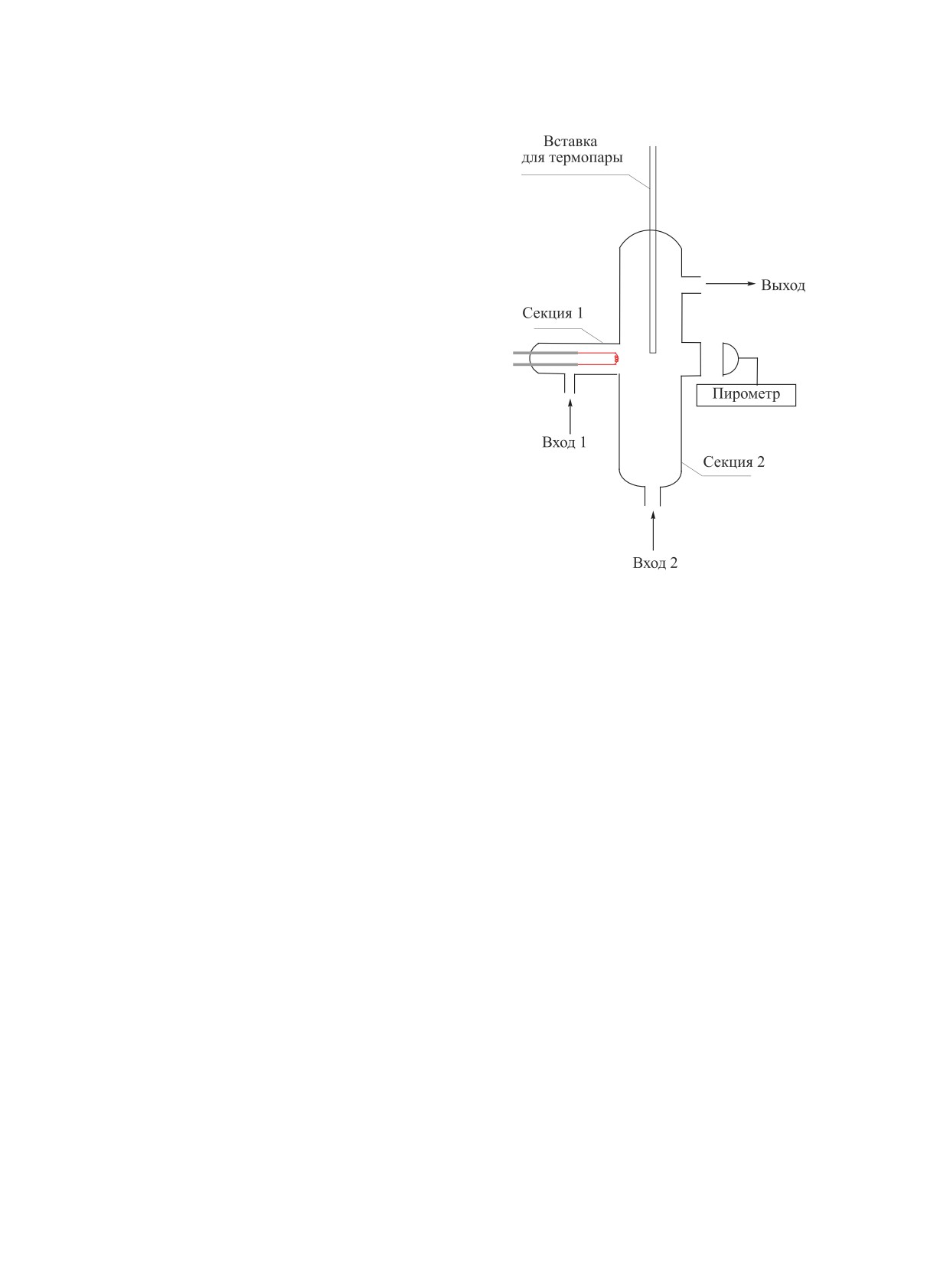
Рис. 1. Схема реактора для реакции совместного пре-
холодный газ, содержащий кислород. В результате
вращения метана с С2-углеводородами [13].
реакции радикалов с кислородом образовывались
оксигенаты, которые фиксировали на выходе из
реактора. Известна также серия работ исследова-
тельской группы П.Г. Цырульникова, посвященных
ции метана в наших предыдущих исследованиях
исследованию пиролиза метана на резистивных
[18, 19]. Исходный металлический сплав содержал
фехралевых катализаторах [16-20]. При исполь-
70% железа, 22% хрома, 6% алюминия и порядка
зовании в качестве такого катализатора фехраля,
2% других примесей и представлял собой прово-
радикальные процессы пиролиза метана локали-
локу диаметром 1 мм. Проволоку из резистивного
зуются у поверхности катализатора и в припо-
сплава разрезали на стержни длиной 30 см, скру-
верхностном газовом слое. При соприкосновении
чивали в спирали диаметром 7 мм, обезжиривали
приповерхностного газового слоя с газовой смесью
спирали в ацетоне и прокаливали в муфельной
других углеводородов, например С2, С3, С4… воз-
печи при температуре 1000°C в течение 12 ч. В ре-
можно их вовлечение в радикальные цепные пре-
зультате высокотемпературной обработки поверх-
вращения с метаном [11, 21, 22].
ность фехраля становилась шероховатой [18, 19]
Настоящая работа направлена на исследование
и неоднородной по морфологии, на ее поверхно-
возможности совместного превращения метана с
сти формировались островки корунда (α-Al2O3) и
другими углеводородами и посвящена изучению
гематита.
взаимодействия метана и этана в присутствии ре-
Обработанную фехралевую спираль помещали
зистивных катализаторов на основе фехраля, спо-
в двухсекционный проточный реактор (рис. 1) и
собность которых активировать метан была описа-
проводили эксперимент по превращению метана и
на ранее [16, 19, 20].
этана. Реактор состоял из двух секций, представля-
ющих собой кварцевые трубки с внутренним диа-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
метром 13 мм и 20 мм соответственно, соединенные
Фехралевая (FeCrAl) проволока использовалась
под прямым углом во избежание прямого нагрева
в качестве резистивного катализатора для актива-
С2-углеводорода от спирали. Фехраль помещали в
НЕФТЕХИМИЯ том 61 № 6 2021
840
ОСИПОВ и др.
Тетрадекан
Анализ
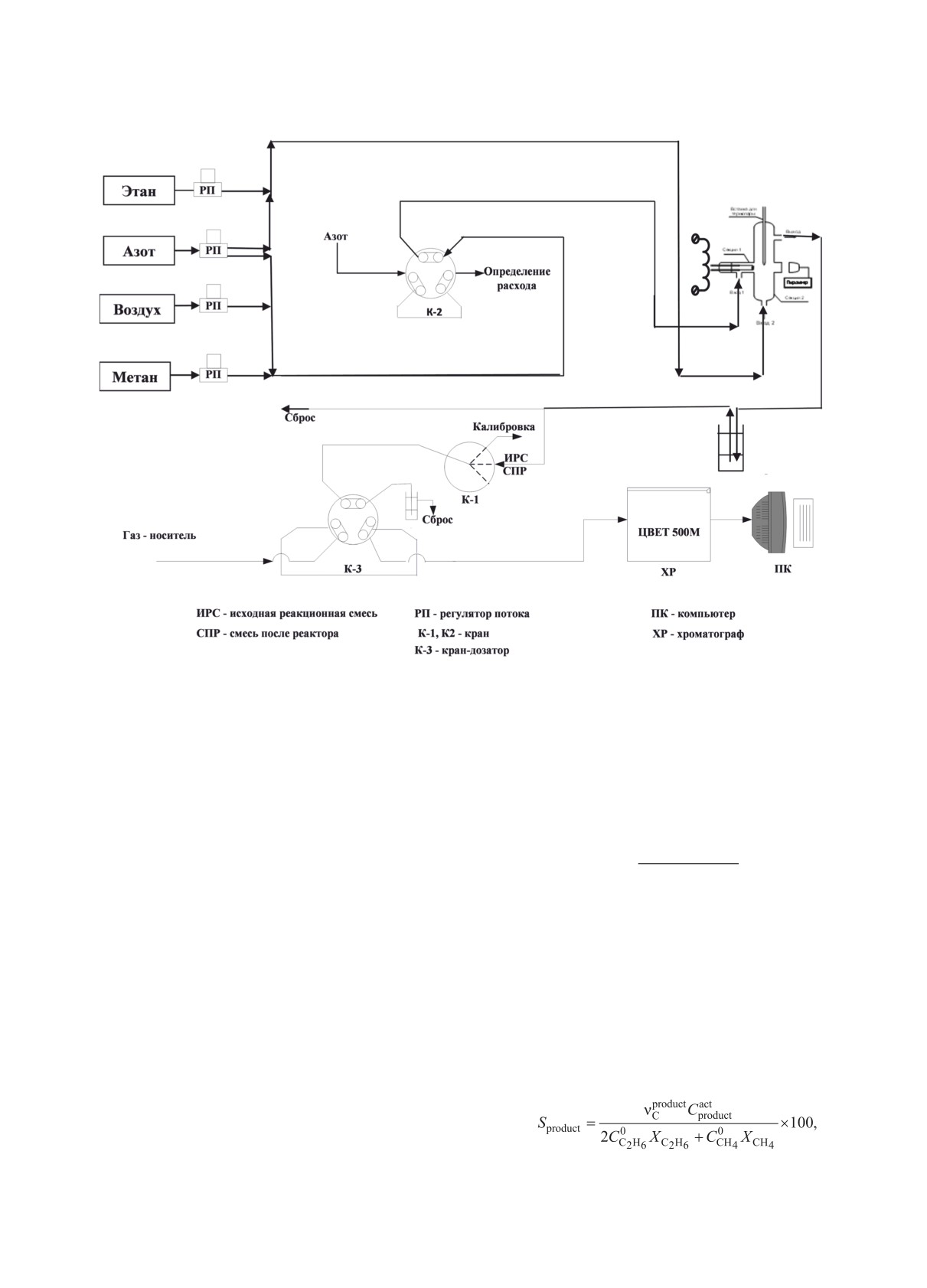
Рис. 2. Схема установки для реакции совместного превращения метана с С2-углеводородами.
секцию 1 реактора. Оба конца спирали соединяли
Степени превращения метана и этана рассчи-
с контактами, присоединенными к источнику элек-
тывали по данным хроматографического анализа в
трического тока. При подаче переменного электри-
соответствии с формулой, %:
ческого тока фехралевая спираль разогревалась
0
act
вследствие выделения джоулева тепла. Температу-
C
CxH
−C
CxH
y
y
X
CxH
=
×100,
ру спирали контролировали при помощи оптиче-
y
0
C
CxHy
ского пирометра ПД-10 (ОАО «Эталон», г. Омск) с
лазерным наведением. Принципиальная схема ис-
где XCxHy - степень превращения метана или этана,
следовательской установки представлена на рис. 2.
%; C0CxHy - исходная концентрация соответствую-
щего компонента, об. %; Cact - текущая концентра-
Содержание остаточных реакционных газов
CxHy
ция соответствующего компонента, об. %.
(метана и этана) и продуктов реакции (этилена,
ацетилена, С3- и С4-углеводородов) определяли
Азот использовали как внутренний стандарт
хроматографически в следующих условиях: капил-
при оценке изменения объема реакционной смеси.
Селективность по продуктам реакции рассчитыва-
лярная колонка (30 м), неподвижная фаза - SiO2,
ли в соответствии со следующей формулой:
газ-носитель
- азот, давление перед колонкой
101.3 кПа, температура колонки - 50°C, пламен-
но-ионизационный детектор (ПИД), питание
ПИД - воздух (300 мл/мин) и водород (30 мл/мин).
НЕФТЕХИМИЯ том 61 № 6 2021
СОВМЕСТНОЕ ПРЕВР
АЩЕНИЕ МЕТАНА И ЭТАНА
841
Таблица 1. Составы газовых смесей, подаваемых в реактор
Состав газов, подаваемых в реактор
Этап
вход 1
вход 2
1
N2 + О2 - 200 мл/мин
С2Н6 - 60 мл/мин
N2 - 140 мл/мин
2
СН4- 60 мл/мин
С2Н6- 60 мл/мин
N2 + О2 - 140 мл/мин
N2 - 140 мл/мин
3
СН4 - 60 мл/мин
N2 - 200 мл/мин
N2 + О2 - 140 мл/мин
где Sproduct - селективность по продукту реакции
три этапа, варьируя составы подаваемых в реактор,
(этилен, ацетилен, C3 и C4), %; Capcrtoduct - текущая
через входы 1 и 2, смесей (табл. 1, рис. 2.). На пер-
product
концентрация продукта реакции, об. %; ν
-
вом этапе в секцию 1 подавали азот с добавкой воз-
число молей углерода в 1 моль продукта реакции,
духа со скоростью 200 мл/мин. Концентрацию кис-
мол %.
лорода в азоте задавали равной 2.0 или 3.3 об. %.
Температуру спирали, размещенной в данной сек-
Содержание других продуктов превращения ко-
ции, задавали 1000°С и поддерживали постоянной,
личественно не оценивали в силу отсутствия воз-
можности контроля с помощью хроматомасспек-
контролируя ее с помощью пирометра. Одновре-
трометрии. Эти продукты представляли собой в
менно в секцию 2 со скоростью 200 мл/мин пода-
вали газовую смесь, содержащую 30 об. % этана
основном, углеродные отложения на поверхности
катализатора, С5-углеводороды и их более тяжелые
в азоте. В области смешения двух потоков вблизи
аналоги, их кислородсодержащие производные.
спирали проходила реакция превращения этана.
Наблюдали также выделение водорода, выход его
Продукты превращения анализировали на выходе
находился на уровне 2-5% в расчете на превращен-
из реактора.
ный метан, однако выбранный хроматографиче-
На втором этапе на вход 1 подавали смесь
ский режим не позволял одновременно фиксиро-
30 об. % метана и 2.0 (или 3.3) об. % кислорода в
вать H2 и целевые продукты (С1-С4-углеводороды)
азоте, также со скоростью 200 мл/мин. При этом
Углеродные отложения очень прочно связаны с
фиксировали концентрацию метана, С2-, С3- и
фехралевым катализатором, что делает невозмож-
С4-углеводородов, а также кислорода и водорода в
ным их количественное отделение. С5-углеводоро-
выходящей из реактора газовой смеси.
ды и их более тяжелые аналоги поглощались при
На третьем этапе на вход 1 также подавали
прохождении смеси после реактора через ловушку
смесь метана, кислорода и азота, а в секцию 2 - чи-
с тетрадеканом, их количественное определение
стый азот со скоростью ранее подаваемой смеси,
было также затруднено в силу малого их содержа-
и фиксировали продукты превращения метана. Ре-
ния. Кислородсодержащие продукты (главным об-
зультаты проведенных экспериментов представле-
разом СО и СО2, Н2О), в основном, концентриро-
ны ниже.
вались в колонке в условиях хроматографического
Как видно из данных (табл. 2) добавление не-
анализа, оценка их качественного и количественно-
больших количеств кислорода (2.0 и 3.3 об. %) к
го состава была также затруднена в силу малого их
азоту при проведении эксперимента в отсутствие
количества, высоких времен удерживания и низкой
метана (этап 1) приводит к увеличению конверсии
чувствительности детектора в выбранных условиях.
этана на 12 и 24 отн. % соответственно. Очевидно,
наблюдаемое увеличение конверсии можно связать
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
с вовлечением в превращение кислорода, вступа-
Эксперимент по совместному превращению ме-
ющего во взаимодействие с этаном в присутствии
тана и этана в присутствии кислорода проводили в
резистивного катализатора [11, 12, 14, 15]. Присут-
НЕФТЕХИМИЯ том 61 № 6 2021
842
ОСИПОВ и др.
Таблица 2. Влияние концентрации кислорода на конверсию метана и этана (в отн. %)
Смесь
Без O2
CH4/O2 = 15/1
CH4/O2 = 9/1
Этан (этап 1)
21.0
23.4
26.1
Метан (этап 2)
1.5
2
3.3
Этан (этап 2)
19.1
22.7
25.7
Метан (этап 3)
1.5
2.5
4.6
Таблица 3. Селективность продуктов реакции совместного превращения метана и этана при температуре 1000°С
CH4/O2 =
CH4/O2 =
Соотношения между компонентами
Этап
Компонент
Без O2
15/1
9/1
смеси
1
Метан
10.0
9.1
7.3
1
10
Этилен
59.9
54.6
48.0
6
60
Ацетилен
22.0
13.4
9.8
2
6
С3
1.1
1.0
0.8
1
С4
4.6
2.4
1.8
1
2
Этилен
62.6
53.7
49.3
20
Ацетилен
14.2
7.3
5.0
3
С3
3.8
2.8
2.3
1
С4
5.8
2.7
1.9
1
3
Этан
24.9
16.1
15.6
Этилен
10.8
11.6
15.5
Ацетилен
0.2
0.6
1.1
С3
0.6
0.9
1.4
ствие кислорода приводит также и к изменению
Введение кислорода способствует развитию
состава газообразных продуктов реакции (табл. 3).
реакций образования тяжелых углеводородов; их
При проведении эксперимента без кислорода в
доля, рассчитываемая как разница между количе-
ством этана, пошедшим на образование метана,
продуктах реакции появляется метан, присутствие
которого можно связать с диссоциацией молекул
С2-, С3- и С4-углеводородов, и общим количеством
этана на резистивном катализаторе с образованием
превращенного этана, возрастает в 8 и 14 раз при
метильных радикалов [23, 24] (термическая диссо-
концентрациях кислорода 2.0 и 3.3 об. % Соответ-
циация этана в объеме смеси в условиях экспери-
ственно. В то же время, механизм окислительного
мента маловероятна, так как подаваемые в реактор
пиролиза этана [25], приводящий к образованию
газовые потоки имеют температуру, близкую к ком-
метана, С2-, С3- и С4-углеводородов не меняется, в
натной, за исключением небольшого объема вбли-
пользу чего свидетельствуют значения селективно-
зи спирали резистивного катализатора, нагретой
сти. Действительно, как показывают данные, меж-
до температуры 1000°С); селективность по метану
ду количествами образующихся углеводородов,
достигает 10%. Основные продукты реакции - эти-
вне зависимости от присутствия кислорода в сме-
лен, образующийся в количествах, превышающих
си, существуют устойчивые соотношения, опре-
метан в 6 раз, и ацетилен, количество которого в
деляемые последовательностью их превращений.
2.2 раза больше, чем метана. В продуктах реакции
Так, количества образующихся этилена, ацетилена
присутствуют также С3-углеводороды в количе-
и метана находятся в соотношении 6:2:1; общее ко-
стве, в ~10 раз меньшем, чем количество образую-
личество образующихся С4-углеводородов и коли-
щегося метана, и С4-углеводороды, которых обра-
чество ацетилена связаны приблизительным моль-
зуется в ~2 раза меньше.
ным соотношением 6:1; количества образующихся
НЕФТЕХИМИЯ том 61 № 6 2021
СОВМЕСТНОЕ ПРЕВР
АЩЕНИЕ МЕТАНА И ЭТАНА
843
Рис. 3. Фотография исходного образца фехралевого катализатора (а) и образца с отложениями углерода после совместного
превращения метана и этана в присутствии О2 (б).
этилена, метана и С3-углеводородов - приблизи-
лизатора и в объеме вблизи него. Как уже было
тельным соотношением 60:10:1.
описано ранее для пиролиза метана на фехралевом
При проведении эксперимента в условиях, когда
катализаторе [19], активными центрами резистив-
оба потока, входящих в реактор, содержат углево-
ного фехралевого катализатора являются ион-ра-
дороды (этап 2), общая величина степени превра-
дикалы кислорода, существующие на поверхности
щения этана остается приблизительно на том же
корунда и гематита на окисленном фехрале. Они
уровне, но заметно меняется качественный состав
являются дегидрирующими агентами и в указан-
продуктов реакции. В 3 раза возрастает отношение
ном интервале температур участвуют в реакциях
С3:С2Н4, с 1:60 до 1:20, и мы также видим, что это
отрыва водорода с образованием метильных ра-
соотношение является устойчивым, не зависит от
дикалов, которые частично десорбируются в газо-
присутствия кислорода в реакционной смеси, и от-
вую фазу. Метильные радикалы в газовой фазе ре-
ражает тот факт, что этилен является предшествен-
комбинируют с образованием этана и участвуют в
ником С3-углеводородов в цепочке превращений.
развитии цепных реакций. Кислород, при наличии
Устойчиво воспроизводится также соотношение
его в реакционной смеси, реокисляет поверхность
между количествами образующегося ацетилена и
катализатора, регенерируя активные кислородные
С4-углеводородов, равное 3:1, что дает также, ос-
центры. Кислород газовой фазы выступает деги-
нования предполагать, что С4-углеводороды явля-
дрирующим агентом для этана, т.е. в газовой фазе
ются продуктом димеризации присутствующих на
протекают реакции отрыва водорода от этана с об-
поверхности катализатора ацетиленовых форм.
разованием радика- ла С2Н•, а затем и этилена.
При подаче в реактор метана, в отсутствие
Этан, адсорбируясь на поверхности фехралево-
этана (этап 3) определенных устойчивых соотно-
го резистивного катализатора (1), дегидрируется до
шений между продуктами реакции не выявлено,
этилена (2) и, далее, до ацетилена (3). Димеризация
можно отметить тенденцию к росту доли этилена,
адсорбированных форм ацетилена приводит к обра-
ацетилена и С3-углеводородов с увеличением со-
зованию С4-углеводородов (уравнения (4)-(6), (24),
держания кислорода в реакционной смеси, а также
(25)), а диссоциация - к образованию СН-форм (7)
существенно более высокую долю нецелевых про-
и, далее - метана (уравнения (9), (10), (16)). Угле-
дуктов, к каковым относится отлагающийся на по-
водороды С3 образуются путем взаимодействия
верхности фехралевой проволоки углерод (рис. 3)
поверхностных форм этилена и метана ((11)-(14),
и образующиеся в присутствии кислорода оксиды
(26)-(28)). Введение в смесь метана увеличивает
углерода.
количество образующихся из него метильных и
На основе анализа состава продуктов реакции
метиленовых форм, что и выражается в увеличе-
можно предположить протекание следующей цепи
нии доли С3-углеводородов ((9)-(16)). Присутствие
превращений на поверхности резистивного ката-
кислорода в реакционной смеси можно, отнести,
НЕФТЕХИМИЯ том 61 № 6 2021
844
ОСИПОВ и др.
скорее, к факторам, оказывающим негативное вли-
С2Н2 (адс) ↔ С2Н2 (г),
(23)
яние, т.к. при незначительном увеличении степени
С4Н6 (адс) ↔ С4Н6 (г),
(24)
превращения происходит снижение доли целевых
С3- и С4-углеводородов, возрастание количества
С4Н8 (адс) ↔ С4Н8 (г),
(25)
отлагающегося углерода и оксидов углерода ((17),
С3Н8 (адс) ↔ С3Н8 (г),
(26)
(18), (20), (21)). Процессу образования углерода,
С3Н6 (адс) ↔ С3Н6 (г),
(27)
по-видимому, способствует и взаимодействие ад-
сорбированных форм кислорода и водорода на по-
С3Н4 (адс) ↔ С3Н4 (г),
(28)
верхности катализатора, приводящее к удалению
Н2 (адс) ↔ Н2 (г),
(29)
воды, и способствующее развитию процессов вза-
имодействия адсорбированных углеводородных
СО (адс) ↔ СО (г)
(30)
форм и образованию полииновых структур, из
СО2 (адс) ↔ СО2 (г),
(31)
которых, далее, формируются частицы углерода.
2Н (адс) +O (адс) → Н2О (адс),
(32)
Процесс формирования углеродных отложений,
по-видимому, протекает согласно моделям, описан-
Н2О (адс) → Н2О (г).
(33)
ным в работах Словецкого [26] и Крестинина [27].
С2Н6 (г) ↔ С2Н6 (адс),
(1)
С2Н6 (адс) ↔ С2Н4 (адс) + 2Н (адс),
(2)
Данная схема превращений во многом совпа-
дает с представленной в литературе для процесса
С2Н4 (адс) ↔ С2Н2 (адс) + 2Н (адс),
(3)
окислительного пиролиза легких углеводородов
2С2Н2 (адс) ↔ С4Н4
(адс),
(4)
(метана, этана), однако имеется и ряд отличий.
С4Н4 (адс) + 2Н (адс) ↔ С4Н6 (адс),
(5)
В частности, как указывалось в работах Fleys
[28, 29], Holmen [30], M. Bistolfi [31], J.A. Sofranko
С4Н6 (адс) + 2Н (адс) ↔ С4Н8 (адс),
(6)
[32], введение кислорода рассматривалось как мера,
С2Н2
(адс) ↔ 2СН (адс),
(7)
предотвращающая зауглероживание, в то время как
в нашем случае кислород, наоборот, способствует
СН (адс) ↔ С (адс) + Н (адс),
(8)
образованию углеродных отложений, о чем свиде-
СН (адс) + Н (адс) ↔ СН2 (адс),
(9)
тельствует фотография отработанного катализато-
СН2 (адс) + Н (адс) ↔ СН3
(адс),
(10)
ра. С другой стороны, Holmen [30] сообщал о не-
гативном влиянии добавления этана и пропана на
С2Н4 (адс) + СН3 (адс) → С3Н7 (адс),
(11)
селективность окислительного пиролиза метана по
С3Н7 (адс) + Н (адс) → С3Н8
(адс),
(12)
С2-углеводородам за счет преимущественного пре-
С2Н4 (адс) + СН2 (адс) → ц-С3Н6 (адс),
(13)
вращения допантов в углерод. Полученные нами
данные свидетельствуют о том, что за образование
С3Н6 (адс) → С3Н4 (адс) + 2Н (адс),
(14)
углерода в большей степени ответственен метан.
СН4 (г) ↔ СН4
(адс),
(15)
Реализация стадийного окислительно-восстано-
СН4 (адс) ↔ СН3 (адс) + Н (адс),
(16)
вительного механизма, предполагающего окисли-
тельное превращение углеводородов на активных
O2 (г) → О2 (адс),
(17)
центрах, содержащих кислород, с образованием ра-
О2
(адс) → 2О- (адс),
(18)
дикалов CH
•, C2H
•, в случае резистивного катализа
2Н (адс) → Н2 (адс)
(19)
затруднена, ввиду быстрого покрытия поверхности
катализатора углеродом. Развитие радикальных
С (адс) + О- (адс) → СО (адс)
(20)
процессов в объеме реактора также затруднено, т.к.
СО (адс) + О- (адс) → СО2
(адс)
(21)
основная часть реакционных потоков имеет тем-
С2Н4 (адс) ↔ С2Н4 (г),
(22)
пературу, близкую к комнатной. Соответственно,
основные превращения развиваются на поверхно-
НЕФТЕХИМИЯ том 61 № 6 2021
СОВМЕСТНОЕ ПРЕВР
АЩЕНИЕ МЕТАНА И ЭТАНА
845
сти углеродных отложений, способных стабилизи-
ИНФОРМАЦИЯ ОБ АВТОРАХ
ровать радикалы, образующиеся при термической
Осипов Алексей Романович, м.н.с, ORCID:
диссоциации углеводородов на поверхности, ра-
зогретой до 1000°С. Сам же углерод, как известно
Борисов Вадим Андреевич н.с., к.х.н., ORCID
[33, 34], является катализатором разложения угле-
водородов на углерод и водород, а также способ-
Темерев Виктор Леонидович, н.с., к.х.н., ORCID:
ствует образованию С2-углеводородов. Отлагаю-
щийся на поверхности катализатора углерод, чаще
всего, является графитоподобным, что является
Шляпин Дмитрий Андреевич с.н.с., к.х.н.,
главным фактором стабилизации радикальных
форм, обеспечивая взаимодействие неспаренных
электронов образующихся радикалов с делокали-
ФИНАНСИРОВАНИЕ РАБОТЫ
зованной электронной плотностью графеновых
Работа выполнена при финансовой поддержке
слоев [35, 36]. Поскольку основная часть реакци-
Министерства науки и высшего образования РФ в
онной смеси имеет температуру близкую к комнат-
рамках государственного задания Института ката-
ной, реакции окисления развиваются в меньшей
степени, нежели радикальные реакции роста цепи,
лиза СО РАН (проект AAAA-A21-121011390009-1).
что и приводит к наблюдаемым нами результатам,
зауглероживанию поверхности катализатора, отло-
КОНФЛИКТ ИНТЕРЕСОВ
жению углерода на поверхности реакционной зоны
Авторы заявляют об отсутствии конфликта
кварцевого реактора.
интересов, требующего раскрытия в данной статье.
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
В результате исследования совместного пре-
1. Christian E.B., Lødeng R., Holmen A. A review of cata-
вращения холодных газовых смесей 30%СН4 +N2,
lytic partial oxidation of methane to synthesis gas with
30%С2Н6+N2 на разогретом до температуры 1000°С
emphasis on reaction mechanisms over transition metal
резистивном фехралевом катализаторе установле-
catalysts // Appl. Catal. A: Gen. 2008. V. 346. P. 1-27.
но, что продукты превращения этана и смеси «ме-
тан + этан» находятся в устойчивых количествен-
2. Holmen A. Direct conversion of methane to fuels and
ных соотношениях, не зависящих от присутствия
chemicals // Catal. Today 2009. V. 142. P. 2-8. https://
кислорода в газовой смеси. Существование этих
doi.org/10.1016/j.cattod.2009.01.004
устойчивых соотношений позволило сделать пред-
3. Gao Z., Zhang J., Wang R. Formation of hydrogen in
положения о последовательности протекающих
oxidative coupling of methane over BaCO3 and MgO
превращений углеводородов, которая отличается
catalysts // J. Nat. Gas Chem. 2008. V. 17. P. 238-241.
от описанной в литературе для процесса окисли-
4. Dedov A.G., Loktev A.S., Moiseev I.I., Aboukais A.,
тельного пиролиза легких углеводородов (метана,
Lamonier J.-F., Filimonov I.N. Oxidative coupling of
этана). Эти отличия заключаются в преимуще-
methane catalyzed by rare earth oxides: Unexpected
ственном протекании в присутствии кислорода
synergistic effect of the oxide mixtures // Appl. Catal. A:
реакций олигомеризации и полимеризации, а не
реакций окисления и обусловлены каталитическим
S0926-860X(02)00641-5
эффектом углеродных отложений и ограниченно-
5. Gambo Y., Jalil А.A., Triwahyono S., Abdulrasheed A.A.
стью зоны высокой температуры, в которой могли
Recent advances and future prospect in catalysts for
бы развиваться радикальные реакции окисления, а
oxidative coupling of methane to ethylene: A review //
также небольшим объемом вблизи спирали ката-
лизатора. Протекание реакций в слое углеродных
org/10.1016/j.jiec.2017.10.027
отложений повышает вероятность взаимодействия
6. Fang T., Yeh C. Interactions of methane with ThO2SiO2
радикальных форм метана и этана с образованием
surface at 1073 K // J. Catal. 1981. V. 69. P. 227-229.
С3-углеводородов.
НЕФТЕХИМИЯ том 61 № 6 2021
846
ОСИПОВ и др.
7.
Aparicio L.M., Rossini S.A., Sanfilippo D.G., Rekoske J.E.,
methane pyrolysis: Pretreatment and study of Fechral
Trevino A.A., Dumesic J.A. Microkinetic analysis of
support // Russ. J. Appl. Chem. 2009. V. 82. P. 307-311.
methane dimerization reaction // Ind. Eng. Chem. Res.
19.
Sigaeva S.S., Temerev V.L., Borisov V.A., Tsyrul’nikov P.G.
ie00057a009
Pyrolysis of methane on fechral resistive catalyst with
8.
Sokolovskii V.D., Aliev S.M., Buyevskaya O.V., Davy-
additions of hydrogen or oxygen to the reaction mix-
dov A.A. Type of hydrocarbon activation and nature of
active sites of base catalysts in methane oxidative dehy-
org/10.1134/S2070050415030101
drodimerization // Catal. Today. 1989. V. 4. P. 293-300.
20.
Sigaeva S.S., Likholobov V.A., Tsyrul’nikov P.G. Pyroly-
sis of methane on a heat-treated FeCrAl coil heated with
9.
Fujimoto K., Sekine Y. Low temperature direct oxida-
electric current // Kinet. Catal. 2013. V. 54. P. 199-206.
tion of methane to methanol // Studies in Surface Sci-
21.
Pogosyan N.M., Pogosyan M.D., Strekova L.N., Tava-
org/10.1016/s0167-2991(97)80317-5
dyan L.A., Arutyunov V.S. Effect of the concentrations of
10.
Sekine Y., Fujimoto K. Low-Temperature direct conver-
methane and ethylene on the composition of the products
sion of methane to methanol with filament wire initiation
of their cooxidation // Russ. J. Phys. Chem. B. 2015. V. 9.
method // Energy & Fuels. 1996. V. 10. P. 1278-1279.
22.
Pogosyan N.M., Pogosyan M.D., Shapovalova O.V.,
11.
Sun Q., Tang Y., Gavalas G. Methane Pyrolysis in a
Nikitin A.V., Arutyunov V.S. Activation of the radical-pro-
Hot Filament Reactor // Energy & Fuels. 2000. V. 14.
moted conversion of light hydrocarbons by the prod-
ucts of a rich methane flame // Russ. J. Phys. Chem. B.
12.
Quah E.B.H., Li C.Z. Effects of radical desorption on
catalyst activity and coke formation during the catalyt-
S1990793116060075
ic pyrolysis and oxidation of light alkanes // Applied
23.
Xia X., Gao Y. Depletion of 13C in residual ethane and
Catalysis A: General. 2003. V. 250. № 1. P. 83-94.
propane during thermal decomposition in sedimenta-
ry basins // Org. Geochem. 2018. V. 125. P. 121-128.
13.
Quah E.B.H., Mathews J.F., Li C.Z. Interinfluence be-
tween reactions on the catalyst surface and reactions
24.
Shinde V.M., Pradeep P. Detailed gas-phase kinetics
in the gas phase during the catalytic oxidation of meth-
and reduced reaction mechanism for methane pyrolysis
ane with air // Journal of Catalysis. 2001. V. 197. № 2.
involved in CVD/CVI processes // J. Anal. Appl. Pyrol-
14.
Quah E.B.H., Li C.Z. Roles of desorbed radicals and
jaap.2020.104998
reaction products during the oxidation of methane using
25.
Naik C.V., Dean A.M. Detailed kinetic modeling of
a nickel mesh catalyst // Applied Catalysis A: General.
ethane oxidation // Combust. Flame. 2006. V. 145. P. 16-
apcata.2003.08.023
26.
Krestinin A.V. Detailed modeling of soot formation in
15.
Секине И., Фуджимото К. Новый метод прямой
hydrocarbon pyrolysis // Combust. Flame. 2000. Т.
конверсии метана // Кинетика и катализ. 1999. № 3.
С. 327.
2180(99)00167-4
16.
Sigaeva S.S., Temerev V.L., Kuznetsova N.V., Tsyrulni-
27.
Slovetskii D.I., Mankelevich Yu.A., Slovetskii S.D.,
kov P.G. Methane pyrolysis on deposited resistive
MeOx/carborundum catalysts, where MeOх is MgO,
Rakhimova T.V. Mathematical modeling of the plas-
CaO, MgO/Al2O3, MgO/ZrO2, CaO/Al2O3, and
ma-chemical pyrolysis of methane // High Energy
CaO/ZrO2 // Catal. Ind. 2017. V. 9. P. 277-282. https://
doi.org/10.1134/S2070050417040080
org/10.1023/A:1013600628538
17.
Sigaeva S.S., Temerev V.L., Kuznetsova N.V., Tsyrul-
28.
Fleys M., Simon Y., Marquaire P.-M. Discussion on the
nikov P.G. Pyrolysis of methane on oxide catalysts sup-
oxidative and the pyrolysis routes of the CH• radicals in
ported by resistive fechral and carborundum // Catal.
the partial oxidation of methane over La2O3 // J. Anal.
S2070050417030114
org/10.1016/j.jaap.2006.09.001
18.
Sigaeva S.S., Tsyrul’nikov P.G., Shlyapin D.A., Doro-
29.
Fleys M., Shan W., Simon Y., Marquaire P.M. Detailed
feeva T.S., Voitenko N.N., Vershinin V.I., Davletkil’de-
kinetic study of the partial oxidation of methane over
ev N.A., Kuznetsov G.B., Kanashenko S.L. Catalysts of
La2O3 catalyst. Part 1: Experimental results // Ind. Eng.
НЕФТЕХИМИЯ том 61 № 6 2021
СОВМЕСТНОЕ ПРЕВР
АЩЕНИЕ МЕТАНА И ЭТАНА
847
33. Muradov N. Catalysis of methane decomposition over
org/10.1021/ie060342z
elemental carbon // Catal. Commun. 2001. V. 2. P. 89-94.
30. Holmen A., Olsvik O., Rokstad O.A. Pyrolysis of nat-
34. Lee E.K., Lee S.Y., Han G.Y., Lee B.K., Lee T.-J.,
ural gas: chemistry and process concepts // Fuel
Jun J.H., Yoon K.J. Catalytic decomposition of methane
over carbon blacks for CO2-free hydrogen production //
org/10.1016/0378-3820(94)00109-7
31. Bistolfi M., Fornasari G., Molinari M., Palmery S., Den-
org/10.1016/j.carbon.2004.06.003
te M., Ranzi E. Kinetic model for methane oxidative cou-
35. Mandeltort L., Choudhury P., Johnson J.K., Yates J.T.
pling reactors // Chem. Eng. Sci. 1992. V. 47. P. 2647-
Methyl radical reactivity on the basal plane of graphite //
J. Phys. Chem. C. 2012. V. 116. P. 18347-18357. https://
doi.org/10.1021/jp3063367
32. Sofranko J.A., Leonard J.J., Jones C.A. The oxidative
36. Sharma A.R., Schneider R., Toussaint U., Nordlund K.
conversion of methane to higher hydrocarbons // J. Catal.
Hydrocarbon radicals interaction with amorphous carbon
surfaces // J. Nucl. Mater. 2007. V. 363-365. P. 1283-
9517(87)90122-9
НЕФТЕХИМИЯ том 61 № 6 2021