НЕФТЕХИМИЯ, 2022, том 62, № 6, с. 773-796
УДК 544.47
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ (ОБЗОР)
© 2022 г. Д. П. Мельников1,*, А. А. Новиков1, А. П. Глотов1, М. В. Решетина1,
Е. М. Смирнова1, H.Q. Wang2, В. А. Винокуров1
1 Российский государственный университет нефти и газа (Национальный исследовательский университет)
имени И.М. Губкина, Москва, 119991 Россия
2 State Key Laboratory of Solidification Processing, Center for Nano Energy Materials, School of Materials Science
and Engineering, Northwestern Polytechnical University and Shaanxi Joint Laboratory of Graphene (NPU),
Xi’an, 710072 China
*E-mail: melnikov.dp@mail.ru
Поступила в редакцию 30 мая 2022 г.
После доработки 11 июля 2022 г.
Принята к публикации 16 августа 2022 г.
В обзоре рассмотрены термодинамические особенности процессов термического и окислительного де-
гидрирования легких алканов, в частности, зависимость конверсии пропана от температуры, давления,
отношения CO2:пропан. Обобщены известные данные по использованию металлических и оксидных
катализаторов для указанных процессов, выявлены наилучшие по совокупности конверсии и селективно-
сти катализаторы окислительного дегидрирования: оксиды хрома на мезопористых носителях. Проведен
обзор существующих промышленных технологий дегидрирования.
Ключевые слова: дегидрирование алканов, углекислотное дегидрирование, производство олефинов,
пропан, пропилен, CO2
DOI: 10.31857/S0028242122060028, EDN: NOXIKF
Низшие олефины С2-С4 являются сырьем для
ацетона и фенола, а также α-метилстирола), оксида
получения широкого спектра нефтехимических
пропилена, бутиловых спиртов, акрилонитрила и
продуктов: полиолефинов, оксиранов, спиртов, ка-
акриловой кислоты, а на нефтеперерабатывающих
учуков, компонентов моторных топлив и др. [1-3].
заводах - для получения полимербензина и алки-
В 2020 г. объем производства наиболее крупнотон-
лата [2].
нажных олефинов - этилена и пропилена - превы-
Олефины С4 находят гораздо меньшее примене-
сил 300 млн т, при этом тенденция к росту их про-
ние, чем этилен и пропилен. В нефтеперерабаты-
изводства сохраняется [4].
вающей промышленности из бутиленов получают
Этилен является мономером для производства
высокооктановые компоненты бензина (алкилат и
таких крупнотоннажных продуктов, как полиэ-
метил-трет-бутиловый эфир, или МТБЭ) [7, 8],
тилен высокой плотности (ПЭВП), полиэтилен
в нефтехимической промышленности - каучуки,
низкой плотности (ПЭНП), линейный полиэтилен
трет-бутиловый спирт, 1-бутен, используют в ка-
низкой плотности (ЛПЭНП), а также прекурсором
честве сомономера для производства ЛПЭНП.
для синтеза ряда других мономеров: дихлорэтана
для производства винилхлорида, этилбензола для
Основными способами промышленного произ-
производства стирола, оксида этилена для произ-
водства низших олефинов являются [8-11]:
водства этиленгликоля [3, 5, 6].
- пиролиз углеводородных фракций (с получе-
Пропилен - сырье для синтеза различных марок
нием всего спектра легких олефинов и, главным
полипропилена, изопропилбензола (для получения образом, этилена), а также жидких продуктов -
773
774
МЕЛЬНИКОВ и др.
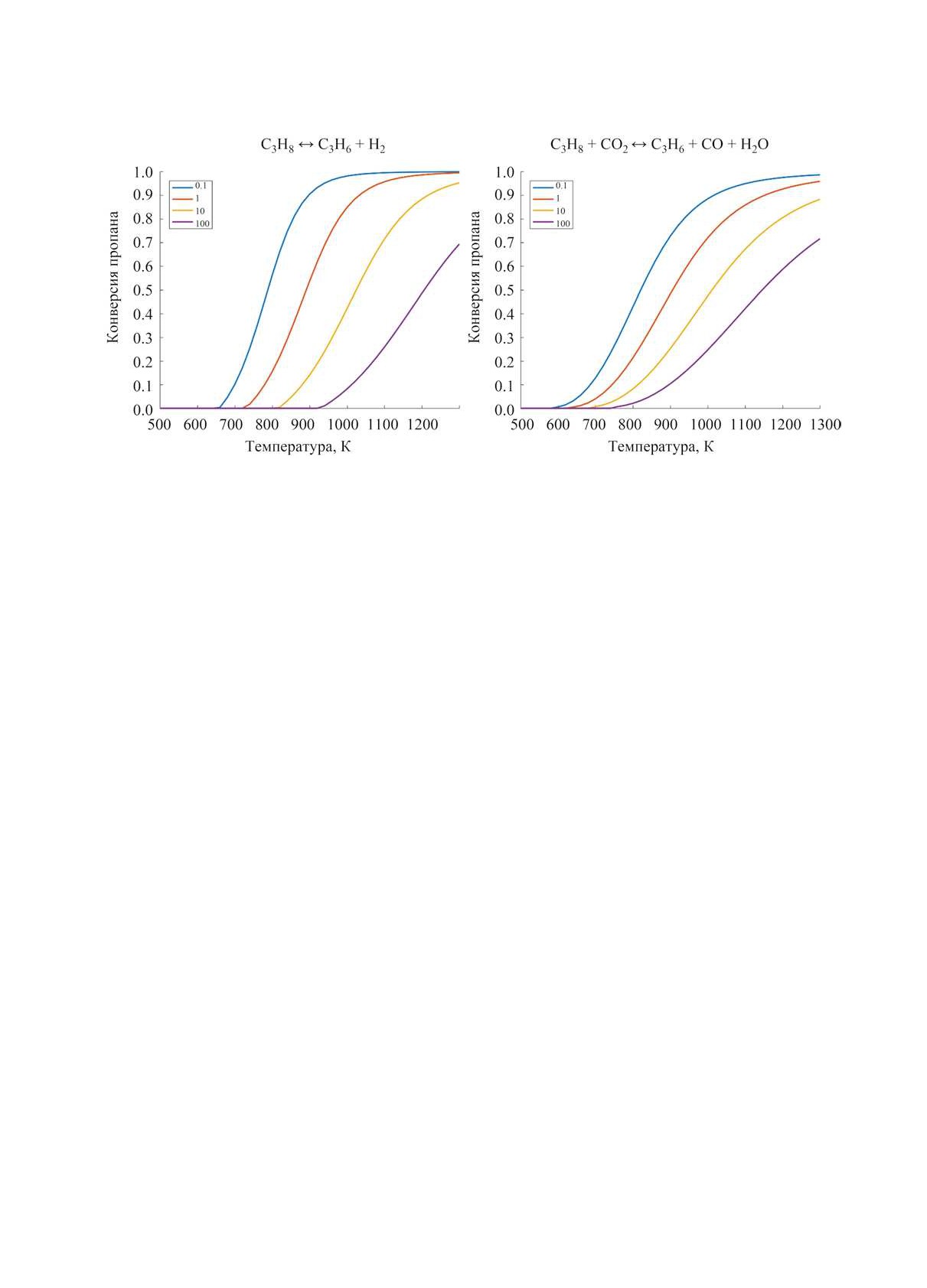
Рис. 1. Зависимость равновесной конверсии пропана от температуры при различных давлениях (0.1, 1.0, 10.0 и 100 бар) для
термического дегидрирования (слева) и окислительного дегидрирования с углекислым газом (справа).
бензол-толуол-ксилольной фракции (БТК-фрак-
Термодинамические особенности
ции) и смолы пиролиза;
дегидрирования легких алканов
- каталитический крекинг вакуумного газойля
Термокаталитическое дегидрирование низших
алканов на примере пропана может быть представ-
(с получением прежде всего пропилена и бутиле-
лено следующим уравнением:
нов);
- каталитическое дегидрирование легких алка-
C3H8 ↔ C3H8 + H2; ΔH0298 = +125.1 кДж/моль.
нов до соответствующих олефинов.
Процесс является обратимым, эндотермиче-
Небольшие объемы пропилена производят за
ским, с увеличением объема; соответственно, для
счет процессов метанол-в-пропилен, а также мета-
его проведения благоприятны низкие давления и
тезиса олефинов [12].
высокие температуры. Зависимость равновесной
Если при пиролизе углеводородов основным
конверсии пропана от температуры при различных
продуктом является этилен, а при каталитическом
давлениях рассчитана аналогично методу в статье
крекинге - бензин, что ограничивает возможность
[13] и показана на рис. 1.
наращивания производства олефинов С3-С4, то
С увеличением длины и разветвленности угле-
процессы дегидрирования легких алканов позволя-
родного скелета дегидрирование алканов облегча-
ют целевым образом получать олефины.
ется [14]. Например, для достижения 50%-ной кон-
версии субстрата требуется температура в 585°C
При этом сам процесс дегидрирования может
для н-гексана, 595°C - для пропана, 540°C - для
быть осуществлен двумя принципиальными спо-
и-бутана и 725°C - для этана [15]. В промышлен-
собами: собственно термокаталитическим деги-
ности дегидрирование пропана проводят при тем-
дрированием и окислительным дегидрированием.
пературах 550-600°C [16]. Однако, столь высокие
Первый способ получил распространение в про-
температуры, необходимые для разрыва прочных
мышленности, однако сопряжен с рядом термоди-
C-H-связей в молекулах алканов, неизбежно при-
намических ограничений, снять которые позволяет
водят к протеканию побочных реакций - крекинга,
окислительный вариант.
коксообразования и других.
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
775
Термодинамические ограничения процесса де-
гидрирования могут быть сняты при использова-
нии окислителя. Например, при использовании
кислорода в качестве окислителя реакция стано-
вится экзотермической и практически необрати-
мой [17, 18]:
C3H8 + 0.5O2 ↔ C3H6 + H2O; ΔH0298 = -116.7 кДж/моль.
Недостатком данного процесса является не-
обходимость предварительного энергозатратного
разделения воздуха, а также высокая вероятность
термодинамически более благоприятного полного
окисления.
В качестве альтернативы кислороду могут быть
использованы более мягкие окислители, например
N2O [19-23] или СО2 [21, 24-26]. Во втором случае
реакция может быть записана в следующем виде:
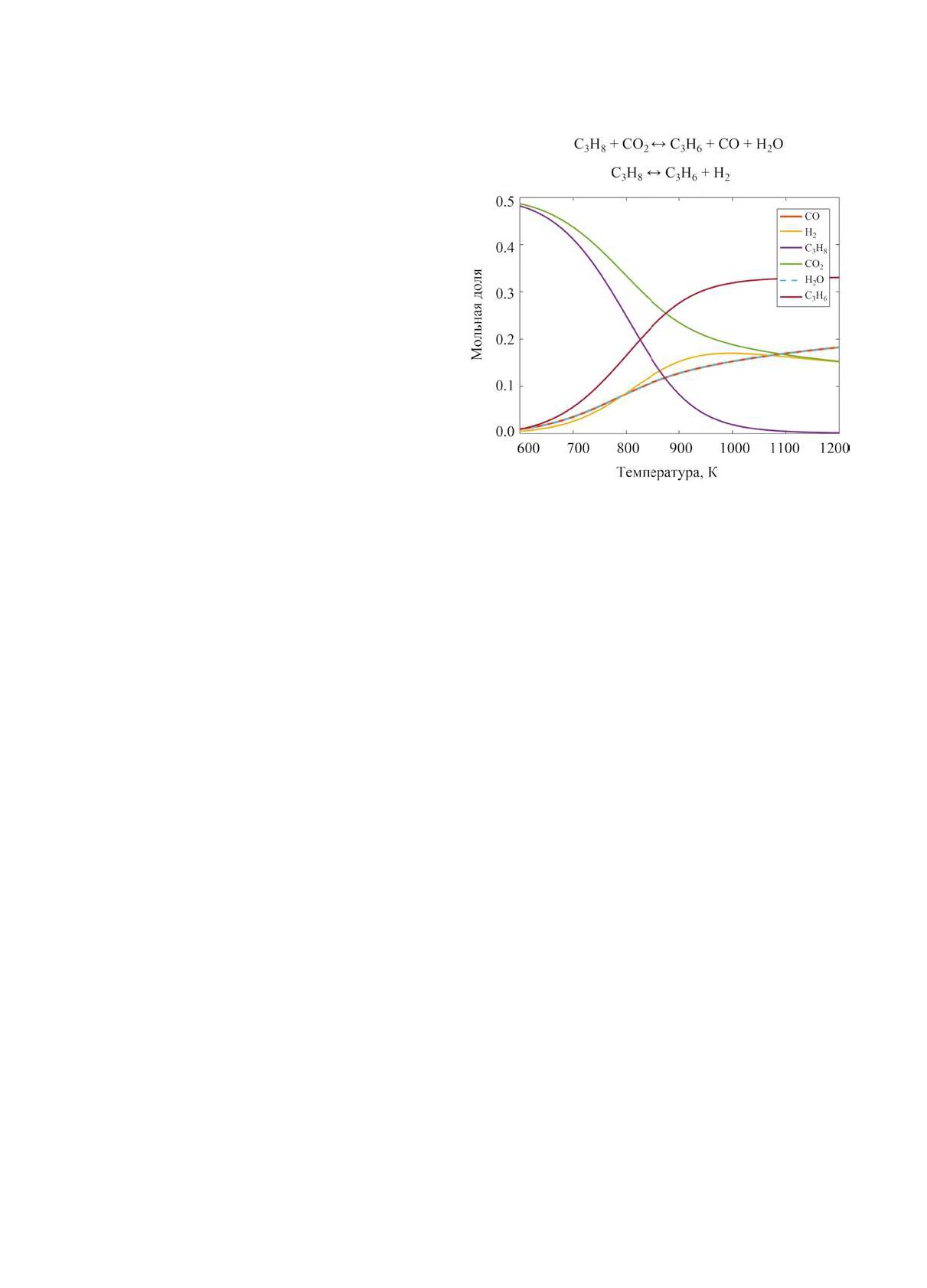
Рис. 2. Зависимость равновесного состава реакционной
смеси от температуры (при давлении 1.0 бар).
C3H8 + CO2 ↔ C3H6 + CO + H2O;
ΔH0298 = +166.3 кДж/моль.
Подробный термодинамический анализ данного
процесса приведен в [27, 28]. Углекислый газ явля-
казана зависимость равновесного состава смеси от
ется существенно более мягким окислителем, чем
температуры при начальном стехиометрическом
O2, и суммарный тепловой эффект реакции оста-
соотношении (в качестве уравнения состояния для
ется эндотермическим. Кроме того, использование
участников реакции использовали уравнение Пен-
СО2 позволяет снизить его выбросы в атмосферу
га-Робинсона).
[29], а образующийся СО можно использовать в
Как видно из рисунка, в диапазоне температур
нефтехимических синтезах, например для карбо-
700-900 K происходит существенное изменение
нилирования или синтеза Фишера-Tропша.
равновесного состава системы, причем увеличение
В первом приближении можно учитывать толь-
температуры повышает равновесный выход пропи-
ко две реакции в системе: реакцию окислительного
лена. По этой причине реакцию дегидрирования с
дегидрирования и реакцию водяного газа. Термоди-
использованием СО2 в качестве окислителя следу-
намические расчеты сводятся к нахождению соста-
ет проводить при температуре не ниже 830 K. На
ва, отвечающего минимуму энергии Гиббса систе-
выход пропилена влияет и отношение CO2:пропан.
мы. В среде Matlab были заданы исходные данные
На рис. 3 показаны зависимости конверсии про-
по теплоемкости участников реакции по данным
пана от температуры при различных отношениях
NIST [30]. Затем были рассчитаны мольные эн-
CO2:пропан.
тальпии, энтропии и энергии Гиббса участников
Как видно из рис. 3, наиболее заметное влияние
реакций. Была задана матрица из двух уравнений
на конверсию пропана в практически релевантном
реакции (окислительное дегидрирование и реакция
диапазоне температур (от 800 до 900 K) оказывает
водяного газа; показаны на рис. 2), и произведена
минимизация энергии Гиббса системы как функ-
увеличение отношения CO2:пропан от 1.0 до 5.0,
ция двух химических переменных при заданных
а дальнейшее увеличение этого отношения лишь
начальных количествах участников реакций [31].
незначительно повышает конверсию. По этой при-
Из полученных таким образом значений химиче-
чине реакцию дегидрирования с использованием
ских переменных были рассчитаны равновесные
СО2 в качестве окислителя следует проводить при
мольные доли участников реакций. На рис. 2 по-
отношении CO2 : пропан от 1:1 до 5:1.
НЕФТЕХИМИЯ том 62 № 6 2022
776
МЕЛЬНИКОВ и др.
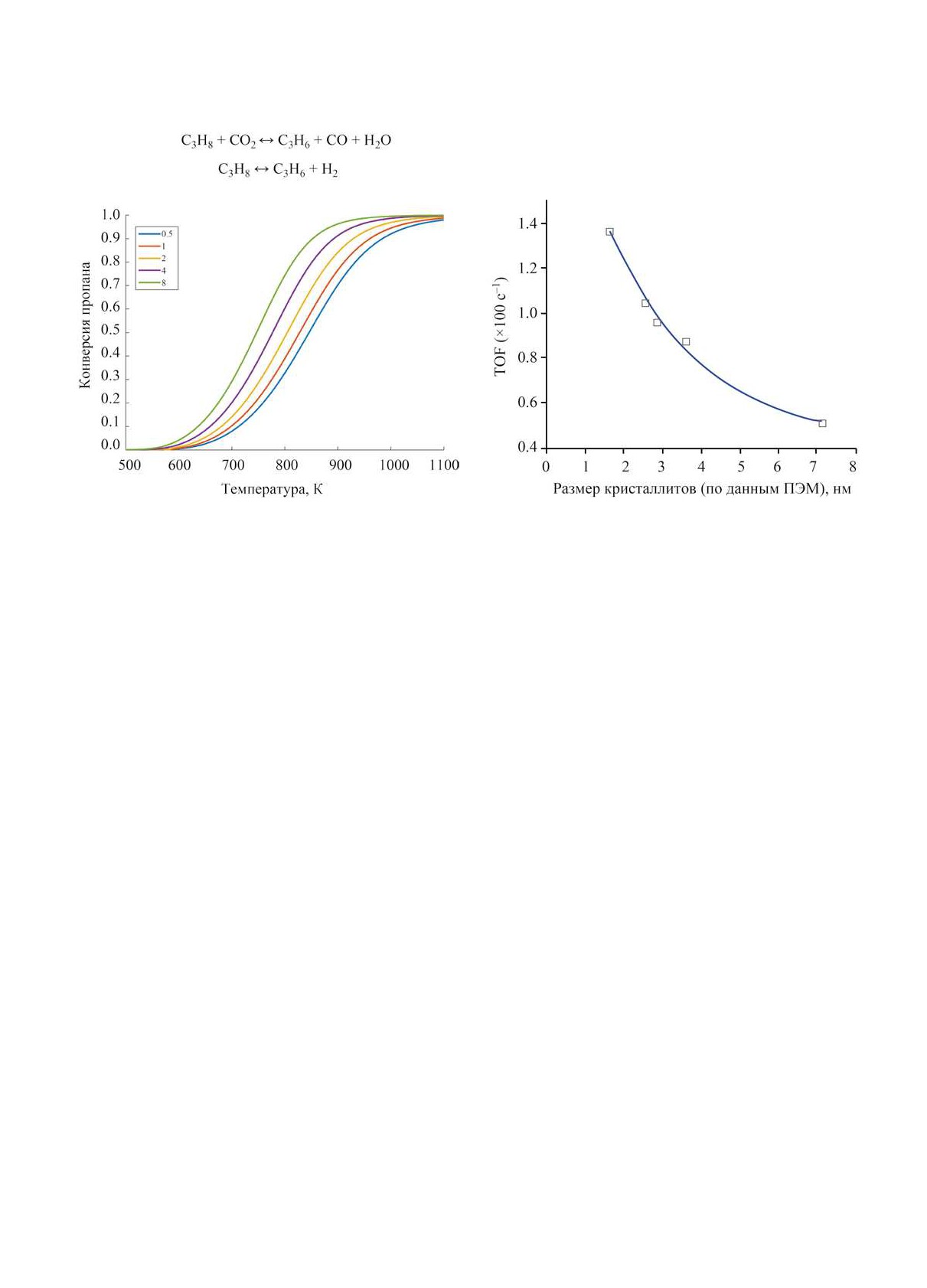
Рис. 3. Зависимость конверсии пропана от температу-
Рис. 4. Зависимость активности катализатора
ры при различном отношении CO2 : пропан (давление
Pt/SBA-15 при гидрогенолизе этана от дисперсности
1.0 бар).
платины при 643 K [35].
Катализаторы термического дегидрирования
образования пропилена линейно зависит от содер-
Каталитически активными в термокаталитиче-
жания платины в биметаллических катализаторах,
ском дегидрировании алканов являются как метал-
т.е. активность в дегидрировании проявляет только
лы (например, платина), так и оксиды переходных
платина. Лимитирующей стадией, по версии авто-
элементов (например, хрома, галлия, ванадия). При
ров, является дегидрирование пропилового ради-
конверсии метана с СО2 образуется исключительно
кала в π-связанный пропилен, адсорбированный
синтез-газ, в то время как при конверсии алканов
на одном атоме платины. Расчеты, проведенные
С2+ может образовываться как синтез-газ, так и со-
по методу функционала плотности, показали, что
ответствующие олефины, в зависимости от катали-
грани Pt(211), хотя и являются важными для акти-
затора.
вации молекул пропана, но катализируют реакции
Катализаторы на основе платины. Платина об-
глубокого дегидрирования и крекинга, в то время
ладает высокой активностью в реакциях разрыва и
как на плоских гранях с меньшей активностью, но
образования C-H-связей; при этом она характери-
с большей селективностью, протекают реакции де-
зуется гораздо меньшей активностью в реакциях
гидрирования [33, 34].
гидрогенолиза C-C-связей, чем другие металлы
Селективность дегидрирования снижается из-за
VIIIб группы. Благодаря указанным свойствам,
гидрогенолиза С-С-связей; простейший пример -
платина является активным компонентом в катали-
заторах риформинга нафты, изомеризации алканов
гидрогенолиз этана. В работе [35] исследована за-
и ароматических углеводородов и др. Катализато-
висимость активности платиновых катализаторов в
ры для ряда промышленных процессов дегидри-
гидрогенолизе этана от дисперсности платины. По-
рования легких алканов также содержат платину
лученные данные, представленные на рис. 4, свиде-
(например, Oleflex и STAR).
тельствуют о том, что реакция является структурно
Механизм дегидрирования пропана на платине
чувствительной и при росте размера кристаллитов
и платино-золотых катализаторах исследован Захт-
платины с 1.7 нм до 7.1 нм активность снижается
лером с соавторами [32]. Установлено, что скорость
более, чем в 2 раза.
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
777
Промышленные платиновые катализаторы деги-
лением хлора позволяет еще больше увеличить
дрирования, как правило, промотированы оловом.
конверсию пропана при аналогичных значениях
Присутствие олова в качестве промотора облегчает
селективности (селективность по пропилену 95%
удаление кокса с активных платиновых центров и
при конверсии 58%) [52]. В дегидрировании этана
стабилизирует каталитическую активность в тече-
аналогичные катализаторы хотя и проявили высо-
ние более длительного времени. Установлено, что
кую селективность, но данные по ним приведены
влияние олова на платину в биметаллическом ка-
только при очень низких конверсиях - менее 10%
тализаторе зависит от носителя [36-38]. На Al2O3
[53]. Биметаллические Pt-In-катализаторы на ги-
олово взаимодействует с носителем и заряжается
дротальците проявили высокую селективность как
положительно, стабилизируя платину в высокодис-
в дегидрировании пропана, так и этана [54]. Ис-
персном состоянии, но не влияя на ее активность.
следованы и Pt-Sn-катализаторы на мезопористом
На поверхности SiO2 олово находится в нуль-ва-
SiO2 типа KIT-6 - они сохраняли активность в тече-
ние 5 ч, при этом селективность по пропилену со-
лентном состоянии, образуя сплав с платиной, что
ставила ~ 65-70% при конверсии пропана 30-35%
сопровождается снижением активности. Олово
[55].
снижает средний размер платиновых центров. При
этом электронная плотность «перетекает» на Sn,
Галлий также исследован в качестве промо-
формируя электроннодефицитные состояния на Pt.
тора к платине [56, 57]. Например, катализатор
Олово также снижает энергию адсорбции пропиле-
Pt-Ga/SiO2 проявил селективность по пропилену
на, что приводит к увеличению активности и сни-
выше 99%, однако быстро дезактивировался со
жению образования кокса и стабилизирует высо-
временем [56]. Авторы связывают промотирующее
кодисперсное состояние платины во время циклов
действие с формированием изолированных «одно-
дегидрирования-регенерации за счет сегрегации
атомных» центров Pt1 в инертной матрице галлия.
металлов в процессе окислительной регенерации.
Для дальнейшего повышения селективности ука-
Тем не менее, после многократных циклов деги-
занная система была промотирована оловом. Ката-
дрирования-регенерации биметаллические актив-
лизатор PtGa-Pb/SiO2 проявил не только высокую
ные центры постепенно обогащаются оловом и их
селективность (99.6% при конверсии пропана 30%),
но и сохранял указанные показатели в течение 96 ч.
активность снижается. Квантово-химические рас-
Дальнейшее добавление кальция к данной системе
четы также показали снижение энергии адсорбции
привело к существенному росту стабильности ка-
пропилена и увеличение энергии активации реак-
тализатора - новый катализатор работал стабильно
ции дегидрирования пропана, что приводит к росту
в течение 30 суток при температуре 600°C [58]. Ав-
селективности по пропилену [39].
торы связывают промотирующее действие свинца
Часто в качестве промотора катализаторов де-
блокировкой платиновых центров Pt3, а кальция -
гидрирования добавляют щелочные металлы, ко-
смещением электронной плотности к одноатом-
торые увеличивают дисперсность платины, пода-
ным платиновым центрам. Установлено также, что
вляют гидрогенолиз и, следовательно, образование
оксид галлия в Pt/Ga2O3/Al2O3-катализаторе сни-
кокса, а также блокируют кислотные центры носи-
жает вероятность окисления платины до летучего
телей [40-47].
оксида PtO2 [59].
Добавление церия к Pt-Sn-системе позволяет
На катализаторах GaxPt/SiO2, полученных пу-
не только достичь высокой конверсии и селектив-
тем восстановления биметаллического металлоо-
ности (селективность более 98% при конверсии >
рганического комплекса, селективность по пропи-
38%), но и снизить отложения кокса на катализа-
лену составляет более 99% при конверсии пропана
торе [48].
31.9% [60]. При этом формирующиеся биметалли-
Ряд исследований посвящен Pt-катализаторам
ческие наночастицы обладают размером ~1 нм. В
дегидрирования, промотированным оловом, нане-
работе [61] предложена система Pt-Ga-K/Al2O3,
сенным на аморфные алюмосиликаты, цеолиты и
проявившая селективность по пропилену на уров-
SAPO-34, а также мезопористый оксид кремния
не 91% при конверсии пропана ~32%. Авторы по-
[49-51]. Замена Al2O3 на гидротальцит с нанесе-
лагают, что собственно за дегидрирование отвечает
нием платины из раствора HCl с дальнейшим уда-
Ga, а платина выступает в роли промотора.
НЕФТЕХИМИЯ том 62 № 6 2022
778
МЕЛЬНИКОВ и др.
Таблица 1. Свойства некоторых катализаторов дегидрирования на основе платины
Катализатор
0.44% Pt/Al2O3
519
3.3
C3H8
-
85-87
0.6
5
[36]
0.35% Pt-1.26% Sn/Al2O3
519
3.3
C3H8
-
95-98
0.6
5
[36]
0.5% Pt-1.5% Sn/Al2O3
590
-
C3H8
25-30
80-95
-
6
[38]
0.93% Pt-0.51% Sn-0.5 K/Al2O3
400
7.4
изо-C4H8
3.4
96.9
3.0×10-2
0.5
[40]
0.3%Pt-0.9 Sn/1.1% Ce/Al2O3
576
-
C3H8
45-47
85-95
-
2.5
[48]
0.48%Pt-0.93 Sn/ Al2O3-SAPO-34
590
2.79
C3H8
40
83
-
8
[49]
Pt-Sn/SBA-15
520
47
C3H8
16
99
0.157
3.5
[51]
PtGa-Pb/SiO2
600
30.7
C3H8
30
99.6
-
96
[56]
0.5%Pt-1%Na/Sn-ZSM-5
590
3.0
C3H8
39
98
-
9
[63]
0.5%Pt/2.6%Zn-Beta
555
2.6
C3H8
29
>90
-
63
[64]
a Массовая скорость подачи сырья.
В работе [62] предложен оригинальный метод
пропилену на уровне 94%. При этом конверсия
приготовления катализаторов дегидрирования пу-
пропана на данном катализаторе снижалась с 27.5
тем пиролиза железосодержащих металлоргани-
до 12.6% в течение 7 ч.
ческих каркасных структур (MOF). При пиролизе
Свойства некоторых платиновых катализаторов
MOF сначала образуются оксиды и карбиды желе-
дегидрирования алканов приведены в табл. 1.
за, которые в процессе работы катализатора восста-
Одной из ключевых проблем при дегидрирова-
навливаются до металаа; однако селективность по
нии алканов является накопление кокса на катали-
пропилену на указанных катализаторах не превы-
заторе. Авторы [66] выделили три типа кокса на
шает 90%.
поверхности платиновых катализаторов дегидри-
Исследованы и катализаторы на основе це-
рования: 1) на активных металлических центрах и
олитов. В работе
[63] предложены системы
в их окрестности; 2) низкографитированный кокс
Pt-Na/HZSM-5, Pt-Sn-Na/HZSM-5 и Pt-Na/Sn-ZSM-5.
на носителе; 3) графитоподобный кокс на носите-
Последний образец проявил более высокие актив-
ле. При этом за дезактивацию катализатора отве-
ность и селективность по пропилену (на уровне
чает только малая часть образующегося кокса. В
98%). Катализатор без добавления олова оказался
другой работе различают «обратимый» (удаляе-
не только наименее селективным, но и наименее
мый водородом) и «необратимый» кокс на поверх-
активным. Платино-цинковые катализаторы на ос-
ности катализаторов [67]. Более детальный анализ
нове цеолитов ZSM-5, ZSM-11 и Beta исследованы
углеродистых отложений с применением ряда фи-
в [64]. Наиболее активным и стабильным оказался
зико-химических методов проведен в [68]; авторы
0.5% Pt/Zn-Beta, при этом селективность находи-
идентифицировали три вида кокса - алифатиче-
лась на уровне ~ 90%.
ский, ароматический и «предграфитовый», при
Среди платиновых катализаторов на основе ме-
этом алифатический кокс переходит в ароматиче-
ский с увеличением глубины дегидрирования.
зопористого диоксида кремния можно отметить
промотированные катализаторы на носителе типа
Очень хорошие результаты были получены на
SBA-15 [65]. Наилучшим оказался катализатор
платиновых катализаторах, нанесенных на сме-
0.5% Pt-Sn-Na/Al-SBA-15 с селективностью по
шанные оксидные системы [69]. На лучшем из
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
779
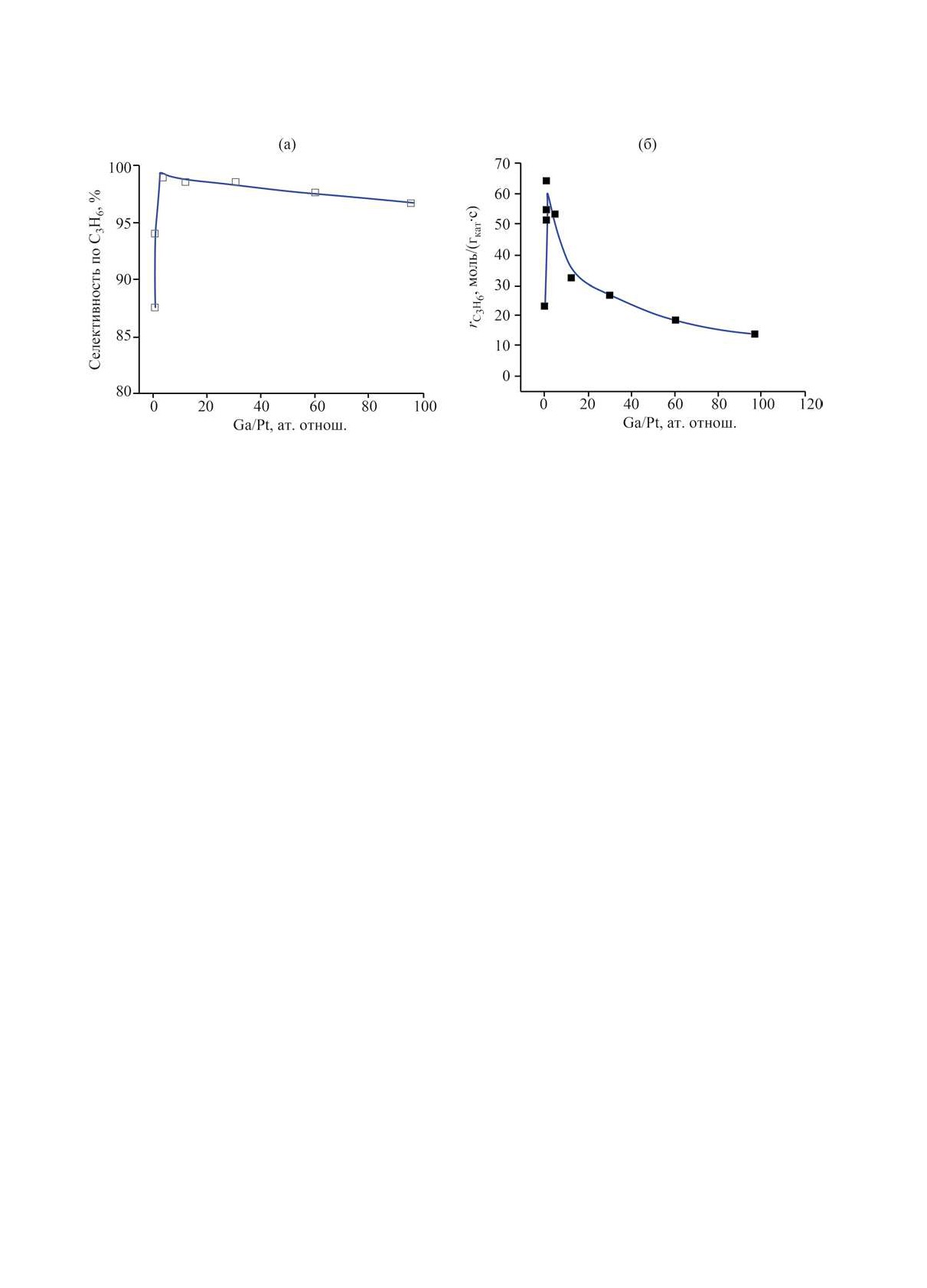
Рис. 5. Зависимость активности катализатора дегидрирования пропана (а) и селективности по пропилену (б) от атомного
соотношения Ga/Pt (катализатор Pt/Mg(Ga)(Al)O [69]).
синтезированных образцов селективность как по
оксидов хрома с различной степенью окисления,
этилену, так и по пропилену превышала 99% при
при этом оксиды находятся в аморфном состоянии.
конверсиях этана и пропана 28.4 и 52.9% соответ-
В циклах «реакции-регенерации» степени окисле-
ственно. Интересно отметить, что активность ката-
ния хрома в катализаторах меняются, при этом уве-
лизатора проходит через максимум в зависимости
личение плотности поверхностных Льюисовских
от атомного отношения Ga/Pt, а селективность вы-
кислотных центров на носителе приводит к агреги-
ходит практически на стационарное значение, как
рованию нанесенных оксидов.
это представлено на рис. 5.
Вопрос о том, какая степень окисления хрома
Катализаторы на основе оксидов переходных
является активной в реакциях дегидрирования,
металлов. Наряду с металлами, каталитическую
остается открытым. Например, авторы [72] связы-
активность в дегидрировании алканов демон-
вают каталитическую активность с Cr2+, а [74, 88] -
стрируют и многие оксиды: хрома [70-75], галлия
с Cr3+. Основным механизмом дезактивации яв-
[76-80], ванадия [81, 82], молибдена [83-87]. В
ляется спекание Cr3+Ox-компонентов с частичной
промышленности применение нашли катализато-
диффузией ионов хрома в носитель [73, 74, 89].
ры на основе оксида хрома (процессы CATOFIN и
Алюмохромовые катализаторы также промо-
CATADIENE).
тируют щелочными металлами. В работе [90-92]
Впервые об активности оксидов хрома в реак-
исследовано влияние промотирования калием на
циях дегидрирования сообщается в работе [70].
свойства CrOx/Al2O3-катализаторов. Авторы по-
Вскоре после этого были созданы первые промыш-
казали, что при небольшом содержании калия (до
ленные установки дегидрирования алканов, в то
2%), он преимущественно взаимодействует с носи-
время предназначенные для получения изобутиле-
телем и влияет на дисперсность Cr3+Ox, в то время
на (для производства высокооктановых компонен-
как при более высоких концентрациях взаимодей-
тов бензина) и бутадиена (для производства синте-
ствует с оксидами хрома.
тических каучуков).
Исследованы и CrOx-катализаторы, нанесенные
В работе [74] исследовано влияние полиморф-
на мезопористый диоксид кремния типа SBA-15
ных модификаций оксида алюминия на свойства
[93]. Лучший из предложенных катализаторов про-
хромовых катализаторов. Авторы установили, что
явил селективность по этилену на уровне ~ 91%
тип оксида алюминия не влияет на распределение
при конверсии этана ~ 34% в термокаталитиче-
НЕФТЕХИМИЯ том 62 № 6 2022
780
МЕЛЬНИКОВ и др.
Таблица 2.Свойства некоторых катализаторов дегидрирования на основе оксидов переходных металлов
Катализатор
15%Cr/Al2O3
580
4.0
C3H8
15
97
1
[73]
CrOx/Al2O3
570
15-30
изо-
34-37
93-95
-
[74]
C4H10
20%Cr-1%Na/Al2O3
550
0.08
C3H8
47-37
80-88
6
[99]
4%CrOx/ZrO2
550
0.2
C3H8
60.9-24.3
76.2-87.0
6
[100]
Ga2O3/SiO2
550
7.2
C3H8
12.6
76
1.5
[76]
Ga8Al2O15
500
-
C3H8
49.7
91.7
8
[77]
Ga-MCM-41
550
1
изо-
19.7
70
3
[78]
C4H10
5%V/MCM-41
550
0.94
C3H8
17-29
90-95
25
[81]
13%Mo-2.9%Mg/Al2O3
560
2
н-C4H10
~10
~81
-
[83]
a МСПС - массовая скорость подачи сырья.
ском дегидрировании. Добавление церия к системе
ность по сумме бутенов была на уровне ~ 90% по-
привело к снижению селективности в термоката-
сле первых двух минут работы катализатора.
литическом дегидрировании, но к увеличению в
Другими активными в дегидрировании алканов
окислительном - до 96.4% при 48.4%-й конверсии
оксидами являются оксиды ванадия [97, 98], одна-
этана. Свойства некоторых оксидных катализато-
ко они нашли более широкое применение в реакци-
ров дегидрирования алканов приведены в табл. 2.
ях окислительного дегидрирования.
Важным недостатком хромовых катализаторов
является высокая токсичность Cr(VI) [94, 95].
Катализаторы окислительного дегидрирования
Наряду с CrOx, каталитической активностью в
Традиционные для термокаталитического деги-
дегидрировании алканов обладают также оксиды
дрирования платиновые катализаторы были иссле-
и других переходных металлов, например, Ga2O3
дованы и в реакциях окислительного дегидрирова-
[76-80]. Интересные результаты получены на ката-
лизаторах, синтезированных из металлоорганиче-
ния в присутствии CO2, однако их эффективность
оказалась недостаточной. Например, в работе [101]
ских комплексов. Например, при разложении гал-
лиевого металлоорганического комплекса на SiO2,
в дегидрировании этана были исследованы катали-
был получен катализатор, проявивший селектив-
заторы на основе Mo2C, а также Pt/Al2O3, Pt/CeO2,
ность по пропилену на уровне 93%, однако данные
PtCo/CeO2. Авторы установили, что на платиновых
получены только при низких конверсиях пропана -
катализаторах протекала в основном углекислот-
6.5-9.3% [96].
ная конверсия этана в синтез-газ, в то время как на
карбидных катализаторах в основном протекало
Оксиды молибдена также активны в дегидриро-
вании алканов. Например, в работе [83] в качестве
окислительное дегидрирование (однако конверсия
катализаторов дегидрирования н-бутана испытаны
этана при этом не превышала 4%). При дегидри-
Mox/Al2O3 и MoxMg/Al2O3. Активность катали-
ровании пропана с использованием CO2 на Pt-,
заторов Mox/Al2O3 заметно снижалась уже после
Ni-, Ni-Pt-, Ni-Fe- и Fe-Pt-системах, нанесенных
нескольких минут работы. Системы MoxMg/Al2O3
на CeO2, также в основном протекала конверсия в
оказались заметно стабильнее, при этом селектив-
синтез-газ [102]. Аналогичные результаты полу-
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
781
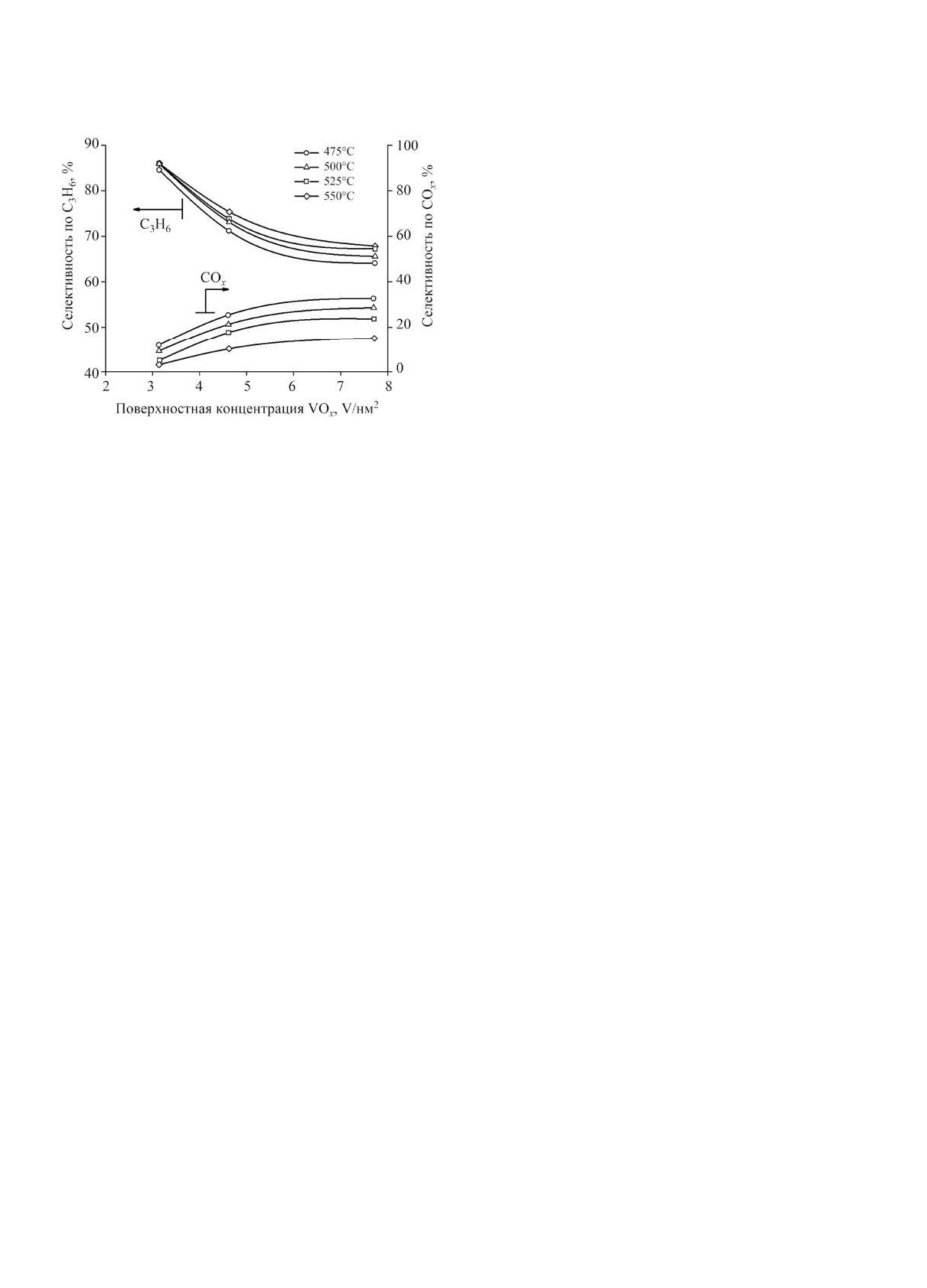
импульсов пропана в реактор с кипящим слоем
катализатора, авторы установили, что с ростом
поверхностной концентрации VOx селективность
по пропилену снижается, а по COx растет, как это
представлено на рис. 6. Для катализатора с 10%-
ным содержанием ванадия селективность по про-
пилену составляла ~ 65% при конверсии пропана ~
15%. Добавление оксида кальция в носитель увели-
чивает селективность по пропилену; для лучшего
катализатора она достигает 96% [114].
При нанесении VOx на MCM-41 наблюдаются
закономерности, схожие с закономерностями на
оксиде алюминия, при этом селективность в деги-
дрировании пропана сильно зависит от окислителя
Рис. 6. Зависимость селективности по пропилену и
[115] и находится на уровне 80-90% при использо-
при дегидрировании пропана от поверхностной
COx
вании N2O, и на уровне 50-80% при использовании
концентрации VOx для катализаторов VOx/Al2O3 [113].
O2. Однако при нанесении VOx на MgO по мере
роста содержания оксидов ванадия образование
поливанадатов не наблюдается [116], вместо это-
чены в работе [103]. Приемлемую селективность
го образуется Mg3(VO4)2. К сожалению, селектив-
(более 80%) в окислительном дегидрировании эта-
ность по пропилену для указанных катализаторов
на с CO2 на платине удалось получить только при
при использовании в качестве окислителя O2 нахо-
использовании в качестве носителя мезопористо-
дилась на уровне 50-60% при конверсии пропана
го цеолита [104]. В дегидрировании пропана на
~ 10%. Свойства катализаторов VOx/SiO2 в окисли-
Pt/Al2O3 с использованием кислорода в качестве
тельном дегидрировании этана сильно зависят от
окислителя селективность по пропилену не превы-
содержания оксида ванадия - наибольшая селек-
шала 30% [105].
тивность (42%) была достигнута на образце с низ-
ким содержанием V2O5, при этом конверсия этана
Таким образом, в окислительном дегидрирова-
составляла всего 14% [117]. В работе [118] прове-
нии алканов более перспективными оказались ка-
дено сравнение катализаторов на основе V2O5, на-
тализаторы на основе оксидов переходных метал-
несенных на различные оксиды (Al2O3, TiO2, ZrO2
лов [106, 107]. Окислительное дегидрирование на
и MgO), в окислительном дегидрировании пропа-
них протекает по механизму Марса-ван-Кревелена
на. Наибольшую активность проявил катализатор
[108-111] с чередованием циклов восстановления и
V2O5/TiO2 (0.101 с-1), а наибольшую селектив-
окисления активных центров. На примере пропана,
ность - V2O5/Al2O3 (39.8% при конверсии пропана
реакция может быть записана следующим образом:
20.3%). Кроме того, в данной работе исследовано
C3H8 + MeOx → C3H6 + H2O + MeOx-1,
(1)
промотирующее действие щелочных металлов на
V2O5/Al2O3. Щелочные металлы снижают актив-
MeOx-1 + 0.5 O2 → MeOx.
(2)
ность катализатора в ряду Li > Na > K. В плане
Многие катализаторы окислительного деги-
увеличения селективности наиболее эффективным
дрирования содержат оксиды ванадия [112]. Уста-
оказался калий, как это представлено на рис. 7.
новлено, что при росте содержания ванадия с 5 до
В работе [119] были исследованы ванадиевые ка-
10% на катализаторах VOx/Al2O3 монованадаты
тализаторы, нанесенные на SiO2, Al2O3, TiO2, MgO,
переходят в поливанадаты [113]. При этом с уве-
La2O3, Sm2O3 и Bi2O3; наибольшую селективность
личением содержания ванадия общая кислотность
по пропилену продемонстрировал катализатор на
носителя снижается по сравнению с кислотностью
Bi2O3. В качестве носителя ванадиевых катализато-
изначального Al2O3 с одновременным ростом доли
ров исследован и мезопористый диоксид кремния
бренстедовских кислотных центров. При подаче
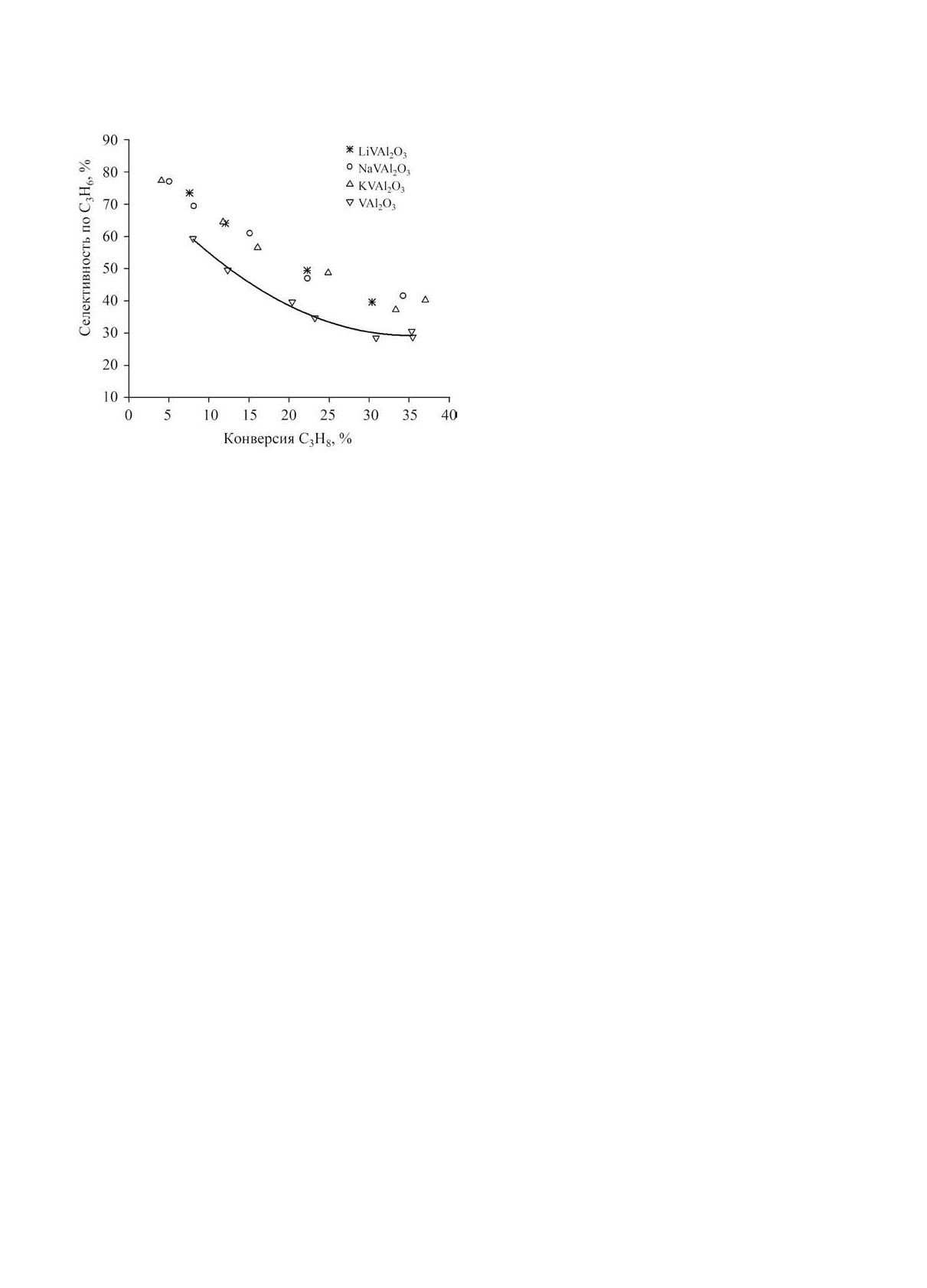
KIT-6 [120]. Наибольшая селективность по сумме
НЕФТЕХИМИЯ том 62 № 6 2022
782
МЕЛЬНИКОВ и др.
лучшие результаты были достигнуты на системе
Mo0.73V0.18Nb0.09 - 10%-ная конверсия при 100%-ной
селективности по этилену (286°C).
В работе [125] предложена еще более сложная
оксидная композиция - Mo-Te-NbO. испытан-
ная в области высоких конверсий - при конвер-
сии этана 88.5% селективность составила 80.8%.
Схожие результаты достигнуты в [126, 127]. Си-
стема Mo-V-Nb-TeOx, нанесенная на CeO2, про-
являет гораздо большую активность
(0.69 кг
C2H4/(кг кат·ч)), чем без носителя
(0.34 кг
C2H4/(кг кат·ч)) [128]. Авторы связывают дан-
ный эффект с облегчением перехода между
V4+ и V5+ в присутствии Ce4+. Промотирование
Mo-V-Te-NbO-системы висмутом увеличивает
селективность по этилену и снижает образование
Рис. 7. Зависимость селективности по пропилену при
кокса [129, 130]. Катализатор Mo-V-SbO отлича-
дегидрировании пропана для катализаторов на основе
V2O5/Al2O3, промотированных щелочными металлами
ется меньшей селективностью по этилену (81.5%
[118].
при конверсии этана 64.6%), но при этом высокой
производительностью - 0.193 кг C2H4/(кг кат·ч)
[131]. Очень высокие показатели были достигнуты
на катализаторе Mo-V0.31-Te0.2-Nb0.14 - селектив-
олефинов C2-C3 при дегидрировании пропана с
ность по этилену 87% при конверсии этана 90%
кислородом была достигнута на образце с содер-
при производительности 0.176 кг C2H4/(кг кат·ч)
жанием ванадия 5% - 70.2% при конверсии 47.6%.
[132]. Подробно сложные оксидные системы в де-
Фосфат ванадия VOPO4 был исследован в каче-
гидрировании этана рассмотрены в обзоре [133].
стве катализатора и как индивидуальное соедине-
Исследованы в окислительном дегидрировании
ние, и в качестве компонента, нанесенного на TiO2
и катализаторы на основе CrOx [134-140]. В рабо-
[121]. Оксид титана увеличивает как активность,
те [139] исследовано влияние носителя на свойства
так и селективность, при этом оптимальные ре-
CrOx-катализаторов в углекислотном дегидрирова-
зультаты были достигнуты в случае монослойно-
нии этана. Наибольшую селективность (выше 90%)
го покрытия - селективность на уровне ~ 60% при
проявили CrOx/γ-Al2O3 и CrOx/ZrO2, при этом если
конверсии этана не более 20%.
на первом катализаторе реакция протекала как тер-
Наряду с ванадием, активность в окислитель-
мокаталитическое дегидрирование, сопряженное с
ном дегидрировании проявляют и оксиды мо-
обратной реакцией водяного газа, то на втором -
либдена [122, 123]. Например, в окислительном
как обычное окислительное дегидрирование. В ка-
дегидрировании этана селективность по этилену
честве промоторов к Cr2O3/ZrO2 исследованы Ni,
составляет 74.0% при конверсии 11.8% при 600°C.
Fe, Co, Mn [140]. Все промоторы, кроме Ni, суще-
Существенный синергетический эффект наблюда-
ственно увеличивали селективность по этилену в
ется при совместном применении оксидов Mo и V
углекислотном дегидрировании этана - до 80-98%
[124]. Если на оксиде молибдена конверсия этана
в зависимости от конверсии. На промотирован-
в окислительном дегидрировании достигала 10%
ном никелем катализаторе основными продуктами
при температуре 562°C, а селективность по этиле-
были CH4 и CO2.
ну при этом составляла 59%, то та же конверсия на
В качестве активного компонента катализато-
Mo0.8V0.2 была достигнута при 540°C, а селектив-
ров окислительного дегидрирования может высту-
ность по этилену составила 100%. Авторы также
пать и Ga2O3 [141-143]. В работе [141] приведены
исследовали в качестве промоторов для оксидных
результаты по углекислотному дегидрированию
Mo-V-систем Nb, Ti, Mn, Ta, Fe, Si, Cu, W, Pb. Наи-
этана на различных оксидах переходных элемен-
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
783
тов. Самый высокий выход этилена (18.6%) был
Катализаторы VOx/SBA-15 предложены в [151]:
достигнут на Ga2O3, который превзошел Cr2O3
с увеличением загрузки VOx активность монотон-
(11.4%) и V2O5 (9.5%). Сравнение Ga2O3-катализа-
но возрастает, а селективность монотонно снижа-
торов, нанесенных на различные носители, показа-
ется. Но даже для наиболее селективного образца
ло, что наибольшая селективность в дегидрирова-
высокая селективность по пропилену (87%) на-
нии пропана наблюдается на Ga2O3/SBA-15 - 90%
блюдалась лишь при ничтожно малой конверсии
при конверсии 32% (после 20 ч работы) [142]. Ка-
(0.5%). Катализаторы CrOx/MCM-41 предложены в
тализаторы Ga2O3/HZSM-5, исследованные в [144],
[156], селективность по пропилену лучшего из них
работали стабильно в течение 70 ч в дегидрирова-
составила ~ 80% при конверсии ~ 60%. Предложе-
нии этана, при этом селективность находилась на
ны и CrOx/Ce-MCM-41 системы: в углекислотном
уровне 90%.
дегидрировании этана селективность превышала
Катализаторы на основе оксидов переходных
90% при конверсии ~ 60% [157]. Еще одним мезо-
металлов идеально подходят для развития техно-
пористым SiO2 является MSU-x, оксиднохромовые
логии циклического дегидрирования
(«chemical
катализаторы на основе которого исследованы в
looping dehydrogenation»), при которой дегидри-
[158]. Лучший из них проявил селективность по
рование осуществляется в реакторе за счет кис-
этилену 92.1% при конверсии этана 58.0%.
лорода из кристаллической решетки активного
Наряду с мезопористыми SiO2, интерес в каче-
компонента катализатора, регенерация которого
стве компонентов катализаторов представляют и
проводится в отдельном аппарате окислением кис-
цеолиты [159-164]. Например, широко распростра-
лородом воздуха [145-147]. Данный подход по-
ненный цеолит ZSM-5 использован в качестве ком-
зволяет проводить окислительное дегидрирование
понента хромовых катализаторов углекислотного
углеводородов кислородом без предварительного
дегидрирования этана [165]. В указанной работе
энергоемкого разделения воздуха. Перспективны-
CrOx-катализаторы были синтезированы на основе
ми для данного процесса являются катализаторы
как ZSM-5, так и Na-ZSM-5. Катализаторы, осно-
на основе марганца. Например, на катализаторе
ванные на натриевой форме цеолита, оказались бо-
Na-W/Mn/MgO была достигнута селективность по
лее селективными - для лучшего из них селектив-
этилену 86% при конверсии этана 64% [145]. Из ко-
ность составила 81.8% при конверсии этана ~ 49%
бальт-молибденовых систем наилучшие показате-
(после 6 ч работы). Катализаторы окислительного
ли были получены на Co0.3-Mo0.7/Fe2O3 - селектив-
дегидрирования пропана на ZSM-5 исследованы в
ность по этилену 90,8% при конверсии этана 49.%
[166]. Селективность лучшего катализатора соста-
[148]. В дегидрировании пропана на VOx/TiO2-
вила ~ 93% при конверсии пропана ~ 25%.
системах с содержанием V не более 1 мас. % селек-
тивность по пропилену составляла не менее 90%,
Свойства некоторых катализаторов окислитель-
однако конверсия пропана при этом не превышала
ного дегидрирования алканов приведены в табл. 3.
15% [149].
Интерес в качестве носителей катализаторов
Промышленные технологии дегидрирования
представляют мезопористные иерархические ма-
пропана
териалы типа SBA-1, SBA-15, MCM-41 [150-155].
В настоящее время распространение в промыш-
Например, в работе [150] исследовано влияние за-
ленности получили лишь несколько технологий,
грузки CrOx на свойства катализаторов CrOx/SBA-1
причем только в одной из них частично реализова-
в углекислотном дегидрировании пропана. Наибо-
ны принципы окислительного дегидрирования.
лее селективным (92.7%) и в то же время наиболее
активным (6.4×10-3 моль С3Н8/(г Cr·с)) оказался
Технология Snamprogetti/Ярсинтез. Одной из
катализатор с минимальным содержанием оксидов
первых технологий, нашедшей применение в про-
хрома (1 мас. %). Катализатор Cr-Ce/SBA-15 проя-
мышленности, является технология, разработанная
вил более высокую селективность в углекислотном
совместно Snamprogetti и Ярсинтезом и предназна-
дегидрировании этана (селективность по этилену
ченная для дегидрирования изобутана. Изначально
96% при конверсии этана 55%), чем Cr/SBA-15
технология была разработана на базе алюмохро-
(95.5% при конверсии 39.6%) [93].
мового катализатора, но в настоящее время все
НЕФТЕХИМИЯ том 62 № 6 2022
784
МЕЛЬНИКОВ и др.
Таблица 3. Свойства некоторых катализаторов окислительного дегидрирования
Температура
Конверсия,
Селективность,
Катализатор
Окислитель
МСПСa, ч-1
Сырье
Ссылка
реакции, °С
%
%
VOx/MCM-41
500
O2
-
C3H8
~7
63
[115]
VOx/MCM-41
500
N2O
-
C3H8
~7
82
[115]
15% V2O5/MgO
500
O2
187.5
C3H8
10.2
52
[116]
9.8% V2O5/SiO2
527
O2
-
C2H4
16
44
[117]
V2O5-K/Al2O3
500
O2
-
C3H8
16.9
57.2
[118]
VOx/KIT-6
600
O2
4.5
C3H8
55
64.7
[120]
6.8% Cr/MCM-41
500
CO2
1.1
C3H8
21
90
[156]
Cr/Ce-MCM-41
700
CO2
-
C2H6
64
96.8
[157]
Cr2O3/ZrO2
600
CO2
-
C2H6
77.47
46.34
[140]
a Массовая скорость подачи сырья по газу.
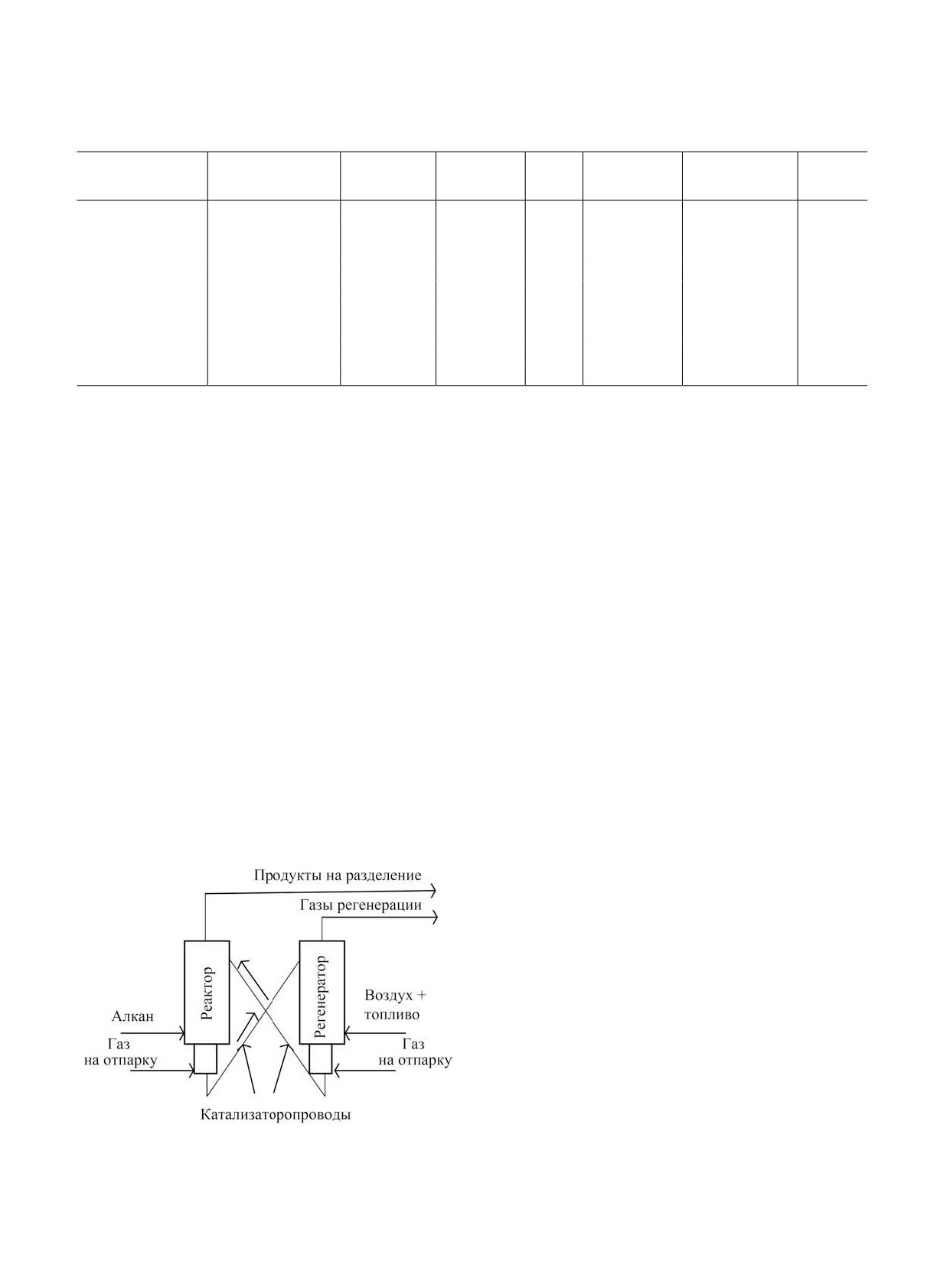
существующие установки используют Pt-Sn-ка-
в 4-8 параллельных реакторах с неподвижным сло-
тализаторы. Принципиальная схема данного про-
ем катализатора при температуре около 565-50°C
цесса представлена на рис. 8. Процесс проводят
[167]. Процесс проводят под вакуумом - при давле-
в кипящем слоем катализатора при температурах
нии 0.2-0.5 бар. Каждый реактор работает в перио-
550-600°C и давлении 1.2-1.5 бар. Регенерация
дическом режиме с чередованием циклов (в скобах
осуществляется непрерывным образом. Так как те-
указана типичная продолжительность цикла):
плоты регенерации недостаточно для проведения
- дегидрирование под вакуумом (12 мин);
процесса в регенератор подводят топливный газ.
- продувка паром (3 мин);
Технология CATOFIN. Эта технология компании
- регенерация воздухом (12 мин);
Lummus, представленная на рис. 9, была разрабо-
- вакуумирование реактора (3 мин);
тана на основе более ранней технологии производ-
ства бутадиена из н-бутана - CATADIENE. Основой
- восстановление катализатора водородом.
технологии является алюмохромовый катализатор
При этом циклы работы реакторов синхронизи-
(18-20% CrOx), промотированный щелочными ме-
рованы таким образом, что установка работает в
таллами (1-2 мас. %) [13]. Процесс осуществляется
целом в непрерывном режиме. Основным источни-
ком тепла для реакции является теплота сгорания
кокса, выделяемая при регенерации катализатора,
однако, в случае необходимости, вместе с возду-
хом может быть осуществлена подача топливно-
го газа. Для запасания энергии, выделяемой при
регенерации, катализатор загружается вместе со
специальным теплоносителем, эффективно ак-
кумулирующим теплоту. Стадия восстановления
регенерированного катализатора водородом необ-
ходима для увеличения активности катализатора.
Срок службы катализатора составляет 2-3 года. Ос-
новной причиной его дезактивации является спека-
ние оксида алюминия, сопряженное со снижением
удельной поверхности.
Технология Oleflex. Одной из самых распростра-
ненных в промышленности технологий дегидриро-
Рис. 8. Технология Snamprogetti/Ярсинтез [16].
вания пропана является Oleflex, представленная на
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
785
Рис. 9. Схема технологии CATOFIN [2].
Рис. 10. Схема технологии UOP Oleflex [2].
рис. 10 и основанная на широко распространенной
катализатора составляет 1-3 года; при этом свежий
технологии каталитического риформинга нафты
катализатор в систему подается непрерывно и по-
компании UOP. В качестве катализатора исполь-
стоянно отводится катализаторная пыль, образую-
зуется Pt/Sn/Al2O3 система, промотированная ще-
щаяся в движущемся слое.
лочными металлами (содержание Pt - менее 1%,
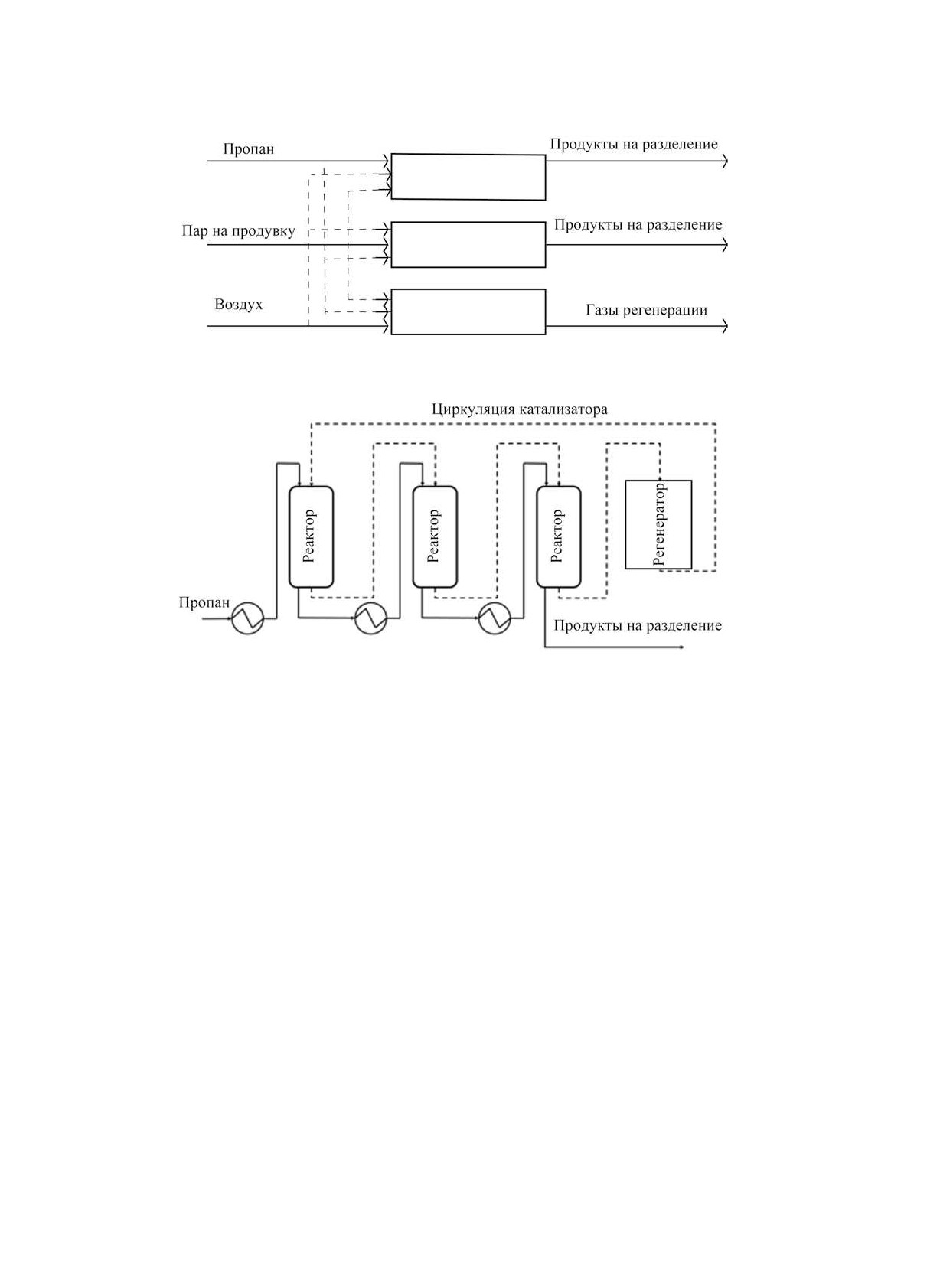
Технология STAR. Технология STAR (STeam
Sn - 2%, до 1% щелочных металлов) [13]. Процесс
Active Reforming) была изначально разработана
проводят в последовательно расположенных реак-
компанией Phillips, а затем усовершенствована ком-
торах (3-4 шт.) с движущимся слоем катализатора
панией Uhde. Технология основана на Pt-Sn-ката-
при температурах 580-650°C и давлении 2-3 бар.
лизаторе на цинк-кальциевом алюминате. Процесс
Между реакторами к технологическому потоку
проводят в двух последовательных реакторах с не-
подводится дополнительное количество теплоты.
подвижным слоем катализатора при температурах
Регенерацию катализатора осуществляют непре-
570-590°C и давлении около 5 бар. Перед подачей
рывно за счет подачи воздуха. После регенерации
сырья в первый реактор в углеводородное сырье
катализатор подвергают хлорированию для под-
добавляют водяной пар, который снижает парци-
держания дисперсности платины. Перед подачей
альное давление углеводородов и удаляет кокс. В
в первый по ходу движения технологического по-
технологический поток на выходе из первого ре-
тока реактор, регенерированный катализатор под-
актора подают кислород для селективного сжига-
вергают восстановлению водородом. Срок службы
ния водорода во втором реакторе, как показано на
НЕФТЕХИМИЯ том 62 № 6 2022
786
МЕЛЬНИКОВ и др.
Рис. 11. Схема технологии Uhde STAR [2].
Рис. 12. Схема технологии Linde PDH/BASF [13].
рис. 11. Данный прием не только подводит допол-
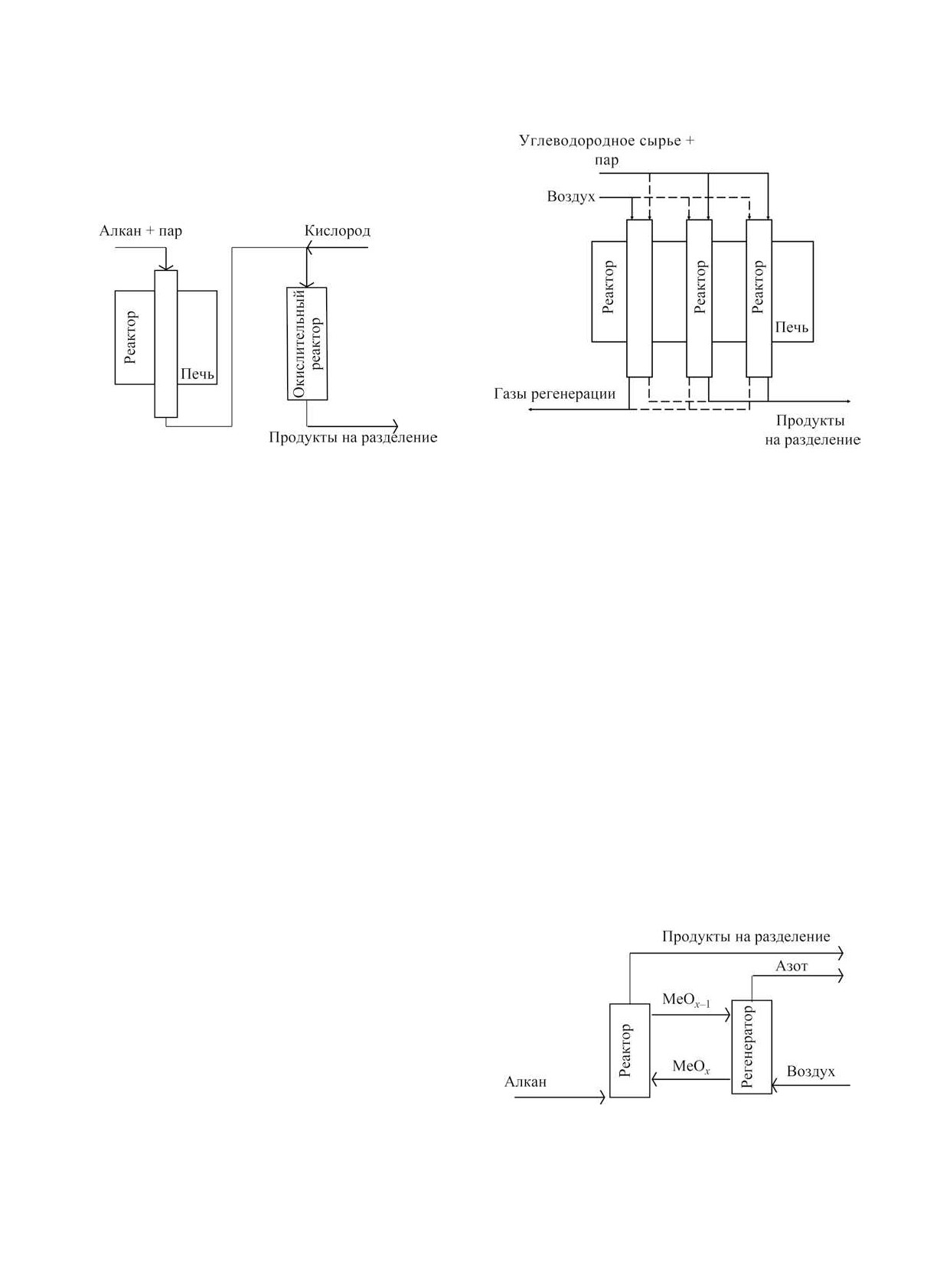
представлена на рис. 13. Процесс дегидрирования
нительное тепло в систему, но и смещает равно-
проводят в реакторе, в котором катализатор в вы-
весие в сторону образования целевого продукта.
сокой степени окисления контактирует с алканом
Подача пара и селективное окисление водорода,
с образованием продуктов и переходом активного
улучшающие термодинамические условия для про-
компонента катализатора в более низкую степень
ведения процесса, позволяют проводить его при
окисления. Приемлемые выходы продукта дости-
относительно высоких давлениях - 7-9 бар. Ука-
гаются при температурах 550-650°С [147].
занная технология на данный момент является
Регенерацию катализатора проводят кислородом
единственной промышленной технологией, в кото-
воздуха, а побочным «продуктом» регенерации яв-
рой частично используются принципы окислитель-
ляется азот. Несмотря на то, что данная технология
ного дегидрирования.
пока не реализована в промышленности, она явля-
ется весьма перспективной за счет потенциальной
Технология Linde PDH/BASF. Технология Linde,
экономии на разделении воздуха (поскольку обра-
представленная на рис. 12, основана на катализа-
зующийся при регенерации азот не загрязняет по-
торе Pt-Sn/ZrO2, поставляемого BASF. Процесс
ток продукта).
проводят в трех параллельных реакторах, из ко-
торых два находятся в работе, а один на регенера-
ции. Рабочая температура составляет 590-600°C, а
давление 1.5 бар. Цикл работы катализатора между
регенерациями составляет 6 ч, а сама регенерация
длится 3 ч. Регенерацию проводят паром и возду-
хом. Таким образом, три периодически работаю-
щих реактора обеспечивают непрерывный процесс.
Технология циклического дегидрирования.
Технология циклического дегидрирования (или
«chemical looping oxidative dehydrogenation») отли-
чается тем, что между реактором и регенератором
циркулирует катализатор, одновременно являю-
щийся переносчиком кислорода, а также теплоно-
Рис. 13. Принципиальная технологическая схема цикли-
ческого дегидрирования [147].
сителем. Принципиальная технологическая схема
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
787
ЗАКЛЮЧЕНИЕ
Новиков Андрей Александрович, к.х.н., ORCID:
В настоящее время существует устойчивый
рост спроса на низшие олефины и прежде всего на
Глотов Александр Павлович, к.х.н., ORCID:
пропилен, который не может быть удовлетворен за
счет наращивания мощностей основных процес-
Решетина Марина Викторовна, ORCID: https://
сов производства олефинов - пиролиза и катали-
orcid.org/0000-0002-8060-9400
тического крекинга, поскольку олефины C3-C4 не
Смирнова Екатерина Максимовна, ORCID:
являются основными продуктами данных процес-
сов. Наиболее подходящими являются технологии
дегидрирования алканов. При этом в промышлен-
org/0000-0003-1262-1958
ности получил распространение только процесс
Винокуров Владимир Арнольдович, д.х.н.,
термокаталитического дегидрирования. Представ-
ляется перспективной технология окислительного
6577
дегидрирования, особенно с использованием CO2 в
качестве мягкого окислителя. Такой процесс позво-
ляет не только нарастить производство пропилена,
СПИСОК ЛИТЕРАТУРЫ
но и утилизировать углекислый газ. Ввиду термо-
1. Zimmermann H., Walzl R. Ethylene // Ullmann’s
динамических ограничений дегидрирование в при-
Encyclopedia of Industrial Chemistry. Weinheim: Wiley-
сутствии CO2 рекомендуется вести при температу-
VCH Verlag GmbH&Co. KGaA, 2000. P. 465-529.
ре не ниже 830 K и отношении CO2:пропан от 1:1
2. Zimmermann H. Propene // Ullmann’s Encyclopedia
до 5:1. Из известных катализаторов окислительно-
of Industrial Chemistry. Weinheim: Wiley-VCH
го дегидрирования наилучшие показатели по кон-
версии и селективности демонстрируют оксиды
org/10.1002/14356007.a22_211.pub3
хрома на мезопористых носителях, однако высокая
3. Платэ Н.В., Сливинский Е.В. Основы химии и техно-
токсичность хрома требует поиска альтернатив-
логии мономеров. М: МАИК Наука/Интерпериодика,
ных, более безопасных активных компонентов.
2002. 696 с.
4. Li G., Liu C., Cui X., Yang Y., Shi F. Oxidative
dehydrogenation of light alkanes with carbon dioxide //
ФИНАНСИРОВАНИЕ РАБОТЫ
Green Chemistry. 2021. V. 23. № 2. P. 689-707. https://
Исследование выполнено при поддержке Рос-
doi.org/10.1039/d0gc03705b
сийской Федерации в лице Минобрнауки России
5. Sundaram K.M., Shreehan M.M., Olszewski E.F.
(Название «Метастабильные катализаторы, полу-
Ethylene // Kirk-Othmer Encyclopedia of Chemical
ченные лазерной обработкой в жидкости, для эф-
фективного дегидрирования алканов», № Соглаше-
10.1002/0471238961.0520082519211404.a01.pub2
6. Zimmermann R.R., Hahn T., Reschetilowski W.,
ния 075-15-2021-1386, Шифр 13.2251.21.0100).
Armbrüster M. Kinetic Parameters for the Selective
Данное исследование в Северо-западном поли-
Hydrogenation of Acetylene on GaPd2 and GaPd //
техническом университете поддержано в рамках
ChemPhysChem. 2017. V. 18. № 18. P. 2517-2525.
Национальной ключевой программы исследований
и разработок Китая (проект № 2021YFE0115100).
7. Geilen F.M.A., Stochniol G., Peitz S., Schulte-
Koerne E. Butenes // Ullmann’s Encyclopedia of
КОНФЛИКТ ИНТЕРЕСОВ
org/10.1002/14356007.a04_483.pub3
Авторы заявляют об отсутствии конфликта ин-
8. Bender M. An Overview of industrial processes for the
тересов, требующего раскрытия в данной статье.
production of olefins - C4 hydrocarbons // ChemBioEng
org/10.1002/cben.201400016
ИНФОРМАЦИЯ ОБ АВТОРАХ
9. Sadrameli S.M. Thermal/catalytic cracking of
Мельников Дмитрий Петрович, к.х.н., ORCID:
hydrocarbons for the production of olefins: A state-
of-the-art review I: Thermal cracking review // Fuel.
НЕФТЕХИМИЯ том 62 № 6 2022
788
МЕЛЬНИКОВ и др.
Environmental. 2018. V. 220. № May 2017. P. 429-445.
fuel.2014.09.034
10. Sadrameli S.M. Thermal/catalytic cracking of liquid
22. Kondratenko E. V, Ovsitser O. Catalytic Abatement
hydrocarbons for the production of olefins: A state-of-
of Nitrous Oxide Coupled with Selective Production
the-art review II: Catalytic cracking review // Fuel. 2016.
of Hydrogen and Ethylene // Angewandte Chemie
International Edition. 2008. V. 47. № 17. P. 3227-3229.
fuel.2016.01.047
11. Gholami Z., Gholami F., Tišler Z., Tomas M., Vakili M.
23. Zhou Y., Lin J., Li L., Tian M., Li X., Pan X., Chen Y.,
A review on production of light olefins via fluid catalytic
Wang X. Improving the selectivity of Ni-Al mixed
cracking // Energies. 2021. V. 14. № 4. P. 1-36. https://
oxides with isolated oxygen species for oxidative
doi.org/10.3390/en14041089
dehydrogenation of ethane with nitrous oxide // J.
12. Gogate M.R. Methanol-to-olefins process technology:
current status and future prospects // Petroleum Science
org/10.1016/j.jcat.2019.07.050
and Technology. 2019. V. 37. № 5. P. 559-565. https://
24. Takehira K., Ohishi Y., Shishido T., Kawabata T., Takaki K.,
doi.org/10.1080/10916466.2018.1555589
Zhang Q., Wang Y. Behavior of active sites on Cr-
13. Sattler J.J.H.B., Ruiz-Martinez J., Santillan-Jimenez E.,
MCM-41 catalysts during the dehydrogenation of
Weckhuysen B.M. Catalytic dehydrogenation of light
propane with CO2 // J. of Catalysis. 2004. V. 224. № 2.
alkanes on metals and metal oxides // Chemical Reviews.
25. Chen M., Xu J., Liu Y.M., Cao Y., He H.Y., Zhuang J.H.
org/10.1021/cr5002436
Supported indium oxide as novel efficient catalysts for
14. James O.O., Mandal S., Alele N., Chowdhury B.,
dehydrogenation of propane with carbon dioxide //
Maity S. Lower alkanes dehydrogenation: Strategies
Applied Catalysis A: General. 2010. V. 377. № 1-2.
and reaction routes to corresponding alkenes // Fuel
Processing Technology. 2016. V. 149. P. 239-255. https://
26. Bustamante F., Enick R.M., Cugini A.V., Killmeyer R.P.,
doi.org/10.1016/j.fuproc.2016.04.016
Howard B.H., Rothenberger K.S., Ciocco M. V.,
15. Weckhuysen B.M., Schoonheydt R.A. Alkane
Morreale B.D., Chattopadhyay S., Shi S. High-
dehydrogenation over supported chromium oxide
temperature kinetics of the homogeneous reverse water-
catalysts // Catalysis Today. 1999. V. 51. № 2. P. 223-
gas shift reaction // AIChE J. 2004. V. 50. № 5. P. 1028-
16. Caspary K.J., Gehrke H., Heinritz-Adrian M., Schwefer M.
27. Zangeneh F.T., Taeb A., Gholivand K., Sahebdelfar S.
Dehydrogenation of alkanes // Handbook of
Thermodynamic equilibrium analysis of propane
Heterogeneous Catalysis: Online, 2008. P. 3206-3229.
dehydrogenation with carbon dioxide and side reactions //
17. Кустов Л.М., Кучеров А.В., Финашина Е.Д. Окис-
Chemical Engineering Communications. 2016. V. 203.
лительное дегидрирование легких алканов С2-С4
в алкены: традиционные системы и СВЧ-катализ //
15.1017638
Журнал Физ. Химии. 2013. T. 87. № 3. C. 357-363.
28. Du X., Yao B., Gonzalez-Cortes S., Kuznetsov V.L.,
Almegren H., Xiao T., Edwards P.P. Catalytic
18. Cavani F., Ballarini N., Cericola A. Oxidative
dehydrogenation of propane by carbon dioxide: A
dehydrogenation of ethane and propane: How far from
medium-temperature thermochemical process for carbon
commercial implementation? // Catalysis Today. 2007.
dioxide utilisation // Faraday Discussions. 2015. V. 183.
cattod.2007.05.009
19. Koc S.N., Dayioglu K., Ozdemir H. Oxidative
29. Al-Mamoori A., Lawson S., Rownaghi A.A., Rezaei F.
dehydrogenation of propane with K-MoO3/MgAl2O4
Oxidative dehydrogenation of ethane to ethylene in an
catalysts // J. of Chemical Sciences. 2016. V. 128. № 1.
integrated CO2 capture-utilization process // Applied
Catalysis B: Environmental. 2020. V. 278. № July. P.
20. Rostom S., De Lasa H. Propane oxidative
dehydrogenation on vanadium-based catalysts under
oxygen-free atmospheres // Catalysts. 2020. V. 10. № 4.
31. Smith M.S., Van Ness H.C., Abbot M.M., Swihart M.T.
Introduction to chemical engineers thermodynamics //
21. Atanga M.A., Rezaei F., Jawad A., Fitch M.,
Chemical Engineering Series. McGraw-Hill. 2017.
Rownaghi A.A. Oxidative dehydrogenation of propane
32. Biloen P., Dautzenberg F.M., Sachtler W.M.H. Catalytic
to propylene with carbon dioxide // Applied Catalysis B:
dehydrogenation of propane to propene over platinum
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
789
and platinum-gold alloys // J. Catalysis. 1977. V. 50. № 1.
dehydrogenation // Langmuir. 2000. V. 16. № 13. P.
33. Yang M.L., Zhu Y.A., Fan C., Sui Z.J., Chen D.,
43. Gokak D.T., Basrur A.G., Rajeswar D., Rao G.S.,
Zhou X.G. DFT study of propane dehydrogenation on
Krishnamurthy K.R. Lithium promoted Pt-Sn/Al2O3
Pt catalyst: Effects of step sites // Physical Chemistry
catalysts for dehydrogenation of n-decane: Influence
Chemical Physics. 2011. V. 13. № 8. P. 3257-3267.
of lithium metal precursors // Reaction Kinetics and
Catalysis Letters. 1996. V. 59. № 2. P. 315-323. https://
34. Zhu J., Yang M.L., Yu Y., Zhu Y.A., Sui Z.J., Zhou X.G.,
doi.org/10.1007/BF02068129
Holmen A., Chen D. Size-Dependent reaction mechanism
44. Wang L., Lin L., Zang T., Cai H. Enhancement of Pt-Sn/
and kinetics for propane dehydrogenation over Pt
Al2O3 catalyst stability for butane dehydrogenation by
catalysts // ACS Catalysis. 2015. V. 5. № 11. P. 6310-
modification with Sm and Li // Reaction Kinetics and
Catalysis Letters. 1994. V. 52. № 1. P. 107-111. https://
35. Rioux R.M., Song H., Hoefelmeyer J.D., Yang P.,
doi.org/10.1007/BF02129857
Somorjai G.A. High-surface-area catalyst design:
45. Siri G.J., Bertolini G.R., Casella M.L., Ferretti O.A.
Synthesis, characterization, and reaction studies of
Pt-Sn/γ-Al2O3 isobutane dehydrogenation catalysts:
platinum nanoparticles in mesoporous SBA-15 silica // J.
The effect of alkaline metals addition // Materials
Physical Chemistry B. 2005. V. 109. № 6. P. 2192-2202.
org/10.1016/j.matlet.2005.03.013
36. Bariås O.A., Holmen A., Blekkan E.A. Propane
46. Tahriri Z.F., Sahebdelfar S. Effect of addition of different
dehydrogenation over supported Pt and Pt-Sn catalysts:
promoters on the performance of Pt-Sn-K/Al2O3
Catalyst preparation, characterization, and activity
catalyst in the propane dehydrogenation // Iranian J.
measurements // J. Catalysis. 1996. V. 158. № 1. P. 1-12.
Chem. Engineering. 2011. V. 8. № 3. P. 48-54.
47. Tahriri Z.F., Taeb A., Gholivand K. The Effect of alkali
37. Cortright R.D., Hill J.M., Dumesic J.A. Selective
metal promoters on the stability and coke formation of
dehydrogenation of isobutane over supported Pt/Sn
platinum-based propane dehydrogenation catalysts: a
catalysts // Catalysis Today. 2000. V. 55. № 3. P. 213-
kinetic study // Iranian J. Chem. Engineering. 2013. V.
32. № 4. P. 25-32.
38. Iglesias-Juez A., Beale A.M., Maaijen K., Weng T.C.,
48. Yu C., Ge Q., Xu H., Li W. Effects of Ce addition on the
Glatzel P., Weckhuysen B.M. A combined in situ time-
Pt-Sn/γ-Al2O3 catalyst for propane dehydrogenation to
resolved UV-Vis, Raman and high-energy resolution
propylene // Applied Catalysis A: General. 2006. V. 315.
X-ray absorption spectroscopy study on the deactivation
behavior of Pt and PtSn propane dehydrogenation
49. Nawaz Z., Wei F. Pt-Sn-based catalyst’s intensification
catalysts under industrial reaction conditions // J.
using Al2O3-SAPO-34 as a support for propane
dehydrogenation to propylene // J. Industrial and
org/10.1016/j.jcat.2010.09.018
Engineering Chemistry. 2011. V. 17. № 3. P. 389-393.
39. Yang B., Burch R., Hardacre C., Headdock G., Hu P.
Origin of the increase of activity and selectivity of nickel
50. Nawaz Z., Fei W. Pt-Sn-based SAPO-34 supported novel
doped by Au, Ag, and Cu for acetylene hydrogenation //
catalyst for n-butane dehydrogenation // Industrial and
ACS Catalysis. 2012. V. 2. № 6. C. 1027-1032. https://
Engineering Chemistry Research. 2009. V. 48. № 15.
doi.org/10.1021/cs2006789
40. Cortright R., Dumesic J. Effects of potassium on
51. Santhosh Kumar M., Chen D., Holmen A., Walmsley J.C.
silica- supported Pt and Pt/Sn catalyst for isobutane
Dehydrogenation of propane over Pt-SBA-15 and Pt-Sn-
dehydrogenation // J. Catalysis. 1995. V. 157. P. 576-
SBA-15: Effect of Sn on the dispersion of Pt and catalytic
behavior // Catalysis Today. 2009. V. 142. № 1-2. P.
41. He S., Sun C., Bai Z., Dai X., Wang B. Dehydrogenation
of long chain paraffins over supported Pt-Sn-K/Al2O3
52. Akporiaye D., Jensen S.F., Olsbye U., Rohr F., Rytter E.,
catalysts: A study of the alumina support effect // Applied
Rønnekleiv M., Spjelkavik A.I. A novel, highly efficient
Catalysis A: General. 2009. V. 356. № 1. P. 88-98.
catalyst for propane dehydrogenation // Industrial and
Engineering Chemistry Research. 2001. V. 40. № 22.
42. Casella M.L., Siri G.J., Santori G.F., Ferreti O.A.,
Ramírez-Corredores M.M. Surface characterization
53. Galvita V., Siddiqi G., Sun P., Bell A.T. Ethane
of Li-modified platinum/tin catalysts for isobutane
dehydrogenation on Pt/Mg(Al)O and Pt-Sn/Mg(Al)O
НЕФТЕХИМИЯ том 62 № 6 2022
790
МЕЛЬНИКОВ и др.
catalysts // J. of Catalysis. 2010. V. 271. № 2. P. 209-
63. Zhang Y., Zhou Y., Huang L., Xue M., Zhang S. Sn-
modified ZSM-5 as support for platinum catalyst in
54. Sun P., Siddiqi G., Vining W.C., Chi M., Bell A.T. Novel
propane dehydrogenation // Industrial and Engineering
Pt/Mg(In)(Al)O catalysts for ethane and propane
Chemistry Research. 2011. V. 50. № 13. P. 7896-7902.
dehydrogenation // J. of Catalysis. 2011. V. 282. № 1.
64. De Cola P.L., Gläser R., Weitkamp J. Non-oxidative
55. Ruelas-Leyva J.P., Mata-Martinez A., Talavera-López A.,
propane dehydrogenation over Pt-Zn-containing zeolites //
Gómez S.A., Jimenez-Lam S.A., Fuentes G.A.
Applied Catalysis A: General. 2006. V. 306. P. 85-97.
Dehydrogenation of propane to propylene with highly
stable catalysts of Pt-Sn supported over mesoporous
65. Duan Y., Zhou Y., Zhang Y., Sheng X., Xue M. Effect
silica KIT-6 // Intern. J. Chem. Reactor Engineering.
of sodium addition to PtSn/AlSBA-15 on the catalytic
properties in propane dehydrogenation // Catalysis
ijcre-2017-0247
org/10.1007/s10562-010-0445-6
56. Nakaya Y., Hirayama J., Yamazoe S., Shimizu K.
66. Larsson M., Hulten M., Blekkan E.A., Andersson B. The
ichi, Furukawa S. Single-atom Pt in intermetallics
effect of reaction conditions and time on stream on the
as an ultrastable and selective catalyst for propane
coke formed during propane dehydrogenation // Journal
dehydrogenation // Nature Communications. 2020. V. 11.
57. Belskaya O.B., Nizovskii A.I., Gulyaeva T.I., Leont’e-
67. Larsson M., Henriksson N., Andersson B. Estimation of
va N.N., Bukhtiyarov V.I. Catalysts Pt/(Ga)Al2O3
reversible and irreversible coke by transient experiments /
obtained using aluminum metal activated with gallium //
C.H. Bartholomew and G.A. Fuentes (eds.) Studies in
Russian Journal of Applied Chemistry. 2020. V. 93. № 1.
Surface Science and Catalysis, Elsevier. 1997. P. 673-
58. Nakaya Y., Xing F., Ham H., Shimizu K., Furukawa S.
68. Wang H.Z., Sun L.L., Sui Z.J., Zhu Y.A., Ye G.H.,
Doubly decorated platinum-gallium intermetallics
Chen D., Zhou X.G., Yuan W.K. Coke formation on
as stable catalysts for propane dehydrogenation //
Pt-Sn/Al2O3 catalyst for propane dehydrogenation //
Angewandte Chemie. 2021. V. 133. № 36. P. 19867-
Industrial and Engineering Chemistry Research. 2018.
59. Xu Y., Chen J., Yuan X., Zhang Y., Yu J., Liu H., Cao M.,
iecr.8b01313
Fan X., Lin H., Zhang Q. Sintering-resistant pt on Ga2O3
69. Siddiqi G., Sun P., Galvita V., Bell A.T. Catalyst
rods for propane dehydrogenation: The morphology
performance of novel Pt/Mg(Ga)(Al)O catalysts for
matters // Industrial and Engineering Chemistry
alkane dehydrogenation // J. Catalysis. 2010. V. 274.
Research. 2018. V. 57. № 39. P. 13087-13093. https://
doi.org/10.1021/acs.iecr.8b03085
70. Frey F.E., Huppke W.F. Equilibrium dehydrogenation
60. Searles K., Chan K.W., Mendes Burak J.A., Zemlyanov
of ethane, propane, and the butanes // Industrial and
D., Safonova O., Copéret C. Highly productive propane
Engineering Chemistry. 1933. V. 25. № 1. P. 54-59.
dehydrogenation catalyst using silica-supported Ga-Pt
nanoparticles generated from single-sites // J. Am. Chem.
71. Marcilly C., Delmon B. The activity of true Cr2O3-
Al2O3 solid solutions in dehydrogenation // Journal of
org/10.1021/jacs.8b05378
61. Sattler J.J.H.B., Gonzalez-Jimenez I.D., Luo L.,
org/10.1016/0021-9517(72)90078-4
Stears B.A., Malek A., Barton D.G., Kilos B.A.,
72. Sterligov O.D., Gitis K.M., Slovetskaya K.I., Shpiro E.S.,
Kaminsky M.P., Verhoeven T.W.G.M., Koers E.J.,
Rubinstein A.M., Minachev K.M. The role of chemical
Baldus M., Weckhuysen B.M. Platinum-promoted
and structural changes on the surface in deactivation
Ga/Al2O3 as highly active, selective, and stable catalyst
of chromia-alumina catalysts in dehydrogenation of
for the dehydrogenation of propane // Angewandte
paraffinic hydrocarbons // Studies in Surface Science
org/10.1002/ange.201404460
org/10.1016/S0167-2991(08)65245-3
62. Sarazen M.L., Jones C.W. MOF-Derived Iron Catalysts
73. Shee D., Sayari A. Light alkane dehydrogenation over
for nonoxidative propane dehydrogenation // J. Physical
mesoporous Cr2O3/Al2O3 catalysts // Applied Catalysis
Chemistry C. 2018. V. 122. № 50. P. 28637-28644.
org/10.1016/j.apcata.2010.09.013
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
791
74. Nazimov D.A., Klimov O.V., Danilova I.G., Trukhan S.N.,
83. Harlin M.E., Backman L.B., Krause A.O.I.,
Saiko A.V., Cherepanova S.V., Chesalov Y.A., Martya-
Jylhä O.J.T. Activity of molybdenum oxide catalyst in
nov O.N., Noskov A.S. Effect of alumina polymorph
the dehydrogenation of n-butane // J. Catalysis. 1999.
on the dehydrogenation activity of supported chromia/
alumina catalysts // J. Catalysis. 2020. V. 391. P. 35-47.
jcat.1999.2413
84. Ledoux M.J., Meunier F., Heinrich B., Pham-Huu C.,
Harlin M.E., Krause A.O.I. Part I. n-Butane
75. Nazimov D.A., Klimov O.V., Saiko A.V., Noskov A.S.
dehydrogenation on unsupported carbon modified MoO3
Effect of steam-air treatment of alumina-chromia
(MoCxCy): Effect of steam on the catalyst stability //
dehydrogenation catalysts on their physicochemical
Applied Catalysis A: General. 1999. V. 181. № 1. P. 157-
and catalytic characteristics // Russian J. of Applied
85. Mitchell P.C.H., Wass S.A. Propane dehydrogenation
org/10.1134/S1070427221090111
over molybdenum hydrotalcite catalysts // Applied
76. Castro-Fernández P., Mance D., Liu C., Moroz I.B.,
Catalysis A: General. 2002. V. 225. № 1-2. P. 153-165.
Abdala P.M., Pidko E.A., Copéret C., Fedorov A., Müller
C.R. Propane dehydrogenation on Ga2O3-based catalysts:
86. Frank B., Cotter T.P., Schuster M.E., Schlögl R.,
contrasting performance with coordination environment
Trunschke A. Carbon dynamics on the molybdenum
and acidity of surface sites // ACS Catalysis. 2021.
carbide surface during catalytic propane dehydrogenation //
Chemistry - A European Journal. 2013. V. 19. № 50.
acscatal.0c05009
77. Chen M., Xu J., Su F.Z., Liu Y.M., Cao Y., He H.Y.,
87. Усачев Н.Я., Герзелиев И.М., Харламов В.В., Кали-
Fan K.N. Dehydrogenation of propane over spinel-type
нин В.П., Беланова Е.П., Канаев С.А., Казаков А.В.,
gallia-alumina solid solution catalysts // J. Catalysis.
Старостина Т.С. Окислительные превращения этана
с участием решеточного кислорода молибденовых
jcat.2008.03.021
систем, модифицированных оксидами алюминия,
78. Nesterenko N.S., Ponomoreva O.A., Yuschenko V.V.,
галлия и иттрия // Нефтехимия. 2016. Т. 56. № 6. С.
Ivanova I.I., Testa F., Di Renzo F., Fajula F.
Dehydrogenation of ethylbenzene and isobutane over
[Usachev N.Y., Gerzeliev I.M., Kharlamov V.V.,
Ga- and Fe-containing mesoporous silicas // Applied
Kalinin V.P., Belanova E.P., Kanaev S.A., Kazakov A.V.,
Catalysis A: General. 2003. V. 254. № 2. P. 261-272.
Starostina T.S. Oxidative conversion of ethane involving
lattice oxygen of molybdenum systems modified with
aluminum, gallium, or yttrium oxide // Petrol. Chemistry.
79. Li H., Yue Y., Miao C., Xie Z., Hua W., Gao Z.
Dehydrogenation of ethylbenzene and propane over
S0965544116090218]
Ga2O3-ZrO2 catalysts in the presence of CO2 // Catalysis
88. Puurunen R.L., Airaksinen S.M.K., Krause A.O.I.
Communications. 2007. V. 8. № 9. P. 1317-1322. https://
Chromium(III) supported on aluminum-nitride-surfaced
doi.org/10.1016/j.catcom.2006.11.034
alumina: Characteristics and dehydrogenation activity //
80. Michorczyk P., Kuśtrowski P., Kolak A., Zimowska M.
Journal of Catalysis. 2003. V. 213. № 2. P. 281-290.
Ordered mesoporous Ga2O3 and Ga2O3-Al2O3 prepared
by nanocasting as effective catalysts for propane
89. Puurunen R.L., Weckhuysen B.M. Spectroscopic study
dehydrogenation in the presence of CO2 // Catalysis
on the irreversible deactivation of chromia/alumina
dehydrogenation catalysts // J. of Catalysis. 2002. V. 210.
org/10.1016/j.catcom.2013.01.019
81. Sokolov S., Bychkov V.Y., Stoyanova M., Rodemerck U.,
90. Cavani F., Koutyrev M., Trifirò F., Bartolini A., Ghisletti D.,
Bentrup U., Linke D., Tyulenin Y.P., Korchak V.N.,
Iezzi R., Santucci A., Del Piero G. Chemical and physical
Kondratenko E.V. Effect of VOx species and support on
characterization of alumina-supported chromia-based
coke formation and catalyst stability in nonoxidative
catalysts and their activity in dehydrogenation of
propane dehydrogenation // ChemCatChem. 2015.
isobutane // J. of Catalysis. 1996. V. 158. № 1. P. 236-
cctc.201500151
91. Rombi E., Cutrufello M.G., Solinas V., De Rossi S.,
82. Kaichev V. V., Chesalov Y.A., Saraev A.A., Tsapina A.M.
Ferraris G., Pistone A. Effects of potassium addition
A Mechanistic study of dehydrogenation of propane
on the acidity and reducibility of chromia/alumina
over vanadia-titania catalysts // J. of Physical Chemistry
dehydrogenation catalysts // Applied Catalysis A:
org/10.1021/acs.jpcc.9b04991
org/10.1016/S0926-860X(03)00308-9
НЕФТЕХИМИЯ том 62 № 6 2022
792
МЕЛЬНИКОВ и др.
92.
Nazimov D.A., Klimov O.V., Saiko A.V., Trukhan S.N.,
alysts for CO2 Reduction by Ethane through Dry Re-
Glazneva T.S., Prosvirin I.P., Cherepanova S.V.,
forming and Oxidative Dehydrogenation // Angewandte
Noskov A.S. Effect of the K loading on effective acti-
Chemie - International Edition. 2015. V. 54. № 51.
vation energy of isobutane dehydrogenation over chro-
mia/alumina catalysts // Catalysis Today. 2021. V. 375.
102. Gomez E., Kattel S., Yan B., Yao S., Liu P., Chen J.G.
Combining CO2 reduction with propane oxidative
93.
Shi X., Ji S., Wang K. Oxidative dehydrogenation of eth-
dehydrogenation over bimetallic catalysts // Nature
ane to ethylene with carbon dioxide over Cr-Ce/SBA-
15 catalysts // Catalysis Letters. 2008. V. 125. № 3-4.
org/10.1038/s41467-018-03793-w
103. Myint M.N.Z., Yan B., Wan J., Zhao S., Chen J.G. Re-
94.
Celebi M., Yurderi M., Bulut A., Kaya M., Zahmakiran M.
forming and oxidative dehydrogenation of ethane with
Palladium nanoparticles supported on amine-func-
CO2 as a soft oxidant over bimetallic catalysts // J.
tionalized SiO2 for the catalytic hexavalent chromi-
um reduction // Applied Catalysis B: Environmental.
org/10.1016/j.jcat.2016.02.004
104. Numan M., Eom E., Li A., Mazur M., Cha H.W.,
catb.2015.06.020
Ham H.C., Jo C., Park S.E. Oxidative Dehydrogenation
95.
Tripathi R.M., Chung S.J. Reclamation of hexavalent
of Ethane with CO2 as a Soft Oxidant over a PtCe Bi-
chromium using catalytic activity of highly recycla-
metallic Catalyst // ACS Catalysis. 2021. V. 11. № 15.
ble biogenic Pd(0) nanoparticles // Scientific Reports.
105. Beretta A., Piovesan L., Forzatti P. An investigation on
s41598-020-57548-z
the role of a Pt/Al2O3 catalyst in the oxidative dehydro-
96.
Searles K., Siddiqi G., Safonova O. V., Copéret C. Sili-
genation of propane in annular reactor // J. of Catalysis.
ca-supported isolated gallium sites as highly active, se-
lective and stable propane dehydrogenation catalysts //
jcat.1999.2446
Chemical Science. 2017. V. 8. № 4. P. 2661-2666.
106. Bañares M.A. Supported metal oxide and other cata-
lysts for ethane conversion: A review // Catalysis Today.
97.
Wachs I.E., Weckhuysen B.M. Structure and reactivity
of surface vanadium oxide species on oxide supports //
S0920-5861(99)00053-X
Applied Catalysis A: General. 1997. V. 157. № 1-2.
107. Grzybowska-Świerkosz B. Effect of additives on the
P.
physicochemical and catalytic properties of oxide
860X(97)00021-5
catalysts in selective oxidation reactions // Topics in
98.
Chaar M.A., Patel D., Kung M.C., Kung H.H. Selective
oxidative dehydrogenation of butane over VMgO cat-
org/10.1023/A:1020547830167
alysts // J. of Catalysis. 1987. V. 105. № 2. P. 483-498.
108. Routray K., Reddy K.R.S.K., Deo G. Oxidative dehy-
drogenation of propane on V2O5/Al2O3 and V2O5/TiO2
99.
Sattler J.J.H.B., González-Jiménez I.D., Mens A.M.,
catalysts: Understanding the effect of support by param-
Arias M., Visser T., Weckhuysen B.M. Operando uv-vis
eter estimation // Applied Catalysis A: General. 2004.
spectroscopy of a catalytic solid in a pilot-scale reactor:
Deactivation of a CrOx/Al2O3 propane dehydrogenation
catalyst // Chem. Communications. 2013. V. 49. № 15.
apcata.2004.01.006
109. Nguyen T.D., Zheng W., Celik F.E., Tsilomelekis G.
100. Zhang X., Yue Y., Gao Z. Chromium oxide supported
CO2-assisted ethane oxidative dehydrogenation over
on mesoporous SBA-15 as propane dehydrogenation
MoOx: Xcatalysts supported on reducible CeO2-TiO2 //
and oxidative dehydrogenation catalysts // Cataly-
Catalysis Science and Technology. 2021. V. 11. № 17.
org/10.1023/A:1020693028720
110. Huš M., Kopač D., Bajec D., Likozar B. Effect of Sur-
101. Porosoff M.D., Myint M.N.Z., Kattel S., Xie Z., Gomez E.,
face Oxidation on Oxidative Propane Dehydrogenation
Liu P., Chen J.G. Identifying Different Types of Cat-
over Chromia: An Ab Initio Multiscale Kinetic Study //
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
793
ACS Catalysis. 2021. V. 11. № 17. P. 11233-11247.
In: Ruiz, P., Delmon, B. (eds.) New developments in
selective oxidation by heteof propane over support-
111.
Heracleous E., Machli M., Lemonidou A.A., Vasalos I.A.
ed-vanadium oxide catalystrogeneous catalysis. Else-
Oxidative dehydrogenation of ethane and propane
vier,1 992. P. 213-220.
over vanadia and molybdena supported catalysts //
120.
Liu Q., Li J., Zhao Z., Gao M., Kong L., Liu J., Wei Y.
Journal of Molecular Catalysis A: Chemical. 2005.
Design, synthesis and catalytic performance of vanadi-
um-incorporated mesoporous silica KIT-6 catalysts for
molcata.2005.01.027
the oxidative dehydrogenation of propane to propylene //
112.
Carrero C.A., Schloegl R., Wachs I.E., Schomaeck-
Catalysis Science and Technology. 2016. V. 6. № 15.
er R. Critical literature review of the kinetics for the
oxidative dehydrogenation of propane over well-de-
121.
Ciambelli P., Galli P., Lisi L., Massucci M.A., Patrono P.,
fined supported vanadium oxide catalysts // ACS
Pirone R., Ruoppolo G., Russo G. TiO2 supported va-
nadyl phosphate as catalyst for oxidative dehydroge-
org/10.1021/cs5003417
nation of ethane to ethylene // Applied Catalysis A:
113.
Al-Ghamdi S.A., De Lasa H.I. Propylene production via
propane oxidative dehydrogenation over VOx/γ-Al2O3
org/10.1016/S0926-860X(00)00481-6
122.
Хаджиев С.Н., Усачев Н.Я., Герзелиев И.М.,
org/10.1016/j.fuel.2014.02.033
Беланова Е.П., Калинин В.П., Харламов В.В.,
114.
Ayandiran A.A., Bakare I.A., Binous H., Al-Ghamdi S.,
Казаков А.В., Харламов В.В., Попов, А.Ю.
Razzak S.A., Hossain M.M. Oxidative dehydrogena-
Окислительное дегидрирование этана в этилен в
tion of propane to propylene over VOx/CaO-γ-Al2O3
системе с циркулирующим микросферическим
using lattice oxygen // Catalysis Science and Tech-
оксиднометаллическим переносчиком кислорода:
1. Синтез и изучение каталитической системы //
org/10.1039/c6cy00078a
Нефтехимия. 2015. Т. 55. № 6. С. 506-526. https://
115.
Kondratenko E. V., Cherian M., Baerns M., Su D.,
doi.org/10.7868/S002824211506012X [Khadzhiev S.N.,
Schlögl R., Wang X., Wachs I.E. Oxidative dehydroge-
Usachev N.Y., Gerzeliev I.M., Belanova E.P.,
nation of propane over V/MCM-41 catalysts: Compar-
Kalinin V.P., Kharlamov V.V., Kazakov A.V., Kanaev S.A.,
ison of O2 and N2O as oxidants // J. of Catalysis. 2005.
Starostina T.S., Popov A.Y. Oxidative dehydrogenation
of ethane to ethylene in a system with circulating mi-
jcat.2005.05.025
crospherical metal oxide oxygen carrier: 1. Synthesis
116.
Pak C., Bell A.T., Tilley T.D. Oxidative dehydroge-
and study of the catalytic system // Petrol. Chemistry.
nation of propane over vanadia-magnesia catalysts
prepared by thermolysis of OV(OtBu)3 in the presence
S0965544115080125].
of nanocrystalline MgO // J. of Catalysis. 2002. V. 206.
123.
Mikhailovskii S. V., Zhilyaeva N.A., Obletsova A.A.,
Ermilova M.M., Orekhova N. V., Malygin A.A., Yaro-
117.
Oyama S.T., Somorjai G.A. Effect of structure in se-
slavtsev A.B. Effect of the composition of (Mo, Nb, V,
lective oxide catalysis: Oxidation reactions of ethanol
Ti)/γ-Al2O3 surface oxide structures on the oxidative
and ethane on vanadium oxide // J. of Physical Chem-
dehydrogenation of ethane to ethylene // Russian J. of
Applied Chemistry. 2016. V. 89. № 1. P. 34-39. https://
org/10.1021/j100375a048
doi.org/10.1134/S1070427216010055
118.
Lemonidou A.A., Nalbandian L., Vasalos I.A. Oxida-
124.
Thorsteinson E.M., Wilson T.P., Young F.G., Kasai P.H.
tive dehydrogenation of propane over vanadium oxide
The oxidative dehydrogenation of ethane over catalysts
based catalysts. Effect of support and alkali promoter //
containing mixed oxides of molybdenum and vanadium //
Catalysis Today. 2000. V. 61. № 1. P. 333-341. https://
doi.org/10.1016/S0920-5861(00)00393-X
org/10.1016/0021-9517(78)90128-8
119.
Corma A., López-Nieto J.M., Paredes N., Pérez M.,
125.
López Nieto J.M., Botella P., Vázquez M.I., Dejoz A.
Shen Y., Cao H., Suib S.L. Oxidative Dehydrogenation /
The selective oxidative dehydrogenation of ethane
НЕФТЕХИМИЯ том 62 № 6 2022
794
МЕЛЬНИКОВ и др.
over hydrothermally synthesised MoVTeNb catalysts //
and future trends // Chemical Society Reviews. 2021.
Chem. Communications. 2002. V. 4. № 17. P. 1906-
d0cs01518k
134. Chernyak S.A., Kustov A.L., Stolbov D.N., Tedeeva M.A.,
126. Bondareva V.M., Chernov A.N., Ishchenko E.V.,
Isaikina O.Y., Maslakov K.I., Usol’tseva N.V., Savilov S.V.
Sobolev V.I. Effect of pressure on the oxidative conver-
Chromium catalysts supported on carbon nanotubes
sion of ethane on VMoTeNbO catalyst // Russian J. of
and graphene nanoflakes for CO2-assisted oxidative
Applied Chemistry. 2016. V. 89. № 11. P. 1786-1790.
dehydrogenation of propane // Applied Surface Science.
127. Bondareva V.M., Ishchenko E. V., Kardash T.Y.,
org/10.1016/j.apsusc.2021.152099
Ishchenko A. V., Zenkovets G.A., Tropin V.I.,
135. Ivashchenko A.N., Tedeeva M.A., Kartavova K.E.,
Sobolev V.I. Oxidative dehydrogenation of ethane on
Aimaletdinov T.R., Pribytkov P. V., Kustov A.L. Oxi-
VMoTeNbО/Al-Si-O catalysts: Effect of the support
dative Dehydrogenation of Ethane in the Presence of
on the physicochemical and catalytic properties // Rus-
СО2 on CrOx/SiO2 Catalysts // Russian J. of Physical
sian J. of Applied Chemistry. 2017. V. 90. № 7. P. 1136-
Chemistry A. 2021. V. 95. № 12. P. 2417-2421. https://
doi.org/10.1134/S0036024421120104
128. Dang D., Chen X., Yan B., Li Y., Cheng Y. Catalytic
136. Tedeeva M.A., Kustov A.L., Pribytkov P.V., Strekalo-
performance of phase-pure M1 MoVNbTeOx/CeO2
va A.A., Kalmykov K.B., Dunaev S.F., Kustov L.M.
composite for oxidative dehydrogenation of ethane //
Dehydrogenation of Propane in the Presence of CO2
on Supported Monometallic MOy/SiO2 and CrOxMOy/
org/10.1016/j.jcat.2018.07.016
SiO2 (M = Fe, Co, and Ni) Bimetallic Catalysts // Rus-
129. Ishchenko E.V., Gulyaev R.V., Kardash T.Y., Ishchen-
sian J. of Physical Chemistry A. 2021. V. 95. № 1. P.
ko A.V., Gerasimov E.Y., Sobolev V.I., Bondareva V.M.
Effect of Bi on catalytic performance and stability of
137. Tedeeva M.A., Kustov A.L., Pribytkov P.V., Evdoki-
MoVTeNbO catalysts in oxidative dehydrogenation of
menko N.D., Sarkar B., Kustov L.M. Dehydrogenation
ethane // Applied Catalysis A: General. 2017. V. 534.
of propane in the presence of CO2 on Cr(3%)/SiO2
catalyst under supercritical conditions // Mendeleev
130. Svintsitskiy D.A., Kardash T.Y., Lazareva E.V., Sar-
Communications. 2020. V. 30. № 2. P. 195-197. https://
aev A.A., Derevyannikova E.A., Vorokhta M., Šmíd B.,
doi.org/10.1016/j.mencom.2020.03.022
Bondareva V.M. NAP-XPS and in situ XRD study of
138. Tedeeva M.A., Kustov A.L., Pribytkov P.V., Leonov A.V.,
the stability of Bi-modified MoVNbTeO catalysts for
Dunaev S.F. Dehydrogenation of propane with СО2 on
oxidative dehydrogenation of ethane // Applied Catal-
supported CrOx/SiO2 Catalysts // Russian J. of Physical
Chemistry A. 2018. V. 92. № 12. P. 2403-2407. https://
org/10.1016/j.apcata.2019.04.027
doi.org/10.1134/S0036024418120403
131. Botella P., Dejoz A., Nieto J.M.L., Concepción P.,
139. Bugrova T.A., Dutov V.V., Svetlichnyi V.A., Cortés
Vázquez M.I. Selective oxidative dehydrogenation of
Corberán V., Mamontov G.V. Oxidative dehydroge-
ethane over MoVSbO mixed oxide catalysts // Applied
nation of ethane with CO2 over CrOx catalysts sup-
Catalysis A: General. 2006. V. 298. № 1-2. P. 16-23.
ported on Al2O3, ZrO2, CeO2 and CexZr1-xO2 // Catal-
132. Xie Q., Chen L., Weng W., Wan H. Preparation of
org/10.1016/j.cattod.2018.04.047
MoVTe(Sb)Nb mixed oxide catalysts using a slurry
140. Deng S., Li H., Li S., Zhang Y. Activity and charac-
method for selective oxidative dehydrogenation of
terization of modified Cr2O3/ZrO2 nano-composite
ethane // J. of Molecular Catalysis A: Chemical. 2005.
catalysts for oxidative dehydrogenation of ethane
to ethylene with CO2 // J. of Molecular Catalysis A:
molcata.2005.07.004
Chemical. 2007. V. 268. № 1-2. P. 169-175. https://
133. Najari S., Saeidi S., Concepcion P., Dionysiou D.D.,
doi.org/10.1016/j.molcata.2006.12.033
Bhargava S.K., Lee A.F., Wilson K. Oxidative dehydro-
141. Nakagawa K., Okamura M., Ikenaga N., Suzuki T.,
genation of ethane: Catalytic and mechanistic aspects
Kobayashi T. Dehydrogenation of ethane over gallium
НЕФТЕХИМИЯ том 62 № 6 2022
ДЕГИДРИРОВАНИЕ ЛЕГКИХ АЛКАНОВ
795
oxide in the presence of carbon dioxide // Chem. Com-
oxide catalysts for CO2 assisted dehydrogenation of
propane // Microporous and Mesoporous Materials.
org/10.1039/a800184g
142. Shao C.T., Lang W.Z., Yan X., Guo Y.J. Catalytic per-
cromeso.2012.05.011
formance of gallium oxide based-catalysts for the pro-
151.
Mitran G., Ahmed R., Iro E., Hajimirzaee S., Hodgson S.,
pane dehydrogenation reaction: effects of support and
Urdă A., Olea M., Marcu I.C. Propane oxidative de-
loading amount // RSC Advances. 2017. V. 7. № 8.
hydrogenation over VOx/SBA-15 catalysts // Catalysis
143. Tedeeva M.A., Kustov A.L., Pribytkov P.V., Kapustin G.I.,
org/10.1016/j.cattod.2016.12.014
Leonov A. V., Tkachenko O.P., Tursunov O.B., Evdoki-
152.
Glotov A., Vutolkina A., Pimerzin A., Vinokurov V.,
menko N.D., Kustov L.M. Dehydrogenation of propane
Lvov Y. Clay nanotube-metal core/shell catalysts for
in the presence of CO2 on GaOx/SiO2 catalyst: Influ-
hydroprocesses // Chem. Society Reviews. 2021. V. 50.
ence of the texture characteristics of the support // Fuel.
d1cs00502b
org/10.1016/j.fuel.2021.122698
153.
Em Y., Stoporev A., Semenov A., Glotov A., Smirnova E.,
144. Shen Z., Liu J., Xu H., Yue Y., Hua W., Shen W. Dehy-
Villevald G., Vinokurov V., Manakov A., Lvov Y. Meth-
drogenation of ethane to ethylene over a highly effi-
ane hydrate formation in halloysite clay nanotubes //
cient Ga2O3/HZSM-5 catalyst in the presence of CO2 //
ACS Sustainable Chemistry and Engineering. 2020.
Applied Catalysis A: General. 2009. V. 356. № 2.
acssuschemeng.0c00758
145. Neal L.M., Yusuf S., Sofranko J.A., Li F. Oxida-
154.
Glotov A., Vutolkina A., Artemova M., Demikhova N.,
tive dehydrogenation of ethane: a chemical looping
Smirnova E., Roldugina E., Stavitskaya A., Ivanov E.,
approach // Energy Technology. 2016. V. 4. № 10.
Egazar’yants S., Vinokurov V. Micro-mesoporous
MCM-41/ZSM-5 supported Pt and Pd catalysts for
146. Zhu X., Imtiaz Q., Donat F., Müller C.R., Li F. Chem-
hydroisomerization of C-8 aromatic fraction // Applied
ical looping beyond combustion-a perspective // En-
Catalysis A: General. 2020. V. 603. P. 117764. https://
ergy and Environmental Science. 2020. V. 13. № 3.
doi.org/10.1016/j.apcata.2020.117764
155.
Макарян И.А., Седов И.В. Катализаторы
147. Fairuzov D., Gerzeliev I., Maximov A., Naranov E.
гидрирования/дегидрирования для систем хранения
Catalytic dehydrogenation of ethane: A mini review of
водорода на основе жидких органических носителей
recent advances and perspective of chemical looping
(обзор) // Нефтехимия. 2021. Т. 61. № 5. С. 591-
org/10.3390/catal11070833
[Makaryan I.A., Sedov I.V. Hydrogenation/Dehydroge-
148. Tian X., Zheng C., Li F., Zhao H. Co and Mo Co-doped
nation catalysts for hydrogen storage systems based on
Fe2O3 for Selective Ethylene Production via Chemi-
liquid organic carriers (A Review) // Petrol. Chemistry.
cal Looping Oxidative Dehydrogenation // ACS Sus-
tainable Chemistry and Engineering. 2021. V. 9. №
S0965544121090085].
156.
Michorczyk P., Ogonowski J., Kuśtrowski P., Ch-
meng.1c02726
mielarz L. Chromium oxide supported on MCM-41
149. Chen S., Pei C., Chang X., Zhao Z.J., Mu R., Xu Y.,
as a highly active and selective catalyst for dehydro-
Gong J. Coverage-dependent behaviors of vanadium ox-
genation of propane with CO2 // Applied Catalysis A:
ides for chemical looping oxidative dehydrogenation //
Angewandte Chemie - International Edition. 2020.
org/10.1016/j.apcata.2008.07.008
157.
Asghari S., Haghighi M., Taghavinezhad P. Plasma-
anie.202005968
enhanced dispersion of Cr2O3 over ceria-doped MCM-
150. Michorczyk P., Pietrzyk P., Ogonowski J. Preparation
41 nanostructured catalyst used in CO2 oxidative de-
and characterization of SBA-1-supported chromium
hydrogenation of ethane to ethylene // Microporous
НЕФТЕХИМИЯ том 62 № 6 2022
796
МЕЛЬНИКОВ и др.
and Mesoporous Materials. 2019. V. 279. P. 165-177.
of MFI nanosheets in accelerated mode // Catalysis
158. Liu L., Li H., Zhang Y. A comparative study on catalytic
org/10.1016/j.cattod.2021.06.011
performances of chromium incorporated and supported
162. Sadovnikov A.A., Arapova O. V, Russo V., Maximov A.L.,
mesoporous MSU-x catalysts for the oxidehydrogena-
Murzin D.Y., Naranov E.R. Synergy of acidity and
tion of ethane to ethylene with carbon dioxide // Catal-
morphology of micro-/mesoporous materials in the
ysis Today. 2006. V. 115. № 1-4. P. 235-241. https://
solid-acid alkylation of toluene with 1-decene //
doi.org/10.1016/j.cattod.2006.02.040
Industrial & Engineering Chemistry Research& En-
159. Шавалеев Д.А., Павлов М.Л., Басимова Р.А.,
gineering Chemistry Research. 2022. V. 61. № 5.
Садовников А.А., Судьин В.В., Смирнова Е.М.,
Демихова Н.Р., Григорьев Ю.В., Максимов А.Л.,
163. Makaryan I.A., Sedov I. V., Maksimov A.L. Hydrogen
Наранов Е.Р. Синтез модифицированного
storage using liquid organic carriers // Russian J. of
катализатора для процесса жидкофазного
Applied Chemistry. 2020. V. 93. № 12. P. 1815-1830.
алкилирования бензола этиленом // Нетфехимия.
164. Makaryan I.A., Sedov I.V. Catalytic reactors for de-
S0028242120050184 [Shavaleev D.A., Pavlov M.L.,
hydrogenation of liquid organic hydrogen carriers //
Basimova R.A., Sadovnikov A.A., Sudin V.V., Smirno-
Russian J. of Applied Chemistry. 2021. V. 94.
va E.M., Demikhova N.R., Grigor’ev Y.V.,
Maksimov A.L., Naranov E.R. Synthesis of modified
S1070427221080012
catalyst for liquid phase alkylation of benzene with eth-
165. Cheng Y., Zhang F., Zhang Y., Miao C., Hua W., Yue
ylene // Petrol. Chemistry. 2020. V. 60. № 9. P. 1073-
Y., Gao Z. Oxidative dehydrogenation of ethane with
CO2 over Cr supported on submicron ZSM-5 zeolite //
160. Naranov E.R., Dement’ev K.I., Gerzeliev I.M., Kole-
Chinese J. of Catalysis. 2015. V. 36. № 8. P. 1242-
snichenko N. V., Roldugina E.A., Maksimov A.L. The
role of zeolite catalysis in modern petroleum refin-
166. Zhang F., Wu R., Yue Y., Yang W., Gu S., Miao C.,
ing: contribution from domestic technologies // Pet-
Hua W., Gao Z. Chromium oxide supported on ZSM-5
rol. Chemistry. 2019. V. 59. № 3. P. 247-261. https://
as a novel efficient catalyst for dehydrogenation of
doi.org/10.1134/S0965544119030101 [Наранов Е.Р.,
propane with CO2 // Microporous and Mesoporous
Дементьев К.И., Герзелиев И.М., Колесниченко Н.В.,
Ролдугина Е.А., Максимов А.Л. Роль цеолитного
org/10.1016/j.micromeso.2011.05.021
катализа в современной нефтепереработке:
167. Kopač D., Jurković D.L., Likozar B., Huš M. First-prin-
вклад отечественных разработок // Современные
ciples-based multiscale modelling of nonoxidative bu-
молекулярные сита. 2019. Т. 1. № 1].
tane dehydrogenation on Cr2O3(0001) // ACS Catal-
161. Naranov E.R., Sadovnikov A.A., Bugaev A.L.,
Shavaleev D.A., Maximov A.L. A stepwise fabrication
org/10.1021/acscatal.0c03197
НЕФТЕХИМИЯ том 62 № 6 2022