НЕФТЕХИМИЯ, 2023, том 63, № 2, с. 211-219
УДК 541.124:541.128+542.943
ОКИСЛЕНИЕ КИСЛОРОДОМ ДВОЙНОЙ СИСТЕМЫ
ЭПОКСИД СТИРОЛА-СЕРНАЯ КИСЛОТА В СПИРТОВОМ РАСТВОРЕ
© 2023 г. Л. В. Петров1,*, М. Г. Спирин1, В. М. Соляников1
1 Институт проблем химической физики Российской академии наук, Черноголовка Московской обл., 1142432 Россия
*E-mail: plv@icp.ac.ru
Поступила в редакцию 12 июня 2022 г.
После доработки 15 марта 2023 г.
Принята к публикации 27 апреля 2023 г.
Изучено поглощение кислорода двойной системой эпоксид стирола (ЭС)-серная кислота (СК) в растворе
90 об. % трет-бутанола и 10 об. % хлорбензола (БУХ). Представлены: выражение скорости окисления
через концентрации реагентов; аррениусовская зависимость эффективной константы скорости окисления.
Сравнение результатов работы с данными по окислению других двойных систем: ЭС - хлорная кислота
(ХК) и ЭС - п-толуолсульфокислота (ТСК) приводит к объяснению особенностей окисления этих систем
различием природы кислот-катализаторов.
Ключевые слова: окисление кислородом, катализ, серная кислота, эпоксид стирола, раствор трет-
бутанола
DOI: 10.31857/S0028242123020053, EDN: HKCDIS
В практике крупнотоннажного радикально-цеп-
Другой пример из практики - окисление н-па-
ного окисления продуктов нефтепереработки по-
рафинов с марганцевым катализатором
[2-4].
вышение селективности процесса в ряде случаев
Свойство этого катализатора
«облагораживать»
достигается использованием конкуренции слож-
(технический термин) оксидат, связанное со спо-
ных ключевых реакций окисления. Так, например,
собностью марганца эффективно обрывать цепи
табельный катализатор промышленного окисле-
окисления по реакции с RO2•-радикалами, предот-
ния циклогексана - нафтенат кобальта - обладает
вращая образование гидрокси- и кетокислот, глав-
свойством ускорять окисление, взаимодействуя с
ных врагов качества оксидата, удалось объяснить
циклогексилгидропероксидом, и регулировать со-
лишь спустя полвека [5, 6]. Дозируя ввод марганца
став оксидата, предотвращая образование веществ,
в оксидат, регулировали соотношение (конкурен-
снижающих селективность окисления и затрудня-
цию) скоростей обрыва и продолжения цепи окис-
ющих переработку оксидата. Минус такого катали-
ления парафина для требуемого режима окисления
затора - разрушение циклогексилгидропероксида
[1, 6].
с образованием спирта циклогексанола, тогда как
Получение перспективных материалов с высо-
целевым продуктом окисления является кетон -
кими физико-механическими свойствами и поиск
циклогексанон. Селективность реакции увеличи-
условий синтеза практически ценных химических
вают, используя в качестве второго компонента
катализатора соединения хрома: на хромовом ката-
реагентов в настоящее время часто тесно связаны
лизаторе циклогексилгидропероксид распадается
с востребованностью различных эпоксидных про-
преимущественно с образованием циклогексанона;
дуктов окисления олефиновых углеводородных
так использованием конкуренции двух путей ката-
структур и их производных [7-17]. Кислотно-ка-
литического распада гидропероксида была решена
талитическое превращение эпоксидов, подробно
задача повышения селективности [1].
изучавшееся на примере эпоксида стирола, давно
211
212
ПЕТРОВ и др.
и обоснованно рассматривали как процесс чисто
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
гетеролитический [18-20]. Эпоксид стирола устой-
В работе использована стандартная методика
чив к окислению пероксидными радикалами, в
измерения скорости поглощения кислорода раст-
присутствии радикальных инициаторов окисляется
вором изучаемой системы [22, 23] в кварцевом ре-
с короткими цепями (до 5 звеньев) при 413 K [21].
акторе манометрической установки, оснащенной
Изучение катализированного кислотами ТСК и ХК
устройством автоматической компенсации измене-
превращения ЭС выявило, однако, что параллель-
ния давления. Раствор реагентов в БУХ вносили в
но гетеролизу эпоксида - основному маршруту его
реактор с рабочим объемом 5 см3 при комнатной
расходования, при невысокой температуре (≤ 343 K)
температуре, продували O2, соединяли с установ-
реализуется неизвестный ранее маршрут-конку-
кой, быстро прогревали до заданной температуры
рент, проявляющийся в поглощении кислорода [22,
при встряхивании, обеспечивавшем интенсивное
перемешивание рабочих растворов. Опытным пу-
23], образовании бензальдегида и пероксида водо-
тем проверяли независимость величин скорости от
рода [24]. Таким образом, конкуренция (в данном
частоты встряхивания реактора. Отличие от стан-
случае конкуренция процессов гетеролиза и гомо-
дартной методики было лишь в том, что измеряли
лиза) свойственна и катализированным реакциям
не постоянную, как в случаях систем ЭС-ТСК и
эпоксидов. Позже было показано [25, 26], что при
ЭС-ХК [22, 23], а максимальную скорость окис-
окислении систем ЭС-ТСК и ЭС-ХК образуется
ления. Специально отмечаем, что кривые погло-
карбен фенилметилен, взаимодействующий с кис-
щения кислорода (рис. 1) идут не из начала коор-
лородом. Для системы ЭС-СК таких данных нет. В
динат: отсчет времени опытов начинали с момента
гетерогенных каталитических процессах с участи-
погружения реактора (Ткомн) в термостат (Топытн).
ем серной кислоты, в некоторых случаях образо-
Эпоксид стирола (97%-ный, фирмы «Aldrich»,
вание карбеновых центров только предполагается
США) дважды ректифицировали в вакууме в
[27, 28].
аргоне. Содержание эпоксида и наличие примесей
Представленная ниже работа обусловлена необ-
в нем контролировали методом ВЭЖХ, аналогич-
ходимостью продолжения и уточнения исследова-
но [24], с внутренним стандартом - хлорбензо-
ния [29], в котором изучалось окисление кислоро-
лом. Хлорбензол, предварительно обработанный
дом систем, содержащих эпоксид стирола и серную
многократным встряхиванием с серной кислотой,
кислоту в присутствии хлорида меди(II).
отмывали водой от кислоты, сушили над CaCl2
Ранее на основании полученного в [29] вы-
и дважды перегоняли. Растворитель БУХ полу-
ражения скорости поглощения кислорода
чали смешиванием очищенного по стандартной
методике хлорбензола с трет-бутанолом (ч.д.а.,
V = k [СК]1[ЭС]0[CuCl2]0, предполагали, что роль
«Реахим», Россия). Его использование обуслов-
соли меди в окислении сводится лишь к «снятию»
лено необходимостью корректного сравнения
индукционного периода окисления двойной си-
экспериментальных данных с данными прежних
стемы ЭС-СК; этому предположению, в частно-
работ [22-24]. Cодержание воды в растворе БУХ
сти, соответствовал нулевой порядок реакции по
(~0.3 моль/л) проверено кулонометрическим титро-
[CuCl2]. В свете последующих исследований окис-
ванием по Карлу Фишеру (C10S) «Mettler Toledo».
ления тройных систем (ЭС-CuCl2-ароматический
Катализатор, серную кислоту (х.ч., 94% основно-
спирт) [30], неточность упомянутого предположе-
го вещества, «Химмед», Россия) использовали без
ния и трактовки результатов [29] стали практиче-
предварительной очистки. Образование пириди-
ски очевидными.
ниевого илида фенилметилена фиксировали спек-
Цель работы - определение схожести и разли-
трофотометрически с использованием модифици-
чия окисления вышеупомянутых трех двойных си-
рованного метода «техника пиридиновой пробы».
стем ЭС-различные кислоты (СК, ТСК, ХК), что
Спектры поглощения исследуемых растворов реги-
потребовало детального изучения окисления двой-
стрировали при 298 и 343 K в термостатированной
ной системы ЭС-СК в спиртовой среде, результаты
ячейке на одноканальном оптоволоконном спек-
которого изложены ниже.
трометре R-2000 со сбалансированным источни-
НЕФТЕХИМИЯ том 63 № 2 2023
ОКИСЛЕНИЕ КИСЛОРОДОМ ДВОЙНОЙ СИСТЕМЫ
213
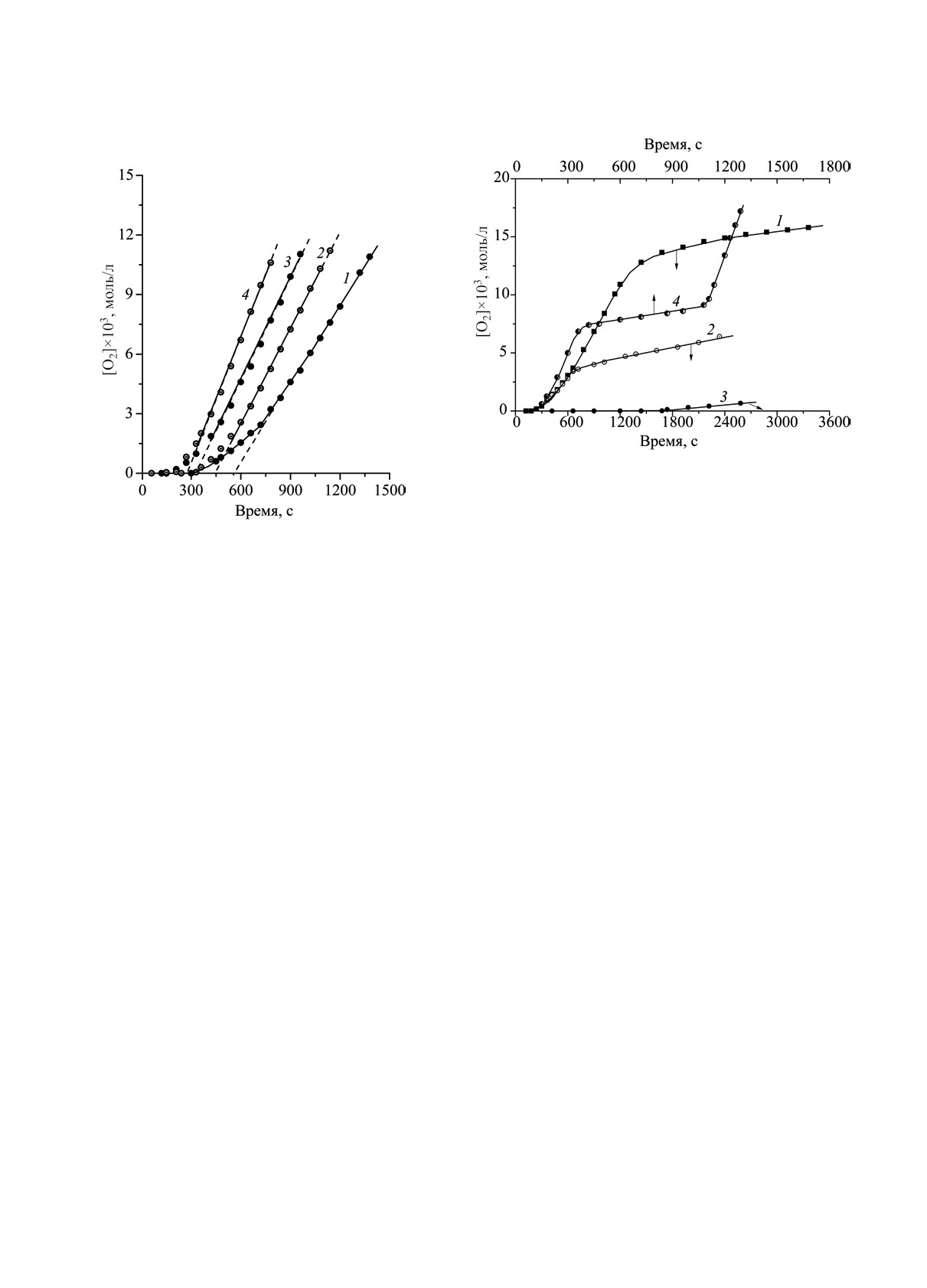
Рис. 2. Кинетические кривые окисления двойной систе-
мы ЭС-СК: 1 -при [ЭС] = 0.52, [СК] = 5.3×10-4 моль/л;
2 - исходные условия оп. 1 - на 11-ой мин опыта
введено 4.0×10-4 моль/л бензилтриэтиламмоний хлори-
Рис. 1. Кинетические кривые поглощения кислоро-
да (БТЭХА); 3 - условия оп. 2, в исходную реакцион-
да двойной системой ЭС-СК: 1, 2, 3, 4 - при 333,
ную смесь введен БТЭХА; 4 -при [ЭС] = 0.52, [СК] =
338, 340 и 343 K соответственно. [ЭС] = 0.52, [СК] =
2.0×10-3 моль/л; на 17-й мин опыта введено 0.5 моль/л
9.9×10-4 моль/л; растворитель БУХ.
ЭС. Растворитель БУХ, 343 K.
ком излучения DH-2000-BAL фирмы Оcean Optics,
исходных экспериментальных данных работы: в
США. Оптическое разрешение данного прибора в
частности, ускорение окисления в начале реакции
исследуемом диапазоне длин волн было не менее
легко было связать с наличием посторонней инги-
0.05 нм, а соотношение сигнал : шум составляло
бирующей окисление примеси в исходных реакти-
250 : 1. Для компьютерной обработки спектров
вах, расходующейся в ходе опыта.
использовали программу OOI Base32. Первона-
В [29] скорости окисления измеряли, снимая
чальный вид спектров корректировали последова-
индукционный период введением CuCl2. В данной
тельным вычитанием фонового поглощения иссле-
работе оперировали величинами максимальных
дуемого раствора до начала прогрева и фонового
скоростей окисления двойной системы ЭС-СК, ко-
поглощения раствора в момент окончания прогре-
торые находили по наклонам пунктирных прямых,
ва. Техника эксперимента детально изложена в [26].
продолжающих прямолинейные участки экспери-
ментальных кривых поглощения кислорода (см.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
рис. 1).
На рис. 1 приведены примеры кинетических
Для установления степени схожести окис-
кривых окисления двойной системы ЭС-СК; пери-
ления двойной системы ЭС-СК и предыдущих
од индукции окисления тем больше, чем ниже тем-
систем ЭС-ХК и ЭС-ТСК выполнили опыты-
пература опыта. Факт воспроизведения в публи-
тесты
- экспериментальные приемы наработ-
куемой работе данных [29] в виде кинетических
ки прежних исследований систем ЭС-кислота
кривых с отчетливо выраженными индукционны-
[24, 31, 32]. В частности, кривые 2, 3 (рис. 2)
ми периодами (окисление двойных систем с ТСК
представляют собой результаты опытов окисления
и HClO4 шло без периодов индукции) явился поло-
системы ЭС-СК (опыт 1 и опыт 2) в присутствии
жительным знаком, т.к. в течение долгого времени
бензилтриэтиламмонийхлорида (БТЭХА). Послед-
после публикации были сомнения в достоверности
ний, будучи введенным в развившуюся реакцию
НЕФТЕХИМИЯ том 63 № 2 2023
214
ПЕТРОВ и др.
100×(VO
/VЭС) оказались равными 3.4, 3.8, 3.25%,
2
средняя величина выхода ~3.5%. Аналогичная ве-
личина для двойной системы ЭС-ТСК составляет
3.9% [24]. Близкие величины для двух систем ука-
зывают на сходство реакций окисления.
Используя стандартную иодометрическую ме-
тодику титрования [33], в отдельных опытах уста-
новили, что в оксидатах двойной системы ЭС-СК
накапливается пероксид, количественно выделяю-
щий иод из иодистого калия в растворе уксусной
кислоты за время около 4 мин. Высокая скорость
выделения иода указывает на образование при
окислении пероксида водорода; H2O2 образуется
и при окислении системы ЭС-ТСК [32], схожесть
систем и в этом случае очевидна. В двух опытах
при [ЭС] = 0.52, [СК] = 9.9×10-4 моль/л определи-
ли содержание H2O2 в оксидатах и его выход при
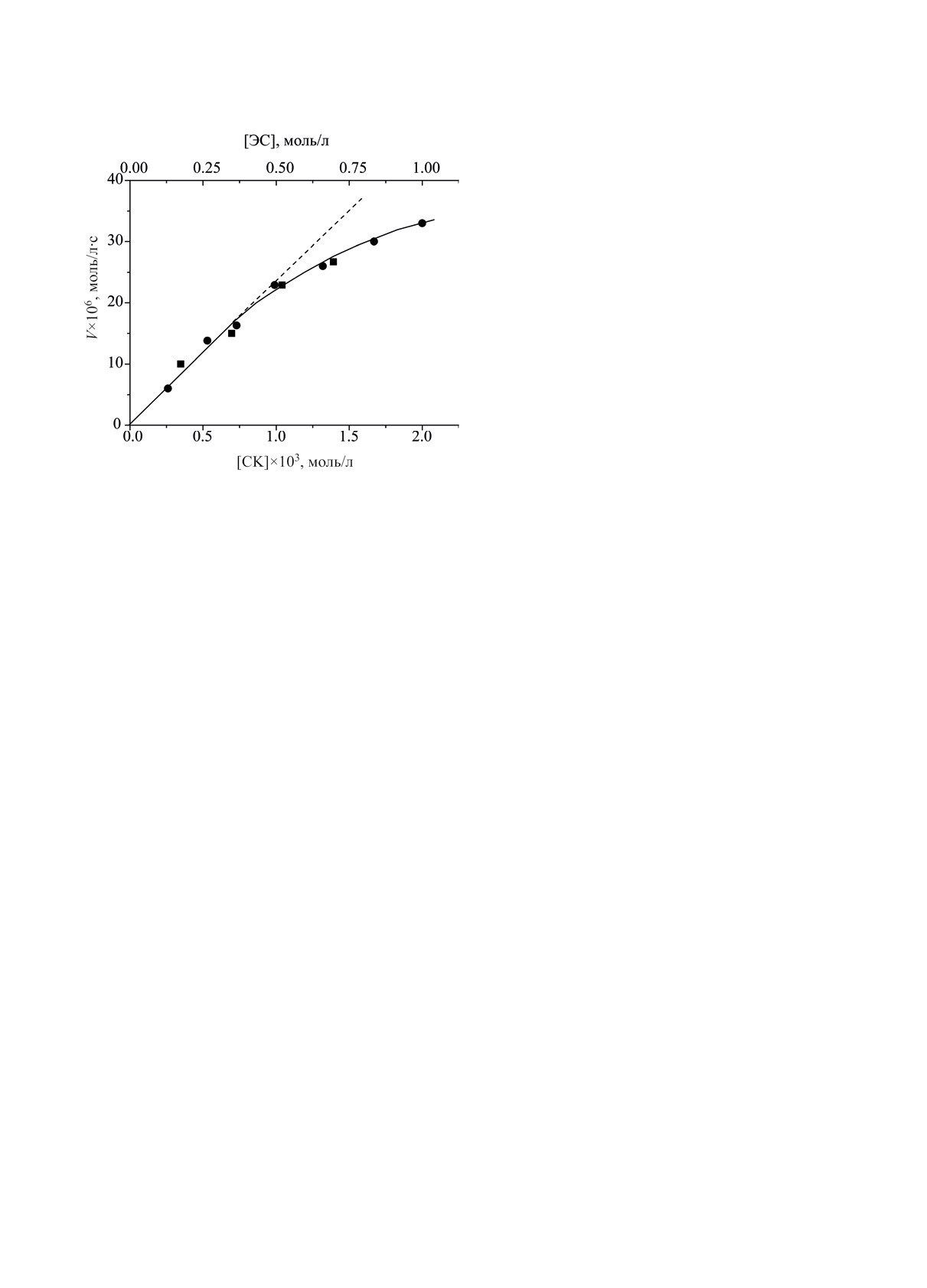
Рис. 3. Зависимости скорости поглощения кислорода
двойной системой ЭС-СК от концентрации компонен-
окислении в расчете на поглощенный кислород,
тов: ■ - от [ЭС] при [СК] = 9.9×10-4 моль/л; ● - от [СК]
100×([H2O2]/[O2]) = 39%. Величина эта весьма
при [ЭС] = 0.52 моль/л. Растворитель БУХ, 343 K.
близка к 40%, аналогичной характеристике окисле-
ния другой системы - ЭС-ТСК [32].
Зависимости скорости окисления от концентра-
окисления двойной системы, тормозит поглощение
ции компонентов двойной системы ЭС-СК пред-
O2 (кривая 2, рис. 2); результат этот качественно
ставлены на рис. 3, величины частных порядков
схож с изученным ранее торможением хлоридами
реакции по эпоксиду и кислоте близки и равны
окисления системы ЭС-ТСК [31]. При введении
0.72 ± 0.05.
БТЭХА в исходную систему, окисление практи-
При [ЭС] = 0.52, [СК] = 9.9×10-4 моль/л и тем-
чески не выходит из периода индукции (кривая 3,
пературах 333, 338, 340, 343 K измерены скоро-
рис. 2).
сти окисления, равные (13.3, 17.2, 18.6, 22.9)×
Для сравнения, другая двойная система
10-6 моль/л∙с соответственно. По этим данным в
ЭС-ТСК реагировала на введение хлорида не-
аррениусовских координатах рассчитана величина
сколько иначе: эффект торможения был одинаков
энергии активации окисления Ea = 50 ± 5 кДж/моль.
при введении хлорида и в ходе реакции, и в ис-
Выражение эффективной константы скорости в
ходную реакционную смесь [31]. Ответ на вопрос
полном виде k = 2.4×105 exp (-50 кДж/моль/RT),
о причине автозамедления окисления после 24-ой
V = k[ЭС]0.72[СК]0.72. Для корректного сравне-
мин (кривая 1, рис. 2) получен в результате экспе-
ния величин эффективных бимолекулярных кон-
римента с повторным вводом в реактор эпоксида
стант скорости окисления двойных систем с
стирола (кривая 4, рис. 2): замедление окисления
серной и хлорной кислотами, апроксимируем вы-
обусловлено не дезактивацией катализатора, как
ражение VO2 пары ЭС-СК простым равенством:
можно было предположить, а израсходованием
V = kб [ЭС]1[СК]1; расчет по наклону пунктирной
эпоксида - реагента двойной системы. Это об-
прямой рис. 3 дает kб(СК) = 4.7×10-2 л/моль∙с. Расчет
стоятельство позволило, используя только дан-
по данным рис. 2 и рис. 4 (см. ниже) дает величи-
ные по кинетике окисления, оценить выход реа-
ну kб(ХК) ≈ 0.95 л/моль∙с, т.е. в растворе БУХ при
гирующих с кислородом свободно-радикальных
343 K хлорная кислота в ~20 раз активнее в каче-
частиц, зная максимальную скорость окисления
стве катализатора окисления системы ЭС-СК [23].
VO
и оценив среднюю скорость расхода эпоксида
2
VЭС = [ЭС]0/t, где t - время опыта до замедления
Надежное подтверждение идентичности ме-
поглощения кислорода. Для трех опытов величины
ханизма окисления двойных систем ЭС-СК и
НЕФТЕХИМИЯ том 63 № 2 2023
ОКИСЛЕНИЕ КИСЛОРОДОМ ДВОЙНОЙ СИСТЕМЫ
215
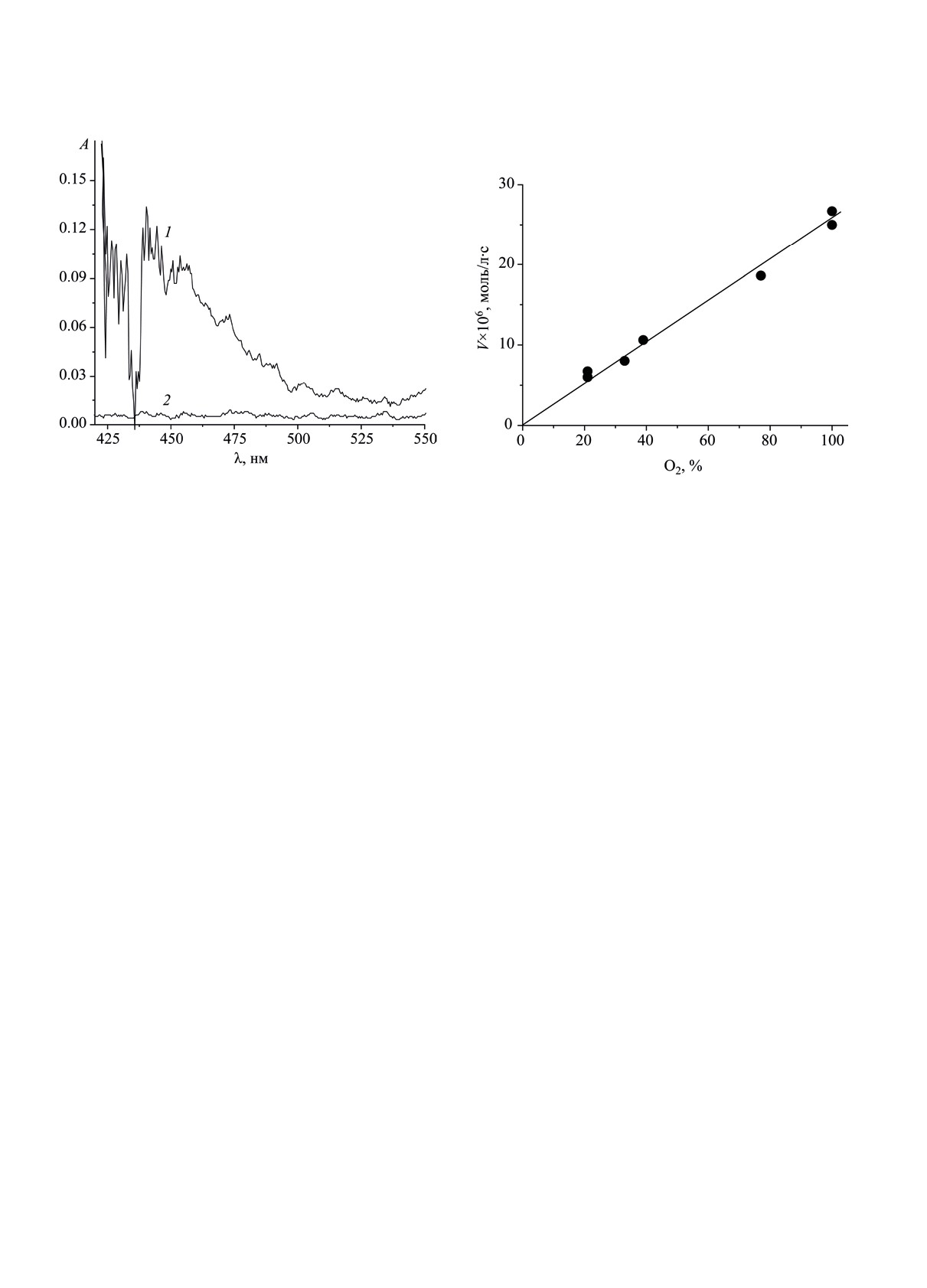
Рис. 4. Разностные спектры поглощения пириди-
ниевого илида фенилметилена, образующегося в рас-
творе системы ЭС-СК-пиридин: 1 - при продолжитель-
ности реакции 1800 с; 2 - в условиях индукционного
Рис. 5. Зависимость скорости окисления двойной си-
периода реакции 300 с. Условия опыта: [ЭС] = 1.04,
стемы ЭС-СК от процентного содержания кислорода
[СК] = 6.0×10-3, [Py] = 0.25 моль/л, растворитель БУХ,
в газовой смеси-окислителе O2-N2. [ЭС] = 0.69, [СК] =
температура 343 K, А - интенсивность поглощения.
9.9×10-4 моль/л, БУХ, 343 K.
ЭС-ТСК через промежуточное образование фе-
систем эпоксид стирола-сильная кислота в рас-
нилметилена - частицы карбеновой природы [37],
творе БУХ. Нет в этом ряду исследования окис-
способной присоединять кислород, приведено на
ления такой двойной системы как ЭС-HCl, т.к.
рис. 4. Спектр 1 поглощения иминиевого илида,
соляная кислота не вызывает поглощения кисло-
продукта взаимодействия пиридина с фенилмети-
рода двойной системой из-за тормозящего дей-
леном (λmax = 450 нм) [34-37] в растворе ЭС-СК
ствия хлорид-аниона [31]. Главное в совокупном
получен в условиях развившейся реакции (1800 с),
итоге двадцатипятилетнего изучения окисления
а спектр 2 - в условиях индукционного периода
трех двойных систем (ЭС-ТСК, ЭС-ХК и ЭС-СК)
(300 с).
состоит в доказанности существования окисли-
Зависимость скорости окисления от содер-
тельного маршрута превращения ЭС, параллель-
жания кислорода в газовой смеси приведена на
ного основному гетеролитическому пути рас-
рис. 5; видно, что скорость окисления прямо про-
ходования эпоксида под действием кислот [22].
порциональна концентрации кислорода, т.е. ме-
Впервые показано для систем с ТСК, ХК и СК,
ханизм окисления двойной системы ЭС-СК, как
что поглощение кислорода в двойных системах
и поглощение кислорода системами ЭС-ТСК и
обусловлено появлением карбена фенилметилена -
ЭС-ХК, отличается от привычного механизма
промежуточной активной частицы, способной в
радикально-цепного окисления углеводородов, при
триплетном состоянии реагировать с кислородом
реализации которого скорость окисления переста-
[C6H5HC: + O2 → C6H5CHOO (карбонилоксид)
ет зависеть от [O2] уже при содержании ~10 об.%
[26, 39-41]; 2C6H5CHOO → 2C6H5CHO (бензаль-
O2 в газовой смеси [38].
дегид) + O2], а в отсутствие кислорода разрушать
гидропероксиды. Примечательно, что скорости
ЗАКЛЮЧЕНИЕ
разрушения гидропероксидов оказались близкими
Представленная работа завершает ряд иссле-
к скоростям поглощения кислорода в идентичных
дований реакций окисления кислородом двойных условиях [25, 31].
НЕФТЕХИМИЯ том 63 № 2 2023
216
ПЕТРОВ и др.
При сопоставлении процессов окисления трех
КОНФЛИКТ ИНТЕРЕСОВ
вышеупомянутых двойных систем ЭС-кислота
Авторы заявляют об отсутствии конфликта
элементы сходства таковы:
интересов, требующего раскрытия в данной статье.
1) в системах с ТСК, ХК и СК поглощение кис-
лорода обусловлено появлением карбена фенилме-
ИНФОРМАЦИЯ ОБ АВТОРАХ
тилена, промежуточной активной частицы, реаги-
Петров Лев Васильевич, вед.н.с., к.х.н. ORCID:
рующей с кислородом, а в отсутствие O2 способной
разрушать гидропероксиды [25-26];
Спирин Максим Геннадьевич, вед.н.с., к.х.н.
2) в системах с СК и ТСК близки величины вы-
ходов промежуточных частиц, реагирующих с кис-
лородом; выходы в расчете на израсходованный ЭС
Соляников Вячеслав Маркович, вед.н.с., д.х.н.
составляют 3.5-4%;
3) в этих же системах весьма близки выходы
H2O2 в расчете на поглощенный кислород; они
СПИСОК ЛИТЕРАТУРЫ
близки к 40%;
1.
Соляников В.М. Кинетика и механизм конкуренции
4) введение хлористых солей лития, натрия и
гомо- и гетеролитических реакций в катализиро-
алкилзамещенного аммония [31] эффективно тор-
ванном жидкофазном окислении углеводородов //
мозит окисление систем с ТСК, ХК и СК, хотя де-
Дисс
докт. хим.наук. ОИХФ АН СССР. Черного-
тали такого торможения для систем с СК и ТСК
ловка, Московской обл., 1985. 120 с. [Solyanikov V.M.
Kinetics and mechanism of competition of homo- and
различаются.
heterolytic reactions in catalyzed liquid-phase oxidation
Вышеперечисленные пункты (2, 3, 4) убеди-
of hydrocarbons // Diss. Doct. Chem. Sciences. OIHF of
тельно схожи в главном механизме окисления трех
the USSR Academy of Sciences, Chernogolovka].
систем ЭС-кислота: они реализуются через проме-
2.
Imhausen A. Die Fettsäure - Synthese und ihre
жуточное образование карбена фенилметилена.
Bedeutung für die Sicherung der deutschen
Элементы различия, свойственные процессам
Fettversorgung // Kolloid - Zeitschrift. 1943. B. 103.
окисления трех исследованных двойных систем:
3.
Langenbeck W., Pritzkow W. Untersuchungen über den
1) различаются выражения скоростей окис-
Mechanismus der Paraffinoxydation, 2 Teil // Fette,
ления через концентрации реагентов: VТСК =
Seifen, Anstrichmittel. 1953. V. 55. № 8. P. 506-511.
kТСК[ЭС]0[ТСК]1, VХК = kХК [ЭС]1 [ХК]1, VСК =
kСК[ЭС]0.72[СК]0.72;
4.
Wietzel G. Herstellung Synthetischer Fettsäuren durch
2) каталитическая активность кислот в окисле-
Oxydation von Paraffinischen Kohlenwasserstoffen mit
нии трех двойных систем резко различается и па-
molekularen Sauerstoff // Chem. Eng. Sci. 1954. V. 3.
дает в ряду: ХК ˃ СК ˃ ТСК, т.е. анионы сильных
кислот явно участвуют в окислительных реакциях
S0009-2509(54)80003-0
двойных систем, что позволяет говорить о зависи-
5.
Оберемко А.В., Перченко А.А., Денисов Е.Т.,
мости механизма окисления от природы кислоты;
Александров А.Л. Роль спиртов при торможении ре-
акции окисления парафинов стеаратом марганца //
3) экспериментально подтверждено наличие ин-
Нефтехимия. 1971. Т. 11. № 2. С. 229-235 [Oberem-
дукционного периода окисления системы ЭС-СК,
ko A.V., Perchenko A.A., Denisov E.T., Aleksandrov A.L.
свидетельствующее о промежуточном комплексо-
The role of alcohols in inhibiting the oxidation reaction
образовании или об образовании лабильного про-
of paraffins with manganese stearate // Petrol. Chemistry.
дукта, предшественника появления карбена.
1971. V. 11. № 2. P. 229-235].
6.
Перченко А.А., Оберемко А.В. О функции марганце-
вого катализатора в реакции окисления н-тетракоза-
ФИНАНСИРОВАНИЕ РАБОТЫ
на кислородом воздуха // Нефтехимия. 1974. Т. 14.
Работа выполнена по темам Государственного
№ 3. С. 217-223 [Perchenko A.A., Oberemko A.V. On
задания: № государственной регистрации АААА-
the function of a manganese catalyst in the oxidation
А19-119071890015-6, № государственной реги-
reaction of n-tetracosane with air oxygen // Petrol.
страции АААА-А19-119070790003-7.
Chemistry. 1974. V. 14. № 3. P. 217-223].
НЕФТЕХИМИЯ том 63 № 2 2023
ОКИСЛЕНИЕ КИСЛОРОДОМ ДВОЙНОЙ СИСТЕМЫ
217
7.
Kenji Miyamoto, Kou Okuro, Hiromichi Ohta. Substrate
Changhe Guo. A novel silk fibroin-grahene oxide
specificity and reaction mechanism of recombinant
hybrid for reinforcing corrosion protection performance
styrene oxide isomerase from pseudomonas putida S12 //
of waterborne epoxy coating // Colloids and Surfaces
A: Physicochemical and Engineering Aspects.
org/10.1016/j.tetlet.2007.03.016
colsurfa.2021.127959
8.
Weil T, Kotke M., Kleiner Ch.M., Schreiner P.R. Bronsted
acid - type organocatalysis: alcoholysis of styrene
16.
Yu Fang, Wang Xiang, Zhang Zhao. Research progress
oxides // Org. Lett. 2008. V. 10. № 8. P. 1513-1516.
of nanofillers for epoxy anty-corrosion coatings // J. of
Chinese Soc. for corrosion and protection. 2023. V. 43.
9.
Tan N., Yin Sh., Li Y., Qiu R., Meng Z., Song X., Luo Sh.,
Au Ch.-T., Wong W.-Y. Synthesis and structure of an air-
stable organobismuth triflate complex and its use as a
17.
Загора А.Г., Ткачук А.И., Терехов И.В., Мухаме-
high-efficiency catalyst for the ring opening of epoxides
тов Р.Р. Методы химической модификации эпоксид-
in aqueous media with aromatic amines // J. Organomet.
ных олигомеров (обзор) // Труды ВИАМ. Композици-
Chem. 2011. V. 696. № 8. P. 1579-1583.
онные материалы. 2021. № 7 (101). С. 73-85. https://
doi.org/10.18577/2307-6046-2021-7-73-85
10.
Zhang Y., Wang M., Li P., Wang L. Iron- promoted
tandem reaction of anilines with styrene oxides via C-C
18.
Parker R.E., Isaacs N.S. Mechanisms of epoxide
cleavage for the synthesis of quinolines // Org. Lett.
reactions // Chem. Revs. 1959. V. 59. № 4. P. 737-799.
ol300391t
19.
Biggs J., Chapman N.B., Finch A.F., Wray V. Mechanism
11.
Крылов А.В., Мохаммед А.Х., Егорова В.В., Борисо-
of acid-catalyzed alcoholysis of epoxides. Part I.
ва Е.Я., Борисова Н.Ю., Флид В.Р. Влияние раство-
Reactions of substituted (1,2-epoxyethyl)benzenes //
рителя на региоселективность раскрытия эпоксид-
ного кольца окиси стирола O- и N-нуклеофилами
org/10.1039/J29710000055
в нейтральных и основных средах // Изв. АН Сер.
20.
Gorzynski Smith J. Synthetically usful reactions of
хим. 2012. № 6. С. 1119-1123 [Krylov A.V., Mokham-
mad A.K., Yegorova V.V., Borisova E.Ya., Borisova Y.Yu.,
org/10.1055/s-1984-30921
Flid V.R. Effect on regioselectivity of epoxide ring
21.
Петров Л.В., Психа Б.Л., Соляников В.М. Оценка кон-
opening in styrene by O- and N-nucleophiles in neutral
курентной способности радикального и нерадикаль-
and basic media // Russ. Chem. Bull. 2012. V. 61. № 6.
ного механизмов в кислотно-каталитическом окисле-
нии эпоксида стирола // Нефтехимия. 2009. Т. 49. №
12.
Morgan K.M., Ellis J.A., Lee J., Fulton A., Wilson S.L.,
3. С. 263-267 [Petrov L.V., Psikha B.L., Solyanikov V.M.
Dupart P.S., Dastoori R. Termochemical studies of
Assessment of the competitiveness of the radical and
epoxides and related compounds //J. Org. Chem. 2013.
nonradical mechanisms in the acid-catalyzed oxidation of
styrene epoxide // Petrol. Chemistry. 2009. V. 49. № 3. P.
jo40028671
13.
Phyu Thin Wai, Pingping Jiang, Yirui Shen, Pingbo
22.
Петров Л.В., Соляников В.М. Кислотный катализ
Zhang, Qian Gu, Yan Leng. Catalytic developments
окисления эпоксида стирола молекулярным кислоро-
in the epoxidation of vegetable oils and the analysis
дом // ДАН. 1996. Т. 350. № 3. С. 357-360 [Petrov L.V.,
methods of epoxidized products // Royal Soc. of
Solyanikov V.M. Acid catalysis of oxidation of styrene
epoxide by molecular oxygen // Dokl. Phys. Chem. 1996.
org/10.1039/C9RA05943A
V. 350. № 1-3. P. 252-255].
14.
Jixing Wang, Binqiang Xie, Huan Yang, Xiaorong Yu,
23.
Петров Л.В., Соляников В.М. Закономерности мяг-
Gaoschen Su, Zhu Meng, Li Wang. Epoxy coating
кого окисления и брутто превращения эпоксида сти-
with excellent anticorrosion and PH-responsive
рола в присутствии следовых количеств хлорной
performances based on DEAEMA modified
кислоты // Нефтехимия. 2011. Т. 51. № 6. С. 467-472
mesoporous silica nanomaterials // Colloids and
[Petrov L.V., Solyanikov V.M. Mild oxidation of styrene
Surfaces A: Physicochemical and Engineering Aspects.
epoxide in the presence of trace perchloric acid // Petrol.
colsurfa.2021.127951
org/10/1134/S0965544111060144].
15.
Zhijun Li, Yi He, Siming Yan, Hongjie Li, Jiao Chen,
24.
Петров Л.В., Соляников В.М. Кислотно-каталитиче-
Chen Zhang, Changhua Li, Yang Zhao, Yi Fan,
ское превращение эпоксида стирола, сопровождаемое
НЕФТЕХИМИЯ том 63 № 2 2023
218
ПЕТРОВ и др.
окислительным разрывом связи C-C // Нефтехимия.
стирола в кислом спиртовом растворе // Нефтехимия.
1999. Т. 39. № 2. С. 107-112 [Petrov L.V., Solyani-
2012. Т. 52. № 5. С. 362-370 [Petrov L.V., Solyani-
kov V.M. Acid-catalyzed transformation of styrene
kov V.M. Inhibition of mild oxidation of styrene epoxide
epoxide accompanied by oxidative C-C bond rupture //
by oxygen in acidic alcohol solution by halide ions //
Petrol. Chemistry. 1999. V. 39. № 2. P. 89-94].
Petrol. Chemistry. 2012. V. 52. № 5. P. 327-334. https://
25.
Петров Л.В., Соляников В.М. Разложение гидропе-
doi.org/10.1134/S096554411205009X].
роксидов, сопряженное с превращением эпоксида
32.
Петров Л.В., Соляников В.М. Кинетика образования
стирола в присутствии п-толуолсульфокислоты //
пероксида водорода при окислении эпоксида стирола
Нефтехимия. 2005. Т. 45. № 3. С. 225-231 [Petrov L.V.,
кислородом в присутствии п-толуолсульфокислоты //
Solyanikov V.M. Hydroperoxide degradation coupled
Нефтехимия. 2003. Т. 43. № 3. С. 199-203 [Petrov L.V.,
with the conversion of styrene epoxide in the presence
Solyanikov V.M. Kinetics of hydrogen peroxide
of p-toluenesulfonic аcid // Petrol. Chemistry. 2005. V.
formation during oxidation of styrene epoxide by
45. № 3. P. 202-208].
dioxygen in the presence of para-toluene sulfonic acid //
26.
Петров Л.В., Спирин М.Г., Соляников В.М. Фенил-
Petrol. Chemistry. 2003. V. 43. No. 3. P. 177-181].
метилен - интермедиат реакции катализируемого
хлорной кислотой поглощения кислорода эпоксидом
33.
Антоновский В.Л., Бузланова М.М. Аналитическая
стирола в полярном растворителе // Изв. АН. Сер.
химия органических пероксидных соединений. М.:
хим. 2019. № 8. С. 1499-1503 [Petrov L.V., Spirin M.G.,
Химия, 1978. 309 с.
Solyanikov V.M. Phenylmethylene, an intermediate of
34.
Admasu A., Gudmundsdóttir A.D., Platz M.S.
perchloric acid catalyzed oxygen absorption by styrene
Laser flash photolysis study of phenylcarbene and
oxide in a polar solvent // Russ. Chem. Bull. Int. Ed.
pentafluorophenylcarbene // J. Phys. Chem. A. 1997. V.
S11172-019-2583-3].
Corpus ID: 94468404
27.
Dhakshinamoorthy A., Alvaro M., Concepcion P.,
Fornes V., Garcia H. Graphene Oxide as an acid catalyst
35.
Admasu A., Platz M.S., Marcinek A., Michalak J.,
for the room temperature ring opening of epoxides //
Gudmundsdóttir A.D., Gebicki J. Lazer flash
Chem. Commun. 2012. V. 48. № 44. P. 5443-5445.
photolysis study of phenylcarbene, o-tolylcarbene
and mesitilcarbene // J. Phys. Org. Chem. 1997.
28.
Пенцак Е.О., Гордеев Е.Г., Анаников В.П. Карбока-
тализ: от тримеризации ацетилена к современно-
1395(199704)10:4<207::AID - POC883>3.O.CO;2-8.
му органическому синтезу. Обзор // Доклады РАН.
Corpus ID: 97496643
Химия, науки о материалах. 2020. Т. 492-493. № 1.
36.
Хлебников А.Ф., Новиков М.С., Костиков Р.Р. Ими-
ниевые илиды из карбенов и карбеноидов: генери-
29.
Петров Л.В., Соляников В.М. Окисление кислородом
рование и применение в синтезе // Успехи химии.
систем, содержащих эпоксид стирола и серную кис-
лоту; эффект солей меди и кобальта // Нефтехимия.
2000. Т. 40. № 6. С. 438-443 [Petrov L.V., Solyani-
chin.200535270 [Khlebnikov A.F., Novikov M.S.,
kov V.M. Oxygen oxidation of systems containing styrene
Kostikov R.R. Iminium ylides from carbenes and
epoxide and sulfuric acid: the effect of copper(II) and
carbenoids: generation and synthetic applications // Russ.
cobalt(II) // Petrol. Chemistry. 2000. V. 40. № 6. P. 399-
404].
org/10.1070/RC2005v074n02ABEH000973].
30.
Петров Л.В., Соляников В.М. Поглощение кисло-
37.
Петров Л.В., Психа Б.Л., Спирин М.Г. Идентифика-
рода тройной системой эпоксид стирола-хлорид
ция фенилметилена в спиртово-водных растворах в
меди(II)-ионол // Хим. физика. 2021. Т. 40. № 7.
присутствии пиридина и пероксида водорода // Изв.
АН. Сер. хим. 2021. № 8. С. 1560-1567. eLIBRARY
[Petrov L.V., Solyanikov V.M. Oxygen absorption by
ID: 46497496 EDN: TGLEJJ [Petrov L.V., Psikha B.L.,
the ternary styrene epoxyde-copper(II) chloride-ionol
system in a methanol solution // Russ. J. Phys. Chemistry
Spirin M.G. Identification of phenylmethylene in alcohol
water solutions in presence of pyridine and hydrogen
S1990793121040084].
peroxide // Russ. Chem. Bull. Int. Ed. 2021. V. 70.
31.
Петров Л.В., Соляников В.М. Ингибирование гало-
ид-ионами мягкого окисления кислородом эпоксида
3252-X].
НЕФТЕХИМИЯ том 63 № 2 2023
ОКИСЛЕНИЕ КИСЛОРОДОМ ДВОЙНОЙ СИСТЕМЫ
219
38. Эмануэль Н.М., Денисов Е.Т., Майзус З.К. Цепные
41. Назаров А.М., Чайникова Е.М., Калиниченко И.А.,
реакции окисления углеводородов в жидкой фазе.
Хурсан С.Л., Сафиуллин Р.Л., Комиссаров В.Д. Абсо-
М.: Наука, 1965. 376 с.
лютные константы скорости гибели арилзамещенных
39. Scaiano J.C., McGimpsey W.G., Casal H.L. Generation
карбонилоксидов // Изв. АН. Сер. хим. 1999. № 4.
and transient spectroscopy of substituted diaril carbonyl
С. 677-681 [Nazarov A.M., Chainikova E.M.,
oxides // J. Org. Chem. 1989. V. 54. № 7. P. 1612-1616.
Kalinichenko I.A., Hursan S.L., Safiullin R.L.,
Komissarov V.D. Absolute constants of the rate of death
40. Bunelle W.H. Preparation, properties, and reactions
of aryl-substituted carbonyloxides // Russ. Chem. Bull.
of carbonyl oxydes // Chem. Rev. 1991. V. 91. № 3.
Int. Ed. 1999. V. 48. P. 672-676].
НЕФТЕХИМИЯ том 63 № 2 2023