НЕФТЕХИМИЯ, 2023, том 63, № 2, с. 239-249
УДК 544.43:544.47
РЕАКЦИЯ ГИДРИРОВАНИЯ CO2 НА КАТАЛИЗАТОРАХ НА ОСНОВЕ
БИОУГЛЯ
© 2023 г. С. А. Свидерский1,*, О. С. Дементьева1, М. И. Иванцов1,
А. А. Грабчак1, М. В. Куликова1, А. Л. Максимов1
1 Институт нефтехимического синтеза им. А.В. Топчиева РАН, Москва, 119991 Россия
*Е-mail: SviderskySA@ips.ac.ru
Поступила в редакцию 14 ноября 2022 г.
После доработки 10 марта 2023 г.
Принята к публикации 12 мая 2023 г.
Изучено протекание реакции гидрирования СО2 на моно- и биметаллических катализаторах на основе
биоугля. Показано, что биметаллические железно-кобальтовые катализаторы в процессе гидрирования
СО2 превосходят по эффективности монометаллические железный и кобальтовый; при этом наилучшее
сочетание показателей процесса достигается при соотношении железо : кобальт = 3:1. Определен состав
активной фазы биметаллического железно-кобальтового катализатора, генезис ее формирования и пред-
полагаемый механизм протекания процесса гидрирования СО2 на катализаторе с преобладанием железа в
его составе. Показано, что применение биоугля в качестве носителя способствует формированию состава
активной фазы, благоприятного для процесса гидрирования СО2.
Ключевые слова: биоуголь, гидрирование СО2, биметаллический катализатор, углеводороды С5+,
оксигенаты
DOI: 10.31857/S0028242123020089, EDN: HKMOTU
В настоящее время актуальны процессы, на-
циональных катализаторов. Авторами исследо-
правленные на ограничение влияния на климат вы-
ваний рассматриваются два основных механизма
бросов парниковых газов, в том числе - диоксида
протекания процесса гидрирования СО2 [4-6]. Пер-
углерода.
вый механизм включает реакцию превращения ди-
оксида углерода в его монооксид в присутствии
Исследования в области получения углеводо-
родов (УВ) из СО2 были начаты еще в 1970-х гг.,
водорода (так называемая обратная реакция водя-
ного газа) с последующим гидрированием CO до
однако эффективность данного процесса с точки
углеводородов:
зрения затрат была низкой и интерес к нему оста-
вался невысоким до середины 2000-х гг., когда од-
CO2+H2 → CO + H2O,
(1)
ним из актуальных направлений исследований ста-
ла разработка технологий химической утилизации
nCO + (2n+1)H2 → CnH2n+2 +nH2O.
(2)
углекислого газа путем превращения его в ценные
Второй возможный механизм подразумевает
продукты [1-3]. В частности, значительное внима-
образование метанола из CO2 с последующим пре-
ние исследователей уделяется конверсии CO2 (ги-
вращением в УВ, в первую очередь, в алкены:
дрированию) в синтетические жидкие углеводоро-
ды (СЖУ).
CO2+ CO+5H2 → 2CH3OH+Н2О,
(3)
В данный момент большая часть исследований,
2CH3OH → CH3OCH3 +H2O,
(4)
выполненных в этой области, посвящена односта-
дийному синтезу СЖУ с использованием бифунк-
nCH3OCH3+ mCH3OH → Cn+2mH2n+4m + (n+m)H2O.
(5)
239
240
СВИДЕРСКИЙ и др.
Авторами работы [4] было показано, что на
носителя углеродных материалов, в том числе био-
биметаллических катализаторах преобладающим
угля. Большую часть катализаторов на основе био-
является первый механизм, в то время как конвер-
угля получают нанесением металлической фазы на
сия CO2 в УВ через стадию образования метанола
активированный углеродный материал, осущест-
становится предпочтительной для катализаторов,
вляемое пропиткой солями соответствующих ме-
нанесенных на цеолиты.
таллов; при этом происходит связывание ионов ме-
таллов с поверхностью носителя. Формирование
Авторами
[5] для Co-Mn-катализаторов ги-
активной фазы - оксидов и карбидов металлов -
дрирования CO2 было выявлено отсутствие СО в
продуктах реакции и методами меченных атомов и
происходит в процессе термической обработки
ИК-спектроскопии in situ установлено, что в при-
предшественника катализатора [9-10].
сутствии данных катализаторов протекает прямое
Применение Со- и Fe-катализаторов на осно-
гидрированию CO2 до УВ без промежуточной
ве биоугля, в частности, эффективно в схожей по
стадии образования CO. Согласно предложенно-
химизму реакции гидрировании СО. Авторами
му механизму, СО2, адсорбированный на поверх-
работы [11] были изучены наноразмерные желез-
ности катализатора, постепенно восстанавливал-
ные катализаторы, активной фазой которых, как и
ся до фрагментов СН2/СН3 через промежуточные
в процессе гидрирования СО2, являются карбиды
стадии образования интермедиатов COδ-, HCOO-,
железа. Исследованные катализаторы показали
-CH2OH и/или СН3О-.
высокую активность и селективность по реакциям
В качестве модификаторов в состав как ко-
синтеза УВ С5+.
бальтовых, так и железных катализаторов могут
Цель работы - исследование в процессе гидри-
вводиться Cu, Mn, щелочные и/или благородные
рования СО2 биметаллических Fe-Co-катализато-
металлы; так, например, добавление Cu и K к же-
ров, нанесенных на биоуголь. В качестве образцов
лезному катализатору усиливает образование ме-
сравнения использованы аналогичные монометал-
таллической и/или карбидной фазы, на которой
лические железный и кобальтовый катализаторы.
происходит рост цепи [7].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Применение железных и кобальтовых катализа-
торов - два основных направления использования
процессов каталитического гидрирования оксидов
Приготовление катализаторов
углерода, так как на их поверхности формируются
Носитель катализаторов - биоуголь, получае-
различные типы активных центров. Идея совме-
мый гидротермальной карбонизацией целлюлозы,
щения активных центров, формируемых Fe и Co,
которую проводили в стальном реакторе автоклав-
в составе железно-кобальтового катализатора, ре-
ного типа объемом 0.5 л, снабженном механической
ализована в работе [8]. Данные биметаллические
мешалкой, при температуре 190°С в изотермиче-
катализаторы были сформированы методами соо-
ском режиме в течение 24 ч. Карбонизат отделяли
саждения или пропитки. Синергия Fe и Co способ-
фильтрацией и сушили при 105°С в течение 24 ч.
ствовала повышению селективности гидрирования
Материал, полученный после сушки, прокаливали
CO2 (до 87% для продуктов C2+). Авторы полагали,
в течение 1 ч при 400°С в муфельной печи. Актив-
что введение металлического Со увеличивает сорб-
ные компоненты наносили из водно-спиртового
цию CO2 и способствует формированию активных
раствора их прекурсоров с последующей терми-
карбидов железа, что, в свою очередь, способству-
ческой обработкой в инертной атмосфере (400°С,
ет образованию связей C-C, протекающему на фазе
1 ч). Общее количество активных компонентов во
карбида железа. Функцию носителя и структуриру-
всех случаях составляло 20 мас. % в пересчете на
ющего промотора в составе традиционных катали-
металл.
заторов процессов гидрирования оксидов углерода
выполняют оксиды алюминия, церия или кремния,
а также цеолиты [7].
Каталитические испытания
Одно из современных тенденций развития ка-
Каталитические испытания проводили в про-
тализаторов этого типа - применение в качестве
точной каталитической установке со стационар-
НЕФТЕХИМИЯ том 63 № 2 2023
РЕАКЦИЯ ГИДРИРОВАНИЯ CO
2
НА КАТАЛИЗАТОРАХ
241
ным слоем катализатора. Для обеспечения эффек-
талевый модифицированный полиэтиленгликоль).
тивного распределения сырьевого потока, тепло- и
Температурно-программный режим: 70°С (8 мин);
массообмена использовали засыпку входной и вы-
70-110°С, 10°С/мин; 110-220°С, 15°С/мин; 220°С
ходной зон реактора кварцевым бисером. Синтез
(10 мин). В качестве внутреннего стандарта ис-
проводили в непрерывном режиме при давлении
пользовали изобутиловый спирт.
2.0 МПа и объемной скорости исходной смеси
Активность катализатора оценивали по следую-
газов СО2 : Н2 = 500 ч-1 (мольное соотношение
щим показателям: конверсия СО2, выход продукта
CO2
: Н2 =
1:3) в диапазоне температур от
(количество продукта, полученного при пропуска-
240-(320-340)°С. Повышение температуры осу-
нии через катализатор 1 м3 газовой смеси, приве-
ществляли ступенчато (на 20°С каждые 12 ч), пред-
денного к нормальным условиям, г), селективность
варительно производя отбор проб газообразных и
(процент СО2, израсходованного на образование
жидких продуктов на анализ.
каждого из продуктов реакции, к общему коли-
Перед каталитическими испытаниями прово-
честву СО2, вступившего в реакцию). Оценку по-
дили активацию образцов при температуре 450°С,
грешности экспериментальных данных получали
давлении 2.0 МПа и объемной скорости Н2 1000 ч-1
путем оценки погрешности в каждом члене расчета
в течение 3 ч.
по правилам расчета косвенных погрешностей.
Анализ реагентов и продуктов реакции
Физико-химические исследования
Исходный СО и газообразные продукты синте-
катализаторов
за анализировали на хроматографе «Кристаллюкс-
Физико-химические исследования катализато-
4000 М» («Мета-Хром», Россия) с детектором по
ров проводили методом рентгеновской дифрак-
теплопроводности и двумя колонками; газ-носи-
ция (XRD) с применением дифрактомера «Rigaku
тель - гелий. Колонку, заполненную молекулярным
Rotaflex D/MAX-RC» фирмы «Rigaku». В качестве
ситом СаА (3мм×3м), применяли для разделения
источника рентгеновского излучения использо-
СО, СН4 и N2 (внутренний стандарт); температур-
вался вращающийся медный анод и вторичный
ный режим - изотермический, 80°С.
графитовый монохроматор (длина волны CuKα-
Для разделения СО2 и УВ С2-С4 применяли на-
излучения 0.1542 нм) в режиме непрерывного θ-2θ
садочную колонку Haye Sep R (3 м×3 мм). Темпе-
сканирования в угловом диапазоне 2θ = 10°-90°,
ратурный режим - программируемый, 50-200°С,
скорость сканирования 2°/мин, шаг сканирования -
8°С/мин.
0.04°. Обработку экспериментальных дифракто-
грамм вели в программе MDI Jade 6.5; фазовый
Жидкие УВ определяли методом газожидкост-
состав исследуемых образцов катализатора был
ной хроматографии (ГЖХ) на хроматографе «Кри-
идентифицирован с использованием базы дифрак-
сталлюкс-4000 М», оснащенном пламенно-иониза-
ционных данных ICDD PDF-2.
ционным детектором. Использовали капиллярную
колонку 50 м×0.32 мм, заполненную фазой OV-351.
Фокусировку рентгеновского пучка осущест-
Температурно-программный режим: 50°С (2 мин);
вляли по методу Брега-Бретано с двумя щелями
50-260°С, 6°С/мин; 260-270°С, 5°С/мин; 270°С
Солера. Для расчета межплоскостного расстояния
(10 мин). По результатам ГЖХ-исследования опре-
использовали формулу Вульфа-Брегга:
деляли относительное массовое содержание ком-
2d sin θ = nλ,
понентов (н-парафины, изо-парафины, олефины) и
где d - межплоскостное расстояние, нм; θ - угол
фракционный состав (бензин, дизельное топливо,
дифракции; n - порядок отражения; λ - длина
парафины).
волны рентгеновских лучей, нм.
Оксигенаты в водной фазе также анализирова-
ли методом ГЖХ на хроматографе «Кристаллюкс-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
4000 М», снабженном пламенно-ионизационным
детектором. Использовали капиллярную колонку
На первом этапе исследования было проведено
50 м×0.32 мм, заполненную HP-FFAP (нитротереф-
сравнение каталитической активности монометал-
НЕФТЕХИМИЯ том 63 № 2 2023
242
СВИДЕРСКИЙ и др.
Таблица 1. Зависимость выхода продуктов гидрирования СО2 K от температуры для катализаторов с различным
составом активных компонентов
Выход, г/м3
Активные
T, °C
KСО2, %
компоненты образца
С1
С2-С4
С5+
оксигенаты
СО
H2O
240
27.1
4.3
3.1
23.8
1.1
18.5
91.7
260
34.5
9.7
8.1
25.7
4.0
14.0
121.9
Fe:Cо = 1:1
280
48.2
13.4
13.3
32.7
16.5
8.9
173.1
300
55.5
18.7
19.4
37.9
10.2
7.1
204.8
320
58.0
27.5
23.5
36.6
6.4
8.4
214.8
240
39.7
40.1
3.0
20.1
1.1
0.0
148.4
260
54.4
64.3
4.6
23.1
0.4
0.0
202.7
Со
280
63.3
66.7
5.2
28.8
0.1
0.0
235.6
300
64.9
80.4
5.3
24.2
0.1
0.0
241.7
320
60.6
72.9
5.1
20.1
0.5
0.0
224.4
240
27.9
11.5
7.8
17.8
2.8
6.8
97.6
260
32.0
10.7
9.4
23.3
3.4
5.3
113.5
Fe
280
39.1
17.4
14.4
22.1
2.2
8.2
138.5
300
42.3
30.4
17.2
23.0
2.4
13.4
70.9
320
48.5
23.9
21.2
24.0
3.2
10.6
165.0
Таблица 2. Зависимость селективности образования продуктов гидрирования СО2 от температуры для катализато-
ров с различным составом активных компонентов
Селективность, %
Активные компоненты
T, °C
KСО2, %
образца
С1
С2-С4
С5+
оксигенаты
СО
240
27.1
9.2
7.6
58.8
1.5
22.9
260
34.5
16.5
15.4
49.8
4.7
13.6
Fe:Cо = 1:1
280
48.2
16.3
18.1
45.5
13.9
6.2
300
55.5
19.7
23.0
45.8
7.2
4.3
320
58.0
27.8
20.7
42.3
4.4
4.9
240
39.7
60.4
5.0
34.2
0.4
0.0
260
54.4
70.9
5.3
23.5
0.3
0.0
Со
280
63.3
64.0
5.4
31.5
0.1
0.0
300
64.9
74.2
5.4
20.3
0.1
0.0
320
60.6
73.2
5.5
21
0.3
0.0
240
27.9
25.0
18.5
44.4
3.6
8.5
260
32.0
20.3
19.4
50.6
3.9
5.8
Fe
280
39.1
27.1
24.3
39.2
2.1
7.3
300
42.3
85.1
62.8
37.6
4.4
21.4
320
48.5
31.1
22.8
35.7
2.5
7.9
лических железного и кобальтового и биметалли-
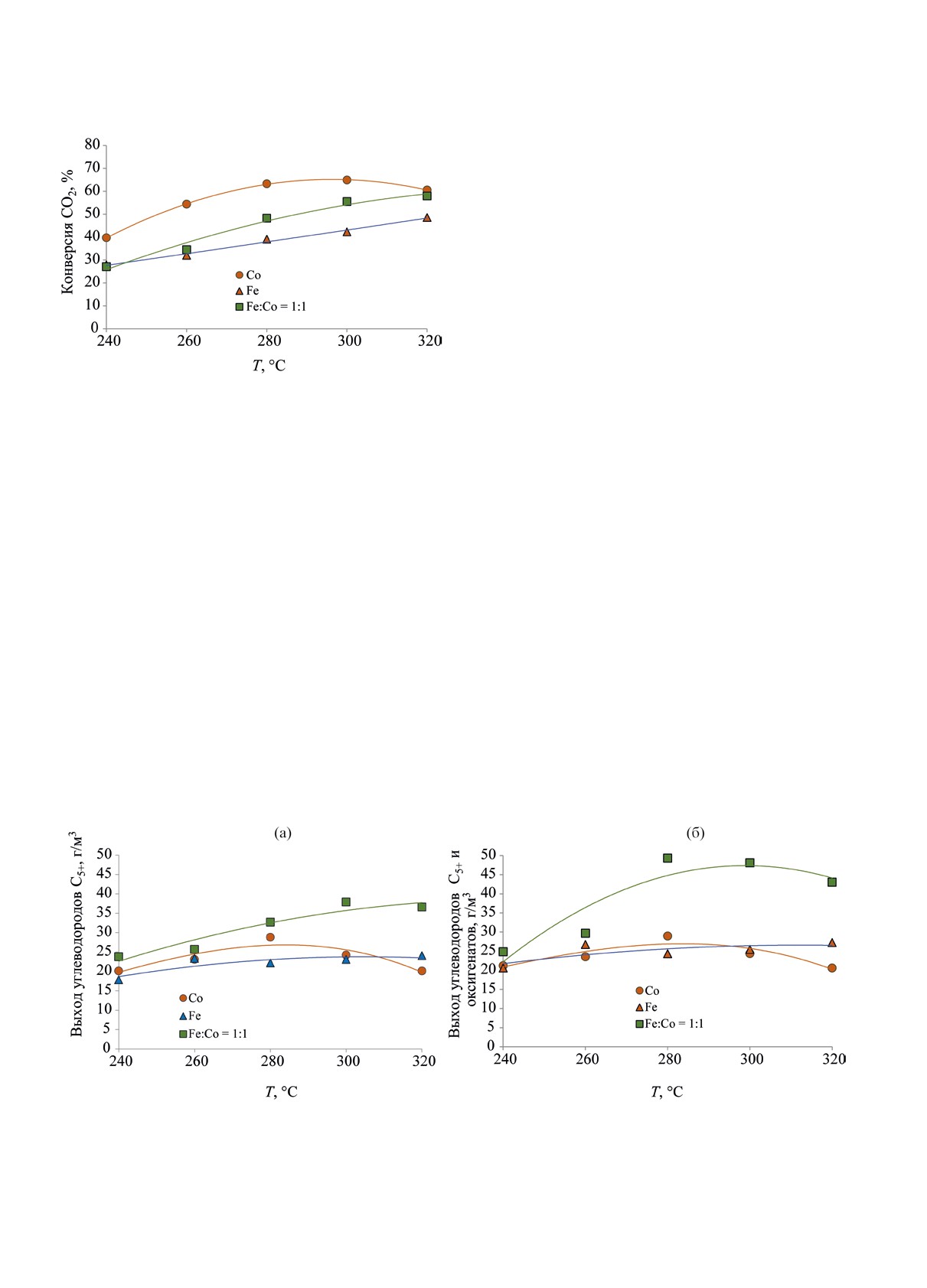
Зависимости конверсии СО2 от температуры
ческого железно-кобальтового (Fe:Cо = 1:1) ката-
для монометаллических и биметаллического ка-
лизаторов. Полученные результаты представлены
тализаторов представлены на рис. 1. Наибольшая
в табл. 1-2.
степень превращения СО2 во всем изученном
НЕФТЕХИМИЯ том 63 № 2 2023
РЕАКЦИЯ ГИДРИРОВАНИЯ CO
2
НА КАТАЛИЗАТОРАХ
243
достигнутому для Со-образца (58.0% против 60.6%
соответственно). Следует отметить, что зависи-
мость конверсии СО2 от температуры в изученном
диапазоне для Со-катализатора проходила через
максимум (64.9% при 300°С), в то время как для
железного и биметаллического катализаторов дан-
ный показатель возрастал во всем исследованном
интервале температур.
Выход целевых продуктов на катализаторах
различной природы существенно зависит от тем-
пературы (рис. 2). Показано, что биметаллический
катализатор во всем изученном диапазоне темпера-
Рис. 1. Зависимость величины конверсии СО2 от темпе-
тур обладает существенным преимуществом перед
ратуры процесса для катализаторов различной природы.
монометаллическими образцами. Выход УВ С5+ в
присутствии биметаллического катализатора воз-
растает во всем изученном диапазоне с повыше-
диапазоне температур была достигнута для ко-
нием температуры, достигая 36.6 г/м3 при 320°С
бальтового катализатора, для железного образца,
(рис. 2a), однако суммарный выход УВ С5+ и окси-
напротив, величина данного показателя в рассма-
генатов достигал максимума 49.3г/м3 при 280°С, а
триваемой температурной области была ниже.
при дальнейшем повышении температуры снижал-
Конверсия СО2 в присутствии биметаллического
ся (рис. 2б). В случае монометаллического кобаль-
равновесного катализатора в нижней части иссле-
тового катализатора образования оксигенатов не
дованного температурного диапазона была близка
наблюдали, а выход УВ С5+ не превышал 28.8 г/м3
к соответствующему показателю для железного
при 280°С и снижался с увеличением температуры.
катализатора; однако рост степени превращения
Монометаллический железный катализатор про-
СО2 в присутствии биметаллического катализатора
являет в целом невысокую активность; в его при-
с повышением температуры процесса происходил
сутствии выход как УВ С5+, так и суммарный С5+ и
быстрее, и при 320°С его конверсия для биметал-
оксигенатов изменяется незначительно в широком
лического катализатора была близка к значению,
интервале температур 260-320°С.
Рис. 2. Зависимость выхода УВ С5+ (а), суммарного выхода УВ С5+ и оксигенатов (б) от температуры для катализаторов
различной природы.
НЕФТЕХИМИЯ том 63 № 2 2023
244
СВИДЕРСКИЙ и др.
Рис. 4. Зависимость конверсииСО2 от температуры для
Рис. 3. Зависимость выхода метана от температуры для
катализаторов с различным соотношением активных
катализаторов различной природы.
компонентов.
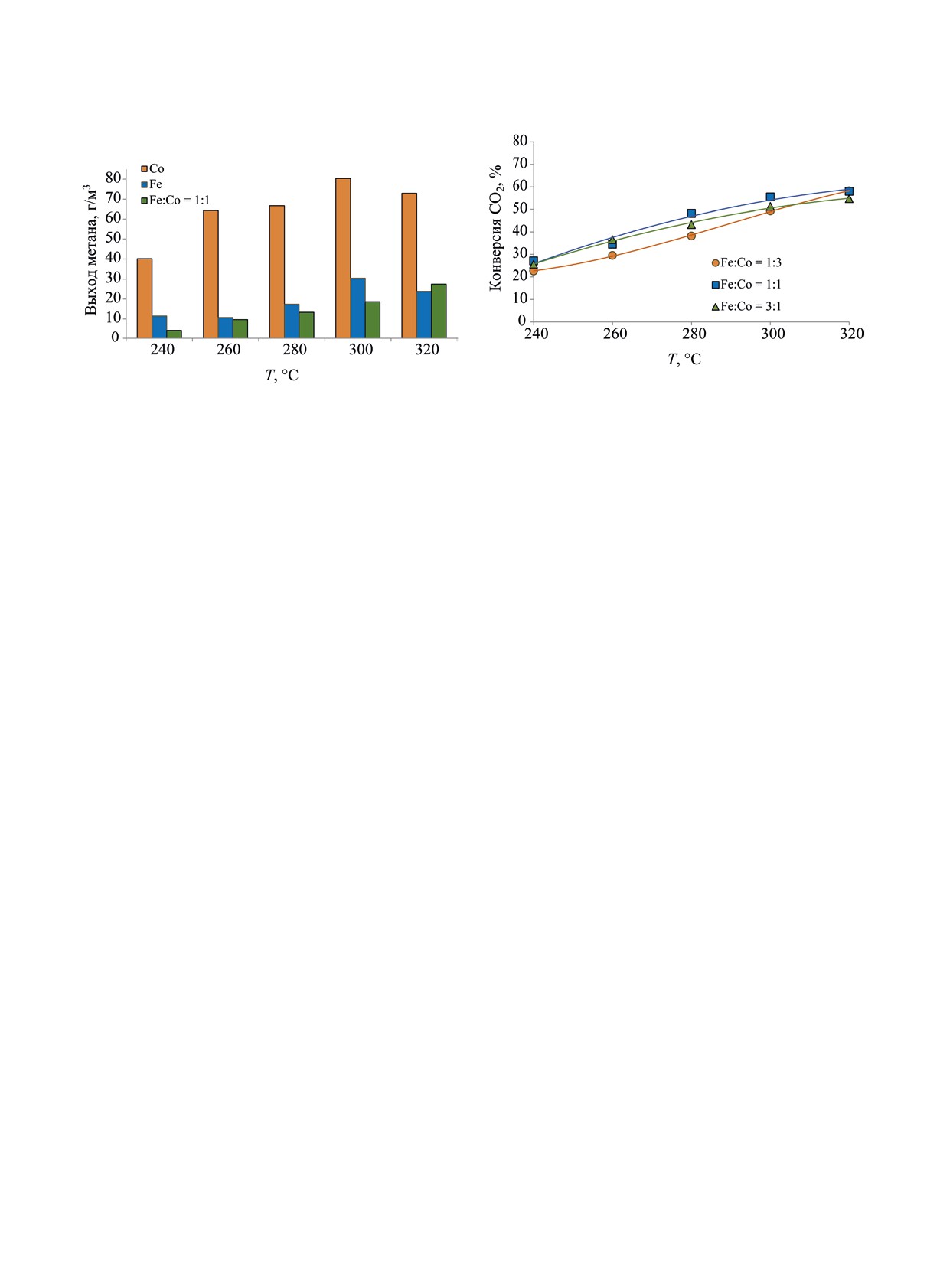
Выход метана также существенно менялся в за-
(равновесный) и 3:1. Полученные результаты пред-
висимости от природы каталиазтора (рис. 3). Наи-
ставлены в табл. 3-4.
более значительное метанообразование наблюдали
Полученные данные показали, что изменение
в присутствии Со-катализатора; для Fe-катализа-
соотношения активных компонентов в составе
тора данный показатель был ниже в среднем втрое
биметаллического катализатора не оказало суще-
при одних и тех же значениях температуры процес-
ственного влияния на зависимость степени пре-
са. Биметаллический катализатор характеризуется
вращения СО2 от температуры: для всех исследо-
наименьшим выходом метана в интервале темпера-
ванных образцов данный показатель возрастал от
тур 240-300°С.
23-26% при 240°С до 55-58% при 320°С (рис. 4).
Еще один существенный показатель, характери-
Зависимость же выходв УВ С5+ и оксигенатов
зующий механизм работы катализатора в процессе
от соотнощения активных компонентов катализа-
гидрирования СО2, - содержание в продуктах ре-
тора, напротив, было значительным. Наибольший
акции СО (табл. 1). В случае Со-катализатора при-
выход как УВ С5+, так и суммарный выход УВ и
сутствие СОа в продуктах реакции не обнаружено
оксигенатов был достигнут в присутствии желез-
вследствие эффективного протекания его гидриро-
но-кобальтового образца с соотношением металлов
вания в метан. Для монометаллического железного
3:1 (рис. 5). Наибольший выход УВ С5+ для дан-
и биметаллического железно-кобальтового ката-
ного катализатора составлял 50.4 г/м3 и был полу-
лизатора зависимости выхода СО от температуры
чен при температуре 320°С (рис. 5а). Следует от-
имели противоположный характер: в первом слу-
метить значительный рост данного показателя (на
чае данный показатель с повышением температуры
11.2 г/м3) при повышении температуры от 300 до
возрастал, во втором - снижался.
320°С, не наблюдавшийся для образцов с более
Таким образом было показано, что биметал-
низким соотношением Fe к Co. Наибольший же
лический железно-кобальтовый катализатор пре-
суммарный выход УВ С5+ и оксигенатов в присут-
восходит по эффективности монометаллические
ствии образца Fe : Со = 3:1, равный 53 г/м3 - был
железный и кобальтовый. Следующим этапом
получен в интервале температур 280-300°С; при
исследования стало определение вклада железа и
дальнейшем повышении температуры до 320°С
кобальта как активных компонентов в каталитиче-
данный показатель снижался (рис. 5б). Схожий ха-
скую активность в процессе гидрирования диокси-
рактер зависимости суммарного выхода УВС5+ и
да углерода. Были испытаны образцы с мольным
оксигенатов от температуры был отмечен для рав-
соотношением железа и кобальта в составе 1:3, 1:1
новесного железно-кобальтового образца. В случае
НЕФТЕХИМИЯ том 63 № 2 2023
РЕАКЦИЯ ГИДРИРОВАНИЯ CO
2
НА КАТАЛИЗАТОРАХ
245
Таблица 3. Зависимость выхода продуктов гидрирования СО2 от температуры для катализаторов с различным соот-
ношением активных компонентов
Выход, г/м3
Соотношение Fe:Cо
T, °C
KСО2, %
(мол)
С1
С2-С4
С5+
оксигенаты
СО
H2O
240
22.6
0.9
1.7
20.9
0.0
23.5
75.1
260
29.5
3.0
1.4
25.1
0.0
33.5
96.4
1:3
280
38.2
10.5
6.3
26.2
10.2
23.4
133.7
300
49.3
21.4
12.5
32.2
12.5
12.0
184.5
320
58.2
33.8
16.8
30.4
17.3
7.6
221.7
240
27.1
4.3
3.1
23.8
1.1
18.5
91.7
260
34.5
9.7
8.1
25.7
4.0
14.0
121.9
1:1
280
48.2
13.4
13.3
32.7
16.5
8.9
173.1
300
55.5
18.7
19.4
37.9
10.2
7.1
204.8
320
58.0
27.5
23.5
36.6
6.4
8.4
214.8
240
25.6
2.2
2.1
25.0
0.0
21.6
88.5
260
36.5
5.9
6.2
32.3
12.8
10.9
134.1
3:1
280
43.2
8.9
9.5
27.9
25.1
14.2
154.1
300
51.3
12.9
15.4
39.2
14.2
11.3
192.4
320
54.7
16.2
15.0
50.4
0.0
11.7
211.1
Таблица 4. Зависимость селективности образования продуктов гидрирования СО2 от температуры для катализато-
ров с различным соотношением активных компонентов
Селективность, %
Соотношение Fe:Cо
T, °C
KСО2, %
(мол)
С1
С2-С4
С5+
оксигенаты
СО
240
22.6
2.2
4.7
59.6
0.0
33.5
260
29.5
5.6
3.0
54.8
0.0
36.6
1:3
280
38.2
15.5
10.3
44.0
10.4
19.7
300
49.3
24.4
15.8
42.1
10.0
7.8
320
58.2
32.7
17.9
33.6
11.6
4.2
240
27.1
9.2
7.6
58.8
1.5
22.9
260
34.5
16.5
15.4
49.8
4.7
13.6
1:1
280
48.2
16.3
18.1
45.5
13.9
6.2
300
55.5
19.7
23.0
45.8
7.2
4.3
320
58.0
27.8
20.7
42.3
4.4
4.9
240
25.6
4.9
5.1
62.9
0.0
27.1
260
36.5
9.1
10.6
56.9
13.7
9.6
3:1
280
43.2
11.6
13.7
41.5
22.6
10.6
300
51.3
14.2
18.8
49.2
10.7
7.1
320
54.7
16.7
17.1
59.3
0.0
6.9
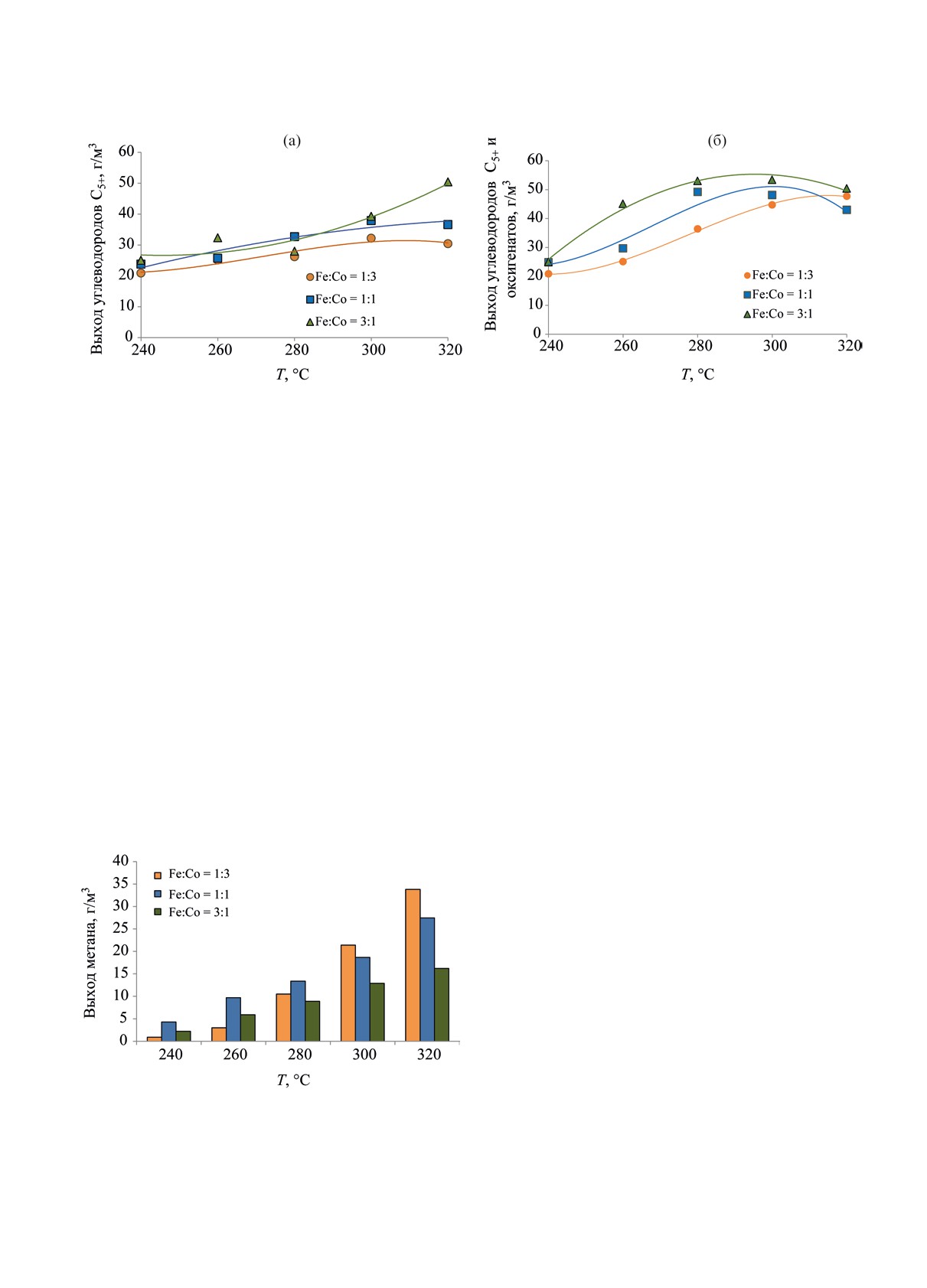
же катализатора с преобладанием в составе кобаль-
Состав активных компонентов катализатора
та - отношение Fe : Co = 1:3 - тот же показатель в
оказывал существенное влияние на выход метана
изученном диапазоне температур возрастал, дости-
(рис. 6). В диапазоне низких температур (240-
гая наибольшего значения 47.7 г/м3 при 320°С.
260°С) наименьший выход метана был получен для
НЕФТЕХИМИЯ том 63 № 2 2023
246
СВИДЕРСКИЙ и др.
Рис. 5. Зависимость выхода углеводородов С5+ (а) и суммарного выхода УВ С5+ и оксигенатов (б) от температуры для
катализаторов с различным соотношением активных компонентов.
образца с соотношением активных компонентов
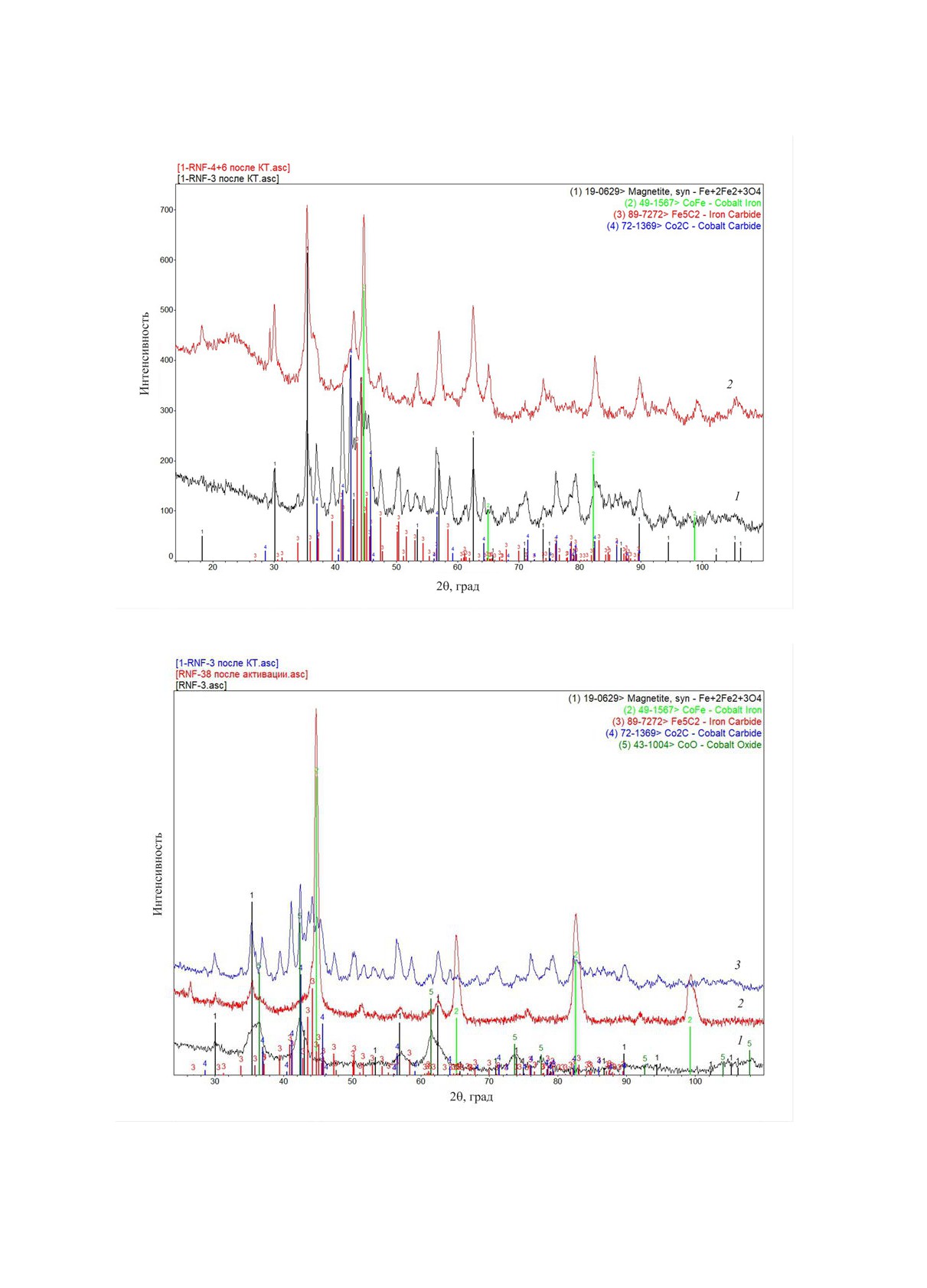
Состав активной фазы катализаторов был ис-
1:3; однако при высоких температурах 300-320°С
следован методом рентгеновской дифракции. По-
для указанного образца данный показатель, на-
лученные результаты представлены на рис. 7-8.
против, был наибольшим. В интервале температур
На рис. 7 приведено сравнение фазового соста-
более 260°С, обеспечивающих эффективное про-
ва образцов с соотношением Fe:Со, равным 1:3 и
текание процесса гидрирования СО2, наименьший
3:1 после проведения гидрирования СО2. Из пред-
выход метана был получен для образца с соотно-
ставленных данных видно, что в составе образцов
шением активных компонентов 3:1.
присутствуют фазы магнетита, карбидов железа
Таким образом было установлено, что наилуч-
и кобальта, а также железно-кобальтовый сплав.
шее сочетание показателей степени превращения
Преобладающие фазы полученных катализаторов
СО2 и выходов целевых продуктов - УВ С5+ и окси-
определяются их составом: для образца с преобла-
генатов - достигается в случае соотношения Fe:Со
данием железа (Fe : Co = 3:1) доля фаз карбида же-
в составе биметаллического железно-кобальтового
леза и магнетита существенно выше, а доля фазы
катализатора 3:1.
карбида кобальта существенно ниже, чем для об-
разца с преобладанием кобальта (Fe : Co = 1:3).
Генезис формирования активной фазы биме-
таллического катализатора определен последова-
тельным изучением свежеприготовленного, акти-
вированного и испытанного в катализе образцов
катализатора. Результаты такого исследования
для равновесного железно-кобальтового образца
(Fe : Co = 1:1) приведены на рис. 8.
Из представленных данных видно, что свеже-
приготовленный образец катализатора характери-
зуется низкой долей хорошо окристаллизованных
фаз, отмечено присутствие магнетита и смешанно-
го оксида железо-кобальт. В составе активирован-
ного образца доминирующей фазой является же-
Рис. 6. Зависимость выхода метана при гидрировании
лезокобальтовый сплав; при этом, судя по периоду
СО2 от температуры для катализаторов с различным
соотношением активных компонентов.
решетки в сплаве, соотношение в нем данных ком-
НЕФТЕХИМИЯ том 63 № 2 2023
РЕАКЦИЯ ГИДРИРОВАНИЯ CO
2
НА КАТАЛИЗАТОРАХ
247
Рис. 7. Исследование образцов с отношением железо:кобальт = 1:3 (1) и 3:1 (2) методом рентгенофазового анализа.
Рис. 8. Исследование образца с отношением железо:кобальт = 1:1 методом рентгенофазового анализа: 1 - свежеприготов-
ленный образец; 2 - образец после активации; 3 - образец после проведения испытаний.
НЕФТЕХИМИЯ том 63 № 2 2023
248
СВИДЕРСКИЙ и др.
понентов составляет около 60-40 в пользу железа.
получения оксигенатов (реакции (3), (4)); доля ок-
Состав поверхности образца после катализа пред-
сигенатов в продуктах резко возрастает, а содержа-
ставлен фазами карбидов железа и кобальта, а так-
ние СО в газовой фазе значительно снижается.
же оксида железа. Средние размеры кристаллитов
При температуре 320° оксигенаты взаимодей-
активной фазы: Fe3O4 ~10 нм, Fe5C2 и Со2С ~20 нм.
ствуют с образованиемУВ (реакция (5)). В продук-
тах доля оксигенатов резко снижается вплоть до
Таким образом было установлено, что форми-
полного их исчезновения, а выход УВ С5+ значи-
рование активной фазы железокобальтового ката-
тельно возрастает.
лизатора гидрирования СО2 происходит непосред-
ственно на начальной стадии протекания процесса.
Судя по тому, что преобладающей фазой активи-
ЗАКЛЮЧЕНИЕ
рованного образца является железокобальтовый
Изучение генезиса биметаллических катали-
сплав, а для отработанного образца наблюдается
заторов процесса гидрирования СО2 показало,
значительное сокращение данной фазы в пользу
что использование биоугля в качестве носителя
оксидной и карбидной, активных в каталитических
способствует достижению синергии железных и
реакциях гидрирования СО2, можно заключить,
кобальтовых активных центров. В отличие от ок-
что образование активной фазы происходит из ато-
сидных носителей, при нанесении на него соеди-
мов металлов, входящих в состав указанного спла-
нений железа и кобальта биоуголь не способству-
ва. Тем самым, достигается синергия кобальтовой
ет формированию массивной фазы смешанных
оксидов. Такая оксидная фаза, обычно имеющая
и железной активных фаз - кристаллиты железной
шпинелеподобную структуру, характерна, в част-
и кобальтовой активных фаз не являются изоли-
ности, для хорошо изученных катализаторов син-
рованными, а формируются из общих кластеров
теза Фишера-Тропша. Этот тип активной фазы не
железокобальтового сплава. Соотношение актив-
способствует формированию карбидов железа и
ных фаз в составе катализатора зависит от доли
кобальта, активных в реакции гидрирования СО2,
каждого металла в биметаллической композиции
а, напротив, способствует активному протеканию
и определяет особенности каталитической актив-
метанирования уже при 220-240°С. Применение
ности образца. Взаимодействие кобальтовой фазы
углеродного носителя при активации обеспечива-
с железной предотвращает формирования центров
ет формирование принципиально иной активной
метанирования, характерных для монометалличе-
фазы - железно-кобальтового сплава, который, в
ского кобальтового катализатора. В то же время, ко-
свою очередь, при запуске процесса гидрирования
бальтовая фаза способствует облегчению гидриро-
СО2 переходит в каталитически активные карбиды
вания и смещает область активности катализатора
железа и кобальта. Металлический кобальт, харак-
в зону более низких температур.
теризующийся высокой активностью в метанообра-
Исходя из полученных данных, для биметал-
зовании, при этом не образуется. Более того, осо-
лического катализатора с преобладанием Fe отно-
бенности биоугля - такие, как отсутствие развитой
сительно Co можно предложить следующий меха-
пористой структуры, и связывание атомов металла
низм гидрирования СО2.
с поверхностью через гидроксильные группы, не
способствуют характерной для оксидных носите-
В области низких температур (240-260°С) ги-
лей агломерации активных компонентов и, напро-
дрирование СО2 протекает преимущественно че-
тив, благоприятствуют формированию кристалли-
рез стадию образования СО и далее по механизму
тов железно-кобальтового сплава размером ~10-20
синтеза Фишера-Тропша (реакции (1), (2)). В этих
нм, переходящих в соответствующего размера кла-
условиях в составе продуктов преобладают угле-
стеры карбидов. Атомы железа и кобальта, вслед-
водороды, в газовой фазе наблюдается высокое
ствие формирования карбидов из сплава, находятся
содержание непрореагировавшего СО; оксигенаты
близко друг к другу, что обеспечивает синергию в
образуются в незначительных количествах.
их каталитической активности. Изменение соотно-
При повышении температуры процесса до 280-
шения активных компонентов, вводимых в состав
300°С значительно увеличивается вклад реакций
катализатора, позволяет управлять каталитически-
НЕФТЕХИМИЯ том 63 № 2 2023
РЕАКЦИЯ ГИДРИРОВАНИЯ CO
2
НА КАТАЛИЗАТОРАХ
249
ми свойствами получаемого катализатора с целью
2.
Zhan Z., Kobsiriphat W., Wilson J.R., Pillai M., Kim I.,
изменения выхода и состава получаемых продук-
Barnett S.A. Syngas production by coelectrolysis of
CO2/H2O: The basis for a renewable energy cycle //
тов. Данное направление является перспективным
для дальнейших исследований с точки зрения оп-
org/10.1021/EF900111F
тимизации свойств как биоугля, используемого в
3.
Graves C., Ebbesen S.D., Mogensen M., Lackner K.S.
качестве носителя, так и формируемой на его по-
Sustainable hydrocarbon fuels by recycling CO2 and
верхности активной фазы.
H2O with renewable or nuclear energy // Renew. Sus-
org/10.1016/J.RSER.2010.07.014
ФИНАНСИРОВАНИЕ РАБОТЫ
4.
Yang H., Zhang C., Gao P., Wang H., Li X., Zhong L.,
Работа выполнена при финансовой поддерж-
Wei W., Sun Y. A review of the catalytic hydrogenation of
ке Российского научного фонда (проект № 17-73-
carbon dioxide into value-added hydrocarbons // Catal.
30046П). Работа выполнена с использованием
org/10.1039/C7CY01403A
оборудования ЦКП «Аналитический центр про-
5.
He Z., Cui M., Qian Q., Zhang J., Liu H., Han B. Syn-
блем глубокой переработки нефти и нефтехимии»
thesis of liquid fuel via direct hydrogenation of CO2 //
ИНХС РАН».
Proceedings of the National Academy of Science. 2019.
pnas.1821231116
КОНФЛИКТ ИНТЕРЕСОВ
6.
Wei J., Ge Q., Yao R., Wen Z., Fang C., Guo L., Xu H.,
А.Л. Максимов - главный редактор журнала
Sun J. Theoretical models of nonlinear effects in
«Нефтехимия», М.В. Куликова - ответственный се-
two-component cooperative supramolecular copoly-
кретарь журнала «Нефтехимия». Остальные авто-
merizations // Nature Commun. 2017. V. 8. № 1. P. 1-9.
ры заявляют об отсутствии конфликта интересов,
требующего раскрытия в данной статье.
7.
Hwang S.M., Han S.J., Min J.E., Park H.G., Jun K.W.,
Kim S.K. Mechanistic insights into Cu and K promoted
Fe-catalyzed production of liquid hydrocarbons via CO2
ИНФОРМАЦИЯ ОБ АВТОРАХ
hydrogenation // J. CO2 Util. 2019. V. 34. P. 522-532.
Свидерский Сергей Александрович, с.н.с.,
8.
Guo L., Cui Y., Zhang P., Peng X., Yoneyama Y., Yang G.,
Tsubaki N. Enhanced liquid fuel production from CO2
1946
hydrogenation: catalytic performance of bimetallic cat-
Дементьева Оксана Сергеевна, с.н.с., к.х.н.,
alysts over a two-stage reactor system // Chemistry-
org/10.1002/SLCT.201803335
Иванцов Михаил Иванович, н.с., к.х.н., ORCID:
9.
Shan R., Han J., Gu J., Yuan H., Luo B., Chen Y.
A review of recent developments in catalytic applications
Грабчак Алена Андреевна, м.н.с, ORCID: https://
of biochar-based materials // Resour. Conserv. Recycl.
orcid.org/0000-0002-0504-5342
rec.2020.105036
Куликова Майя Валерьевна, в.н.с., д.х.н.,
10.
Kumar M., Xiong X., Sun Y., Yu I.K., Tsang D.C., Hou D.,
Gupta J., Bhaskar T., Pandey A. Critical review on
Максимов Антон Львович, д.х.н., чл.-корр. РАН,
biochar-supported catalysts for pollutant degradation
and sustainable biorefinery // Adv. Sustain. Syst. 2020.
11.
Kuz’min A.E., Pichugina D.A., Kulikova M.V., De-
СПИСОК ЛИТЕРАТУРЫ
ment’eva O.S., Nikitina N.A., Maksimov A.L .A possi-
1. Steinberg M. Synthetic carbonaceous fuels and feed-
ble role of paramagnetic states of iron carbides in the
stocks from oxides of carbon and nuclear power //
fischer-tropsch synthesis selectivity of nanosized slurry
catalysts // J. of Catalysis. 2019. V. 380. P. 32-42. https://
org/10.1016/0016-2361(78)90154-0
doi.org/10.1016/j.jcat.2019.09.033
НЕФТЕХИМИЯ том 63 № 2 2023