ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 11, с. 1658-1673
УДК 547.298.4
N,N′-ДИФЕНИЛДИТИОМАЛОНДИАМИД:
ИССЛЕДОВАНИЕ ОСОБЕННОСТЕЙ СТРОЕНИЯ,
КИСЛОТНЫХ СВОЙСТВ И ОЦЕНКА БИОЛОГИЧЕСКОЙ
АКТИВНОСТИ in silico
© 2021 г. А. Э. Синоцкоa, А. В. Беспаловa, Н. В. Пащевскаяa, В. В. Доценкоa,b,*,
Н. А. Аксеновb, И. В. Аксеноваb
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
b Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
*e-mail: victor_dotsenko_@mail.ru
Поступило в Редакцию 14 августа 2021 г.
После доработки 14 августа 2021 г.
Принято к печати 18 сентября 2021 г.
Изучены спектральные характеристики дитиомалондианилида (N,N′-дифенилдитиомалондиамида),
методом потенциометрического титрования определена константа диссоциации. Квантово-химическими
методами на уровне B3LYP-D3BJ/6-311+G(2d,p) проведен расчет молекулярной геометрии и колебатель-
ных спектров наиболее устойчивых таутомерных форм дитиомалондианилида. Рассчитаны параметры
биодоступности, методом протеин-лигандного докинга спрогнозированы возможные белковые мишени.
Ключевые слова: метиленактивные тиоамиды, дитиомалондианилид, таутомерия, потенциометрическое
определение константы диссоциации, расчетная биологическая активность
DOI: 10.31857/S0044460X21110032
Дитиомалондиамиды и, в частности, N,N′-ди-
раскрыт - имеются лишь единичные сведения о
фенилдитиомалондиамид 1 активно используются
взаимодействии дитиомалондианилида 1 с акцеп-
в различных областях химии в качестве бидентат-
торами Михаэля [23] или активными карбониль-
ных комплексообразующих агентов [1-6], ингиби-
ными соединениями [26]. Продолжая исследова-
торов коррозии стали [7], реагентов для экстрак-
ния в области химии метиленактивных тиоамидов,
ции Ag+ из хлорид-содержащих водных растворов
мы остановили свое внимание на N,N′-дифенилди-
[8], а также как исходные реагенты для синтеза
тиомалондиамиде 1 как перспективном доступном
ряда серосодержащих гетероциклических систем -
метиленактивном соединении для получения ряда
производных 1,2-дитиола [9-14], тиазола [15, 16],
гетероциклических систем.
1,3-дитиина [17-22], [1,2]дитиоло[3,4-b]пириди-
В настоящей работе с использованием экспери-
на [23], 1,2,3-тиадиазола [24], тиофена [25, 26],
ментальных и теоретических методов изучены та-
3,5-диаминопиразола [11, 26, 27] и др. (схема 1).
утомерия и геометрия молекулы дитиомалондиа-
В то же время, сравнивая N,N′-дифенилдитио-
нилида, сделано соотнесение экспериментальных
малондиамид 1 с другими метиленактивными ти-
и расчетных колебательных спектров, методом
оамидами (см. обзорные работы [28-32]), можно
потенциометрического титрования впервые экс-
отметить, что потенциал тиоамида 1 в качестве
периментально определено значение рKа дитио-
метиленактивного соединения практически не
малондианилида, а также рассчитаны параметры
1658
N,N′-ДИФЕНИЛДИТИОМАЛОНДИАМИД
1659
Схема 1.
H Ph
N
S
NHPh
ClO4
S
O
N
H
NHPh
N
S
R
N
S
Ph
Ar
Ph
NHPh
N
S
S
NC
N
S
N
N
N
H
H
H2N
N S
PhHN
H
1
Ph
S
NHPh
Ph
S
NHPh
Br
Ph
N
N
Ar
X
S
N
Ar
O
S
S
S
PhHN
Ph
Схема 2.
O O
NH2
NPh
PhHN
NHPh
PhHN
P4S10
или
S
S
C3S2
реагент
PhH
3
Лоуссона
Zn, HCl
AcOH
O
CH3
O
CH3
S
S
PhN=C=S
PhN=C=S
PhHN
CH3
N
N
CH
3
Na
H
H
S
O
O
2
1
биодоступности и спрогнозированы возможные
Zn-HCl-AcOH [9], либо реакцией ацетилацетона
протеиновые мишени для молекулы 1.
с PhN=C=S в присутствии алкоголята натрия в
EtOH, MeOH или Et2O [1, 3, 27, 40-43] (схема 2).
Известно несколько способов получения дити-
Последний способ наиболее прост в препаратив-
омалондианилида 1: соединение получают конден-
ном отношении и дает максимальные выходы.
сацией натриевой соли диацетилтиоацетанилида 2
с PhNCS [33], реакцией субсульфида углерода С3S2
Дитиомалондианилид
1 был получен нами
с анилином в инертном растворителе [34-36], вза-
по модифицированной методике [43] с выходом
имодействием малонанилида с P4S10 [24,37,38] или
97%. Реакция, очевидно, протекает как последо-
реагентом Лоуссона [39], восстановлением 3-фе-
вательность тандемных процессов тиокарбамои-
ниламино-5-фенилимино-1,2-дитиола 3 системой
лирования-кетонного расщепления (схема 3). Об-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1660
СИНОЦКО и др.
Схема 3.
O
CH3
H3C
O
H
δ+
H3C
C CH3 PhN=C=S
EtONa
PhHN
CH3
H3C
CH2
O
O
Na
S
O
O
Na
EtO
O
CH3
S
NHPh
δ+
δ+
EtOH
PhN=C=S
PhHN
CH
PhHN
CH3
PhHN
CH3
3
EtONa
δ+
-AcOEt
S
O
S
O
S
O
Na
Na
S
NHPh
S
S
PhHN
NHPhH
2O
EtOH
PhHN
CH
3
Ph
Ph
-AcOEt
N
N
S
S
-NaOH
EtONa
H
H
S
O
Na
1
EtO
PhN
PhHN
KOH
S
S
H2O-EtOH
[O]
PhHN
NHPh
S
S
Ph
Ph
N
N
S
S
H
H
S
S
1
K
PhHN
3
PhN
наружено, что использование изопропанола или
малондианилид обработкой KОН с последующим
н-бутанола в качестве растворителей резко снижа-
осаждением кислотой привела к образованию но-
ет выход дитиоамида 1: так, в случае н-бутанола
вого соединения, идентифицированного методом
выход составил всего 43%. По нашему мнению, это
спектроскопии ЯМР как 3-фениламино-5-фенили-
может быть связано с пространственными затруд-
мино-1,2-дитиол 3.
нениями при протекании кетонного расщепления с
Строение соединений 1 и 3 подтверждено дан-
более объемным нуклеофилом (i-PrO- или BuO-),
ными ИК и ЯМР спектроскопии, в том числе и
а также с ограниченной смешиваемостью указан-
двумерной спектроскопии ЯМР (1Н-13С HSQC,
ных спиртов с водой, что препятствует осаждению
1H-13C HMBC) для дитиомалондианилида 1 (см.
продукта при обработке реакционной смеси. Ин-
Дополнительные материалы). Наблюдаемые кор-
тересно отметить, что попытка очистить дитио-
реляции представлены в табл. 1.
Таблица 1. Корреляции в спектрах ЯМР 1H-13C HSQC и 1H-13C HMBC дитиомалондианилида 1
δC, м. д.
δH, м. д.
1H-13C HSQC
1H-13C HMBC
4.27 c (2Н, CH2)
62.8 (CH2)
195.4 (C=S)
7.23-7.27 м (2H, H4-Ph)
126.2* (2C4-Ph)
123.0* (2C2, 2C6-Ph)
7.40-7.43 м (4H, H3, Н5-Ph)
128.5* (2C3, 2C5-Ph)
123.0* (2C2, 2C6-Ph), 128.5* (2C3, 2C5-Ph), 139.4 (2C1-Ph)
7.86 д (4H, H2, Н6-Ph, 3J 7.6 Гц)
123.0* (2C2, 2C6-Ph)
123.0* (2C2, 2C6-Ph), 126.2* (2C4-Ph), 139.4 (2C1-Ph)
11.86 c (2H, NH)
-
62.8 (CH2), 123.0* (2C2, 2C6-Ph)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
N,N′-ДИФЕНИЛДИТИОМАЛОНДИАМИД
1661
S7
C15
C16
C10
C4
H
C3
H2
S
N5
C17
C11
N
C
N1
C9
C8
HN
C12
C2
C19
S
C18
C14
C13
S6
A
S7
S7
S6
C12
C15C16
C17
C
10
C3
N5
C19
C11
C3
C4
C13
C14
C9
C18
C2
C4
1
N5
N
N1
C8
C2
C8
C9
C15
S6
C10
C19
C14
SH
C13
C11
C18
C16
C17
C12
N
HN
H
S
H
S S
Б1
HN
NH
Б2
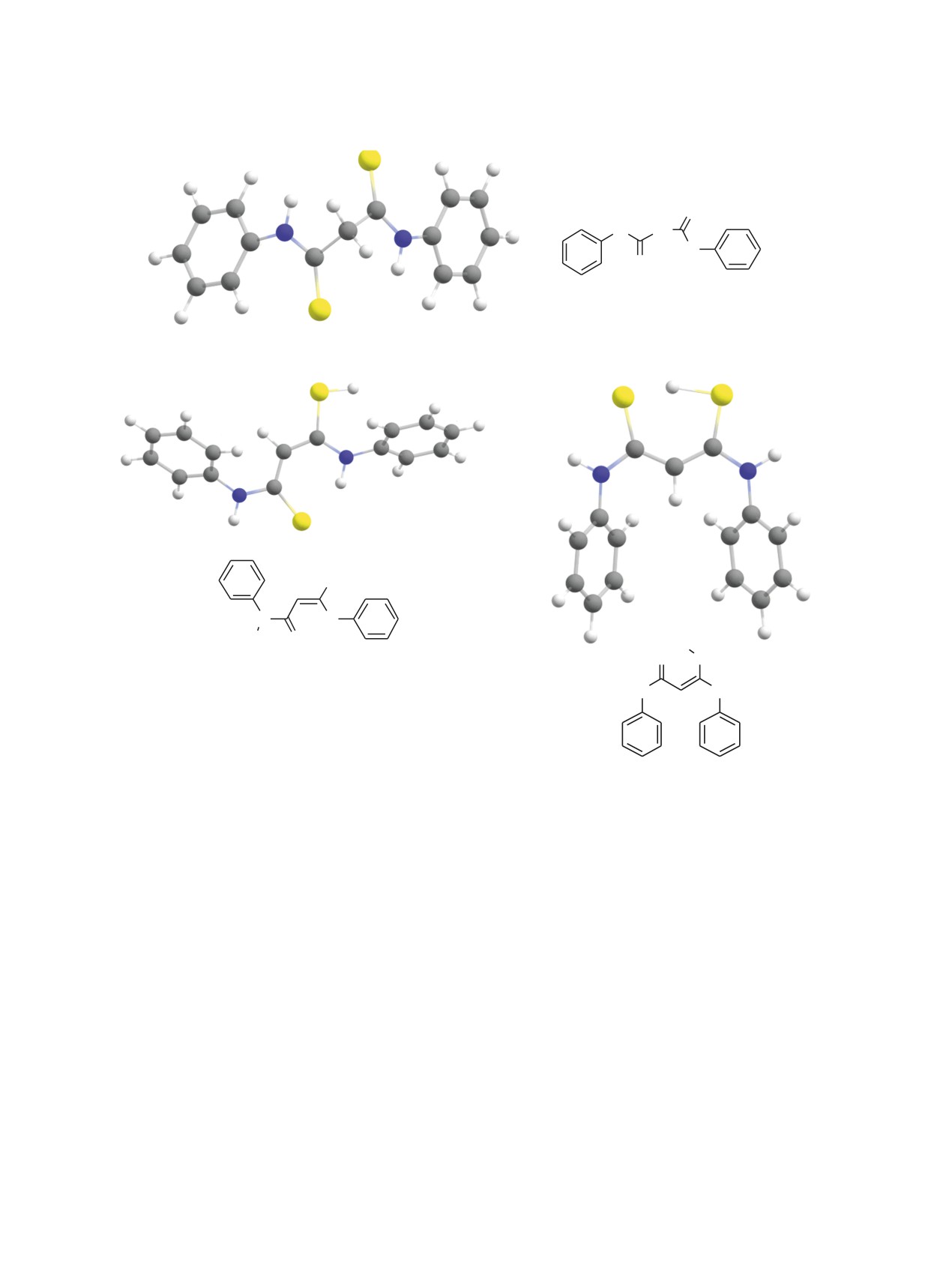
Рис. 1. Оптимизированные на уровне B3LYP-D3BJ/6-311+G(2d,p) молекулярные структуры таутомерных форм дитиома-
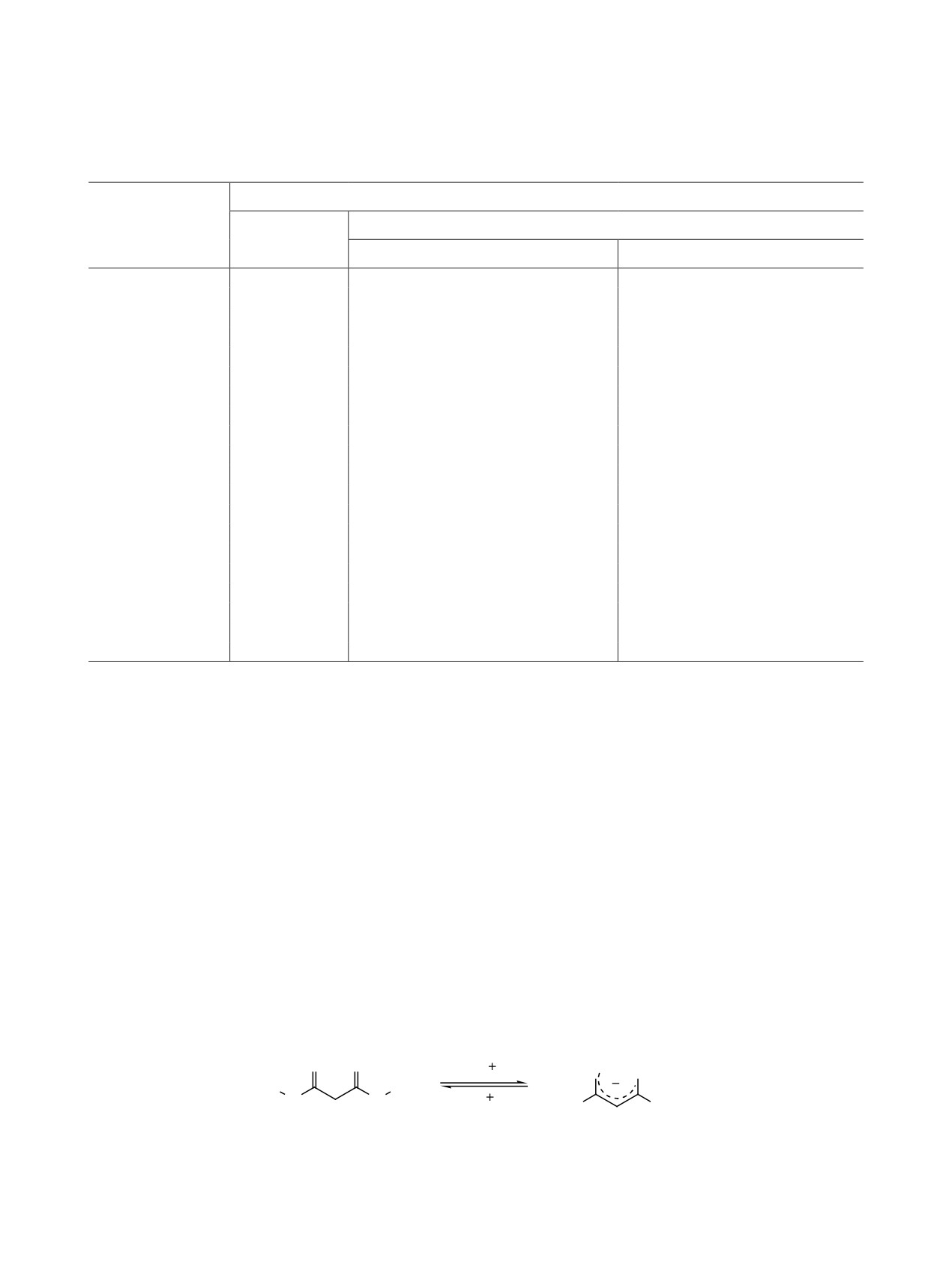
лондианилида: A - транс-дитионовая форма, Б1 - транс-изомер ентиольной формы, Б2 - цис-изомер ентиольной формы.
По данным ЯМР, в растворе ДМСО-d6 и CDCl3
ения дитиомалондианилида мы рассчитали энер-
соединение 1 существует в дитионовой форме: в
гии наиболее устойчивых таутомеров и провели
спектре не обнаруживаются сигналы ентиольных
сравнительный анализ экспериментальных и рас-
таутомеров в заметном количестве, что в целом со-
четных колебательных спектров с использованием
относится с литературными данными [44]. Следует
квантово-химических методов.
отметить, что вопросы таутомерии и конформаци-
Расчеты молекулярной геометрии и колебатель-
онного анализа дитиомалонамидов до настоящего
ных спектров таутомеров дитиомалодианилида
времени практически не изучались. Так, в един-
осуществляли в программном пакете ORCA 4.2
ственной найденной нами работе [45] были пред-
[46, 47] с использованием гибридного функцио-
ставлены исследования конформаций N,N′-диал-
нала B3LYP [48, 49] с дисперсионной поправкой
килдитиомалондиамидов на основе анализа ИК
D3BJ [50] в валентно-расщепленном базисном
спектров в растворе. Для выяснения деталей стро-
наборе 6-311+G(2d,p). Сравнение рассчитанных
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1662
СИНОЦКО и др.
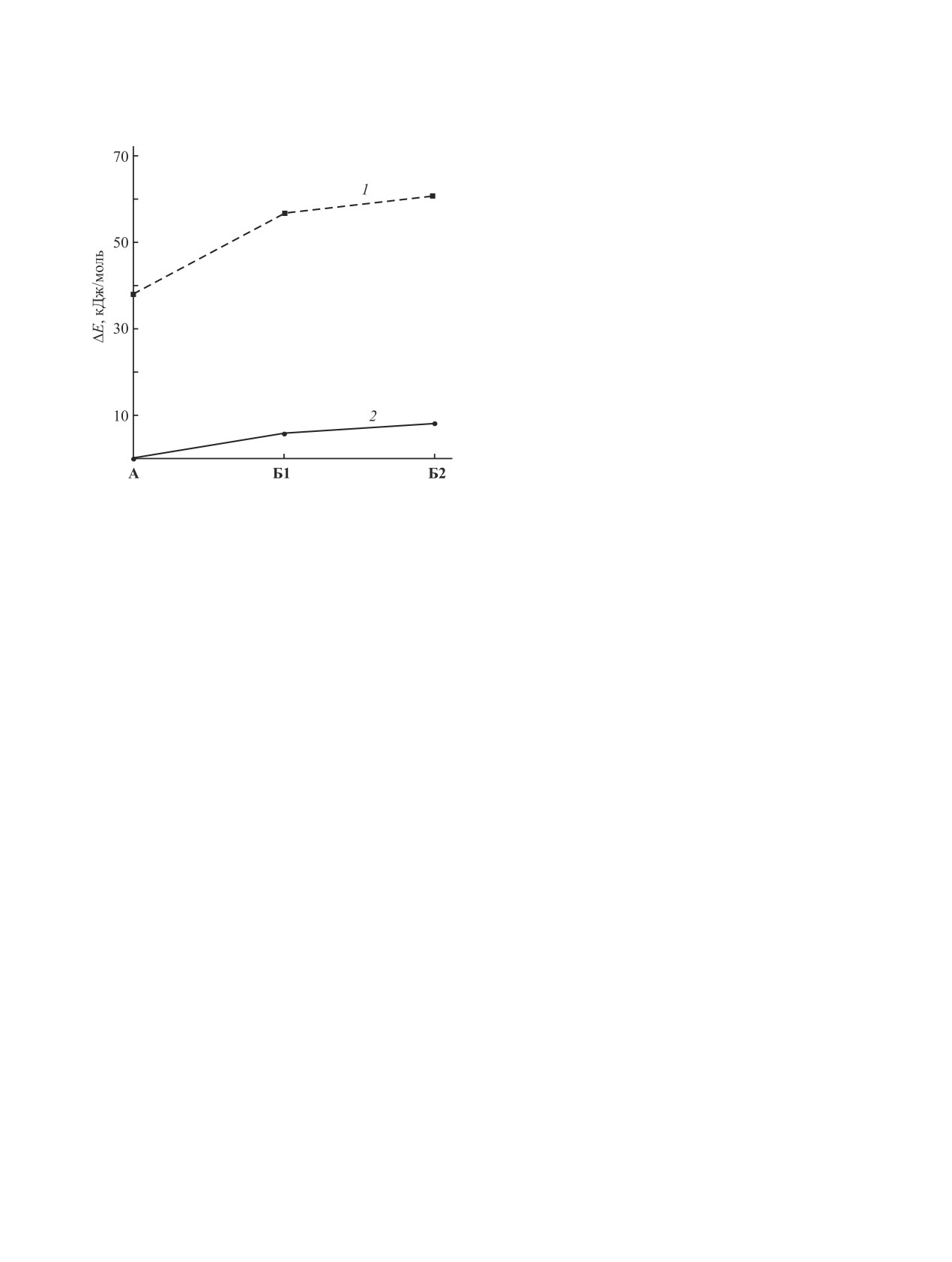
Результаты расчета энергии таутомеров приве-
дены на рис. 2. Как можно заметить, по расчетным
данным, дитионовая форма А является наиболее
устойчивой как в вакууме, так и в среде ДМСО,
что подтверждается данными спектроскопии ЯМР.
Из ентиольных форм несколько более устойчи-
вым является транс-изомер Б1, однако разница в
энергии с цис-измером Б2 невелика и составляет
4.1 кДж/моль в вакууме и 2.3 кДж/моль в ДМСО.
Следует отметить, что разница в энергии между
дитионовой формой А и ентиольными формами
Б1, Б2 в вакууме (18.7 кДж/моль) существенно
превышает аналогичную величину в среде ДМСО
(5.8 кДж/моль), что указывает на более эффектив-
ную сольватацию ентиольных форм и возмож-
ность существования таутомерного равновесия
Рис. 2. Энергии таутомеров дитиомалондианилида 1,
между формами A, Б1 и Б2. Следует отметить,
рассчитанные без учета влияния растворителя (1) и с
что образование ентиольных форм дитиоамида 1
учетом неспецифической сольватации в среде ДМСО
зафиксировано в спектрах, записанных в более по-
(2), относительно минимального значения энергии
лярном растворителе (СD3COOD) [44].
таутомера А в среде ДМСО.
Таким образом, по данным квантово-хими-
ческих расчетов, дитиомалондианилид 1 в кри-
колебательных частот с экспериментальными осу-
сталлическом состоянии должен существовать в
ществляли с учетом поправочных коэффициентов
дитионовой форме А, которая является наиболее
[0.9679 для высокочастотных (>1000 см-1) и 1.0100
устойчивой. Данные ИК спектроскопии дитио-
для низкочастотных колебаний (<1000 см-1)] [51].
малондианилида в кристаллическом состоянии
Для определения энергии сольватации исследу-
подтверждают данный вывод. Расчетный спектр
емых соединений осуществляли расчет с учетом
дитионовой формы А согласуется с эксперимен-
неспецифической сольватации в рамках моде-
тальным существенно лучше, чем расчетные спек-
ли СРСМ [52]. Все расчеты осуществляли после
тры ентиольных форм Б1 и Б2. Сравнение экс-
предварительного поиска наиболее устойчивых
периментальных значений колебательных частот
конформаций. Для генерации Input-файлов при-
дитиомалондианилида 1 с данными квантово-хи-
меняли программу Gabedit 2.5 [53]. Для визуали-
мического расчета для таутомера А представлено
зации молекулярной геометрии и колебательных
в табл. 2. Рассчитанные на уровне B3LYP-D3BJ/6-
частот использовали программу ChemCraft 1.8.
311+G(2d,p) ИК спектры различных тауто-
Молекула дитиомалондианилида может суще-
меров дитиомалондианилида
1 приведены в
ствовать в виде двух таутомерных форм - дити-
Дополнительных материалах.
оновой A и ентиольной Б. При этом ентиольная
В контексте изучения реакционной способно-
форма Б, в свою очередь, может существовать в
сти дитиомалондианилида как метиленактивного
виде Z- и E-изомеров. Для оценки устойчивости
соединения представлялось целесообразным ис-
данных форм дитиомалондианилида был произ-
следовать кислотные свойства данного соедине-
веден квантово-химический DFT-расчет энергии
наиболее устойчивых конформеров молекулы 1
ния. Следует указать, что вопросам изучения кис-
как в вакууме, так и в среде ДМСО (учет раство-
лотности метиленактивных тиоамидов посвящено
рителя производили с помощью континуумной
относительно небольшое число работ. Так, в лите-
модели CPCM). Оптимизированные молекуляр-
ратуре имеются сведения об определенных мето-
ные структуры таутомеров представлены на рис. 1.
дом потенциометрического титрования значениях
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
N,N′-ДИФЕНИЛДИТИОМАЛОНДИАМИД
1663
Таблица 2. Сравнение экспериментальных колебательных частот (спектроскопия нарушенного полного внутреннего
отражения) с данными квантово-химического расчета для дитионовой формы (таутомер А) дитиомалондианилида 1
ν, см-1
Отнесение
расчет
эксперимент
без поправочного коэффициента
с поправочным коэффициентом
N-H
3182.3
3492.9
3380.8
СAr-H
3012.6
3178.3
3076.3
–а
1595.0
1650.1
1597.1
C-Cскелетные
1595.0
1647.8
1594.9
δ(N-H)
1515.9
1586.1
1535.2
C-Cскелетные
1492.8
1532.9
1483.7
δ(CH2)
1444.6
1493.7
1445.8
C-N
1392.5
1431.3
1385.3
–а
1290.3
1361.8
1318.1
–а
1271.0
1282.5
1241.3
C=S
1110.9
1113.5
1077.8
–а
1070.4
1103.8
1068.4
–а
968.2
996.1
1006.0
–а
906.5
915.0
924.1
–а
848.6
849.3
857.8
δ(СAr-H)внепл
756.0
770.2
777.9
–а
715.5
742.8
750.2
–а
682.8
700.2
707.2
–а
545.8
557.8
563.4
–а
499.5
504.4
509.4
а Полосы поглощения соответствуют групповым колебаниям, которые сложно отнести к конкретному фрагменту молекулы.
рK цианотиоацетамида (рKа 10.34 [54], 9.46 [55]),
трования в водно-спиртовой и водно-ацетоновой
цианотиоацетанилида (рKа 8.95 [55]), этил-3-(R-
среде приведены в Дополнительных материалах.
амино)-3-тиоксопропаноатов (рKа 14.2-14.5 [56]),
Понижение буферной области кривых титрования
ряда β-(R-сульфонил)тиоацетамидов (рKа 10.03-
свидетельствует о протолитическом равновесии
13.41 [54, 55]), β-кетотиоамидов (рKа 7.04-11.70
N,N′-дифенилдитиомалонамида 1 в водно-спирто-
[54, 55, 57, 58]). При этом стоит отметить, что дан-
вом и водно-ацетоновом растворе при рН больше
ные о кислотных свойствах дитиомалондиамидов
8 (схема 4).
в литературе отсутствуют.
Предварительную оценку константы протони-
Константу протонирования N,N′-дифенилди-
рования проводили по значениям эксперименталь-
тиомалондиамида 1 определяли методом потен-
ных точек кривых титрования двумя методами:
циометрического титрования в водно-спиртовой
(1:2 по объему) и водно-ацетоновой (1:2 по объ-
прямым расчетом и по методу Бьеррума. Прямой
ему) среде. Кривые потенциометрического ти-
расчет проводили согласно уравнению (1).
Схема 4.
S
S
-H
S
S
Ph
Ph
N
N
+H
PhHN
NHPh
H
H
1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1664
СИНОЦКО и др.
+
-
(1−a)c
−[H
]+[OH
]
1.0
HL
(1)
lgK
=
lg
+pH.
2
1
ac
+[H+]−[OH−]
HL
0.8
Здесь а - степень нейтрализации, рассчитываемая
0.6
по формуле (2).
0.4
V ⋅c
-
-
OH OH
a
=
(2)
V
⋅c
0.2
O HL
Здесь сHL - концентрация дитиомалондианилида 1,
6
10
14
моль/л; сОН- - концентрация щелочи, моль/л; VO -
pH
объем титруемого раствора, мл.
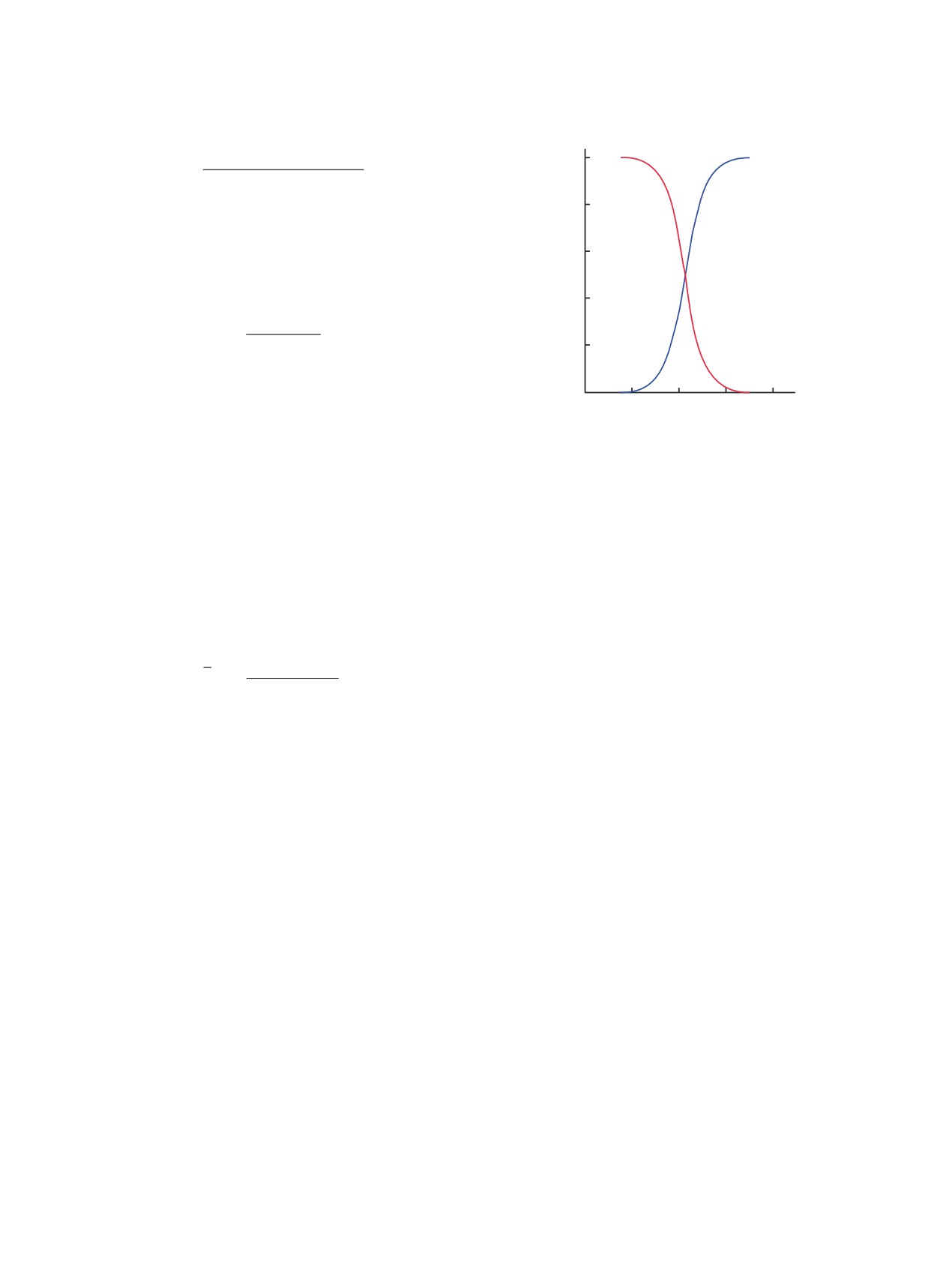
Рис. 3. Кривые распределения протонированной (1) и
По результатам прямого расчета среднее
депротонированной (2) форм дитиомалондианилида 1
значение логарифма константы протонирова-
при различных значениях рН раствора.
ния N,N′-дифенилдитиомалонамида
1 равно
рKа 10.28±0.02 в водно-спиртовой среде и рKа
10.25±0.02 в водно-ацетоновой среде.
Имеющиеся в литературе данные о биологиче-
При определении константы протонирования
ском действии дитиомалондиамидов фрагментар-
соединения 1 по методу Бьеррума среднее лиганд-
ны. Так, ряд дитиомалонамидов и их комплексов
ное число рассчитывали по уравнению (3).
обладает фунгицидной активностью в отношении
Botrytis cinerea и возбудителей ложной мучнистой
росы винограда [59]. Также сообщается [60] об
V ⋅c
-
HL OH
(3)
n
=1−
антибактериальном действии ряда производных
(V
+V
)c
O HL HL
малоновой кислоты, включая замещенные дитио-
малондианилиды. Производные 1,2-дитиола, в том
n - среднее лигандное число Бьеррума.
числе и продукты окисления малондитиоамидов,
По полученным значениям были построены
представляют значительный интерес в первую
n
очередь как активные антираковые препараты из-
от pH в водной-спиртовой и в водно-ацетоновой
за присущего им репаративного действия в отно-
среде (см. Дополнительные материалы). Сред-
шении ДНК [61-66].
ние значения констант протонирования состави-
Мы провели предварительные расчеты возмож-
ли рKа 10.30±0.05 в водно-спиртовой среде и рKа
ных протеиновых мишеней, параметров ADMET
10.28±0.07 в водно-ацетоновой среде. Точные ве-
и параметров соответствия критериям биодоступ-
личины констант протонирования N,N′-дифенил-
ности для дитиомалондианилида 1 и 3-фенилами-
10.30±0.02 в
дитиомалонамида 1 составили рKа
но-5-фенилимино-1,2-дитиола 3. Анализ струк-
10.28±0.04 в водно-
водно-спиртовой среде и рKа
тур на соответствие «правилу пяти» К. Липински
ацетоновой среде.
[молекулярная масса (MW) ≤ 500, сLogP ≤ 5.0,
По полученному значению константы прото-
TPSA ≤ 140 Å2, число акцепторов водородных
нирования дитиомалондианилида была построе-
связей ≤ 10, доноров ≤ 5] [67-69] проведен с ис-
на диаграмма распределения протонированной и
пользованием программного сервиса OSIRIS
депротонированной форм лиганда в зависимости
Property Explorer [70]. Рассчитаны параметры:
от рН (рис. 3). Из диаграммы, представленной на
растворимость (logS), сLogP [логарифм коэффи-
рис. 3, следует, что дитиомалондианилид 1 суще-
циента распределения между н-октанолом и водой
ствует в водно-спиртовом растворе преимуще-
lg(coctanol/cwater)], растворимость (lgS), площадь то-
ственно в депротонированной форме при рН > 8.
пологической полярной поверхности (Topological
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
N,N′-ДИФЕНИЛДИТИОМАЛОНДИАМИД
1665
Таблица 3. Риски токсичности и физико-химические параметры соединений 1 и 3, спрогнозированные с помощью
сервиса OSIRIS Property Explorer
Риск токсичностиа
Физико-химические параметры
Соединение
А
В
С
D
сLogP
logS
MW
TPSA
drug-likeness
drug score
1
-
-
-
-
3.15
-5.08
286
88.24
-1.81
0.38
3
-
-
-
-
3.75
-4.04
284
74.99
-0.90
0.48
а Знаком «+» показан высокий риск токсичности, «±» - умеренный риск, «-» - отсутствие токсичности. A - мутагенность, B - кан-
церогенность, С - раздражающее действие, D - репродуктивные эффекты.
Таблица 4. Риски токсичности, параметры ADMET и биодоступности соединений 1 и 3
Острая токсичность
б
(крысы), ЛД50
Ингибирование цитохромов Р450а
Тест
Эймсаa
IP
IV
Oral‡
1
+
+
+
+
+
-
+
+
0.340
-0.49
0.726
0.9108
0.8061
0.9691
0.8561
0.5749
0.7075
0.6606
0.5626
627.4
92.7
1524.0
3
+
+
+
+
-
+
-
+
0.009
-0.594
0.565
0.9397
0.8430
0.8344
0.8049
0.5928
0.5174
0.6330
0.7470
290.3
72.37
1044.0
а Знаком «+» или «-» показано наличие или отсутствие эффекта, число означает вероятность эффекта в долях от единицы.
б IP (IntraPeritoneal) - внутрибрюшинное введение, IV (IntraVenous) - внутривенное введение, Oral - пероральное введение.
Polar Surface Area, TPSA), ряд токсикологических
SwissADME [71], admetSAR [72] и GUSAR [73].
характеристик - рисков побочных эффектов (му-
Полученные расчетные данные представлены в
тагенные, онкогенные, репродуктивные эффекты),
табл. 4. В целом, оценка острой токсичности по-
параметр сходства с известными лекарственными
зволяет отнести соединения 1 и 3 к IV и V классам
препаратами (drug-likeness), а также общая оценка
опасности согласно критериям OECD [74].
фармакологического потенциала соединения (drug
Расчет вероятной антибактериальной активно-
score). Полученные расчетные данные представле-
сти с помощью сервиса Way2Drug AntiBac-Pred
ны в табл. 3. Как следует из таблицы, соединения
[75, 76] указывает на высокий потенциал дитиома-
1 и 3 полностью соответствует критериям перо-
лонанилида 1 как противомикробного агента в от-
ральной биодоступности, не обнаруживают про-
ношении возбудителя брюшного тифа Salmonella
гнозируемого риска токсичных эффектов, и имеют
typhi (С 0.8108), сенной палочки Bacillus subtilis
достаточно высокие предсказанные значения по-
(С 0.7994), чумной палочки Yersinia pestis (С
казателя фармакологического потенциала соеди-
0.5138) [показатель confidence (С) рассчитывается
нения (drug score).
как превышение вероятности активности над ве-
Для прогнозирования параметров ADMET
роятностью неактивности, PA > PI]. Для 1,2-дити-
также использовались программные пакеты
ола 3 ожидается наиболее вероятная активность в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1666
СИНОЦКО и др.
Таблица 5. Результаты прогнозирования протеин-лигандного взаимодействия для соединений 1 и 3
Соединение
4rqv
O15530
0.141
-16.978
0.268
1c5z
P00749
0.111
-17.425
0.242
5o2d
Q460N5
0.074
-21.280
0.233
4twp
P00519
0.081
-18.401
0.219
2gwh
O75897
0.052
-21.977
0.217
1q20
O00204
0.058
-20.535
0.212
H
N
S
1uwj
P15056, P15056
0.068
-18.726
0.209
H
3nyx
P29597
0.064
-19.158
0.208
N
3rx3
P15121
0.045
-21.513
0.207
S
6mom
Q9NWZ3
0.064
-18.916
0.206
1
6n8s
Q6P1M3
0.049
-20.850
0.205
4fmw
Q8TBZ6
0.047
-21.048
0.205
1ydr
P61925
0.076
-17.220
0.205
2reo
Q6IMI6
0.044
-21.302
0.204
5tx5
Q13546
0.047
-20.938
0.204
4jvl
P49888
0.047
-20.893
0.204
2onl
P49137, Q16539
0.059
-19.291
0.204
6e2n
Q99683, Q99683
0.064
-18.560
0.203
5ek0
Q15858, Q15858, Q15858, Q15858
0.052
-20.089
0.203
5mwy
P08235
0.061
-18.834
0.202
4rqv
O15530
0.147
-15.466
0.263
4nns
P15090
0.117
-15.670
0.235
5ewv
P55201
0.102
-17.041
0.229
5m0c
P61925
0.090
-18.235
0.226
5d0r
Q96PN6
0.092
-17.629
0.225
5o2d
Q460N5
0.089
-17.852
0.223
1c5z
P00749
0.088
–17.586
0.220
4twp
P00519
0.075
-19.098
0.218
3nyx
P29597
0.066
-19.765
0.214
N
S
S
5ngz
Q9NPD8
0.080
-17.410
0.210
3mdy
O00238
0.058
-20.259
0.210
HN
5niu
Q9NZQ7, Q9NZQ7
0.050
-21.190
0.209
2gwh
O75897
0.050
-21.143
0.209
3
6c4d
Q13546
0.048
-21.251
0.207
5dft
P02751, P02751, P02751, P02751,
0.058
-19.680
0.206
P02751
4d83
P56817
0.081
-16.647
0.206
4y85
P41279, P41279
0.048
-20.967
0.205
6cnx
Q99986
0.061
-19.162
0.205
1g3m
P49888
0.052
-20.300
0.204
6gqo
P35968
0.060
-19.198
0.204
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
N,N′-ДИФЕНИЛДИТИОМАЛОНДИАМИД
1667
отношении Yersinia pestis (С 0.3938) и возбудите-
роль в патогенезе хронического миелоидного лей-
ля туберкулеза Mycobacterium bovis, штамм BCG
коза [88-90]. Ингибиторы тирозин-киназы TYK2
(С 0.2291).
могут быть использованы для лечения псориаза,
системной красной волчанки и ревматоидного ар-
Возможные протеиновые мишени для получен-
трита [91-93].
ных соединений были спрогнозированы с исполь-
зованием нового протокола протеин-лигандного
Минимум расчетной энергии связывания
докинга GalaxySagittarius [77] на базе веб-сервера
для
дитиомалондианилида
1
(ΔGbind
=
GalaxyWeb [78, 79]. 3D-Структуры соединений
–21.977 ккал/моль) и одно из наименьших значений
были предварительно оптимизированы средства-
для 1,2-дитиола 3 (ΔGbind = -21.143 ккал/моль) от-
ми молекулярной механики в силовом поле ММ2
мечается в случае протеиновой мишени SULT1C2
для выбора оптимальной геометрии и минимиза-
(PDB ID 2gwh) - сульфотрансферазы, регулирую-
ции энергии. Докинг с использованием протокола
щей метаболизм ксенобиотиков фенольного типа
GalaxySagittarius проводился в режимах Binding
[94]. В целом, соединения 1 и 3 представляют ин-
compatability prediction и Re-ranking using docking.
терес как перспективные объекты для скрининга
В табл. 5 представлены результаты докинга по
с целью поиска новых агентов, в первую очередь,
каждому из соединений 1, 3 для 20 комплексов
для терапии различных вирусных, аутоиммунных
протеиновая мишень-лиганд с минимальным зна-
и онкологических заболеваний.
чением свободной энергии связывания ΔGbind и
Таким образом, в настоящей работе прове-
наилучшей оценкой протеин-лигандного взаимо-
ден детальный анализ особенностей строения и
действия. Прогнозируемые протеиновые мишени
свойств дитиомалондианилида: получены новые
указаны с помощью ID-идентификаторов в Protein
спектральные характеристики, впервые экспери-
Data Bank (PDB) и в базе данных UniProt. Общи-
ментально определен показатель кислотности,
ми рецепторами для соединений 1, 3 являются
расчетными методами выявлены наиболее устой-
3-фосфоинозитид-зависимая протеинкиназа PDK1
чивые таутомерные формы. Для наиболее устой-
(PDB ID 4rqv), урокиназный активатор плазми-
чивых таутомерных форм рассчитаны ИК спектры,
ногена (uPA) (PDB ID 1c5z), полимераза PARP14
проведен их сравнительный анализ с эксперимен-
(poly(ADP-ribose) polymerase 14, PDB ID 5o2d),
тальными спектрами. Показано, что в кристалли-
мутантная (T315I) Bcr-Abl1 тирозинкиназа (PDB
ческим виде дитиомалондианилид существует в
ID 4twp), тирозин-протеинкиназа TYK2 (PDB ID
дитионной форме, тогда как в растворе возможно
3nyx) (рис. 4).
существование ентиольных таутомеров. Для ди-
тиомалондианилида и продукта его окисления,
Протеинкиназа PDK1 играет важную роль в
клеточных процессах, в том числе приводит к ак-
3-фениламино-5-фенилимино-1,2-дитиола, прове-
тивации сигнального пути PI3K, что сопряжено с
ден расчет токсичности и параметров биодоступ-
ности, методом молекулярного докинга отобраны
избыточной пролиферацией клеток [80, 81]. Уро-
наиболее вероятные протеиновые мишени. Исхо-
киназный активатор плазминогена (uPA) - проте-
дя из полученных данных, дитиомалондианилид
аза, связанная с развитием метастаз; ингибиторы
и 3-фениламино-5-фенилимино-1,2-дитиол пред-
uPA представляют интерес как перспективные
ставляют интерес для дальнейших исследований
агенты для терапии рака простаты и груди [82-84].
в области поиска антибактериальных препаратов
Полимераза PARP14 является перспективной ми-
и новых средств терапии различных форм онкоза-
шенью для разработки препаратов для терапии
болеваний.
диффузной крупноклеточной B-клеточной лим-
фомы, множественной миеломы, рака простаты и
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
гепатоцеллюлярной карциномы, а также аллерги-
ческих воспалительных процессов [85]. Наряду с
ИК спектры получали на спектрометре Bruker
этим, PARP14 играет важную роль в репликации
Vertex 70 с приставкой НПВО методом нарушен-
вирусов [86] и регулирует интерфероновый отклик
ного полного внутреннего отражения на кристал-
на вирусную инфекцию SARS-CoV-2 [87]. Мутант-
ле алмаза, погрешность ±4 см-1. Спектры ЯМР
ная Bcr-AblT315I-тирозинкиназа играет ключевую
регистрировали на приборе Bruker Avance III HD
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1668
СИНОЦКО и др.
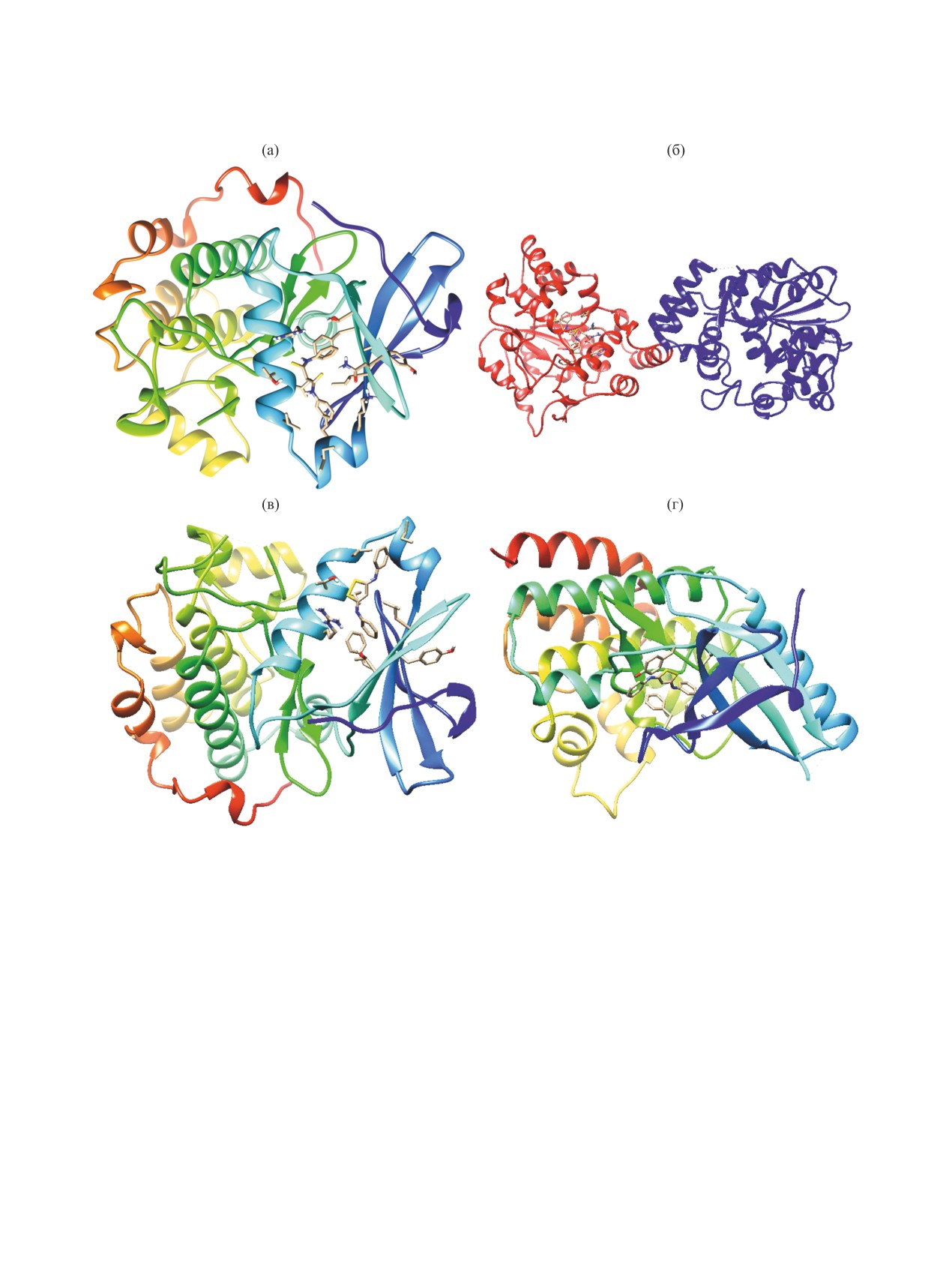
Рис. 4. Прогнозируемая структура протеин-лигандных комплексов для дитиомалондианилида 1 и протеинкиназы PDK1
(PDB ID 4rqv) (а), дитиомалондианилида 1 и сульфотрансферазы SULT1C2 (PDB ID 2gwh) (б), 1,2-дитиола 3 и протеинки-
назы PDK1 (PDB ID 4rqv) (в), 1,2-дитиола 3 и тирозин-протеинкиназы TYK2 (PDB ID 3nyx) (г) (получено с использованием
протокола GalaxyWeb Sagittarius). Молекулярная графика визуализирована с использованием программного комплекса
UCSF Chimera [95, 96].
400MHz [400.17 (1Н), 100.63 МГц (13С)] в растворе
Этанол абсолютировали кипячением с метал-
ДМСО-d6 и CDCl3, в качестве стандарта использо-
лическим кальцием с последующей перегонкой.
вали остаточные сигналы растворителя. Индиви-
N,N′-Дифенилдитиомалондиамид
(1) полу-
дуальность полученных образцов контролировали
чали по модифицированной методике, основан-
методом ТСХ на пластинах Сорбфил-А («ООО
ной на патенте [43]. К абсолютированному EtOH
Имид», Краснодар), элюент - ацетон-петролейный
(50 мл) добавляли 0.96 г (0.042 моль) металличе-
эфир (3:5), проявитель - пары иода, УФ детектор.
ского натрия; к свежеполученному раствору эти-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
N,N′-ДИФЕНИЛДИТИОМАЛОНДИАМИД
1669
лата натрия приливали 4.28 мл (0.042 моль) све-
c (1H, NH). Спектр ЯМР 13С (ДМСО-d6), δC, м.
жеперегнанного ацетилацетона при 25°С. Раствор
д.: 113.1 (C4), 121.2 (2C2, 2C6-Ph), 122.8 (2C4-Ph),
перемешивали 5 мин до завершения образования
128.5 (2C3, 2C5-Ph), 145.1 (2C1-Ph). Сигнал С3 (С5)
ацетилацетоната натрия, затем добавляли 10.0 мл
не обнаруживается, вероятно, вследствие быстрых
(0.084 моль) фенилизотиоцианата. Смесь переме-
таутомерных переходов. Найдено, %: C 63.37; H
шивали 2 ч и оставляли на ночь при 25°С. Полу-
4.33; N 9.83. C15H12N2S2. Вычислено, %: C 63.35;
ченный желто-оранжевый раствор выливали в
H 4.25; N 9.85. M 284.40.
100 мл ледяной воды и перемешивали до образова-
рН-Потенциометрическое
титрование
ния лимонно-желтого осадка дитиомалондианили-
водно-спиртовых и водно-ацетоновых
(1:2 по
да 1. Осадок отфильтровывали, промывали EtOH,
объему) растворов N,N′-дифенилдитиомалонди-
сушили при 50°С и получали 8.21 г тиоанилида 1.
амида 1 проводили с использованием иономера
Из маточного раствора через 24 ч дополнительно
ЭКСПЕРТ-001-1 с комбинированным стеклян-
отфильтровывали еще 3.38 г продукта. Суммар-
ным электродом ЭСК-10603 в термостатирован-
ный выход дитиомалондианилида составил 11.59 г
ной ячейке при 25±0.1°С и ионной силе раствора
(97%), порошок желтого цвета, т. пл. 150-152°С, Rf
0.1 М. KCl. В качестве титранта использовали
0.42. Соединение для аналитических целей может
освобожденный от карбонатов 1 М. раствор KОН,
быть очищено перекристаллизацией из горячего
точную концентрацию которого устанавливали по
EtOH или смеси ацетон-гептан, 1:1. Дитималон-
1 М. раствору HCl. Для определения констант про-
дианилид хорошо растворим в ацетоне, EtOAc,
тонирования титровали смеси N,N′-дифенилдити-
ДМСО и ДМФА, умеренно растворим в горячем
омалондиамида 1 (сHL 0.01 М.) и соляной кисло-
EtOH, нерастворим в воде. ИК спектр, ν, см-1:
ты (сHCl 0.1 M.), избыток которой требовался для
1111 (С=S), 1595 (C-C), 3013 (СAr-H), 3182 (N-H).
перевода N,N′-дифенилдитиомалондиамида 1 в
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 4.27 c (2Н,
полностью протонированную форму в начальный
CH2), 7.23-7.27 м (2H, H4-Ph), 7.40-7.43 м (4H, H3,
момент титрования.
Н5-Ph), 7.86 д (4H, H2, Н6-Ph, 3J 7.6 Гц), 11.86 c (2H,
NH). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 4.22 с (2Н,
ИНФОРМАЦИЯ ОБ АВТОРАХ
CH2), 7.26-7.30 м (2H, H4-Ph), 7.38-7.42 м (4H, H3,
Синоцко Анна Эдуардовна, ORCID: https://
Н5-Ph), 7.72 д (4H, H2, Н6-Ph, 3J 7.8 Гц), 10.17 c
orcid.org/0000-0003-4625-8798
(2H, NH). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δC,
м. д.: 62.8 (CH2), 123.0* (2C2, 2C6-Ph), 126.2* (2C4-
Беспалов Александр Валерьевич, ORCID:
Ph), 128.5* (2C3, 2C5-Ph), 139.4 (2C1-Ph), 195.4
(C=S). Здесь и далее звездочкой отмечены сигна-
Пащевская Наталья Вячеславовна, ORCID:
лы в противофазе. Спектр ЯМР 13С (CDCl3), δC, м.
д.: 66.7 (CH2), 123.2 (2C2, 2C6-Ph), 127.3 (2C4-Ph),
Доценко Виктор Викторович, ORCID: http://
129.0 (2C3, 2C5-Ph), 138.2 (2C1-Ph), 193.8 (C=S).
orcid.org/0000-0001-7163-0497
Найдено, %: C 62.87; H 4.99; N 9.75. C15H14N2S2.
Аксенов Николай Александрович, ORCID:
Вычислено, %: C 62.90; H 4.93; N 9.78. M 286.42.
3-Фениламино-5-фенилимино-1,2-дити-
Аксенова Инна Валерьевна, ORCID: http://
ол (3). Смесь дитиомалондианилида 1 (400 мг,
orcid.org/0000-0002-8083-1407
1.4 ммоль), 10 мл 10%-ного водного раствора KОН
и 25 мл EtOH перемешивали и оставляют на 72
БЛАГОДАРНОСТЬ
ч, после чего нейтрализовали АсОН. Осадок от-
фильтровывали, промывали водным EtOH и пе-
Исследования проведены с использованием
тролейным эфиром. Получали 251 мг (63%) дити-
оборудования научно-образовательного центра
ола 3 в виде порошка желто-оранжевого цвета, Rf
«Диагностика структуры и свойств наноматериа-
0.52. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 6.94 уш.
лов» и оборудования центра коллективного поль-
c (1Н, C4H), 6.98-7.02 м (2H, H4-Ph), 7.24-7.28 м
зования «Эколого-аналитический центр» Кубан-
(4H, H3, Н5-Ph), 7.36-7.50 м (4H, H2, Н6-Ph), 11.44
ского государственного университета.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1670
СИНОЦКО и др.
ФОНДОВАЯ ПОДДЕРЖКА
12.
Schmidt U. // Chem. Ber. 1959. Vol. 92. N 5. P. 1171.
doi 10.1002/cber.19590920527
Исследование выполнено при финансовой
13.
Menabue L., Pallacani G.C. // J. Chem. Soc. Dalton
поддержке Российского фонда фундаментальных
Trans. 1976. N 5. P. 455. doi 10.1039/DT9760000455
исследований и администрации Краснодарского
14.
Breising V.M., Gieshoff T., Kehl A., Kilian V.,
Schollmeyer D., Waldvogel S.R. // Org. Lett. 2018.
края в рамках научного проекта № 19-43-230007
Vol. 20. N 21. P. 6785. doi 10.1021/acs.orglett.8b02904
р_а, а также Министерства образования и науки
15.
Грабенко А.Д., Кулаева Л.Н., Пелькис П.С. // ХГС.
Российской Федерации (тема 0795-2020-0031).
1966. Т. 2. № 3. С. 364; Grabenko A.D., Kulaeva L.N.,
Pel’kis P.S. // Chem. Heterocycl. Compd. 1966. Vol. 2.
КОНФЛИКТ ИНТЕРЕСОВ
N 3. P. 261. doi 10.1007/BF00742362
16.
Обыденнов К.Л., Головко Н.А., Костерина М.Ф.,
Авторы заявляют об отсутствии конфликта ин-
Поспелова Т.А., Слепухин П.А., Моржерин Ю.Ю.
тересов.
// Изв. АН. Сер. хим. 2014. № 6. С. 1330; Obyden-
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
nov K.L., Golovko N.A., Kosterina M.F., Pospelo-
va T.A., Slepukhin P.A., Morzherin Y.Y. // Russ. Chem.
Дополнительные материалы для этой статьи
Bull. 2014. Vol. 63. N 6. P. 1330. doi 10.1007/s11172-
доступны по doi 10.31857/S0044460X21110032 для
014-0599-2
авторизованных пользователей.
17.
Низовцева Т.В., Комарова Т.Н., Нахманович А.С.,
Ларина Л.И., Лопырев В.А., Калистратова Е.Ф. //
СПИСОК ЛИТЕРАТУРЫ
ЖОрХ. 2002. Т. 38. № 8. С. 1256; Nizovtseva T.V.
Komarova T.N.. Nakhmanovich A.S., Larina L.I.,
1. Pal T., Ganguly A., Maity D.S., Livingstone S.E. //
Lopyrev V.A., Kalistratova E.F. // Russ. J. Org.
Talanta. 1986. Vol. 33. N 12. P. 973. doi 10.1016/0039-
Chem.
2002. Vol.
38. N
8. P.
1205. doi
9140(86)80236-3
10.1023/A:1020922131002
2. Peyronel G., Pellacani G.C., Benetti G., Pollacci G. //
18.
Елохина В.Н., Ярошенко Т.И., Нахманович А.С.,
J. Chem. Soc. Dalton Trans. 1973. N 8. P. 879. doi
Ларина Л.И., Амосова С.В. // ЖОХ. 2006. Т. 76.
10.1039/DT9730000879
№ 12. С. 2005; Elokhina V.N., Yaroshenko T.I.,
3. Pal T., Ganguly A., Pal A. // J. Ind. Chem. Soc. 1988.
Nakhmanovich A.S., Larina L.I., Amosova S.V. // Russ.
Vol. 65. P. 655.
J. Gen. Chem. 2006. Vol. 76. N 12. P. 1916. doi 10.1134/
4. Pellacani G.C. // Can. J. Chem. 1974. Vol. 52. N 20. P.
S1070363206120140
3454. doi 10.1139/v74-512
19.
Низовцева Т.В., Комарова Т.Н., Нахманович А.С.,
5. Pellacani G.C., Peyronel G., Malavasi W., Menabue L. //
Лопырев В.А. // ХГС. 2002. № 9. С. 1293; Nizovtse-
J. Inorg. Nucl. Chem. 1977. Vol. 39. N 10. P. 1855. doi
va T.V. Komarova T.N.. Nakhmanovich A.S., Lopy-
10.1016/0022-1902(77)80222-4
rev V.A. // Chem. Heterocycl. Compd. 2002. Vol. 38.
6. Mиxaйлов О.В., Казымова М.А., Шумилова Т.А. //
N 9. P. 1134. doi 10.1023/A:1021273702933
ЖОХ. 2008. Т. 78. № 2. С. 279; Mikhailov O.V.,
20.
Волкова К.А., Нахманович А.С., Елохина В.Н., Яро-
Kazymova M.A., Shumilova T.A. // Russ. J. Gen.
шенко Т.К., Ларина Л.К., Шулунова A.M., Амосо-
Chem. 2008. Vol. 78. N 2. P. 258. doi 10.1134/
ва С.В. // ЖОрХ. 2007. Т. 43. № 5. С. 770; Volko-
S1070363208020138
va K.A., Nakhmanovich A.S., Elokhina V.N., Yaroshen-
7. Kumar A., Singh M.M. // Anti-Corros. Methods Mater.
ko T.I., Larina L.I., Shulunova A.M., Amosova S.V. //
1993. Vol. 40. N 12. P. 4. doi 10.1108/eb007333
Russ. J. Org. Chem. 2007. Vol. 43. N 5. P. 768. doi
8. Ortet O., Paiva A.P. // Sep. Sci. Technol. 2010. Vol. 45.
10.1134/S1070428007050211
N 8. P. 1130. doi 10.1080/01496391003697408
21.
Nizovtseva T.V., Komarova T.N., Nakhmanovich A.S.,
9. Грабенко А.Д., Кулаева Л.Н., Пелькис П.С. // ХГС.
Larina L.I., Lopyrev V.A. // Arkivoc. 2003. Vol. xiii.
1974. № 7. С. 924; Grabenko A.D., Kulaeva L.N.,
P. 191. doi 10.3998/ark.5550190.0004.d20
Pel’kis P.S. // Chem. Heterocycl. Compd. 1974.
22.
Chirkina E.A., Larina L.I., Komarova T.N. // J.
Vol. 10. N 7. P. 806. doi 10.1007/bf00471359
Organomet. Chem. 2020. Vol. 915. Article N 121242.
10. Кулаева Л.Н., Грабенко А.Д., Пелькис П.С. // ХГС.
doi 10.1016/j.jorganchem.2020.121242
1978. № 7. С. 909; Kulaeva L.N., Grabenko A.D.,
23.
Доценко В.В., Кривоколыско С.Г., Фролов К.А. //
Pel’kis P.S. // Chem. Heterocycl. Compd. 1978. Vol.
ХГС. 2015. Т. 51. № 4. С. 389; Dotsenko V.V.,
14. N 7. P. 731. doi 10.1007/BF00471638
Krivokolysko S.G., Frolov K.A. // Chem. Heterocycl.
11. Barnikow G. // Chem. Ber. 1967. Vol. 100. N 5. P. 1389.
Compd. 2015. Vol. 51. N 4. P. 389. doi 10.1007/s10593-
doi 10.1002/cber.19671000502
015-1713-6
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
N,N′-ДИФЕНИЛДИТИОМАЛОНДИАМИД
1671
24.
Bakulev V.A., Lebedev A.T., Dankova E.F., Mokru-
42.
Grabenko A.D., Pelkis P.S., Borisewitsch A.N., Kulaje-
shin V.S., Petrosyan V.S. // Tetrahedron. 1989. Vol. 45.
wa L.N. Pat. DE1225633 (1966) (ФРГ).
N 23. P. 7329. doi 10.1016/S0040-4020(01)89194-8
43.
Грабенко А.Д., Пелькис П.С., Борисевич А.Н., Кула-
25.
Obydennov K.L., Klimareva E.L., Kosterina M.F.,
ева Л. Н. А.с. № 198327 СССР (1967) // Б. И. 1967.
Slepukhin P.A., Morzherin Y.Y. // Tetrahedron Lett. 2013.
№ 14.
Vol. 54. N 36. P. 4876. doi 10.1016/j.tetlet.2013.06.127
44.
Обыденнов К.Л. Дис
канд. хим. наук. Екатерин-
26.
Barnikow G. // Lieb. Ann. Chem. 1966. Bd 700. N 1.
бург, 2015. С. 49.
S. 46. doi 10.1002/jlac.19667000107
45.
Гинзбург И.М., Дашкевич Л.Б., Кузнецов П.В., Тара-
27.
Degorce S., Jung F.H., Harris C.S., Koza P., Lecoq J.,
сов Б.П. // ЖОХ. 1975. Т. 45. № 12. С. 2705.
Stevenin A. // Tetrahedron Lett. 2011. Vol. 52. N 50.
46.
Neese F. // WIREs Comput. Mol. Sci. 2012. Vol. 2. N 1.
P. 6719. doi 10.1016/j.tetlet.2011.09.150
P. 73. doi 10.1002/wcms.81
28.
Литвинов В.П. // Усп. хим. 1999. Т. 68. № 9. С. 817;
47.
Neese F. // WIREs Comput. Mol. Sci. 2018. Vol. 8. N 1.
Litvinov V.P. // Russ. Chem. Rev. 1999. Vol. 68. N 9.
Paper e1327. doi 10.1002/wcms.1327
P. 737. doi 10.1070/RC1999v068n09ABEH000533
48.
Becke A.D. // Phys. Rev. (A). 1988. Vol. 38. N 6.
29.
Брицун В.М., Есипенко А.М., Лозинский М.О. // ХГС.
P. 3098. doi 10.1103/PhysRevA.38.3098
2008. № 12. С. 1763; Britsun V.N., Esipenko A.N.,
49.
Lee C., Yang W., Parr R.G. // Phys. Rev. (B). 1988.
Lozinskii M.O. // Chem. Heterocycl. Compd. 2008.
Vol. 37. N 2. P. 785. doi 10.1103/PhysRevB.37.785
Vol. 44. N 12. P. 1429. doi 10.1007/s10593-009-0214-x
50.
Grimme S., Ehrlich S., Goerigk L. // J. Comput. Chem.
30.
Дяченко В.Д., Дяченко И.В., Ненайденко В.Г. //
2011. Vol. 32. N 7. P. 1456. doi 10.1002/jcc.21759
Усп. хим. 2018. Т. 87. № 9. С. 1; Dyachenko V.D.,
51.
Andersson M.P., Uvdal P. // J. Phys. Chem. (A). 2005.
Dyachenko I.V., Nenajdenko V.G. // Russ. Chem. Rev.
Vol. 109. N 12. P. 2937. doi 10.1021/jp045733a
2018. Vol. 87. N 1. P. 1. doi 10.1070/RCR4760
52.
Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005.
31.
Доценко В.В., Бурый Д.С., Лукина Д.Ю., Кривоколы-
Vol. 105. N 8. P. 2999. doi 10.1021/cr9904009
ско С.Г. // Изв. АН. Сер. хим. 2020. № 10. С. 1829;
53.
Allouche A.-R. // J. Comput. Chem. 2011. Vol. 32. N 1.
Dotsenko V.V., Buryi D.S., Lukina D.Yu., Krivokolys-
P. 174. doi 10.1002/jcc.21600
ko S.G. // Russ. Chem. Bull. 2020. Vol. 69. N 10.
54.
Walter W., Meyer H.-W., Lehmann A. // Lieb. Ann.
P. 1829. doi 10.1007/s11172-020-2969-2
Chem. 1974. Bd 1974. N 5. S.765. doi 10.1002/
32.
Магеррамов А.М., Шихалиев Н.Г., Дяченко В.Д.,
jlac.197419740508
Дяченко И.В., Ненайденко В.Г. α-Цианотиоацетамид.
55.
Брицун В.М., Дорощук В.А., Богдан Н.В., Зайцев В.М.,
М.: Техносфера, 2018. 224 с.
Лозинский М.О. // Укр. хим. журн. 2007. Т. 73. № 5.
33.
Barnikow G. // J. Prakt. Chem. 1966. Bd 32. N 5-6.
С. 40.
S. 254. doi 10.1002/prac.19660320505
56.
Печенюк В.А., Кузнецов П.В., Дашкевич Л.Б. //
34.
Stock A., Praetorius P. // Chem. Ber. 1912. Bd 45. N 3.
ЖОрХ. 1975. Т. 11. № 6. С. 1345.
S. 3568. doi 10.1002/cber.191204503114
57.
Barsoum B.N., Naoum M.M. // Ind. J. Chem. (A). 1985.
35.
Stadlbauer W., Kappe T., Ziegler E. // Z. Naturforsch.
Vol. 24. N 6. P. 533.
(B). 1977. Bd 32. N 8. S. 893. doi 10.1515/znb-1977-
58.
Брицун В.М., Дорощук В.А.,Старова В.С., Ря-
0813
бицкий А.Б., Лозинский М.О. // ЖОХ. 2012. Т. 82.
36.
Stadlbauer W., Kappe T. // Sulfur Rep. 1999. Vol. 21.
№ 10. С. 1695; Britsun V.N., Doroshchuk V.A., Staro-
N 4. P. 423. doi 10.1080/01961779908047951
va V.S., Ryabitskii A.B., Lozinskii M.O. // Russ. J. Gen.
37.
Reissert A., Moré A. // Chem. Ber. 1906. Bd 39. N 3.
Chem. 2012. Vol. 82. N 10. P. 1700. doi 10.1134/
S. 3298. doi 10.1002/cber.190603903152
S1070363212100106
38.
Данкова Е.Ф., Бакулев В.А., Моржерин Ю.Ю. //
59.
Bayer H.O., Weiler E.D. US Patent 3829580 (1974).
ХГС. 1992. № 8. С. 1106; Dankova E.F., Bakulev V.A.,
60.
Rahme L., Lepine F., Maura D., Napolitano C.,
Morzherin Yu.Yu. // Chem. Heterocycl. Compd. 1992.
Felici A., Negri M., Fontana S., Andreotti D. Patent
Vol. 28. N 8. P. 931. doi 10.1007/BF00531330
WO2019/79759 (2019).
39.
Scheibye S., Pedersen B.S., Lawesson S.O. // Bull. Soc.
61.
Roebuck B.D., Liu Y.L., Rogers A.E., Groopman J.D.,
Chim. Belg. 1978. Vol. 87. N 3. P. 229. doi 10.1002/
Kensler T.W. // Cancer Res. 1991. Vol. 51. N 20. P. 5501.
bscb.19780870311
62.
Groopman J.D., DeMatos P., Egner P.A., Love-Hunt A.,
40.
Hoffmeister Marten E., Maggiulli C. A. // J. Heterocycl.
Kensler T.W. // Carcinogenesis. 1992. Vol. 13. N 1.
Chem. 1978. Vol. 15. N 8. P. 1277. doi 10.1002/
P. 101. doi 10.1093/carcin/13.1.101
jhet.5570150807
63.
Wang J.S., Shen X., He X., Zhu Y.R., Zhang B.C.,
41.
Barnikow G., Kath V., Richter D. // J. Prakt. Chem. 1965.
Wang J.B., Qian G.S., Kuang S.Y., Zarba A., Egner
Bd 30. N 1-2. S. 63. doi 10.1002/prac.19650300108
P.A., Jacobson L.P., Muñoz A., Helzlsouer K.J., Groop-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1672
СИНОЦКО и др.
man J.D., Kensler T.W. // J. Nat. Cancer Inst. 1999. Vol.
80.
Barile E., De S.K., Pellecchia M. // Pharm. pat. anal.
91. N 4. P. 347. doi 10.1093/jnci/91.4.347
2012. Vol. 1. N 2. P. 145. doi 10.4155/ppa.12.17.
64.
Chatterji T., Kizil M., Keerthi K., Chowdhury G.,
81.
Sabbah D.A., Hajjo R., Bardaweel S.K., Zhong H.A. //
Pospísil T., Gates K.S. // J. Am. Chem. Soc. 2003.
Exp. Opin. Therap. Pat. 2021. doi 10.1080/
Vol. 125. N 17. P. 4996. doi 10.1021/ja029169y
13543776.2021.1924150
65.
Kwak M.K., Wakabayashi N., Itoh K., Motohashi H.,
82.
Andreasen P.A., Kjøller L., Christensen L., Duffy M.J. //
Yamamoto M., Kensler T.W. // J. Biol. Chem. 2003.
Int. J. Cancer. 1997. Vol. 72. N 1. P. 1. doi 10.1002/
Vol. 278. N 10. P. 8135. doi 10.1074/jbc.M211898200
(SICI)1097-0215(19970703)72:1<1::AID-
66.
Jian F., Zheng J., Li Y., Wang J. // Green Chem.
IJC1>3.0.CO;2-Z
2009. Vol. 11. N 2. P. 215. doi 10.1039/b808949c
83.
Li Santi A., Napolitano F., Montuori N., Ragno P. // Int.
J. Mol. Sci. 2021. Vol. 22. N 8. P. 4111. doi 10.3390/
67.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
ijms22084111
Adv. Drug. Delivery Rev. 1997. Vol. 23. N 1-3. P. 4. doi
84.
Katz B.A., Mackman R., Luong C., Radika K., Martelli A.,
10.1016/S0169-409X(96)00423-1
Sprengeler P.A., Wang J., Chan H., Wong L. // Chem.
68.
Lipinski C.A. // Drug Discov. Today: Technologies. 2004.
Biol. 2000. Vol. 7. P. 299. doi 10.1016/S1074-
Vol. 1. N 4. P. 337. doi 10.1016/j.ddtec.2004.11.007
5521(00)00104-6
69.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
85.
Qin W., Wu H.J., Cao L.Q., Li H.J., He C.X., Zhao D.,
Adv. Drug. Delivery Rev. 2012. Vol. 64. Suppl. P. 4. doi
Xing L., Li P.Q., Jin X., Cao H.L. // Front. Pharmacol.
10.1016/j.addr.2012.09.019
2019. Vol. 10. P. 172. doi 10.3389/fphar.2019.00172
70.
Sander T. OSIRIS Property Explorer. http://
86.
Tauber A.L., Levonis S.M., Schweiker S.S. // Fut. Med.
Chem. 2020. Vol. 12. N 18. P. 1657. doi 10.4155/fmc-
Pharmaceuticals Ltd, Switzerland.
2020-0166
71.
Daina A., Michielin O., Zoete V. // Sci. Rep. 2017.
87.
Tauber A.L., Schweiker S.S., Levonis S.M. // Fut. Med.
Vol. 7. Article N 42717. doi 10.1038/srep42717
Chem. 2021. Vol. 13. N 06. P. 587. doi 10.4155/fmc-
72.
Cheng F., Li W., Zhou Y., Shen J., Wu Z., Liu G.,
2020-0226
Lee P.W., Tang Y. // J. Chem. Inf. Model. 2012. Vol. 52.
88.
Андрианов А.М., Корноушенко Ю.В., Карпенко А.Д.,
N 11. P. 3099. doi 10.1021/ci300367a
Босько И.П., Игнатович Ж.В., Королева Е.В. //
73.
Lagunin A., Zakharov A., Filimonov D., Poroikov V. //
Матем. биология и биоинформ. 2020. Т. 15. № 2. С.
Mol. Inform. 2011. Vol. 30. N 2-3. P. 241. doi 10.1002/
396. doi 10.17537/2020.15.396
minf.201000151
89.
Gibbons D.L., Pricl S., Kantarjian H., Cortes J.,
74.
OECD Environment, Health and Safety Publications
Quintás-Cardama A. // Cancer. 2012. Vol. 118. N 2.
Series on Testing and Assessment No 24. Guidance
P. 293. doi 10.1002/cncr.26225
Document on Acute oral Toxicity Testing. ENV/JM/
90.
Liu J., Zhang Y., Huang H., Lei X., Tang G., Cao X.,
Peng J. // Chem. Biol. Drug Design. 2021. Vol. 97.
officialdocuments/publicdisplaydocumentpdf/?cote=e
N 3. P. 649. doi 10.1111/cbdd.13801
nv/jm/mono(2001)4&doclanguage=en
91.
He X., Chen X., Zhang H., Xie T., Ye X.Y. // Exp.
75.
Opin. Therap. Pat. 2019. Vol. 29. N 2. P. 137. doi
antibac/. Laboratory for Structure-Function Based Drug
10.1080/13543776.2019.1567713
Design, Institute of Biomedical Chemistry (IBMC),
92.
Menet C.J. // Pharm. Pat. Anal. 2014. Vol. 3. N 4. P. 449.
Moscow, Russia.
doi 10.4155/ppa.14.23
76.
Filimonov D., Druzhilovskiy D., Lagunin A., Gloriozo-
93.
Nogueira M., Puig L., Torres T. // Drugs. 2020. Vol. 80.
va T., Rudik A., Dmitriev A., Pogodin P., Poroikov V. //
N 4. P. 341. doi 10.1007/s40265-020-01261-8
Biomed. Chem. Res. Methods. 2018. Vol. 1. N 1.
94.
Chapman E., Best M.D., Hanson S.R., Wong C.H. //
Paper e00004. doi 10.18097/bmcrm00004
Angew. Chem. Int. Ed. 2004. Vol. 43. N 27. P. 3526. doi
77.
Yang J., Kwon S., Bae S.H., Park K.M., Yoon C.,
10.1002/anie.20030063.
Lee J.H., Seok C. // J. Chem. Inf. Model. 2020. Vol. 60.
95.
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S.,
N 6. P. 3246. doi 10.1021/acs.jcim.0c00104
Greenblatt D.M., Meng E.C., Ferrin T.E. // J. Сomput.
78.
Chem. 2004. Vol. 25. N 13. P. 1605. doi 10.1002/
web server for protein structure prediction, refinement,
jcc.20084
and related methods. Computational Biology Lab,
96.
UCSF Chimera. Visualization system for exploratory
Department of Chemistry, Seoul National University,
research and analysis developed by the Resource for
S. Korea.
Biocomputing, Visualization, and Informatics at the
79.
Ko J., Park H., Heo L., Seok C. // Nucleic Acids Res.
University of California, San Francisco, US. https://
2012. Vol. 40. Iss. W1. P. W294. doi 10.1093/nar/gks493
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
N,N′-ДИФЕНИЛДИТИОМАЛОНДИАМИД
1673
N,N′-Diphenyldithiomalonodiamide: Structural Features,
Acidic Properties and in silico Estimation of Biological Activity
A. E. Sinotskoa, A. V. Bespalova, N. V. Pashchevskayaa, V. V. Dotsenkoa,b,*,
N. A. Aksenovb, and I. V. Aksenovab
a Kuban State University, Krasnodar, 350040 Russia
b North Caucasus Federal University, Stavropol, 355009 Russia
*e-mail: victor_dotsenko_@mail.ru
Received August 14, 2021; revised August 14, 2021; accepted September 18, 2021
The spectral characteristics of dithiomalondianilide (N,N′-diphenyldithiomalonodiamide) were studied, and the
dissociation constant was determined by potentiometric titration. Quantum-chemical methods at the B3LYP-
D3BJ/6-311+G (2d,p) level were used to calculate the molecular geometry and vibrational spectra of the most
stable tautomeric forms of dithiomalonodianilide. The bioavailability parameters were calculated, and possible
protein targets were predicted by the protein ligand docking method.
Keywords: methylene active thioamides, dithiomalondianilide, tautomerism, potentiometric determination of
the dissociation constant, calculated biological activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021