ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 11, с. 1679-1692
УДК 547.794.2
СИНТЕЗ
(1,2,3-ТИАДИАЗОЛ-4-ИЛ)(МЕТОКСИ)ФЕНИЛАМИНОВ
И ОСНОВАНИЙ ШИФФА С САЛИЦИЛОВЫМ
АЛЬДЕГИДОМ НА ИХ ОСНОВЕ
© 2021 г. Д. Ю. Матузко, Л. М. Певзнер*, М. Л. Петров, А. И. Поняев
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: pevzner_lm@list.ru
Поступило в Редакцию 27 августа 2021 г.
После доработки 27 августа 2021 г.
Принято к печати 18 сентября 2021 г.
Разработаны методы синтеза 4-(3-нитро-4-метоксифенил)-, 4-(2,5-диметокси-3-нитрофенил)- и 4-(2,5-ди-
метокси-4-нитрофенил)-1,2,3-тиадиазолов и изучено их восстановление до аминов цинком и уксусной
кислотой в изопропиловом спирте. На основе полученных аминов и салицилового альдегида синтези-
рованы основания Шиффа, проявляющие люминесцирующую способность.
Ключевые слова: 4-фенил-1,2,3-тиадиазолы, нитрование, восстановление, салициловый альдегид,
основания Шиффа
DOI: 10.31857/S0044460X21110056
Основания Шиффа на основе салицилового
сифенил)-1,2,3-тиадиазола [6] в связи с проявля-
альдегида проявляют высокую антибактериаль-
емой ими биологической активностью, причем
ную [1-3], противогрибковую [1, 2] и противо-
основным направлением исследований является
вирусную активность [1], в связи с чем данные
поиск подходящей группы для защиты и модифи-
соединения интенсивно изучаются в последнее
кации фенольной ОН-группы.
время. Кроме того, многие из них являются люми-
В связи с этим целью настоящей работы явилась
нофорами [3, 4], имеющими очень узкую полосу
разработка синтетического подхода к защищен-
испускания при возбуждении видимым светом
ным по кислороду производным 4-(гидроксиами-
[4], причем максимум в спектре люминесценции
нофенил)- и 4-(дигидроксиаминофенил)-1,2,3-тиа-
находится вблизи физиологического окна (700-
диазола и получение оснований Шиффа на их ос-
800 нм), что очень важно для иммунохимического
нове. На первом этапе работы в качестве исход-
анализа и фотодинамической терапии. В качестве
ного соединения был выбран 4-(4-гидроксифе-
аминокомпоненты помимо ароматических аминов
нил)-1,2,3-тиадиазол 1. Нитрование его азотной
широко используются гетероциклические [3, 4],
кислотой (d 1.5 г/мл) в среде уксусной кислоты
среди них производные 1,3,4-тиадиазолов [5]. В то
происходило с выделением тепла. Температуру ре-
же время, основания Шиффа на основе замещен-
акционной массы регулировали скоростью подачи
ных 4-(аминофенил)-1,2,3-тиадиазолов до настоя-
азотной кислоты и внешним охлаждением и под-
щего времени неизвестны. Вместе с тем большой
держивали не выше 32°С. 4-(3-Нитро-4-гидрокси-
интерес представляют производные 4-(4-гидрок-
фенил)-1,2,3-тиадиазол 2 был выделен с выходом
1679
1680
МАТУЗКО и др.
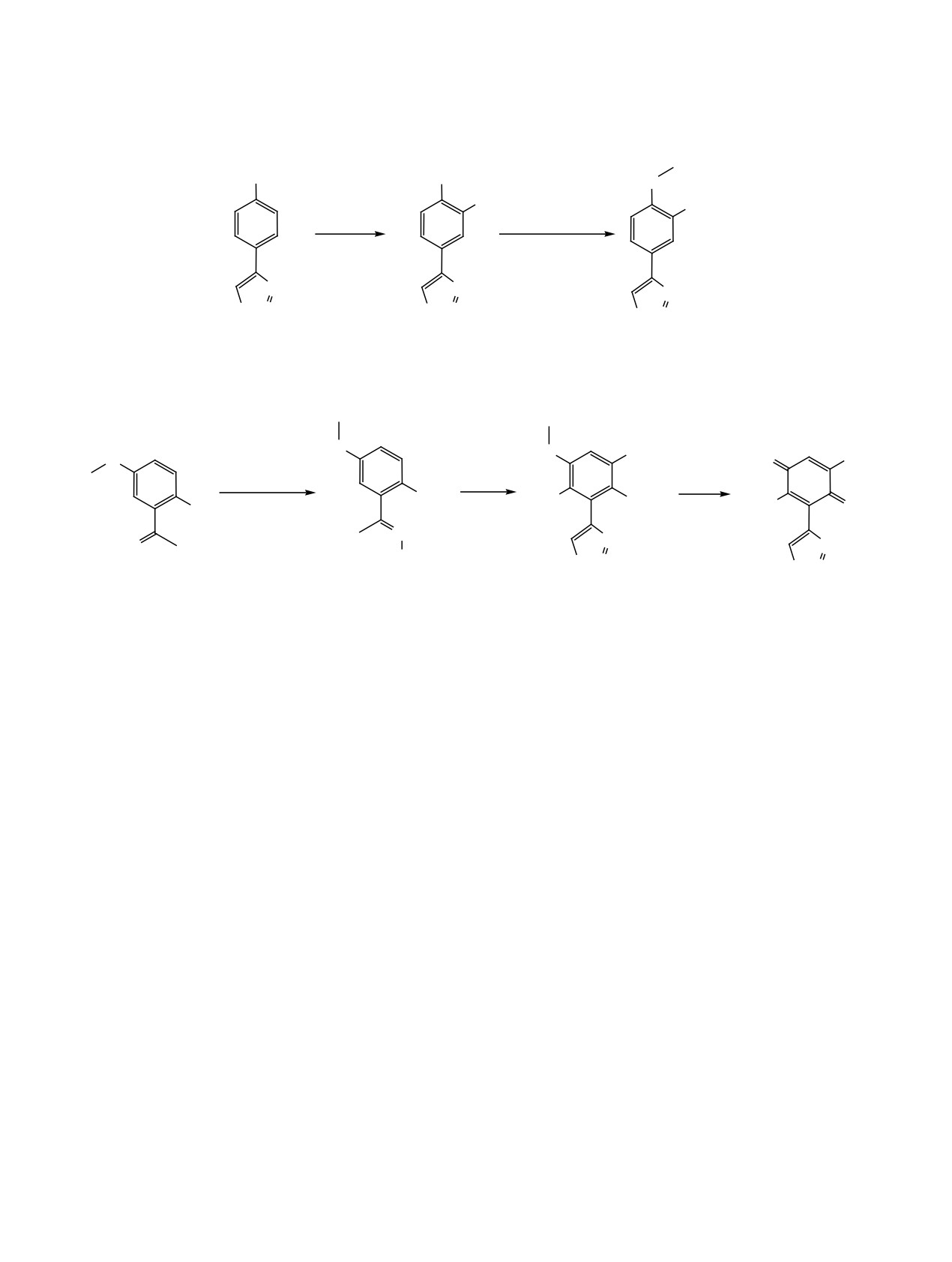
Схема 1.
OH
OH
O
NO2
NO2
(CH3O)2SO2
HNO3
AcOH
KOH, TEBA-Br
N
N
N
S N
S N
S N
2
3
1
Схема 2.
O
O
Cl
O
O
Cl
H2N-NHCO2Et
SOCl2
HNO3
OH
Cl
OH
p-TSA
Cl
O
OH
AcOH
N
N
O
N
NHCO2Et
S N
S N
4
7
5
6
92% (схема 1). В его спектре ЯМР 1Н наблюдалось
глет протонов метоксильной группы при 4.07 м. д.
три сигнала ароматических протонов при 7.28
Сигнал соответствующего ядра углерода наблю-
(1Н, Н5, JHH 8.4 Гц), 8.28 (1Н, Н6, JHH 8.4, 2.0 Гц), и
дался при 56.90 м. д.
8.61 м. д. (1Н, Н2, JHH 2.0 Гц), что однозначно до-
Следующим шагом стала разработка мето-
казывало вхождение нитрогруппы в положение 3
дов синтеза 4-(2,5-диметокси-3-нитрофенил)- и
фенильного кольца. Синглет протона Н5 тиадиазо-
4-(2,5-диметокси-4-нитрофенил)-1,2,3-тиадиазо-
ла располагался при 9.61 м. д., а сигнал гидрок-
лов. Исходя из известного 2-гидрокси-5-меток-
сильного протона - при 11.44 м. д.
сиацетофенона 4 взаимодействием с карбэтокси-
Поскольку
1,2,3-тиадиазольное кольцо чув-
гидразином был синтезирован соответствующий
ствительно к действию оснований, получение ме-
карбэтоксигидразон 5 (схема 2). Реакцию проводи-
тилового эфира фенола 3 проводили в условиях
ли в бензоле в присутствии п-толуолсульфокисло-
межфазного катализа в системе хлороформ-вода.
ты с азеотропной отгонкой воды. Целевой продукт
В качестве метилирующего агента использовали
был выделен с выходом 70%. Методика синтеза
диметилсульфат, бромид бензилтриэтиламмония
и спектральные характеристики вещества 5 под-
(TEBA-Br) служил катализатором межфазного
робно рассмотрены в Экспериментальной части.
переноса. В качестве основания использовали
Далее это соединение было введено в реакцию с
гидроксид калия в виде 0.6 н. водного раствора.
избытком хлористого тионила с целью образова-
Реакцию проводили в течение 6 ч при комнат-
ния 1,2,3-тиадиазольного кольца. Процесс прово-
ной температуре, выход 4-(3-нитро-4-метоксифе-
дили при кипячении до прекращения выделения
нил)-1,2,3-тиадиазола составил 85% (схема 1). В
газа. Оказалось, что помимо протекания реакции
спектре ЯМР 1Н полученного соединения исчезал
Хурда-Мори происходит хлорирование бензо-
сигнал гидроксильного протона и появлялся син-
льного кольца по положениям 3 и 6. Положение
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
СИНТЕЗ (1,2,3-ТИАДИАЗОЛ-4-ИЛ)(МЕТОКСИ)ФЕНИЛАМИНОВ
1681
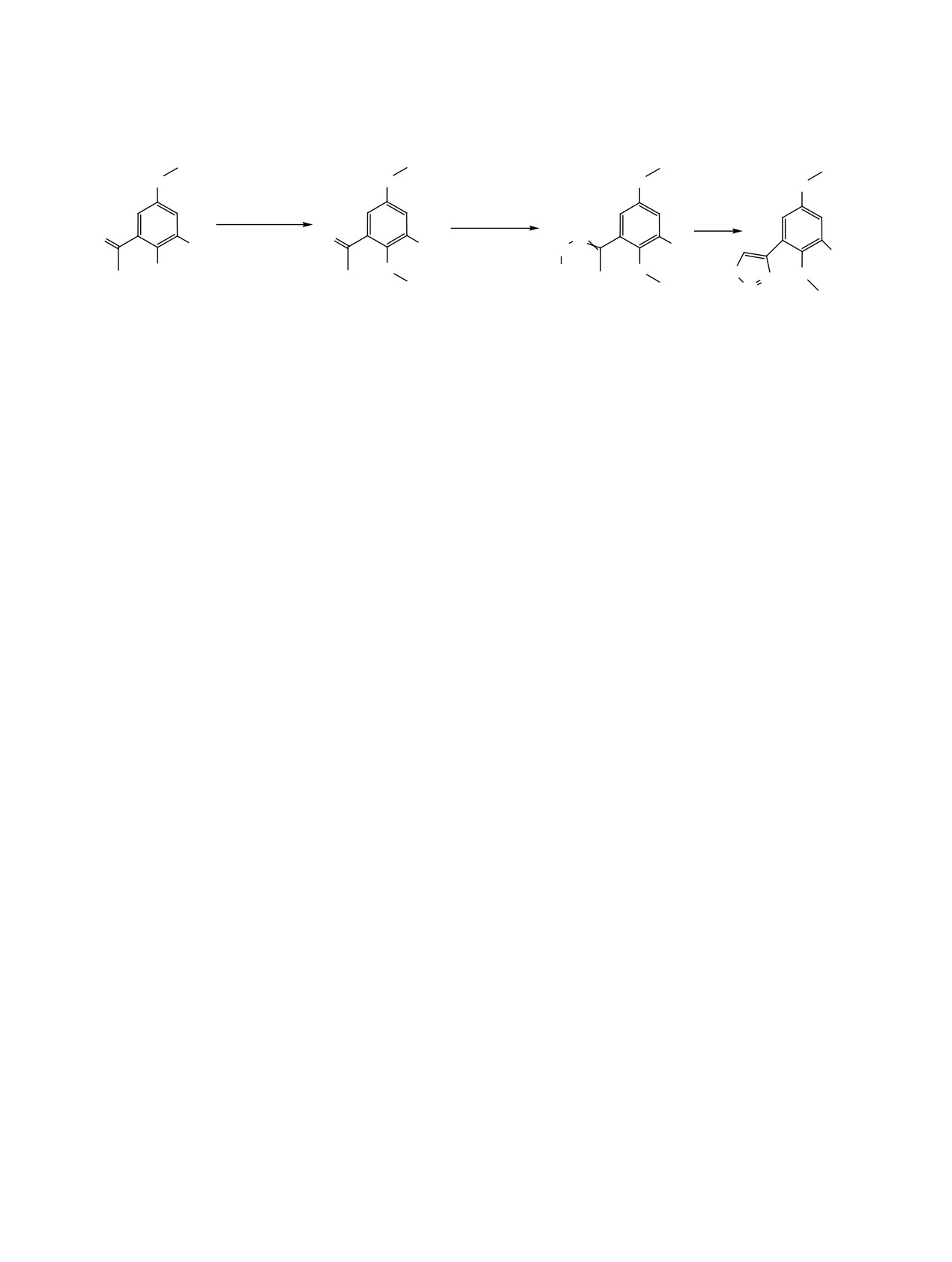
Схема 3.
O
O
O
O
(CH3O)2SO2
H2N-NHCO2Et
SOCl2
O
TEBA-Br, KOH
O
N
p-TSA
NO
NO2
HN
NO2
2
NO
2
OH
O
CO2Et
O
S
N
O
N
8
9
10
11
атомов хлора было установлено с помощью спек-
диметилсульфат, а катализатором межфазного пе-
троскопии ЯМР HMQC и HMBC. 4-(2-Гидрок-
реноса служил TEBA-Br (схема 3). Диметиловый
си-3,6-дихлор-5-метоксифенил)тиадиазол
6 был
эфир 9 был выделен с выходом 73%. Взаимодей-
выделен с выходом 69% (схема 2).
ствием с карбэтоксигидразином в присутствии
Взаимодействие тиадиазола 6 с азотной кисло-
п-толуолсульфокислоты он был превращен в карб-
этоксигидразон 10, существующий в виде смеси
той (d 1.5 г/мл) изучали в среде уксусной кисло-
син- и анти-изомеров в соотношении 0.2:1. Отне-
ты. Оказалось, что при температурах ниже 60°С
сение сигналов изомеров было сделано на основа-
признаков протекания реакции не наблюдалось.
нии литературных данных по химическим сдвигам
При 60°С начиналось небольшое выделение ни-
сигналов протонов метильных групп фрагмента
трозных газов. Реакционную массу выдерживали
СН3С=N [8-10]. Сигнал анти-изомера, у которо-
3 ч при этой температуре до завершения выделе-
го метильная группа имеет цис-расположение по
ния газа и выливали на лед. Продукт реакции был
выделен в виде желтоватых сильно электризую-
отношению к амидному фрагменту относитель-
но связи С=N, всегда находится в более сильном
щихся кристаллов с т. разл. 151°С. В его спектре
поле, чем сигнал метильной группы син-изомера.
ЯМР 1Н (ДМСО-d6) наблюдалось два синглета при
Целевой продукт был выделен с выходом 72%.
7.69 (1Н) и 9.38 м. д. (1Н, Н5-тиадиазол). Сигна-
Подробности эксперимента и отнесение сигналов
лы протонов метоксильной группы и фенольного
приведены в Экспериментальной части.
фрагмента отсутствовали. В спектре ЯМР 13С на-
блюдались сигналы ядер углерода тиадиазольного
Кипячением с избытком хлористого тионила
кольца при 135.11 (С5) и 151.90 м. д. (С4), а также
карбэтоксигидразон 10 был превращен в 4-(2,5-ди-
сигналы при 176.41 и 177.68 м. д., характерные для
метокси-3-нитрофенил)-1,2,3-тиадиазол 11 с выхо-
карбонильных групп хинона. Окончательно при-
дом 97% (схема 3). Дублеты протонов бензольного
надлежность сигналов была установлена с помо-
кольца наблюдались при 7.45 (1Н, Н6, JHH 3.2 Гц) и
щью двумерной спектроскопии HMQC и HMBC.
8.16 м. д. (1Н, Н4, JHH 3.2 Гц), а сигнал протона Н5
На основании полученных данных продукту ре-
тиадиазола располагался при 9.20 м. д.
акции была приписана структура 2-(1,2,3-тиади-
Следущим этапом работы стала разработ-
азол-4-ил)-3,6-дихлор-1,4-бензохинона 7. Состав
ка метода синтеза 4-(2,5-диметокси-4-нитрофе-
продукта был подтвержден с помощью масс-спек-
нил)-1,2,3-тиадиазола 12. Исходным соединением
трометрии высокого разрешения (ESI).
послужил 2,5-диметоксиацетофенон 13. Действи-
Было решено изменить последовательность
ем карбэтоксигидразина аналогично предыдущим
стадий и исходить из описанного 2-гидрокси-3-ни-
синтезам он был превращен в карбэтоксигидра-
тро-5-метоксиацетофенона 8 [7]. Первой стадией
зон 14 (схема 4). Целевой продукт был выделен
синтеза стало метилирование фенольной ОН-груп-
с выходом 96%. В спектрах ЯМР 1Н и 13С соеди-
пы. Реакцию проводили в условиях межфазного
нения 14 присутствует один набор сигналов, что
катализа в системе хлороформ-0.6 н. гидроксид
свидетельствует об отсутствии спектрально раз-
калия, в качестве метилирующего агента выступал
личимых изомеров. Кипячением с хлористым ти-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1682
МАТУЗКО и др.
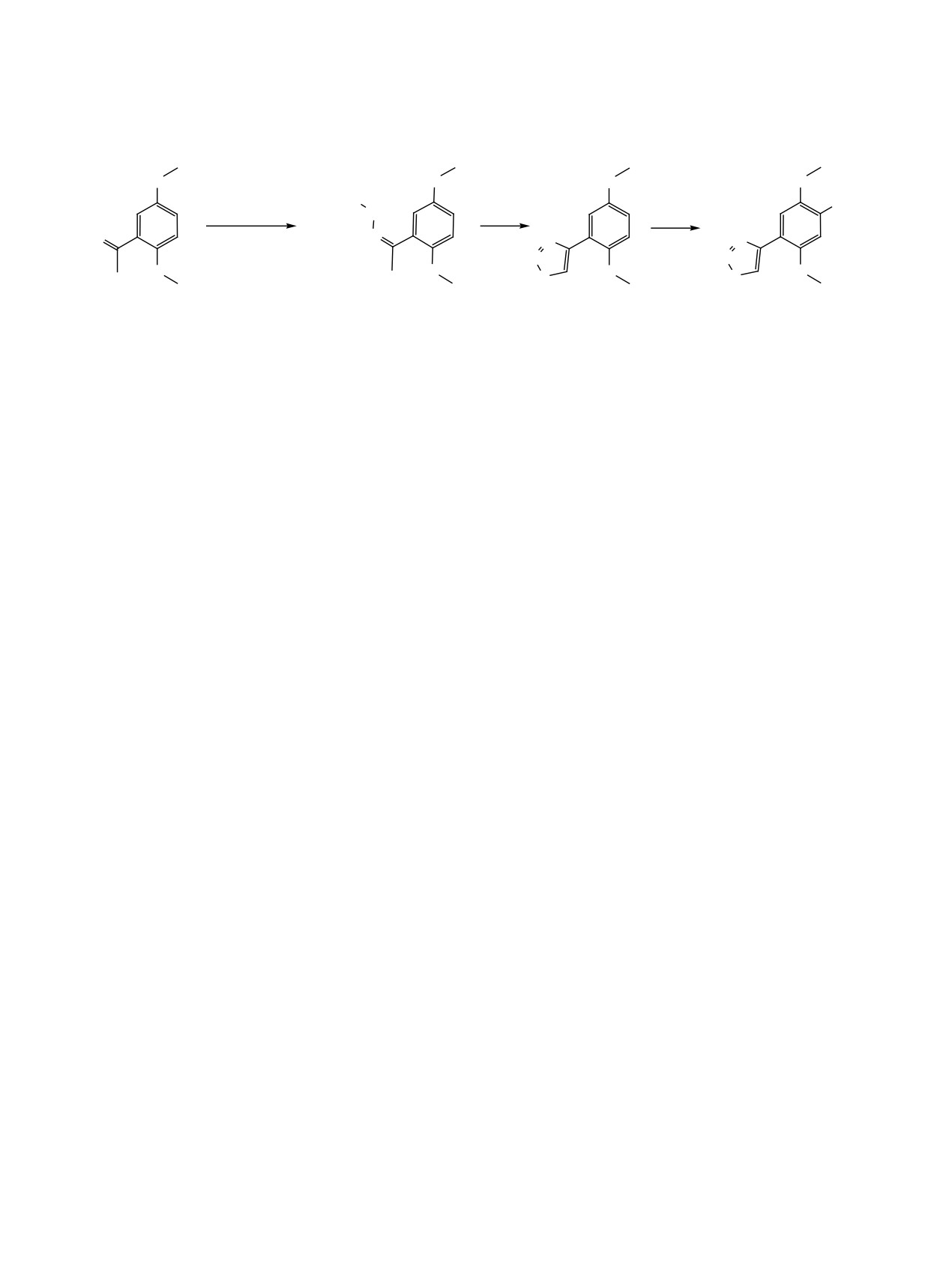
Схема 4.
O
O
O
O
EtO2C
NO2
H2N-NHCO2Et
NH
SOCl2
HNO3
O
p-TSA
N
N
AcOH
N
N
N
O
O
O
O
S
S
13
14
15
12
онилом карбэтоксигидразон 14 был превращен в
цинка и уксусной кислоты в изопропиловом спир-
4-(2,5-диметоксифенил)-1,2,3-тиадиазол 15 с вы-
те (схема 5). Мольное соотношение нитросоеди-
ходом 86% (схема 4). Хлорирования бензольного
нение-цинк-уксусная кислота составляло во всех
кольца не наблюдалось. Спектральные характе-
случаях 1:5:20, но характер протекания реакции
ристики соединения 15 приведены в Эксперимен-
существенно отличался. Так, нитросоединение 3
тальной части.
реагировал с цинком и уксусной кислотой толь-
Нитрование тиадиазола 15 проводили азотной
ко при нагревании до 50-55°С, восстановление
кислотой (d 1.5 г/мл) в среде ледяной уксусной
заканчивалось в течение 1.5 ч. Выход 4-(3-ами-
кислоты при температуре 22-29°С. Реакция проте-
но-4-метоксифенил)-1,2,3-тиадиазола 16 состав-
кала в течение 3 ч. В спектре ЯМР 1Н (CDCl3) про-
лял 63%. Нитрофенилтиадиазол 11 реагировал с
дукта реакции наблюдалось два синглета аромати-
цинком и уксусной кислотой с выделением теп-
ческих протонов при 7.64 и 8.41 м. д. Отсутствие
ла, температура реакционной смеси поднималась
взаимодействия между ними доказывает, что они
до 35°С, но для завершения реакции требовалось
находятся в пара-положении относительно друг
нагревание до 45-50°С в течение 2.5 ч. В ходе ре-
друга и, следовательно, нитрогруппа вступает в
акции затрагивается тиадиазольное кольцо, отме-
положение 4. Строение полученного продукта ре-
чается выделение сероводорода. Выход амина 17
акции было подтверждено также данными двумер-
составил всего 15%. Нитросоединение 12 восста-
ной спектроскопии HMQC и HMBC, на основании
навливается значительно легче. Выделение тепла
которых ему была приписана структура 12. Выход
в ходе реакции настолько значительно, что темпе-
целевого продукта составил 82%.
ратура реакционной смеси поднимается до 43°С.
Восстановление завершается в течение 3 ч, допол-
Образование 4-нитро-изомера в данном случае
нительного нагревания не требовалось. Амин 18
можно объяснить, приняв во внимание перенос
был выделен с выходом 42%. Физико-химические
электронной плотности от метоксильной группы в
и спектральные характеристики полученных про-
положении 2 на 1,2,3-тиадиазольное кольцо, обла-
дуктов приведены в Экспериментальной части.
дающее акцепторными свойствами. В результате
этого эффекта активация положения 3 2-метокси-
Таким образом, оказывается, что чем больше
группой оказывается меньше, чем активация по-
донорных заместителей присутствует в бензоль-
ложения 4 5-метоксигруппой, которая с 1,2,3-тиа-
ном кольце фенилтиадиазолов, тем легче протекает
диазольным фрагментом не сопряжена. Такое пе-
восстановление. Вместе с тем, при этом заметным
рераспределение электронной плотности позволя-
образом понижается устойчивость 1,2,3-тиадиазо-
ет понять вступление нитрогруппы в пара-поло-
льного кольца к действию восстановителя.
жение к электронно-акцепторному заместителю,
Исходя из полученных аминов, по реакции с са-
которое, с формальной точки зрения, должно быть
лициловым альдегидом были получены основания
более дезактивировано, чем мета-положение.
Шиффа 19-21. Реакцию аминов 16 и 18 с салици-
Нитросоединения 3, 11 и 12 были восстановле-
ловым альдегидом поводили в бензоле при кипя-
ны до соответствующих аминов 16-18 действием
чении в присутствии каталитических количеств
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
СИНТЕЗ (1,2,3-ТИАДИАЗОЛ-4-ИЛ)(МЕТОКСИ)ФЕНИЛАМИНОВ
1683
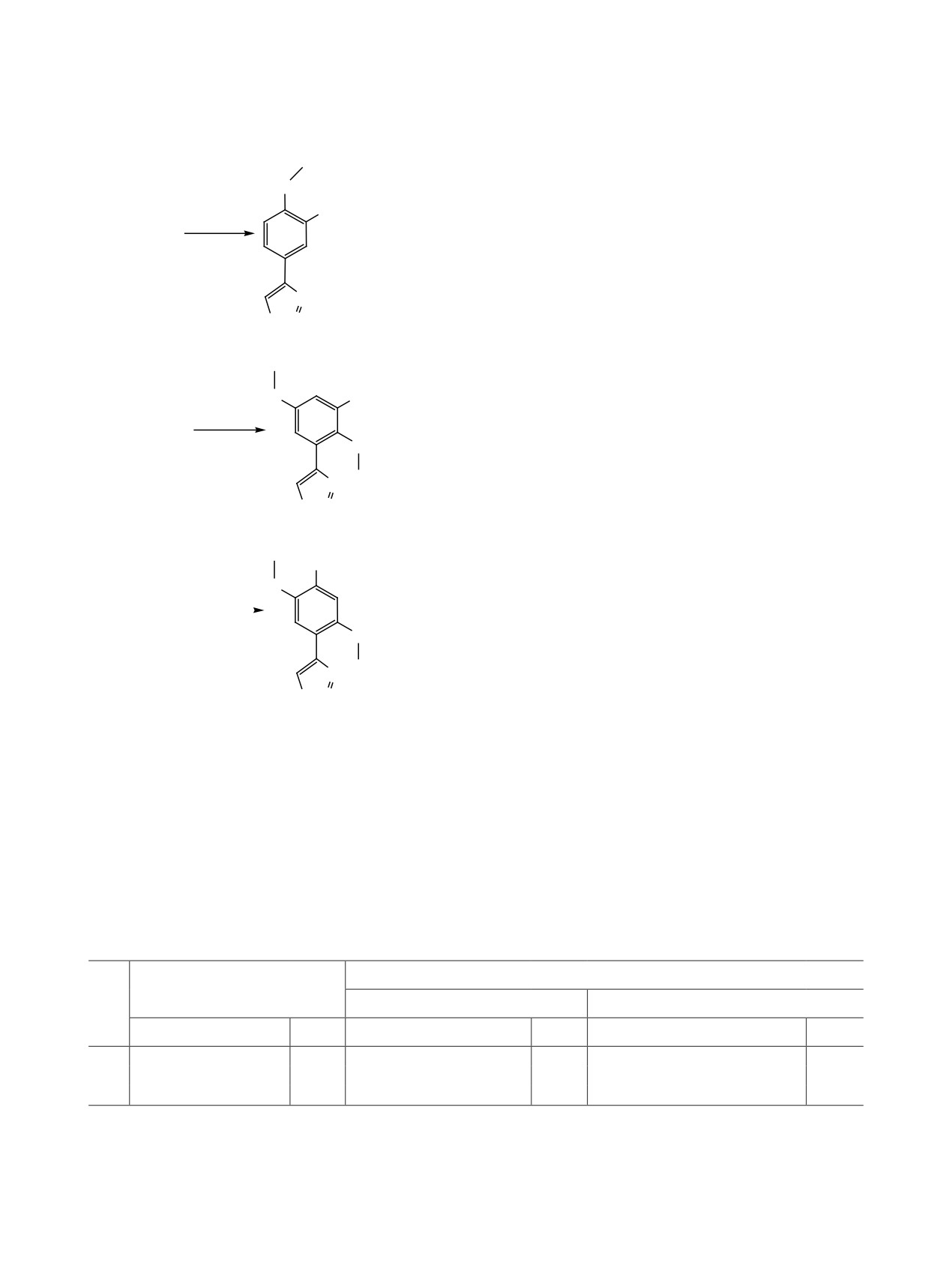
Схема 5.
реагировал с салициловым альдегидом медленнее,
выделение воды заканчивалось после кипячения в
O
течение 8 ч. Азометин 21 был получен с выходом
NH2
63%. Амин 17 оказался совершенно нерастворим
Zn, AcOH
3
в бензоле. Его реакцию с салициловым альдеги-
i-PrOH
дом проводили в этаноле в присутствии катали-
тического количества п-толуолсульфокислоты при
N
комнатной температуре в течение 4 сут. Выход азо-
S N
метина 20 был равен 57%. Методики синтеза и па-
16
раметры спектров ЯМР полученных соединений
приведены в Экспериментальной части.
В спектрах ЯМР 1Н и 13С азометина 20 присут-
O
NH2
ствуют два набора сигналов протонов и атомов
Zn, AcOH
11
углерода в соотношении 2.5:1. Видимо, это соеди-
i-PrOH
O
нение существует в виде смеси син- и анти-форм,
однако определить принадлежность наборов сиг-
N
налов той или иной форме не удалось.
S N
Азометины 19-21 являются люминофорами.
17
Нами зарегистрированы их спектры люминесцен-
NH2
ции и возбуждения в порошке и в растворе хлори-
стого метилена в концентрациях 10-4 и 10-5 моль/л.
O
Zn, AcOH
Фотофизические характеристики люминофоров
12
i-PrOH
приведены в табл. 1.
O
Сравнение спектров люминесценции азомети-
нов 19-21 в порошке и в растворах обнаруживает
N
существенные различия. Так, для азометина 19 в
S N
порошке спектр люминесценции имеет максимум
18
при 553 нм и неявно выраженное плечо при 603 нм
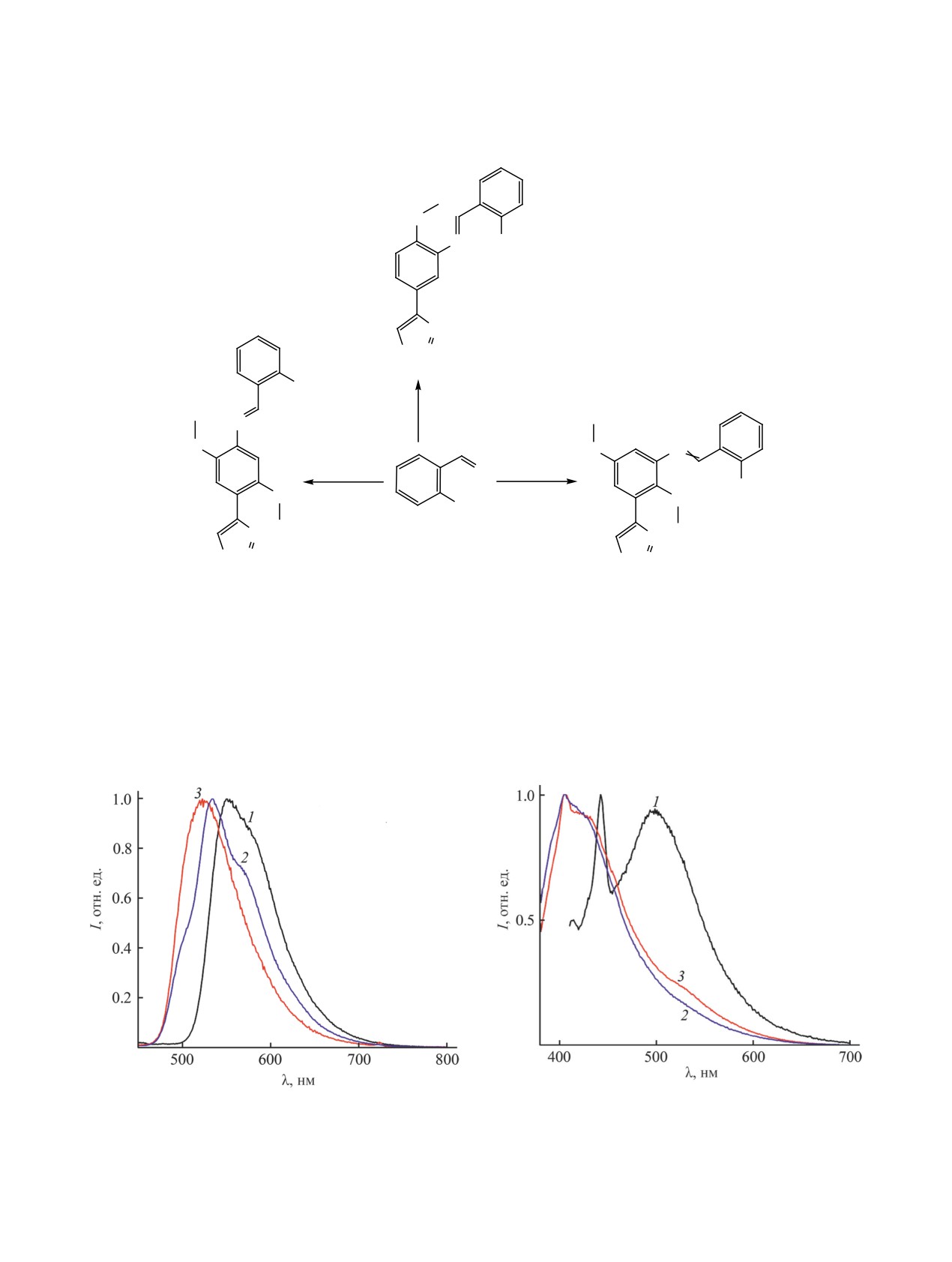
(рис. 1). В спектре раствора в хлористом метилене
при концентрации 10-4 моль/л для этого вещества
п-толуолсульфокислоты (схема 6). Выделяющую-
регистрируются полосы испускания с максимума-
ся воду отделяли с помощью азеотропной сушки
ми при 414, 442 и 498 нм (рис 2). При переходе к
с ловушкой Дина-Старка. В случае соединения 16
раствору с концентрацией 10-5 моль/л происходит
процесс заканчивался в течение 3 ч. Целевой азо-
гипсохромный сдвиг максимумов полос испуска-
метин 19 был выделен с выходом 81%. Амин 18
ния до 405, 442 и 478 нм (рис. 3). Во всех случаях
Таблица 1. Фотофизические характеристики 1,2,3-тиадиазолов 19-21
Раствор в CH2Cl2
Порошок
№
с×10-4, моль/л
с×10-5, моль/л
λem, нма
Φs, %
λem, нма
Φs, %
λem, нма
Φs, %
19
553, 603 пл (400)
1.50
414, 442, 458, 552 пл (390)
2.48
405, 436, 478 пл (360)
5.17
20
505, 534. 574 пл (400)
1.40
406, 429, 465 пл (360)
0.41
405, 433, 515 пл (360)
0.39
21
526, 576 пл (400)
0.30
406, 430, 486 пл (360)
3.17
404, 433, 476, 511, 530 пл (360)
3.28
а В скобках указана длина волны возбуждения, нм.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1684
МАТУЗКО и др.
Схема 6.
O
N OH
N
S N
19
OH
16
N
p-TSA
O
18
17
O
N
p-TSA
O
p-TSA
OH
O
O
OH
N
N
S N
S N
21
20
интенсивность излучения убывает по экспоненте.
Как видно из табл. 1, аналогичные изменения
Квантовый выход люминесценции для порошко-
спектров люминесценции регистрируются и для
образного образца составляет 1.50, а при переходе
азометинов 20 и 21. Сравнение с аналогичным
к растворам он увеличивается до 2.48 и 5.17 соот-
спектром азометина 19 в порошке (рис. 1) показы-
ветственно при уменьшении концентрации соеди-
вает, что длинноволновые полосы испускания при
нения 19 от 10-4 до 10-5 моль/л.
введении дополнительного донорного заместите-
Рис. 2. Спектры люминесценции азометинов 19-21
Рис. 1. Спектры люминесценции азометинoв 19-21
(1-3) в хлористом метилене (с 10-4 моль/л, длина волны
(1-3) в порошке. Длина волны возбуждения - 400 нм.
возбуждения - 390 нм).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
СИНТЕЗ (1,2,3-ТИАДИАЗОЛ-4-ИЛ)(МЕТОКСИ)ФЕНИЛАМИНОВ
1685
Рис. 3. Спектры люминесценции азометинов 19-21
Рис. 4. Спектры возбуждения азометинов 19-21 (1-3) в
(1-3) в хлористом метилене (с 10-5 моль/л, длина волны
порошке. Длины волны люминесценции 433 (19), 435
возбуждения - 360 нм).
(20) и 430 нм (21).
ля претерпевают гипсохромный сдвиг. Квантовый
порошков азометинов 19-21 сходно, хотя интен-
выход люминесценции в порошке для азометина
сивность возбуждения для соединения 19 значи-
20 составляет 1.4, а при переходе к растворам он
тельно выше (рис. 4). У этого соединения также
составляет 0.41 и 0.39 при уменьшении концен-
появляется дополнительная полоса возбуждения в
трации соединения 20 от 10-4 до 10-5 моль/л соот-
длинноволновой части спектра.
ветственно. Таким образом, азометины 19 и 20 в
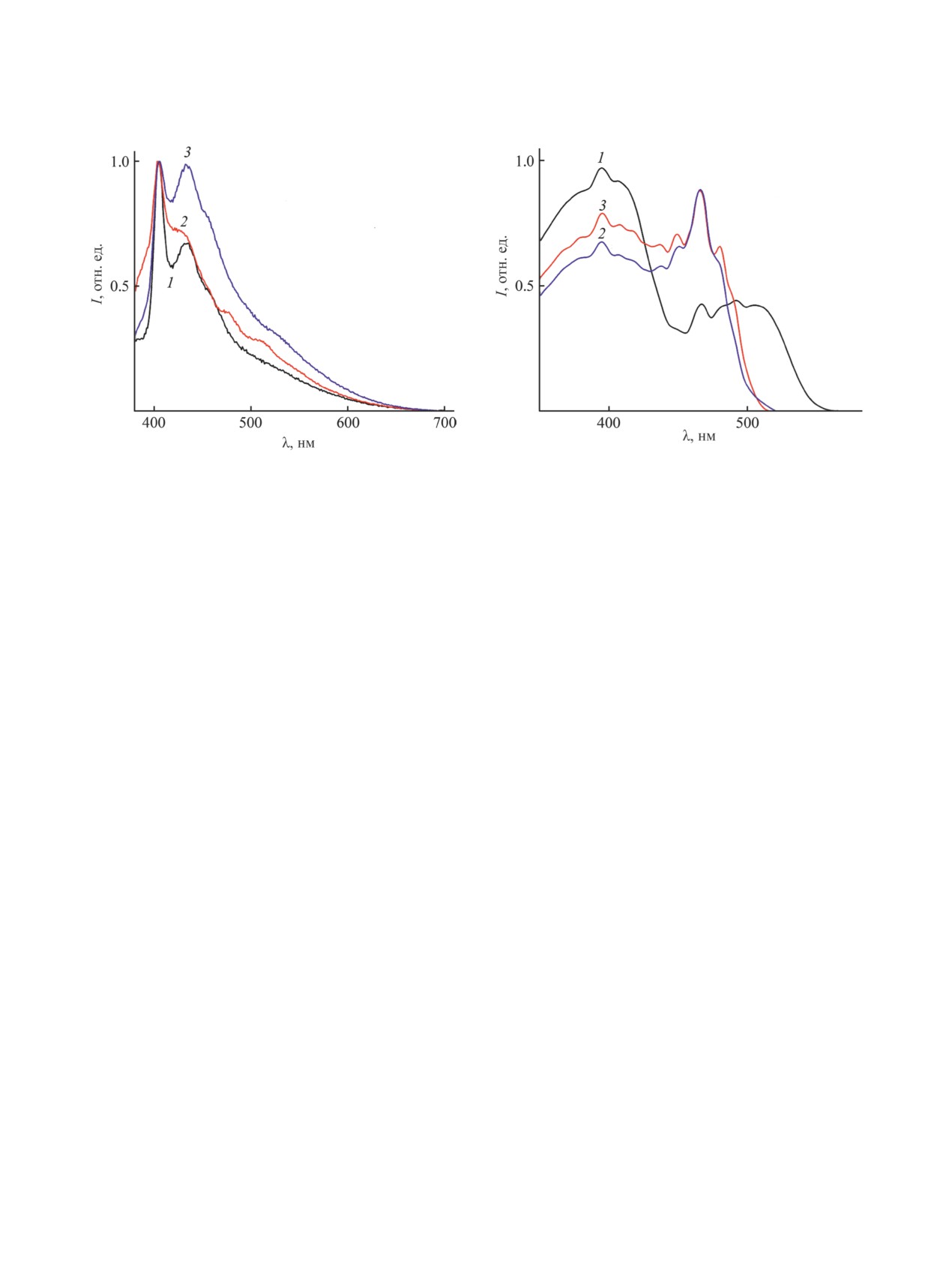
В растворах хлористого метилена (рис. 5, 6)
порошкообразном состоянии имеют близкий кван-
картина спектров возбуждения сильно отлича-
товый выход люминесценции, тогда как в раство-
ется от наблюдаемой в порошке и меняется с ро-
ре квантовый выход для соединения 20 на порядок
стом разбавления. При концентрации 10-4 моль/л
ниже, чем для азометина 19.
максимальная интенсивность возбуждения для
Спектр люминесценции азометина 21 в порош-
соединений 20 и 21 отмечается около 330 нм. В
ке имеет две полосы испускания при 526 и 576 нм.
спектре возбуждения азометина 19 в этой области
В хлористом метилене при концентрации
также отмечается локальный максимум, однако
10-4 моль/л регистрируются полосы испуска-
область наибольшей интенсивности возбуждения
ния с λmax 406, 430 и 486 нм. При концентрации
располагается около 420 нм. При концентрации
10-5 моль/л первые две полосы становятся более
10-5 моль/л максимумы всех полос возбуждения
выраженными и имеют λmax 404 и 433 нм, тогда как
сдвигаются гипсохромно. При этом сильнее всего
максимум последней сдвигается гипсохромно до
476 нм (рис. 1-3). Квантовый выход люминесцен-
эффект наблюдается для азометина 20. Наблюдав-
ции в порошке составляет 0.30, а при переходе к
шаяся в более концентрированном растворе поло-
растворам он возрастает на порядок до 3.17 и 3.28
са возбуждения в районе 380 нм превращается в
при уменьшении концентрации соединения 21 от
полосу с явно выраженным максимумом, причем
10-4 до 10-5 моль/л соответственно.
для соединения 19 он становится наиболее интен-
На рис. 4-6 представлены спектры возбужде-
сивным. В спектре возбуждения этого азометина
ния азометинов 19-21 в порошке и в хлористом
в концентрации 10-5 моль/л также исчезают все
метилене. Положение максимумов возбуждения
полосы возбуждения, расположенные в более кон-
в коротковолновой части спектров возбуждения
центрированном растворе далее 400 нм.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1686
МАТУЗКО и др.
Рис. 5. Спектры возбуждения азометинов 19-21 в хло-
Рис. 6. Спектры возбуждения азометинов 19-21 (1-3)
ристом метилене (1-3) (с 10-4 моль/л). Длины волны
в хлористом метилене (с 10-5 моль/л). Длины волны
люминесценции 433 (19), 435 (20) и 430 нм (21).
люминесценции 435 (19), 435 (20) и 430 нм (21).
Таким образом, рассмотрение спектров лю-
оказывает влияние возможность образования ква-
минесценции и возбуждения азометинов 19-21
зиароматического шестичленного цикла с участи-
показывает, что их характер определяется струк-
ем атома азота азометинового фрагмента и водо-
турными особенностями изучаемых соединений.
родной связи. Такой цикл у соединения 19 может
Вид спектров люминесценции определяется чис-
образовываться в растворах за счет водородной
лом метоксильных групп, а не их расположением в
связи от гидроксильной группы, а у соединения у
бензольном кольце. При этом оказывается неваж-
21 - за счет водорода орто-метоксигруппы. Этим,
ным, в пара- или в мета-положении относительно
по-видимому, объясняется 10-кратный рост кван-
азометинового фрагмента находится 1,2,3-тиади-
тового выхода люминесценции у соединения 21
азольный цикл. В случае соединения 19 спектры
при переходе от порошка к растворам (табл. 1). В
возбуждения (рис. 4-6) обнаруживают наиболее
твердом состоянии для этого соединения квази-
длинноволновое поглощение. Поэтому для этого
ароматический шестичленный цикл не может ре-
соединения в наибольшей степени выражена ре-
ализоваться из-за жесткости матрицы, а в жидких
абсорбция квантов испускания и искажение вслед-
растворах при комнатной температуре он обра-
ствие этого регистрируемых спектров люминес-
зуется за счет конформационной подвижности
ценции (рис. 2, 3).
орто-метоксигруппы. Наличие шестичленного
Квантовый выход люминесценции в порошке
цикла в молекуле уплощает ее структуру в раство-
близок для азометинов 19 и 20, а в случае азоме-
рах, что усиливает степень сопряжения фрагмен-
тина 21 он в 4-5 раз ниже. В растворах хлори-
тов молекулы. Как следствие этого резко возраста-
стого метилена для соединения 21 наблюдается
ет квантовый выход люминесценции соединения
резкий рост квантового выхода люминесценции,
21 в растворах. У соединения 20 возможности об-
а у соединения 20 он снижается (табл. 1). Кван-
разования шестичленного цикла нет. Кроме того,
товый выход люминесценции определяется сте-
это соединение существует в растворах в смеси
пенью сопряжения вдоль всей молекулы и растет
син- и анти- изомеров, что уменьшает жесткость
по мере усиления донорно-акцепторного взаимо-
молекулы и, как следствие, приводит к снижению
действия заместителей. На степень сопряжения
квантового выхода люминесценции у этого соеди-
гетероциклического и азометинового фрагментов
нения в растворах.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
СИНТЕЗ (1,2,3-ТИАДИАЗОЛ-4-ИЛ)(МЕТОКСИ)ФЕНИЛАМИНОВ
1687
Таким образом, разработан способ синтеза азо-
зиламмония (TEBA-Br), 6 мл свежеперегнанного
метинов, содержащих 1,2,3-тиадиазольный фраг-
диметилсульфата и 60 мл хлороформа прибавляли
мент в разных положениях бензольного кольца
при интенсивном перемешивании раствор 1.9 г ги-
относительно азометиновой группы. Эти соедине-
дроксида калия в 30 мл воды. Полученную смесь
ния люминесцируют, но их фотофизическое пове-
перемешивали 6 ч при комнатной температуре,
дение достаточно сложно и требует более деталь-
затем отделяли водную фазу. Органическую фазу
ных исследований.
промывали (2×30 мл) 0.6 н. раствором гидроокиси
калия и 30 мл воды, затем сушили сульфатом на-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
трия и упаривали. Выход 6.12 г (85%), т. пл. 148°С.
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 4.07 с (3Н, СН3О),
Спектры ЯМР 1Н, и 13С получали на приборе
7.26 д (1Н, Н5-фенил, JHH 8.8 Гц), 8.31 д. д (1Н,
Bruker AVANCE-400 (400.13 и 100.16 МГц соот-
Н6-фенил, JHH 8.8, 2.2 Гц), 8.50 д (1Н, Н2-фенил,
ветственно). Масс-спектры (ESI) получали на при-
JHH 2.2 Гц), 8.79 с (1Н, Н5-тиадиазол). Спектр ЯМР
боре Bruker MicrOTOF. Спектры люминесценции
13С (CDCl3), δС, м. д.: 56.90 (СН3О), 114.10 (С5-фе-
записывали на приборе Fliorolog-3 (Horiba Jobin
нил), 123.57 (С1-фенил), 124.48 (С2-фенил), 130.37
Yvon) при комнатной температуре. Квантовые
(С6-фенил), 132.96 (С5-тиадиазол), 139.81 (С3-фе-
выходы люминесценции определяли на том же
нил), 153.06 (С4-тиадиазол), 160.24 (С4-фенил).
приборе прямым измерением с помощью инте-
Карбэтоксигидразон
2-гидрокси-5-метокси-
грирующей сферы. Для измерений времени жиз-
ацетофенона (5). Смесь 2.83 г 2-гидрокси-5-ме-
ни возбужденного состояния в качестве источни-
токсиацетофенона 4, 1.86 г карбэтоксигидразина,
ка возбуждения использовали источник NanoLED
0.3 г п-толуолсульфокислоты и 30 мл бензола
(Horiba Jobin Yvon, длительность импульса
-
кипятили при перемешивании с ловушкой Дина-
1.1 нс, частота повторения - 50 кГц).
Старка до прекращения отделения воды в течение
4-(3-Нитро-4-гидроксифенил)-1,2,3-тиади-
5 ч. После этого отгоняли бензол, остаток затира-
азол (2). К суспензии 12.44 г 4-(4-гидроксифе-
ли с водой. Образовавшиеся кристаллы отфиль-
нил)-1,2,3-тиадиазола 1 в 150 мл уксусной кис-
тровывали, промывали водой и сушили на воз-
лоты прибавляли по каплям при перемешивании
духе до постоянной массы. Выход 3.03 г (70%),
7.3 мл азотной кислоты (d 1.5 г/мл) при охлаж-
т. пл. 167°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
дении водой, поддерживая температуру не выше
1.39 уш. т (3Н, СН3-эфир, JHH 7.0 Гц), 2.27 с (3Н,
32°С. Твердая фаза растворялась, а затем выпа-
СН3), 3.80 с (3Н, СН3О), 4.35 уш. к (2Н, СН2О, JHH
дал оранжевый осадок. Реакционную массу пере-
7.0 Гц), 6.87 д. д (1Н, Н4, JHH 8.8, 2.8 Гц), 6.94 д
мешивали при комнатной температуре 1 ч, затем
(1Н, Н5, JHH 8.8 Гц), 6.96 д (1Н, Н6, JHH 2.8 Гц), 9.03
выливали в 250 мл ледяной воды и оставляли на
уш. с (1Н, NH), 12.04 уш. с (1Н, ОН). Спектр ЯМР
ночь. На следующий день отфильтровывали оса-
13С (ДМСО-d6), δС, м. д.: 12.22 (СН3), 14.47 (СН3-
док, промывали водой до нейтральной реакции
эфир), 55.98 (СН3О), 62.73 уш. с (СН2О), 112.84
и сушили на воздухе до постоянной массы. Вы-
(С3-фенил), 116.74 (С6-фенил), 118.29 (С4-фенил),
ход 14.42 г (92%), т. пл. 198°С. Спектр ЯМР 1Н
122.38 (С1-фенил), 149.49 уш. с (С=N), 151.11 уш. с
(ДМСО-d6), δ, м. д.: 7.28 д (1Н, Н5-фенил, JHH 8.4
(NHC=O), 152.79 (С5-фенил), 154.34 (С2-фенил).
Гц), 8.28 д. д (1Н, Н6-фенил, JHH 8.4, 2.0 Гц), 8.61 д
4-(2-Гидрокси-3,6-дихлор-5-метоксифенил)-
(1Н, Н2-фенил, JHH 2.0 Гц), 9.61 с (1Н, Н5-тиадиа-
тиадиазол
(6). Карбэтоксигидразон
2-гидрок-
зол), 11.44 с (1Н, ОН). Спектр ЯМР 13С (ДМСО-d6),
си-5-метоксиацетофенона 5 (3.03 г) смешивали с
δС, м. д.: 120.38 (С5-фенил), 122.54 (С1-фенил),
15 мл хлористого тионила и кипятили 3 ч до пре-
124.03 (С2-фенил), 133.31 (С5-тиадиазол), 133.88
кращения выделения газа. После этого отгоняли
(С6-фенил), 137.81 (С3-фенил), 153.06 (С4-тиадиа-
хлористый тионил, остаток затирали с водой и пе-
зол), 160.32 (С4-фенил).
рекристаллизовывали из водного этанола. Выход
4-(3-Нитро-4-метоксифенил)-1,2,3-тиадиа-
2.31 г (69%), белые кристаллы, т. пл. 141°С. Спектр
зол (3). К смеси 6.84 г 4-(3-нитро-4-гидроксифе-
ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.88 с (3Н, СН3О),
нил)-1,2,3-тиадиазола 2, 3.3 г бромида триэтилбен-
7.44 с (1Н, Н4-фенил), 9.40 с (1Н, Н5-тиадиазол),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1688
МАТУЗКО и др.
9.41 уш. с (1Н, ОН). Спектр ЯМР 13С (ДМСО-d6),
с ловушкой Дина-Старка до прекращения отде-
δС, м. д.: 57.44 (СН3О), 115.24 (С3-фенил), 121.13
ления воды. Полученную смесь упаривали, оста-
(С6-фенил), 121.44 (С4-фенил), 122.31 (С1-фенил),
ток затирали с водой. Образовавшиеся кристаллы
139.58 (С5-тиадиазол), 147.77 (С5-фенил), 149.01
отфильтровывали, промывали водой и сушили на
(С2-фенил), 155.16 (С4-тиадиазол).
воздухе до постоянной массы. Выход 3.49 г (72%),
т. пл. 134°С. В хлороформе соединение существу-
2-(1,2,3-Тиадиазол-4-ил)-3,5-дихлорбен-
ет в виде смеси син- и анти-изомеров в соотноше-
зохинон (7). К суспензии 2.34 г 4-(2-гидрок-
нии 0.2:1. Спектр ЯМР 1Н (CDCl3), δ, м. д.: общие
си-3,6-дихлор-5-метоксифенил)тиадиазола
6 в
сигналы, 1.36 т (3Н, СН3-этил, JHH 7.2 Гц), 4.30 к
30 мл уксусной кислоты прибавляли по каплям
(2Н, СН2О-этил, JHH 7.2 Гц); анти-изомер, 2.25 с
1.4 мл азотной кислоты (d 1.5 г/мл). Реакционную
(3Н,СН3-гидразон), 3.81 с (3Н, СН3О2), 3.85 с (3Н,
массу нагревали до 60°С и выдерживали 3 ч при
СН3О5), 7.24 д (1Н, Н6-фенил, JHH 3.2 Гц), 7.35 д
этой температуре, после чего выливали на 100 г
(1Н, Н4-фенил, JHH 3.2 Гц), 8.03 уш. с (1Н, NH);
измельченного льда. На следующий день отфиль-
син-изомер, 2.36 с (3Н,СН3-гидразон), 3.82 с (3Н,
тровывали образовавшийся осадок и сушили на
СН3О2), 3.87 с (3Н, СН3О5), 6.88 д (1Н, Н6-фенил,
воздухе до постоянной массы. Выход 1.35 г (61%),
J
3.2 Гц), 7.40 д (1Н, Н4-фенил, JHH 3.2 Гц), 7.70
HH
т. разл. 151°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
уш. с (1Н, NH). Спектр ЯМР 13С (CDCl3), δС, м. д.:
7.69 с (1Н, Н5-хинон), 9.38 с (1Н, Н5-тиадиазол).
общие сигналы, 14.57 (СН3-этил), 15.75 (СН3-
Спектр ЯМР 13С (ДМСО-d6), δС, м. д.: 133.87
гидразон), 62.31 уш. с (СН2О-этил), 63.34 (СН3О2),
(С5-хинон), 135.11 (С5-тиадиазол), 142.20 (С3-
136.82 (С1-фенил),
144.34 (С3-фенил),
145.82
хинон),
142.48 (С6-хинон),
143.68 (С2-хинон),
(С2-фенил), 147.50 (С=N),153.75 уш. с (С=О);
151.90 (С4-тиадиазол), 176.41 (С4-хинон), 177.68
анти-изомер, 56.17 (СН3О5), 110.40 (С4-фенил),
(С1-хинон). Масс-спектр (ESI), m/z: 282.9113 [M +
120.50 (С6-фенил), 155.17 (С5-фенил); син-изо-
Na]+ (вычислено для С8Н2Сl2N2O2S: 282.9106).
мер, 56.30 (СН3О5), 110.64 (С4-фенил), 118.85 (С6-
2,5-Диметокси-3-нитроацетофенон
(9).
К
фенил), 155.94 (С5-фенил).
раствору 3.65 г 2-гидрокси-3-нитро-5-метоксиа-
4-(2,5-Диметокси-3-нитрофенил)-1,2,3-тиа-
цетофенона 8 и 3.2 мл диметилсульфата в 60 мл
диазол
(11). Карбэтоксигидразон
2,5-диметок-
хлороформа прибавляли при перемешивании
си-3-нитроацетофенона 10 (3.49 г) растворяли при
1.85 г бромида триэтилбензиламмония и раствор
перемешивании в 30 мл хлористого тионила и по-
1.05 г гидроксида калия в 30 мл воды. Полученную
степенно нагревали. Выделение газа начиналось
смесь кипятили при интенсивном перемешивании
при 30°С (температура бани) и заканчивалось в
8 ч, затем отделяли водный слой. Органический
течение 1.5 ч при достижении температуры бани
слой промывали 0.6 М. раствором гидроксида ка-
80°С. Реакционную массу перемешивали еще
лия (2×25 мл), 25 мл воды, 25 мл раствора NaCl,
30 мин при этой температуре, затем отгоняли
сушили сульфатом натрия и отгоняли хлороформ.
хлористый тионил, остаток затирали с водой.
Выход 2.83 г (73%), т. пл. 53°С. Спектр ЯМР 1Н
Выпавшие кристаллы отфильтровывали, промы-
(CDCl3), δ, м. д.: 2.65 с (3Н, СН3-кетон), 3.85 с
вали водой и сушили на воздухе до постоянной
(3Н, СН3О5), 3.87 с (3Н, СН3О2), 7.23 д (1Н, Н6-
массы. Выход 2.90 г (97%), светло-желтые кри-
фенил, JHH 3.2 Гц), 7.44 д (1Н, Н6-фенил, JHH
сталлы, т. пл. 135°С. Спектр ЯМР 1Н (CDCl3), δ,
3.2 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 30.53
м. д.: 3.76 с (3Н, СН3О5), 3.94 с (3Н, СН3О2), 7.45
(СН3-кетон),
56.24 (СН3О5),
64.27 (СН3О2),
д (1Н, Н6-фенил, JHH 3.2 Гц), 8.16 д (1Н, Н4-фенил,
113.49 (С4-фенил), 119.11 (С6-фенил), 136.55 (С1-
JHH-мета 3.2 Гц), 9.20 с (1Н, Н5-тиадиазол). Спектр
фенил),
144.72 (С3-фенил), 145.86 (С2-фенил),
ЯМР 13С (CDCl3), δС, м. д.: 56.29 (СН3О5), 62.42
155.15 (С5-фенил), 198.52 (С=О).
(СН3О2), 111.43 (С4-фенил), 120.20 (С6-фенил),
Карбэтоксигидразон 2,5-диметокси-3-нитро-
127.81 (С1-фенил), 135.11 (С5-тиадиазол), 144.40
ацетофенона (10). Смесь 2.83 г 2,5-диметок-
(С3-фенил), 144.97 (С2-фенил), 155.68 (С5-фенил),
си-3-нитроацетофенона 9, 1.30 г карбэтоксигидра-
156.50 (С4-тиадиазол).
зина, 0.20 г п-толуолсульфокислоты и 40 мл бензо-
Карбэтоксигидразон 2,5-диметоксиацетофе-
ла кипятили 5 ч при интенсивном перемешивании
нона (14). Смесь 2.05 г 2,5-диметоксиацетофенона
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
СИНТЕЗ (1,2,3-ТИАДИАЗОЛ-4-ИЛ)(МЕТОКСИ)ФЕНИЛАМИНОВ
1689
13, 1.3 г карбэтоксигидразина, 0.2 г п-толуолсуль-
нил)-1,2,3-тиадиазола 15 в 22 мл ледяной уксусной
фокислоты и 40 мл бензола кипятили 3 ч при пере-
кислоты прибавляли по каплям при перемешива-
мешивании с ловушкой Дина-Старка до прекраще-
нии 1.2 мл азотной кислоты (d 1.5 г/мл). Темпера-
ния отделения воды. После этого бензол отгоняли,
тура реакционной массы поднималась до 29°С и
остаток растворяли в 40 мл хлороформа, промыва-
начиналось выделение осадка. Полученную смесь
ли водой, раствором NaCl и сушили сульфатом на-
перемешивали 3 ч, затем выливали в 70 мл воды.
трия. Хлороформ отгоняли, остаток выдерживали
На следующий день отфильтровывали выделив-
в вакууме (1 мм рт. ст.) 1 ч при комнатной темпера-
шийся осадок, промывали его водой до нейтраль-
туре. Выход 2.90 г (96%). Спектр ЯМР 1Н (CDCl3),
ной реакции и сушили на воздухе до постоянной
δ, м. д.: 1.32 т (3Н, СН3-эфир, JHH 7.0 Гц), 2.25 с
массы. Выход 1.94 г (82%), оранжевый порошок,
(3Н, СН3-гидразон), 3.75 с (6Н, СН3О), 4.28 к (2Н,
т. пл. 119-120°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
СН2О-эфир, JHH 7.0 Гц), 6.60 с (1Н, NH), 6.79 д
4.04 с (3Н, СН3О2), 4.07 с (3Н, СН3О2), 7.64 с (1Н,
(1Н, Н3-фенил, JHH 8.8 Гц), 6.84 д. д (1Н, Н4-фе-
Н3-фенил), 8.41 с (1Н, Н6-фенил), 9.30 с (1Н, Н5-ти-
нил, JHH 8.8, 3.2 Гц), 6.98 д (1Н, Н6-фенил, JHH
адиазол). Спектр ЯМР 13С (CDCl3), δС, м. д.: 56.53
3.2 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.57
(СН3О2), 57.19 (СН3О5), 108.95 (С3-фенил), 115.65
(СН3-эфир),
14.59 (СН3-эфир),
16.50 (СН3-ги-
(С6-фенил), 125.36 (С1-фенил), 136.06 (С5-тиадиа-
дразон), 55.81 (СН3О5), 56.11(СН3О2), 61.90 уш.
зол), 138.78 (С4-фенил), 147.77 (С5-фенил), 149.39
с (СН2О-эфир),
112.32(С3-фенил),
113.00 (С4-
(С2-фенил), 156.38 (С4-тиадиазол).
фенил),
113.47 (С4-фенил),
114.88 (С6-фенил),
4-(3-Амино-4-метоксифенил)-1,2,3-тиадиа-
115.58(С6-фенил),
123.57 (С1-фенил),
149.46
зол (16). К суспензии 3.45 г 4-(3-нитро-4-метокси-
(С=N),
151.64 (С2-фенил),
153.54 (С5-фенил),
фенил)-1,2,3-тиадиазола 3 в 82 мл изопропилово-
154.03 (С=О).
го спирта прибавляли 17.9 мл уксусной кислоты,
4-(2,5-Диметоксифенил)-1,2,3-тиадиазол (15).
затем небольшими порциями при перемешивании
Карбэтоксигидразон
2,5-диметоксиацетофенона
прибавляли 4.80 г цинка. После окончания прибав-
14 (2.74 г) растворяли в 30 мл хлористого тио-
ления реакционную массу перемешивали 1.5 ч при
нила и постепенно нагревали при перемешива-
50-52°С, отфильтровывали осадок, промывали его
нии. При 65°С начиналось активное выделение
изопропиловым спиртом и полученный раствор
газа. Смесь перемешивали при 65-70°С до пол-
упаривали. Остаток растворяли в 30 мл хлоро-
ного выделения газа, затем нагревали в течение
форма, промывали 5%-ной соляной кислотой (3×
10 мин при 80°С, охлаждали и отгоняли хлори-
10 мл), экстракт подщелачивали карбонатом на-
стый тионил. Остаток разлагали 25 мл воды, ор-
трия до рН 9-10. Выпавшее масло после недолгого
ганическую фазу экстрагировали хлороформом
затирания закристаллизовывалось. Полученный
(2×15 мл), промывали полученный экстракт водой
осадок отфильтровывали, промывали 5 мл воды и
(2×10 мл), бикарбонатом натрия (10 мл насыщен-
сушили на воздухе до постоянной массы. Выход
ного раствора) и раствором NaCl (15 мл). Получен-
1.90 г (63%), т. пл. 115°С. Спектр ЯМР 1Н (CDCl3),
ный раствор сушили сульфатом натрия, отгоняли
δ, м. д.: 3.92 уш. с (5Н, СН3О, NH2), 6.89 д (1Н,
хлороформ, остаток выдерживали в вакууме (1
Н5-фенил, JHH 8.4 Гц), 7.40 д. д (1Н, Н6-фенил, JHH
мм рт. ст.) 1 ч при комнатной температуре. Выход
8.4, 2.0 Гц), 7.46 д (1Н, Н2-фенил, JHH 2.0 Гц), 8.49
1.97 г (86%), т. пл. 32°С. Спектр ЯМР 1Н (CDCl3), δ,
с (1Н, Н5-тиадиазол). Спектр ЯМР 13С (CDCl3),
м. д.: 3.88 с (3Н, СН3О5), 3.94 с (3Н, СН3О2), 6.99-
δС, м. д.: 55.62 (СН3О), 110.62 (С5-фенил), 113.77
7.00 м (2Н, Н3,4-фенил), 8.12 с (1Н, Н6-фенил), 9.12
(С2-фенил), 117.82 (С6-фенил), 123.81 (С1-фенил),
с (1Н, Н5-тиадиазол). Спектр ЯМР 13С (CDCl3), δС,
128.54 (С5-тиадиазол), 136.70 (С3-фенил), 148.27
м. д.: 55.93 (СН3О5), 56.07 (СН3О2), 112.64 (С3-фе-
(С4-тиадиазол), 163.12 (С4-фенил).
нил), 114.65 (С4-фенил), 116.46 (С6-фенил), 120.12
4-(2,5-Диметокси-3-аминофенил)-1,2,3-ти-
(С1-фенил), 133.67 (С5-тиадиазол), 150.71 (С5-
адиазол (17). К суспензии 2.90 г 4-(2,5-диметок-
фенил), 153.84 (С2-фенил), 158.41 (С4-тиадиазол).
си-3-нитрофенил)-1,2,3-тиадиазола
11 в
60 мл
4-(2,5-Диметокси-4-нитрофенил)-1,2,3-тиа-
изопропилового спирта при интенсивном пере-
диазол (12). К раствору 1.97 г 4-(2,5-диметоксифе-
мешивании прибавляли 3.5 г цинка, затем 13 мл
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1690
МАТУЗКО и др.
уксусной кислоты. Наблюдалось выделение тепла,
130.67 (С5-тиадиазол), 138.28 (С4-фенил), 141.37
температура реакционной массы поднималась до
(С5-фенил), 151.62 (С2-фенил), 159.26 (С4-тиадиазол).
35°С. После прекращения экзотермической реак-
4-[3-(2-Гидроксибензилиден)амино-4-ме-
ции реакционную массу нагревали при перемеши-
токсифенил]-1,2,3-тиадиазол (19). К суспензии
вании при 45-50°С 2.5 ч, затем охлаждали до ком-
0.78 г 4-(3-амино-4-метоксифенил)-1,2,3-тиадиа-
натной температуры. Осадок отфильтровывали,
зола 16 в 25 мл бензола прибавляли при переме-
фильтрат упаривали. Остаток растворяли в 30 мл
шивании 0.39 мл салицилового альдегида и 0.25 г
хлороформа, фильтровали и промывали 5%-ной
п-толуолсульфокислоты. Полученную смесь кипя-
соляной кислотой (3×10 мл). Кислотную вытяжку
тили 3 ч с ловушкой Дина-Старка до прекраще-
подщелачивали до рН 9-10, осадок выдерживали
ния отделения воды, отфильтровывали образо-
при комнатной температуре 30 мин и отфильтро-
вавшийся осадок и перекристаллизовывали его
вывали. При сушке на воздухе он расплывается,
из этанола. Выход 0.95 г (81%), желто-оранжевые
а потом образует комки, не имеющие четкой тем-
кристаллы, т. пл. 135°С. Спектр ЯМР 1Н (CDCl3),
пературы плавления и разлагающиеся при 101°С.
δ, м. д.: 3.98 с (3Н, СН3), 6.96 уш. д. д (1Н, Н5-
Выход 0.38 г (15%). Спектр ЯМР 1Н (ДМСО-d6),
салицил, JHH 8.0, 8.4 Гц), 7.12 д (1Н, Н5-фенил,
δ, м. д.: 3.52 с (3Н, СН3О2), 3.73 с (3Н, СН3О5),
JHH 8.2 Гц), 7.39 уш. д (1Н, Н6-фенил, JHH 8.2 Гц),
5.22 уш. с (2Н, NH2), 6.42 д (1Н, Н4-фенил, JHH
7.43 уш. д. д (1Н, Н4-салицил, JHH 8.0, 8.4 Гц), 7.90
3.2 Гц), 6.91 д (1Н, Н6-фенил, JHH 3.2 Гц), 9.39 с
уш. д (1Н, Н6-салицил, JHH 8.4 Гц), 7.96 уш. д (1Н,
(1Н, Н5-тиадиазол). Спектр ЯМР 13С (ДМСО-d6),
Н3-фенил, JHH 8.0 Гц), 7.99 уш. с (1Н, Н2-фенил),
δС, м. д.: 55.51 (СН3О2), 59.36 (СН3О5), 101.56
8.62 с (1Н, =СН), 8.83 с (1Н, Н5-тиадиазол), 13.71
(С4-фенил), 102.19 (С6-фенил), 124.39 (С1-фенил),
с (1Н, ОН). Спектр ЯМР 13С (CDCl3), δС, м. д.:
135.69 (С5-тиадиазол), 138.28 (С3-фенил), 143.62
56.07 (СН3), 112.24 (С5-фенил), 117.45 (С2-фенил),
(С2-фенил), 156.62 (С4-тиадиазол),158.63 (С5-фенил).
118.75 (С1-салицил), 118.97 (С3-салицил), 119.87
4-(2,5-Диметокси-4-аминофенил)-1,2,3-тиа-
(С5-салицил), 123.88 (С1-фенил), 126.70 (С6-фе-
диазол (18). К суспензии 4-(2,5-диметокси-4-ни-
нил), 120.99 (С5-тиадиазол), 132.25 (С6-салицил),
трофенил)-1,2,3-тиадиазола 12 (3.00 г) в 63 мл изо-
133.29 (С4-салицил), 137.77 (С3-фенил),
153.89
пропилового спирта добавляли 3.65 г цинкового
(С4-тиадиазол), 161.63 (=СН), 162.22 (С2-салицил),
порошка и при перемешивании приливали неболь-
162.98 (С4-фенил).
шими порциями 13.6 мл ледяной уксусной кисло-
4-[2,5-(Диметокси)-3-(2-гидроксибензил-
ты. Температура реакционной смеси поднималась
иден)аминофенил]-1,2,3-тиадиазол (20). К су-
до 43°С. Реакционную массу перемешивали 3 ч,
спензии
0.28 г
4-(2,5-диметокси-3-аминофе-
при этом ее окраска изменялась с оранжевой на
нил)-1,2,3-тиадиазола 17 в 15 мл этанола при-
светло-коричневую. После удаления солей цинка,
бавляли 0.15 мл салицилового альдегида и 0.05 г
фильтрат упаривали досуха, остаток растворяли
п-толуолсульфокислоты, полученную смесь пере-
в 30 мл хлороформа, фильтровали, промывали
мешивали 4 сут. Оранжевый осадок отфильтровы-
5%-ной соляной кислотой. Кислотную вытяжку
вали, промывали этанолом и сушили на воздухе
фильтровали, фильтрат подщелачивали карбона-
до постоянной массы. Выход 0.23 г (57%), оран-
том калия до рН 9-10. Выделившееся масло при
жевый порошок, т. пл. 232°С (разл.). В растворе
затирании закристаллизовывалось. Образовав-
существует в виде двух форм в соотношении 2.5:1.
шийся осадок отфильтровывали, промывали водой
Спектр ЯМР 1Н (CDCl3), δС, м. д.: 7.427.50 м (Н4
и сушили на воздухе до постоянной массы. Выход
основного изомера, Н4,6 минорного изомера), 13.37
1.12 г (42%), светло-коричневый порошок, т. пл.
с (1Н, ОН); основной изомер, 3.47 с (3Н, СН3О5),
103°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 3.91 с (3Н,
3.73 с (3Н, СН3О2), 6.02 уш. с (1Н, Н6-фенил), 6.69
СН3О5), 3.96 с (3Н, СН3О5), 4.12 уш. с (2Н, NH2),
т (1Н, Н5-салицил, JH4H5 = JH5H6 = 7.0 Гц), 7.13
6.47 с (1Н, Н3-фенил), 8.03 с (1Н, Н6-фенил), 8.92
д (1Н, Н3-салицил, JH3H4 8.4 Гц), 7.15 д (1Н, Н6-
с (1Н, Н5-тиадиазол). Спектр ЯМР 13С (CDCl3),
салицил, JH5H6 7.0 Гц), 7.73 уш. с (1Н, Н2-фенил),
δС, м. д.: 55.96 (СН3О5), 56.20 (СН3О2), 98.91 (С3-
8.23 с (1Н, СН=), 8.33 с (1Н, Н5-тиадиазол); минор-
фенил),
104.66 (С1-фенил), 112.66 (С6-фенил),
ный изомер, 3.73 с (3Н, СН3О5), 3.93 с (3Н, СН3О2),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
СИНТЕЗ (1,2,3-ТИАДИАЗОЛ-4-ИЛ)(МЕТОКСИ)ФЕНИЛАМИНОВ
1691
6.88 уш. с (1Н, Н6-фенил), 6.99 т (1Н, Н5-салицил,
JH4H5 = JH5H6 = 7.2 Гц), 7.07 д (1Н, Н3-салицил,
org/0000-0001-8666-282X
JH3H4 8.4 Гц), 7.89 уш. с (1Н, Н2-фенил), 8.74 с (1Н,
Поняев Александр Иванович, ORCID: https://
СН=), 9.22 с (1Н, Н5-тиадиазол). Спектр ЯМР 13С
orcid.org/0000-0002-1562-2510
(CDCl3), δС, м. д.: основной изомер, 55.66 (СН3О5),
61.52 (СН3О2), 107.21 (С4-фенил), 111.58 (С2-
БЛАГОДАРНОСТИ
фенил), 114.64 (С3-салицил), 119.25 (С1-салицил),
Авторы выражают благодарность М.А. Кинжа-
124.43 (С1-фенил), 125.01 (С5-салицил),
132.55
лову и Э.В. Соколовой (Санкт-Петербургский го-
(С6-салицил), 134.00 (С4-салицил), 136.22 (С5-
сударственный университет) за помощь в съемке
тиадиазол), 142.43 (С3-фенил), 143.59 (С2-фенил),
и интерпретации спектров люминесценции и воз-
157.03 (С5-фенил), 157.06 (С4-тиадиазол), 163.91
буждения.
(С2-салицил),
167.45
(=СН); минорный изомер,
55.98 (СН3О5), 61.06 (СН3О2), 107.49 (С4-фенил),
ФОНДОВАЯ ПОДДЕРЖКА
111.24 (С2-фенил), 117.43 (С3-салицил),
119.15
(С1-салицил),
124.43 (С1-фенил),
125.74 (С5-
Работа выполнена в рамках государственного
салицил),
133.73 (С6-салицил),
134.16 (С4-
задания Министерства науки и высшего образо-
салицил),136.22 (С5-тиадиазол),
142.43 (С3-фе-
вания России № 785.00X6019 с использованием
нил), 143.84 (С2-фенил), 156.56 (С5-фенил), 157.06
оборудования инжинирингового центра Санкт-Пе-
(С4-тиадиазол), 161.42 (С2-салицил), 173.42 (=СН).
тербургского государственного технологическо-
4-[2,5-(Диметокси)-4-(2-гидроксибензил-
го института (технического университета) и при
поддержке Российского фонда фундаментальных
иден)аминофенил]-1,2,3-тиадиазол (21). К смеси
1.00 г 4-(2,5-диметокси-4-аминофенил)-1,2,3-тиа-
исследований (грант № 19-08-1232). Измерение
диазола 18, 0.10 г п-толуолсульфокислоты и 20 мл
фотофизических параметров произведено в Ре-
бензола прибавляли при интенсивном перемеши-
сурсном центре Санкт-Петербургского государ-
вании 0.5 мл салицилового альдегида и получен-
ственного университета «Оптические и лазерные
ную смесь кипятили при перемешивании с ловуш-
методы исследования вещества».
кой Дина-Старка до прекращения отделения воды
КОНФЛИКТ ИНТЕРЕСОВ
8 ч. Осадок отфильтровывали и перекристалли-
зовывали из этанола. Выход 0.91 г (63%), желтый
Авторы заявляют об отсутствии конфликта
порошок, т. пл. 255°С. Спектр ЯМР 1Н (CDCl3),
интересов.
δ, м. д.: 3.54 с (3Н, СН3О5), 3.58 с (3Н, СН3О2),
6.43 с (1Н, Н3-фенил), 6.62 т (1Н, Н5-салицил, JHH
СПИСОК ЛИТЕРАТУРЫ
7.6 Гц), 6.99 д (1Н, Н3-салицил, JHH 8.4 Гц), 7.20
1. da Silva C.M., da Silva D.L., Modolo L.V., Alves R.B.,
д (1Н, Н6-салицил, JHH 7.6 Гц), 7.37 д. д (1Н, Н4-
Resende M.A., Martins C.V.B., Fatima A. // J. Adv. Res.
салицил, JH3H4 8.4, JH4H5 7.6 Гц), 7.99 с (1Н, Н6-
2011. Vol. 2. N 1. P. 1. doi 10.1016/j.jare.2010.05.004
фенил), 8.35 с (1Н, =СН), 9.04 с (Н5-тиадиазол),
2. Krarky M., Dzurkova M., Janousek J., Konecna K.,
13.64 уш. с (1Н, ОН). Спектр ЯМР 13С (CDCl3),
Treitnar F., Stolarikova J., Vinsova J. // Molecules.
δС, м. д.: 55.66 (СН3О5), 56.04 (СН3О2), 104.60 (С3-
2017. Vol. 22. P. 1573. doi 10.3390/molecules22091573
фенил), 112.18 (С6-фенил), 114.53 (С3-салицил),
3. Surabhi A.K., Pradeepkumar K. // J. Appl. Chem. 2016.
117.49 (С1-фенил), 118.72 (С1-салицил),
124.03
Vol. 9. N 11. P. 11. doi 10.9790/5736-0911031118
(С5-салицил),
133.54 (С5-тиадиазол),
136.14
4. Thorat B.R., Kanat P., Khandekar D., Lele S., Musta-
(С6-салицил), 136.54 (С4-салицил), 138.54 (С4-фе-
pha M., Savant S., Jadhav R., Kolekar S., Yamgar R.,
нил), 145.48 (С5-фенил), 150.91 (С2-фенил), 157.82
Atram R.G. // J. Chem. Pharm. Res. 2011. Vol. 3. N 6.
(С4-тиадиазол), 168.92 (С2-салицил), 172.89 (=СН).
P. 1109.
ИНФОРМАЦИЯ ОБ АВТОРАХ
5. Dilmaghani K.A., Jazani N.H., Nasuhi Pur F., Shokou-
feh N., Ghadiri F., Fakhraee F.M. // Chem. Heterocycl.
Певзнер Леонид Маркович, ORCID: https://
Compd. 2012. Vol. 48. N 2. P. 362. doi 10.1007/S10593-
orcid. org/0000-0002-1678-2524
012-0998-y
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1692
МАТУЗКО и др.
6. Minkkila A., Myllymaki M.J., Saario S.M., Castillo-
8. Karabatsos G.R., Taller R.A. // J. Am. Chem. Soc. 1963.
Melendez J.A., Koskinen A.M.P., Fowler C.J., Leppa-
Vol. 85. N 22. P. 3624. doi 10.1021/ja00905a020
9. Karabatsos G.R., Taller R.A., Vane F.M. // J. Am.
nen J., Nevalainen T. // Eur. J. Med. Chem. 2009.
Chem. Soc. 1963. Vol. 85. N 15. P. 2327. doi 10.1021/
Vol. 44. P. 2994. doi 10.1016/j.ejmech.2009.01.007
ja00898a033
7. Cushman M., Zhu H., Geahlen R.L., Krakert A.J. //
10. Karabatsos G.R., Vane F.M., Taller R.A., Hsi N. // J. Am.
J. Med. Chem. 1994. Vol. 37. P. 3353. doi 10.1021/
Chem. Soc. 1964. Vol. 86. N 16. P. 3351. doi 10.1021/
jm00046a020
ja01070a029
Synthesis of (1,2,3-Thiadiazol-4-yl)(methoxy)phenylamines
and Shiff Bases with Salicylaldehyde
D. Yu. Matuzko, L. M. Pevzner*, M. L. Petrov, and A. I. Ponyaev
St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: pevzner_lm@list.ru
Received August 27, 2021; revised August 27, 2021; accepted September 18, 2021
Methods for the synthesis of 4-(3-nitro-4-methoxyphenyl)-, 4-(2,5-dimethoxy-3-nitrophenyl)- and 4-(2,5-di-
methoxy-4-nitrophenyl)-1,2,3-thiadiazoles and their reduction to amines with zinc and acetic acid in isopropyl
alcohol was studied. On the basis of the obtained amines and salicylic aldehyde, Schiff bases exhibiting a
luminescent ability were synthesized.
Keywords: 4-phenyl-1,2,3-thiadiazoles, nitration, reduction, salicylic aldehyde, Schiff bases
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021