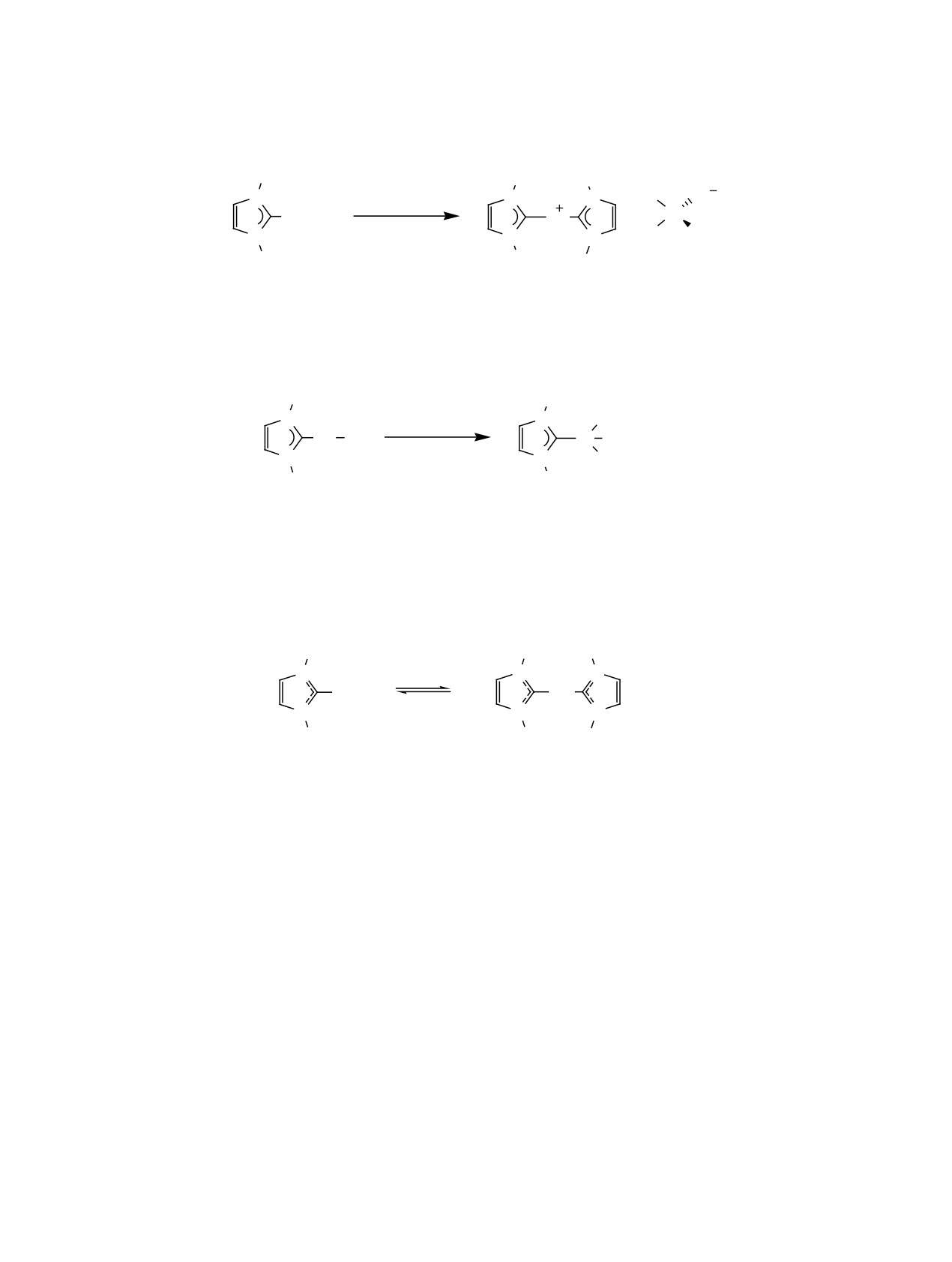ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 11, с. 1723-1779
УДК 547.1’1(9’56’57)
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
N-ГЕТЕРОЦИКЛИЧЕСКИХ КАРБЕНОВЫХ
КОМПЛЕКСОВ МЕТАЛЛОВ 11 ГРУППЫ В РЕАКЦИЯХ
ПЕРЕМЕТАЛЛИРОВАНИЯ (ОБЗОР)
© 2021 г. В. Н. Михайлов, И. А. Балова*
Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: i.balova@spbu.ru
Поступило в Редакцию 3 августа 2021 г.
После доработки 30 сентября 2021 г.
Принято к печати 4 октября 2021 г.
Перенос карбена с N-гетероциклических карбеновых комплексов металлов 11 группы (NHC-MC), особен-
но серебра и меди, на другие металлы в настоящее время рассматривается как удобный, универсальный,
а иногда и безальтернативный метод синтеза широкого набора важных N-гетероциклических карбеновых
комплексов переходных металлов. По мере роста количества примеров успешного переметаллирования с
образованием целевых продуктов накапливались данные об альтернативных результатах взаимодействия
комплексов NHC-MC с соединениями других металлов. Примеры таких превращений, которые протекают
не по стандартному реакционному пути, а с изменением степени окисления металлов, превращением
гетеролептических комплексов (NHC)MСX в катионные гомолептические формы [(NHC)2MС]+, пере-
металлированием с сохранением другого металла в координационной сфере продукта, образованием
биметаллических аддуктов с сохранением связи MС-Cкарбен обсуждаются в обзоре. Отдельно рассма-
тривается переметаллирование, протекающее в «обратном» направлении - на металлы 11 группы. В
обзоре сделана попытка определить возможные механизмы и движущие силы таких превращений, а
также проиллюстрированы аспекты практического применения получаемых продуктов, прежде всего,
в различных каталитических процессах.
Ключевые слова: N-гетероциклические карбеновые комплексы металлов 11 группы, монетные метал-
лы, переходные металлы, «обратный» перенос карбена, гетерометаллические комплексы и кластеры,
металлокомплексный катализ
DOI: 10.31857/S0044460X21110093
1. Введение
1724
2. «Обратный» перенос карбена
1725
3. Перенос карбена, протекающий с изменением степени окисления металлов
1732
4. Превращение гетеролептических N-гетероциклических карбеновых комплексов
1740
(NHC)MCX в катионные гомолептические комплексы [(NHC)2MC]+ под действием
соединений других металлов
5. Переметаллирование с сохранением другого металла в структуре продукта
1744
6. Реакции с образованием биметаллических аддуктов с сохранением связи NHC-MС
1747
7. Возможные механизмы и движущие силы реакций переметаллирования и родственных
1759
процессов
8. Применение продуктов реакций N-гетероциклических карбеновых комплексов металлов
1761
11 группы с соединениями других металлов
9. Заключение
1769
1723
1724
МИХАЙЛОВ, БАЛОВА
Схема 1.
n
N
N
N
N
R
R
N
N
R
R
R
R
SIMe (R = Me)
IMe (R = Me)
6-Mes (n = 1, R = 2,4,6-Me3C6H2)
SIEt (R = Et)
IEt (R = Et)
6-Dipp (n = 1, R = 2,6-iPr2C6H3)
SIMes (R = 2,4,6-Me3C6H2)
ITol (R = 4-MeC6H4)
7-Mes (n = 2, R = 2,4,6-Me3C6H3)
SIPr (R = 2,6-iPr2C6H3)
IMes (R = 2,4,6-Me3C6H2)
7-Dipp (n = 2, R = 2,6-iPr2C6H3)
IPr (R = 2,6-iPr2C6H3)
Схема 2.
+
M
NHC
MC
NHC
M
-
MC
M
= Pd, Pt, Ni, Co, Rh, Ir, Fe, Ru, Os, Mn, Re, Cr, Mo, W, Ga, Al;
MC
= Cu, Ag, Au
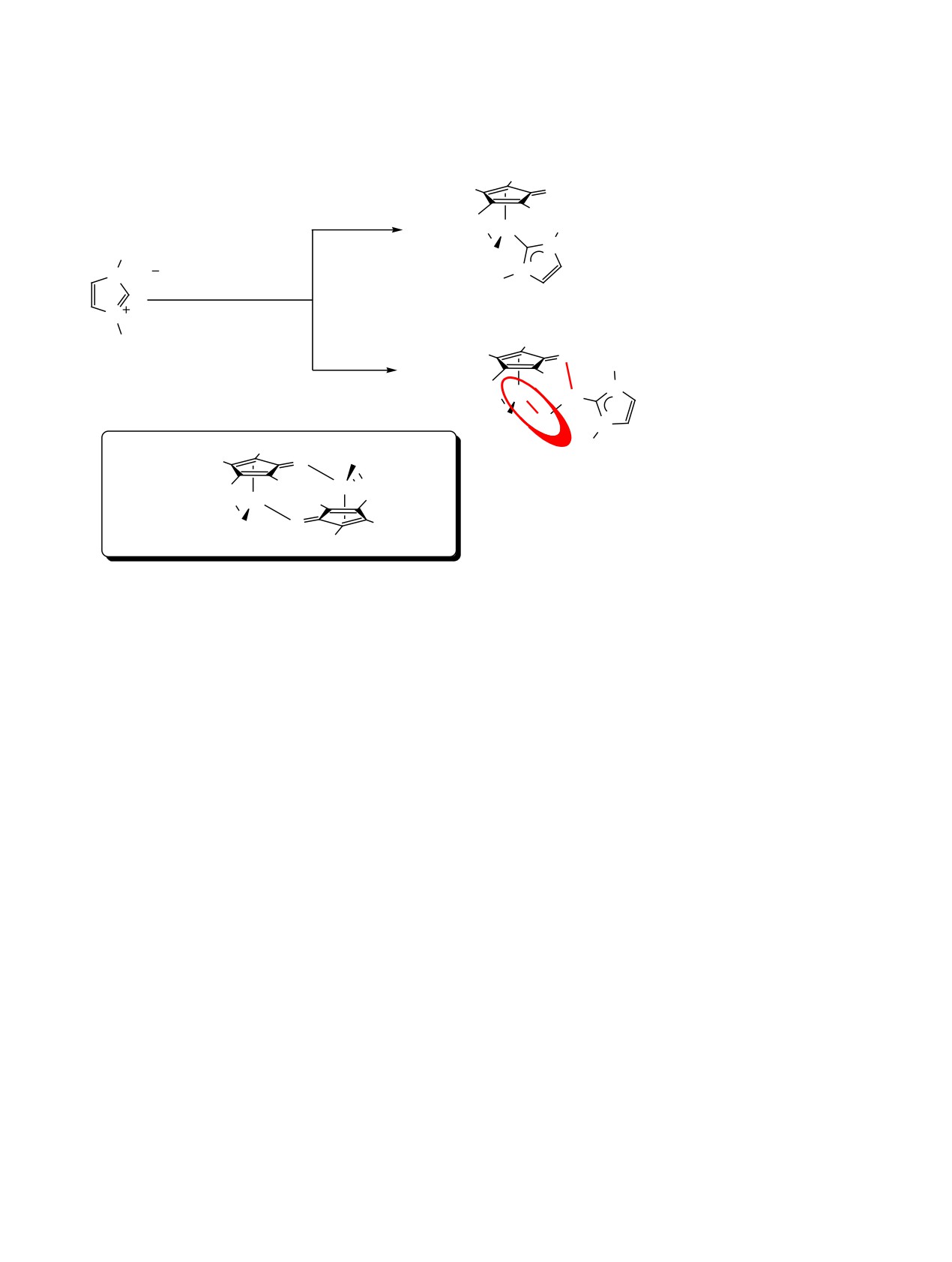
1. ВВЕДЕНИЕ
В последние годы активно развивается альтер-
нативный подход к синтезу TM-NHC через реак-
Благодаря выраженной способности стабили-
цию переметаллирования (схема 2) с использо-
зировать редкие соединения металлов в самых
ванием малочувствительных к кислороду и влаге
разных степенях окисления, диаминокарбены
переметаллирующих агентов, таких как N-гете-
(схема 1) являются ключевыми лигандами, а их
роциклические карбеновые комплексы серебра(I),
комплексы с различными переходными металла-
реже меди(I), и совсем редко золота(I) (далее
ми находят применение в биомедицине [1-10], в
NHC-MС). Первые примеры переноса карбена с
качестве катализаторов для широкого спектра ор-
серебра(I) и меди(I) описаны в 1998 году в работе
ганических реакций [11-22], а также в разработке
Лина [28] и 2010 году в работе Казин [29] соответ-
функциональных и люминесцентных материалов
ственно. Реакция проста в исполнении и обычно
[23-25].
протекает с образованием нерастворимого в усло-
Традиционно синтез N-гетероциклических
виях реакции побочного продукта (MСX), который
карбеновых комплексов переходных металлов
легко удаляется простым фильтрованием, что су-
(TM-NHC) осуществляется через предварительное
щественным образом упрощает обработку реак-
получение свободного карбена с последующим
ционной смеси и выделение целевого комплекса в
комплексообразованием, что требует использова-
индивидуальном виде.
ния инертной атмосферы и сильных оснований
[26]. Другой популярный современный метод син-
В настоящее время опубликовано более 500 ра-
теза данных комплексов заключается в обработке
бот, а также ряд обзоров [26, 29-40], где показана
смеси соответствующей азолиевой соли и предше-
широкая применимость и эффективность переме-
ственника переходного металла с помощью сла-
таллирования как инструмента синтеза карбено-
бых оснований (чаще K2CO3) [27].
вых комплексов переходных металлов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1725
Известны примеры переноса карбенов с нике-
ля [41], ртути [42,43], хрома [44-51], молибдена
[44,52], и вольфрама [44, 53-70]. Однако среди дру-
гих N-гетероциклические карбеновые комплексы
серебра(I) и меди(I) значительно чаще представле-
ны в качестве агентов для переноса карбена.
В рамках подготовки материала настоящего об-
зора был произведен литературный поиск и ана-
лиз с использованием базы данных SciFinder для
выявления примеров реакций переноса карбена с
NHC-MС на любые другие металлы. Из получен-
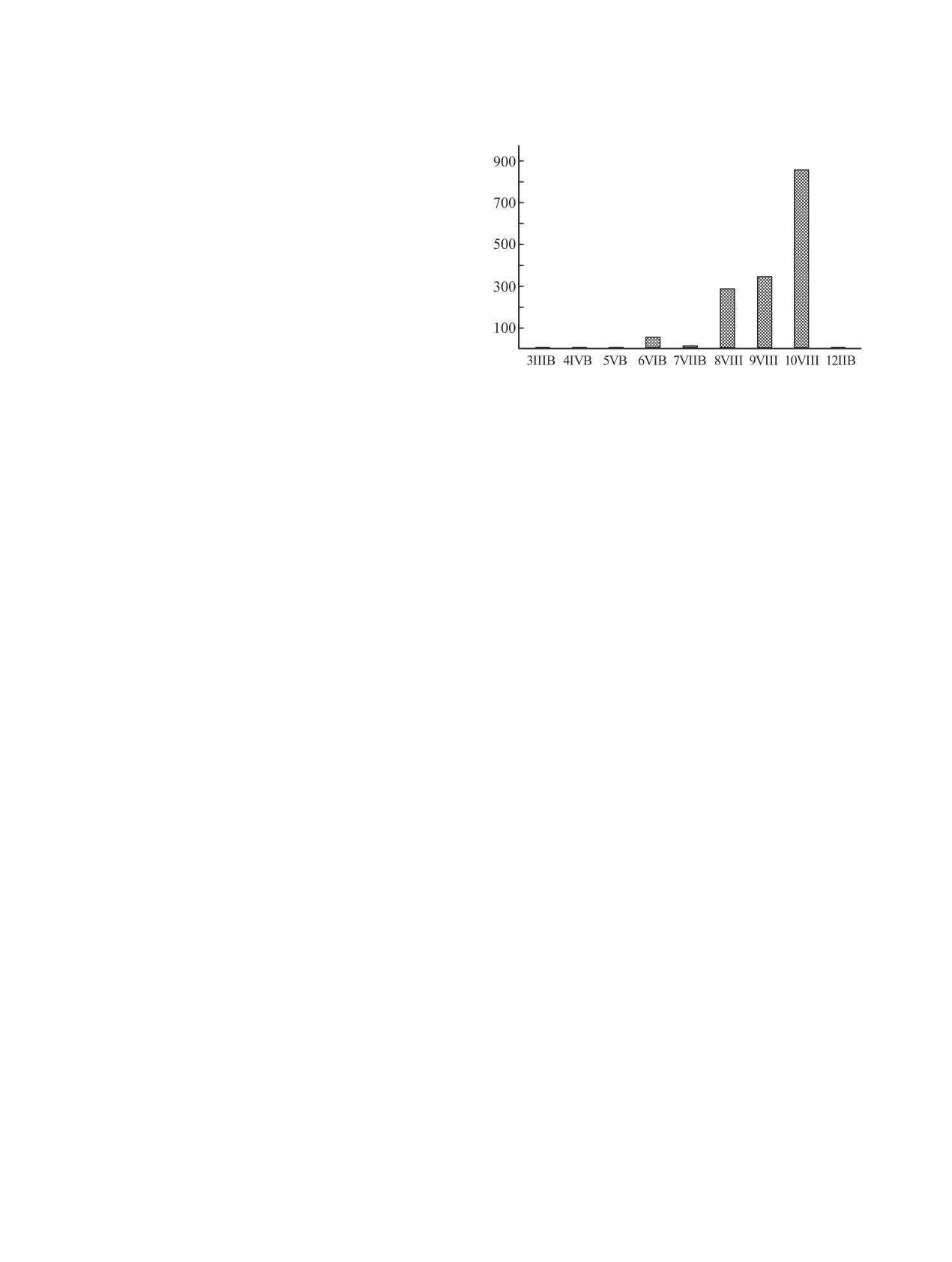
ных статистических данных (рис. 1) следует, что
Рис. 1. Количество примеров переноса карбена с
до сих пор неизвестны примеры переноса карбена
NHC-MС на другие переходные d-металлы.
с NHC-MС на металлы 3(VIIB), 4(IVB), 5(VB) и
12(IIB) групп. При этом известно, в общей слож-
ности, более 1500 примеров успешного переметал-
ное или неожиданное направление протекания
лирования с NHC-MС на металлы 6(VIB), 7(VIIB),
реакции переноса карбена позволяет критиче-
8-10(VIII) групп. Чаще всего переметаллирование
ским образом взглянуть на факторы, определяю-
осуществляется на металлы платиновой груп-
щие селективность и реакционную способность
пы [35, 40]. В качестве растворителя в условиях
исследуемых субстратов (раздел 7). По нашему
данных превращений, как правило, используют
мнению, анализ подобного материала важен для
CH2Cl2 (в 70% случаев), реже ацетонитрил, ТГФ
определения возможностей и ограничений подхо-
и др.
да к синтезу гетероциклических карбеновых ком-
Несмотря на широкие возможности метода,
плексов металлов через перенос карбена, а также
его высокую хемоселективность и толерантность
позволит рассмотреть возможные механизмы и
к функциональным группам, по мере роста коли-
движущие силы таких превращений. Более того,
чества примеров ожидаемого протекания реакций
нередко получаемые продукты обладают полезны-
переметаллирования с образованием целевых про-
ми свойствами. Например, обсуждаемые в обзоре
дуктов, появилось заметное количество примеров
гетерометаллические системы могут выступать
альтернативных превращений с переносом карбена
в качестве высокоэффективных катализаторов за
в «обратном» направлении, а также неожиданные
счет кооперативного эффекта металлов (раздел 8).
или нестандартные результаты взаимодействия
Альтернативные пути реакций N-гетероцикличе-
комплексов NHC-MС с соединениями, содержа-
ских карбеновых комплексов металлов 11 группы
щими другой металл, которые сопровождались:
с соединениями других металлов также открыва-
- изменением степени окисления металлов
ют путь к получению новых соединений с ценны-
(раздел 3);
ми свойствами, синтез которых другими методами
- превращением гетеролептических NHC-MС в
недоступен. Мы надеемся, что данная работа бу-
катионные гомолептические формы [(NHC)2MC]+
дет полезна для специалистов самых различных
(раздел 4);
областей, так как TM-NHC являются объектами
- переметаллированием с сохранением другого
исследования огромного множества химических и
металла в координационной сфере продукта (раз-
междисциплинарных проектов.
дел 5);
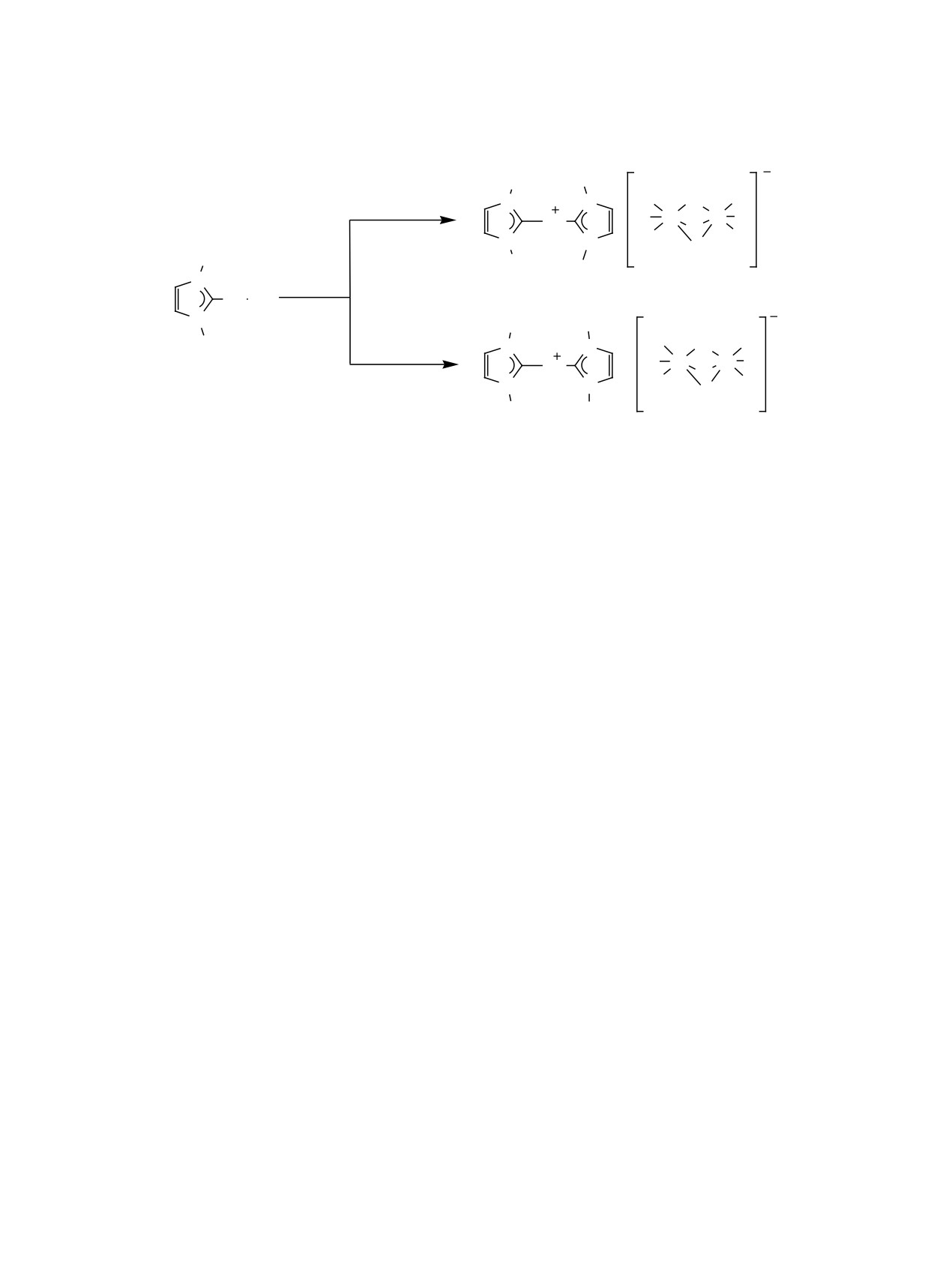
2. «ОБРАТНЫЙ» ПЕРЕНОС КАРБЕНА
- образованием биметаллических аддуктов с
сохранением связи NHC-MС (раздел 6).
Принято считать, что для успешного протека-
Работ, посвященных обобщению, систематиза-
ния реакции переноса карбена с NHC-MС ком-
ции и анализу таких случаев, на данный момент,
плексов на любые другие металлы в процессе та-
не представлено. Однако зачастую альтернатив-
кого превращения должны формироваться более
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1726
МИХАЙЛОВ, БАЛОВА
Схема 3.
N
N
N
N
Mes
Mes
Mes
Mes
Cl
Ru
Ru
Cl
40°C
Cl
Cl
Ph
O
O
PCy3
1
CuCl
2 (85%)
O
O
CH2Cl
2
O
O
N
N
N
N
Ru
Cl
Cl
Ph
IBiox
PCy3
3
O
O
N
N
Cl
20°C
Ru
4:5:6 = 1:1:0.6
Cl
O
4
O
O
PCy3
N
N
Ru
+
Cl
+
Cl
Cu
O
Cl
5
6
прочные связи Скарбен-M [30]. Так, энергия связи
реакции также благоприятствует выделение нера-
Скарбен-M, как правило, снижается в ряду Ag < Cu <
створимых солей металлов 11 группы.
Au [71]. По этой причине зачастую перенос кар-
В данном разделе рассматриваются примеры
бена наблюдается только в следующем порядке: c
реверсного направления протекания реакции пере-
Ag на Cu или Au, с Cu на Au. Также известно, что
металлирования с образованием формально менее
перенос карбенов, как правило, осуществляется с
прочной связи Скарбен-M.
металлов 11 группы на металлы платиновой груп-
Превращение комплекса 1, содержащего насы-
пы [26, 34, 35, 38-40], а не наоборот, что также
щенный гетероциклический карбеновый лиганд
может объясняться образованием более прочных
1,3-бис(2,4,6-триметилфенил)-4,5-дигидроимида-
связей Скарбен-M в сравнении с Скарбен-MС и опре-
зол-2-илиден (SIMes) под действием 1-винил-2-
деляет направление переметаллирования. Смеще-
изопропоксибензол в присутствии CuCl в качестве
нию равновесия в сторону образования продуктов
акцептора фосфина дает комплекс 2 - высокоак-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1727
Схема 4.
N
N
R
Mes
N
N
MC = Cu или Au
Cl
N N
R
Mes
R
Mes
Cl
Ru
Ru
5 ч
Cl
MC
O
O
Cl
Ph
Cl
R
Mes
N N
9, MC = Cu (86%)
MCCl
8
10, MC = Au (39%)
7
91% (MC = Cu)
CD2Cl2
45% (MC = Au)
50°C
R = циклооктил
N
N
Mes
Mes
N
N
Cl
MC = Cu
Mes
Mes
Cl
N
N
Ru
R
Mes
Ru
Cl
Ph
1 ч
Cl
Cu
R
Mes
O
N N
Cl
11
12 (95%)
13 (75%)
тивный катализатор в метатезисе диенов (схема 3)
помощью CuCl или AuCl [74]. Так, реакция ком-
[72]. Комплекс 3, содержащий бисоксазолинкар-
плекса 7, содержащего два ненасыщенных N-гете-
беновый лиганд (схема 3, IBiox), в подобных ус-
роциклических карбена, с CuCl или AuCl в среде
ловиях также превращается в целевой комплекс
хлористого метилена в присутствии 1-винил-2-
4, однако побочными продуктами такой реакции
изопропоксибензола протекает с образованием
являются комплексы 5 и 6 в соотношении 1:1:0.6
комплекса рутения 8 и карбеновых комплексов
соответственно. Комплекс 5, который выделен с
меди 9 или серебра 10, формально продуктов
помощью хроматографии в индивидуальном виде,
«обратного» переноса карбена (схема 4), причем
можно рассматривать как продукт «обратного»
в условиях превращения хлорид меди(I) проявлял
переноса карбена с Ru на Cu. Данный пример де-
большую реакционную способность в сравнении
монстрирует влияние природы самого карбеново-
с AuCl.
го лиганда на исследуемую реакцию. Возможно,
Важно, что реакция смешанного карбенового
различие в реакционной способности комплек-
комплекса рутения 11, содержащего насыщенный
са 1 и 3 связано с большей лабильностью связи
(SIMes) и ненасыщенный (IMes) гетероцикличе-
Скарбен-Ru с IBiox, так как ненасыщенные карбе-
ские карбеновые лиганды, с CuCl в идентичных
ны в сравнении с насыщенными обладают менее
условиях протекала с большей скоростью в срав-
выраженными как σ-донорными, так и π-акцептор-
нении с комплексом 7 и показывала высокую се-
ными свойствами [71, 73].
лективность в отношении переноса карбена. Так, в
Примечательно, что подобное направление
процессе данной реакции протекал перенос имен-
«обратного» переметаллирования может быть ис-
но ненасыщеного карбена на медь с образованием
пользовано для активации бис-NHC-комплексов
комплекса 13, а насыщенный SIMes сохранял связь
рутения путем превращения в соответствующий
с Ru, превращаясь в комплекс 12. Можно предпо-
моно-NHC-комплекс, проявляющий высокую
ложить, что различие в реакционной способности
активность в условиях метатезиса олефинов за
комплексов 7 и 11 связано с большей лабильно-
счет связывания второго карбенового лиганда с
стью связи Скарбен-Ru с IMes в сравнении с SIMes.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1728
МИХАЙЛОВ, БАЛОВА
Схема 5.
Rh2(CF3COO)3(cod)
N
N
N
N
Mes
Mes
CF3CO2Ag
Mes
Mes
избыток CF3CO2Ag
N
N
Mes
Mes
Rh
Rh
CH2Cl2
CH2Cl2
Cl
CF
3CO2
Ag
-AgCl
Mes
Mes
N N
15 (65%)
14
16 (27%)
Можно обнаружить также примеры перено-
о высоком сродстве Ag(I) к шестичленному насы-
са циклических алкиламинокарбенов (CAAC) на
щенному циклическому карбену. Однако вопрос
CuCl из соответствующих бис-CAAC-комплексов
о движущих силах «обратного» переметаллиро-
рутения [75, 76].
вания остается малоисследованным, и, наряду с
предположением авторов, можно допустить влия-
Перенос карбена с рутения на серебро в про-
ние на протекание процесса природы противоиона
цессе реакции N-гетероциклического карбенового
X в составе соли серебра AgX [78].
комплекса RuCl2(IMes)(py)2(=CHPh) с избытком
изоцианата серебра(I) (AgOCN) в среде бензола
Перенос карбена с комплексов серебра(I) на
при комнатной температуре сопровождается об-
другие металлы является надежным способом
разованием целевого продукта анионного обмена
синтеза комплексов пинцерных бис-NHC-лиган-
Ru(OCN)2(IMes)(py)2(=CHPh)
[77] со следовы-
дов, содержащих пиридиновый линкер, с различ-
ми количествами гомолептического комплекса
ными переходными металлами [79], а анионный
[(IMes)2Ag]2(OCN). Учитывая следовые коли-
обмен с солями серебра(I) часто используется для
чества [(IMes)2Ag]2(OCN), сложно данный при-
постсинтетической модификации таких хелатных
мер рассматривать как «обратное» переметалли-
систем. Однако известен пример, когда при попыт-
рование. Более того, нельзя исключать реакцию
ке провести реакцию анионного обмена хелатного
AgOCN с IMes∙HCl как возможного побочного
комплекса Ni(II) 17 с AgOTf в тетрагидрофуране
продукта незначительного гидролиза исходного
наблюдали «обратное» переметаллирование с фор-
комплекса рутения.
мированием комплекса 19 (схема 6), структура ко-
торого установлена с помощью данных РСА [80].
Реакция комплекса родия 14, содержащего в
качестве лигандов циклооктадиен и 6-членный
Реакция структурно подобного комплекса Ni(II) 18
с AgNO3 также вместо ожидаемого продукта ани-
насыщенный циклический карбен (6-Mes), с 1.0
онного обмена протекала с образованием кластера
экв. CF3COOAg приводит к ожидаемому продукту
Ag(I) 20 и комплекса Ag(I) 21 [81]. Оба соединения
анионного обмена 15 с выходом 65% и выделению
в виде осадка нерастворимого в этой среде AgCl
могут рассматриваться как продукты «обратного»
переметаллирования.
(схема 5) [78]. Примечательно, что использование
избытка CF3COOAg в данной реакции приводит
Другой хелатный бис-NHC-комплекс Ni(II)
к замещению Rh(I) на Ag(I) и образованию кати-
22Br, к удивлению авторов, при обработке AgOAc
оно-анионного соединения 16, включающего го-
или AgO2CCF3 вместо целевого продукта ани-
молептический катион (6-Mes)2Ag и противоион
онного обмена давал комплексы Ag(I) 23 или 24
Rh2(CF3COO)3(COD), структура которого надежно
соответственно (схема 7) [82]. Казалось бы, мень-
установлена с помощью РСА. Авторы предпола-
шая растворимость AgI в сравнении с AgBr могла
гают, что данный необычный процесс переноса
способствовать целевому направлению реакции,
карбена с родия(I) на серебро(I) свидетельствует
однако попытка использовать иодидный комплекс
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1729
Схема 6.
R
R
2 OTf
N N N N N
2 экв. AgOTf
Ag
Ag
ТГФ
R
R
N N N N
N
Y
R
R
N
N N
Ni
19
N
N Br
)
17 (R = Me, Y = AgI2
избыток AgNO3
18 (R = H, Y = Br)
[(NHC)2Ag7(NO3)7]x
+ (NHC)AgNO3
MeOH
25°C
20
21
(R = H, Y = Br)
Схема 7.
N
N
2 экв. AgY
N
N
N
Ni
CH3CN
N
N
N
70°C
Ag Ag
X X
YY
22Br, 22I
23 (Y=OAc, 68%), 24 (Y= O2CCF3, 70%)
22I в идентичных условиях также дала вместо
В работе [83] изучался динамический процесс
иодида серебра его карбеновый комплекс. Так-
лигандного обмена между комплексами Pd(II) и
же примечательно, что комплекс 23 не вступал в
Au(I), содержащими N-гетероциклические карбе-
реакцию переметаллирования с NiBr2(PPh3)2, что
новые и трифениларсиновые лиганды. Процессы
контрастирует с классической реакционной спо-
обмена изучали с помощью спектроскопии ЯМР
собностью соединений серебра(I), а обработка
1H в CD3CN при 80°С в течение 24 ч (схема 8).
комплекса 22Br тетрагидротиофеновым комплек-
С помощью определения равновесных концен-
сом AuCl приводило к анионному обмену OAc на
траций, было показано, что в исследуемых усло-
Cl. Авторы объясняют данное направление реак-
виях реакция бис-NHC-комплекса (IMe)2PdCl2 с
ции принципами ЖМКО (карбен и Ag(I) - мягкие
(Ph3As)AuCl сопровождается лигандным обме-
центры) и Ле Шателье (смещением равновесия
ном с полной конверсией исходных соединений
из-за выпадения в осадок безводного NiBr2 в усло-
в моно-NHC-комплекс (IMe)(Ph3As)PdCl2 и (IMe)
виях реакции). Таким образом, вышеприведенные
AuCl [схема 8, (1)], что можно рассматривать как
примеры «обратного» переметаллирования снова
карбеновый перенос с Pd на Au. При этом реакции
заставляют задуматься о возможной критической
моно-NHC-комплекса (IMe)AuCl с (Ph3As)2PdCl2
роли аниона X в составе соли AgX на направление
и (IMe)(Ph3As)PdCl2 с трифениларсиновым ком-
переноса карбена.
плексом золота(I) (Ph3As)AuCl сопровождаются
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1730
МИХАЙЛОВ, БАЛОВА
Схема 8.
Ph
Ph
Ph
N
N
N
N
N
N
Me
Me
Me
Me
As
Me
Me
CD3CN
Au
(1)
Cl
Pd
Cl
+
Au
Cl
Pd
Cl
+
80°C
Cl
Cl
24 ч
As
Me
Me
N N
Ph
Ph
Ph
Ph
Ph
Ph
Ph
N
N
Ph
Ph
N
N
Me
Me
As
Me
Me
As
CD3CN
Au
(2)
Cl
Pd
Cl
+
Cl Pd Cl
+
Au
80°C
Cl
As
As
24 ч
Cl
Ph
Ph
Ph
Ph
Ph
Ph
Ph
Ph
Ph
Ph
Ph
Ph
N
N
N
N
Me
Me
Me
Me
As
As
CD3CN
Cl Pd Cl
Au
(3)
Cl
Pd
Cl
+
Au
+
80°C
As
Cl
As
Cl
24 ч
Ph
Ph
Ph
Ph
Ph
Ph
N
N
N
N
Me
Me
Me
Me
CD3CN
(4)
Cl
Pd
Cl
+
Au
80°C
As
Cl
24 ч
Ph
Ph
Ph
неполным переметаллированием в идентичных
селективного расщепления связи Pd-Cкарбен у не-
условиях [схема 8, (2) и (3)] (возможно, устанавли-
насыщенного карбена. Анализ остатка маточного
вается равновесие), а реакция (IMe)(Ph3As)PdCl2 с
раствора после реакции методом спектроскопии
(IMe)AuCl [схема 8, (1)] вовсе не протекает. Дан-
ЯМР 1H показал образование димерного карбе-
ные процессы переметаллирования оказались кри-
нового комплекса палладия(II) [(SIEt)PdCl2]2, кар-
тически важны для более глубокого понимания
бенового комплекса серебра(I) (IEt)AgCl и соли
реакционной способности смешанных каталити-
имидазолия IEt·HCl с выходами 72, 45 и 51% со-
ческих систем в реакциях кросс-сочетания [83].
ответственно [схема 9, (1)]. Таким образом, в дан-
Существует пример «обратного» переметал-
ных условиях протекало селективно «обратное»
лирования с Pd(II) на Ag(I). Так, кипячение сме-
переметаллирование с Pd на Ag. В то же время в
шанного sNHC-NHC-комплекса (IEt)(SIEt)PdCl2
реакции бисфункционализированного насыщен-
(смесь цис- и транс-изомеров) в среде CH3CN в
ным карбеном SIEt комплекса trans-(SIEt)2PdCl2 с
течение 48 ч в присутствии AgBF4 с последующим
AgBF4 в идентичных условиях не фиксировалось
анионным обменом с LiCl приводит к продуктам
расщепление связи Pd-Cкарбен. Данный процесс со-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1731
Схема 9.
N
N
1) AgBF4, CH3CN
Et
Et
Et
Cl-
N
N
N
N
80°C
N
N
Et
Et
Et
Et
2) LiCl
Et
Et
N
Cl
Cl
Pd
Cl
H
+
Et
+
+
Cl
Pd
Cl
Pd
Ag
N
+
N
Cl
Pd
Cl
Cl
Cl
Et
Et
Et
N N
N
Et
Et
Et
N N
(1)
1) AgBF4, CH3CN
N
N
N
N
Et
Et
80°C
Et
Et
2) LiCl
Cl
Cl
Pd
Cl
Et
Pd
(2)
N
Cl
Et
Et
N N
N
Et
Схема 10.
2PF6
[Cu(NCMe)4]PF6
PF
OTf-
N
6
AgOTf
N
Cs2CHO3
N+ H
N+
N
N
CH3CN
H
Cu
CH3CN
H
Ag
N
N
N
N
60°C
20°C
N
N
25
26 (92%)
27 (67%)
провождался Ag-промотируемой транс/цис-изо-
мый с помощью реакции соли бисимидазолия 25 с
меризацией комплекса [схема 9, (2)].
[Cu(NCMe)4]PF6 в присутствии основания Cs2CO3,
вступал в реакцию переметаллирования с AgOTf c
Таким образом, ненасыщенный карбен IEt мо-
образованием комплекса Ag(I) 27 (схема 10) [88].
жет быть перенесен с Pd(II) на Ag(I), а насыщен-
При этом стандартный протокол синтеза NHC-
ный SIEt не подвергается переносу в исследуемых
Ag(I) через обработку соли 25 с помощью Ag2O
условиях. Можно предположить, что селектив-
не приводил к соответствующему комплексу, что
ность наблюдаемого процесса обусловлена боль-
делает реакцию «обратного» переметаллирования
шим σ-донорным [84] и π-акцепторным [85, 86]
особенно полезной в данном случае.
характером насыщенного NHC в сравнении с нена-
В свою очередь, перенос карбена с Cu на Au
сыщенным и, как следствие, большим транс-эф-
в условиях реакции переметаллирования также
фектом первого, что делает связь Pd-Cкарбен(NHC)
является типичным превращением. Однако обра-
более лабильной в процессе лигандного обмена.
ботка комплекса Au(I) 28 с помощью 2 экв. CuI в
Известно, что перенос карбена в условиях ре-
ТГФ при комнатной температуре в течение ночи
акции переметаллирования, как правило, проте-
приводит к образованию смеси, из которой вы-
кает с серебра на медь [34, 87]. Однако есть ред-
делены два комплекса: гексаядерный комплекс
кие примеры переметаллирования в обратном
меди(I) 29 с двумя параллельными линейными
направлении. Так, комплекс Cu(I) 26, генерируе-
трехъядерными группами атомов меди, включаю-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1732
МИХАЙЛОВ, БАЛОВА
Схема 11.
CF3SO3
CF3SO3
2·CF3SO3
(But)2P
N N P(tBu)
2
N
N
N
N
(But)2P
P(tBu)2
2 экв. CuI
(But)2P
P(tBu)2
Cu
Cu
Cu
2
Au
I
I
I I
I
+
Au Au Au
ТГФ
20°C
I
Cu
Cu
Cu
(But)2P
P(tBu)2
(But)2P
P(tBu)2
N N
N N
(But)2P
P(tBu)2
N N
28
29
30
29:30 = 2:1
щие характерные мостиковые атомы иода, и трехъ-
комплексов с NHC, может также способствовать
ядерный иодидный комплекс золота(I) 30 с двумя
«обратному» переметаллированию путем смеще-
трифлат-анионами (схема 11) [89]. Соотношение
ния равновесия в реакциях.
данных соединений в реакционной смеси, по дан-
3. ПЕРЕНОС КАРБЕНА, ПРОТЕКАЮЩИЙ
ным спектроскопии ЯМР 1H, составило 29:30 =
С ИЗМЕНЕНИЕМ СТЕПЕНИ
2:1. По данным РСА, в обоих комплексах, получен-
ОКИСЛЕНИЯ МЕТАЛЛОВ
ных в чистом виде в других реакциях, существуют
металлофильные взаимодействия. Таким образом,
При окислительно-восстановительном переме-
этот пример представляет необычный процесс
таллировании перенос лиганда от одного металла
переметаллирования с золота(I) на медь(I). Обра-
к другому сопровождается изменением степени
ботка комплекса 28 2 экв. Ag(O3SCF3) или 3 экв.
окисления обоих металлических центров. Данная
AgPF6 в среде MeCN при комнатной температуре
реакция является термодинамически выгодной,
приводила лишь к координации ионов серебра по
если металл-донор, связанный с переносимым ли-
фосфиновым лигандам с образованием трехъядер-
гандом, более электроотрицательный в сравнении
ных гетерометаллических (Ag2Au) комплексов и с
с металлом-акцептором и металл-донор находится
сохранением Au-Cкарбен-Au связи.
в высокой степени окисления, а металл-акцептор в
низкой. Особое место в окислительно-восстанови-
Завершая рассмотрение примеров «обратного»
тельном переметаллировании занимают комплек-
переноса карбена в процессе реакции переметал-
сы ртути(II) [42, 90, 91].
лирования, можно отметить, что природа лиган-
да, влияющая на характер связи металл-карбен,
Стандартное переметаллирование с перено-
играет ключевую роль в данном процессе. Так,
сом карбена из NHC-MC-комплексов на соедине-
при наличии насыщенного NHC и ненасыщенного
ния других металлов не сопровождается окисли-
NHC в структуре исходного комплекса в реакции
тельно-восстановительными процессами. В то же
обратного переметаллирования протекает перенос
время обнаружены примеры переноса карбена,
исключительно ненасыщенного NHC, что может
протекающие с изменением степени окисления
быть связано с лабильностью соответствующей
металла-акцептора.
связи металл-карбен. Возможность «обратного»
Направление реакции NHC-Ag(I)-комплекса
переметаллирования определяется сродством об-
31 со стехиометрическим количеством димерных
разующихся связей, что может быть объяснено
комплексов Ru(II) зависит от природы вспомога-
принципом ЖМКО или особенностями структур-
тельных лигандов. Так, реакция комплекса 31 с
ной периферии. Низкая растворимость безлиганд-
[Ru(p-cymene)Cl2]2 при комнатной температуре в
ных соединений металла, высвобождающихся из
среде CH2Cl2 сопровождается выделением осадка
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1733
Схема 12.
i-Pr
t-Bu
t-Bu
H
Ru
N
N
O
[Ru(p-cymene)Cl2]
2
Ph
N+
N
−AgCl↓
N
N
Ph
79%
Cl-
32
O
t-Bu
N
N
t-Bu
Ag Ag
t-Bu
N
N
t-Bu
O
CH2Cl2
t-Bu
20oC
N
N
N
Cl
Ph
RuCl2(PPh3)3
t-Bu
Cl
N
Ru
31
-Ag0↓
N
PPh3
67%
O
N
Ph
33
Схема 13.
Bu
N
N
Cl
N
PF6
N
1) Ag2O, CH2Cl2
N
M
Br
2) 1/4 [MCl(COE)2]2, KPF6
N
N
N
Cl
N
Bu
Bu
COE ≡
цис-циклооктен
34 (60%, M = Rh)
35 (21%, M = Ir)
AgCl и образованием NHC-Ru(II)-комплекса 32, а
да и условий проведения реакции на результат
с RuCl2(PPh3)3 - коллоидного серебра и образова-
переметаллирования. Так, NHC-Ag(I)-комплекс,
нием NHC-Ru(III)-комплекса 33 (схема 12) [92].
предварительно образующийся in situ из бромида
Окислительнo-восстановительный
потенциал
1-бутил-3-(2-пиколил)-1H-имидазолия под дей-
комплекса 31 заметно ниже, чем у простых солей
ствием Ag2O в среде CH2Cl2, вступает в реакцию с
серебра, но достаточен для окисления рутения(II)
комплексами [MCl(COE)2]2 (M = Rh или Ir) в при-
в реакции с RuCl2(PPh3)3, однако недостаточен
сутствии KPF6 с образованием комплексов 34 и 35
для протекания окислительно-восстановительно-
как продуктов окислительно-восстановительного
го переметаллирования с [Ru(p-cymene)Cl2]2, что
переметаллирования (схема 13) [93]. Окислитель-
может объясняться различием лигандного окру-
ное присоединение [MCl(COE)2]2 по связи C-H в
жения. Примечательно, что RuCl2(PCy3)2(=CHPh)
соли имидазолия в качестве причины образования
(катализатор Граббса) не вступал в реакцию с ком-
комплексов 34 и 35 исключено авторами на ос-
плексом 31 в идентичных условиях.
новании наблюдаемого формирования металли-
Описаны и другие примеры, демонстрирую-
ческого серебра как побочного продукта окисли-
щие влияние природы вспомогательного лиган-
тельно-восстановительного переметаллирования.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1734
МИХАЙЛОВ, БАЛОВА
Схема 14.
O O
N N
N
N
N
[Cp*MCl2]2
M
Ag
Ag
NN
CH2Cl2-MeOH
Cl
N
N
N
N
N
CO
2
O
O
37 (93%, M = Rh)
38 (80%, M = Ir)
36
Схема 15.
O
N
Cl
O
N
1) 1.5 экв. Ag2O, MeOH
N
Ir
NN
N
2. 0.5 экв. [Ir(µ-Cl)(COD)]2
O
Br
N
N O
39
40 (38%)
При этом реакция циклооктадиеновых комплексов
В работе [95] авторы обнаружили любопытное
[MCl(COD)]2 (M = Rh или Ir) в подобных условиях
различие в реакционной способности бромидных
приводила к продуктам стандартного переметал-
гетеролептических NHC-Ag(I)-комплексов в зави-
лирования без изменения степени окисления ме-
симости от положения CN-группы в N-бензильном
таллов.
заместителе карбена. Так, NHC-Ag(I)-комплекс
Если проводить реакцию NHC-Ag(I)-комплек-
41, содержащий
4-цианобензильный N-заме-
са 36 с комплексами [Cp*MIIICl2]2 (M = Rh или Ir),
ститель в структуре карбена, вступает в реак-
образуются классические продукты переметалли-
цию переметаллирования с (SMe2)AuICl в среде
рования 37 и 38 (схема 14) с высокими выходами
CH2Cl2 с образованием (NHC)AuICl-комплекса 43
[94]. Использование же NHC-Ag(I)-комплексов в
(схема 16) с высоким выходом. В то же время
качестве переносчиков карбена для синтеза ком-
реакция структурно подобного комплекса 42, со-
плексов иридия NHC-Ir(I) осложнено возмож-
держащего 2-цианобензильный N-заместитель, с
ностью окисления металлического центра. Так,
(SMe2)AuICl в подобных условиях сопровожда-
реакция [MI(μ-Cl)(COD)]2 с комплексом 36 сопро-
ется окислением Au(I) до Au(III) с образованием
вождается образованием неидентифицируемой
NHC-Au(III)-комплекса 44 и образованием не-
смеси продуктов. Однако реакция in situ образу-
растворимых побочных продуктов (предположи-
ющегося из соли 39 NHC-Ag(I)-комплекса 36 с
тельно, металлического серебра со следами AuBr
[Ir(μ-Cl)(COD)]2 сопровождается образованием
и металлического золота) (схема 16) [96]. Данный
продукта окислительно-восстановительного пе-
пример особенно примечателен тем, что исходный
реметаллирования - желтого NHC-IrII-комплекса
гетеролептический комплекс 42 синтезировали пу-
40 с умеренным выходом (схема 15) [94]. Причем
тем обработки соответствующей соли имидазолия
в данных условиях присутствие избытка Ag2O
с помощью Ag2O в среде MeOH. Однако извест-
может оказывать влияние на степень протекания
но, что данные условия способствуют образова-
окислительно-восстановительной реакции.
нию гомолептических бис-NHC-Ag(I)-комплексов
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1735
Схема 16.
CN
N N
R1
Au
Cl
43 (89%)
N
AuCl[S(CH3)2]
Ag Br
CH2Cl2
N
20oC
NC
R2
N N
Bu
41 (R1, R2 = 4-CN, Me)
42 (R1, R2 = 2-CN, Bu)
Cl
Au
Cl
Cl
44 (31%)
Схема 17.
(IMes)AgI
N
N
Mes
Mes
избыток Ln0
THF
I
Ln
ТГФ
I
THF
−Ag0↓
THF
0.5 [(IMes)2Ag]AgI2
46 (33%, Ln = Eu)
45
47 (41%, Ln = Yb)
[97]. Таким образом, можно предположить влияние
ла к образованию редких N-гетероциклических
2-цианобензильного заместителя на стабилизацию
карбеновых комплексов лантанидов(II) 46 и 47
комплекса 42 в гомолептической форме за счет
(схема 17) с выходом 33 и 41% соответственно
близости координирующей CN-группы к метал-
[99]. В реакции используется избыток лантанидов
лоцентру. Возможно, именно это предопределяет
(Ln), что может быть важным для предотвращения
различие реакционной способности комплексов
последующего окисления LnII→LnIII (Ln = Eu и
41 и 42 в исследуемых условиях переметаллиро-
Yb). Структура обоих комплексов установлена ме-
вания. Примечательно, что возможно окисление
тодом РСА. Комплекс 46 обладает яркой желто-зе-
Au(I) до Au(III) в составе NHC-Au(I)-комплексов
леной люминесценцией (λexc 365 нм) с квантовым
без участия ионов серебра [98].
выходом φ 53% (λexc 350 нм). Примечательно, что
Уникальным примером окислительно-восста-
при использовании аналогичного NHC-Ag(I)-ком-
новительного переметаллирования является реак-
плекса, содержащего лиганд IPr, также наблю-
ция NHC-Ag(I)-комплекса 45, который представ-
далась окислительно-восстановительная реак-
ляет собой равновесную смесь гомолептической
ция с Ln0, но она сопровождалась образованием
и гетеролептической форм, со свежеприготовлен-
свободного карбена и комплекса LnI2(THF)n, что
ными Eu0 или Yb0 в среде ТГФ, которая приводи-
можно объяснить легкой диссоциацией из-за бо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1736
МИХАЙЛОВ, БАЛОВА
Схема 18.
N N
N
N
N N
M
M
Ni
t-Bu
O O
t-Bu t-Bu
O
O
t-Bu t-Bu
O O
t-Bu
1
R1
R
R1
N
N
N
N R1
N
N
Ag
Ag
Ag
N
N
N
N
N
R1
R1
R1
N R1
2
R2
R
R2
R2
AgX
2
AgCl2
AgCl2
48
49
0.6 экв. Pd2dba3
0.6 экв. Pd2dba3
50
CH2Cl2
CH2Cl2
20oC
20oC
0.6 экв. Pd2dba3
CH2Cl2
35°C
N N
M
N
N
t-Bu
O O
t-Bu
N N
M
t-Bu
O
O
t-Bu
Ni
t-Bu
O O
t-Bu
R1
R1
N
N
R1
R1
N
N
R1
R1
N
Pd
N
N
Cl Cl
N
2
R1
R2
X X
R
N
Pd
N R1
Pd
N
N
R2
Cl
Cl
R2
51Cl (M, R1, R2, X = Pd, H, Me, Cl)
51Br (M, R1, R2, X = Pd, H, Me, Br)
57 (M, R1, R2 = Pd, H, Me)
52 (M, R1, R2, X = Pd, H, Ph, Cl)
58 (M, R1, R2 = Pd, H, Ph)
53 (M, R1, R2, X = Pd, C4H4, Me, Cl)
59 (M, R1, R2 = Ni, H, Me)
54 (M, R1, R2, X = Ni, H, Me, Cl)
60 (M, R1, R2 = Ni, H, Ph)
55 (M, R1, R2, X = Ni, H, Ph, Cl)
61
56 (M, R1, R2, X = Pd, C4H4, Me, Cl)
лее высокого стерического объема лиганда IPr по
Далее приводятся примеры реакций переме-
сравнению с IMes (%Vbur 39.0 и 31.2% соответ-
таллирования, которые также протекают с изме-
ственно, для длины связи 2.28 Å)[100]. Целевая
нением степени окисления металла-акцептора, но
реакция переметаллирования Eu0 с AgCl(IPr) или
роль Ag+ в качестве металла-донора в окислитель-
[Ag(IPr)2][BPh4] в идентичных условиях не проте-
но-восстановительном переметаллировании не та-
кает, но взаимодействие с [Ag(IPr)2][BF4] сопрово-
кая однозначная.
ждается образованием аддукта IPr∙BF3, что вновь
Реакции переметаллирования NHC-Ag(I) на
может указывать на влияние противоиона в струк-
Pd0 известны [101-113] и все они протекают с со-
туре NHC-Ag(I)-комплекса на успешное протека-
хранением степени окисления палладия. Однако
ние окислительно-восстановительного переметал-
в работе Питерса и соавторов показано [114], что
лирования.
реакция биметаллических комплексов 48 и 49 с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1737
Схема 19.
2·CF3SO3
2·CF3SO3
N
N
N
N
(But)2P
P(tBu)2
(But)2P
P(tBu)2
CH2Cl2
Cl
Ag Pd Ag
Ag Pd Ag
MeCN-CH2Cl2 (10:1)
Cl
(But)2P
P(tBu)2
20oC, 2 недели
(But)2P
P(tBu)2
N N
N N
62
63
0.6 экв. Pd2(dba)3 в среде CH2Cl2 при комнатной
ет Pd(0) до Pd(II), так как наблюдается образова-
температуре сопровождается изменением степе-
ние металлического серебра в условиях реакции.
ни окисления Pd и протекает с образованием бис-
Образование комплекса 51Br в данных условиях
NHC-Pd(II)-комплексов 51Cl, 52-60 (схема
18).
дополнительно может свидетельствовать в пользу
Процесс протекает гладко, а продукты реакции
окислительно-восстановительного переметалли-
рования за счет сохранения галогенидного остатка.
могут быть выделены с помощью колоночной хро-
матографии с выходами 21-73%. Удивительно, что
Однако известен пример [105], когда выде-
попытки синтеза комплексов 51Cl, 52-60 из ком-
ленный после реакции переметаллирования
плексов 48 и 49 через классический маршрут пе-
NHC-Pd(0)-комплекс 62 при стоянии в растворе
реметаллирования, используя соединения Pd(II),
MeCN-CH2Cl2 или в среде MeCN в присутствии
оказались безуспешными. Более того, альтерна-
PtCl2(NCPh)2 нацело окисляется и переходит в
тивный путь синтеза комплекса 51Cl через in situ
хлоридный комплекс NHC-Pd(II) 63 (схема 19) с
обработку соответствующего хлорида имидазолия
сохранением степени окисления включенных в со-
став комплекса металлоцентров Ag(I). Учитывая
с помощью K2CO3 в присутствии PdCl2(CH3CN)2
структуру рассматриваемых примеров комплексов
оказался менее эффективным - выход продукта
Pd(0), можно предположить радикальный или SN2
составил всего 18% по сравнению с 73% в услови-
механизм окислительного присоединения [116]
ях реакции переметаллирования. Сравнительный
молекулы CH2Cl2 с последующими превращения-
эксперимент с использованием аналогичных ком-
ми. Окислительное присоединение CH2Cl2 к фос-
плексов бромида серебра(I) показал критическое
финовым [117] и карбеновым [118] комплексам
влияние природы галогенид-аниона. Так, выход
L2Pd0 хорошо известно, что показывает возмож-
комплекса 51Br в идентичных условиях составил
ность окисления металла под действием хлорсо-
21%, что практически в 3.5 раза меньше хлорид-
держащих растворителей в реакционной смеси, а
ного аналога 51Cl.
не за счет окислительно-восстановительного пере-
В еще одной работе из макроциклического би-
металлирования.
металлического комплекса 50 в подобных условиях
В некоторых случаях в условиях реакции пе-
переметаллирования аналогичный продукт 61 по-
реметаллирования с Cu на Ru изменение степени
лучен с выходом 52% (схема 18) [115]. Все синте-
окисления металла также может быть объяснено
зированные комплексы существовали в виде смеси
не окислительно-восстановительным переметал-
двух диастереомеров. Стоит отметить, что замена
лированием, а переметаллированием металла-ак-
Ni на Pd или Zn в тетрадентантном лиганде сале-
цептора и уже последующим его окислением Cu(I)
нового типа комплекса 50 изменяет его геометрию,
[119].
что драматическим образом сказывается на воз-
В качестве металла-акцептора в условиях окис-
можности протекания реакции переметаллирования.
лительно-восстановительного переметаллирова-
Обсуждая вероятный механизм данного пре-
ния может также выступать хром в составе CrCl2,
вращения, авторы предполагают, что Ag(I) окисля-
меняя свою степень окисления с Cr+2 на Cr+3 [120].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1738
МИХАЙЛОВ, БАЛОВА
Схема 20.
CO
OC
CO
Os
N
N
Mes
Mes
H H
[Os]
Mes
OC
CO
Os
N
[Os]
Ag Cl
Cl H
[Os]
N
CH2Cl2-гексан
60°C
[Os]
Mes
-"AgH" (Ag¯), -CO
64
[Os] = Os(CO)3
Схема 21.
N
N
Mes
Mes
OC
OC
CO
OC
CO
H
M
H
Mes
H
M
H
Me3NO
N
[M]
[M]
Ag Cl
+
[M]
[M]
CH2Cl
2
N
-AgCl¯
H
[M] H
H
[M] H
Mes
65 (M = Os)
66 (M = Ru)
[M] = M(CO)3
Далее обсуждаются примеры переметаллиро-
Карбеновый комплекс осмия 64 был выделен с вы-
вания, которые протекают с изменением степени
ходом 19% после очистки с помощью хроматогра-
окисления металла-донора с сохранением степени
фии и последующей перекристализации.
окисления металла-акцептора в условиях реакции.
При использовании стандартного декарбони-
Все они, как оказалось, сопряжены с гидридным
лирующего агента Me3NO реакция переметал-
обменом.
лирования Os4(µ-H)4(CO)12 или Ru4(µ-H)4(CO)12
Среди редких примеров переметаллирования
c (IMes)AgCl в CH2Cl2 при 20-22°С протекала
NHC-MC с заменой MC на Os [121-125] особое
с предварительной активацией кластеров и со-
место занимает пример с переносом карбена из
провождалась выделением нерастворимой соли
комплекса (IMes)AgCl на гидридный трехядер-
AgCl. В этих условиях продукты переметаллиро-
ный кластер осмия Os3(µ-H)2(CO)10 (схема 20)
вания 65 и 66 могут быть выделены с выходами
[121, 123]. Данное превращение сопровождается
21 и 34% соответственно без замещения гидрид-
образованием смешанного гидридно-хлоридного
ного остатка на Cl- (схема 21). Возможно, именно
кластерного карбенового комплекса осмия 64 и
активация кластера способствовала протеканию
выделением металлического серебра как продукта
переметаллирования без гидрид-хлоридного об-
разложения малостабильного AgH, формирующе-
мена, что полезно учитывать при выборе условий
гося в процессе реакции гидрид-хлоридного обме-
для проведения превращений. Показана возмож-
на. Обмен гидрида на хлорид в осмиевом класте-
ность бис-NHC-функционализации исследуемо-
ре протекает с сохранением трехцентровой связи.
го кластера при использовании Me3NO и 2 экв.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1739
Схема 22.
Mes
Mes
Mes
Mes
Mes
Mes
LiAlH4
N
H
N
H
N
t-Bu LiAlH4
N
H
N
N
Cu
+
Al
H
Cu
O
Cu
Cu
ТГФ-d8
ТГФ-d
8
N
N H
N
N
H
N
N
-95-64°C
-18°C
Mes Mes
Mes
Mes
Mes
Mes
- "CuH"(Cu0)
(6-Mes)AlH3
67
68
69
(IMes)AgCl. Данный факт является редким случа-
сов переходных металлов. Измерение и анализ
ем для подобных систем [31].
окислительно-восстановительных
потенциа-
Интересный пример реакции комплекса NHC-
лов соответствующих пар [Mn] + me → [Mn-m] и
Cu(I) 67 с LiAlH4 описан Макгрегором и Уиттлси
m[(NHC)MC(I)] + e → MC(0)(тв) в растворителях,
[126]. Добавление LiAlH4 к раствору комплекса
используемых в условиях переметаллирования,
67 в ТГФ при комнатной температуре вызвало
может интенсифицировать развитие окислитель-
мгновенное образование желтого раствора, ука-
но-восстановительного переметаллирования как
зывающего, по мнению авторов, на образование
удобного метода синтеза N-гетероциклических
CuH-содержащих частиц. Через несколько минут
карбеновых комплексов металлов в редких сте-
этот желтый цвет переходил в черный с образова-
пенях окисления, так как одновременное окисле-
нием металлической меди. При проведении реак-
ние металл-акцептора в данных условиях будет
ции комплекса 67 с LiAlH4 при -95°С в условиях
совмещено со стабилизацией металла в неустой-
низкотемпературного ЯМР-эксперимента было,
чивой степени окисления за счет координацион-
действительно, зафиксировано образование ги-
ной связи со стабилизирующим высокодонорным
дридного интермедиата 68 (схема 22). На основа-
карбеновым лигандом. Однако изменение степени
нии эксперимента DOSY авторы предположили
окисления металла-акцептора или металла-донора
образование интермедиата 68 с димерной струк-
в условиях протекания реакции переметаллирова-
турой. На гидридную природу интермедиата 68
ния может быть связано не только с окислитель-
указывал сигнал при 0.96 м. д. атомов водорода
но-восстановительным переметаллированием, но
Cu-H в спектре ЯМР 1H. Интермедиат 68 оказал-
и с переметаллированием без изменения степени
ся стабильным до -64°С, выше этой температуры
окисления металлов с последующим окислитель-
в спектре ЯМР 1H наблюдали уширение сигна-
но-восстановительным превращением в реакции с
лов, а при -18°С предположено образование ком-
эндогенными компонентами реакционной смеси.
плекса 69 как продукта внедрения по связи Cu-H.
Использование Pd2(dba)3 вместо соединений пал-
Попытки выделить соединение 68 в кристалли-
ладия(II) может быть полезно для оценки возмож-
ческом виде не увенчались успехом, и образую-
ности оптимизации условий синтеза карбеновых
щиеся кристаллы, пригодные для РСА, оказыва-
комплексов палладия(II) в реакциях переметалли-
лись карбеновым комплексом гидрида алюминия
рования, протекающих крайне медленно или вовсе
(6-Mes)AlH3. Вероятно, (6-Mes)AlH3 образовался в
не протекающих с соответствующими соединени-
результате переметаллирования. Существует так-
ями палладия(II). Переметаллирование различ-
же альтернативный способ синтеза (6-Mes)AlH3
ных карбеновых комплексов меди(I) и серебра(I) с
через свободный карбен 6-Mes с использованием
менее доступного гидридного комплекса алюми-
LiAlH4 может быть рассмотрено в качестве подхо-
ния (Me3N)AlH3 [127].
да для разработки нового метода синтеза стабили-
зированных аланов.
В завершение обсуждения данного раздела,
стоит отметить, что окислительно-восстанови-
Дальнейшее исследование примеров таких ре-
тельное переметаллирование имеет высокий по-
акций может существенно расширить синтетиче-
тенциал для синтеза малодоступных комплек-
ские возможности реакции переметаллирования.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1740
МИХАЙЛОВ, БАЛОВА
Схема 23.
Mes Mes
TiCl4
N
N
Cl
Cl
Cl
Cl
Ti
Ti
Cl
Ag
Cl
Cl
Cl
N
N
Cl
Ar
Mes
Mes
N
72 (83%)
Ag Cl
CH2Cl2
N
Ar
Ar
Ar
Cp
N
N
Cl
Cl
(Cp)ZrCl
3
Cl
Zr
Zr
Cl
Ag
70 (Ar = Mes)
Cl
Cl
Cp
N
N
71 (Ar = 4-Br-2,6-Me2C6H2)
Cl
Ar
Ar
73 (67%, Ar = 4-Br-2,6-Me2C6H2)
4. ПРЕВРАЩЕНИЕ ГЕТЕРОЛЕПТИЧЕСКИХ
73 наблюдалось нековалентное гетерогалогенное
N-ГЕТЕРОЦИКЛИЧЕСКИХ КАРБЕНОВЫХ
взаимодействие концевых атомов хлора аниона
КОМПЛЕКСОВ (NHC)MCX В КАТИОННЫЕ
[{(η5-C5H5)ZrCl}2(η2-Cl)3]- и брома в пара-положе-
ГОМОЛЕПТИЧЕСКИЕ КОМПЛЕКСЫ
нии N-арильного заместителя комплексного кати-
[(NHC)2MC]+ ПОД ДЕЙСТВИЕМ
она 73. Карбеновый атом углерода C-Ag в соеди-
СОЕДИНЕНИЙ ДРУГИХ МЕТАЛЛОВ
нении 72 не отображается в спектре ЯМР 13С{1H}
(100 МГц, ДМСО-d6), что говорит о быстром обме-
Данный раздел посвящен реакциям гетеро-
не лигандов в растворе. Соединение 73 оказалось
лептических NHC-MC-комплексов с соединени-
малорастворимым в стандартных дейтерирован-
ями других металлов (M), которые вместо пере-
ных растворителях, а при растворении в ДМСО-d6
металлирования сопровождаются образованием
быстро разлагалось.
катионных гомолептических бис-NHC-MC-ком-
В другой работе показано [129], что реак-
плексов, в состав которых входят комплексные
ция In(C6F5)3·Et2O, проявляющего высокую кис-
анионы, содержащие M.
лотность по Льюису, с комплексом (IPr)AgCl в
Абернети и соавторами показано [128], что
CH2Cl2 при комнатной температуре также приво-
реакция солей металлов
4 группы TiCl4 или
дит к образованию гомолептического комплекса
(η5-C5H5)ZrCl3 с N-гетероциклическими карбено-
[Ag(NHC)2]+, противоионом в структуре которого
выми комплексами серебра(I) 70 или 71 в среде
выступает [In2(μ-Cl)(C6F5)6]-.
CH2Cl2 при комнатной температуре в инертных
условиях приводит к формированию ионных
В недавней работе показано [130], что реак-
соединений
[Ag(IMes)2]+[(TiCl3)2(η2-Cl)3]-
(72)
ция солей металлов 13 группы AlCl3, GaCl3 и
и
[Ag(NHC)2]+[{(η5-C5H5)ZrCl}2(η2-Cl)3]-
(73)
InCl3 с (IPr)AgCl в среде CH2Cl2 при комнатной
(схема 23), которые после отделения AgCl выде-
температуре в инертных условиях вместо про-
ляются в виде индивидуальных кристаллических
дукта переметаллирования приводит к форми-
продуктов 72 (желтые кристаллы) и 73 (бесцветные
рованию гомолептических ионных комплексов
кристаллы) при выдерживании маточного раствора
[Ag(IPr)2]+[MCl4]- (74 (M = Al), 75 (M = Ga), 76
реакционной смеси при -30°С. Цвет определяется
(M = In) (схема 24). Строение соединений под-
природой соответствующих комплексных анионов.
тверждено данными РСА. Стоит отметить, что не-
Структура соединений подтверждена данными
удачные попытки переноса карбена с (IPr)AgCl на
РСА. В обоих соединениях в анионе присутство-
AlCl3 с образованием [Ag(IPr)2]+[AlCl4]- наблюда-
вало три мостиковых атома хлора, а в соединении
ли и ранее [131].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1741
Схема 24.
Dipp
Dipp Dipp
N
MCl
N
N
Cl
Cl
3
Ag Cl
Ag
M
Cl
Cl
N
CH2Cl2
N
N
Dipp
Dipp
Dipp
74 (62%), M = Al
75 (66%), M = Ga
76 (85%), M = In
Схема 25.
R
R
N
MCl3
N
Cl
Cu Cl
M
Cl
N
CH2Cl2
N
Cl
R
R
77 (92%), M = Al, R = Dipp
78 (82%), M = Ga, R = Dipp
79* M = Al, R = Mes
80 (95%), M = Ga, R = Mes)
*в смеси с [(IMes)2Cu]AlCl4
Схема 26.
R
R
R
N
N
N
+
-
MC X
0.5
MC
MCX2
N
N
N
R
R
R
Б
A
Примечательно, что замена серебросодержа-
N-гетероциклических комплексов серебра(I) [136]
щего переметаллирующего агента на медьсодер-
и меди(I) [137]. Возможно, кислота Льюиса промо-
жащие аналоги (IPr/IMes)CuCl с менее лабиль-
тирует смещение равновесия в сторону гомолепти-
ной и более прочной связью MC-C [132-135] в
ческого комплекса за счет комплексообразования
реакции с AlCl3 и GaCl3 нивелировала влияние их
с галогенид-анионом, что приводит к выделению
льюисовской кислотности и приводила к образо-
в осадок нерастворимой в условиях реакции соли
ванию классических продуктов переметаллирова-
серебра(I). Однако потенциально галогенид-ани-
ния (соединений 77, 78, 80) c выходами 82-95%
он может быть атакован кислотой Льюиса как в
(схема 25). Соединение 79 образовывалось в смеси
форме Б (схема 26) в составе аниона MCX–, так
с гомолептическим бис-NHC-комплексом меди(I)
и в составе формы A, что может промотировать
[(IMes)2Cu]AlCl4.
дальнейшее образование гомолептической формы.
Оценка влияния кислоты Льюиса на данный про-
Образование гомолептических бискарбеновых
цесс требует дополнительного исследования.
комплексов серебра(I) и меди(I) может объяснять-
ся существованием равновесия, изображенного
При переносе карбена на металлы в составе
на схеме 26, которое наблюдается в растворе для
соединений, проявляющих выраженную кислот-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1742
МИХАЙЛОВ, БАЛОВА
Схема 27.
+
2-
Mes Mes
N
N
Cl
Cl
Cl
Ag
Pd
Pd
Cl
Cl
Cl
N
N
Mes
Mes
Mes
N
2
PdCl2(CH3CN)2
81 (82%)
Ag Cl
CH2Cl2
N
Mes Mes
Cl
Mes
N
N
Pd
×
N
Cl
N
Mes
Mes
Схема 28.
Mes Mes
2
?
N
N
4
R2
Pd
R2
Ag
2Cl4Br2
AgBr2
R1 = Mes
N
N
R1
R1
Mes
Mes
2
N
N
PdCl2(CH3CN)2
85 (R2 = H), 85Y (R2 = Y)
R2
Ag
R2
CH2Cl2
N
N
1
iPr
Pri
R1
R1
Y =
O
N Cl
N
82 (R1 = Mes, R2 = H)
Pd
O
R1 = iPr
83 (R1 = Mes, R2 = Y)
N Cl
N
R2 = H
84 (R1 = iPr, R2 = H)
iPr
Pri
86
ность по Льюису, гетеролептические N-гетеро-
[141] или на Ru(II) [119], Rh(I) [119,142], Ni(II)
циклические карбеновые комплексы меди(I) могут
[119]. Причем исходный агент карбенового пере-
быть рекомендованы в качестве оптимальных пе-
носа представлен либо в виде гомолептических
реметаллирующих агентов из-за меньшей склон-
бискарбеновых катионных комплексов, либо ге-
ности к побочной изомеризации в гомолептиче-
теролептических комплексов (sNHC)MCX (X =
ский комплекс.
I или Br). Переметаллирование с переносом се-
мичленных N-гетероциклических карбенов на
Описаны также примеры с превращением ге-
теролептических комплексов (NHC)MCX в кати-
данный момент представлено лишь в двух работах
[138, 139] шестью примерами: перенос карбена с
онные гомолептические комплексы [(NHC)2MC]+
Ag(I) и Cu(I) на Au(I), а также с Ag(I) на Cu(I).
в реакциях с соединениями металлов, не облада-
ющих выраженной льюисовской кислотностью. В
В противоположность примерам успешно-
данном контексте отдельно стоит разобрать реак-
го переметаллирования Херрманн показал [143],
ции переметаллирования с участием комплексов
что обработка комплекса (6-Mes)AgCl 0.5 экв.
меди(I) и серебра(I) с шести- и семичленными
PdCl2(CH3CN)2 в среде CH2Cl2 при комнатной тем-
карбенами. Известны примеры мягкого перено-
пературе вместо ожидаемого продукта переметал-
са тетрагидропиримидин-2-илиденов с Ag(I) на
лирования - (6-Mes)2PdCl2 - приводит к форми-
Сu(I) [138, 139], на Au(I) [140] и с Сu(I) на Cr(III)
рованию гомолептического комплекса серебра(I)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1743
Схема 29.
Cl
R
R
Pd
Pd
N
N
Cl
n
Ag Br
n
Pd
CH2Cl2
N
N
Cl
34-93%
R
R
(6-Mes)AgBr (R = Mes, n = 1)
87 (R = Mes, n = 1)
(6-Dipp)AgBr (R = Diip, n = 1)
88 (R = Diip, n = 1)
(7-Mes)AgBr (R = Mes, n = 2)
89 (R = Mes, n = 2)
(7-Dipp)AgBr (R = Diip, n = 2)
90 (R = Diip, n = 2)
81 (схема 27) с выходом 82%, строение которого
анионов, содержащих серебро(I) в составе про-
подтверждено данными РСА. Приведенный со-
тивоиона, анионы Ag2X4-, образование которых
став комплекса также подтверждается наличием
предполагает схема Бухмайзера, крайне редки и
в спектре ЯМР 13С{1H} (100 МГц, CD2Cl2) харак-
представлены лишь Ag2Br4- и Ag2I4- [145-149].
терного сигнала карбенового атома углерода при
Стоит отметить, что тетрагидропирими-
205.8 м. д. в виде дублета дублетов с 1J(107Ag,13C)
дин-2-илиденовый комплекс серебра(I) 84 с менее
174.3 Гц и 1J(109Ag,13C) 201.3 Гц.
объемным изопропильным N-заместителем в со-
Примечательно, что в работе Бухмайзера
ставе карбена в идентичных условиях реагирует с
[142] продукт реакции аналогичного по строе-
PdCl2(CH3CN)2 с образованием нейтрального ком-
нию гомолептического комплекса серебра 82 с
плекса 86, структура которого подтверждена дан-
PdCl2(CH3CN)2 в среде CH2Cl2 описан как гомо-
ными РСА [142]. По данным спектроскопии ЯМР
лептический карбеновый комплекс палладия(II)
13С, карбеновый атом углерода PdC дает два сигна-
85 (схема 28), строение которого анализировалось
ла при 192.1 и 192.5 м. д. Возможно, наличие двух
данными РСА. В своей последующей работе автор
сигналов можно объяснить присутствием цис- и
предположил протекание подобного превращения
транс-изомеров.
с N-мезитилфункционализированным комплексом
Попытки Нечаева и соавторов перенести кар-
83, содержащим также в тетрагидропиримидино-
бен с (6-Dipp)AgBr и (7-Dipp)AgBr на переход-
вом кольце объемный бициклогептеновый заме-
ные металлы в составе комплексов PdCl2(PPh3)2,
ститель (схема 28, R1 = Mes, R2 = Y) с образова-
PdCl2(COD), Pd(OAc)2 или [RhCl(COD)]2 оказа-
нием соединения 85Y, но предложенная структура
лись безуспешными, и даже после длительного
не была подтверждена данными РСА [144]. В то
проведения реакции были выделены исходные
же время Херрманн [143] проанализировал дан-
соединения [139]. Это не единственные примеры,
ные РСА, масс-спектрометрии, спектроскопии
демонстрирующие кинетическую стабильность
ЯМР 13С и цвета соединений, приведенные в ра-
карбенов с расширенным циклом в условиях реак-
боте Бухмайзера, и аргументированно заключил,
ции переметаллирования. Так, комплекс (6-Dipp)
что структура соединения 85, в действительности,
AgBr не вступает в реакцию переметаллирования
соответствует гомолептическому бискарбеновому
комплексу серебра(I), который аналогичен ком-
с Cu(OTf)2, CuF2·2H2O и Cu(OAc)2, а с CuBr2 ре-
плексу 81.
агирует, но не по пути переметаллирования, а с
количественным образованием соли галоамиди-
По результатам проведенного нами обширно-
ния, где в качестве противоионов выступают медь-
го литературного поиска с использованием базы
содержащие анионы [150].
данных Кембриджского кристаллографического
центра можно заключить, что наиболее характер-
Однако Нечаев и соавторы показали [151], что
ными для серебра(I) являются анионы AgX– или
(6-Mes/7-Mes)Pd(cinn)Cl (соединения 87, 89) и
AgnXn+2-, и, несмотря на многообразие примеров
даже (6-Dipp/7-Dipp)Pd(cinn)Cl (соединения
88,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1744
МИХАЙЛОВ, БАЛОВА
90) все же могут быть получены с помощью со-
ты в реакциях переметаллирования серебра(I) на
ответствующих карбеновых комплексов серебра(I)
палладий(II) в составе карбеновых комплексов.
в реакции переметаллирования (схема 29) при ис-
5. ПЕРЕМЕТАЛЛИРОВАНИЕ
пользовании в качестве источника палладия(II)
С СОХРАНЕНИЕМ ДРУГОГО МЕТАЛЛА
димерный комплекс [Pd(cinn)Cl]2 (cinn = π-цинна-
В СТРУКТУРЕ ПРОДУКТА
мил). Комплексы 87 и 89, содержащие Mes, были
выделены с высокими выходами 62-93%. Напро-
Переметаллирование комплексов MC с помо-
тив, переметаллирование с образованием комплек-
щью соединений других металлов платиновой
сов 88 и 90, содержащих объемный 2,6-диизопро-
группы является четко направленным процес-
пилфенильный заместитель при атомах азота, как
сом, протекающим в мягких условиях. Как пра-
предполагают авторы, протекало обратимо, что
вило, комплексы, несущие MC и другой металл,
требовало смещения равновесия через многократ-
существуют как интермедиаты, которые быстро
ное отделение осадка AgBr, и характеризовалось
вступают во внутримолекулярное переметалли-
низкими выходами продуктов 34-42%.
рование. Однако есть примеры, когда гетероме-
Стоит добавить, что реакция переметаллиро-
таллические NHC-MC-комплексы, образующие-
вания также может быть рекомендована для син-
ся при обработке Ag2O [152-157] или Cu2O [115]
теза 6-Mes- или 7-Mes-содержащих комплексов
соответствующих металлосодержащих солей
золота(I) как более предпочтительная в сравнении
имидазолия стабильны и могут быть выделены.
с синтетической стратегией через получение сво-
При этом подобные гетерометаллические NHC-
бодного карбена, которая осложнена побочным
MC-комплексы (предварительно синтезированные
образованием бискарбеновых комплексов [138].
или генерируемые in situ) могут вступать в реак-
В то же время для более стерически загруженных
цию переметаллирования по MC с сохранением
6-Dipp или 7-Dipp синтез через свободный карбен
другого металла, координированного с соседним
оказался более эффективным.
ковалентно-связанным лигандом (схема 30) [114,
На основании приведенных данных можно
115, 158-172]. Все эти примеры объединяет то,
заключить, что реакция переметаллирования с
что потенциальный металл-акцептор в структуре
участием шести- и семичленных N-гетероцикли-
таких комплексов прочно хелатирован [114, 115,
ческих карбеновых комплексов металлов 11 груп-
158-163, 167, 168] или входит в состав металлоце-
пы требовательна к выбору источника металла,
на [164-166, 171, 172] и, как следствие, не может
принимающего карбен. Наличие объемных N-за-
вступать в реакцию переметаллирования.
местителей (например, Dipp) в структуре таких
Отдельно стоит рассмотреть пример реакции
карбенов сопряжено с низкой эффективностью
хемоселективного переметаллирования Ag(I) в
переметаллирования и, для получения целевых
присутствии Cu(I). Так, реакция комплекса 91 с
комплексов целесообразнее использовать аль-
[PdCl(allyl)]2 в среде CHCl3 протекает с образо-
тернативный путь через свободный карбен. Для
ванием гетеробиметаллического комплекса 92 с
переноса шести- и семичленных N-гетероцикли-
высоким выходом (схема 31) [173]. В этой же ра-
ческих карбенов на переходные металлы 8-10
боте показана возможность получения структурно
групп в качестве предшественников могут быть
подобного трехъядерного гетерометаллического
рекомендованы биядерные димерные комплексы,
sNHC-Pd/Cu/Pd-комплекса из соответствующе-
содержащие мостиковые галогены, или моноя-
го sNHC-Ag/Cu/Ag-комплекса. Данный пример
дерные комплексы с низколабильными лигандами
во избежание нежелательного образования гомо-
подтверждает более высокую лабильность связи
лептических комплексов. Обработка комплексов
Ag-Cкарбен в сравнении со связью Cu-Cкарбен. При-
серебра(I), содержащих карбен с расширенным
мечательно, что исходный комплекс 91 содер-
циклом, комплексами палладия(II) с лабильными
жит CuCl в присутствии более лабильной связи
лигандами может приводить к гомолептическим
Ag-Cкарбен, однако не отмечается протекание по-
катионным бис-NHC-Ag(I)-комплексам с проти-
бочных процессов переметаллирования, что ве-
воионом вида Pd2X2-. Данные соединения могут
роятно связано с высокой стабильностью связи
рассматриваться как потенциальные интермедиа-
Ag-Cкарбен в составе комплекса с насыщенным sNHC.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1745
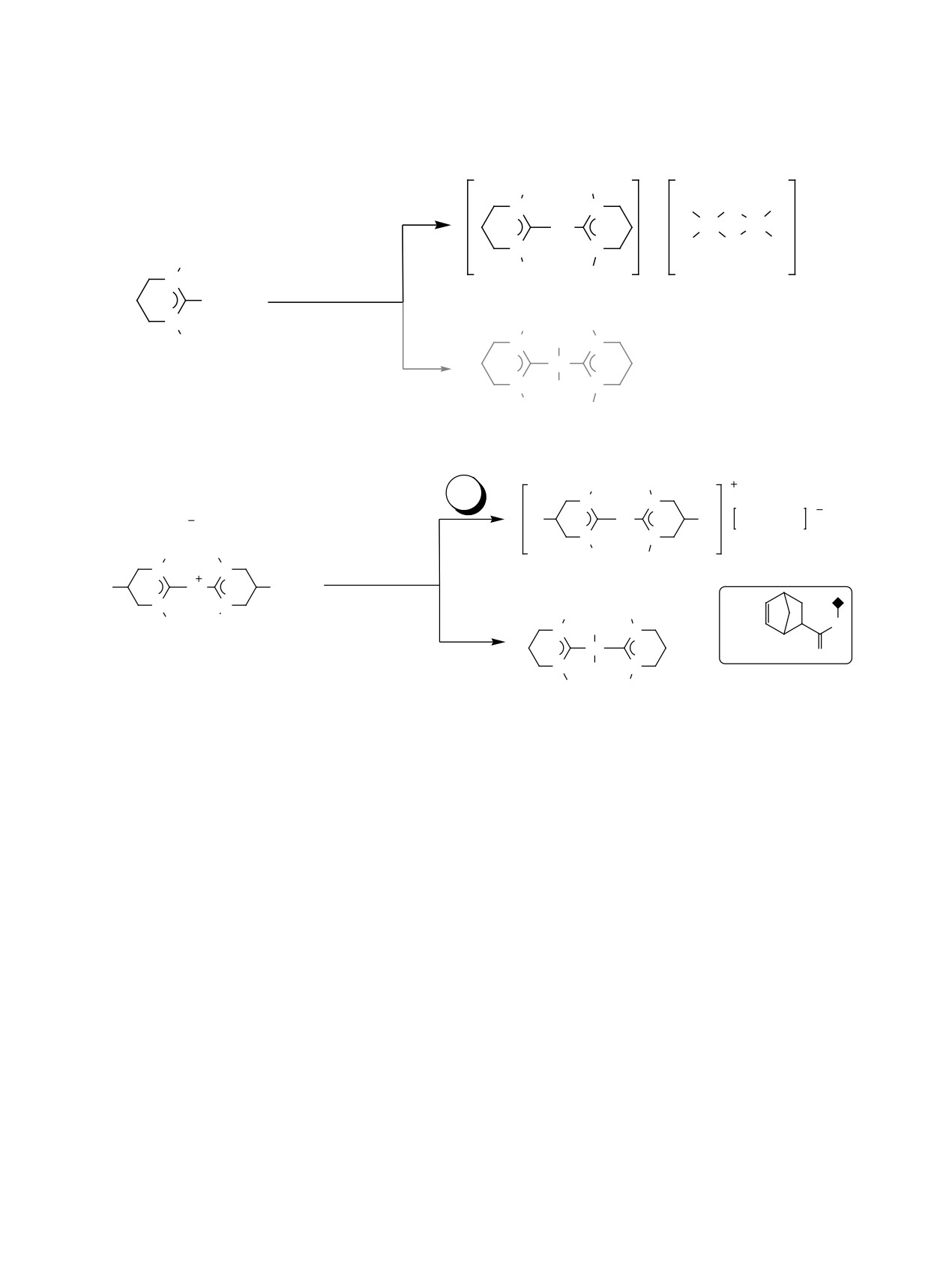
Схема 30.
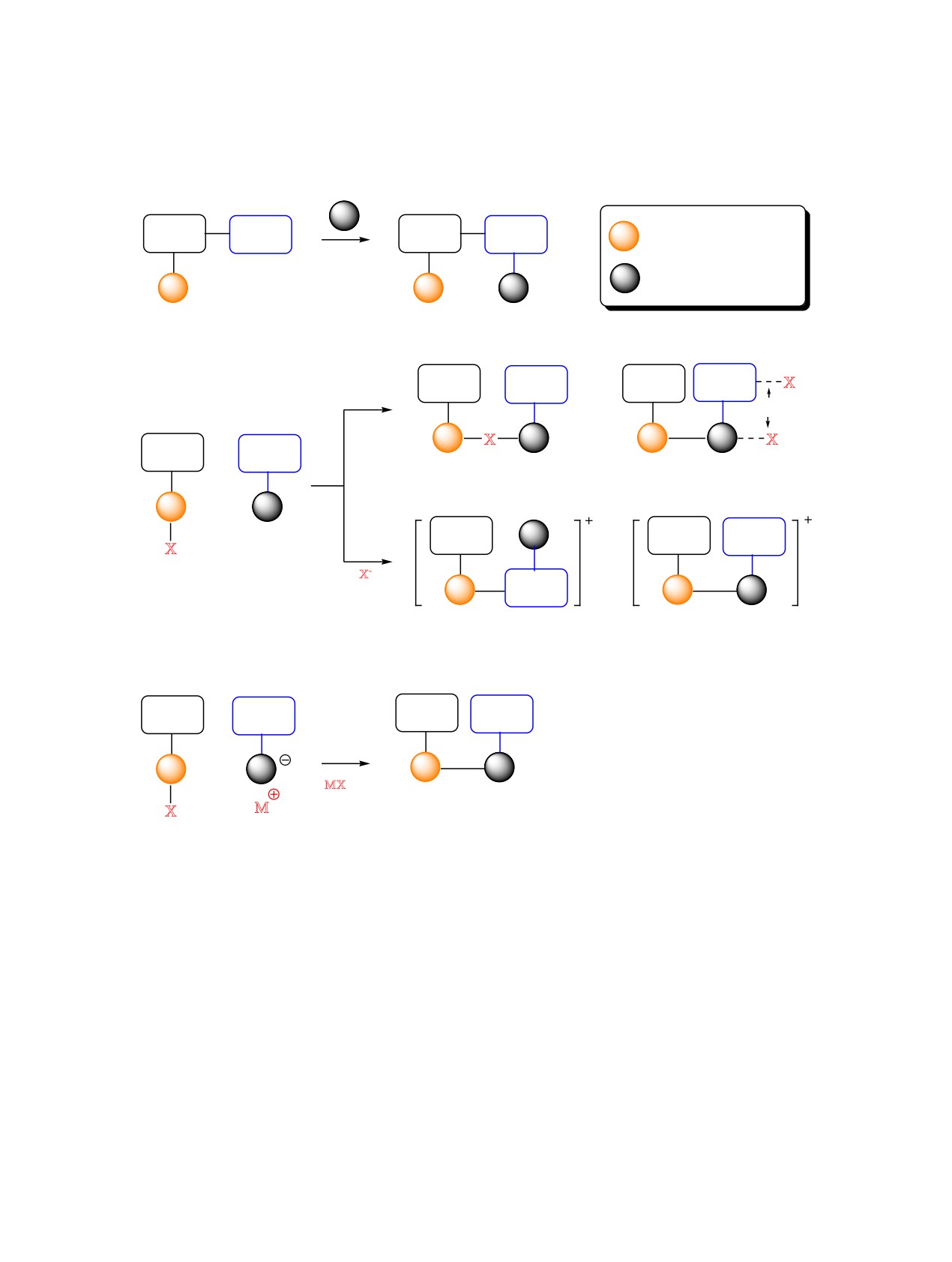
= металл-акцептор
Лиганд
NHC
Лиганд
NHC
= монетный металл
-
= другой металл
Схема 31.
N
N
Pri
Pri
N N
N N
N
N
iPr
iPr
[PdCl(allyl)]2
iPr
iPr
N
N
Cu
Cu
Pri
Pri
Cl
CHCl3
Cl
N
Pri
N
Pri
25°C
iPr
iPr
Cl
Ag
N
Pd
N
Cl
iPr
Pri
iPr
Pri
91
92 (93%)
Уникальные примеры хемоселективных ре-
[Ir(COD)(µ-Cl)]2 также демонстрирует высо-
акций переметаллирования описаны в работе
кую хемоселективность переметаллирования по
[174]. Синтезированные смешанные фосфино-
связи Ag-Cкарбен. При обработке комплекса
94
вые карбеновые комплексы Ag(I) были исследо-
1 экв. [Ir(COD)(µ-Cl)]2 происходит формирование
ваны в условиях реакции переметаллирования с
комплекса 99, содержащего мостиковый Ag2Br2
(SMe2)CuBr и [Ir(COD)(µ-Cl)]2 в различных со-
фрагмент, с выходом близким к количественно-
отношениях (схема 32). Обработка комплексов
му. Примечательно, что соответствующий гете-
93 или 94 2 экв. (SMe2)CuBr в среде CH2Cl2 при
рометаллический Ir-Ag-комплекс не образует-
комнатной температуре приводила к образова-
ся в идентичных условиях из комплекса 93 с Cy,
нию гетерометаллических комплексов 95 или 96
вместо этого формируется некоторое количество
соответственно. Переметаллирование протекало
комплекса 100, который также может быть полу-
селективно по связи Ag-Cкарбен с раскрытием ку-
чен с высоким выходом при использовании 2 экв.
бановой структуры и сохранением координаци-
[Ir(COD)(µ-Cl)]2.
онной связи Ag-P. Обработка комплексов 93 или
Другой пример селективного переметаллирова-
94 4 экв. (SMe2)CuBr приводила к полному заме-
ния описан в работе [105]. Обработка смешанно-
щению Ag на Cu и образованию гетерометалли-
го фосфинового карбенового комплекса Cu(I) 101
ческих комплексов 97 или 98 соответственно, что
1.2 экв. Pd(PPh3)4 в среде CH2Cl2 при комнатной
демонстрирует высокую селективность переме-
температуре приводила к образованию гетероме-
таллирования в данных условиях. Мониторинг
реакции комплекса 94 с избытком (SMe2)CuBr
таллического комплекса 102 (схема 33), трехъя-
(> 4 экв.) с помощью спектроскопии ЯМР 1H и
дерный гетерометаллический фрагмент которого
31P{1H} при низких температурах показал, что пе-
может быть описан как CuI-CuI-Pd0. В отличие от
реметаллирование протекает по связи Ag-Cкарбен,
предыдущего примера реакция переметаллирова-
так как комплекс 96 оказался единственным интер-
ния протекала по связи Cu-P, что может указывать
медиатом на пути к продукту 98. Использование
на кинетический характер продукта. Для струк-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1746
МИХАЙЛОВ, БАЛОВА
Схема 32.
N
N
N
N
N
N
Bu
Bu
Bu
R2P Br
Cu
R2P Br
Cu
Ag
Br
PR2
Ag
Br
2 CuBr·SMe2
4 CuBr·SMe2
Cu
Br
Br
Ag
CH2Cl2
Br
Ag
CH2Cl2
Br
Ag
Br
Cu
-2AgBr
-4AgBr
Ag
Br
PR2
Cu
Br
PR2
Cu
Br
PR2
Bu
Bu
Bu
N
N
N
N
N
N
95 (88%, R = Cy
93 (R = Cy)
97 (90%, R = Cy)
96 (85%, R = tBu
94 (R = tBu)
98 (92%, R = tBu)
t-Bu
t-Bu
2
CH2Cl
P
Ag
N
N
Bu
C
Ir
Ag
Br
a
б
t-Bu
Br
P
P
Ir
Cy2
Cl
N
N
t-Bu
−2AgBr
-4AgBr
Bu
Ir
Cl
Cl
a, 1 экв. [Ir(cod)(µ-Cl)]2
б, 2 экв. [Ir(cod)(µ-Cl)]2
N Ir
100 (89%)
N
Bu
99 (98%)
турного аналога комплекса серебра(I) 103 данное
рый, по заключению авторов, содержит цепочку
превращение в идентичных условиях протека-
Pd0-CuI-Pd0 с электронной дыркой, делокализо-
ет с той же хемоселективностью с образованием
ванной по всему катиону. Дальнейшее увеличение
комплекса 104. При этом отмечена кинетическая
концентрации Pd(PPh3)4 до 6 экв. не приводит к
лабильность комплекса 104, заключающаяся в пе-
полному замещению всех Cu на Pd. В то же время
регруппировке трехъядерного гетеробиметалличе-
использование 3 экв. Pd(dba)2 дает трехъядерный
ского линейного фрагмента AgI-AgI-Pd0 во фраг-
комплекс Pd(II) 107, который, по заключению ав-
мент AgI-Pd0-AgI с образованием комплекса 105
торов, содержит цепочку Pd0-PdII-Pd0 и, как след-
и новой Pd0-Скарбен связи. Данный процесс отме-
ствие, является продуктом окислительно-восста-
чался при медленном испарении досуха раствора
новительного процесса. Использование комплекса
105 в CH2Cl2 на воздухе или хранении раствора в
103 в реакции с 4 экв. Pd(dba)2 в идентичных ус-
течение 2 сут. Формально данный процесс можно
ловиях также дает комплекс 107 [175]. В этом слу-
рассматривать как внутримолекулярное переме-
чае вновь можно отметить критическое влияние
таллирование. Если реакцию комплекса 101 осу-
природы исходного источника Pd0 на направление
ществлять с 3 экв. Pd(PPh3)4 в идентичных усло-
реакции переметаллирования.
виях, то наблюдается переметаллирование по двум
Таким образом, присутствие хелатированных
связям Cu-P с образованием продукта 106, кото-
металлов или металлоценов в составе смешанных
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1747
Схема 33.
(OTf)2
(OTf)2
(OTf)2
N
N
(But)2P
P(tBu)2
N
N
(But)2P
P(tBu)2
N
N
(But)2P
P(tBu)2
SOCF3
Pd(PPh3)4
3 экв. Pd(PPh3)4
M M Pd
O
O
Pd Cu Pd
M M M
CH2Cl2, 20oC
CH2Cl2, 20oC
(But)2P
P(tBu)2
N N
(But)2P
P(tBu)2
(But)2P
P(tBu)2
M = Cu
N N
N N
102 (M = Cu), 104 (M =Ag)
101 (M = Cu), 103 (M =Ag)
106
3 экв. Pd(dba)2
M = Ag
MeCN, 20oC
(OTf)2
(OTf)2
N
N
N
N
(But)2P
P(tBu)2
(But)2P
P(tBu)2
Ag Pd Ag
Pd Pd Pd
(But)2P
P(tBu)2
(But)2P
P(tBu)2
N N
N N
105
107
гетерометаллических комплексов предотвращает
Координационная геометрия и характер взаимо-
протекание реакции внутри- или межмолекуляр-
действия металл-металл в фосфин-функционали-
ного переметаллирования и позволяет селективно
зированных NHC-комплексах влияют на свойства
замещать MC на другие лиганды для направлен-
фотолюминесценции [89, 174], что делает пер-
ного синтеза новых гетерометаллических ком-
спективным изучение таких систем в дальнейшем.
плексов. Сочетание двух металлов в структуре
6. РЕАКЦИИ С ОБРАЗОВАНИЕМ
рассматриваемых в данном разделе полиметалли-
БИМЕТАЛЛИЧЕСКИХ АДДУКТОВ
ческих систем позволяет добиться улучшенных
С СОХРАНЕНИЕМ СВЯЗИ NHC-MС
каталитических [115, 158, 161, 162, 168] и анти-
пролиферативных [171] свойств. Некоторые из
Синтез и исследование биметаллических си-
них проявляют фотокаталитическую активность.
стем в последнее время являются перспективной
Наличие ферроценильного заместителя придает
областью, так как за счет кооперативного дей-
таким гетерометаллическим системам редокс-ак-
ствия металлов данные системы могут обладать
тивность [166, 172]. Окисление ферроценильного
уникальными каталитическими [176-180], анти-
заместителя, находящегося в сопряжении с N-ге-
пролиферативными [181-183], фотофизическими
тероциклическим комплексом каталитическиак-
свойствами [24, 184, 185] и привлекают внимание
тивного металла, позволяет настраивать каталити-
в качестве перспективных соединений для созда-
ческие свойства последнего [172].
ния систем искусственного фотосинтеза [186].
Возможно также селективное переметаллиро-
В данном разделе также рассматриваются ре-
вание по связи MC-Скарбен в присутствии MC-P
акции, сопровождающиеся формированием гете-
связей. Однако селективность переметаллирова-
рометаллических систем, однако в их процессе
ния MC по связи MC-Скарбен в структуре полиден-
не происходит переметаллирование, а образуется
тантных фосфино-карбеновых NHC-MC комплек-
новый гетерометаллический аддукт за счет коор-
сов определяется доступностью металлоцентра.
динации M по лиганду на периферии NHC-MC
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1748
МИХАЙЛОВ, БАЛОВА
Схема 34.
Путь 1
NHC
Лиганд
NHC
Лиганд
= монетный металл
= другой металл
NHC
Лиганд
NHC
Лиганд
X
Путь 2
а
или
X
или
X
NHC
Лиганд
+
NHC
NHC
Лиганд
X
б
или
-X-
Лиганд
Путь 3
NHC
Лиганд
NHC
Лиганд
+
-MX↓
X
M
(схема 34, путь 1) за счет координации галогенид-
плексом саленового типа (б), которые протекают
ного остатка в составе NHC-MC по металлоцентру
в течение нескольких минут с количественным
M (схема 34, путь 2а), за счет ассоциации с дис-
образованием стабильных гетерометаллических
социацией галогенидного остатка в NHC-MCX
комплексов 109a (пурпурный) и 109б (оранжевый)
(схема 34, путь 2б) и, наконец, наиболее часто
(схема 35) [187], растворимость которых выше в
встречающийся вариант: за счет катион-анионного
сравнении с исходным комплексом 108. Пиридин
обмена (метатезиса) между NHC-MCХ-комплекса-
в комплексе 109a координирует атом Zn почти пер-
ми и/или кластерными соединениями других ме-
пендикулярно плоскости порфирина. Длина связи
таллов [M] (схема 34, путь 3).
Zn-N составляет 2.182(2) Å.
В качестве примера реализации пути 1 можно
Примерами предпочтительной координа-
рассмотреть реакции NHC-Ag(I)-комплекса 108
ции вместо переметаллирования [185] являют-
с порфириновым комплексом Zn(II) (a) или ком-
ся реакции (Me2S)AuCl или [(µ3-allyl)PdCl)]2 с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1749
Схема 35.
[Zn]
N
N
N
[Zn]
N
Ag Cl
Ag Cl
CH2Cl2
N
N
20oC
Mes
Mes
109a, б
108
[Zn]
Ph
Ph
N
N N
N
Zn
N
Zn
t-Bu
O O
t-Bu
N
Ph
Ph
t-Bu
t-Bu
a
б
Схема 36.
[M]
Dipp
Dipp
Ph2P
Ph2P
N
[Mp]
N
Cu Cl
Cu Cl
ТГФ
N
N
20oC
Dipp
Dipp
110
111Au (95%, [M] = AuCl)
111Pd (77%, [M] = (η3-allyl)PdCl)
[Mp] = (Me2S)AuCl, [(η3-allyl)PdCl)]2.
фосфин-функционализированным
комплексом
ческий или термодинамический) и оценки влия-
меди(I) 110, которые протекают с образовани-
ния природы N-заместителей на направление про-
ем биметаллических комплексов 111Au и 111Pd
текания процесса.
(схема 36). Данный результат делает интересным
Реализация пути 2а, как модель конкуренции
дальнейшее исследование подобных систем для
между реакцией переметаллирования и простой
определения характера таких продуктов (кинети-
ассоциации, продемонстрирована в работе [189].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1750
МИХАЙЛОВ, БАЛОВА
Схема 37.
Ph
MeOC6H4
113 (90%, R1 = R2 = CH3)
O
необъемный
114 (97%, R1 = R2 = CH2Ph)
Ph
NHC
MeOC6H4
Ru
R2
115 (96%, R1 = CH3, R2 = n-C3H7)
OC
N
116 (98%, R1 = CH3, R2 = C2H2CH2OH)
R1
−AgX
1) Ag2O, CH2Cl2
OC
117 (98%, R1 = CH3, R2 = tBu)
или CH3CN,
N
N
X
R1
20-80oC
N
2) [Ru], CH2Cl2,
R2
20oC
объемный
Ph
NHC
MeOC6H4
O
R2
Ph
MeOC6H4
N
Ru
Ag
OC
OC
X
N
Ph
R1
118 (96%, R1 = R2 = Dipp, X = Cl)
MeOC6H4
O
CO
119 (0%, R1 = R2 = Dipp, X = Br)
CO
Ph
Ru
120 (95%, R1 = R2 = tBu, X = Cl)
MeOC6H4
[Ru] =
C6H4OMe
Ru
Ph
121 (97%, R1 = CH3, R2 = Dipp, X = I)
OC
O
C6H4OMe
OC
122 (0%, R1 = iPr, R2 = tBu, X = I)
Ph
112
123 (0%), R1 = R2 = Mes, X = I)
Авторы исследовали реакции димерного дикарбо-
в их составе. К сожалению, в работе не представ-
нильного тетраарилциклопентадиенонового руте-
лено надежных свидетельств того, что комплексы
ниевого комплекса 112 с различными (NHC)-Ag(I)
121-123 являются иодидными.
комплексами, генерируемыми путем обработки
В работе
[190] при исследовании реакции
Ag2O соответствующих солей имидазолия с раз-
[(IPr)Cu]OTf, несущего ненуклеофильный проти-
личными галоген-анионами (Cl, Br, I). Показано,
воион OTf, с хелатным бензохинолинатным ком-
что (NHC)-Ag(I) комплексы, содержащие относи-
плексом палладия(II) 124 показана возможность
тельно малые по объему карбены, вступали с ком-
их ассоциации с образованием биметаллической
плексом 112 в реакцию переметаллирования с об-
комплексной частицы 125 с редкой связью Pd-
разованием (NHC)-Ru(I)-комплексов 113-117, в то
Cu-С (схема 38). По данным ренгеноструктурно-
время как (NHC)-Ag(I)-комплексы, содержащие
го анализа, в структуре представлена удивительно
объемные карбены, давали лишь биметаллические
короткая связь Pd-Cu и тригональный ипсо-атом
ассоциаты 118-123, в структуре которых связь
углерода. Подобная структура может рассматри-
между Ru и Ag осуществлялась через мостиковый
ваться как полезная модель для исследования пе-
Cl (схема 37). Соединения 118-123 являются ста-
реметаллирования как одной из ключевых катали-
бильными в твердом состоянии, но разлагаются
тических стадий реакции Соногаширы-Хагихары.
в растворе. Реакция (IPr)CuCl с комплексом 112
Для реализации пути 2б может быть полезна
протекала аналогичным образом, как и (IPr)AgCl с
реакция (NHC)MCX с соединениями других метал-
образованием ассоциата. Структура комплекса 118
лов в составе анионных частиц, где отрицательный
подтверждена данными РСА. Данные ассоциаты,
заряд аниона сконцентрирован на органическом
будучи кинетическими продуктами, могут рассма-
лиганде [191]. Координация по координационно
триваться как вероятные интермедиаты реакции
активному центру с образованием биметалличе-
карбенового переноса в исследуемых условиях.
ских катионных частиц вместо переметаллирова-
По всей видимости, соединения оказались ста-
ния также наблюдается при использовании хелат-
бильными благодаря объемной природе карбенов
ных иридиевых циклометаллированных [184] и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1751
Схема 38.
N N
Dipp
Dipp
Cu
N
[(IPr)Cu]OTf
OTf
N
Pd
-35°C
Pd
N
N
124
125
Схема 39.
N
N
R
R
PF6
M
S
S
Pt
Pt
Ph3P
PPh3
Ph3P
PPh
3
126 (M = Ag, R = Mes)
127 (M = Au, R = Mes)
128 (M = Au, R = Dipp)
фероценновых [192] структур в присутствии KPF4
Катионные частицы (NHC)MC проявляют за-
как источника ненуклеофильного координацион-
метную льюисовскую кислотность
[194]. Так,
ного аниона.
ярким примером реализации пути 3 является об-
разование смешанных галлильных карбеновых
Другой любопытный аддукт формируется при
комплексов металлов 13 группы в реакции метате-
обработке нейтрального [Pt2(µ-S)2(PPh3)4] 1 экв.
зиса [195], протекающего с формированием связи
(IMes)AgCl в метаноле [193]. В процессе данной
Ga-MC.
реакции не происходит переметаллирования, а
формируется (IMes)Ag-S связь c образованием
Формирование биметаллических аддуктов с
биметаллического аддукта, который может быть
образованием новой связи металл-металл так-
выделен в виде соли [Pt2(µ-S)(µ-SAg(IMes))(PPh3)4]
же рассмотрим на примере образования соеди-
PF6 126 (схема 39) после добавления NH4PF6 к
нений (NHC)M-[MСО] (M = Cu, Ag, Au; [MСЩ] =
маточному реакционному раствору после филь-
FeCp(CO)2, Mn(CO)5, WCp(CO)3, Co(CO)4).
трации спустя 12 ч. Продукт оказался загрязнен
Различные гетерометаллические системы
[{Pt2(µ-S)2(PPh3)4Ag}2]2+. Идентичная реакция с
(NHC)MC-M(CO)nL [(MC = Cu, Ag, Au; ML(CO)n =
(NHC)AuCl (NHC = IPr, IMes) давала (NHC)Au-S
CrCp(CO)3, Mn(CO)5, FeCp(CO)2, Co(CO)4,
аддукты 127 и 128 в индивидуальном виде, что
MoCp(CO)3, RuCp(CO)2, WCp(CO)3] могут быть
можно объяснить меньшей лабильностью связи
получены по реакции обмена при взаимодей-
Au-Cкарбен.
ствии соответствующих комплексов (NHC)MCCl и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1752
МИХАЙЛОВ, БАЛОВА
Схема 40.
KM(Cp)n(CO)m или NaM(Cp)n(CO)m
NHC MC Cl
NHC MC M(Cp)n(CO)m
-KCl или NaCl
MC = Cu, Ag, Au; M = Cr, Mn, Fe, Mo, Ru, W; n = 0, 1; m = 2-5.
Схема 41.
O
O
O
C
C
C
Fe
Fe
Mo
Cu C
Cu
C
Cu
C
NHC
NHC
IPr
O
O
O
129 (NHC = IPr)
132 (NHC = IPr)
134
130 (NHC = IMes)
133 (NHC = IMes)
131 (NHC = sIMes)
NaM(CO)nL или KM(CO)nL (схема 40) [196-200].
для комплекса 132 и 172.9° для комплекса 133, а
Реакция обмена протекает с выделением низкомо-
длина связи Cu-Fe относительно малая и состав-
лекулярных продуктов NaCl или KCl.
ляет 2.3462(5) (129), 2.3514(7) (131), 3414(4) (132)
и 2.3215(3) Å (133). Обменная реакция между
Так, при взаимодействии (IPr, IMes, SIMes)CuCl
(IPr)CuCl и NaMoCp(CO)3 в среде ТГФ-диметок-
c эквимолярным количеством KFeCp(CO)2 в среде
сиэтан приводит к образованию комплекса 134 с
ТГФ образуются гетерометаллические комплексы
выходом 58% [196]. Данный комплекс может быть
129-134 (схема 41) с хорошими выходами 63-76%.
также получен альтернативным образом через ре-
Примечательно, что образующиеся комплексы,
акцию конденсации (IPr)CuOH с гидридным ком-
содержащие карбен в качестве стабилизирующе-
плексом HMoCp(CO)3 в среде толуола и выделен с
го лиганда, оказались устойчивыми на воздухе, в
выходом 83% [202]. Валентный угол СкарбенCuMo
отличие от структурно подобного фосфинового
подобно вышеописанным комплексам отклонен от
комплекса (dmpe)CuFeCp(CO)2 [dmpe = 1,2-бис-
линейности и составляет 167.28(15)°.
(диметилфосфино)этан] [201]. Подобная обменная
В продолжение исследований Манкад с сотр.
реакция между (IPr)CuCl и NaFeCp*(CO)2 (Cp* =
расширил библиотеку гетерометаллических
пентаметилциклопентадиенил) в идентичных ус-
комплексов, которые могут быть синтезирова-
ловиях приводит к образованию структурно по-
ны по реакции обмена [197]. Так, комплексы
добных комплексов 132 и 133 (схема 41) с выхода-
(IPr)Cu-RuCp(CO)2
(135) и (IPr)Cu-WCp(CO)3
ми 65 и 66% соответственно. Данные соединения
(136W) (схема 42) легко образуются в ранее опи-
обладали значительно большей растворимостью
санных классических условиях в среде ТГФ при
в неполярных углеводородных растворителях в
комнатной температуре при эквимолярном соот-
сравнении с циклопентадиенилсодержащими ком-
ношении (IPr)CuCl и соответствующей натриевой
плексами 129-131, но при этом оказались менее
соли NaRuCp(CO)2 или NaWCp(CO)3 и могут быть
стабильными [200].
выделены с высокими выходами, 73 и 91% соответ-
В соответствии с данными РСА, при коорди-
ственно. Однако реакция (IPr)CuCl c менее нукле-
нации кислоты Льюиса (NHC)Cu+ на металло-
офильными анионами для получения комплексов
центр угол Cкарбен-Cu-Fe составляет 170.2° для
136Cr, 137, 138 (схема 42) требовала использова-
комплекса 129, 167.0° для комплекса 131, 178.9°
ния избытка соответствующей соли (1.2-3 экв.),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1753
Схема 42.
O
O
O
O
O
O
C
O
O
C
C
C
C
C
C
O
C
C
O
C
Ru
M
Co
Fe
Mn
Cu
Cu
C
C
Cu C C
Cu
C
MC
C
IPr
IPr
IPr
O
O
O
O
O
O
IPr
IPr
136W (M = W)
137
138
135
136Cr (M = Cr)
139Ag (MC = Ag)
139Au (MC = Au)
Схема 43.
O
O
O
O
O
C
C
C
C
C
Ru
W
Mn
Cu C
Cu
C
C
Cu
C
C
IMes
IMes
IMes
O
O
O
O
O
140
141W (M = W)
142
141Cr (M = Cr)
а в некоторых случаях и повышения температуры
разованием целевых гетерометаллических ком-
(до 36°С), при этом выход соответствующих ком-
плексов 140 и 141W (схема 43) с выходами 64 и
плексов составил 78-85%. Все синтезированные
88% соответственно
[197]. Подобно (IPr)CuCl
комплексы оказались чувствительными к воздуху,
для менее нуклеофильных анионов для достиже-
но стабильными в течение нескольких недель при
ния полной конверсии (IMes)CuCl использовали
комнатной температуре в инертной атмосфере.
избыток соответствующей соли (3 экв.) или по-
вышение температуры (до 36°С). Примечатель-
Методом РСА показано существование двух
но, что кристаллизация продуктов 141Cr и 142
независимых структур 136W в одной и той же
(схема 43) в идентичных условиях в зависимости
асимметричной единице, образованных прямой
от концентрации соответствующих натриевых
и боковой атакой (IPr)Cu+, что подчеркивает воз-
солей NaMn(CO)5 или NaCrCp(CO)2 приводила к
можность различных вариантов подхода кислоты
образованию либо гомолептического комплекса
Льюиса и/или лабильную природу образующихся
состава [(IMes)2Cu]+[CuY2]- (без избытка соли),
связей металл-металл, подверженных перегруп-
либо целевого гетеролептического комплекса
пировкам в координационной сфере.
(IMes)CuY (в избытке соли), где Y - анионный
Комплексы (IPr)AgCl и (IPr)AuCl вступают в
остаток используемых солей. Твердофазный ана-
реакцию обмена с KFeCp(CO)2 в среде толуола
лиз с помощью ИК спектроскопии показал разли-
при комнатной температуре, которая сопровожда-
чие в структурах, в то время как спектры ЯМР 1H и
ется боковой атакой (IPr)Ag+ и (IPr)Au+ и приво-
13C{1H} в растворе C6D6 оказались идентичными c
дит к образованию соответствующих комплексов
температурной зависимостью ширины линий. В то
139Ag и 139Au (схема 42) с выходом 58 и 82% [198].
же время при использовании соли - NaCo(CO)4 c
Комплекс (IMes)CuCl, содержащий менее сте-
наименее нуклеофильным из исследованных ани-
рически объемный карбеновый лиганд, также
онном вне зависимости от ее концентрации кри-
легко реагирует с нуклеофильными NaRuCp(CO)2
сталлизация протекала с формированием структу-
или NaWCp(CO)3 в классических условиях с об-
ры [(IMes)2Cu]+[CuY2]-. Все это может указывать
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1754
МИХАЙЛОВ, БАЛОВА
Схема 44.
143 (MC = Cu, NHC = IPr)
O
O
144 (MC = Cu, NHC = IMes)
C
C
Na2[Fe(CO)4]
145 (MC = Ag, NHC = IPr)
Fe
2
NHC
MC
Cl
146 (MC = Ag, NHC = IMes)
ТГФ
MCCC
MC NHC
147 (MC = Au, NHC = IPr)
-2 NaCl
NHC
O
O
148 (MC = Au, NHC = IMes)
на существование динамического равновесия
ный. Термическая обработка соединений 143 и 145
между формами (IMes)CuY и [(IMes)2Cu]+[CuY2]-,
при 130°С в ДМСО приводит к изомеризации ком-
зависящего от нуклеофильности аниона Y и при-
плексов с образованием треугольных кластерных
роды растворителя. Подобное равновесие наблю-
анионов [Ag3Fe3(CO)12]3- и [Au3Fe3(CO)12]3- с про-
дается для комплексов (NHC)Ag(I) [136] и (NHC)
тивоионами в виде (IMes)2Ag+ или (IMes)2Au+ со-
Cu(I) [137, 203] и (NHC)Au(I) [98].
ответственно. В то же время реакция Na2[Fe(CO)4]–
При обработке (IPr)CuOTf нейтрального
с безлигандными солями серебра(I) и золота(I)
NHC-аминобориленового комплекса, полученно-
(AgNO3 и [NEt4][AuBr2]) протекает с образованием
го из Na2[Fe(CO)4] (реагент Коллмана), возможно
квадратных кластерных анионов [Ag4Fe4(CO)16]4-
образование аддукта без анионного обмена [204].
и [Au4Fe4(CO)16]4-. В случае меди(I) как с карбено-
Взаимодействие
[NEt4][Fe5C(CO)14(CuNCMe)] с
выми, так и безлигандными системами, наблюда-
(ImiPr)AgCl, несмотря на ионный характер реаги-
ется формирование исключительно треугольных
рующих субстратов, не сопровождается анионным
кластерных анионов [Cu3Fe3(CO)12]3-. Примеча-
обменом с образованием связи Ag-Fe. Вместо этого
тельно, что создание гетеротриметаллических
протекает переметаллирование с Ag на Cu в соста-
систем также возможно, если проводить последо-
ве кластера и образуется смешанная соль состава
вательную селективную функционализацию ком-
(NEt4)2[Fe4C(CO)12(Cu-ImiPr)][Fe4C(CO)12(CuCl)-
плексами (NHC)MCCl с различными металлами
(Cu-ImiPr)] [205], содержащая два NHC-функцио-
MC.
нализированных моноанионных кластера.
Исследование реакционной способности ани-
Двойная функционализация с помощью
онного металлоборида 149 по отношению к (ITol)
(NHC)MCCl (MC = Cu, Ag, Au) возможна, если в
MCCl показало возможность образования триме-
качестве субстрата используется немодифициро-
таллоборидов 150 в среде толуола при комнатной
ванный реагент Коллмана (схема 44) [206-210].
температуре (схема 45) [211, 212]. По данным рент-
Так, реакция Na2[Fe(CO)4] с двумя эквивалентами
геноструктурного анализа молекулярных структур
(NHC)MCCl в среде тетрагидрофурана при комнат-
150 выявлена тенденция ослабления связи Mn-MC
ной температуре приводит к образованию соответ-
(MC = Cu, Ag, Au) при переходе от Au к Cu, на что
ствующих бисфункционализированных комплек-
указывает угол BMCCкарбен, который изменяется
сов 143-148 (схема 44).
следующим образом: 153.0(1) (150Au), 167.3(5)
Особенностью структуры комплексов
143-
(150Ag) и 175.28(8)° (150Au). Фактически в случае
148 является наличие тригонального фрагмента
с (ITol)CuCl координация осуществляется равно-
MC-Fe-MC. Расстояние MC···MC вместе с углом
удалено от двух металлоцентров Mn. Изучение
MCFeMC увеличиваются при переходе от IMes к
факторов [213], определяющих взаимодействия в
IPr. Стабильность соединений зависит от прочно-
данных системах, указало на то, что относитель-
сти связей MC-Fe и MC-NHC и уменьшается в сле-
ная электронная плотность на металле определяет
дующем порядке: Au > Cu > Ag. Металлофильные
его склонность к η2-взаимодействию с π-системой
взаимодействия MC···MC характерны для комплек-
металлоборилена в рамках модели Дьюара-Чатта-
сов, содержащих IMes, в то время как более объ-
Дункансона. Карбеновые лиганды способствуют
емного лиганда IPr контакт MC···MC незначитель-
η2-координации за счет более выраженного σ-до-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1755
Схема 45.
[Li(dme)3]
ITol
C
M
OC
OC
(ITol)MCCl
OC
OC
Mn B Mn
Mn B Mn
CO
толуол
CO
CO
CO
-LiCl
149
150Cu (66%, MC = Cu)
150Ag (74%, MC = Ag)
150Au (30%, MC = Au)
[Li(dme)3]
PCy3
PCy3
Pt
Pt
OC
CO
OC
CO
(ITol)MCCl
OC
CO
CO
Mn
Mn
Mn
Mn
B
B
растворитель
-LiCl
OC
MC
151
ITol
152Cu (61%, MC = Cu, из толуола)
152Au (35%, MC = Au, из ТГФ)
норного характера в сравнении с фосфиновыми
кластеры чрезвычайно чувствительны к возду-
лигандами. Из (ITol)MCCl (MC = Cu, Au) в реакции
ху и влаге, обладают высокой реакционной спо-
с комплексом 151 могут быть получены Mn2PtCu
собностью и плохо растворяются в стандартных
тетраметаллабориды 152, сочетающие в себе сразу
органических растворителях, а также несут вы-
два типа координации по Mn2B фрагменту
сокие отрицательные заряды. Фесслером с сотр.
(схема 45) [214, 215]. Расчетные данные [214] на
показано, что N-гетероциклические карбеновые
примере тетраметаллаборида 152Cu показывают,
комплексы (NHC)MCX (MC = Cu, Ag, Au, X = Cl,
что образующаяся геометрия исследуемых ком-
Br) вступают в реакцию обмена с трис-силили-
рованными анионными кластерами (кластеры
плексов является результатом дисперсионных вза-
Цинтля) германия [Ge9(SiR3)3]- (R = TMS, iBu) с
имодействий d10-d10 между фрагментами меди и
образованием гетеробиметаллических комплексов
платины.
(NHC)MC{η3-Ge9(Si(TMS)3)3} (MC = Cu, Ag, Au)
При использовании терминального борилено-
[219] или (NHC)MC{η3-Ge9(Si(iBu)3)3} (MC
=
вого комплекса [(η5-C5H5)(OC)2Mn=BtBu] в реак-
Cu, Ag, Au) [220] (схема 46). Соответствующие
ции с (IPr)AuCl наблюдается аналогичная σ-коор-
трис-силилированные анионные кластеры гер-
динация кислоты Льюиса (IPr)Au+ по связи Mn-B
мания генерируются in situ путем силилирования
[216], но протекающая с присоединением Cl- к B
K4Ge9 с помощью соответствующего хлорсила-
и образованием ионного металлогалобориленово-
на ClSi(R)2 непосредственно перед введением
го комплекса с привлекательными постсинтетиче-
(NHC)MCX. Данные превращения протекают в сре-
скими возможностями.
де ацетонитрила при использовании эквимолярно-
Кластеры Цинтля (Ge9) являются перспек-
го отношения реагентов при комнатной темпера-
тивными лигандами для переходных металлов и
туре и сопровождаются выделением KCl в виде
прекурсорами для полупроводниковых матери-
побочного продукта, который удаляется в процес-
алов [217, 218]. Однако немодифицированные
се экстракции целевого кластерного комплекса
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1756
МИХАЙЛОВ, БАЛОВА
Схема 46.
NHC
MC
K
Ge
Ge
Ge
Ge
Ge
Ge
R3Si
Ge
(NHC)MCX
Ge
SiR3
Ge
-
R3Si
Ge
Ge
SiR3
Ge
R3Si
CH3CN
Ge
R3Si
Ge
Ge
-KX
Ge
Ge
Ge
Схема 47.
NHC
MC
2K+
Ge
Ge
Ge
Ge
Ge
Ge
2 (NHC)MCX
R3Si
Ge
Ge
R3Si
Ge
Ge
2
-
Ge
Ge
CH3CN
R3Si
R3Si
Ge
-KX
Ge
Ge
Ge
Ge
Ge
22-45%
MC
NHC
153 (MC = Cu, NHC = IPr)
154 (MC = Cu, NHC = IMes)
155 (MC = Ag, NHC = IPr)
156 (MC = Au, NHC = IPr)
толуолом из сухого остатка реакционной смеси.
кластерам не протекает [222], что позволяет рас-
Образующиеся комплексы легко растворяются в
сматривать реакцию обмена на данный момент,
неполярных органических растворителях, таких
как наиболее пригодный подход для опосредо-
как ацетонитрил, тетрагидрофуран или толуол, что
ванной NHC-модификации подобных систем.
решает проблему растворимости подобных кла-
Циклические алкиламинокарбеновые комплексы
стеров. Кроме того, данные соединения стабильны
Cu(I) [CAAC-Cu(I)] и комплексы Cu(I) с мезои-
при комнатной температуре. Однако исключением
онными карбенами [MIC-Cu(I)] также могут быть
является комплекс (IPr)Ag{η3-Ge9[Si(TMS)3]3}, ко-
использованы для успешной функционализации
торый в растворе со временем (в течение 7 сут) пре-
KGe9[Si(TMS)3]3 [223].
вращается в гомолептический комплекс состава
В продолжение своих исследований Фес-
[Ag(IPr)2]+[Ag{η3-Ge9[Si(TMS)3]3}2]-
[219].
слер с сотр. продемонстрировал возмож-
Уменьшение объема силильного заместителя не
ность
бис-NHC-функционализации
герма-
оказывает влияния на направление процесса и
ниевого кластера, используя дианионную
на тип координации металлоцентра к остову гер-
биссилилированную форму K2Ge9(Si(TMS)3)2.
маниевого кластера через одну из треугольных
Так, реакция 2 экв. (IPr)MCX (MC = Cu, Ag, Au,
граней η3-типом со средним расстоянием Cu-Ge
X = Cl, Br) и (IMes)CuCl c K2Ge9(SiR3)2 в среде
2.5328(9) Å [221]. Важно отметить, что прямая
ацетонитрила при комнатной температуре приво-
координация свободного карбена к исследуемым
дит к образованию комплексов 153-156 с выхода-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1757
Схема 48.
IPr
Cu
Ge
Ge
Ge
R
R=Mes
R=Ni-Pr2
(TMS)3Si
Ge
Ge
P
Ge
(TMS)3Si
R
Ge
K
Ge
Ge
(IPr)MCCl
Ge
Ge
Ge
CH3CN
R
157 (30%, R = Mes)
20oC
(TMS)3Si
Ge
Ge
P
158 (30%, R = NiPr2)
Ge
-KCl
(TMS)3Si
R
Ge
IPr
Ge
Ge
Ge
Ge
Ge
MC
R = t-Bu
(TMS)3Si
Ge
Ge
P
Ge
t-Bu
(TMS)3Si
Ge
t-Bu
Ge
Ge
159 (40%, MC = Cu)
160 (30%, MC = Ag)
161 (25%, MC = Au)
ми до 25-45% (схема 47) [221]. Данные РСА для
по тригональному фрагменту Ge3 с образованием
[(IPr)Cu]2{η3-Ge9[Si(TMS)3]3} позволили устано-
кластеров 157-158 соответственно, в то же время
вить, что координация (IPr)Cu+ происходит че-
громоздкий фосфиновый лиганд (PtBu2) способ-
рез открытые треугольные грани кластера [Ge9].
ствует образованию цвиттер-ионных соединений
Синтезированные комплексы показывали очень
159-161 со связью P-MC вне зависимости от при-
хорошую растворимость даже в толуоле. Приме-
роды металла (Cu, Ag, Au) (схема 48). Использова-
чательно, что реакция K2Ge9[Si(TMS)3]2 с 1 экв.
ние (IMes)CuCl вместо (IPr)CuCl также приводи-
(IPr)CuCl, несмотря на подобранную стехиоме-
ло к образованию цвиттер-ионного соединения в
трию, не приводила к выделению монозамещен-
реакции с K[Ge9{Si(TMS)3}2PtBu2], что указывает
ного аддукта, а сопровождалась образованием
на отсутствие выраженной чувствительности на-
[(IPr)Cu]2{η3-Ge9[Si(TMS)3]3}
в
смеси
с
правления реакции к природе карбенового лиган-
остатками
непрореагировавшего
исходного
да. Для ряда серебряных комплексов образование
K2Ge9[Si(TMS)3]2.
PAg-координации
отображается
наличием
Обработка K2[Ge9{Si(TMS)3}2] хлорфосфином
1J(31P-107Ag/109Ag) констант спин-спинового вза-
R2PCl приводит к образованию нового кластер-
имодействия в диапазоне 207.8-486.2 Гц. Иссле-
ного соединения K[Ge9{Si(TMS)3}2PR2], содер-
дование влияния заместителей PR1R2 в составе
жащего в своем составе фосфиновый лиганд, что
кластера K[Ge9{Si(TMS)3}2PR1R2] на направление
открывает путь для исследования селективности
атаки катиона в составе карбенового комплекса
образования Ge-MC и P-MC связей при после-
(IPr)MCCl (MC = Cu, Ag), подтвердило вышеука-
дующей обработке in situ с помощью (IPr)MCCl
занную тенденцию [226]. Причем природа MC
[224, 225]. Показано, что при наличии таких отно-
не оказывает существенного влияния на направ-
сительно малых по объему фосфиновых остатков,
ление реакции. Реакция (IPr)CuCl с трис-фос-
как PMes и PNiPr2 наблюдается атака (IPr)CuCl
фин-функционализированными
кластерами
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1758
МИХАЙЛОВ, БАЛОВА
Схема 49.
N
N
Dipp
Dipp
N
Mes
N
N
N
Dipp
Dipp
Mes
Ag
Mes
CO
Ag
[NEt4]2[Pt3n(CO)6n]
N
O
Pt
OC
(n = 2, 3, 4)
C
CO
Pt
Pt
O
N
OC
CO
C
CO
OC
Pt
CO
OC
Pt
Pt
Mes
O
Pt
OC
CO
AgCl
OC
CO
C
CO
(IPr)AgCl
(IMes)AgCl
Pt
Pt
Pt
или
O
OC
C
CO
CO
OC
CO
Pt
Pt
Pt
ацетон, 20oC
O
OC
CO
Pt
OC
CO
C
CO
Pt
Pt
Pt
C
CO
Mes
O
OC
Pt
CO
N
Ag
CO
NMes
Dipp
Dipp
Ag
N N
164
Dipp
Dipp
N N
162
163
KGe9{P(NiPr2)2}3] и K[Ge9{P(NiPr2Bu}3] приводит
с (IMes)Ag+ выделено не было, что демонстриру-
также к Cu-Ge3 ассоциации [227].
ет критическое влияние природы карбена на на-
правление реакции. Таким образом, менее стери-
Другие кластеры Цинтля c Sn9 являются также
чески затрудненный IMes способствует процессу
реакционноспособными в подобных превраще-
переметаллирования. Особенно примечателен тот
ниях и полианионные металлические NHC-функ-
факт, что свободный IMes в отличии от свободно-
ционализированные кластеры [(IPr)MC{η4-Sn9}]3-
го IPr не реагирует с исследуемыми исходными
(MC = Cu, Ag, Au) могут быть образованы при
кластерами Хини, что позволяет рассматривать
низких температурах в результате реакции K4Sn9
переметаллирование как предпочтительный метод
с (IPr)MCCl в жидком аммиаке [228]. При исполь-
IMes-функционализации подобных систем.
зовании (IPr)AgCl наблюдали также образование
Таким образом, кислотность по Льюису кати-
интерметаллоидного димера [(η4-Sn9)Ag(η1-Sn9)]7-
онных частиц (NHC)MC может быть использована
по причине большей лабильности связи Ag-Cкарбен.
для формирования самых различных гетероме-
Обработка анионных карбонильных платино-
таллических аддуктов с уникальными физико-хи-
вых кластеров Хини [NEt4]2[Pt3n(CO)6n] (n = 2, 3,
мическими свойствами. Данная область только
4) (IPr)AgCl в ацетоне приводит к образованию
начинает развиваться, но даже первичный анализ
аддуктов [Pt6(CO)12(Ag(IPr))2] (из [Pt6(CO)12]2-)
имеющихся примеров таких реакций позволяет
(соединение
162) и
[Pt6(CO)12(Ag(IPr))2] (сое-
заключить, что природа N-гетероциклического
динение 163) (из [Pt9(CO)18]2- и [Pt12(CO)24]2-)
карбенового лиганда и природа металлоцетра в
(схема 49) [229]. В структуре последних, по дан-
значительной мере отражается на стабильности
ным рентгеноструктурного анализа, сохранился
синтезируемых аддуктов. Наиболее прочные и ста-
кластерный мотив исходного субстрата с терми-
бильные системы формируются при использова-
нальной функционализацией через координа-
нии N-гетероциклических карбеновых комплексов
цию (IPr)Ag+ по обеим тыльным Pt3 тригональ-
меди(I) и золота(I) cо стерически загруженными
ным сторонам кластера с формированием новых
лигандами. Использование малообъемных лиган-
связей Ag-Pt. (IMes)AgCl, содержащий менее
дов и комплексов серебра(I) может сопровождать-
стерически нагруженный карбен в сравнении с
ся переметаллированием. Реакции с комплексами
(IPr)AgCl, вступал в реакцию переметаллирова-
серебра(I) также нередко сопровождаются процес-
ния с исследуемыми анионным кластерами Хини
сам скремблирования лигандов с образованием го-
с образованием кластера 164 (схема 49). Аддуктов
молептических катионных комплексов (NHC)2Ag+
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1759
Схема 50.
a
+[M]Y
N
N
N
N
N
N
R
R
R
R
R
R
-MCX
MC
[M]Y
X
N
N
R
R
C
M
[M]Y
+[M]Y
X
б
N
N
или
N
N
R
R
R
R
-M
CX
MC
[M]Y
N
N
R
R
X
C
XM
[M]
Y
и анионных частиц AgY–, где Y чаще является ма-
двумя одинаковыми металлами 11 группы хорошо
лоосновным анионом.
известно [231-244]. В то же время примеров по-
добных гетерометаллических систем не выявлено,
7. ВОЗМОЖНЫЕ МЕХАНИЗМЫ
что косвенно может свидетельствовать о их низкой
И ДВИЖУЩИЕ СИЛЫ РЕАКЦИЙ
стабильности. Примеры образования стабильных
ПЕРЕМЕТАЛЛИРОВАНИЯ
биметаллических ассоциатов 118-123 (схема 37), в
И РОДСТВЕННЫХ ПРОЦЕССОВ
структуре которых металлы связаны мостиковым
В данном разделе на основании анализа приме-
Cl [189], можно рассматривать в качестве первич-
ров различных направлений протекания реакций
ного кислотно-основного взаимодействия, пред-
(NHC)-MC комплексов с соединениями других ме-
шествующего формированию NHC-мостикового
таллов сделана попытка рассмотреть возможные
интермедиата. Однако возможность образования
механизмы и движущие силы реакции переметал-
связей MC-металл в реакциях (NHC)-MC-ком-
лирования.
плексов с соединениями других металлов (раздел
На данный момент принято выделять два теоре-
5) указывает на допустимость прямой атаки MC
тически возможных механизма этих превращений:
по металлу-акцептору без посредничества анио-
мономолекулярный-диссоциативный и бимоле-
нов [190]. Использование гомолептических бис-
кулярный-ассоциативный (схема 50, а и б соот-
NHC-Cu(I) [245] и бис-NHC-Ag(I) [246] в реакци-
ветственно) [230]. Мономолекулярный механизм
ях переметаллирования дополнительно указывает
предполагает диссоциацию (NHC)-MC комплекса
на допустимость формирования бимолекулярного
с образованием свободного карбена, который да-
переходного состояния со связью MC-металл с
лее связывается с другим металлом, образуя про-
последующим переносом карбена через NHC-мо-
дукт переметаллирования. Бимолекулярный меха-
стиковый интермедиат. Наличие гидридно-гало-
низм реализуется через образование мостикового
генидного обмена (раздел 5) в процессе реакций
карбенового комплекса с последующим отщепле-
(NHC)MCX c гидридами других металлов [121,
нием MCХ и формированием целевого продукта
123, 126] также может свидетельствовать в пользу
переметаллирования.
бимолекулярного процесса. Влияние стерических
Стоит отметить, что образование комплексов
параметров карбенового лиганда на большинство
со связанными с помощью мостиковых карбенов
обсуждаемых в данном обзоре превращений также
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1760
МИХАЙЛОВ, БАЛОВА
Схема 51.
Me
Me
Me
Me
(Me2S)AuCl
N
N
N
N
Dipp
Dipp
CH2Cl2
iPr
40°C, 2 ч
iPr
Cu
Au
>99% (ВЭЖХ)
Cl
Cl
(Ra)-(+)-165
(Ra)-(+)-166 (ee >99%)
Me
Me
iPr
(Me2S)AuCl
N
N
Dipp
CH2Cl2
40°C, 2 ч
Au
Me
Me
>99% (ВЭЖХ)
Cl
iPr
N
N
Dipp
(Ra)-(-)-166 (ee >99%)
Cu
Cl
Me
Me
(Ra)-(-)-165
iPr
[(allyl)PdCl]2
N
N
Dipp
CH2Cl2
20°C, 2 ч
Pd
86% (ВЭЖХ)
Cl
(Ra)-(-)-167 (ee 98%)
указывает на существенный вклад ассоциативного
фигурации связи N-CAr, что позволяет исключить
бимолекулярного механизма, который в большей
реализацию диссоциативного механизма из-за
степени чувствителен к пространственным затруд-
значительно меньшего барьера вращения вокруг
нениям.
связи N-CAr в свободном карбене. Аналогичным
образом реакция протекала с образованием ком-
Недавно в работе [230], посвященной синтезу
плекса (Ra)-(-)-167. Потенциал новых хиральных
оптически чистых NHC-комплексов переходных
комплексов был проиллюстрирован на примере
металлов (TM) из прохиральных предшественни-
асимметричного катализа аллилирования и вну-
ков, проведено исследование взаимодействия оп-
тримолекулярного α-арилирования с ее до 98%.
тически активных карбеновых комплексов меди
(NHC)CuCl с соединениями других металлов в
Таким образом, на основании данной работы и
условиях реакции переметаллирования. Атропои-
других работ, рассматриваемых в настоящем об-
зомеры (Ra)-(+)-165 и (Ra)-(-)-165, которые могут
зоре, ассоциативный механизм через образование
быть выделены хроматографически в индивиду-
NHC-мостиковых гетерометаллических переход-
альном виде с использованием хиральной непод-
ных состояний или интермедиатов является наибо-
вижной фазы, реагировали с (Me2S)2AuCl с обра-
лее вероятным. Примечательно, что образование
зованием (NHC)-Au(I)-комплексов (Ra)-(+)-166 и
мультиядерных N-гетероциклических карбеновых
(Ra)-(-)-166 (схема 51) c полным сохранением кон-
комплексов с двумя мостиковыми NHC также воз-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1761
Схема 52.
Et
Ph
O2N
O
N
Cl
Et
169
Ru
Cl
толуол, 80°C,
O
Et
30 мин
Ph
NO
2
N
-(CAAC)CuCl
Cl
Ph
Et
CuCl
170 (38%)
Ru
EtCl
N
Ph
Et
Et
Et
N
Cl
168
Ru
CH2Cl2, 40°C
30 мин
Cl
-(CAAC)CuCl
Ph
2
Ph
171 (78%)
можно [244]. Поэтому в некоторых случаях нельзя
тово-химические исследования. Использование
исключать трех- и четырехмолекулярных пере-
атропоизомеров может стать эффективным под-
ходных состояний или интермедиатов, что может
ходом для дифференциации механизмов реакции
зависеть от природы аниона, карбена или метал-
переметаллирования в каждом конкретном случае.
лоцентра.
8. ПРИМЕНЕНИЕ ПРОДУКТОВ РЕАКЦИЙ
В рамках настоящего обзора нередко встре-
N-ГЕТЕРОЦИКЛИЧЕСКИХ КАРБЕНОВЫХ
чались примеры, демонстрирующие различие
КОМПЛЕКСОВ МЕТАЛЛОВ 11 ГРУППЫ
поведения комплексов серебра(I) и меди(I). Так,
С СОЕДИНЕНИЯМИ ДРУГИХ МЕТАЛЛОВ
(NHC)AgY в значительно большей степени подвер-
жены динамическим процессам аккумулирования
В заключительном разделе обзора мы привели
карбеновых лигандов с образованием соединений,
примеры использования продуктов альтернатив-
содержащих комплексный катион [(NHC)2Ag]+ и
ных превращений в реакциях переметаллирова-
анион AgY– Таким процессам могут способство-
ния карбеновых комплексов металлов 11 группы.
вать низкоосновные анионы Y и полярные раство-
Большинство из них относятся к получению эф-
рители, а также лабильное окружение металла-ак-
фективных каталитических систем для самых раз-
цептора.
нообразных процессов.
Однако для более глубокого понимания ме-
Так, использование «обратного» переметалли-
ханизма данных реакций, необходимы дополни-
рования позволяет существенным образом улуч-
тельные сравнительные исследования активности
шить каталитические свойства коммерчески до-
(NHC)-MC-комплексов в условиях реакции пере-
ступного рутениевого катализатора 168 на основе
металлирования, а также кинетические и кван-
CAAC. Обработка соединения 168 с помощью
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1762
МИХАЙЛОВ, БАЛОВА
Схема 53.
EtO
CO2Et
2C
EtO
CO2Et
[cat]
2C
C6H6, 20-40°C
N
N
N
N
Mes
Mes
Mes
Mes
Cl
Ph
Cl
Ru
Ru
[cat] = 168, 170, 171,
Cl
Cl
O
PCy2
NO2
172
173
Схема 54.
O
O
0.002 мол% 171
O
C6H6, 40°C
O
174
175
β-метилстирола 169 в присутствии CuCl сопрово-
сравнимую с катализатором 170, при загрузке
ждается захватом CAAC последним с образова-
0.005 мол% при комнатной температуре и более
нием рутениевого комплекса 170 (схема 52) [76].
высокую активность при экстранизкой загрузке
В то же время обработка соединения 168 CuCl в
0.0009 мол% и 40°C. Значения TON приведены в
отсутствие дополнительных лигандов при 40°C
табл. 1. Катализатор 171 демонстрирует уровень
в среде CH2Cl2 за короткое время через реакцию
активности ранее достижимый только с бензили-
«обратного» переметаллирования приводит к об-
деновыми катализаторами, что указывает на кри-
разованию димерного рутениевого комплекса 171
тическую роль лабильности стабилизирующего
с препаративным выходом 78% (схема 52) [75].
лиганда. Активность комплекса 171 также превос-
Структура комплекса 171 подтверждена с помо-
ходит комплексы 172 и 173 (схема 53), содержащие
щью данных РСА.
IMes в качестве стабилизирующего лиганда. Такое
Каталитическая активность комплексов 170 и
различие может быть связано с меньшей стабиль-
ностью соответствующих комплексов в услови-
171 исследовалась в условиях реакции метатезиса
ях реакции и низкой лабильностью фосфинового
олефинов [75]. Так, в условиях превращения диэти-
лиганда в случае комплекса 172, что отражается в
лового эфира 2,2-диаллилмалоновой кислоты в ди-
низких значениях TON (табл. 1).
этилциклопент-3-ен-1,1-дикарбоксилат (схема 53)
в среде бензола при комнатной температуре ком-
Также показана превосходная каталитическая
плексы 170 и 171 оказались значительно более
активность рутениевого комплекса 171 в условии
активными в сравнении со своим предшественни-
макроциклизации эфира 174 с концевыми двой-
ком - коммерчески доступным катализатором 168.
ными связями в соединение 175 при 40°C при ис-
Комплекс
171 продемонстрировал активность,
пользовании экстранизкой загрузки катализатора
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1763
Таблица 1. Сравнение каталитических свойств рутениевых комплексов 168, 170-173 в реакции метатезиса
TON
Катализатор
0.005 мол% (20°С)
0.0009 мол% (40°С)
20 мин
120 мин
20 мин
120 мин
168
3800
12000
-
-
170
16600
20000
46000
70000
171
16600
20000
68000
78000
172
0
2000
-
-
173
7200
17200
-
-
0.002 мол% (схема 54). Значения TON для ком-
(5 мол%) приводило к быстрому инициированию
плекса 171 в этих условиях достигают 27 500. Для
реакции метатезиса, конверсии исходного диена
сравнения, рекордное значение TON для NHC ком-
уже через 20 мин достигали 80%, и полное пре-
плексов рутения в этой реакции составляет 16000
вращение последнего наблюдалось через 40 мин.
при 80°C и концентрации эфира 174 8 мМ. [247]
Добавка AuCl показала еще более впечатляющую
с использованием тщательно очищенного диена
скорость инициирования преобразования исследу-
и растворителя, а также удалением этилена для
емого диэтилового эфира 2,2-диаллилмалоновой
ограничения разложения катализатора. Наличие
кислоты с выходом до 80% в течение 5 мин, од-
CAAC в структуре 171, вероятно, способствует по-
нако каталитическая система выходила на плато,
вышенной стабильности данной каталитической
и через 2 ч конверсия оставалась на уровне 84%.
системы по отношению к этилену.
При 80°С комплекс 176 увеличивает активность и
позволяет через 2 ч преобразовать исходный диен
В другой работе [74] показана возможность
в продукт с конверсией 73% (>99% через 6 ч). До-
использования «обратного» переметаллирования
для активации бис-NHC-комплекса рутения 176
бавление CuCl (5 мол%) в данных условиях приво-
дит к резкой активации каталитической системы,
(1 мол%) in situ с помощью добавок CuCl или
которая способна к достижению полной конвер-
AuCl в условиях метатезиса диэтилового эфира
сии диена уже за 4 мин.
2,2-диаллилмалоновой кислоты в диэтилцикло-
пент-3-ен-1,1-дикарбоксилате в среде толуола при
Окислительно-восстановительное переметал-
температурах 30 или 80°С. При 30°C комплекс
лирование также может дать соединения с по-
176 (схема 55) показал низкую каталитическую
лезными каталитическими свойствами. В работе
активность по отношению к исследуемому диену:
[93] показано, что каталитическое гидрирование
наблюдали только 10% конверсии исходного суб-
ацетофенона и бензофенона с переносом водоро-
страта через 2 ч (67% через 24 ч). Добавление CuCl
да от i-PrOH-KOH может быть успешно осущест-
Схема 55.
N
N
Mes
Cl
Ph
Ru
Cl
Mes
N N
176
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1764
МИХАЙЛОВ, БАЛОВА
Схема 56.
Bu
N
O
Cl
1 мол% [cat]
OH
N
N
2 мол% tBuOK
M
[cat] =
R
R
N
Cl
N
KOH-iPrOH
∆
N
Bu
34 (60%, M = Rh)
35 (21%, M = Ir)
влено при 82°C в присутствии комплексов родия
ся изменением степени окисления металла-акцеп-
34 или иридия 35 как катализаторов (схема 56),
тора, иногда демонстрируют свою синтетическую
которые получены в условиях реакции окисли-
полезность и безальтернативность в сравнении с
тельно-восстановительного переметаллирования.
классическим преметалированием в синтезе со-
Активность комплекса иридия 35 оказалась выше
ответствующих комплексов. Так, попытки полу-
в сравнении с комплексом родия 34. Так, полная
чения комплексов 51Cl, 52-60 из комплексов 48 и
конверсия бензофенона в дифенилметанол при ис-
49 через классический маршрут переметаллирова-
пользовании 1 мол% катализатора достигалась за
ния, используя соединения Pd(II), оказались безу-
2 ч при использовании комплекса 34, в то время
спешными, в то время как использование Pd2(dba)3
как использование комплекса 35 требовало более
приводило к синтезу целевых комплексов [114].
продолжительного времени реакции (10 ч) для до-
В разделе
3 обсуждены реакции переме-
стижения такого же результата.
таллирования с гидридными предшествен-
Комплекс золота 44 (схема 16), образующий-
никами металлов и (NHC)MCCl, которые
ся в условиях окислительно-восстановительного
сопровождаются гидридным обменом и высвобо-
переметаллирования, проявляет крайне высокую
ждением нестабильных AgH или CuH, разлага-
антипролиферативную активность в отношении
ющихся в условиях реакции до H2 и металла. В
клеточных линий рака груди человека (MCF-7),
этих условиях фиксируется образование гетеро-
простаты (PC3) и лейкемии (U937) [96]. Данное
металлических интермедиатов с мостиковыми ги-
соединение против раковых клеточных линий
дридными лигандами. Примечательно, что в усло-
MCF-7 и PC3 продемонстрировало низкую концен-
виях реакции гидридного комплекса рутения 177 c
трацию полумаксимального ингибирования IC50 на
(IPr)CuCl можно выделить стабильный гидридный
наномолярном уровне: 0.31±0.02 и 0.34±0.02 нМ.
мостиковый комплекс 178 (схема 57) с хорошим
соответственно. Активность комплекса золота 44
выходом [248]. Важно заметить, что содержащие
против клеточной линии U937 имела значение IC50
гидридные лиганды гетерометаллические соеди-
0.19±0.002 мкМ., что почти в 20 раз ниже, чем у
нения переходных металлов особенно интересны
5-фторурацила как используемого стандарта.
из-за возможных новых свойств, не наблюдаемых
Более того, вышеупомянутый комплекс 44 так-
для гомобиметаллических гидридных аналогов
же показал самую высокую активность среди те-
[249-254].
стируемых соединений золота и серебра в отноше-
Известно, что восстановление производных ни-
нии клеточной линии рака толстой кишки человека
тробензола до производных анилина может проте-
HCT116 со значением IC50 0.05±0.01 мкМ., что в
кать с использованием различных гомогенных и
100 раз эффективнее используемого стандарта.
гетерогенных катализаторов на основе платина,
Стоит отметить, что обсуждаемые в обзоре
золота, палладия, серебра, никеля, железа, меди,
примеры переметаллирования, сопровождающие-
рутения, иридия, родия [255, 256]. Новые высо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1765
Схема 57.
Dipp
(IPr)CuCl
N
H
H
Ru
Ru
Cu
Na
Et2O
H
N
H solv
2
Me(iPr)2P
Me(iPr)2P
Dipp
solv = Et2O, THF
177
178 (76%)
ко эффективные катализаторы должны не только
185, который может быть получен через обсуждае-
генерировать продукты с высоким выходом, но
мое в разделе 5 переметаллирование с сохранени-
и характеризоваться высокой селективностью. В
ем хелатированного металла в структуре целевого
работе [161] исследовалась каталитическая актив-
комплекса, демонстрировал высокую продуктив-
ность гомогенных NHC комплексов золота(I) 183
ность (выход 82%) и селективность по отношению
и иридия(III) 184 в условиях реакции сочетания
к N-бензиланилину, что указывает на выраженый
нитробензола с бензиловым спиртом (схема 58). В
кооперативный эффект двух металлоцентров.
обоих случаях реакция протекала в среде бензило-
Выраженный кооперативный эффект также
вого спирта при 100°С с использованием Cs2CO3 и
был замечен для Ag/Cu-NHC-комплекса 91, кото-
0.5 мол% соответствующего катализатора и сопро-
рый в своем составе сочетает CuCl в присутствии
вождалась образованием смеси N-бензиланилина
более лабильной связи Ag-Cкарбен без протека-
179, имина 180, азоксибензола 181, и азобензола
ния побочных процессов трансметаллирования
182 (табл. 2). В случае использования комплекса
(схема 59). Данный гетерометаллический ката-
золота(I) 183 реакция отличалась некоторой селек-
лизатор демонстрировал сравнительно более вы-
тивностью по отношению к образованию азокси-
сокую каталитическую активность в условиях
бензола и азобензола с относительно низкими вы-
реакции алкинилирования трифторометилфенил-
ходами (33 и 22% соответственно), в то время как
кетона фенилацетиленом в сравнении с мономе-
комплекс иридия(III) 184 способствовал формиро-
таллическими исходными соединениями [173].
ванию имина 180 с выходом 44%. Использование
эквимолярной смеси комплексов 183 и 184 в каче-
Используя реакции метатезиса анионов между
стве каталитической системы отличалось селек-
(NHC)MCCl и солями карбонильных комплексов
тивностью, свойственной комплексу 184, однако с
других металлов в группе Манкада разработаны
несколько большей продуктивностью (выход ими-
различные гетеробиметаллические каталитиче-
на 180 составил 56%). В то же время использова-
ские системы (NHC)MС-[MСО] {MС = Cu, Ag, Au,
ние гетерометаллического Au/Ir-NHC-комплекса
ZnCl; [Mco] = FeCp(CO)2, Mn(CO)5, WCp(CO)3,
Таблица 2. Каталитическая активность NHC-комплексов 183-185 в реакции сочетания нитробензола с бензиловым
спиртом
Выход, %а
Катализатор
Конверсия, %
179
180
181
182
183
74
0
8
33
22
184
59
5
44
5
4
183 + 184
74
8
56
5
5
185
100
82
14
0
4
a По данным ГХ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1766
МИХАЙЛОВ, БАЛОВА
Схема 58.
Схема 59.
R
R
N
N
MeI
Fe
Fe
Cu
Cu
I
+
Me
N
C
C
N
C C
O
O
R
O
R
O
129 (R = Dipp)
186 (R = Dipp)
130 (R = Mes)
187 (R = Mes)
Схема 60.
R
R
N
N
MeI
Fe
Fe
Cu
Cu
I
+
Me
N
C
C
N
C C
O
O
R
O
R
O
129 (R = Dipp)
186 (R = Dipp)
130 (R = Mes)
187 (R = Mes)
Co(CO)4 и т. д.}. Сформировавшиеся связи ме-
больших молекул, таких как H2, CS2 и N2O, в мяг-
талл-металл поляризованы таким образом, что ме-
ких условиях [179, 200, 257].
таллический центр MC сохраняет электрофильный
Комплексы 129 и 130 вступают в реакцию с
характер, тогда как металлический центр M сохра-
метилиодидом с образованием соответствующих
няет нуклеофильный характер. Такая поляризация
комплексов 186 и 187 с полной конверсией при
связи определяет способность синтезированных
комнатной температуре (схема 60) [196]. Образо-
гетерометаллических комплексов к активации не-
вание продуктов (NHC)Cu-Me или I-FeCp(CO)2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1767
Схема 61.
D
D O
[cat]
O
D
D
hν (450-W Hg лампа)
D
B
HB
+
O
C6D6, 25°C, 24 ч
O
D
D
D
D
D
D
188
Dipp
Dipp
Dipp
Cl
N
N
Fe
N
Fe
[cat] =
NHC
Cu
Cu
Zn
Zn
Fe
C
C
N
C
C
N
Fe
N
C
O
O
C
O
Dipp
O
Dipp
C
C
Dipp
O
O
O
O
129 (NHC = IPr)
132
189
190
130 (NHC = IMes)
131 (NHC = SIMes)
замечено не было. Данное превращение рассма-
плекса 129, полученного по реакции (IPr)CuCl
тривается авторами как реакция биметаллическо-
с KFeCp(CO)2. Так, при использовании 5 мол%
го окислительного присоединения. Отмечено, что
комплекса 129 реакция пинаколборана с дейте-
комплекс 130, содержащий IMes, проявляет более
робензолом (схема 61) протекала гладко в тече-
высокую реакционную способность в данных ус-
ние 24 ч при 25°C в условиях УФ облучения с
ловиях в сравнении с комплексом 129, содержа-
образованием целевого продукта 188 с выходом
щим более стерически нагруженный IPr. Если в
71%, по данным спектроскопии ЯМР 1H. Сниже-
первом случае реакция завершается практически
ние загрузки катализатора до 2.5 мол% привело
сразу после смешения, то при использовании ком-
к ощутимой потере в скорости реакции (табл. 3,
плекса 129 полная конверсия достигается только
оп. № 1 и 2). Стоит отметить, что комплекс 129
через 48 ч. Наблюдаемая реакционная способ-
устойчив в данных условиях реакции и может быть
ность согласуется с полярностью связи Cu-Fe,
повторно использован без значительного сниже-
оцененной с помощью квантово-химических рас-
четов методом DFT.
Продукты реакции метатезиса анионов ком-
Таблица 3. Данные о фотокаталитической активности
плексов (NHC)CuCl с KFeCp(CO)2 могут быть
Cu-Fe-гетеробиметаллических комплексов в реакции
также использованы как катализаторы в условиях
CH-борилирования
реакции CH-борилирования. В работе [177] по-
Количество
Выход,
казана высокая каталитическая активность син-
№ опыта
Катализатор
катализатора,
%а
тезированных гетеробиметаллических систем в
мол%
исследуемой реакции без необходимости исполь-
1
129
5
71
зования дорогих монометаллических каталитиче-
2
129
2.5
26
ских систем на основе комплексов благородных
3
130
10
33
металлов, таких как Rh или Ir. Сравнение ката-
4
131
10
0
литической активности Cu/Fe-NHC-комплексов
5
132
10
24
проводилось с комплексами, содержащими пару
6
189
10
0
Zn/Fe. Из протестированных каталитических
7
190
10
37
систем наибольшая активность отмечена у ком-
a По данным спектроскопии ЯМР 1H.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1768
МИХАЙЛОВ, БАЛОВА
Схема 62.
O
129
H
B
O
hν (450-W Hg лампа)
O
HB
+
R
R
O
C6D6, 25°C, 24 ч
191 (71%, R = H)
192 (46%, R = 4,5-Me)
193 (6%, R = 2,5-Me)
194 (83%, R = 2- или 4-Me)
195 (25%, R = 2- или 4-CF3)
196 (41%, R = 2- или 3- или 4-CF3)
ния эффективности путем добавления дополни-
региоселективностью, близкой к таковой для толу-
тельной порции субстрата в реакционный раствор
ола (схема 62). Только в случае анизола было обна-
после каталитического цикла. Переход к структур-
ружено орто-борилирование из-за орто-эффекта.
но подобным комплексам 130-132, содержащим
Вероятный механизм гетеробиметаллического
менее объемный IMes или SIMes (130 и 131) или
CH-борилирования включает стадии: (а) биме-
пентаметилциклопентадиен (132) отразился в су-
таллическое окислительное присоединение B-H
щественном понижение активности каталитиче-
с разрывом связи металл-металл; (б) фотохими-
ской системы (табл. 3, оп. № 3-5). Тестирование
ческое CH-борилирование образующимся проме-
каталитической активности исходных (IPr)CuCl и
жуточным борным интермедиатом и (в) биметал-
KFeCp(CO)2 в идентичных условиях показало от-
лическое восстановительное элиминирование H2 с
сутствие активности последних, что указывало на
образованием связи металл-металл и регенераци-
критическую роль гетерометаллической природы
ей каталитически активной частицы.
катализатора 129. Успешное борилирование с ис-
Способность подобных гетеробиметалличе-
пользованием катализатора 129 также может быть
ских NHC комплексов к активации H2 за счет коо-
достигнуто с использованием катехолборана и
перативного действия металлов была использова-
бис(пинаколато)дибора в качестве субстратов.
на для разработки каталитического гидрирования
Другие производные бензола также могут
ацетиленов [258]. Оптимальным катализатором,
успешно подвергаться CH-борилированию с ис-
обеспечивающим высокую активность и наивыс-
пользованием комплекса 129 в качестве катали-
шую E,Z-селективность исследуемой реакции ги-
затора [177]. Селективность борилирования по
дрирования, оказался комплекс 197 (схема 63). Се-
связи Csp2-H в этих условиях зависит от стериче-
лективное восстановление алкинов в присутствии
ских факторов. Так, реакция м-ксилола с пинакол-
других потенциально активных по отношению к
бораном происходила селективно в 5-положение с
процессам восстановления агентов (альдегидов,
выходом продукта 192 46% (схема 62). Борилиро-
кетонов, алкенов, нитрилов) показало толерант-
вание п-ксилола в идентичных условиях протекает
ность к другим функциональным группам. В рам-
с низкой конверсией, из-за пространственных пре-
ках предложенного механизма гидрирования алки-
пятствий, и выход продукта 193 составляет только
нов исследуемыми системами предполагается, что
6%. Борилирование толуола протекало с высоким
на первой стадии в обратимой реакции H2 c гете-
выходом с образованием изомерной смеси мета- и
робиметаллическими (NHC) комплексами проис-
пара-продуктов 194 в соотношении 0.62:0.38. Бо-
ходит образование (NHC)CuH и HRuCp(CO)2, на
рилирование анизола и α,α,α-трифтортолуола про-
следующей стадии син-присоединение образовав-
текало с меньшей скоростью с выходами целевых
шегося (NHC)AgH к тройной связи дает виниль-
продуктов 195 и 196 41 и 25% соответственно и
ный серебряный интермедиат, который, в свою
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1769
Схема 63.
H2 (1 атм)
20 мол% [cat]
R2
R2
R1
R1
+
R1
+
ксилол, 150°C, 24 ч
R2
R2
R1
I
II
III
Dipp
N
Ru
[cat] =
Ag
N
C
C
O
Dipp
O
197
очередь, способен реагировать с HRuCp(CO)2 с
Примеры кооперативного эффекта металлов в
образованием Z-алкена и регенерацией катализа-
составе рассматриваемых в данном обзоре гете-
тора. Результирующий Z-алкен изомеризуется в
робиметаллических комплексов также продемон-
условиях реакции под действием HRuCp(CO)2 че-
стрированы в условиях тандемной реакции Сузу-
рез внедрение с образованием металл-алкильного
ки-Мияура/гидрирование с переносом водорода
интермедиата, который через β-элиминирование
[158,
162], каталитического
1,4-присоединения
дает термодинамический более стабильный E-ал-
оксиндолов к нитрофенолам [259], региоселек-
кен, что и определяет наблюдаемую E,Z-селектив-
тивном гидростаннилирования алкинов [115, 199].
ность исследуемого превращения (табл. 4).
Аддукты люминесцентных комплексов иридия с
(IPr)Cu+ демонстрируют возможность увеличения
Последующие механистические исследования
времени жизни фосфоресценции при введении
[179] подтвердили ключевую роль активации H2
меди, что делает перспективной разработку раз-
с помощью гетеробиметаллического комплекса.
личных систем на основе биметаллических аддук-
Наибольшая активность каталитической системы
тов с сохранением связи NHC-MС с улучшенными
с Ag в сравнении с системой Cu может частично
оптическим свойствами [184].
объясняться более высокой скоростью отщепле-
ния β-гидрида из соединения 4d-металла по срав-
9. ЗАКЛЮЧЕНИЕ
нению с 3d-металлом. Также на основании резуль-
татов квантово-химического анализа предложено,
Все рассмотренные в настоящем обзоре приме-
что дальнейший рациональный лигандный дизайн
ры иллюстрируют богатство и многоплановость
следует направить на снижение активационного
и, зачастую, непредсказуемость этой области ме-
барьера первой стадии активации Н2, а также на
таллорганической химии, которая таит еще мно-
стабилизацию уязвимого гидридного интермедиа-
го сюрпризов для исследователей. В то же время
та (NHC)MCH (MC = Cu и Ag).
нестандартные превращения легкодоступных и
Таблица 4. E,Z-Селективность при каталитическом гидрировании интернальных алкинов до алкенов
№ опыта
R1
R2
R3
Соотношение I:II:III
1
Ph
Ph
96
90.2:4.2:1.1
2
4-MeOC6H4
4-MeOC6H4
>99
71:24:5
3
4-CF3C6H4
4-CF3C6H4
>99
72:20:8
4
4-(nC5H11)C6H4
H
91
-
5
Ph
nBu
>99
-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1770
МИХАЙЛОВ, БАЛОВА
стабильных (NHC)MC-комплексов металлов
11
комплексов металлов 11 группы с малоосновной
группы в большей степени раскрывают их синте-
жесткой анионной частью. Наличие координаци-
тический потенциал и, наряду с хорошо извест-
онно активного центра в структуре (NHC)Cu(I)-
ными процессами стандартного переметалли-
комплексов, содержащих объемные N-заместите-
рования, могут быть полезны для планирования
ли в карбене, открывает возможность селективной
целенаправленного структурного дизайна различ-
координации по этим центрам без реакции пере-
ных комплексов переходных металлов для широ-
металлирования, что открывает путь к гетероме-
кого спектра применения.
таллическим системам.
Примеры
окислительно-восстановитель-
(NHC)Cu(I)-Комплексы в
сравнении
с
ного переметаллирования с использованием
(NHC)Ag(I)-комплексами благодаря меньшей ла-
(NHC)MC-комплексов могут стать предпосылками
бильности связи MC-Скарбен могут вступать в реак-
разработки новых безальтернативных подходов
цию переметаллирования с соединениями метал-
синтеза N-гетероциклических карбеновых ком-
лов, проявляющими выраженную льюисовскую
плексов переходных металлов, в том числе, с ред-
кислотность, что делает их удобными реагентами
кими степенями окисления или с редкоземельными
для переноса карбена на такие металлы.
металлами. Переметаллирование металла-акцеп-
Таким образом, показанные выше превраще-
тора в низких степенях окисления с последующим
ния вместе с хорошо известными процессами
окислением может быть целесообразно в тех слу-
стандартного переметаллирования еще в большей
чаях, когда невозможен прямой синтез комплексов
степени раскрывают синтетический потенциал
с использованием соответствующих прекурсоров.
легкодоступных и стабильных (NHC)MC-комплек-
Использование гидридов металла-акцептора мо-
сов и могут быть полезны для планирования целе-
жет открыть принципиально новый сопряженный
направленного структурного дизайна различных
с гидридным обменом подход к переметаллирова-
комплексов переходных металлов для широкого
нию.
спектра применения. И, наконец, хемоселективное
Стоит отметить, что различие окислитель-
переметаллирование также можно рассматривать
но-восстановительного переметаллирования и
как удобный подход для получения гетерометал-
переметаллирования с последующим окислением
лических комплексов.
при использовании (NHC)MC-комплексов явля-
В совокупности обсуждаемые в обзоре превра-
ется отдельной задачей, которой целесообразно
щения зачастую приводят к получению комплексов
уделять больше внимания при исследовании таких
переходных металлов с новыми или улучшенными
примеров.
каталитическими свойствами, дают возможность
Использование (NHC)MC-комплексов в реак-
из прохиральных предшественников получать оп-
ции метатезиса анионов может быть полезно для
тически чистые комплексы для асимметрического
стабилизации и улучшения растворимости кла-
катализа. Потенциал и спектр биологической ак-
стерных соединений, а также для синтеза новых
тивности этих соединений представляется еще да-
гетерометаллических аддуктов с уникальными
леко не полностью раскрытым.
физико-химическими и биологическими свойства-
ИНФОРМАЦИЯ ОБ АВТОРАХ
ми за счет кооперативного действия NHC-стаби-
лизированных металлов 11 группы в комбинации
Михайлов Владимир Николаевич, ORCID:
с другими металлоцентрами. Наличие множества
солей, содержащих металлы в составе анионов,
Балова Ирина Анатольевна, ORCID: https://
обеспечивает потенциал будущих исследований
orcid.org/0000-0002-8593-4755
таких реакций. Изучение новых комбинаций мо-
жет открыть системы, содержащие беспреце-
ФОНДОВАЯ ПОДДЕРЖКА
дентные связи металл-MC, свойства которых еще
неизвестны. В свою очередь создание катионных
Работа выполнена при финансовой поддержке
гетерометаллических систем на основе (NHC)MC-
Российского фонда фундаментальных исследова-
комплексов возможно при использовании исходных
ний (проект № 20-13-50247).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1771
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
9.
Михердов А.С., Байков С.В., Проскурина И.К., Шет-
нев А.А., Котов А.Д. // ЖОХ. 2019. Т. 89. Вып. 10.
CAAC - комплексы циклических алкиламино-
С. 1572; Mikherdov A.S., Baikov S.V., Proskurina I.K.,
карбенов
Shetnev A.A., Kotov A.D. // Russ. J. Gen. Chem. 2019.
Vol. 89. N 10. P. 2062. doi 10.1134/S1070363219100128
COD - циклооктадиеновый лиганд
10.
Serebryanskaya T.V., Kinzhalov M.A., Bakulev V.,
COE - цис-циклооктеновый лиганд
Alekseev G., Andreeva A., Gushchin P.V., Protas A.V.,
Cp* - пентаметилциклопендадиенил
Smirnov A.S., Panikorovskii T.L., Lippmann P., Ott I.,
Dipp - 2,6-диизопропилфенил
Verbilo C.M., Zuraev A.V., Bunev A.S., Boyarskiy V.P.,
Kasyanenko N.A. // New J. Chem. 2020. Vol. 44. N 15.
MC - металл 11 группы
P. 5762. doi 10.1039/D0NJ00060D
Mes - 2,4,6-триметилфенил
11.
Valente C., Çalimsiz S., Hoi K.H., Mallik D., Sayah M.,
NHC - N-гетероциклический карбен
Organ M.G. // Angew. Chem. Int. Ed. 2012. Vol. 51.
N 14. P. 3314. doi 10.1002/anie.201106131
sNHC - насыщенный N-гетероциклический
12.
Hoyos M., Guest D., Navarro O. In: N-Heterocyclic
карбен
Carbenes. Weinheim: Wiley-VCH Verlag GmbH & Co.
NHC-MС - N-гетероциклические карбеновые
KGaA, 2014. Vol. 4. P. 85. doi 10.1002/9783527671229.
комплексы металлов 11 группы
ch04
NHC-M-комплекс - N-гетероциклический кар-
13.
Khazipov O.V., Shepelenko K.E., Pasyukov D.V.,
Chesnokov V.V., Soliev S.B., Chernyshev V.M., Anani-
беновый комплекс металла, которому соответству-
kov V.P. // Org. Chem. Front. 2021. Vol. 8. N 11. P. 2515.
ет химический символ M
doi 10.1039/d1qo00309g
КОНФЛИКТ ИНТЕРЕСОВ
14.
Shepelenko K.E., Soliev S.B., Galushko A.S., Cherny-
shev V.M., Ananikov V.P. // Inorg. Chem. Front. 2021.
Авторы заявляют об отсутствии конфликта
Vol. 8. N 6. P. 1511. doi 10.1039/d0qi01411g
интересов.
15.
Levin E., Ivry E., Diesendruck C.E., Lemcoff N.G. //
Chem. Rev. 2015. Vol. 115. N 11. P. 4607. doi 10.1021/
СПИСОК ЛИТЕРАТУРЫ
cr400640e
16.
Yuan D., Zhang Q., Liao S., Xiong W., Yuan L., Cai Q.,
1. Lee J.-Y., Lee J.-Y., Chang Y., Hu C., Wang N.M.,
Yang M., Li X., Jiang Y., Liu Y., Li P., Xu Z., Sun P.,
Lee H.M. // Organometallics. 2015. Vol. 34. N 17.
Geng H. // Chinese J. Org. Chem. 2015. Vol. 35. N 5.
P. 4359. doi 10.1021/acs.organomet.5b00586
P. 961. doi 10.6023/cjoc201407022
2. Patil S.A., Patil S.A., Patil R., Keri R.S., Budagumpi S.,
17.
Mora M., Jiménez-Sanchidrián C., Rafael Ruiz J. //
Balakrishna G.R., Tacke M. // Future Med. Chem.
Curr. Org. Chem. 2012. Vol. 16. N 9. P. 1128. doi
Future Sci. 2015. Vol. 7. N 10. P. 1305. doi 10.4155/
10.2174/138527212800564358
fmc.15.61
18.
Fortman G.C., Nolan S.P. // Chem. Soc. Rev. 2011.
3. Aher S.B., Muskawar P.N., Thenmozhi K., Bhagat P.R.,
Vol. 40. N 10. P. 5151. doi 10.1039/c1cs15088j
Babaji S., Narayan P., Thenmozhi K., Rambhau P.,
19.
Kantchev E.A.B., O’Brien C.J., Organ M.G. // Angew.
Aher S.B., Muskawar P.N., Thenmozhi K., Bhagat P.R. //
Chem. Int. Ed. 2007. Vol. 46. N 16. P. 2768. doi
Eur. J. Med. Chem. 2014. Vol. 81. P. 408. doi 10.1016/j.
10.1002/anie.200601663
ejmech.2014.05.036
4. Muhammad N., Guo Z. // Curr. Opin. Chem. Biol. 2014.
20.
Beletskaya I.P., Nájera C., Yus M. // Russ. Chem. Rev.
Vol. 19. P. 144. doi 10.1016/j.cbpa.2014.02.003
2020. Vol. 89. N 2. P. 250. doi 10.1070/RCR4916
5. Oehninger L., Rubbiani R., Ott I. // Dalton Trans. 2013.
21.
Masoud S.M., Vorobyeva D.V., Petropavlovskikh D.A.,
Vol. 42. N 10. P. 3269. doi 10.1039/C2DT32617E
Bruneau C., Osipov S.N. // Russ. Chem. Rev. 2021.
6. Liu W., Gust R. // Chem. Soc. Rev. 2013. Vol. 42. N 2.
Vol. 90. N 4. P. 419. doi 10.1070/RCR4984
P. 755. doi 10.1039/C2CS35314H
22.
Sahharova L.T., Gordeev E.G., Eremin D.B., Anani-
7. Kapdi A.R., Fairlamb I.J.S.S. // Chem. Soc. Rev. 2014.
kov V.P. // ACS Catal. 2020. Vol. 10. N 17. P. 9872. doi
Vol. 43. N 13. P. 4751. doi 10.1039/c4cs00063c
10.1021/acscatal.0c02053
8. Ray S., Mohan R., Singh J.K., Samantaray M.K.,
23.
Mercs L., Albrecht M. // Chem. Soc. Rev. 2010. Vol. 39.
Shaikh M.M., Panda D., Ghosh P. // J. Am. Chem. Soc.
N 6. P. 1903. doi 10.1039/b902238b
Am. Chem. Soc. 2007. Vol. 129. N 48. P. 15042. doi
24.
Visbal R., Gimeno M.C. // Chem. Soc. Rev. 2014.
10.1021/ja075889z
Vol. 43. N 10. P. 3551. doi 10.1039/c3cs60466g
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1772
МИХАЙЛОВ, БАЛОВА
25.
Smith C.A., Narouz M.R., Lummis P.A., Singh I.,
45.
Fehlhammer W.P., Achatz D., Plaia U., Völkl A. //
Nazemi A., Li C.H., Crudden C.M. // Chem. Rev.
Zeit. Naturforsch. (B). 1987. Vol. 42. N 6. P. 720. doi
2019. Vol. 119. N 8. P. 4986. doi 10.1021/acs.
10.1515/znb-1987-0614
chemrev.8b00514
46.
Barluenga J., Vicente R., López L.A., Tomás M. // J.
26.
Peris E. // N-Heterocyclic Carbenes Transit. Met. Catal.
Organomet. Chem. 2006. Vol. 691. N 26. P. 5642. doi
2007. P. 83. doi 10.1007/3418_027
10.1016/j.jorganchem.2006.09.013
27.
Martynova E.A., Tzouras N. V., Pisanò G., Cazin C.S.J.,
47.
Öfele K., Herberhold M. // Angew. Chem. Int. Ed. 1970.
Nolan S.P. // Chem. Commun. 2021. Vol. 57. N 32.
Vol. 9. N 9. P. 739. doi 10.1002/anie.197007391
P. 3836. doi 10.1039/d0cc08149c
48.
Fañanás-Mastral M., Aznar F. // Organometallics. 2009.
28.
Wang H.M.J., Lin I.J.B. // Organometallics. 1998. Vol.
Vol. 28. N 3. P. 666. doi 10.1021/om801146z
17. N 5. P. 972. doi 10.1021/om9709704
49.
Kessler F., Szesni N., Maaß C., Hohberger C., Weibert B.,
29.
Furst M.R.L., Cazin C.S.J. // Chem. Commun. 2010.
Fischer H. // J. Organomet. Chem. 2007. Vol. 692. N 14.
Vol. 46. N 37. P. 6924. doi 10.1039/c0cc02308f
P. 3005. doi 10.1016/j.jorganchem.2007.03.022
30.
Lin J.C.Y., Huang R.T.W., Lee C.S., Bhattacharyya A.,
50.
Casey C.P., Anderson R.L. // J. Chem. Soc. Chem.
Hwang W.S., Lin I.J.B. // Chem. Rev. 2009. Vol. 109.
Commun. 1975. N 21. P. 895. doi 10.1039/
N 8. P. 3561. doi 10.1021/cr8005153
C39750000895
31.
Cabeza J.A., García-Álvarez P. // Chem. Soc. Rev. 2011.
51.
Ashworth T. V., Berry M., Howard J.A.K., Laguna M.,
Vol. 40. N 11. P. 5389. doi 10.1039/c1cs15108h
Stone F.G.A. // J. Chem. Soc. Dalton Trans. 1980. N 9.
32.
Lin I.J.B., Vasam C.S. // Can. J. Chem. 2005. Vol. 83.
P. 1615. doi 10.1039/DT9800001615
N 6-7. P. 812. doi 10.1139/v05-087
52.
Fischer E.O., Beck H.-J. -J // Angew. Chem. Int. Ed.
33.
Jazzar R., Soleilhavoup M., Bertrand G. // Chem.
1970. Vol. 9. N 1. P. 72. doi 10.1002/anie.197000721
Rev. 2020. Vol. 120. N 9. P. 4141. doi 10.1021/acs.
53.
Chang Y.-H., Fu C.-F., Liu Y.-H., Peng S.-M., Chen J.-T.,
chemrev.0c00043
Liu S.-T. // Dalton Trans. 2009. N 5. P. 861. doi 10.1039/
34.
Danopoulos A.A., Simler T., Braunstein P. // Chem. Rev.
B814234C
2019. Vol. 119. N 6. doi 10.1021/acs.chemrev.8b00505
54.
Meana I., Toledo A., Albeniz A.C., Espinet P. // Chem.
35.
Nahra F., Gómez-Herrera A., Cazin C.S.J. // Dalton
Eur. J. 2012. Vol. 18. N 25. P. 7658. doi 10.1002/
Trans. 2017. Vol. 46. N 3. P. 628. doi 10.1039/
chem.201200575
C6DT03687B
55.
Fu C.-F., Liu Y.-H., Peng S.-M., Liu S.-T. // Tetrahedron.
36.
Bidal Y.D., Santoro O., Melaimi M., Cordes D.B.,
2010. Vol. 66. N 12. P. 2119. doi 10.1016/j.
Slawin A.M.Z., Bertrand G., Cazin C.S.J. // Chem.
tet.2010.01.081
Eur. J. 2016. Vol. 22. N 27. P. 9404. doi 10.1002/
56.
Jordi L., Moreto J.M., Ricart S., Vinas J.M., Mejias
chem.201601254
M., Molins E. // Organometallics. 1992. Vol. 11. N 11.
37.
Zhang D., Zi G. // Chem. Soc. Rev. 2015. Vol. 44. N 7.
P. 3507. doi 10.1021/om00059a011
P. 1898. doi 10.1039/c4cs00441h
57.
Albéniz A.C., Espinet P., Manrique R., Pérez-Mateo A. //
38.
Lazreg F., Cazin C.S.J. In: N-Heterocyclic Carbenes.
Angew. Chem. Int. Ed. 2002. Vol. 41. N 13. P. 2363.
Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA,
doi 1521-3773(20020703)41:13<2363::AID-
2014. P. 199. doi 10.1002/9783527671229.ch08
ANIE2363>3.0.CO;2-9
39.
Garrison J.C., Youngs W.J. // Chem. Rev. 2005.
58.
Liu S.-T., Hsieh T.-Y., Lee G.-H., Peng S.-M. // Organo-
Vol. 105. N 11. P. 3978. doi 10.1021/cr050004s
metallics. 1998. Vol. 17. N 6. P. 993. doi 10.1021/
40.
Lin I.J.B., Vasam C.S. // Coord. Chem. Rev. 2007.
OM9709897
Vol. 251. N 5-6. P. 642. doi 10.1016/j.ccr.2006.09.004
41.
Liu B., Liu X., Chen C., Chen C., Chen W. //
59.
Kuo H.-Y., Liu Y.-H., Peng S.-M., Liu S.-T. //
Organometallics. 2012. Vol. 31. N 1. P. 282. doi
Organometallics. 2012. Vol. 31. N 20. P. 7248. doi
10.1021/om300800c
10.1021/om200881s
42.
Baker M.V., Brown D.H., Haque R.A., Simpson P.V.,
60.
Liu S.-T., Lee C.-I., Fu C.-F., Chen C.-H., Liu Y.-H.,
Skelton B.W., White A.H., Williams C.C. / /
Elsevier C.J., Peng S.-M., Chen J.-T. // Organometallics.
Organometallics. 2009. Vol. 28. N 13. P. 3793. doi
2009. Vol. 28. N 24. P. 6957. doi 10.1021/om900776j
10.1021/om8011745
61.
Aumann R., Fischer E.O. // Chem. Ber. 1981. Vol. 114.
43.
Yu M.-H., Yang H.-H., Gu Y.-C., Wang B.-H., Liu F.-C.,
N 5. P. 1853. doi 10.1002/cber.19811140523
Lin I.J.B., Lee G.-H. // J. Organomet. Chem. 2019. doi
62.
Ku R.-Z., Huang J.-C., Cho J.-Y., Kiang F.-M.,
10.1016/j.jorganchem.2019.02.015
Reddy K.R., Chen Y., Lee K.-J., Lee J.-H., Lee G.-H.,
44.
Fischer E.O., Bock M. // J. Organomet. Chem. 1985.
Peng S., Liu S.-T. // Organometallics. 1999. Vol. 18.
Vol. 287. N 2. P. 279. doi 10.1016/0022-328X(85)87265-X
N 11. P. 2145. doi 10.1021/om981023d
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1773
63.
Fu C.-F., Chang Y.-H., Liu Y.-H., Peng S.-M., Else-
79.
Asay M. // Pincer Compounds. 2018. P. 431. doi
vier C.J., Chen J.-T., Liu S.-T. // Dalton Trans. 2009.
10.1016/B978-0-12-812931-9.00021-9
N 35. P. 6991. doi 10.1039/b906016b
80.
Pugh D., Boyle A., Danopoulos A.A. // Dalton Trans.
64.
Fu C.-F.F., Lee C.-C.C., Liu Y.-H.H., Peng S.-M.M.,
2008. N 8. P. 1087. doi 10.1039/b715769j
Warsink S., Elsevier C.J., Chen J.-T.T., Liu S.-T.T. //
81.
Mrutu A., Dickie D.A., Goldberg K.I., Kemp R.A. //
Inorg. Chem. 2010. Vol. 49. N 6. P. 3011. doi 10.1021/
Inorg. Chem. 2011. Vol. 50. N 7. P. 2729. doi 10.1021/
ic200029c
ic9025188
82.
Huynh H.V., Koh C.H.M., Nguyen V.H. // Dalton
65.
Bezuidenhout D.I., Van Der Westhuizen B., Rosenthal A.J.,
Trans. 2017. Vol. 46. N 34. P. 11318. doi 10.1039/
Wörle M., Liles D.C., Fernández I., Woerle M.,
C7DT01912B
Liles D.C., Fernandez I., Wörle M., Liles D.C.,
83.
DelPozo J., Casares J.A., Espinet P. // Chem. Commun.
Fernández I. // Dalton Trans. 2014. Vol. 43. N 2.
2013. Vol. 49. N 65. P. 7246. doi 10.1039/c3cc43133a
P. 398. doi 10.1039/C3DT52961D
84.
Meng G., Kakalis L., Nolan S.P., Szostak M. //
66.
Albéniz A.C., Espinet P., Pérez-Mateo A., Nova A.,
Tetrahedron Lett. 2019. Vol. 60. N 4. P. 378. doi
Ujaque G., Albeniz A.C., Espinet P., Perez-Mateo A.,
10.1016/j.tetlet.2018.12.059
Nova A., Ujaque G. // Organometallics. 2006. Vol. 25.
85.
Junor G.P., Lorkowski J., Weinstein C.M., Jazzar R.,
N 5. P. 1293. doi 10.1021/om051028s
Pietraszuk C., Bertrand G. // Angew. Chem. Int.
67.
Adams R.D., Babin J.E., Wang J.-G.G. // Polyhedron.
Ed. 2020. Vol. 59. N 49. P. 22028. doi 10.1002/
1989. Vol. 8. N 19. P. 2351. doi 10.1016/S0277-
anie.202010744
5387(00)80296-X
86.
Verlinden K., Buhl H., Frank W., Ganter C. // Eur.
68.
Albéniz A.C., Espinet P., Manrique R.R.R.R., Pérez-
J. Inorg. Chem. 2015. Vol. 2015. N 14. P. 2416. doi
Mateo A., Albeniz A.C., Espinet P., Manrique R.R.R.R.,
10.1002/ejic.201500174
Perez-Mateo A. // Chem. Eur. J. 2005. Vol. 11. N 5.
87.
Nayak S., Gaonkar S.L. // ChemMedChem. 2020. doi
P. 1565. doi 10.1002/chem.200400811
10.1002/cmdc.202000836
69.
Meana I., Albeniz A.C., Espinet P. // Organometallics.
88.
Liu X., Pattacini R., Deglmann P., Braunstein P. //
2008. Vol. 27. N 16. P. 4193. doi 10.1021/om800358f
Organometallics. 2011. Vol. 30. N 12. P. 3302. doi
70.
Hahn F.E., Meier N., Pape T. // Zeit. Naturforsch. (B).
10.1021/om200033m
2006. Vol. 61. N 7. P. 820. doi 10.1515/znb-2006-0708
89.
Ai P., Mauro M., De Cola L., Danopoulos A.A.,
71.
Jacobsen H., Correa A., Poater A., Costabile C.,
Braunstein P. // Angew. Chem. Int. Ed. 2016. Vol. 55.
Cavallo L. // Coord. Chem. Rev. 2009. Vol. 253. N 5-6.
N 10. P. 3338. doi 10.1002/anie.201510150
P. 687. doi 10.1016/j.ccr.2008.06.006
90.
Deacon G.B., Delbridge E.E., Skelton B.W.,
72.
Garber S.B., Kingsbury J.S., Gray B.L., Hoveyda A.H.
White A.H. // Eur. J. Inorg. Chem. 1998. N 5. P. 543. doi
10.1002/(SICI)1099-0682(199805)1998:5<543::AID-
// J. Am. Chem. Soc. 2000. Vol. 122. N 34. P. 8168. doi
EJIC543>3.0.CO;2-D
10.1021/ja001179g
91.
De Bruin-Dickason C.N., Boutland A.J., Dange D.,
73.
Munz D. // Organometallics. 2018. Vol. 37. N 3. P. 275.
Deacon G.B., Jones C. // Dalton Trans. 2018. Vol. 47.
doi 10.1021/acs.organomet.7b00720
N 28. P. 9512. doi 10.1039/c8dt02138d
74.
Kamal F., Colombel-Rouen S., Dumas A., Guégan J.-P.P.,
92.
Arnold P.L., Scarisbrick A.C. // Organometallics. 2004.
Roisnel T., Dorcet V., Baslé O., Rouen M., Mauduit M. //
Vol. 23. N 11. P. 2519. doi 10.1021/om0498091
Chem. Commun. 2019. Vol. 55. N 77. P. 11583. doi
93.
Mas-Marzá E., Sanaú M., Peris E. // Inorg. Chem. 2005.
10.1039/C9CC05776E
Vol. 44. N 26. P. 9961. doi 10.1021/ic051272b
75.
Nascimento D.L., Gawin A., Gawin R., Guńka P.A.,
94.
Puerta-Oteo R., Jiménez M.V., Lahoz F.J., Mod-
Zachara J., Skowerski K., Fogg D.E. // J. Am. Chem.
rego F.J., Passarelli V., Pérez-Torrente J.J. // Inorg.
Soc. 2019. Vol. 141. N 27. P. 10626. doi 10.1021/
Chem. 2018. Vol. 57. N 9. P. 5526. doi 10.1021/acs.
jacs.9b05362
inorgchem.8b00498
76.
Gawin R., Tracz A., Chwalba M., Kozakiewicz A.,
95.
Patil S., Deally A., Hackenberg F., Kaps L., Müller-Bunz H.,
Trzaskowski B., Skowerski K. // ACS Catal. 2017.
Schobert R., Tacke M. // Helv. Chim. Acta. 2011.
Vol. 7. N 8. P. 5443. doi 10.1021/acscatal.7b00597
Vol. 94. N 9. P. 1551. doi 10.1002/hlca.201100107
77.
Monfette S., Marleau-Gillette J., Conrad J.C.,
96.
Haque R.A., Ghdhayeb M.Z., Budagumpi S., Khadeer
McDonald R., Fogg D.E. // Dalton Trans. 2012.
Ahamed M.B., Abdul Majid A.M.S. // RSC Adv. 2016.
Vol. 41. N 48. P. 14476. doi 10.1039/c2dt32568c
Vol. 6. N 65. P. 60407. doi 10.1039/C6RA09788J
78.
Imlinger N., Mayr M., Wang D., Wurst K., Buchmei-
97.
Aher S., Das A., Muskawar P., Osborne J., Bhagat P. //
ser M.R. // Adv. Synth. Catal. 2004. Vol. 346. N 13-15.
J. Mol. Liq. 2017. Vol. 233. P. 270. doi 10.1016/j.
P. 1836. doi 10.1002/adsc.200404176
molliq.2017.03.021
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1774
МИХАЙЛОВ, БАЛОВА
98.
Goetzfried S.K., Gallati C.M., Cziferszky M., Talma-
114.
Mechler M., Latendorf K., Frey W., Peters R.R. //
zan R.A., Wurst K., Liedl K.R., Podewitz M., Gust R. //
Organometallics. 2013. Vol. 32. N 1. P. 112. doi
Inorg. Chem. 2020. Vol. 59. N 20. P. 15312. doi
10.1021/om3008629
10.1021/acs.inorgchem.0c02298
115.
Mechler M., Frey W., Peters R.R. // Organometallics.
99.
Simler T., Feuerstein T.J., Yadav R., Gamer M.T., Roe-
2014. Vol. 33. N 19. P. 5492. doi 10.1021/om500762r
116.
Labinger J.A. // Organometallics. 2015. Vol. 34. N 20.
sky P.W. // Chem. Commun. 2019. Vol. 55. N 2. P. 222.
P. 4784. doi 10.1021/acs.organomet.5b00565
doi 10.1039/C8CC08120D
117.
Scheetz P.M., Blank N.F., Gibbons S.K., Glueck D.S.,
100.
Gómez-Suárez A., Nelson D.J., Nolan S.P. // Chem.
Rheingold A.L. // Inorg. Chim. Acta. 2018. Vol. 483.
Commun. 2017. Vol. 53. N 18. P. 2650. doi 10.1039/
P. 111. doi 10.1016/j.ica.2018.08.007
c7cc00255f
118.
Lee J.H., Jeon H.T., Kim Y.J., Lee K.E., Ok Jang Y.,
101.
Normand A.T., Nechaev M.S., Cavell K.J. // Chem.
Lee S.W. // Eur. J. Inorg. Chem. 2011. N 11. P. 1750.
Eur. J. 2009. Vol. 15. N 29. P. 7063. doi 10.1002/
doi 10.1002/ejic.201001257
chem.200900373
119.
Jiang Y., Gendy C., Roesler R. // Organometallics.
102.
Warsink S., van Aubel C.M.S., Weigand J.J., Liu S.-T.,
2018. Vol. 37. N 7. P. 1123. doi 10.1021/acs.organom-
Elsevier C.J. // Eur. J. Inorg. Chem. 2010. N 35.
et.8b00022
P. 5556. doi 10.1002/ejic.201000768
120.
Lu Z., Cramer S.A., Jenkins D.M. // Chem. Sci. 2012.
103.
Scattolin T., Canovese L., Visentin F., Santo C.,
Vol. 3. N 10. P. 3081. doi 10.1039/c2sc20628e
Demitri N. // Polyhedron. 2018. Vol. 154. P. 382. doi
121.
Cooke C.E., Ramnial T., Jennings M.C., Pomeroy R.K.,
10.1016/j.poly.2018.08.007
Clyburne J.A.C.C. // Dalton Trans. 2007. Vol. 3. N 18.
104.
Canovese L., Visentin F., Levi C., Santo C., Berto-
P. 1755. doi 10.1039/b703071c
lasi V. // Inorg. Chim. Acta. 2012. Vol. 390. P. 105. doi
122.
Cooke C.E., Jennings M.C., Pomeroy R.K., Clybur-
10.1016/j.ica.2012.04.018
ne J.A.C.C. // Organometallics. 2007. Vol. 26. N 25.
105.
Ai P., Monakhov K.Y., van Leusen J., Kögerler P.,
P. 6059. doi 10.1021/om7007293
Gourlaouen C., Tromp M., Welter R., Danopou-
123.
Cooke C.E., Jennings M.C., Katz M.J., Pomeroy R.K.,
los A.A., Braunstein P. // Chem. Eur. J. 2018. Vol. 24.
Clyburne J.A.C.C. // Organometallics. 2008. Vol. 27.
N 35. P. 8787. doi 10.1002/chem.201801170
N 22. P. 5777. doi 10.1021/om800577x
106.
Warsink S., Chang I.-H., Weigand J.J., Hauwert P.,
124.
Lalaoui N., Reuillard B., Philouze C., Holzinger
Chen J.-T., Elsevier C.J. // Organometallics. 2010.
M., Cosnier S., Le Goff A. // Organometallics. 2016.
Vol. 29. N 20. P. 4555. doi 10.1021/om100670u
Vol. 35. N 17. P. 2987. doi 10.1021/acs.organom-
107.
Warsink S., Bosman S., Weigand J.J., Elsevier C.J. //
et.6b00508
125.
Bayon Castanon E., Kaposi M., Reich R.M.,
Appl. Organomet. Chem. 2011. Vol. 25. N 4. P. 276.
Kuehn F.E. // Dalton Trans. 2018. Vol. 47. N 7.
doi 10.1002/aoc.1754
P. 2318. doi 10.1039/C7DT04684G
108.
Sluijter S.N., Warsink S., Lutz M., Elsevier C.J. //
126.
Collins L.R., Rajabi N.A., Macgregor S.A., Mahon M.F.,
Dalton Trans. 2013. Vol. 42. N 20. P. 7365. doi
Whittlesey M.K. // Angew. Chem. Int. Ed. 2016.
10.1039/c3dt32835j
Vol. 55. N 50. P. 15539. doi 10.1002/anie.201608081
109.
Tromp D.S., Hauwert P., Elsevier C.J. // Appl.
127.
Abdalla J.A.B., Riddlestone I.M., Tirfoin R., Phillips N.,
Organomet. Chem. 2012. Vol. 26. N 7. P. 335. doi
Bates J.I., Aldridge S. // Chem. Commun. 2013.
10.1002/aoc.2866
Vol. 49. N 49. P. 5547. doi 10.1039/c3cc42342e
110.
Scattolin T., Santo C., Demitri N., Canovese L., Visen-
128.
Hollmann D., Kennedy A.R., Spicer M.D., Ramnial T.,
tin F. // Dalton Trans. 2020. Vol. 49. N 17. P. 5684. doi
Clyburne J.A.C., Abernethy C.D. // J. Organomet.
10.1039/d0dt01144d
Chem. 2005. Vol. 690. N 23. P. 5346. doi 10.1016/j.
111.
Scattolin T., Canovese L., Demitri N., Santo C., Vis-
jorganchem.2005.05.008
entin F. // Polyhedron. 2019. Vol. 173. P. 114144. doi
129.
Щербина Н.А., Казаков И.В., Спиридонова Д.В.,
10.1016/j.poly.2019.114144
Суслонов В.В., Хорошилова О.В., Михайлов В.Н.,
112.
Scattolin T., Pangerc N., Lampronti I., Tupini C., Gam-
Тимошкин А.Ю. // ЖОХ. 2020. Т. 91. Вып. 1. С.
bari R., Marvelli L., Rizzolio F., Demitri N., Canovese L.,
142; Shcherbina N.A., Kazakov I.V., Spiridonova D.V.,
Visentin F. // J. Organomet. Chem. 2019. Vol. 899.
Suslonov V.V., Khoroshilova O.V., Mikhailov V.N.,
P. 120857. doi 10.1016/j.jorganchem.2019.07.008
Timoshkin A.Y. // Russ. J. Gen. Chem. 2020. Vol. 90.
113.
Canovese L., Visentin F., Scattolin T., Santo C., Ber-
N 12. P. 2503. doi 10.1134/S1070363220120440
tolasi V. // Polyhedron. 2018. Vol. 144. P. 131. doi
130.
Mikhaylov V.N., Kazakov I. V., Parfeniuk T.N., Khoro-
10.1016/j.poly.2018.01.010
shilova O. V., Scheer M., Timoshkin A.Y., Balova I.A. //
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1775
Dalton Trans. 2021. Vol. 50. N 8. P. 2872. doi 10.1039/
145.
Wei Q., Ge B.-D., Zhang J., Sun A.-H., Li J.-H.,
D1DT00235J
Han S.-D., Wang G.-M. // Chem. Asian J. 2019.
131.
Tang S., Monot J., El-Hellani A., Michelet B., Guillot R.,
Vol. 14. N 2. P. 269. doi 10.1002/asia.201801555
Bour C., Gandon V. // Chem. Eur. J. 2012. Vol. 18. N
146.
Baron M., Tubaro C., Cairoli M.L.C., Orian L., Bo-
33. P. 10239. doi 10.1002/chem.201201202
gialli S., Basato M., Natile M.M., Graiff C. // Organo-
metallics. 2017. Vol. 36. N 12. P. 2285. doi 10.1021/
132.
Naderizadeh B., Bayat M. // Mendeleev Commun.
acs.organomet.7b00163
2021. Vol. 31. N 2. P. 179. doi 10.1016/j.men-
147.
Yu T., Shen J., Fu Y., Fu Y. // CrystEngComm. 2014.
com.2021.03.011
Vol. 16. N 24. P. 5280. doi 10.1039/c3ce42579g
133.
Nemcsok D., Wichmann K., Frenking G. // Organo-
148.
Li L., Chen H., Qiao Y.-Z., Niu Y.-Y. // Inorg. Chim.
metallics. 2004. Vol. 23. N 15. P. 3640. doi 10.1021/
Acta. 2014. Vol. 409. N PB. P. 227. doi 10.1016/j.
om049802j
ica.2013.09.029
134.
Naderizadeh B., Bayat M. // ACS Omega. 2020. Vol. 5.
149.
Song L.-S., Wang H.-M., Niu Y.-Y., Hou H.-W., Zhu Y. //
N 42. P. 26999. doi 10.1021/acsomega.0c01471
CrystEngComm. 2012. Vol. 14. N 15. P. 4927. doi
135.
Jerabek P., Roesky H.W., Bertrand G., Frenking G. //
10.1039/c2ce25103e
J. Am. Chem. Soc. 2014. Vol. 136. N 49. P. 17123. doi
150.
Kolychev E.L., Shuntikov V. V, Khrustalev V.N.,
10.1021/ja508887s
Bush A.A., Nechaev M.S. // Dalton Trans. 2011. Vol. 40.
136.
Caytan E., Roland S. // Organometallics. 2014. Vol. 33.
N 12. P. 3074. doi 10.1039/c0dt01630f
N 8. P. 2115. doi 10.1021/om401124y
151.
Kolychev E.L., Asachenko A.F., Dzhevakov P.B.,
137.
Михайлов В.Н., Павлов А.О., Огороднов Я.В.,
Bush A.A., Shuntikov V. V., Khrustalev V.N., Necha-
Спиридонова Д.В., Сорокоумов В.Н., Балова И.А. //
ev M.S. // Dalton Trans. 2013. Vol. 42. N 19. P. 6859.
ХГС. 2020, Т. 56. № 7. С. 915; Mikhaylov V.N., Pav-
doi 10.1039/c3dt32860k
lov A.O., Ogorodnov Y.V, Spiridonova D.V., Sorokou-
152.
Dyson G., Frison J.-C., Simonovic S., Whitwood A.C.,
mov V.N., Balova I.A. // Chem. Heterocycl. Compd.
Douthwaite R.E. // Organometallics. 2008. Vol. 27.
2020. Vol. 56. N 7. P. 915. doi 10.1007/s10593-020-
N 2. P. 281. doi 10.1021/om7009478
02750-0.
153.
Bildstein B., Malaun M., Kopacka H., Wurst K., Mitter-
138.
Morozov O.S., Lunchev A. V, Bush A.A., Tukov A.A.,
boeck M., Ongania K.-H.H., Opromolla G., Zanello P.,
Asachenko A.F., Khrustalev V.N., Zalesskiy S.S., Anan-
Mitterböck M., Ongania K.-H.H., Opromolla G.,
ikov V.P., Nechaev M.S. // Chem. Eur. J. 2014. Vol. 20.
Zanello P. // Organometallics. 1999. Vol. 18. N 21.
N 20. P. 6162. doi 10.1002/chem.201303760
P. 4325. doi 10.1021/om990377h
139.
Kolychev E.L., Portnyagin I.A., Shuntikov V.V.,
154.
Li Q., Li X., Yang J., Song H.-B., Tang L.-F. // Poly-
hedron. 2013. Vol. 59. P. 29. doi 10.1016/j.po-
Khrustalev V.N., Nechaev M.S. // J. Organomet.
ly.2013.04.032
Chem. 2009. Vol. 694. N 15. P. 2454. doi 10.1016/j.
155.
Latendorf K., Mechler M., Schamne I., Mack D.,
jorganchem.2009.03.014
Frey W., Peters R.R. // Eur. J. Org. Chem. 2017. Vol.
140.
Marchenko A., Koidan G., Hurieva A., Vlasenko Y.,
2017. N 28. P. 4140. doi 10.1002/ejoc.201700436
Kostyuk A., Lenarda A., Biffis A., Tubaro C., Baron M.,
156.
Pell T.P., Wilson D.J.D., Skelton B.W., Dutton J.L.,
Graiff C., Nestola F. // J. Organomet. Chem. 2017.
Barnard P.J. // Inorg. Chem. 2016. Vol. 55. N 14. P.
Vol.
829. N I. P.
71. doi
10.1016/j.jor-
6882. doi 10.1021/acs.inorgchem.6b00222
ganchem.2016.09.030
157.
Seitz S.C., Rominger F., Straub B.F. // Organometallics.
141.
Al Thagfi J., Lavoie G.G., Thagfi J. Al, Lavoie G.G. //
2013. Vol. 32. N 8. P. 2427. doi 10.1021/om400143u
Organometallics. A2012. Vol. 31. N 21. P. 7351. doi
158.
Bitzer M.J., Kühn F.E., Baratta W. // J. Catal. 2016.
10.1021/om300873k
Vol. 338. P. 222. doi 10.1016/j.jcat.2016.02.031
142.
Mayr M., Wurst K., Ongania K.-H., Buchmeiser M.R. //
159.
Longevial J.-F., Langlois A., Buisson A., Devillers C.H.,
Chem. Eur. J. 2004. Vol. 10. N 5. P. 1256. doi 10.1002/
Clément S., van der Lee A., Harvey P.D., Richeter S. //
chem.200305437
Organometallics. 2016. Vol. 35. N 5. P. 663. doi
143.
Herrmann W.A., Schneider S.K., Öfele K., Saka-
10.1021/acs.organomet.5b00966
moto M., Herdtweck E. // J. Organomet. Chem.
160.
Bente S., Kampert F., Tan T.T.Y.Y., Hahn F.E. // Chem.
2004. Vol. 689. N 15. P. 2441. doi 10.1016/j.jor-
Commun. 2018. Vol. 54. N 91. P. 12887. doi 10.1039/
ganchem.2004.04.032
C8CC08440H
144.
Mayr M., Buchmeiser M.R. // Macromol. Rapid
161.
Böhmer M., Kampert F., Tan T.T.Y., Guisado-Barrios G.,
Commun. 2004. Vol. 25. N 1. P. 231. doi 10.1002/
Peris E., Hahn F.E. // Organometallics. 2018. Vol. 37.
marc.200300173
N 21. P. 4092. doi 10.1021/acs.organomet.8b00642
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1776
МИХАЙЛОВ, БАЛОВА
162.
Böhmer M., Guisado-Barrios G., Kampert F.,
178.
Maity R., Birenheide B.S., Breher F., Sarkar B. //
Roelfes F., Tan T.T.Y., Peris E., Hahn F.E. // Organo-
ChemCatChem. 2021. Vol. 13. N 10. P. 2337. doi
metallics. 2019. Vol. 38. N 9. P. 2120. doi 10.1021/acs.
10.1002/cctc.202001951
organomet.9b00120
179.
Karunananda M.K., Mankad N.P. // Organometallics.
163.
Pardatscher L., Bitzer M.J., Jandl C., Kück J.W.,
2017. Vol. 36. N 1. P. 220. doi 10.1021/acs.organom-
Reich R.M., Kühn F.E., Baratta W. // Dalton Trans.
et.6b00356
2019. Vol. 48. N 1. P. 79. doi 10.1039/C8DT03713B
180.
Mazzacano T.J., Leon N.J., Waldhart G.W., Man-
164.
Teng Q., Huynh H.V. // Organometallics. 2018.
kad N.P. // Dalton Trans. 2017. Vol. 46. N 17. P. 5518.
Vol. 37. N 21. P. 4119. doi 10.1021/acs.organom-
doi 10.1039/C6DT04533B
et.8b00664
181.
Anwar M.T., Ali S., Shahzadi S., Shahid M. // Russ. J.
165.
Visentin F., Togni A. // Organometallics. 2007. Vol. 26.
Gen. Chem. 2013. Vol. 83. N 12. P. 2380. doi 10.1134/
N 15. P. 3746. doi 10.1021/om0702126
S1070363213120311
182.
Mui Y.F., Fernández-Gallardo J., Elie B.T., Gubran A.,
166.
Rosen E.L., Varnado C.D., Tennyson A.G., Khram-
Maluenda I., Sanaú M., Navarro O., Contel M. //
ov D.M., Kamplain J.W., Sung D.H., Cresswell P.T.,
Organometallics. 2016. Vol. 35. N 9. P. 1218. doi
Lynch V.M., Bielawski C.W. // Organometallics. 2009.
10.1021/acs.organomet.6b00051
Vol. 28. N 23. P. 6695. doi 10.1021/om900698x
183.
Tripathy S.K., De U., Dehury N., Pal S., Kim H.S.,
167.
Maity R., Schulte To Brinke C., Hahn F.E. // Dalton
Patra S. // Dalton Trans. 2014. Vol. 43. N 39. P. 14546.
Trans. 2013. Vol. 42. N 36. P. 12857. doi 10.1039/
doi 10.1039/c4dt01033g
c3dt51572a
184.
Shi C., Huang M., Li Q., Xie G., Yang C., Yuan A. //
168.
Peuntinger K., Pilz T.D., Staehle R., Schaub M., Kauf-
Dalton Trans. 2018. Vol. 47. N 48. P. 17299. doi
hold S., Petermann L., Wunderlin M., Görls H., Heine-
10.1039/C8DT04007A
mann F.W., Li J., Drewello T., Vos J.G., Guldi D.M.,
185.
Simler T., Möbius K., Müller K., Feuerstein T.J., Gam-
Rau S. // Dalton Trans. 2014. Vol. 43. N 36. P. 13683.
er M.T., Lebedkin S., Kappes M.M., Roesky P.W. //
doi 10.1039/c4dt01546k
Organometallics. 2019. Vol. 38. N 19. P. 3649. doi
169.
Webster A.A., Prasad S.K.K.K., Hodgkiss J.M., Ho-
10.1021/acs.organomet.9b00449
berg J.O. // Dalton Trans. 2015. Vol. 44. N 8. P. 3728.
186.
Arifin K., Majlan E.H., Wan Daud W.R., Kassim M.B. //
doi 10.1039/C4DT03086A
Int. J. Hydrogen Energy. 2012. Vol. 37. N 4. P. 3066.
170.
Bitzer M.J., Poethig A., Jandl C., Kuehn F.E., Barat-
doi 10.1016/j.ijhydene.2011.11.052
ta W., Pöthig A., Jandl C., Kühn F.E., Baratta W. //
187.
Rubio M., Siegler M.A., Spek A.L., Reek J.N.H.H. //
Dalton Trans. 2015. Vol. 44. N 26. P. 11686. doi
Dalton Trans. 2010. Vol. 39. N 23. P. 5432. doi
10.1039/C5DT01914A
10.1039/c003352a
171.
Muenzner J.K., Biersack B., Albrecht A., Rehm T.,
188.
Mendoza-Espinosa D., Donnadieu B., Bertrand G. //
Lacher U., Milius W., Casini A., Zhang J.-J.J., Ott I.,
Chem. Asian J. 2011. Vol. 6. N 4. P. 1099. doi 10.1002/
Brabec V., Stuchlikova O., Andronache I.C., Kaps L.,
asia.201000856
Schuppan D., Schobert R. // Chem. Eur. J. 2016.
189.
Cesari C., Conti S., Zacchini S., Zanotti V., Cassani M.C.,
Vol. 22. N 52. P. 18953. doi 10.1002/chem.201604246
Mazzoni R. // Dalton Trans. 2014. Vol. 43. N 46.
172.
Ibanez S., Poyatos M., Dawe L.N., Gusev D., Peris E. //
P. 17240. doi 10.1039/C4DT02747G.
Organometallics. 2016. Vol. 35. N 16. P. 2747. doi
190.
Oeschger R.J., Chen P. // J. Am. Chem. Soc. 2017.
10.1021/acs.organomet.6b00517
Vol. 139. N 3. P. 1069. doi 10.1021/jacs.6b12152
173.
Wang W., Zhao L., Lv H., Zhang G., Xia C., Hahn F.E.,
191.
Batcup R., Chiu F.S.N., Annibale V.T., Huh J.-E.E.U.,
Li F. // Angew. Chem. Int. Ed. 2016. Vol. 55. N 27.
Tan R., Song D. // Dalton Trans. 2013. Vol. 42. N 46.
P. 7665. doi 10.1002/anie.201600999
P. 16343. doi 10.1039/c3dt52135d
174.
Simler T., Braunstein P., Danopoulos A.A. // Angew.
192.
Guo S., Lim M.H., Huynh H.V. // Organometallics.
Chem. Int. Ed. 2015. Vol. 54. N 46. P. 13691. doi
2013. Vol. 32. N 23. P. 7225. doi 10.1021/om400911u
10.1002/anie.201505958
193.
Henderson W., Oliver A.G. // Inorg. Chim. Acta. 2011.
175.
Ai P., Gourlaouen C., Danopoulos A.A., Braunstein P. //
Vol. 378. N 1. P. 121. doi 10.1016/j.ica.2011.08.032
Inorg. Chem. 2016. Vol. 55. N 3. P. 1219. doi 10.1021/
194.
Muñoz-Castro A., Wang G., Ponduru T.T., Dias H.V.R. //
acs.inorgchem.5b02382
Phys. Chem. Chem. Phys. 2021. Vol. 23. N 2. P. 1577.
176.
Powers I.G., Uyeda C. // ACS Catal. 2017. Vol. 7.
doi 10.1039/d0cp05222a
N 2. P 936. doi 10.1021/acscatal.6b02692.
195.
Green S.P., Jones C., Mills D.P., Stasch A. // Organo-
177.
Mazzacano T.J., Mankad N.P. // J. Am. Chem. Soc.
metallics. 2007. Vol. 26. N 14. P. 3424. doi 10.1021/
2013. Vol. 135. N 46. P. 17258. doi 10.1021/ja408861p
om700345m
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1777
196.
Jayarathne U., Mazzacano T.J., Bagherzadeh S.,
Ed. 2009. Vol. 48. N 51. P. 9735. doi 10.1002/
Mankad N.P. // Organometallics. 2013. Vol. 32. N 14.
anie.200904774
P. 3986. doi 10.1021/om400471u
212.
Braunschweig H., Damme A., Dewhurst R.D., Kram-
197.
Banerjee S., Karunananda M.K., Bagherzadeh S.,
er T., Östreicher S., Radacki K., Vargas A. // J. Am.
Jayarathne U., Parmelee S.R., Waldhart G.W., Man-
Chem. Soc. 2013. Vol. 135. N 6. P. 2313. doi 10.1021/
kad N.P. // Inorg. Chem. 2014. Vol. 53. N 20. P. 11307.
ja310895w
doi 10.1021/ic5019778
213.
Braunschweig H., Ewing W.C., Kramer T., Mattock J.D.,
198.
Karunananda M.K., Parmelee S.R., Waldhart G.W.,
Vargas A., Werner C. // Chem. Eur. J. 2015. Vol. 21.
Mankad N.P. // Organometallics. 2015. Vol. 34. N 15.
N 35. P. 12347. doi 10.1002/chem.201500788
P. 3857. doi 10.1021/acs.organomet.5b00476
214.
Braunschweig H., Ewing W.C., Ghosh S., Kramer T.,
199.
Cheng L.-J., Mankad N.P. // J. Am. Chem. Soc. 2019.
Mattock J.D., Östreicher S., Vargas A., Werner C. //
Vol. 141. N 8. P. 3710. doi 10.1021/jacs.9b00068
Chem. Sci. 2016. Vol. 7. N 1. P. 109. doi 10.1039/
C5SC03206G
200.
Jayarathne U., Parmelee S.R., Mankad N.P. // Inorg.
215.
Braunschweig H., Dewhurst R.D., Kraft K., Östreicher S.,
Chem. 2014. Vol. 53. N 14. P. 7730. doi 10.1021/
Radacki K. // Angew. Chem. Int. Ed. 2012. Vol. 51.
ic501054z
N 9. P. 2183. doi 10.1002/anie.201107248
201.
Doyle G., Eriksen K.A., Van Engen D. // J. Am. Chem.
216.
Braunschweig H., Radacki K., Shang R. // Chem.
Soc. 1985. Vol. 107. N 26. P. 7914. doi 10.1021/
Commun. Royal Society of Chemistry, 2013. Vol. 49.
ja00312a019
N 85. P. 9905. doi 10.1039/c3cc45455j
202.
Fortman G.C., Slawin A.M.Z.Z., Nolan S.P. // Organo-
217.
Scharfe S., Kraus F., Stegmaier S., Schier A., Fässler T.F. //
metallics. 2010. Vol. 29. N 17. P. 3966. doi 10.1021/
Angew. Chem. Int. Ed. 2011. Vol. 50. N 16. P. 3630.
om100733n
doi 10.1002/anie.201001630
203.
Santoro O., Collado A., Slawin A.M.Z.Z., Nolan S.P.,
218.
Sevov S.C., Goicoechea J.M. // Organometallics. 2006.
Cazin C.S.J.J. // Chem. Commun. 2013. Vol. 49. N 89.
Vol. 25. N 24. P. 5678. doi 10.1021/om060480o
P. 10483. doi 10.1039/c3cc45488f
219.
Geitner F.S., Fässler T.F. // Eur. J. Inorg. Chem. 2016.
204.
Pranckevicius C., Jimenéz-Halla J.O.C., Kirsch M.,
Vol. 2016. N 17. P. 2688. doi 10.1002/ejic.201600258
Krummenacher I., Braunschweig H. // J. Am. Chem.
220.
Schiegerl L.J., Geitner F.S., Fischer C., Klein W.,
Soc. 2018. Vol. 140. N 33. P. 10524. doi 10.1021/
Fässler T.F. // Zeit. anorg. allg. Chem. Wiley-VCH
jacs.8b05398
Verlag GmbH & Co. KGaA, 2016. Vol. 642. N 24.
205.
Della Pergola R., Sironi A., Rosehr A., Colombo V.,
P. 1419. doi 10.1002/zaac.201600295
Sironi A. // Inorg. Chem. Commun. 2014. Vol. 49.
221.
Geitner F.S., Giebel M.A., Pöthig A., Fässler T.F. //
P. 27. doi 10.1016/j.inoche.2014.09.007
Molecules. 2017. Vol. 22. N 7. P. 1204. doi 10.3390/
206.
Bortoluzzi M., Cesari C., Ciabatti I., Femoni C., Ha-
molecules22071204
yatifar M., Iapalucci M.C., Mazzoni R., Zacchini S. //
222.
Fischer C., Klein W., Jantke L.A., Schiegerl L.J.,
J. Clust. Sci. 2017. Vol. 28. N 2. P. 703. doi 10.1007/
Fässler T.F. // Zeit. anorg. allg. Chem. 2016. Vol. 642.
s10876-016-1073-0
N 22. P. 1314. doi 10.1002/zaac.201600296
207.
Berti B., Bortoluzzi M., Cesari C., Femoni C., Iapa-
223.
Schiegerl L.J., Melaimi M., Tolentino D.R., Klein W.,
lucci M.C., Mazzoni R., Vacca F., Zacchini S. // Inorg.
Bertrand G., Fässler T.F. // Inorg. Chem. 2019. Vol. 58.
Chem. 2019. Vol. 58. N 5. P. 2911. doi 10.1021/acs.
N 5. P. 3256. doi 10.1021/acs.inorgchem.8b03338
inorgchem.8b03334
224.
Geitner F.S., Dums J. V., Fässler T.F. // J. Am. Chem.
208.
Berti B., Bortoluzzi M., Cesari C., Femoni C., Iapa-
Soc. 2017. Vol. 139. N 34. P. 11933. doi 10.1021/
lucci M.C., Mazzoni R., Zacchini S. // Eur. J. Inorg.
jacs.7b05834
Chem. 2020. Vol. 2020. N 22. P. 2191. doi 10.1002/
225.
Geitner F.S., Wallach C., Fässler T.F. // Chem.
ejic.202000260
Eur. J. 2018. Vol. 24. N 16. P. 4103. doi 10.1002/
209.
Lakliang Y., Mankad N.P. // Organometallics. 2020.
chem.201705678
Vol. 39. N 11. P. 2043. doi 10.1021/acs.organom-
226.
Wallach C., Geitner F.S., Klein W., Fässler T.F. //
et.0c00212
Chem. Eur. J. 2019. Vol. 25. N 53. P. 12349. doi
210.
Berti B., Bortoluzzi M., Cesari C., Femoni C., Iapa-
10.1002/chem.201901673
lucci M.C., Mazzoni R., Vacca F., Zacchini S. // Eur.
227.
Geitner F.S., Klein W., Fässler T.F. // Angew. Chem.
J. Inorg. Chem. 2019. Vol. 2019. N 26. P. 3084. doi
Int. Ed. 2018. Vol. 57. N 44. P. 14509. doi 10.1002/
10.1002/ejic.201900537
anie.201803476
211.
Braunschweig H., Brenner P., Dewhurst R.D., Kaupp M.,
228.
Geitner F.S., Klein W., Fässler T.F. // Dalton Trans.
Müller R., Östreicher S. // Angew. Chemie Int.
2017. Vol. 46. N 18. P. 5796. doi 10.1039/C7DT00754J
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1778
МИХАЙЛОВ, БАЛОВА
229.
Bortoluzzi M., Cesari C., Ciabatti I., Femoni C., Iapa-
243.
Munro L.B., Catalano V.J. // Eur. J. Inorg. Chem. 2014.
lucci M.C., Zacchini S. // Inorg. Chem. 2017. Vol. 56.
Vol. 2014. N 29. P. 4994. doi 10.1002/ejic.201402483
N 11. P. 6532. doi 10.1021/acs.inorgchem.7b00665
244.
Della Pergola R., Bruschi M., Sironi A.A.A., Colombo V.,
230.
Kong L., Morvan J., Pichon D., Jean M., Albalat M.,
Sironi A.A.A. // Organometallics. 2014. Vol. 33. N 19.
Vives T., Colombel-Rouen S., Giorgi M., Dorcet V.,
P. 5610. doi 10.1021/om500733f
Roisnel T., Crévisy C., Nuel D., Nava P., Humbel S.,
245.
Santoro O., Lazreg F.F., Cordes D.B., Slawin A.M.Z.,
Vanthuyne N., Mauduit M., Clavier H. // J. Am.
Cazin C.S.J. // Dalton Trans. 2016. Vol. 45. N 12.
Chem. Soc. 2020. Vol. 142. N 1. P. 93. doi 10.1021/
P. 4970. doi 10.1039/C6DT00595K
jacs.9b12698
246.
Salman A.W., Haque R.A. // Eur. J. Chem. 2016. Vol. 7.
231.
Zhang S., Shang R., Nakamoto M., Yamamoto Y., Ada-
N 1. P. 115. doi 10.5155/eurjchem.7.1.115-120.1387
247.
Kadyrov R. // Chem. Eur. J. 2013. Vol. 19. N 3.
chi Y., Ohshita J. // Dalton Trans. 2019. Vol. 48. N 32.
P. 1002. doi 10.1002/chem.201202207
P. 12250. doi 10.1039/C9DT02435B
248.
Smith P.W., Ellis S.R., Handford R.C., Tilley T.D. //
232.
Evans K.J., Campbell C.L., Haddow M.F., Luz C.,
Organometallics. 2019. Vol. 38. N 2. P. 336. doi
Morton P.A., Mansell S.M. // Eur. J. Inorg. Chem. 2019.
10.1021/acs.organomet.8b00738.
Vol. 2019. N 46. P. 4894. doi 10.1002/ejic.201901003
249.
Wheatley N., Kalck P. // Chem. Rev. 1999. Vol. 99.
233.
Lake B.R.M., Willans C.E. // Organometallics. 2014.
N 12. P. 3379. doi 10.1021/cr980325m
Vol. 33. N 8. P. 2027. doi 10.1021/om500178e
250.
Bodio E., Picquet M., Le Gendre P. // Top. Or-
234.
Cabeza J.A., Fernández-Colinas J.M., García-Álvarez P.,
ganomet. Chem. 2015. Vol. 59. P. 139. doi
Pérez-Carreño E., Pruneda V., Van der Maelen J.F.
10.1007/3418_2015_161
// Chem. Eur. J. 2013. Vol. 19. N 28. P. 9251. doi
251.
Cooper B.G., Napoline J.W., Thomas C.M. //
10.1002/chem.201204250
Catal. Rev. 2012. Vol. 54. N 1. P. 1. doi
235.
Han X., Koh L.-L., Liu Z.-P., Weng Z., Hor T.S.A. //
10.1080/01614940.2012.619931
Organometallics. 2010. Vol. 29. N 11. P. 2403. doi
252.
Shibasaki M., Kanai M., Matsunaga S., Kumagai N. //
10.1021/om100277f
Top. Organomet. Chem. 2011. Vol. 37. P. 1. doi
236.
Gischig S., Togni A. // Organometallics. 2005. Vol. 24.
10.1007/3418_2011_1
N 2. P. 203. doi 10.1021/om049097e
253.
Thomas C.M. // Comm. Inorg. Chem. 2011. Vol. 32.
237.
Agonigi G., Ciancaleoni G., Funaioli T., Zacchini S.,
N 1. P. 14. doi 10.1080/02603594.2011.593213.
Pineider F., Pinzino C., Pampaloni G., Zanotti V., Mar-
254.
Ritleng V., Chetcuti M.J. // Chem. Rev. 2007. Vol. 107.
chetti F. // Inorg. Chem. 2018. Vol. 57. N 24. P. 15172.
N 3. P. 797. doi 10.1021/cr940270y
doi 10.1021/acs.inorgchem.8b02445
255.
Goksu H., Sert H., Kilbas B., Sen F. // Curr. Org.
238.
Agonigi G., Bortoluzzi M., Marchetti F., Pampaloni G.,
Chem. 2017. Vol. 21. N 9. P. 794. doi 10.2174/13852
Zacchini S., Zanotti V. // Eur. J. Inorg. Chem. 2018.
72820666160525123907
Vol. 2018. N 8. P. 960. doi 10.1002/ejic.201701115
256.
Kadam H.K., Tilve S.G. // RSC Adv. 2015. Vol. 5.
239.
Andrew R.E., Storey C.M., Chaplin A.B. // Dalton
N 101. P. 83391. doi 10.1039/C5RA10076C
Trans. 2016. Vol. 45. N 21. P. 8937. doi 10.1039/C6D-
257.
Karunananda M.K., Vázquez F.X., Alp E.E., Bi W.,
T01263A
Chattopadhyay S., Shibata T., Mankad N.P. // Dalton
240.
Gu S., Du J., Huang J., Xia H., Yang L., Xu W., Lu C. //
Trans. 2014. Vol. 43. N 36. P. 13661. doi 10.1039/
Beilstein J. Org. Chem. 2016. Vol. 12. P. 863. doi
c4dt01841a
10.3762/bjoc.12.85
258.
Karunananda M.K., Mankad N.P. // J. Am. Chem.
241.
Liu Q.-X., Huo R., Liu J., Wei Q., Zhao X.-J.,
Soc. 2015. Vol. 137. N 46. P. 14598. doi 10.1021/
Zhao Z.-X. // Organometallics. 2015. Vol. 34. N 13.
jacs.5b10357
P. 3167. doi 10.1021/acs.organomet.5b00188
259.
Schmid J., Frey W., Peters R. // Organometallics. 2017.
242.
Liu B., Ma X., Wu F., Chen W. // Dalton Trans. 2015.
Vol. 36. N 21. P. 4313. doi 10.1021/acs.organom-
Vol. 44. N 4. P. 1836. doi 10.1039/C4DT02986K
et.7b00729
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
АЛЬТЕРНАТИВНЫЕ ПРЕВРАЩЕНИЯ
1779
Alternative Transformation of Group 11 Metal Complexes
of N-Heterocyclic Carbene in Reaction with Compounds
of Other Metals
V. N. Mikhaylov and I. A. Balova*
St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: i.balova@spbu.ru
Received August 3, 2021; revised September 30, 2021; accepted October 4, 2021
Currently, the carbene transfer from N-heterocyclic carbene complexes of Group 11 metals (NHC-MC)
(especially silver and copper) to other metals is considered a simple and universal, sometimes, no alternative
method for the synthesis of a wide range of important N-heterocyclic carbene complexes of transition metals.
As the number of successful examples of transmetalation with the formation of the target product increased,
data was accumulated on the unexpected or non-classic results of the reaction of NHC-MC with compounds of
other metals. This review considers examples of NHC-MC reactions with compounds of other metals, which
do not proceed according to the standard reaction pathway, but with a change of the metals oxidation state or
conversion of (NHC)MCX into cationic homoleptic [(NHC)2MC]+ forms, transmetalation saving another metal
in the coordination sphere of the product, formation of heterometallic adducts with saving of the MC-Ccarbene
bond. Unusual “reverse“ carbene transfer reactions are considered separately. The review material reveals a
promising new synthetic potential of NHC-MC in reactions with other metals and allows a critical look at the
possible mechanisms and driving forces of such transformations. The review also discusses the most important
aspects of the application of the obtained products, primarily in various catalytic processes.
Keywords: Group 11 metal N-heterocyclic carbene complexes, coinage metals, transition metals, “reverse”
carbene transfer, heterometallic complexes and clusters, catalysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021