ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 11, с. 1801-1804
КРАТКИЕ
СООБЩЕНИЯ
УДК [547.495.2:547.281.1:547.415.1]:66.095.253.095.832
ПОЛУЧЕНИЕ ПРОДУКТОВ КОНДЕНСАЦИИ
МОЧЕВИНЫ С ФОРМАЛЬДЕГИДОМ
И ПРОПАН-1,3-ДИАМИНОМ И БУТАН-1,4-ДИАМИНОМ
© 2021 г. Ф. Хамудa, Я. Бедухa, С. М. Рамшb,*, Е. С. Храброваb
a Центр экологических исследований, Aннаба, 23005 Алжир
b Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, Россия
*е-mail: sramsh@technolog.edu.ru
Поступило в Редакцию 11 сентября 2021 г.
После доработки 10 октября 2021 г.
Принято к печати 17 октября 2021 г.
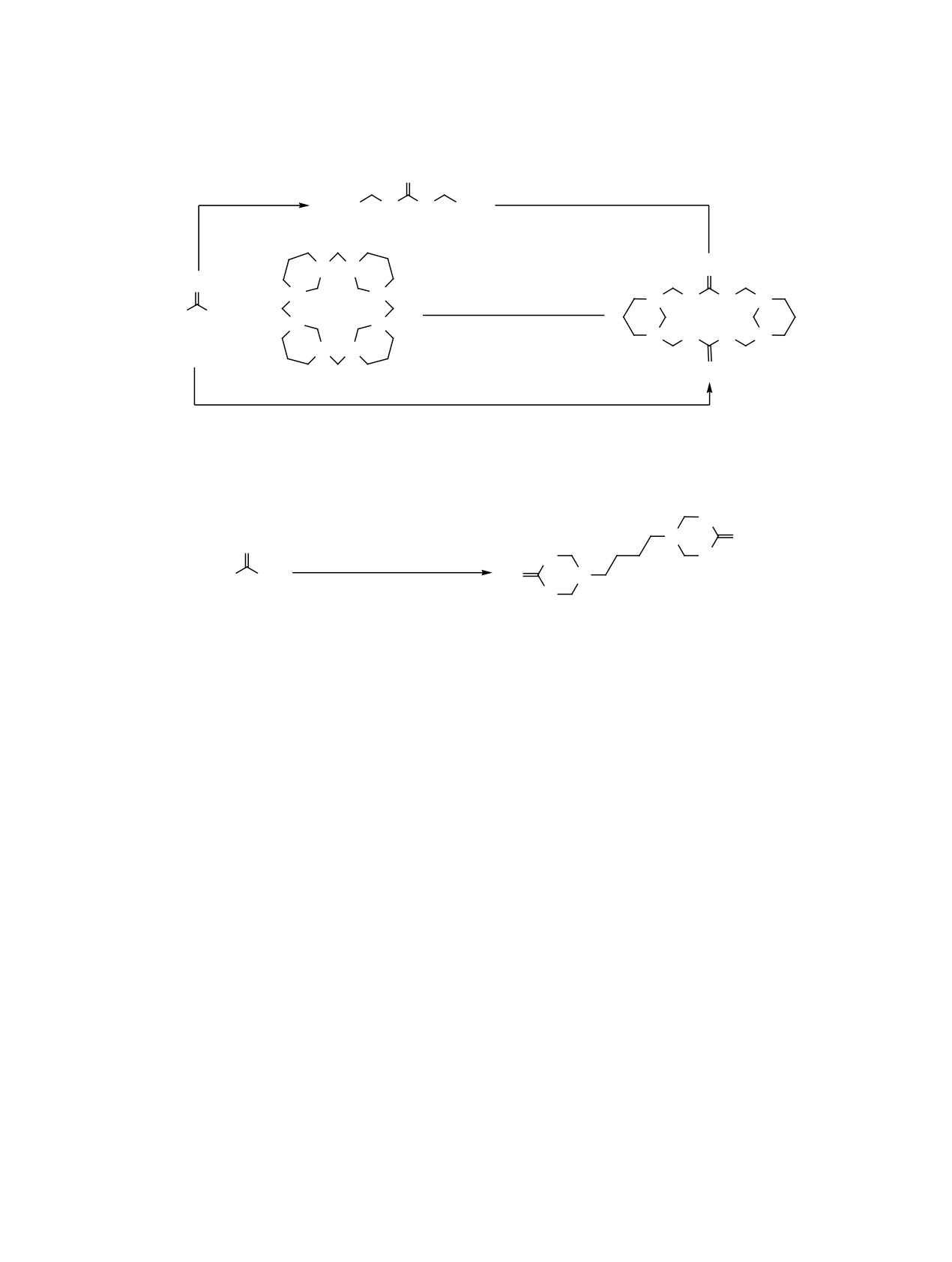
Трехкомпонентная конденсация между мочевиной, формальдегидом и пропан-1,3-диамином в мольном
соотношении 1:3:1 приводит к трициклическому 1,3,5,7,11,13,15,17-октаазатрицикло[15.3.1.17,11]доко-
зан-4,14-диону. Конденсация мочевины с 1,3,7,9,13,15,19,21-октаазапентацикло[19.3.1.13,7.19,13.115,19]-
октакозаном также приводит к указанному трициклическому продукту. В результате конденсации между
мочевиной, формальдегидом и бутан-1,4-диамином в соотношении 2:4:1 образуется 5,5′-бутан-1,4-ди-
илбис(1,3,5-триазинан-2-он).
Ключевые слова: аминометилирование, мочевина, диамины, формальдегид, бисмочевинные макро-
циклы
DOI: 10.31857/S0044460X21110123
Среди производных мочевины 1 известно зна-
азинан-2-оны [2-7]. Аналогичные продукты об-
чительное число лекарственных веществ; соответ-
разуются из диметилолмочевины 2 и аминов: при
ственно, соединения этого класса часто использу-
взаимодействии эквимольных количеств димети-
ются в качестве объектов медицинской химии для
лолмочевины 2 и этаноламина образуется 5-(2-ги-
дроксиэтил)-1,3,5-триазинан-2-он
[8-10], а при
разработки новых лекарств, в частности, предна-
взаимодействии диметилолмочевины 2 с этилен-
значенных для лечения ВИЧ-инфекции [1, 2]. Не-
диамином или гексаметилендиамином в мольном
которые производные мочевины 1 полезны в каче-
отношении
2:1 образуются
5,5′-этан-1,2-диил-
стве гербицидов и фунгицидов [2].
бис(1,3,5-триазинан-2-он) и 5,5′-гексан-1,6-диил-
Данное сообщение посвящено трехкомпонент-
бис(1,3,5-триазинан-2-он) соответственно [9]. В
ной конденсации мочевины 1 с формальдегидом и
работах [4, 5] сообщается о реакциях мочевины с
алифатическим диаминами. Реакция мочевины с
формальдегидом и этилендиамином в мольных от-
формальдегидом и аминами известна с середины
ношениях 1:2:1 и 2:4:1, приводящих к 5-(2-амино-
прошлого столетия. Установлено, что в результате
этил)-1,3,5-триазинан-2-ону и 5,5′-этан-1,2-диил-
конденсации мочевины с формальдегидом и пер-
бис(1,3,5-триазинан-2-ону) соответственно. Одна-
вичными моноаминами получаются 5-R-1,3,5-три-
ко трехкомпонентные конденсации мочевины 1 с
1801
1802
ХАМУД и др.
Схема 1.
O
CH2O
NH2(CH2)3NH2
[11]
HO N
N
OH
H
H
2 ч, EtOH или H2O, ∆
2
61 или 52%
O
N N
O
N
N
N
N
N
N
H
H
H2N NH2
+
N
N
2 ч, EtOH, ∆
H
H
1
42%
N
N
N
N
N N
3
O
4
CH2O, NH2(CH2)3NH2
2 ч, EtOH, ∆
76%
Схема 2.
NH
N
O
O
NH2(CH2)4NH2, CH2O
HN
NH
H2N NH2
O
N
2 ч, EtOH:H2O = 1:1, ∆
1
27%
HN
5
формальдегидом и пропан-1,3-диамином или бу-
заном 4 (макроциклический продукт взаимодей-
тан-1,4-диамином ранее не изучались. Также не изу-
ствия пропан-1,3-диамина с формальдегидом [12])
чалась реакция мочевины с 1,3,7,9,13,15,19,21-окта-
в 96%-ном этаноле при мольном соотношении 2:1
азапентацикло[19.3.1.13,7.19,13.115,19]октакозаном 4.
с выходом 42% (схема 1). Идентичность получен-
ных образцов с описанным в работе [11] соедине-
Ранее мы показали, что конденсация димети-
лолмочевины 2 с пропан-1,3-диамином при моль-
нием 3 подтверждена совокупностью спектраль-
ных данных, совпадающих с приведенными для
ном соотношении 2:1 приводит к трициклическому
этого соединения в указанной работе.
1,3,5,7,11,13,15,17-октаазатрицикло[15.3.1.17,11]-
докозан-4,14-диону 3 (схема 1), причем в качестве
С целью получить гомологичный соединению
растворителя в этой реакции можно использо-
3 продукт мы осуществили конденсацию моче-
вать как воду (выход 52%), так и 96%-ный этанол
вины 1 c бутан-1,4-диамином (путресцином) и
(выход 61%) [11]. Целью данной работы было раз-
формальдегидом в 50%-ном этаноле (наибольше-
работать более простой метод получения трицик-
го выхода удалось достичь, когда водный раствор
ла 3, исходя непосредственно из мочевины 1. Дей-
мочевины и формальдегида прибавлялся к спир-
ствительно, мы обнаружили, что однореакторная
товому раствору диамина), взяв реагенты в моль-
конденсация мочевины 1 с формальдегидом и про-
ном соотношении 2:1:4, но в качестве конечного
пан-1,3-диамином в 96%-ном этаноле при мольном
продукта реакции получили не соответствующий
соотношении 1:3:1 также приводит к самосборке
трицикл, а ранее не известный 5,5′-бутан-1,4-ди-
трицикла 3 с выходом 76% (схема 1). Соедине-
илбис(1,3,5-триазинан-2-он) 5 (схема 2). Также не
ние 3 удалось получить и другим путем, а именно
удалось получить и гомологичный соединению 3
конденсацией мочевины 1 с 1,3,7,9,13,15,19,21-ок-
продукт путем конденсации диметилолмочевины
таазапентацикло[19.3.1.13,7.19,13.115,19]октако-
2 с этан-1,2-диамином по методике [9], равно как
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
ПОЛУЧЕНИЕ ПРОДУКТОВ КОНДЕНСАЦИИ МОЧЕВИНЫ
1803
и путем трехкомпонентной конденсации мочеви-
формалина и 15 мл воды. Реакционную массу
ны 1, формальдегида и этан-1,2-диамина по ме-
кипятили 1 ч, затем упаривали при 60°С. Остаток
тодикам [4, 5]. В обоих случаях после удаления
обрабатывали 60 мл этанола, образовавшийся оса-
из реакционной массы растворителя (воды) фор-
док отфильтровывали и сушили в вакуум-эксикато-
мировались ломкие водорастворимые пластины,
ре. Выход 0.88 г (26.6%), т. пл. 289-290°С (этанол).
извлечь из которых индивидуальные вещества не
ИК спектр, ν, см-1: 1374 (C-N), 1520 (C=O), 1547
получилось.
[C-N, δ(N-H)], 2880, 2930, 2974, 3054, (CH2), 3210
Таким образом, оптимальным способом полу-
(NH). Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 6.23 с
чения трициклического
1,3,5,7,11,13,15,17-окта-
(4Н, NH), 3.98 т (8Н, СН2-цикл., J 2.1 Гц), 2.58 т
азатрицикло[15.3.1.17,11]докозан-4,14-диона
яв-
(4H, NCH2CH2, J 6.1 Гц), 1.46 м (4H, NCH2CH2).
ляется однореакторная конденсация мочевины
Спектр ЯМР 13C (ДМСО-d6), δС, м. д.: 155.1 (C=O),
с формальдегидом и пропан-1,3-диамином. При
61.3 (NHCH2N), 49.4 (NCH2CH2CH2CH2N), 25.6
конденсации мочевины с формальдегидом и бу-
(NCH2CH2CH2CH2N). Масс-спектр, m/z: 257.1711
тан-1,4-диамином получается не гомологичный
[M + H]+ (вычислено для С10Н21N6O2: 257.1720).
трицикл, а
5,5′-бутан-1,4-диилбис(1,3,5-триази-
ИК спектры зарегистрированы на спектрофо-
нан-2-он). Изученная конденсация может быть
тометре Shimadzu FTIR-8400S в таблетках KBr.
использована при разработке пролекарственных
Спектры ЯМР 1Н и 13С зарегистрированы на спек-
форм лекарственных субстанций с уреидным
трометре Bruker Avance III-400 (400 и 100 МГц
фрагментом.
соответственно), в качестве внутреннего стандар-
1,3,5,7,11,13,15,17-Октаазатрицик-
та использованы сигналы остаточных ДМСО-d6.
ло[15.3.1.17,11]докозан-4,14-дион (3). а. К рас-
Масс-спектры получены в Ресурсном центре
твору 2.96 г (40 ммоль, 3.35 мл) пропан-1,3-диа-
Санкт-Петербургского государственного универ-
мина в 15 мл этилового спирта, охлажденному до
ситета «Методы анализа состава вещества» на хро-
5°С, при интенсивном перемешивании в течение
мато-масс-спектрометре MaXis 62 (Bruker Daltonik
15 мин прибавляли по каплям 9.75 г (120 ммоль)
GmbH), оснащенном источником электроспрей-
37%-ного формалина. При продолжающемся ох-
ионизации и квадруполь-времяпролетным масс-
лаждении и перемешивании к реакционной массе
анализатором (ESI-QTOF). Запись масс-спектра
одномоментно прибавляли 2.40 г (40 ммоль) моче-
вели в режиме детектирования положительных ио-
вины 1, после чего убирали охлаждение и давали
нов, растворитель - метанол, напряжение - 4.5 кВ.
температуре подняться до 10°С. Реакционную мас-
Характеристичные изотопные распределения мо-
су кипятили 2 ч и оставляли на ночь. На следую-
лекулярных ионов совпадали с расчетными значе-
щий день отфильтровали образовавшийся осадок
ниями.
и сушили. Выход 5.18 г (76.3%), т. пл. 203-204°С
(ацетонитрил) (т. пл. 205-207°С [11]).
ИНФОРМАЦИЯ ОБ АВТОРАХ
б. К раствору 1.20 г (20 ммоль) мочевины 1 в
15 мл этилового спирта при интенсивном пе-
0000-0003-0355-2292
ремешивании одномоментно прибавляли 3.92 г
Рамш Станислав Михайлович, ORCID: https://
(10 ммоль) макроцикла 4, затем реакционную
orcid.org/0000-0003-4613-068X
смесь кипятили 2 ч. Выпавший через неделю
ФОНДОВАЯ ПОДДЕРЖКА
осадок отфильтровывали и сушили. Выход 1.44 г
(42.3%), т. пл. 202-204°С (ацетонитрил) (т. пл.
Работа выполнена в рамках государственного
205-207°С [11]).
задания Министерства науки и высшего образова-
5,5ʹ-Бутан-1,4-диилбис(1,3,5-триазинан-
ния РФ в сфере научной деятельности (программа
2-он) (5). К раствору 1.16 г (0.013 моль) бу-
785.00X60.19).
тан-1,4-диамина в 15 мл этанола при переме-
КОНФЛИКТ ИНТЕРЕСОВ
шивании добавляли по каплям раствор 1.56 г
(0.026 моль) мочевины в смеси 4.22 г (0.052 моль)
Авторы заявляют об отсутствии конфликта
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021
1804
ХАМУД и др.
интересов.
7. Dave P.R., Doyle G., Axenrod T., Yazdekhasti H.,
Ammon H.L. // Tetrahedron Lett. 1992. Vol. 33. N 8.
СПИСОК ЛИТЕРАТУРЫ
P. 1021. doi 10.1016/s0040-4039(00)91849-5
1. Ghosh A.K., Brindisi M. // J. Med. Chem. 2020. Vol. 63.
8. Burke W.J. // J. Am. Chem. Soc. 1947. Vol. 69. N 9.
N 6. P. 2751. doi 10.1021/acs.jmedchem.9b01541
P. 2136. doi 10.1021/ja01201a024
2. Dandia A., Arya K., Sati M. // Synth. Commun. 2004.
9. Burke W.J. Pat. 2304624A (1942). USA // C. A. 1943.
Vol. 34. N 6. P. 1141. doi 10.1081/scc-120028646
Vol. 37. N 10. P. 2852.
10. McCormick L.J., McDonnell-Worth C., Platts J.A.,
3. Рамш С.М., Иваненко А.Г., Шпилевый В.А., Медвед-
Alison J. Edwards A.J. Turner D.R. // Chem. Asian J.
ский Н.Л., Кушакова П.М. // ХГС. 2005. № 7. С. 1089;
2013. Vol 8. P. 2642. doi 10.1002/asia.201300530
Ramsh S.M., Ivanenko A.G., Shpilevyi V.A., Medved-
11. Хамуд Ф., Рамш С.М., Певзнер Л.М., Фундамен-
skiy N.L., Kushakova P.M. // Chem. Heterocycl. Compd.
ский В.С., Гуржий В.В., Захаров В.И., Кузнецов В.А.,
2005. Vol. 41. N 7. P. 921. doi 10.1007/s10593-005-
Криворотов Д.В., Храброва Е.С. // ХГС. 2014. № 7.
0249-6
С. 1141; Hamoud F., Ramsh S.M., Pevzner L.M.,
4. Paquin A.M. // Angew. Chem. (A). 1948. Bd 60. N 10.
Fundamensky V.S., Gurzhiy V.V., Zakharov V.I.,
S. 267.
Kuznetsov V.A., Krivorotov D.V., Khrabrova E.S. //
5. Paquin A.M. // J. Org. Chem. 1949. Vol. 14. N 2. P. 189.
Chem. Heterocycl. Compd. 2014. Vol. 50. N 7. P. 1053.
doi 10.1021/jo01154a001
doi 10.1007/s10593-014-1562-8
6. Yawer M.A., Necas M., Sindelar V. // Tetrahedron. 2016.
12. Dale J., Sigvartsen T. // Acta Chem. Scand. 1991. Vol. 45.
Vol. 72. N 22. P. 2943. doi 10.1016/j.tet.2016.04.009
N 10. P. 1064. doi 10.3891/acta.chem.scand.45-1064
Three-Component Condensation of Urea with Formaldehyde
and Propane-1,3-diamine or Butane-1,4-diamine
F. Hamouda, Y. Bedouha, S. M. Ramshb,*, and E. S. Khrabrovab
a Environmental Research Center (CRE), Annaba, 23005 Algeria
b St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*е-mail: sramsh@technolog.edu.ru
Received September 11, 2021; revised October 10, 2021; accepted October 17, 2021
Three-component condensation of urea with formaldehyde and propane-1,3-diamine in a molar ratio of 1:3:1
leads to the tricyclic 1,3,5,7,11,13,15,17-octaazatricyclo[15.3.1.17,11]docosane-4,14-dione. Condensation of urea
with 1,3,7,9,13,15,19,21-octaazapentacyclo[19.3.1.13,7.19,13.115,19]octacosane (2:1) also leads to the formation
of tricyclic product. As a result of the condensation of urea with formaldehyde and butane-1,4-diamine in the
ratio of 2:4:1, 5,5′-butane-1,4-diylbis(1,3,5-triazinan-2-one) was obtained.
Keywords: aminomethylation, urea, diamines, formaldehyde, bis-urea macrocycles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 11 2021