ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 12, с. 1807-1829
К 100-летию со дня рождения М.Г. Воронкова
УДК 547.435.422
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА
М.Г. ВОРОНКОВА В РАЗВИТИЕ ХИМИИ
БИОЛОГИЧЕСКИ АКТИВНЫХ АТРАНОВ
(ПРОТАТРАНОВ И ГИДРОМЕТАЛЛАТРАНОВ) (ОБЗОР)
© 2021 г. Ю. А. Кондратенко*, Т. А. Кочина
Институт химии силикатов имени И. В. Гребенщикова Российской академии наук,
наб. Макарова 2, Санкт-Петербург, 199034 Россия
*e-mail: kondratencko.iulia@yandex.ru
Поступило в Редакцию 22 июня 2021 г.
После доработки 19 июля 2021 г.
Принято к печати 26 июля 2021 г.
Обобщены и представлены основные результаты многолетних исследований научной школы академика
Михаила Григорьевича Воронкова в области двух подгрупп семейства атранов - протатранов и гидро-
металлатранов, а также результаты работ, которые являются продолжением исследований, начатых
академиком М.Г. Воронковым. Многолетние исследования атранов под руководством М.Г. Воронкова
позволили открыть их уникальную биологическую активность, создать ряд оригинальных лекарствен-
ных препаратов, не имеющих аналогов в мировой медицине и средств химизации сельского хозяйства -
биостимуляторов и адаптогенов для сельскохозяйственных растений, животных, полезных насекомых
и микроорганизмов.
Ключевые слова: атраны, протатраны, гидрометаллатраны, триэтаноламин, трекрезан, биологически
активные вещества
DOI: 10.31857/S0044460X21120015
1. Введение
1807
2. М.Г. Воронков - основоположник класса атранов
1808
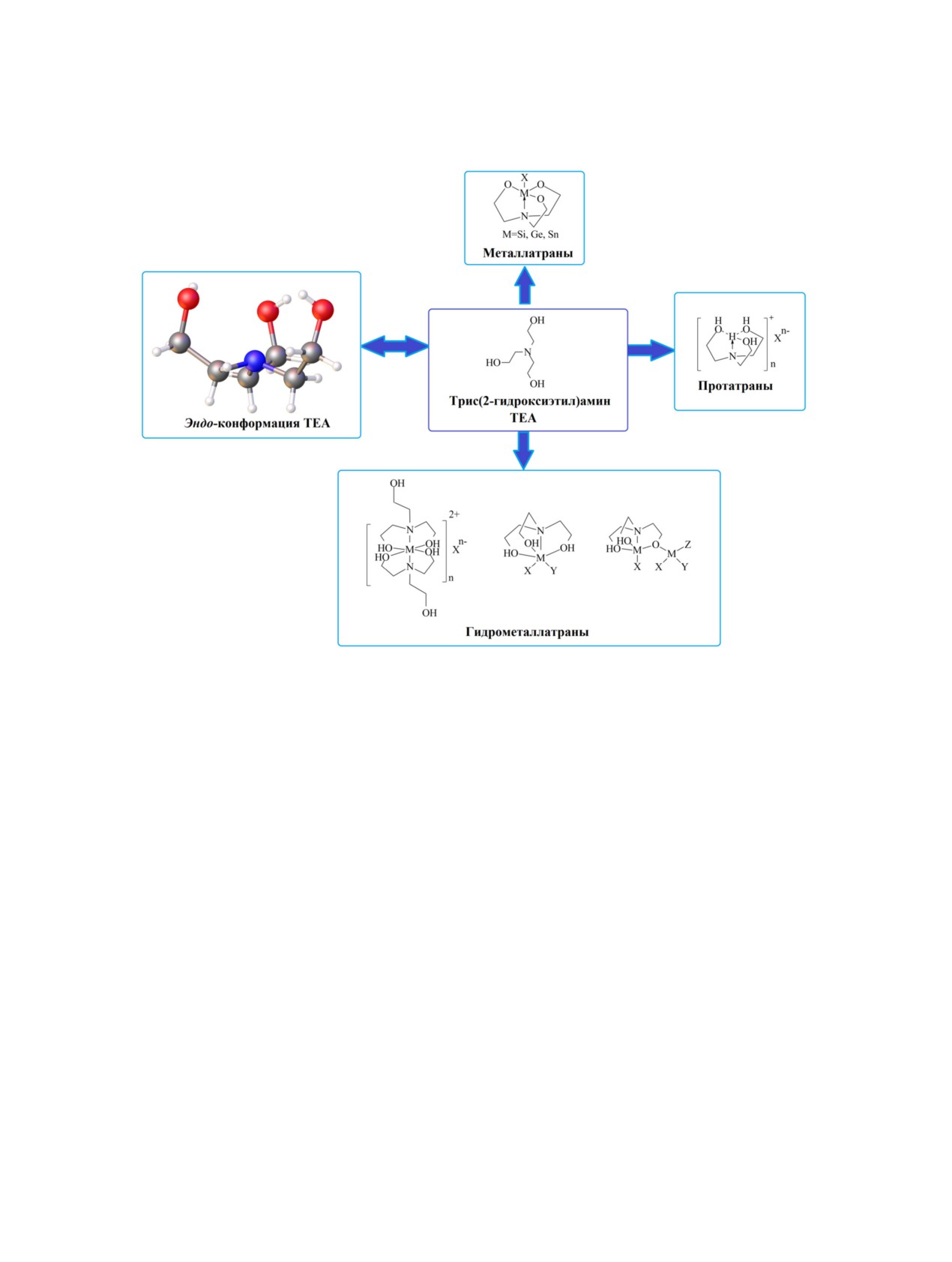
3. Атраны
1810
4. Протатраны
1812
5. Гидрометаллатраны
1820
5. Заключение
1823
1. ВВЕДЕНИЕ
ную связь N→M, обладают высокой специфиче-
ской биологической активностью широкого спек-
На сегодня хорошо известно, что атраны - вну-
тра действия. Однако о биологической активности
трикомплексные соединения гидроксиалкилами-
кремнийорганических соединений практически
нов с кремний-, германий-, олово- и другими ор-
ганическими и координационными соединениями,
ничего не было известно до 1964 г., когда академик
содержащие трансаннулярную донорно-акцептор-
М.Г. Воронков впервые обнаружил чрезвычайно
1807
1808
КОНДРАТЕНКО, КОЧИНА
не будут рассмотрены. Их подробное рассмотре-
ние, включая биологическую активность и аспек-
ты практического применения, представлены в
обзорах [1-4].
2. М.Г. ВОРОНКОВ - ОСНОВОПОЛОЖНИК
КЛАССА АТРАНОВ
Академик Михаил Григорьевич Воронков -
личность космического масштаба и его исследо-
вания, конечно же, не ограничиваются открытием
соединений касса атранов. Выдающийся ученый с
мировым именем, он является основателем одной
из ведущих научных химических школ России,
проводящей фундаментальные исследования в об-
ласти химии органических соединений тетра-, ги-
пер- и гиповалентных кремния, германия и олова,
а также органических соединений серы, фосфора,
фтора и иода. Им так же внесен фундаментальный
высокую токсичность 1-фенилсилатрана, что впо-
вклад в физическую органическую химию, ме-
следствии привело к созданию нового поколения
дицинскую химию, фармакологию и агрохимию.
экологически безопасных зооцидов. Именно это
Его стремление находить практическое примене-
открытие послужило мощным толчком к разви-
ние результатам научных исследований позволило
тию не только кремнийорганической химии, но и
внести существенный вклад в различные области
привело к широкому изучению соединений класса
промышленности и сельского хозяйства.
атранов. Работы М.Г. Воронкова в области атра-
Научная жизнь М.Г. Воронкова началась в
нов, берущие начало еще со второй половины XX
1954 году в Институте химии силикатов им.
века, широко известны мировому научному сооб-
И.В. Гребенщикова Академии наук СССР в лабо-
ществу, и исследования в этом направлении актив-
ратории профессора Б.Н. Долгова - пионера со-
но продолжаются и в настоящее время. Обширные
ветской кремнийорганической химии. Научные
исследования биологической активности атранов
интересы этих выдающихся ученых в то время
привели к созданию широкого ряда лекарствен-
сосредоточились на химии кремнийорганических
ных препаратов - новых классов адаптогенов и
соединений и основные фундаментальные иссле-
иммуномодуляторов. Яркими примерами являют-
дования того периода были направлены на изу-
ся лекарственные препараты трекрезан (крезацин)
чение реакций гетеролитического расщепления
на основе трис(2-гидроксиэтил)аммониевой соли
силоксановой связи Si-O, включающей тетрако-
2-метилфеноксиуксусной кислоты, аналог трекре-
ординированный атом кремния. Эта связь, как из-
зана - хлоркрезацин (2-метил-4-хлорфеноксиаце-
вестно, является наиболее важной связью в химии
тат трис(2-гидроксиэтил)аммония), мивал (хлор-
кремнийорганических соединений. Результаты
метилсилатран), мигуген (этоксисилатран) и др.
исследований силоксановой связи легли в основу
В настоящем обзоре более подробно рассмо-
докторской диссертации М.Г. Воронкова и обоб-
трены основные результаты многолетних иссле-
щены в монографии «Силоксановая связь» [5]. В
дований научной школы М.Г. Воронкова в области
1961 году появилось первое сообщение о синтезе
двух групп представителей семейства атранов -
пентакоординированных трициклических силок-
протатранов и гидрометаллатранов, а также ре-
сазолидинов [6]. Вслед за этим открытием к изу-
зультаты работ, которые являются продолжением
чению пентакоординированных соединений крем-
исследований, начатых академиком М.Г. Воронко-
ния приступил М.Г. Воронков [7, 8] в Институте
вым. Металлатраны, в частности силатраны, как
органического синтеза Академии наук Латвийской
наиболее изученные представители атранов, здесь
ССР, куда он был приглашен возглавить лаборато-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1809
рию элементоорганических соединений. Именно
отправным пунктом создания новой области нау-
М.Г. Воронков ввел термин «силатраны» для обо-
ки на стыке химии, биологии и биохимии - био-
значения пентакоординированных кремнийорга-
кремнийорганической химии [17]. В 1977 году на
нических эфиров гидроксиалкиламинов.
Нобелевском симпозиуме в Стокгольме после до-
В Институте органического синтеза Академии
кладов ведущих ученых мира по проблеме «Крем-
наук Латвийской ССР М.Г. Воронков развил три
ний и жизнь» кремний был официально признан
новых научных направления: химию силатранов
элементом жизни [18]. Открытие специфической
[9, 10], химию герматранов [11] и новые реакции
биологической активности 1-арилсилатранов и их
элементной серы с органическими соединениями
аналогов послужило мощным толчком к синтезу и
[12-14]. Одной из них - реакции серы с арилга-
широким исследованиям биологической активно-
логеналканами- присвоено его имя (реакция Во-
сти соединений этого класса во всем мире. Однако
ронкова). Эта реакция основана на взаимодей-
впервые эти исследования начались в 70-х годах
ствии элементной серы с арилгалогеналканами:
прошлого столетия под руководством выдающе-
ArCnH2n-m-1Xm (X = Cl, Br, n ≥ 1, m ≥ 1) при 180-
гося российского ученого М.Г. Воронкова. Им же
300°С и приводит к разнообразным серосодержа-
заложены фундаментальные основы химии сила-
щим гетероциклическим системам ароматического
транов, герматранов и других соединений гипер-
ряда, включающим циклы тиофена, тиенотиофе-
валентных кремния, германия и олова.
нов, 1,4-дитиадиена и 1,2-дитиолен-3-тиона, а так-
В 1970 году М.Г. Воронков был приглашен в
же к производным стильбена [15].
Иркутский институт органической химии (в насто-
Широкое распространение кремния в нежи-
ящее время Иркутский институт химии СО РАН)
вой природе, с одной стороны, и низкое, почти
СО АН СССР, который он возглавлял в течение
на уровне случайных включений в большинстве
25 лет. Именно в Иркутске были продолжены ис-
живых организмов с другой стороны, долгое вре-
следования новых биологически активных вну-
мя являлось причиной скептического отношения
трикомплексных соединений класса атранов.
большинства ученых к самой мысли об участии
В начале 70-х годов М.Г. Воронков впервые об-
этого элемента в биологических процессах. В 60-е
ратил внимание на то, что перевод биологически
годы прошедшего столетия, началось стремитель-
активных органических кислот в их триэтанолам-
ное внедрение кремнийорганических полимеров
мониевые соли не только повышает растворимость
(силиконов) в медицину и косметологию, в частно-
этих кислот в воде и понижает их кислотность,
сти, в имплантационную хирургию, что также го-
но и существенно повышает производимый ими
ворило об инертности соединений кремния. В это
фармакологический эффект и расширяет спектр
же время под руководством М.Г. Воронкова, были
их физиологического действия [19]. Это откры-
начаты работы по исследованию биологической
тие послужило отправной точкой для широкого
активности соединений кремния. Среди нового
изучения данных солей, впоследствии названных
класса органических соединений пентакоордини-
М.Г. Воронковым протатранами.
рованного кремния, названного М.Г. Воронковым,
В начале 2000-х годов М.Г. Воронков с коллега-
как уже отмечалось, силатранами, были обнару-
ми из Иркутского института химии СО РАН при-
жены вещества, обладающие необычно высокой
ступили к изучению биологической активности
специфической токсичностью для теплокровных
гидрометаллатранов - координационных соеди-
животных. Данные об этих исследованиях были
нений гидроксиалкиламинов. Несмотря на то, что
им доложены на 1 Международном симпозиуме
о взаимодействии гидроксиалкиламинов с солями
по кремнийорганической химии в Праге в 1965
металлов сообщалось еще в 70-х годах прошлого
году и признаны сенсационными [16]. Это откры-
столетия [20-22], об их биологической активности
тие нанесло сокрушительный удар по доминиро-
до этого момента практически ничего не было из-
вавшим в науке представлениям о биологической
вестно.
инертности соединений кремния по отношению к
живым организмам, привело к переосмыслению
В 2003 году Михаил Григорьевич вернулся в
роли этого элемента в живой природе и явилось
Институт химии силикатов РАН, где возглавил
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1810
КОНДРАТЕНКО, КОЧИНА
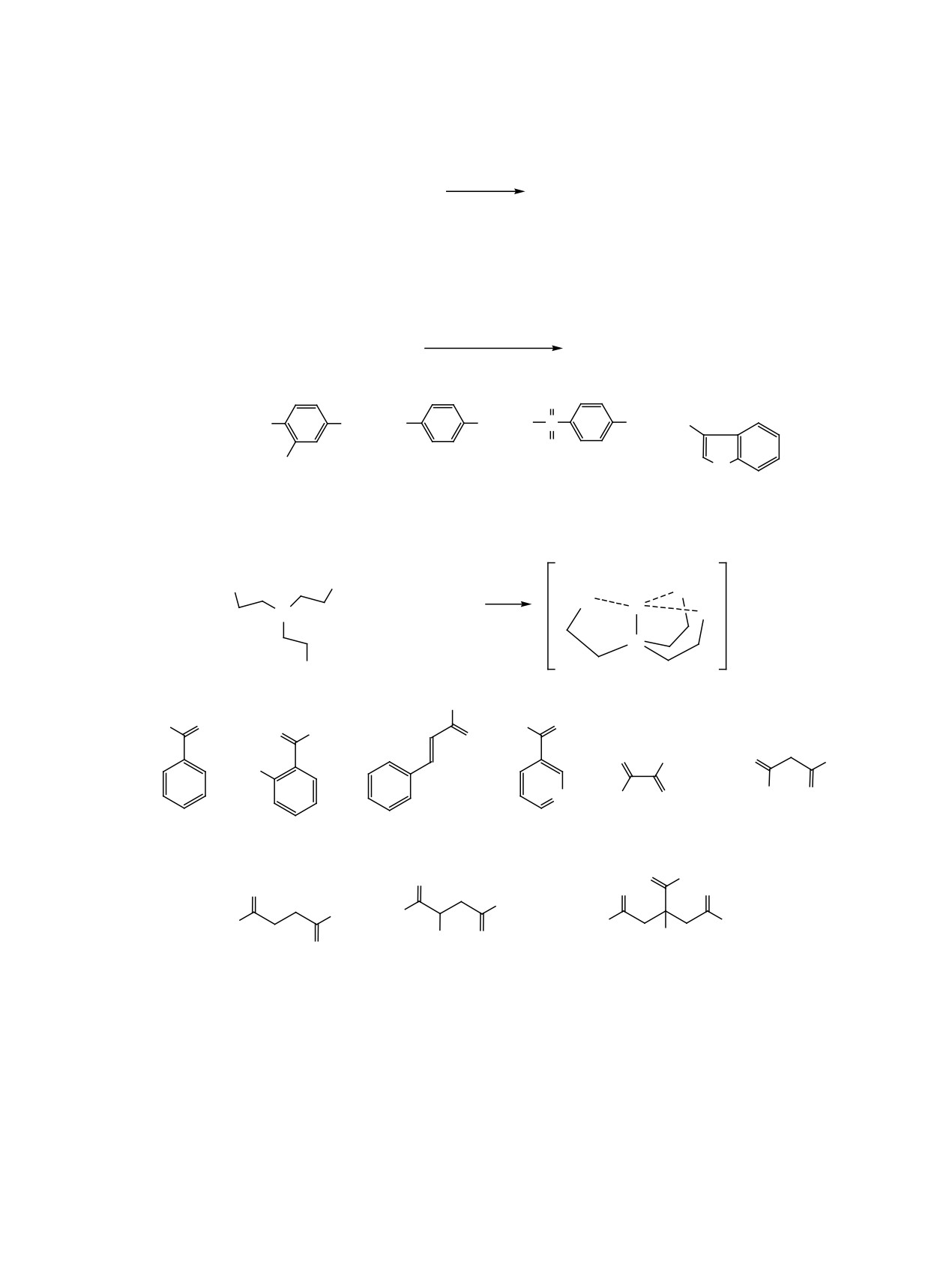
Схема 1.
лабораторию кремнийорганических соединений
3. АТРАНЫ
и материалов. Здесь были продолжены исследова-
К классу атранов общепринято относить ме-
ния соединений класса атранов, которые ведутся и
таллатраны (силатраны, герматраны, станнатраны
по сей день.
и др.), протатраны - гидроксиалкиламмониевые
Многолетние исследования под руководством
соли и гидрометаллатраны - координационные со-
М.Г. Воронкова позволили открыть уникальную
единения гидроксиалкиламинов (схема 1).
биологическую активность силатранов и других
Молекула металлатрана представляет собой
представителей атранов (протатраны, металла-
каркасную конструкцию из трех ветвей, концы ко-
траны, гидрометаллатраны), создать ряд ориги-
торых сходятся в двух трехлучевых узлах с обра-
нальных лекарственных препаратов, не имеющих
зованием трех пятичленных циклов, что несколько
аналогов в мировой медицине (трекрезан, мивал,
напоминает трехлепестковый бутон. Наиболее ин-
силакаст, феракрил, аргакрил, циакрил, ацизол,
тересная деталь такой конструкции — смещение
цитримин, хлоркрезацин и др.) и средств хими-
узлового атома азота из плоскости окружающих
зации сельского хозяйства - биостимуляторов и
его трех атомов углерода по направлению к эле-
адаптогенов для сельскохозяйственных растений,
менту (Si, Ge, Sn), который находится в другом
животных, полезных насекомых и микроорганиз-
узле. Это результат трансаннулярной связи [23, 24].
мов. Более подробно результаты этих многолетних
исследований в области протатранов и гидроме-
Высокую и специфическую биологическую
таллатранов будут рассмотрены далее.
активность силатранов можно объяснить их не-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1811
обычной тригонально-пирамидальной структу-
рой, содержащей трансаннулярную донорно-ак-
цепторную связь N→Si, приводящей, наряду с
индуктивным взаимодействием между атомами
азота и кислорода через систему σ-связей и через
пространство внутри гетероциклического скелета,
к высокому дипольному моменту молекулы (7-
10 Д) и повышенной электроотрицательности эн-
доциклических атомов кислорода, т. е. их нуклео-
фильности [2, 4].
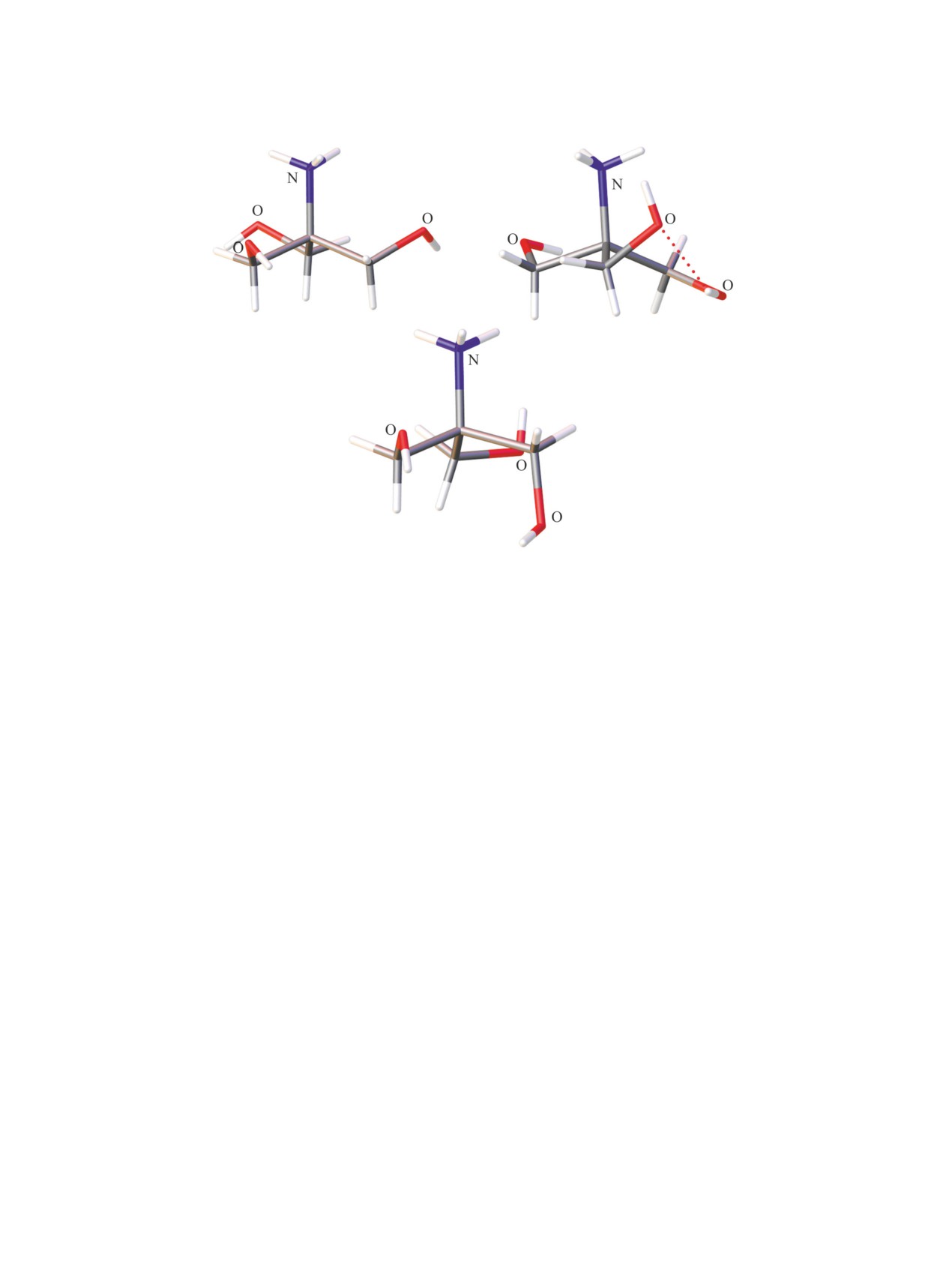
Следует отметить, что молекула исходного
трис(2-гидроксиэтил)амина (ТЕА) характеризует-
ся эндо-конформацией (неподеленная пара элек-
тронов азота направлена внутрь абажура из трех
гидроксиэтильных групп, схема 1) и в кристал-
лической фазе ТЕА существует только в форме
димеров [25]. Как и следовало ожидать, в катио-
нах трис(2-гидроксиэтил)аммония сохраняется
эндо-конформация ТЕА - три гидроксиэтильные
ветви окружают аммонийный атом водорода с об-
разованием трех внутримолекулярных водород-
ных связей. Именно благодаря уникальному стро-
ению катиона трис(2-гидроксиэтил)аммониевые
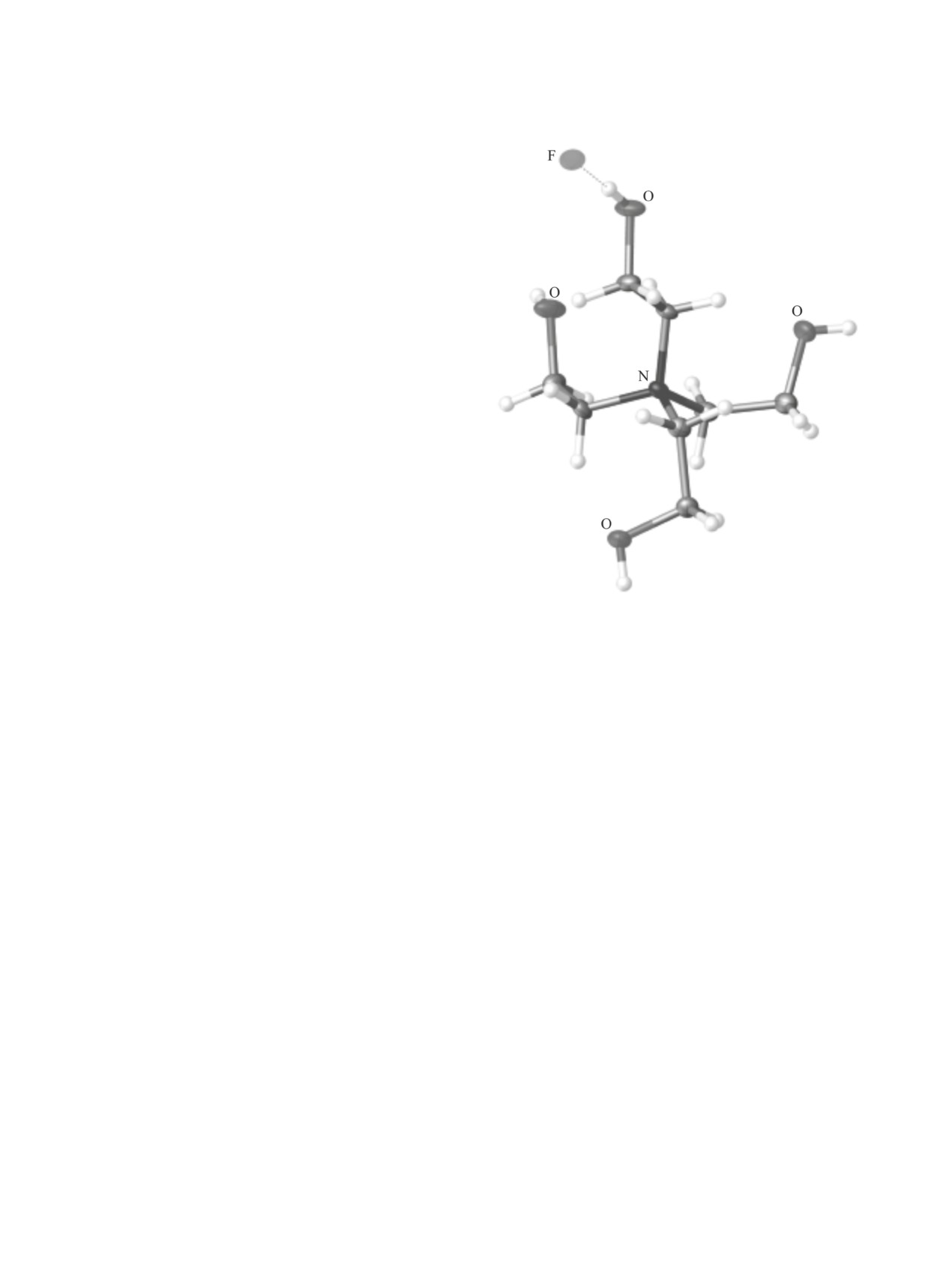
Рис. 1. Конформация катиона во фториде тетра-
кис(2-гидроксиэтил)аммония.
соли и их ближайшие структурные аналоги стали
широко известны как протатраны. Следует также
отметить, что при замене аммонийного атома во-
дорода на четвертую гидроксиэтильную ветвь, т. е.
при переходе к тетракис(2-гидроксиэтил)аммони-
комплексах ТЕА способен выступать мостиковым
евым солям [N(C2H4OH)4]nX, происходит разупо-
лигандом, связывая атомы металлов между собой
рядочивание эндо-конформации (рис. 1) [26].
(схема 1).
Гидрометаллатраны представляют собой про-
N-Оксид триэтаноламина, отвечающей форму-
дукты взаимодействия гидроксиалкиламинов с со-
ле -ON+(CH2CH2OH)3, является производным ТЕА
лями металлов. Среди них, наиболее распростра-
и легко образуется при его окислении пероксидом
нены комплексы с солями переходных металлов. В
водорода. М.Г. Воронков рассматривал N-оксид
зависимости от ряда факторов их строение может
ТЕА как родоначальника нового семейства атра-
существенно варьироваться - от моноядерных ка-
нов, поэтому для его обозначения был введен тер-
тионных до полиядерных смешанно-лигандных
мин «оксатран» [27]. Предполагалось, что, как и
комплексов (схема 1). Как правило, в таких ком-
ТЕА, оксатран будет характеризоваться эндо-кон-
плексах ТЕА действует как три- (N,O,O′) или тетра-
формацией. Однако изучение его молекулярной
дентатный (N,O,O′,O′′) лиганд. Ввиду сохранения
и кристаллической структуры показали, что три
гидроксильных атомов водорода и трициклическо-
атома кислорода гидроксильных групп практиче-
му строению комплексов ТЕА М.Г. Воронков ввел
ски находятся в одной плоскости с атомами угле-
термин «гидрометаллатраны» для их обозначения.
рода, торсионные углы NCCO составляют -166°
Однако при образовании полиядерных гидроме-
(рис. 2а). В работе [28] изучена структура ком-
таллатранов часто происходит диссоциация ТЕА
плекса ТЕА с оксатраном (рис. 2б). В данном ком-
с потерей одного или нескольких гидроксильных
плексе ТЕА, образуя три водородные связи с ато-
атомов водорода. Благодаря этому в полиядерных
мом кислорода (O-H···ON) оксатрана, сохраняет
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1812
КОНДРАТЕНКО, КОЧИНА
(а)
(б)
Рис. 2. Молекулярная структура оксатрана (а) [27] и его комплекса с ТЕА (б) [28].
свою трициклическую эндо-конформацию. При
аммониевой соли 2-метилфеноксиуксусной кис-
этом конформация N-оксида ТЕА в комплексе су-
лоты [29], которая впоследствии станет широко
щественно изменяется по сравнению с исходным
известным лекарственным препаратом трекрезан
оксатраном. Атомы кислорода гидроксиэтильных
(в сельском хозяйстве - крезацин). Катион трекре-
групп выходят из плоскости атомов углерода, зна-
зана в кристалле обладает эндо-конформацией, в
чения торсионных углов NCCO составляют -83°
которой атом водорода в группировке N-H объ-
(рис. 2).
единен трифуркационной водородной связью с
тремя атомами кислорода трех групп СН2СН2ОН
4. ПРОТАТРАНЫ
(рис. 3а) [4].
Исследования протатранов были начаты
Трис(2-гидроксиэтил)аммониевые соли легко
М.Г. Воронковым с сотрудниками в начале 70-х
образуются взаимодействием эквимолярных коли-
годов прошлого века в Иркутском институте орга-
честв ТЕА с протонными кислотами, как правило,
нической химии Сибирского отделения АН СССР
в спиртовой или водной среде. Взаимодействие
с целью усилить биологическую активность син-
ТЕА с протонными кислотами сопровождается
тетических фитогормонов, таких как арилгете-
диссоциацией кислоты и переносом протона к
роуксусные кислоты. Протатраны являются ком-
атому азота ТЕА с образованием трис(2-гидрокси-
бинацией гидроксиалкиламмониевого катиона и
этил)аммониевых катионов [NH(CH2CH2OH)3]+ и
аниона X-. Классическими и наиболее изученны-
анионов протонных кислот Xn-. М.Г. Воронков с
ми протатранами являются трис(2-гидроксиэтил)-
соавторами [30] разработали оригинальный метод
аммониевые соли протонных кислот. В 1981 году
синтеза трис(2-гидроксиэтил)аммониевых солей
методом рентгеноструктурного анализа была уста-
неорганических кислот [NH(CH2CH2OH)3]X (X =
новлена кристаллическая структура первого пред-
F, Cl, Br, I, NO3, ClO4 и др.), основанный на вза-
ставителя протатранов - трис(2-гидроксиэтил)-
имодействии ТЕА с соответствующими солями
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1813
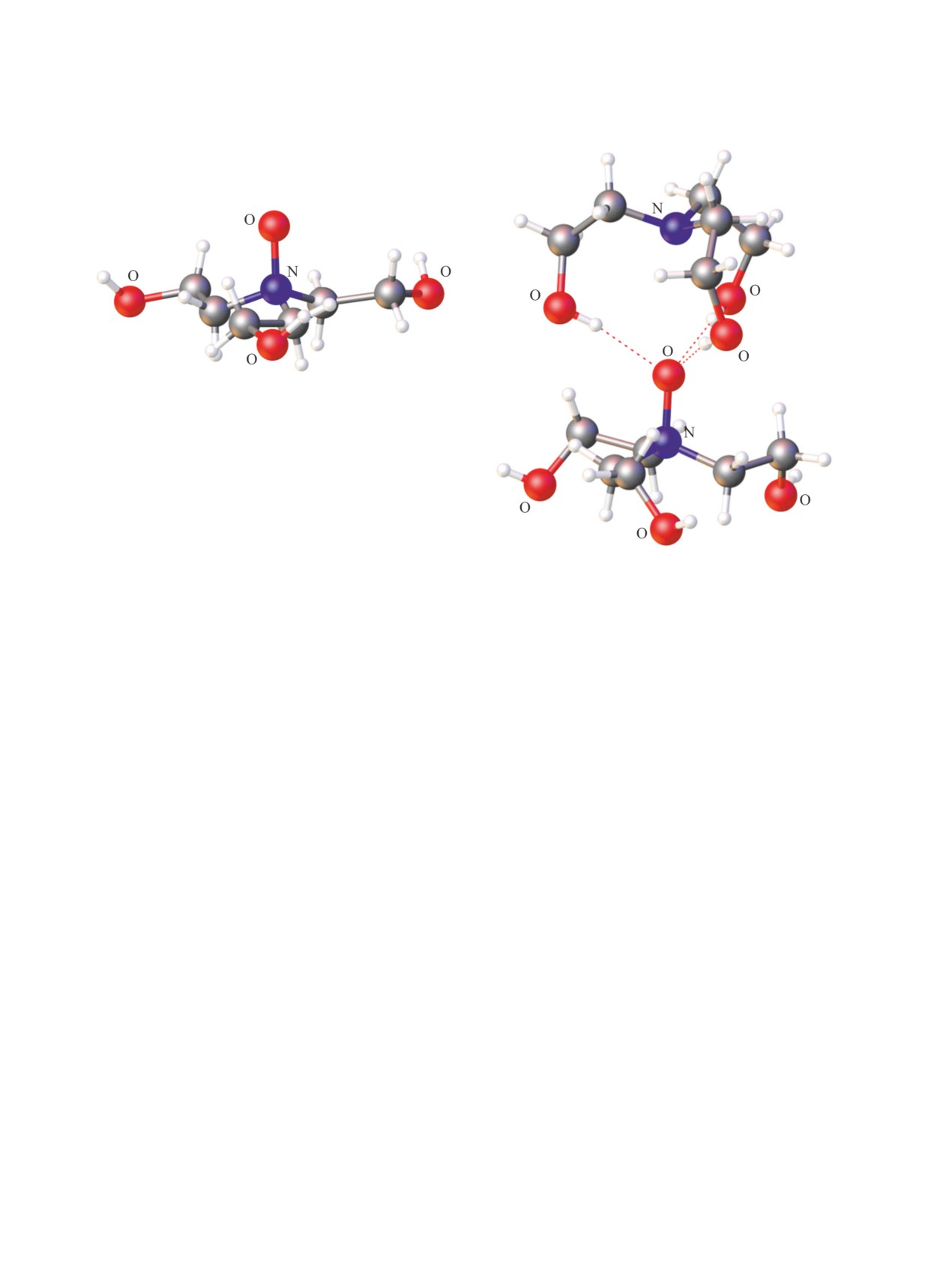
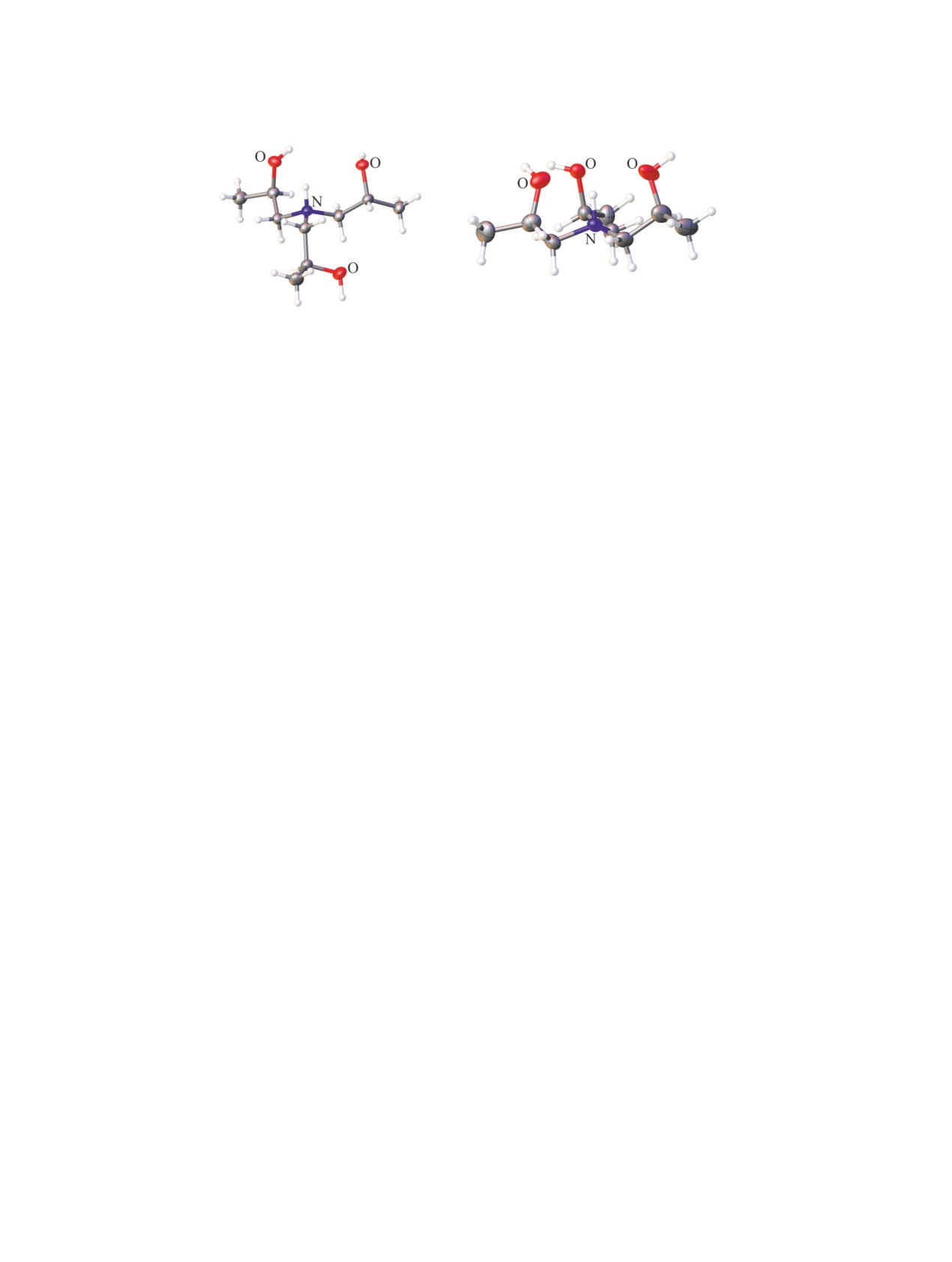
(а)
(б)
Рис. 3. Молекулярная структура 2-метилфеноксиацетата (а) [29] и фторида трис(2-гидроксиэтил)аммония (б) [32].
аммония NH4X как в водной или безводной среде,
Исследования строения протатранов сопро-
так и в отсутствие растворителя.
вождались широким изучением их биологиче-
ской активности. В ряду протатранов наиболее
Квантово-химические расчеты свидетель-
изученной является трис(2-гидроксиэтил)аммо-
ствуют
[31], что при взаимодействии ТЕА с
ниевая соль
2-метилфеноксиуксусной кислоты
кислотами НХ образуется два типа комплексов
(трекрезан, крезацин). Высокая биологическая
[(HOCH2CH2)3NН]+·-X: водородосвязанные, в ко-
активность трекрезана обусловлена сочетанием в
торых межатомное расстояние N···H составляет
его молекуле фрагментов аниона ароксиуксусной
около 1.5 Å и комплексы с переносом протона,
кислоты и катиона трис(2-гидроксиэтил)аммония.
в которых длина ковалентной связи N+-H равна
Министерство здравоохранения РФ разрешило к
~1.0 Å.
применению трекрезан как новый иммуномодуля-
Трициклическая эндо-конформация катиона ха-
тор и адаптоген [33].
рактерна для большинства трис(2-гидроксиэтил)
Многолетние всесторонние исследования тре-
аммониевых солей. Однако фторид трис(2-гидрок-
крезана в Иркутском институте химии СО РАН
сиэтил)аммония [32] характеризуется необычной
совместно с рядом НИИ биологического и меди-
конформацией, которая существенно отличается
цинского профиля позволили установить, что по
от традиционной трициклической. Две гидрокси-
спектру физиологического действия трекрезан по-
этильные ветви, как и в случае оксатрана, нахо-
добен природным адаптогенам (женьшень, элеуте-
дятся в плоскости атомов углерода, а третья ветвь
рококк, золотой корень и др.), однако его эффектив-
выходит из плоскости и направлена к аммоний-
ность значительно выше [34]. Трекрезан относится
ному атому водорода (эндо-ветвь) (рис. 3б). Вну-
к малотоксичным соединениям (LD50 для крыс >
тримолекулярные расстояния между атомом азота
3700 мг/кг при внутрибрюшинном и > 6300 мг/кг
и тремя атомами кислорода сильно различаются.
при пероральном введении препарата, для мышей
Это указывает на асимметрию протатранового
> 2000 мг/кг при внутрибрюшинном и > 3200 мг/кг
скелета, и как следствие, индуктивное взаимодей-
при пероральном введении препарата) [35]. Он
ствие атома азота лишь с одним атомом кислорода
обладает повышающим цитокинную активность
гидроксиэтильной группы.
суммарной триптофанил-мРНК синтетазы через
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1814
КОНДРАТЕНКО, КОЧИНА
стимуляцию синтеза специфической матричной
вотных, птиц и полезных насекомых [41, 43, 44].
РНК-синтетазы действием. Это является ключе-
Крезацин оказывает многофункциональное дей-
вым звеном в сложном механизме действия препа-
ствие на растения - ускоряет прорастание семян,
рата [36, 37]. Трекрезан оказывает стресс-протек-
увеличивает высоту растений, массу надземной
торное действие на моделях иммобилизационного
части и корней, продуктивную кустистость, озер-
и болевого гиподинамического стресса, обладает
ненность колосьев, способствует формированию
способностью ускорять репарацию поврежденных
более крупных зерновок, повышает устойчивость
растений к неблагоприятным факторам среды и
тканей (печень, миокард, мышцы), защищает вну-
заболеваниям [45]. Низкие повреждающие тем-
тренние органы от повреждающего действия ток-
пературы стимулируют разрушение ингибиторов
синов, СВЧ-облучения, инфекционного фактора.
перекисного окисления липидов, в результате раз-
Он обладает достаточно уникальной комбинацией
рушается фосфолипидная основа мембран, пода-
антиоксидантных, антигипоксантных, репарант-
вляется их функциональная активность, которая
ных, антитоксических, адаптогенных, иммуно-
ведет к гибели клеток [46]. Механизм действия
стимулирующих, гемостимулирующих, противо-
крезацина заключается в его мембраностабилизи-
воспалительных, желчегонных, гонадотропных
рующем эффекте и увеличении содержания в мем-
и антибластомных свойств [35, 38]. Трекрезан
бранах витаминов A и E, которые тормозят пере-
стимулирует выработку α- и γ-интерферонов, спо-
кисное окисление липидов [47, 48].
собствует повышению и коррекции иммунного
Трис(2-гидроксиэтил)аммониевая соль
2-ме-
статуса организма за счет активации клеточного
тил-4-хлорфеноксиуксусной кислоты является
и гуморального звеньев иммунитета, его следует
ближайшем аналогом трекрезана и широко из-
рассматривать как высокоэффективный иммуно-
вестна как хлоркрезацин. Как и трекрезан, хлор-
модулятор. Повышение иммуномодулирующей
крезацин обладает адаптогенными, гемопоэз- и
активности трекрезана при комбинировании его
иммуномодулирующими свойствами [41, 49, 50].
с другими иммуномодуляторами позволяет до-
Хлоркрезацин наиболее эффективно усиливает
стичь более высоких терапевтических результатов
устойчивость организма при цитотоксической
при первичных и вторичных иммунодефицитах
гипоксии, гипер- и гипотермии, воздействии ток-
[39, 40]. Трекрезан также эффективен в экстре-
сических веществ [51] и электромагнитного излу-
мальных климатогеографических условиях, при
чения [52], будучи при этом безвредным. Хлоркре-
перегрузках в физическом и умственном труде,
зацин предупреждает нарушения высшей нервной
спорте, вирусных простудных заболеваниях, тя-
деятельности, возникающие под влиянием элек-
желой инфекционной патологии, при всех заболе-
тромагнитного излучения СВЧ-диапазона. Как
ваниях, связанных с понижением иммунитета. Он
один из возможных механизмов защитного дей-
необходим для профилактики онкологических бо-
ствия хлоркрезацина следует рассматривать его
лезней, а также коррекции психоэмоционального
антиоксидантную активность [53].
статуса у наркологических больных [34]. Трекре-
Хлоркрезацин тормозит рост аденокарциномы
зан эффективен также при комплексном лечении
755 (93-97%) и карциномы толстой кишки (33%) и
больных туберкулезом. Комплексная терапия с
достоверно подавляет пролиферацию опухолевых
использованием трекрезана может применяться к
клеток мастоцитомы Р815, меланомы В16, лимфо-
больным с тяжелой соматической патологией [41].
мы L1210 и гепатомы Г27, тормозит процесс ме-
Трекрезан может найти применение как эффектив-
тастазирования клеток гепатомы Г27 в легкие и
ное средство в системе комплексных методов для
меланомы В16. По защитной активности и эффек-
профилактики, лечения и возникновений ослож-
тивности он превышает известный противоопухо-
нений при коронавирусной инфекции, в том числе,
левый препарат 5-фторурацил [54]. Хлоркрезацин
связанных с бронхолегочной патологией [42].
способен повышать устойчивость сосудистой си-
В сельском хозяйстве трекрезан (крезацин)
стемы к холестерину при развитии атеросклероти-
применяется как регулятор продуктивности и
ческого процесса [55].
адаптивных свойств растений, а также для повы-
При введении хлоркрезацина значительно уве-
шения репродуктивности и продуктивности жи-
личивается экспрессия матричной РНК трипто-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1815
фанил-тРНК-синтетазы (в дозе 15 мг/кг на 60%).
4-Хлорфенилсульфонилацетат трис(2-гидрок-
Следует отметить, что трекрезан повышает актив-
сиэтил)аммония (сульфацетамин) при низкой ток-
ность ТРСазы лишь на 20% по сравнению с кон-
сичности (LD50 6000 мг/кг) в микроконцентрациях
тролем, в дозе, почти вдвое большей (25 мг/кг),
(10-5-10-8 моль/л) проявляет высокую физиологи-
чем хлоркрезацин [56]. Хлоркрезацин более эф-
ческую, а именно ростостимулирующую актив-
фективно по сравнению с трекрезаном ингибиру-
ность при культивировании полезных бактерий,
ет агрегацию тромбоцитов, усиливает антитром-
хлебопекарных дрожжей, пищевой лимонной кис-
богенные свойства сосудистой стенки, тормозит
лоты, грибов, а также в технологии проращивания
перекисное окисление липидов и повышает толе-
ячменя для получения пивоваренного солода [58].
рантность клеточных элементов крови к действию
В работе [72] получены жидкие водораствори-
дезинтегрирующих агентов [57].
мые производные аспирина на основе 2-гидрок-
Гидроксиалкиламмониевые соли серосодер-
сиэтиламмониевых солей О-ацетилсалициловой
жащих кислот при низкой токсичности (LD50
кислоты, пригодные для внутривенного введения
1300-6000 мг/кг) также обладают высокой и раз-
и проявляющие противовосполительную актив-
нообразной биологической активностью: гемо- и
ность. Противовоспалительная активность О-аце-
иммунотропной, кардиотропной, противовоспали-
тилсалицилата трис(2-гидроксиэтил)аммония ока-
тельной, антитромботической, антиоксидантной,
залась наиболее высокой.
адаптогенной, гипохолестеринемической и т. д. и
В одной из своих последних работ
[73]
являются высокоэффективными ростостимули-
М.Г. Воронков с соавторами сообщил о синтезе
рующими препаратами для биотехнологических
потенциально биологически активных ароксипро-
процессов [58, 59]. Биологическая активность ал-
татранов, полученных при взаимодействии ТЕА и
каноламмониевых солей серосодержащих кислот
не только не уступает, но зачастую превосходит
других гидроксиалкиламинов с фенолом, 2-, 2,4-
активность родственных им алканоламмониевых
ди-, 2,4,6-тринитрофенолами. Нитрофенолы, как
солей ароксиуксусных кислот. Причем активность
сильные кислоты, образуют с ТЕА комплексы с
усиливается при увеличении степени окисления
переносом протона и содержат ониевый атом азо-
атома серы и зависит от строения гидроксиалки-
та (N+-Н).
ламмониевого фрагмента [60, 61]. В их ряду осо-
В настоящее время исследования протатранов
бенно следует выделить две соли - индол-3-ил- и
активно продолжаются как в Иркутском институ-
1-бензилиндол-3-илсульфанилацетаты трис(2-ги-
те химии СО РАН, так и в Институте химии си-
дроксиэтил)аммония (индацетамин и вилим со-
ликатов им. И.В. Гребенщикова РАН. В Иркутском
ответственно). Индацетамин обладает широким
институте химии СО РАН ведутся исследования
спектром биологической активности, является эф-
как в области синтеза новых представителей про-
фективным антиагрегантом, стабилизатором кле-
татранов, так и в области изучения их биологиче-
точных мембран эритроцитов и тромбоцитов, ан-
ской активности. В частности, в последних рабо-
тиоксидантом и протектором при ультразвуковом
тах С.Н. Адамовича с соавторами было показано,
и γ-облучении [62-67].
что протатраны являются:
Отличительная особенность индацетамина
- потенциальными биостимуляторами роста
[68, 69] и вилима [70, 71] заключается в наличии
листерий и стафилококков (L. monocytogenes, S.
выраженной антипролиферативной активности в
aureus); использование протатранов позволяет
культуре in vitro и иммунодепрессивных свойств
ускорить выращивание золотистого стафилококка
in vivo при относительной малотоксичности. Ви-
для диагностики инфекций, сокращая время выра-
лим является иммунодепрессантом с противоо-
щивания с 48 до 6-9 ч по сравнению с контролем
пухолевым эффектом. Следует также отметить,
на стандартной питательной среде [74-76];
что индацетамин и вилим способны избирательно
влиять на соотношение функции Т- или В-систе-
- потенциальными биостимуляторами роста
мы иммунитета, вызывая девиацию иммунного
дрожжей Saccharomyces cerevisiae (концентра-
ответа в определенном - Th1 или Th2 - нужном
ция 10-4-10-8 мас%) и Candida ethanolica (10-6-
направлении [62].
10-8 мас%); использование исследованных био-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1816
КОНДРАТЕНКО, КОЧИНА
Схема 2.
O
NH2
OH
NH
2
HN
, Br2
S
, KBr
S
HBr
H2N
SH
ClCH2CO2H, NaOH
N
-H2NC(SH)NH HBr, KBr
N
N
R
R
R
Схема 3.
H2O, Na2CO3
4-ClC6H4SO2Na + ClCH2COOCH3
4-ClC6H4SO2CH2COOCH3
4-ClC6H4SO2CH2COOH
стимуляторов в производстве спирта и биотопли-
индол-3-илсульфанил(сульфонил)уксусных кис-
ва позволит повысить эффективность процессов и
лот (схема 2) для дальнейшего получения их био-
выходы целевых продуктов на единицу массы за-
логически активных гидроксиалкиламмониевых
траченного сахара [77-79];
солей. Предложенный авторами подход способ-
ствовал повышению выхода и чистоты продуктов
- потенциальными биостимуляторами роста
за счет исключения образования побочных про-
углеводородокисляющих бактерий Rhodococcus
дуктов окисления (дисульфиды индола и др.), как
erythropolis в микроконцентрации 10-4-10-8 мас%;
это происходило в случае применения сильного
данный эффект может быть использован при раз-
окислителя — паров I2 и KI. Протатраны 1-R-ин-
работке экологически безопасных и экономиче-
дол-3-илсульфанил(сульфонил)уксусных кислот
ски выгодных способов восстановления объектов
показали дозозависимую антипролиферативную
окружающей среды после их загрязнения нефтью
активность и ингибировали спонтанную и мито-
[80];
гениндуцированную (конканавалин, Con A, Sigma)
- синтетическими биостимуляторами солодо-
пролиферацию клеток селезенки эксперименталь-
ращения; применение сульфацетамина в микроко-
ных мышей.
личестве 6×10-6 г на 1 кг ячменя является наибо-
Экологичным и технологичным методом синте-
лее оптимальным вариантом: сокращается время
за 4-хлорфенилсульфонилуксусной кислоты (пре-
приготовления, повышается урожайность и каче-
курсор сульфацетамина) является взаимодействие
ство солода [81];
4-хлорфенилсульфината натрия с метиловым эфи-
- биостимуляторами роста и развития гибридов
ром монохлоруксусной кислоты с последующим
сиговых рыб, а также адаптогенами для них; об-
гидролизом образующегося эфира (схема 3). Суль-
наружено положительное влияние протатранов на
фацетамин в опытах in vitro и in vivo проявляет ан-
увеличение роста и веса рыб, а также на снижение
титромботическую, мембранстабилизирующую,
смертности среди них [82];
антиоксидантную активность, снижает уровень
- 2-метилфеноксиацетат N-метилбис(2-гидрок-
холестерина в крови. При применении в низких
сиэтил)аммония (бикрезан) в системах in vitro и
дозах сульфацетамин проявляет выраженную им-
эксперименте на животных обладает выраженной
мунностимулирующую и протекто-адаптацион-
противоопухолевой и антиметастатической актив-
ную активность [86].
ностью в сочетании с отсутствием токсических
С.Н. Адамович с соавторами [87] разработали
свойств [83].
эффективный способ получения крезацина и его
В работах [84, 85] разработан новый эффек-
аналогов фармакопейной чистоты (схема 4). Авто-
тивный метод синтеза труднодоступных
1-R-
ры обратили внимание на то, что при взаимодей-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1817
Схема 4.
-
+
Ar-X-CH2COONa(K) + HCl N(CH2CH2OH)3
Ar-X-CH2COO HN(CH2CH2OH)3
-NaCl (KCl)
Ar = Ph, 2-ClC6H4, 4-ClC6H4, 2-HOC6H4, 2-NO2C6H4, 2-MeC6H4, индол-3-ил, 1-бензилиндол-3-ил; X = O, S, SO2, Se.
Схема 5.
H2O, MeOH, 20-45°C
+
1-3 ч
+
(HOCH2CH2)3NOH- + RCO2H
(HOCH2CH2)3N-OH RCO−
O
Cl
Cl ;H
S
Cl;CH2S
R = CF3;CH2O
;CH2S
2C
O
Me
N
H
Схема 6.
OH
HO
OH
HO H
n
N
+
HnX
OH
X
N
n
OH
OH
HO
O
HO
O
O OH
O
O
OH
O
OH
HO
;
;
;
;
;
;
N
HO O
OH O
n = 1
n = 1
n = 1
n = 1
n = 1, 2
n = 1, 2
HnX =
O
O OH
O
O
O
OH
HO
HO
OH ;
;
HO
OH
OH
O
OH
O
n = 1, 2
n = 1, 2
n = 1-3
ствии ТЕА с соответствующими арилокси- или
очищаемого от примесей ТЕА используется твер-
арилсульфанилуксусными кислотами образуются
дый, химически устойчивый, легко очищаемый
протатраны с высокими выходами (75-90%), но
перекристаллизацией гидрохлорид ТЕА, а вместо
их чистота является недостаточной для примене-
свободных кислот - их Na(K)-соли.
ния в медицине. Новизна способа заключается в
В работе [88] реакцией оксатрана с биологиче-
том, что вместо вязкого, гигроскопичного, трудно
ски активными производными уксусной кислоты
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1818
КОНДРАТЕНКО, КОЧИНА
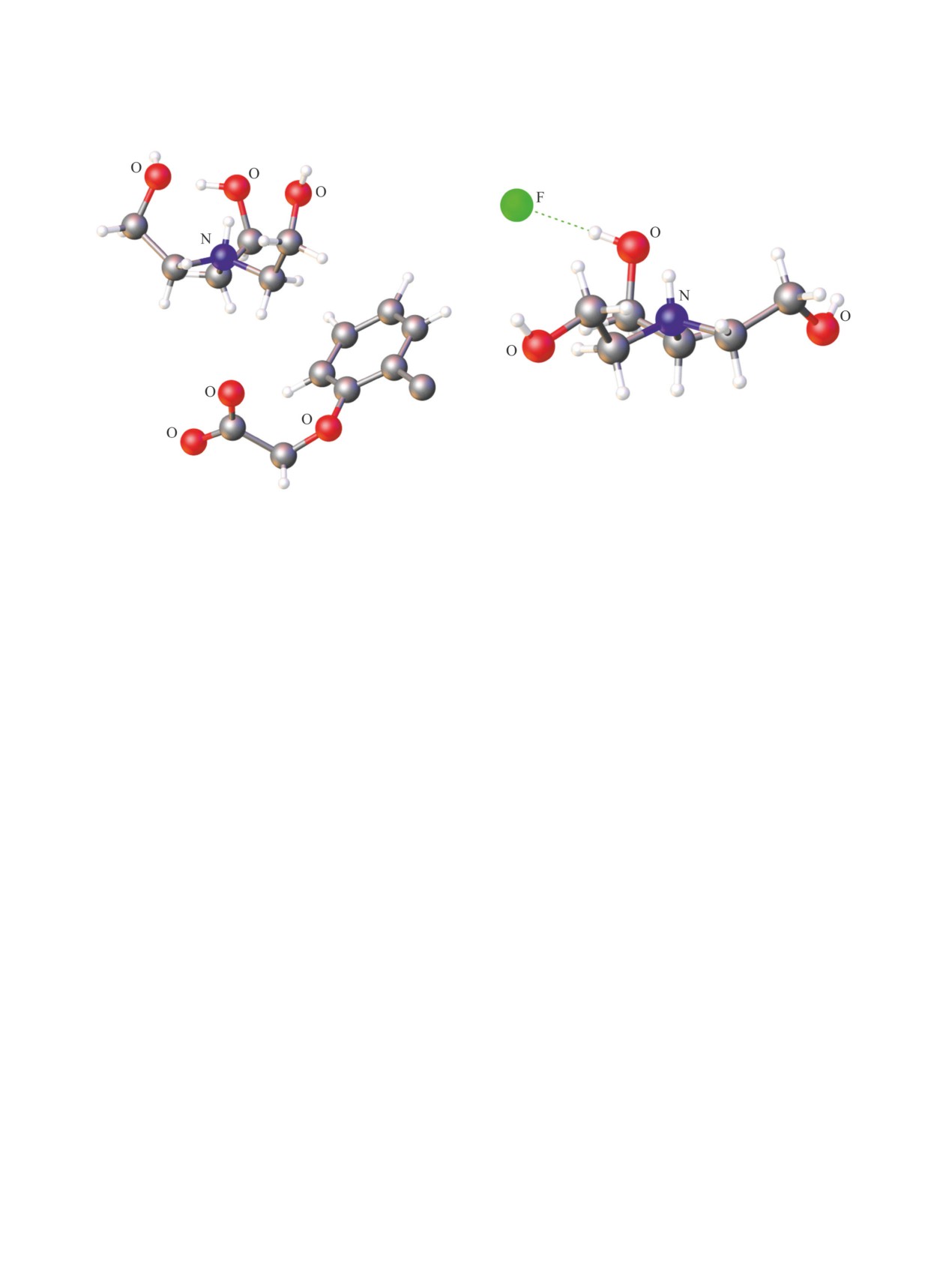
(а)
(б)
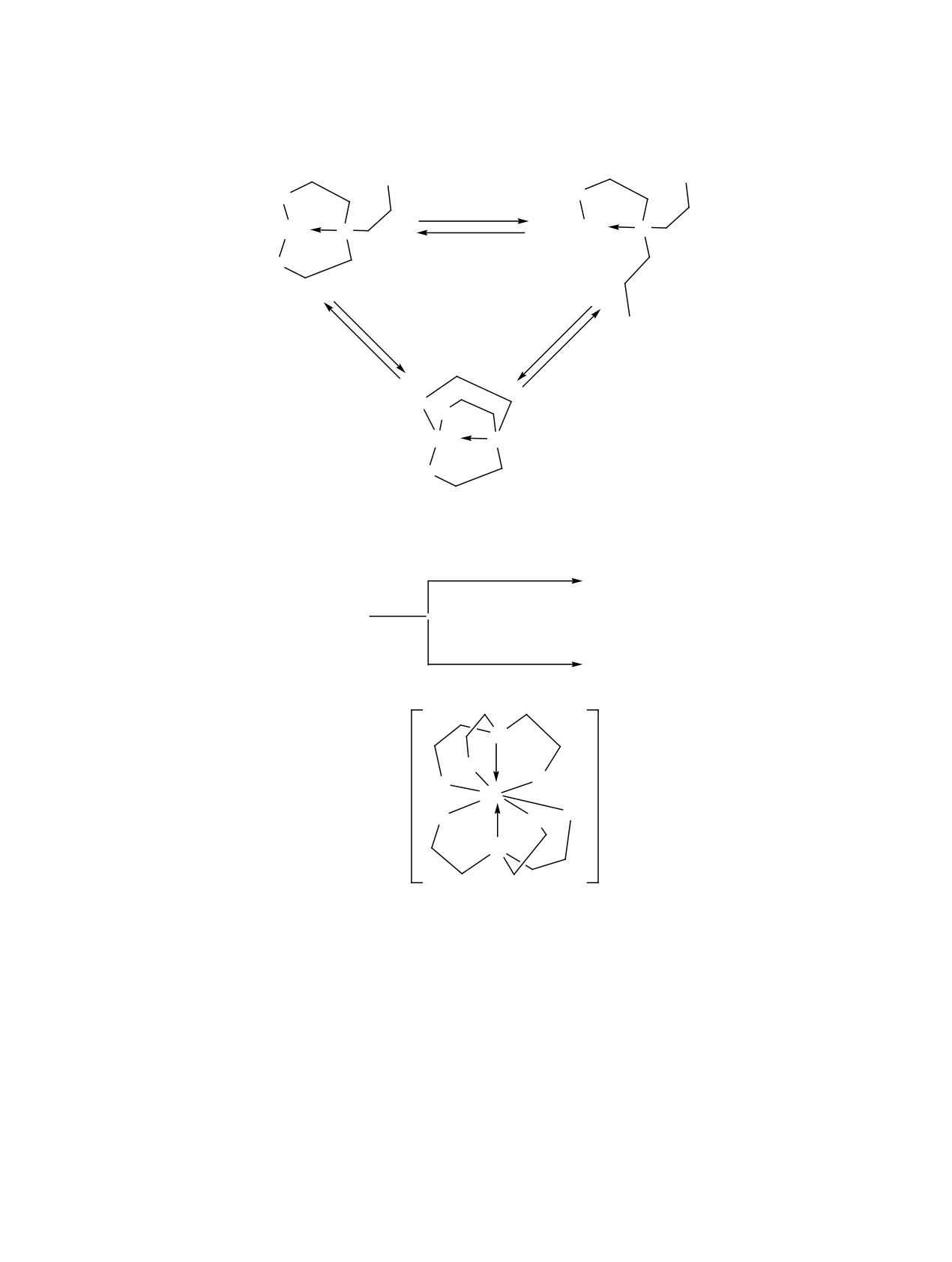
Рис. 4. Конформация трис(2-гидроксиэтил)аммониевого катиона: (а) классическая трициклическая эндо-конформация;
(б) бициклическая эндо/экзо-конформация [в сукцинате трис(2-гидроксиэтил)аммония] [90].
получены новые аналоги протатранов - трис(2-ги-
aureus. Трис(2-гидроксиэтил)аммониевые соли ко-
дроксиэтил)гидроксиламмониевые соли (схема 5).
ричной, бензойной и малоновой кислот оказывают
С 2014 г. в Институте химии силикатов РАН
положительное влияние на прорастание семян и
исследования в основном сосредоточены на син-
ростовые характеристики проростков кресс-сала-
та (Lepidium sativum L.). Их применение в качестве
тезе и изучении кристаллической структуры но-
вых протатранов и их аналогов. В частности,
стимулятора роста гриба Rhizopus oryzae - пер-
в работе [89] сообщалось о получении трис(2-
спективного продуцента биополимера хитозана -
позволяет значительно увеличить количество по-
гидроксиэтил)аммониевых солей бензойной, ко-
ричной, салициловой, никотиновой, янтарной, ма-
лучаемого биосорбента (до 24%).
лоновой, щавелевой, яблочной и лимонных кислот
Дальнейшие исследования в Институте химии
(схема 6). Структурные исследования этих солей
силикатов РАН были сосредоточены на получении
показали, что конформация трис(2-гидроксиэтил)-
новых гидроксиалкиламмониевых солей. В част-
аммониевого катиона может отличаться от при-
ности, впервые синтезированы трис(гидроксиме-
вычной трициклической эндо-конформации [90].
тил)метиламмониевые (TRIS) и трис(2-гидрок-
Сукцинат трис(2-гидроксиэтил)аммония
- это
сипропил)аммониевые (TPA) соли аналогичных
первая трис(2-гидроксиэтил)аммониевая соль с
карбоновых кислот (коричная, бензойная и др.)
бициклической эндо/экзо-конформацией катионов
[93, 94] с целью изучения конформации гидрок-
(рис. 4б), которые формируют бесконечные ка-
сиалкиламмониевого катиона и катион-анион-
тионные цепи за счет водородных связей меж-
ных взаимодействий. Для трис(гидроксиметил)
ду N+H-группой одного катиона и OH-группой
метиламмониевого катиона были обнаружены
экзо-ветви соседнего катиона. Удивительно, что в
три конформации катиона (рис. 5): (a) плоскост-
случае ближайших структурных аналогов - гидро-
ная, в которой все три гидроксиметильные груп-
сукцината и малата трис(2-гидроксиэтил)аммония -
пы находятся в плоскости четвертичного атома
конформация ТЕА катионов соответствует трици-
углерода (рис. 5а); (б) редкая эндо/экзо-конформа-
клической эндо-конформации (рис. 4а) [90, 91].
ция, в которой одна ветвь смещена к N+H3-группе
В работах [91, 92] было показано, что трис(2-
(эндо-ветвь), вторая ветвь - плоскостная, а третья
гидроксиэтил)аммониевые соли карбоновых кис-
немного выходит из плоскости атома углерода в
лот являются протонными ионными жидкостями
противоположную сторону (экзо-ветвь) (рис. 5б);
(т. пл. < 100°C), обладающими ростостимулирую-
(в) экзо-конформация, в которой две ветви находят-
щим и противомикробным действием. Все иссле-
ся в плоскости, а третья ветвь значительно откло-
дуемые протонные ионные жидкости проявили се-
нена в противоположную сторону от N+H3-группы
лективную активность к бактерии Staphylococcus
(рис. 5в). Как показывает анализ кристаллографи-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1819
(а)
(б)
(в)
Рис. 5. Три возможных конформации трис(гидроксиметил)метиламмониевого катиона: (a) плоскостная конформация;
(б) эндо/экзо-конформация; (в) экзо-конформация [93].
ческой базы данных, плоскостная конформация
и пептидами. Комплексы 68Ga с рядом клинически
наиболее характерна для TRIS-солей.
значимых пептидов являются радиофармпрепара-
Для TPA-солей вероятность образования би-
тами, которые широко востребованы в ядерной ме-
дицине для диагностики различных новообразова-
циклической эндо/экзо-конформации значительно
возрастает по сравнению с TEA-солями, что веро-
ний. Гидроксиалкиламмониевые буферы на основе
ятно, связано с присутствием трех дополнитель-
ТЕА бензоата и 2-метилфеноксиацетата оказались
ных метильных групп в TPA-катионах. Однако
наиболее эффективными в реакциях 68Ga-радио-
образование трициклической эндо-конформации
мечения пептидов в низкотемпературных услови-
TPA-катионов также возможно (рис. 6). Удиви-
ях (37°С). Их эффективность значительно превос-
тельно, что для салицилата трис(2-гидроксипро-
ходит эффективность коммерчески доступного и
пил)аммония были обнаружены две полиморфные
широко используемого буфера HEPES.
модификации, которые характеризовались разны-
Другим абсолютно новым направлением яв-
ми конформациями ТРА-катионов - трицикличе-
ляется использование биологически активных
ской и бициклической [94].
протатранов в качестве экологически безопасных
Совместные исследования с Российским на-
биоцидов в составах защитных покрытий. В рабо-
учным центром радиологии и хирургических
те [97] изучена биостойкость органосиликатных
технологий им. академика А.М. Гранова [95, 96]
покрытий, в состав которых введен протатран са-
показали, что синтезированные гидроксиалки-
лициловой кислоты в качестве мягкого биоцида
ламмониевые соли карбоновых кислот являются
в количестве 1 и 3 мас%. Высокую биостойкость
перспективными буферными агентами для полу-
показали органосиликатные покрытия на основе
чения комплексов изотопа галлий-68 с хелаторами
полидиметилфенилсилоксана, причем как с био-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1820
КОНДРАТЕНКО, КОЧИНА
(а)
(б)
Рис. 6. Конформация ТРА-катиона: (а) бициклическая эндо/экзо-конформация, (б) трициклическая эндо-конформация [94].
цидной добавкой, так и без нее. Однако покрытие
работанные антидоты представляют собой ком-
с биоцидной добавкой (3 мас%) показало наиболее
плексы ТЕА с цинковыми солями неорганических
высокую биостойкость.
и органических кислот (2,8,9-тригидроцинкатран)
[104, 105]. В ряду комплексных соединений ТЕА с
5. ГИДРОМЕТАЛЛАТРАНЫ
солями биомикроэлементов (Mg, Ca, Zn, Mn, Cu,
Fe, Co, Ni, Cd, Rh) в тестах in vitro и in vivo выявле-
Исследования гидрометаллатранов научной
ны малотоксичные высокоэффективные вещества
группой М.Г. Воронкова начались значительно
(LD50 675-4000 мг/кг), обладающие иммуноак-
позднее по сравнению с исследованиями прота-
тивными свойствами, причем как с иммуности-
транов. О получении новых представителей ги-
мулирующими, так и с иммунодепрессивными
дрометаллатранов сообщалось только в начале
свойствами [106, 107]. В зависимости от концен-
2000-х годов. В частности, М.Г. Воронковым с
трации и природы металла Zn(II)-, Cu(II)-, Mn(II)-,
соавторами [98, 99] получен ряд биологически ак-
Ni(II)-содержащие комплексы ТЕА могут стиму-
тивных комплексов ТЕА с солями ароксиуксусных
лировать или подавлять ростовую активность кле-
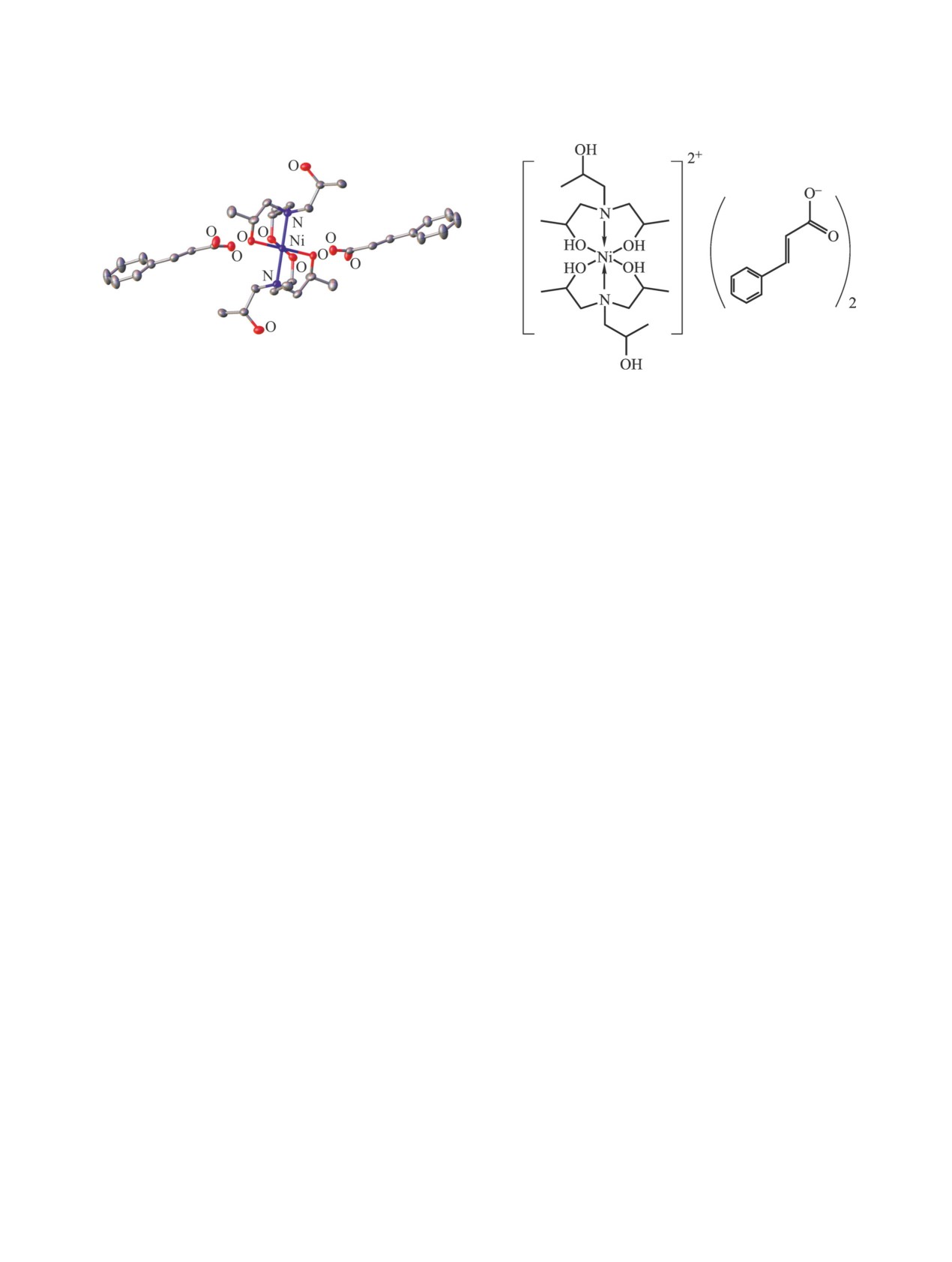
кислот. Кристаллическая структура одного из них,
ток суспензионной культуры сахарного тростника
[Ni(TEA)2][4-ClPhSCH2CO–]2, была установлена
(Saccharum officinarum, сорт POJ2878) [18].
методом рентгеноструктурного анализа [100]. Ав-
Среди гидрометаллатранов особо следует вы-
торы работ [100-103] отнесли синтезированные
делить комплекс ТЕА с 2-метилфеноксиацетатом
комплексы, состоящие из гидрометаллатрановых
цинка, известный также как цинкатран или цитри-
катионов и анионов протонных кислот, к классу
мин. Широкие исследования его биологической
металлированных алканоламмониевых ионных
активности позволили открыть:
жидкостей.
- эффективность цинкатрана при лечении и
Исследования гидрометаллатранов методом
профилактики атеросклероза, которая существен-
спектроскопии ЯМР [101-103] позволили уста-
но превосходит эффективность трекрезана (требу-
новить, что в биомиметических условиях (вода,
емая доза в 5 раз ниже дозы трекрезана) [109];
25°C) комплексы существуют в виде моно-, би- и
- свойства цинкатрана ингибировать синтез
трициклических структур, которые находятся в
кислой холестеролэстеразы тромбоцитов и моно-
равновесии. Сдвиг равновесия зависит от природы
нуклеаров [110, 111];
металла (схема 7) и отражается на изменении всех
параметров в спектрах ЯМР.
- способность цинкатрана к ингибированию
кислой фосфолипазы Al и угнетению общей ак-
Исследования биологической активности ги-
тивности основной (щелочной) фосфолипазы A2
дрометаллатранов, впервые инициированные
мононуклеаров [114, 115]
М.Г. Воронковым, привели к открытию новых
антидотов смертельных и тяжелых отравлений
- цинкатран стимулирует экспрессию матрич-
этиловым спиртом и монооксидом углерода. Раз-
ной РНК триптофанил-тРНК-синтетазы, обладаю-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1821
Схема 7.
HO
HO
HO
HO
M2+
N
M2+
N
HO
M = Cd, Mg
M = Zn
OH
M = Fe, Rh
HO
HO
M2+
N
HO
Схема 8.
PhC CH
PhCH CHSiR3
R3Si H
PhCH CH2
PhCH2CH2SiR3
R = OMe, OEt, Et.
3+
N
OH
OH
OH
3Cl-
Rh
OH
HO
OH
N
щей ярко выраженным антиангиогенным и антиа-
активатора PGC-1α, использование которого при-
терогенным действием [112-116];
водит к увеличению содержания митохондрий в
- эффективность цинкатрана при лечении тер-
мышечной ткани, росту работоспособности попе-
мических ожоговых ран кожи особенно в сочета-
речно-полосатой мускулатуры [119].
нии с фототерапией [117];
Адамович с соавторами [120] впервые проде-
- применение цинкатрана в качестве биологи-
монстрировали способность гидрометаллатранов
чески активной добавки для повышения статиче-
формулы [Rh(TEA)n]Cl3 (n = 1, 2) катализировать
ской и динамической работоспособности [118];
региоселективное гидросилилирование фенилаце-
- стимуляция цинкатарном экспрессии гена ко-
тилена и стирола (схема 8).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1822
КОНДРАТЕНКО, КОЧИНА
Схема 9.
HO
HO
HO
N
O
+ MX2
HO
N
O
MX
2
HO
HO
n
n
Схема 10.
2+
OHHO
OH
N
Co
N
2NO3
HO
OHHO
+
2+
OHHO
OH
O
2-
O
N
Co
N
O
HO
OHHO
O
MeOH
O
O
N
OH
O
O
HO
N
Co
O
OH
O Co
N
OH
O
O
HO
HO
N
O
O
В работе [121] впервые сообщалось о полу-
и др., n = 1, 2, M =Cu(II), Co(II), Zn(II), Ni(II) и др.].
чении новых производных гидрометаллатранов
За последние 5 лет был синтезирован широкий ряд
[(HOCH2CH2)3NO]·MX2 на основе комплексов ок-
новых гидрометаллатранов и их ближайших ана-
сатрана с солями переходных металлов (схема 9).
логов с ТЕА-, TRIS-, DEA- и ТРА-лигандами.
В Институте химии силикатов РАН исследо-
Широкие структурные исследования гидроме-
вания больше направлены на получение и иссле-
таллатранов показали, что на их строение оказыва-
дование строения гидрометаллатранов на основе
ет существенное влияние природа металла и рас-
комплексов гидроксиалкиламинов с карбоксила-
творителя, наличие дополнительных лигандов и их
тами эссенциальных биометаллов M(RCO2)n [R =
дентатность. В частности, в работах [122-124] были
C6H5, 2-OHC6H4, C6H5CHCH, CH2CH2CO2 и др.,
получены моноядерные катионные комплексы, со-
M = Cu(II), Co(II), Zn(II), Ni(II) и др., n = 1, 2) или
стоящие из [M(TEA)2]2+ [M = Cu(II), Co(II)] катио-
их неорганическими солями MXn (X = Cl, NO3, SO4
нов и анионов неорганических (NO–) или карбоно-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1823
Рис. 7. Молекулярная структура комплекса [Ni(TPA)2](C9H7O2)2 [128].
вых кислот ([O2C(CH2)2CO2]2-, C6H5CHCHCO–),
проявил высокую активность к микромицетам
моноядерный смешанно-лигандный комплекс
(Aspergillus niger, Cladosporium cladosporioides и
[Zn(TEA)(H2O)2]SO4·H2O, биядерные смешанно-
Penicillium brevicompactum) - основным деструк-
лигандные комплексы - [Zn2(TEAH2)(C6H5CO2)3],
торам материалов и может быть рекомендован в
[Cu2(TEAH2)2(2-OHC6H4CO2)2]H2O,
качестве перспективной экологически безопасной
[Cu2(TEAH2)2(C6H5CHCHCO2)2]H2O,
биоцидной добавки в составы защитных материа-
[Co2(TEA)2(NO3)2(C4H4O4)] и [Co2(TEA)2Cl2]Cl2..
лов и покрытий.
В работе [122] впервые предложен оригиналь-
Впервые использование гидрометаллатранов в
ный подход к синтезу гидрометаллатранов, осно-
качестве экологически безопасных биоцидов в со-
ванный на взаимодействии двух катионных ком-
ставах защитных противообрастающих покрытий
плексов ТЕА. С использованием данного подхода
было продемонстрировано в работе [128]. Среди
удалось получить биядерный смешанно-лиганд-
исследуемых лакокрасочных покрытий состав, со-
ный комплекс Co(II) (cхема 10).
держащий смесь протатрана салициловой кислоты
Впервые синтезированы триметилгидрометал-
и гидрометаллатрана [Zn2(TEAH2)(C6H5CO2)3] в
латраны
- комплексы трис(2-гидроксипропил)-
качестве биоцидной добавки, наиболее перспекти-
амина (ТРА) с Ni(II)-, Zn(II)-, Cu(II)-, Co(II)-солями
вен для дальнейшей разработки противообрастаю-
биоактивных карбоновых кислот. Методом моно-
щих покрытий.
кристальной рентгеновской дифракции было по-
6. ЗАКЛЮЧЕНИЕ
казано, что строение комплекса ТРА с циннаматом
никеля(II) соответствует структуре катионного мо-
Таким образом, исследования атранов, иници-
ноядерного комплекса, состоящего из циннамат-а-
ированные М.Г. Воронковым во второй половине
нионов и [Ni(TPA)2]2+ катионов c тридентатной
прошлого столетия, крайне актуальны и на сегод-
координацией ТРА, как и в случае моноядерных
няшний день. Академик Михаил Григорьевич Во-
катионных комплексов ТЕА (рис. 7) [125].
ронков развил уникальное междисциплинарное
В работе [126] впервые получены комплексы
направление современной науки, результаты кото-
L-валинатов меди(II), цинка(II), никеля(II) и ко-
рого широко используются в медицине, фармацев-
бальта(II) с TEA, DEA и TRIS, образование ко-
тике, сельском хозяйстве, микробиологии и других
торых было подтверждено комплексом методов.
областях. Разработка лекарственного препарата
Комплекс валината кобальта с TRIS проявил наи-
трекрезан привела к открытию новых биологи-
более широкую активность к микроорганизмам S.
чески активных протатранов - потенциальных
aureus, A. niger и M. tuberculosis.
лекарственных препаратов. В последнее время
В работе [127] показано, что катионный ком-
протатраны стали выделять как представителей
плекс циннамата Co(II) с ТЕА ([Co(TEA)2](C9H7O2)2]
протонных ионных жидкостей, представляющих
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1824
КОНДРАТЕНКО, КОЧИНА
особый интерес для науки и техники. Последние
СПИСОК ЛИТЕРАТУРЫ
исследования протатранов позволили открыть со-
1.
Puri J.K., Singh R., Chahal V.K. // Chem. Soc. Rev.
вершенно новые аспекты их применения - в каче-
2011. Vol. 40. P. 1791. doi 10.1039/B925899J
стве буферных агентов в реакциях радиомечения
2.
2. Воронков М. Г., Беляева В.В., Абзаева К.А. // ХГС.
биомолекул, а также в качестве биоцидов нового
2011. № 11. С. 1606; Voronkov M.G., Belyaeva V.V.,
поколения в составах защитных композиционных
Abzaeva K.A. // Chem. Heterocycl. Compd. 2012.
материалов.
Vol. 47. P. 1330. doi 10.1007/s10593-012-0918-1
3.
Воронков М.Г., Барышок В.П. // Хим.-фарм. ж.
С каждым годом активно растет количество ра-
2004. Т. 38. № 1. С. 5; Voronkov M.G., Baryshok V.P. //
бот, посвященных синтезу гидрометаллатранов с
Pharm. Chem. J. 2004. Vol. 38. N 1. P. 3. doi 10.1023/B:
различными гидроксиалкиламинами. Исследова-
PHAC.0000027635.41154.0d
ния их биологической активности, впервые ини-
4.
Воронков М.Г., Барышок В.П. // Вест. РАН. 2010.
циированные М.Г. Воронковым, уникальны и не
Т. 80. №11. С. 985; Voronkov M.G., Baryshok V.P. //
имеют аналогов за рубежом. В настоящее время
Her. Russ. Acad. Sci. 2010. Vol. 80. N 6. P. 514. doi
активно развиваются исследования в области ме-
10.1134/S1019331610060079
таллоорганических каркасных структур - коорди-
5.
Воронков М.Г., Милешкевич В.П., Южелевский Ю.А.
национных полимеров, состоящих из ионов или
Силоксановая связь. Новосибирск: Наука, 1976. 413
малых кластеров металлов, связанных с органиче-
с.
скими лигандами, с образованием одно-, двух- или
6.
Frye C.L., Vogel G.E., Hall J.A. // J. Am. Chem. Soc.
1961. Vol. 83. N 4. P. 996. doi 10.1021/ja01465a058
трехмерных структур. Комплексы гидроксиалки-
7.
Воронков М.Г., Зелчан Г.И. В кн.: Гетероциклы в
ламинов с карбоксилатами металлов полимерной
органическом синтезе. Киев, 1964. С. 118.
структуры относятся к металлоорганическим кар-
8.
Балткайс Я.Я., Воронков М.Г., Зелчан Г.И. // Изв. АН
касам. Благодаря пористой структуре таких карка-
Латв. ССР. Сер. хим. 1964. № 2. С. 102.
сов области их применения весьма разнообразны:
9.
Voronkov M.G. // Pure Appl. Chem. 1966. Vol. 13. P. 35.
от адсорбции газов и катализа до адресной достав-
doi 10.1351/pac196613010035
ки лекарственных средств и биосенсорики. Все
10.
Воронков М.Г., Дьяков В.М. Силатраны. Новоси-
это указывает на актуальность и огромную прак-
бирск: Наука, 1978. 208 с.
тическую значимость исследований в области со-
11.
Воронков М.Г. // Вестн. АН СССР. 1968. № 10. С. 48.
единений класса атранов, в развитие которых внес
12.
Воронков М.Г. // Изв. Латв. ССР. Сер. хим. 1965.
№ 2. С. 33.
неоценимый вклад выдающийся ученый - акаде-
13.
Воронков М.Г., Удре В.Э. // ХГС. 1965. № 5. С. 683;
мик РАН Михаил Григорьевич Воронков.
Voronkov M.G., Udre V.E. // Chem. Heterocycl. Compd.
1965. Vol. 1. N 5. P. 458. doi 10.1007/BF00469918
ИНФОРМАЦИЯ ОБ АВТОРАХ
14.
Воронков М.Г. Реакции серы с органическими соеди-
Кондратенко Юлия Андреевна, ORCID: https://
нениями. Новосибирск: Наука, 1979. 368 с.
orcid.org/0000-0001-5032-8977
15.
Страдынь Я.П. // ХГС. 1981. № 10. С. 1412;
Stradyn’ Y.P. // Chem. Heterocycl. Compd. 1979.
Кочина Татьяна Александровна, ORCID: https://
Vol. 15. P. 1262. doi 10.1007/BF00471449
orcid.org/ 0000-0002-7056-9310
16.
Voronkov M.G. // Special Lectures Presented at the
International Symposium on Organosilicon Chemistry,
ФОНДОВАЯ ПОДДЕРЖКА
Prague, 1966. P. 35.
Работа выполнена в рамках государственного
17.
Воронков М.Г., Зелчан Г.И., Лукевиц Э.Я. Кремний и
задания Института химии силикатов РАН при под-
жизнь. Рига: Зинатне, 1971. 327 с.
18.
Voronkov M.G. In: Biochemistry of silicon and related
держке Министерства образования и науки России
problems. New York: Plenum Press, 1978. P. 395.
(тема № AAAA-A19-119022290090-1).
19.
Платонова Р.Н., Воронков М.Г., Ольховенко В.Л.,
КОНФЛИКТ ИНТЕРЕСОВ
Поляченко В.М., Карпова Н.И., Парфенов Г.П.,
Дьяков В.М., Семенова Н.В., Платонова А.Т.,
Авторы заявляют об отсутствии конфликта
Ратнер Е.Т. // Докл. АН СССР. 1976. Т. 226. № 6.
интересов.
С. 1433.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1825
20.
Brannon D.G., Morrison R.H., Hall J.L., Humphrey G.L.,
Pharm. Chem. J. 2007. Vol. 41. N 1. P. 1. doi 10.1007/
Zimmerman D.N. // J. Inorg, Nucl. Chem.1971. Vol. 33.
s11094-007-0001-x
P. 981. doi 10.1016/0022-1902(71)80164-1
35.
Шабанов П.Д., Ганапольский В.П., Жумашева А.Б.,
21.
Dotson R. L., Sen B. // Inorg. Nucl. Chem. Lett. 1970.
Елистратов А.А., Мокеева Е.Г., Кудлай Д.А. // Вестн.
Vol. 6. P. 497.
Рос. воен.-мед. акад. 2006. № 1(15). С. 53.
22.
Sen B., Dotson R.L. // J. Inorg, Nucl. Chem. 1970.
36.
Расулов М.М., Нурбеков М.К., Бобкова С.Н., Бе-
Vol. 32. P. 2707. doi 10.1016/0022-1902(70)80320-7
ликова О.А., Воронков М.Г. // Хим.-фарм. ж. Т. 45.
23.
Леменовский Д.А., Зайцева Г.С., Карлов С.С. // При-
№ 7. 2011. С. 3; Rasulov M.M., Nurbekov M.K.,
рода. 2008. № 3. С. 28.
Bobkova S.N., Belikova O.A., Voronkov M.G. // Pharm.
24.
Сидоркин В.Ф., Пестунович В.А., Воронков М.Г. //
Chem. J. 2011. Vol. 45. N 7. P. 381. doi 10.1007/s11094-
Усп. хим. 1980. Т. 49. № 5. С. 789; Sidorkin V.F.,
011-0639-2
37.
Расулов М.М., Нурбеков М.К., Бобкова С.Н., Булано-
Pestunovich V.A., Voronkov M.G. // Russ. Chem.
ва В.В., Антонова Е.С., Сусова М.И., Воронков М.Г.
Rev. 1980. Vol. 49. N 5. P. 414. doi 10.1070/
// Хим.-фарм. ж. 2010. Т. 44. № 6. С. 3; Rasulov M.M.,
RC1980v049n05ABEH002468
Nurbekov M.K., Bobkova S.N., Bulanova V.V., Antono-
25.
Parkanyi L., Hencsei P., Nyulaszi L. // J. Mol.
va E.S., Susova M.I., Voronkov M.G. // Pharm. Chem.
Struct. 1996. Vol. 377. N 1. P. 27. doi 10.1016/0022-
J. 2010. Vol. 44. N 6. P. 287. doi 10.1007/s11094-010-
2860(95)09083-5
0451-4
26.
Кондратенко Ю.А., Кочина Т.А., Буслаев Г.С. Пат.
38.
Казимировская В.Б., Дьяков В.М., Воронков М.Г.,
РФ 2655903 (2018).
Ковальчук С.Ф. Трекрезан: токсикология, фармако-
27.
Воронков М.Г., Зельбст Э.А., Васильев А.Д., Мо-
логия, результаты клинических испытаний. Иркутск,
локеев М.С., Кузнецова Г.А. // Докл. АН. 2014.
1996. 320 с.
Т. 458. № 3. С. 287; Voronkov M.G., Zel’bst E.A.,
39.
Шабанов П.Д., Зарубина И.В., Мокренко Е.В. // Обз.
Vasil’ev A.D., Molokeev M.S., Kuznetsova G.A. //
клин. фармакол. и лек. тер. 2014. Т. 12. № 2. С. 12.
Doklady Chem. 2014. Vol. 458. Pt 1. P. 172. doi
40.
Максимов М.Л., Аляутдин Р.Н. // Терапия. 2017.
10.1134/S0012500814090031
№ 2 (12). С. 114.
28.
Kemmitt T., Gainsford G.J., Steel P.J., Wikaira J. // Acta
41.
Воронков М.Г., Колесникова О.П., Расулов М.М., Мир-
Crystallogr. (E). 2002. Vol. 58. P. o851. doi 10.1107/
скова А.Н. // Хим.-фарм. ж. 2007. Т. 41. № 5. С. 13;
S1600536802012175
Voronkov M.G., Kolesnikova O.P., Rasulov M.M.,
29.
Старова, Г.Л., Франк-Каменецкая О.В., Фундамен-
Mirskova A.N. // Pharm. Chem. J. 2007. Vol. 41. P. 244.
ский B.C., Семенова Н.В., Воронков М.Г. // Докл. АН
doi 10.1007/s11094-007-0054-x
СССР. 1981. Т. 260. № 4. С. 888.
42.
Ерофеева М.К., Максакова В.Л. // Поликлиника.
30.
Воронков М.Г., Албанов А.И., Аксаментова Т.Н.,
2020. № 4. С. 71.
Адамович С.Н., Чипанина Н.Н., Мирсков Р.Г.,
43.
Воронков М.Г., Мухитдинова Х.Н., Нурбеков М.К.,
Кочина Т.А., Вражнов Д.В., Литвинов М.Ю. // ЖОХ.
Расулов М.М. // Докл. РАСХН. 2003. № 2. С. 39.
2009. Т. 79. № 11. С. 1817; Voronkov M.G., Alba-
44.
Павел Ю.Г., Карус А.Л., Кумар Ю.А., Воронков М.Г.
nov A.I., Aksamentova T.N., Adamovich S.N., Chipani-
// Докл. АН. 2002. Т. 38. № 5. С. 419.
na N.N., Mirskov R.G., Kochina T.A., Vrazhnov D.V.,
45.
Справочник пестицидов и агрохимикатов, разре-
Litvinov M.Y. // Russ. J. Gen. Chem. 2009. Vol. 79.
шенных к применению на территории Российской
N 11. P. 2339. doi 10.1134/S1070363209110097.
Федерации. М.: Агрорус, 2007. 399 с.
31.
Chipanina N.N., Aksamentova T.N., Adamovich S.N.,
46.
Вакуленко В.В. // Защита и карантин растений. 2004.
Albanov A.I., Mirskova A.N., Mirskov R.G., Voron-
№ 1. С. 24.
kov M.G. // Compr. Theor. Chem. 2012. Vol. 985. P. 36.
47.
Прусакова Л.Д., Кефели В.И., Белопухов С.Л.,
doi 10.1016/j.comptc.2012.01.033
Вакуленко В.В., Кузнецова С.А. // Агрохимия. 2008.
32.
Воронков М.Г., Корлюков А.А., Кочина Т.А.,
№ 7. С. 86.
Зельбст Э.А. // ЖСХ. 2013. Т. 54. № 1. С. 198;
48.
Мирскова А.Н., Мирсков Р.Г., Адамович С.Н., Во-
Voronkov M.G., Kochina T.A., Korlyukov A.A.,
ронков М.Г. // Химия в интересах устойч. разви-
Zel’bst E.A. // J. Struct. Chem. 2013. Vol. 54. N 1.
тия. 2011. Т. 19. № 5. С. 467; Mirskova A.N., Mir-
P. 192. doi 10.1134/S0022476613010319
skov R.G., Adamovich S.N., Voronkov M.G. // Chemistry
33.
Регистр лекарственных средств России. М.: Инфор-
for Sustainable Development. 2011. Vol. 19. N 5. P. 429.
мхим, 1995. 487 c.
49.
Колесникова О.П., Кудаева О.Т., Сухенко Т.Г., Ли-
34.
Воронков М.Г., Расулов М.М. // Хим.-фарм. ж. 2007.
монов В.Л., Козлов В.А., Мирскова А.Н., Ворон-
Т. 41. № 1. С. 3; Voronkov M.G., Rasulov M.M. //
ков М.Г. // Докл. АН. 2003. Т. 391. № 3. С. 410;
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1826
КОНДРАТЕНКО, КОЧИНА
Kolesnikova O.P., Kudaeva O.T., Sukhenko T.G.,
гин А.А., Воронков М.Г. // Докл. АН СССР. 1990.
Limonov V.L., Kozlov V.A., Mirskova A.N., Voron-
Т. 311. № 4. С. 1000.
kov M.G. // Doklady Biol. Sci. 2003. Vol. 391. N 1-6.
61.
Нефедова Т.В., Казимировская В.Б., Левковская Г.Г.,
P. 306. doi 10.1023/a:1025186114079
Брюзгин А.А., Гусева С.А., Мирскова А.Н., Ворон-
50.
Воронков М.Г., Белоусова Л.И., Григорьева О.Ю.,
ков М.Г. // Хим.-фарм. ж. 1986. Т. 20. № 3. С. 291;
Власова Н.Н. // ЖОрХ. 2014. Т. 50. № 12. С. 1782;
Nefedova T.V., Kazimirovskaya V.B., Levkovskaya G.G.,
Voronkov M.G., Belousova L.I., Grigor’Eva O.Y.,
Bryuzgin A.A., Guseva S.A., Mirskova A.N., Voron-
Vlasova N.N. // Russ. J. Org. Chem. 2014. Vol. 50.
kov M.G. // Pharm. Chem. J. 1986. Vol. 20. N 3. P. 176.
N 12. P. 1763. doi 10.1134/S1070428014120082
doi 10.1007/BF00758564
51.
Воронков М.Г., Каплан Е.Я., Райхман Л.М. // Химия
62.
Мирскова А.Н., Левковская Г.Г., Колесникова О.П.,
и жизнь. 1988. № 1. С. 54.
Перминова О.М., Рудякова Е.В., Адамович С.Н. //
52.
Воронков М.Г., Мирскова А.Н., Левковская Г.Г.
Изв. АН. Сер. хим. 2010. № 12. С. 2181; Mirsko-
va A.N., Levkovskaya G.G., Kolesnikova O.P.,
// Докл. АН. 2002. Т. 385. № 3. С. 411; Voron-
Perminova O.M., Rudyakova E.V., Adamovich S.N. //
kov M.G., Mirskova A.N., Levkovskaya G.G. //
Russ. Chem. Bull. 2010. Vol. 59. N 12. P. 2236. doi
Doklady Biol. Sci. 2002. Vol. 386. N 1-6. P. 404. doi
10.1007/s11172-010-0384-9
10.1023/A:1020797714298
63.
Мирскова А.Н., Левковская Г.Г., Гусева С.А., Ворон-
53.
Воронков М.Г., Софронов Г.А., Старченко Д.А.,
ков М.Г., Нефедова Т.В., Малышев В.В., Василье-
Адамович С.Н., Мирскова А.Н. // Докл. АН. 2009.
ва Л.С., Макрова Н.Г. Пат. РФ 2086239 (1997).
Т. 428. № 1. С. 125; Voronkov M.G., Sofronov G.A.,
64.
Нефедова Т.В., Малышев В.В., Корытов Л.И., Ка-
Starchenko D.A., Adamovich S.N., Mirskova A.N. //
закова Т.Л., Четверякова Т.Д., Непомнящих С.Ф.,
Doklady Biol. Sci. 2009. Vol. 428. N 1. P. 398. doi
Мирскова А.Н., Гусева С.А., Левковская Г.Г., Ворон-
10.1134/S0012496609050020
ков М.Г., Мирошников Ф.Ф. Пат. РФ 2080861 (1997).
54.
Колесникова О.П., Мирскова А.Н., Адамович С.Н.,
65.
Козлов В.А., Колесникова О.П., Кудаева О.Т., Тузо-
Мирсков Р.Г., Кудаева О.Т., Воронков М.Г. // До-
ва М.Н., Ширинский В.С., Мирскова А.Н., Левков-
кл. АН. 2009. Т. 425. № 4. С. 556; Kolesnikova O.P.,
ская Г.Г., Сухенко Т.Г., Кирикова С.Ф., Воронков М.Г.
Mirskova A.N., Adamovich S.N., Mirskov R.G., Kudae-
Пат. РФ 2108100 (1998).
va O.T., Voronkov M.G. // Doklady Biol. Sci. 2009.
66.
Мирскова А.Н., Левковская Г.Г., Тизенберг Г.М. Пат.
Vol. 425. N 1. P. 107. doi 10.1134/S0012496609020070
РФ 2034540 (1995).
55.
Расулов М.М., Воронков М.Г., Абзаева К.А.,
67.
Мирскова А.Н., Мирсков Р.Г., Адамович С.Н.,
Яхкинд М.И., Сусова М.И., Расулов Р.М. Пат. РФ
Воронков М.Г. // Докл. АН. 2010. Т. 435. № 4.
2563831 (2015).
С. 561; Mirskova A.N., Mirskov R.G., Adamovich S.N.,
56.
Расулов М.М., Воронков М.Г., Абзаева К.А.,
Voronkov M.G. // Doklady Biol. Sci. 2010. Vol. 435.
Яхкинд М.И., Расулов Р.М., Смирнова М.И. Пат. РФ
N 1. P. 390. doi: 10.1134/S0012496610060050
2623035 (2017).
68.
Колесникова О.П., Кудаева О.Т., Сухенко Т.Г.,
57.
Мирскова А.Н., Адамович С.Н., Мирсков Р.Г.,
Лыков А.П., Гайдуль К.В., Лимонов В.Л., Мирско-
Воронков М.Г. // Докл. АН. 2010. Т. 433. № 5.
ва А.Н., Левковская Г.Г., Воронков М.Г., Козлов В.А. //
С. 710; Mirskova A.N., Adamovich S.N., Mirskov R.G.,
Эксп. клин. фармакол. 2006. Т. 69. № 3. С. 47.
Voronkov M.G. // Doklady Biol. Sci. 2010. Vol. 433.
69.
Колесникова О.П., Мирскова А.Н., Адамович С.Н.,
N. 1. P. 244. doi 10.1134/S0012496610040022
Кудаева О.Т., Мирсков Р.Г., Воронков М.Г. // Бюлл.
58.
Мирскова А.Н., Левковская Г.Г., Мирсков Р.Г., Во-
СО РАМН. 2010. Т. 30. № 6. С. 12.
ронков М.Г. // ЖОрХ. 2008. Т. 44. № 10. С. 1501;
70.
Лимонов В.Л., Шурлыгина А.В., Робинсон М.В.,
Mirskova A.N., Levkovskaya G.G., Mirskov R.G.,
Мельникова Е.В., Колесникова О.П., Гайдуль К.В.,
Voronkov M.G. // Russ. J. Org. Chem. 2008. Vol. 44.
Мирскова А.Н., Труфакин В.А. // Бюлл. СО РАМН.
N 10. P. 1478. doi 10.1134/S1070428008100126
2005. Т. 25. № 1. С. 70.
59.
Мирскова А.Н., Левковская Г.Г., Ступина А.Г.,
71.
Колесникова О.П., Кудаева О.Т., Ненашева Е.В.,
Чхенкели В.А., Воронков М.Г. // Докл. АН. 2003.
Гольдина И.А., Гойман Е.В., Лыков А.П., Сафроно-
Т. 390. № 2. С. 280; Mirskova A.N., Levkovskaya G.G.,
ва И.В., Лимонов В.Л., Мирскова А.Н., Рудякова Е.В.,
Stupina A.G., Chkhenkeli V.A., Voronkov M.G. //
Гайдуль К.В. // Бюлл. СО РАМН. 2007. № 2(124).
Doklady Biol. Sci. 2003. Vol. 390. P. 239. doi
С. 14.
10.1023/A:1024409601260
72.
Адамович С.Н., Мирсков Р.Г., Мирскова А.Н., Во-
60.
Нефедова Т.В., Бойко М.И., Казимировская В.Б.,
ронков М.Г. // Изв. АН. Сер. хим. 2012. № 6.
Иванова А.А., Левковская Г.Г., Гусева С.А., Брюз-
С. 1246; Adamovich S.N., Mirskov R.G., Mirskova A.N.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1827
Voronkov M.G. // Russ. Chem. Bull. 2012. Vol. 61. N 6.
87.
Адамович С.Н., Оборина Е.Н., Ушаков И.А., Мирско-
P. 1260. doi 10.1007/s11172-012-0172-9
ва А.Н. // ЖОХ. 2018. Т. 88. № 10. С. 1743; Adamo-
73.
Воронков М.Г., Адамович С.Н., Ушаков И.А. // ЖОХ.
vich S.N., Oborina E.N., Ushakov I.A., Mirskova A.N. //
2014. Т. 84. № 2. С. 346; Voronkov M.G., Adamo-
Russ. J. Gen. Chem. 2018. Vol. 88. N 10. P. 2227. doi
vich S.N., Ushakov I.A. // Russ. J. Gen. Chem. 2014.
10.1134/S1070363218100353
Vol. 84. N 2. P. 340. doi 10.1134/S1070363214020340
88.
Адамович С.Н., Кузнецова Г.А., Ушаков И.А., Мир-
74.
Анганова Е.В., Мирскова А.Н., Савченков М.Ф.,
сков Р.Г., Мирскова А.Н. // Изв. АН. Сер. хим.
Духанина А.В., Адамович С.Н., Мирсков Р.Г., Крюко-
2016. № 3. С. 826; Adamovich S.N., Kuznetsova G.A.,
ва Н.Ф. // Сиб. мед. ж. 2014. № 2. С. 75.
Ushakov I.A., Mirskov R.G., Mirskova A.N. // Russ.
75.
Крюкова Н.Ф., Адамович С.Н., Анганова Е.В., Мир-
Chem. Bull. 2016. Vol. 65. N 3. P. 826. doi 10.1007/
сков Р.Г., Мирскова А.Н. Пат. РФ 2511031 (2014).
s11172-016-1383-2
76.
Лукьянова С.В., Гефан Н.Г., Адамович С.Н., Обори-
89.
Кондратенко Ю.А., Кочина Т.А., Фундаменский В.С.,
на Е.Н., Хаптанова Н.М., Кузнецов В.И., Остяк А.С.,
Власов Ю.Г. // ЖОХ. 2015. Т. 85, №. 12. C. 1978;
Косилко В.С., Балахонов С.В. // Acta Biomed. Sci.
Kondratenko Yu.A., Kochina T.A., Fundamensky V.S.,
2020. Vol. 5. N 1. C. 47. doi 10.29413/ABS.2020-5.1.6
Vlasov Yu.G. // Russ. J. Gen. Chem. 2015. Vol. 85. N 12.
77.
Привалова Е.А., Тигунцева Н.П., Адамович С.Н.,
P. 2710. doi 10.1134/S1070363215120075
Мирсков Р.Г., Мирскова А.Н. // Вестн. ИрГТУ. 2015.
90.
Fundamensky V.S., Kochina T.A., Kondratenko Y.A.,
№ 11(106). С. 136.
Zolotarev A.A., Vlasov Yu.G., Ignatyev I.S. // J. Mol.
78.
Привалова Е.А., Тигунцева Н.П., Адамович С.Н.,
Liq. 2017. Vol. 230. P. 113. doi: 10.1016/j.
Мирсков Р.Г., Мирскова А.Н. // Изв. АН. Сер. хим.
molliq.2016.12.111
2017. № 7. С. 1320; Privalova E.A., Tiguntseva N.P.,
91.
Кондратенко Ю.А., Гуржий В.В., Панова Г.Г.,
Adamovich S.N., Mirskov R.G., Mirskova A.N. // Russ.
Аникина Л.М., Удалова О.Р., Крутиков В.И., Угол-
Chem. Bull. 2017. Vol. 66. N 7. P. 1320. doi 10.1007/
ков В.Л., Кочина Т.А. // ЖНХ. 2020. Т. 65. № 9.
s11172-017-1893-6
С. 1265; Kondratenko Yu.A., Gurzhiy V.V., Panova
79.
Кирюхина А.С., Лозовая Т.С., Привалова Е.А., Фе-
G.G., Anikina L.M., Udalova O.R., Krutikov V.I., Ugol-
досеева В.Г., Оборина Е.Н., Адамович С.Н., Розен-
kov V.L., Kochina T.A. // Russ. J. Inorg. Chem. 2020.
цвейг И.Б. // Изв. вузов. Прикл. хим. и биотехнол.
Vol. 65. N 9. P. 1407. doi: 10.1134/S0036023620090089
2020. Т. 10. № 3 (34). С. 487. doi 10.21285/2227-2925-
92.
Кондратенко Ю.А., Няникова Г.Г., Молчанова К.В.,
2020-10-3-487-495
Кочина Т.А. // Физика и химия стекла. 2017.
80.
Павлова О.Н., Адамович С.Н., Мирскова А.Н., Зем-
Т. 43. № 5. С. 496; Kondratenko Yu.A., Nyanikova G.G.,
ская Т.И. Пат. РФ 2694593 (2019).
Molchanova K.V., Kochina T.A. // Glass Phys.
81.
Адамович С.Н., Оборина Е.Н. // Изв. АН. Сер. хим.
Chem. 2017. Vol. 43. N 5. P. 445. doi 10.1134/
2020. № 1. С. 179; Adamovich S.N., Oborina E.N. //
S108765961705008X
Russ. Chem. Bull. 2020. Vol. 69. N 1. P. 179. doi
93.
Kondratenko Yu.A., Nikonorova A.A., Zolotarev A.A.,
10.1007/s11172-020-3048-4.
Ugolkov V.L., Kochina T.A. // J. Mol. Struct. 2020.
82.
Глызина О.Ю., Адамович С.Н., Белых О.А., Сухано-
Vol. 1207. Article ID 127813. doi 10.1016/j.
ва Л.В., Оборина Е.Н., Глызин Л.А., Яхненко В.М.,
molstruc.2020.127813
Тягун М.Л., Сапожникова Ю.П. // Изв. Байкальск.
94.
Kondratenko Y.A., Antuganov D.O., Kadnikova O.Yu.,
гос. унив. 2020. Т. 30. № 3. С. 463. doi 10.17150/2500-
Zolotarev A.A., Ugolkov V.L., Nadporojskii M.A.,
2759.2020.30(3).463-471
Kochina T.A. // J. Mol. Liq. 2021. Vol. 324. Article ID
83.
Адамович С.Н., Мирскова А.Н., Колесникова О.П.
114717. doi 10.1016/j.molliq.2020.114717
Пат. РФ 2623034 (2017).
95.
Antuganov D., Timofeev V., Timofeeva K., Antuganova Y.,
84.
Адамович С.Н., Мирскова А.Н. // ЖПХ. 2018. Т. 91.
Kondratenko Y.A. // ChemistrySelect. 2019. Vol. 4.
№. 3. C. 432; Adamovich S.N., Mirskova A.N. // Russ.
P. 12524. doi 10.1002/slct.201902588
J. Appl. Chem. 2018. Vol. 91. N 3. P. 469. doi: 10.1134/
96.
Antuganov D., Nadporojskii M., Sysoev D., Shatik
S1070427218030205
S., Kondratenko Y. // ChemistrySelect. 2020. Vol. 5.
85.
Мирскова А.Н., Адамович С.Н., Мирсков Р.Г. Пат. РФ
P. 10953. doi 10.1002/slct.202002891
2642778 (2018)
97.
Кондратенко Ю.А., Власов Д.Ю., Буслаев Г.С.,
86.
Адамович С.Н., Оборина Е.Н., Мирскова А.Н. //
Кочина Т.А., Шилова О.А. // Физика и химия стек-
ЖПХ. 2018. Т. 91. № 4. С. 602; Adamovich S.N.,
ла. 2019. Т. 45. № 5. С. 469; Kondratenko Yu.A.,
Oborina E.N., Mirskova A.N. // Russ. J. Appl.
Vlasov D.Yu., Buslaev G.S., Kochina T.A., Shilova O.A. //
Chem. 2018. Vol. 91. N 4. P. 701. doi 10.1134/
Glass Phys. Chem. 2019. Vol. 45. No. 5. P. 372. doi
S1070427218040249
10.1134/S1087659619050080
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1828
КОНДРАТЕНКО, КОЧИНА
98.
Чипанина Н.Н., Аксаментова Т.Н., Адамович С.Н.,
Sci. 2006. Vol. 410. N 1. P. 414. doi 10.1134/
Мирсков Р.Г., Мирскова А.Н., Албанов А.И., Ворон-
S0012496606050206
ков М.Г. // ЖОХ. 2010. Т. 80. №. 9. С. 1452; Chipani-
109.
Расулов М.М., Воронков М.Г., Абзаева К.А.,
na N.N., Aksamentova T.N., Adamovich S.N.,
Яхкинд М.И., Смирнова М.И., Расулов Р.М. Пат.
Mirskov R.G., Mirskova A.N., Albanov A.I., Voron-
РФ 2575788 (2016).
kov M.G. // Russ. J. Gen. Chem. 2010. Vol. 80. N 9.
110.
Расулов М.М., Абзаева К.А., Яхкинд М.И., Жигаче-
P. 1771. doi 10.1134/S1070363210090094
ва И.В., Николаева И.С., Расулов Р.М., Ворон-
99.
Адамович С.Н., Кашик Т.В., Чипанина Н.Н.,
ков М.Г. // Изв. АН. Сер. xим. 2015. № 7. С. 1686;
Мирсков Р.Г., Мирскова А.Н., Воронков М.Г. // ЖПХ.
Rasulov M.M., Abzaeva K.A., Yakhkind M.I., Zhi-
2009. Т. 82. № 5. С. 808; Adamovich S.N., Kashik T.V.,
gacheva I.V., Nikolaeva I.S., Rasulov R.M., Voron-
Chipanina N.N., Mirskov R.G., Mirskova A.N., Voron-
kov M.G. // Russ. Chem. Bull. 2015. Vol. 64. N 7.
kov M.G. // Russ. J. Appl. Chem. 2009. Vol. 82. N 5.
P. 1686. doi 10.1007/s11172-015-1061-9
P. 862. doi: 10.1134/S1070427209050218
111.
Стороженко П.А., Воронков М.Г., Расулов М.М.,
100.
Mirskova A.N., Adamovich S.N., Mirskov R.G., Schil-
Снисаренко Т.А., Мирскова А.Н., Абзаева К.А.,
de U. // Chem. Cent. J. 2013. Vol. 7. Article ID: 34.
Оржековский А.П., Ваганов М.А., Федорин А.Ю.,
doi10.1186/1752-153X-7-34
Сусова М.И. Пат. РФ 2540518. (2015).
101.
Ushakov I. A., Voronov V.K., Adamovich S.N.,
112.
Расулов М.М., Стороженко П.А., Воронков М.Г.,
Mirskov R.G., Mirskova A.N. // J. Mol. Struct. 2016.
Снисаренко Т.А., Абзаева К.А., Мирскова А.Н.,
Vol. 1103. P. 125. doi 10.1016/j.molstruc.2015.08.074
Сусова М.И., Ваганов М.А., Федорин А.Ю.,
102.
Ушаков И.А., Воронов В.К., Гришмановский Д.С.,
Оржековский А.П. Пат. РФ 2545888 (2015) .
Адамович С.Н., Мирсков Р.Г., Мирскова А.Н. // Изв.
113.
Расулов М.М., Стороженко П.А., Расулов Р.М.,
АН. Сер. хим. 2015. № 1. С. 58; Ushakov I.A., Vor-
Снисаренко Т.А., Абзаева К.А., Сусова М.И.,
onov V.K., Grishmanovskii D.S., Adamovich S.N., Mir-
Оржековский А.П., Яхкинд М.И. Пат. РФ 2546537
skov R.G., Mirskova A.N. // Russ. Chem. Bull. 2015.
(2015).
Vol. 64. N 1. P. 58. doi 10.1007/s11172-015-0821-x
114.
Расулов М.М., Воронков М.Г., Нурбеков М.К.,
103.
Воронов В.К., Дударева О.В.
// Успехи
Зверева М.В., Мирскова А.Н., Адамович С.Н.,
современного естествознания. 2014. № 9. С. 98.
Мирсков Р.Г. // Докл. АН. 2012. Т. 444. № 2. С. 219;
104.
Воронков М.Г., Кузнецова Г.А., Федорин А.Ю.,
Rasulov M.M., Voronkov M.G., Nurbekov M.K., Zvere-
Юшков Г.Г., Машанов А.В., Малышкина Н.А.,
va M.V., Mirskova A.N., Adamovich S.N., Mirskov R.G. //
Расулов М.М. Пат. РФ 2418580 (2011).
Doklady Biochem. Biophys. 2012. Vol. 444. P. 147.
105.
Воронков М.Г., Федорин А.Ю., Машанов А.В.,
doi 10.1134/S1607672912030064
Малышкина Н.А., Кузнецова Г.А., Юшков Г.Г. Пат.
115.
Расулов М.М., Стороженко П.А., Воронков М.Г.,
РФ 2425676 (2011)
Снисаренко Т.А., Абзаева К.А., Мирскова А.Н.,
106.
Колесникова О.П., Мирскова А.Н., Адамович С.Н.,
Сусова М.И., Ваганов М.А., Федорин А.Ю.,
Кузнецова Г.А., Кудаева О.Т., Гольдина И.А.,
Оржековский А.П., Нурбеков М.К. Пат. РФ 2540469
Сафронова И.В., Мирсков Р.Г., Гайдуль К.В.,
(2015).
Воронков М.Г. // Бюлл. СО РАМН. 2009. Т. 29.
116.
Расулов М.М., Зверева М.В., Нурбеков М.К.,
№ 6. С. 73.
Адамович С.Н., Мирскова А.Н., Мирсков Р.Г.,
107.
Адамович С.Н., Оборина Е.Н. // Изв. АН. Сер. хим.
Воронков М.Г. Пат. РФ 2457837 (2012)
2019. № 9. С. 1723; Adamovich S.N., Oborina E.N. //
117.
Расулов Р.М. // Вестн. МГОУ. Сер. Естественные
Russ. Chem. Bull. 2019. Vol. 68. N 9. P. 1723. doi
науки. 2017. № 4. С. 56. doi 10.18384/2310-7189-
10.1007/s11172-019-2616-y
2017-4-56-62
108.
Шмаков В.Н., Константинов Ю.М., Кузнецо-
118.
Расулов М.М., Стороженко П.А., Воронков М.Г.,
ва Г.А., Воронков М.Г. // Докл. АН. 2006. Т. 410.
Сусова М.И., Снисаренко Т.А., Федорин А.Ю.,
№ 5. С. 716; Shmakov V.N., Konstantinov Y.M.,
Абзаева К.А., Ваганов М.А., Нурбеков М.К.,
Kuznetsova G.A., Voronkov M.G. // Doklady Biol.
Оржековский А.П. Пат. РФ 2540476 (2015).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
ВКЛАД НАУЧНОЙ ШКОЛЫ АКАДЕМИКА М.Г. ВОРОНКОВА
1829
119.
Расулов М.М., Стороженко П.А., Сусова М.И.,
125. Кадникова О.Ю., Кондратенко Ю.А., Гуржий В.В.,
Снисаренко Т.А., Абзаева К.А., Нурбеков М.К.,
Уголков В.Л., Кочина Т.А. // Изв. АН. Сер. xим.
Расулов Р.М., Яхкинд М.И. Пат. РФ 2559779 (2015).
2020. № 5. С. 958; Kadnikova O.Y., Kondratenko Y.A.,
120.
Адамович С.Н., Мирсков Р.Г., Мирскова А.Н. // Изв.
Gurzhiy V.V., Ugolkov V.L., Kochina T.A. // Russ.
АН. Сер. xим. 2015. № 9. С. 2275; Adamovich S.N.,
Chem. Bull. 2020. Vol. 69. N 5. P. 958. doi 10.1007/
Mirskov R.G., Mirskova A.N. // Russ. Chem. Bull.
s11172-020-2855-y
2015. Vol. 64. N 9. P. 2275. doi 10.1007/s11172-015-
126. Кипрова Н.С., Кондратенко Ю.А., Уголков В.Л.,
1153-6
Гуржий В.В., Кочина Т.А. // Изв. АН. Сер. xим.
121.
Адамович С.Н., Кузнецова Г.А., Ушаков И.А.,
2020. № 9. С. 1789; Kiprova N.S., Kondratenko Y.A.,
Мирскова А.Н. // Изв. АН. Сер. xим. 2016. № 11.
Ugolkov V.L., Gurzhiy V.V., Kochina T.A. // Russ.
С. 2751; Adamovich S.N., Kuznetsova G.A., Usha-
Chem. Bull. 2020. Vol. 69. P. 1789. doi 10.1007/
kov I.A., Mirskova A.N. // Russ. Chem. Bull. 2016.
s11172-020-2963-8
Vol. 65. N 11. P. 2751. doi 10.1007/s11172-016-1646-y
127. Kondratenko Y.A., Ugolkov V.L., Vlasov D.Y., Kochi-
122.
Ignatyev I., Kondratenko Y., Fundamensky V., Kochi-
na T.A. // Mendeleev Commun. 2020. Vol. 30. P. 639.
na T. // Transition Met. Chem. 2018. Vol. 43. P. 127.
doi 10.1016/j.mencom.2020.09.029
doi 10.1007/s11243-017-0199-8
128. Шилова О.А., Халаман В.В., Комендантов А.Ю.,
123.
Kondratenko Y., Zolotarev A.A., Ignatyev I., Ugolkov V.,
Кондратенко Ю.А., Ефимова Л.Н., Цветкова И.Н.,
Kochina T. // Transition Met. Chem. 2020. Vol. 45.
Кочина Т.А. // Физика и химия стекла. 2021. Т. 47.
P. 71. doi 10.1007/s11243-019-00359-7
№ 2. С. 209; Shilova O.A., Khalaman V.V., Komen-
124.
Kondratenko Y., Fundamensky V., Ignatyev I.,
dantov A.Y., Kondratenko Y.A., Efimova L.N., Tsvetko-
Zolotarev A., Kochina T., Ugolkov V. // Polyhedron.
va I.N., Kochina T.A. // Glass Phys. Chem. 2020.
2017. Vol. 130. P. 176. doi 10.1016/j.poly.2017.04.022
Vol. 46. N 6. P. 620. doi 10.1134/S1087659620060243
Contribution of the Scientific School
of Academician M.G. Voronkov to the Development
of the Chemistry of Biologically Active Atranes
(Protatranes and Hydrometallatranes) (A Review)
Yu. A. Kondratenko* and T. A. Kochina
Grebenshchikov Institute of Silicate Chemistry of the Russian Academy of Sciences, St. Petersburg, 199034 Russia
*e-mail: kondratencko.iulia@yandex.ru
Received June 22, 2021; revised July 19, 2021; accepted July 26, 2021
The main results of the multiannual studies of the scientific school of Academician Mikhail G. Voronkov in the
field of two subgroups of the atrane family - protatranes and hydrometallatranes, as well as the results that is
a continuation of the studies initiated by Academician M. G. Voronkov, are summarized and presented. Peren-
nial studies of atranes under the leadership of M.G. Voronkov led to the discovery of their unique biological
activity and the creation of a number of original drugs that have no analogues in world medicine and means
of agricultural chemicalization - biostimulants and adaptogens for agricultural plants, animals, useful insects
and microorganisms.
Keywords: atranes, protatranes, hydrometallatranes, triethanolamine, trecresan, biologically active substances
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021