ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 12, с. 1887-1896
К 100-летию со дня рождения М.Г. Воронкова
УДК 547.245
(ХЛОРМЕТИЛ)АЛКОКСИГАЛОГЕНСИЛАНЫ В
РЕАКЦИИ
С N-ТРИМЕТИЛСИЛИЛ-N-МЕТИЛАЦЕТАМИДОМ
© 2021 г. Н. Ф. Лазарева*, Н. Н. Чипанина, А. С. Солдатенко, Л. П. Ознобихина
Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
*е-mail: nataly_lazareva@irioch.irk.ru
Поступило в Редакцию 31 августа 2021 г.
После доработки 31 августа 2021 г.
Принято к печати 18 сентября 2021 г.
Изучено взаимодействие N-триметилсилил-N-метилацетамида с полифункциональными силанами: ме-
тил(хлорметил)алкоксихлорсиланами и (хлорметил)дифтор(изопропокси)силаном. Методами квантовой
химии изучено строение синтезированных (O-Si)-хелатов и получены данные об апикофильности атомов
фтора и хлора в этих соединениях.
Ключевые слова: метил(хлорметил)алкоксихлорсиланы, (хлорметил)дифтор(изопропокси)силан, N-три-
метилсилил-N-метилацетамид, апикофильность
DOI: 10.31857/S0044460X21120076
(Хлорметил)силаны СlCH2SiMenX3-n (X = Hlg,
ле заместители X различной природы, очень мало
OR; n = 0-3) являются универсальными бифунк-
изучены, мы нашли лишь несколько работ, описы-
циональными реагентами [1, 2]. Большинство из-
вающих их синтез. Диспропорционирование при
вестных к настоящему времени α-карбофункци-
комнатной температуре в течение 1-2 сут меж-
ональных силанов YCH2SiMenX3-n (Y = OR, SR,
ду СlCH2SiСl3 и СlCH2Si(OEt)3 (в соотношении
NR1R2, RCOO) синтезированы с использованием
1:2) приводит к образованию СlCH2SiCl(OEt)2, а
реакций нуклеофильного замещения атома хлора
между СlCH2SiMeСl2 и СlCH2SiMe(OEt)2 (в экви-
хлорметильной группы. Поэтому повышенный
мольном соотношении) приводит к образованию
интерес к развитию методов их синтеза не вызы-
СlCH2SiCl(OEt)2 [Чернышев Е.А. и др., ЖОХ,
вает особого удивления. В начале 90-х годов был
2001, т. 71, вып. 7.]. К сожалению, авторами не
продемонстрирован эффективный лабораторный
указаны физико-химические константы, выходы
метод синтеза (хлорметил)силанов, основанный на
и степень чистоты полученных соединений. Рас-
реакции сочетания между хлорсиланами и (хлор-
щепление связи С-О-С винилбутилового эфира
метил)литием, получаемым in situ из бромхлор-
(хлорметил)трихлорсиланом привело к получению
метана и н-бутиллития в тетрагидрофуране [3, 4].
дихлор(хлорметил)бутоксисилана
[Басенко С.В.
Эта методология была успешно использована
и др., ЖОХ, 2003, т. 73, вып. 7]; метил(хлорметил)-
для получения силанов (СlCH2)nSiR4-n (n = 2-4),
изопропоксихлорсилан был синтезирован взаимо-
содержащих у атома кремния несколько хлор-
действием СlCH2SiMeCl2 c изопропанолом в при-
метильных групп (см., например [5, 6]). Однако
сутствии триэтиламина [7]. Органил(хлорметил)-
(хлорметил)силаны, содержащие в одной молеку-
алкоксихлорсиланы СlCH2SiR1Cl(OR2) (R1 = Me,
1887
1888
ЛАЗАРЕВА и др.
Схема 1.
20oC, 15 сут
2ClCH2SiF3
+ ClCH2Si(Oi-Pr)3
3ClCH2SiF2(Oi-Pr)
2
Схема 2.
Me
Me O
F
C
ClCH2SiF2OCHMe2
N
Si
F
N
C
Me
SiMe
Me
O OCHMe2
3
1
5
Ph, п-С6Н13; R2 = Me, Et, i-Pr) были выделены с
что метил(хлорметил)изопропоксихлорсилан реа-
хорошими выходами (степень чистоты 86-96%) в
гирует с N-ТМС-пергидро-2-азепиноном с образо-
результате взаимодействия спиртов с соответству-
ванием
1-[(метилизопропоксихлорсилил)метил]-
ющими органил(хлорметил)дихлорсиланами [8].
пергидро-2-азепинона, а при взаимодействии из-
бытка
1-(триметоксисилилметил)-2-пергидро-2-
(Хлорметил)силаны, благодаря уникальному
азепинона с ацетилхлоридом получен 1-[(меток-
сочетанию двух функциональных групп (СlCH2 и
сидихлорсилил)метил]пергидро-2-азепинон. Их
SiX) в молекуле, не только нашли широкое приме-
строение изучено методами ИК и ЯМР 1Н спектро-
нение как синтоны в химии полимеров и гибрид-
скопии, и на основании значений валентных коле-
ных материалов (см., например, [9-14]), но и обе-
баний карбонильной группы авторы делают вывод
спечили развитие синтетической и структурной
о пентакоординации атома кремния. Продолжая
химии (O-Si)-хелатных соединений гипервалент-
наши исследования в области (O-Si)-хелатных
ного кремния [см., например, [15-19]). Пробле-
соединений пентакоординированного кремния
ма взаимодействия бифункциональных силанов
мы изучили взаимодействие N-триметилсилил-N-
XCH2SiMe2Y с O- и/или N-триметилсилилирован-
метилацетамида 1 с бифункциональными (хлор-
ными (ТМС) лактамами и амидами карбоновых
метил)(алкокси)галогенсиланами СlCH2SiF2(Oi-Pr)
кислот уже почти полвека привлекает внима-
(2), СlCH2SiMe(Oi-Pr)Cl (3), СlCH2SiMe(Ot-Bu)Cl
ние химиков. К настоящему времени наиболее
(4).
изучены соединения с координационным узлом
XC3SiO, значительная их часть была синтезиро-
(Хлорметил)дифтор(изопропокси)силан
2 был
вана с использованием реакции пересилилирова-
получен при диспропорционировании (хлорметил)-
ния O/N-ТМС-амидов и родственных соединений
трифторсилана и (хлорметил)триизопропоксисила-
хлор(хлорметил)диметилсиланом и последующих
на (схема 1). По данным спектроскопии ЯМР, ре-
обменных реакций по связи Si-Cl. Среди (O-Si)-
акционная смесь содержит соединение 2, исходные
реагенты и СlCH2SiF(Oi-Pr)2. Соединение 2 было
хелатов, содержащих у пентакоординированного
атома кремния два или три атома галогена, наиболее
выделено перегонкой на ректификационной колон-
ке. Следует отметить, что при хранении силан 2
изучены соединения с координационными узлами
SiC2OF2 и SiCOF3. N-Силилметилкарбоксамиды
постепенно диспропорционирует с образованием
исходных силанов.
и родственные соединения, содержащие у пента-
координированного атома кремния заместители
Взаимодействие
(хлорметил)дифтор(изо-
различной природы (например, атом галогена и
пропокси)силана 2 с амидом 1. При взаимодей-
алкоксигруппу) практически не изучены. Мы на-
ствии (хлорметил)дифтор(изопропокси)силана
2
шли единственную работу [7], в которой показано,
с амидом 1 образуется единственный продукт -
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
(ХЛОРМЕТИЛ)АЛКОКСИГАЛОГЕНСИЛАНЫ
1889
Схема 3.
Me
O
C
Me
Cl
N
N
Si F
Me
SiMe
3
-Me3SiF
C
1a
Me
O F
A
ClCH2SiF3
Me
Me
O
F
C
SiMe3
N
Si
F
-Me3SiCl
C
N
Me
O F
Me
1и
Б
N-[(изопропоксидифторсилил)метил]-N-метил-
нения с пентакоординированным атомом кремния:
ацетамид 5 (схема 2).
N-{[хлор(дифтор)силил]метил}-N-метилацетамид
A и N-[(трифторилил)метил]}-N-метилацетамид
Реакцию проводили в среде гексана или хлоро-
форма при комнатной температуре, через 6 ч после
Б (схема 3) [19]. Причина двух параллельно про-
текающих реакций между силаном ClCH2SiF3 и
смешивания реагентов выход продукта реакции 5
N-триметилсилилацетамидом связана с уникаль-
составляет 60-69%. Изучение реакционной смеси
методом спектроскопии ЯМР в среде дейтерохло-
ной природой каждого из реагентов: амбидентной
роформа показало, что увеличение времени реак-
реакционной способностью бифункциональных
ции или температуры реакционной смеси с целью
силанов вследствие наличия двух электрофиль-
повышения выхода приводит к уменьшению со-
ных центров в их молекулах и существованием
держания целевого продукта и образованию неи-
амидо-имидатной таутомерии амида 1.
дентифицированных соединений. Следует также
Мониторинг реакции методом ИК спектроско-
отметить, что при комнатной температуре в спек-
пии показал, что в первоначальном спектре реак-
тре ЯМР соединения 5 уже через сутки появляют-
ционной смеси амида 1 с силаном 2 в растворе
ся сигналы неидентифицированных соединений,
дейтерохлороформа наблюдается только интен-
интенсивность которых увеличивается с течением
сивная полоса ν(C=O) амида 1a при 1626 см-1.
времени. По-видимому, причиной этого являются
Затем появляется и увеличивается полоса погло-
реакции диспропорционирования у атома кремния.
щения ν(C=N) 1666 см-1 промежуточного имидата
Согласно данным ЯМР, соединение 5, запаянное в
5′ (схема 4) при снижении интенсивности полосы
дегазированной ампуле, остается неизменным на
исходного амида. В итоге, в спектре непродолжи-
протяжении длительного времени при хранении в
тельное время наблюдается только интенсивная
сосуде Дьюара с жидким азотом.
полоса ν(C=N) имидата. Появление слабой полосы
Недавно мы показали, что при взаимодействии
ν(C=O) при 1610 см-1 характеризует образование
амида 1, существующего в виде смеси амидно-
конечного продукта 5 с внутримолекулярной свя-
го (1а) и имидатного (1и) таутомеров, с силанами
зью C=O→Si. С течением времени интенсивность
СlCH2SiF3 и СlCH2SiMeF2 протекают два независи-
полосы ν(C=N) уменьшается, а интенсивность
мых параллельных процесса: процесс пересилили-
полосы ν(C=O) растет. В результате спектр рас-
рования и процесс алкилирования с образованием
твора содержит интенсивную полосу ν(C=O) при
(O-Si)-хелатных N-силилметилированных амидов.
1610 см-1 и свидетельствует о завершении реакции
Так, в результате взаимодействия соединения 1 с
с образованием ее продукта. Атом фтора занимает
СlCH2SiF3 образуются два (O-Si)-хелатных соеди-
в этом соединении аксиальное положение, кото-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1890
ЛАЗАРЕВА и др.
Схема 4.
#
H
H H
O SiF2Oi-Pr
O
O
H
MeC
C
MeC
C
MeC
O C Cl
H
+
H
MeC
N Si
F
MeN
SiF2Oi-Pr
MeN
Cl
Me
SiMe
SiMe3
F
3
MeN
5'
Oi-Pr
1a
SiMe3
Me
F
N
Si
F
ClCH2SiF2Oi-Pr
C
Me
O Oi-Pr
5
O
#
O
O
MeC
SiMe3
MeC SiMe
3
MeC
SiMe3
SiF2Oi-Pr
Cl
N
Me
N
C SiF2Oi-Pr
N C Cl
Me
1и
Me
H H
H H
Схема 5.
Me
Me
O
Cl
ClCH2SiMeClOR, C6H12
N
C
Si
OR
N
C
Me
SiMe
Me
O Me
3
1
6, R = Oi-Pr (90%)
7, R = Ot-Bu (94%)
рому в спектре твердого продукта соответствует
силана 2 с амидом 1 протекает только реакция O-
интенсивная дублетная полоса ν(Si-Fax) с макси-
и/или N-алкилирования. Предполагаемый меха-
мумами при 711, 692 см-1, смещенная к низким ча-
низм этой реакции приведен на схеме 4 и подробно
стотам относительно полосы ν(Si-F) при 912 см-1
обсуждался нами ранее на примере реакции между
в спектре силана 2.
амидом 1 и ClCH2SiF3 [19].
В спектре ЯМР 29Si продукта реакции со-
По-видимому, причина различия реакционной
держится единственный сигнал в виде трипле-
способности СlCH2SiF3 и силана 2 связана с тем,
та (-100.26 м. д., J 223.9 Гц), а в спектре ЯМР
что в результате замены атома фтора объемной изо-
13C присутствует сигнал NCH2Si-группы также в
пропильной группой атака нуклеофилом протекает
виде триплета (35.03 м. д., 2J 37.6 Гц), что свиде-
предпочтительно по атому углерода хлорметильной
тельствует о наличии SiF2R-группы в молекуле.
группой и приводит к образованию единственного
Следует также отметить, что уже через 2 ч после
продукта алкилирования 5. Хорошо известно, что
смешивания реагентов в спектрах ЯМР 1Н реакци-
стерические эффекты оказывают существенное
влияние на реакционную способность кремнийор-
онной смеси присутствует сигнал силана Me3SiCl
(побочного продукта в реакции алкилирования) и
ганических соединений [20].
отсутствуют сигналы силана Me3SiF (побочного
Взаимодействие
метил(хлорметил)алкок-
продукта в реакции пересилилирования). Эти фак-
сихлорсиланов 3 и 4 с амидом 1. Метил(хлорметил)-
ты свидетельствуют о том, что при взаимодействии
алкоксихлорсиланы 3 и 4 синтезировали по ме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
(ХЛОРМЕТИЛ)АЛКОКСИГАЛОГЕНСИЛАНЫ
1891
Схема 6.
ClCH2SiMeOt-BuCl
+
Me
O
Me
O
C
C SiMe3
N
Me
SiMe
N
3
Me
1a
1и
-Me3SiCl
-Me3SiCl
O
O
MeC
SiMeOt-Bu
MeC
MeN
NMe CH2
SiMeOt-BuCH2Cl
Cl
7a
7и
Me
Me
Me
Cl
N
N
Si
Me
O
C
O Ot-Bu
t-BuO
Si
Me
Me
Cl
7
7'
тодике, предложенной в работе [7]. Метил(хлор-
налы исходных соединений, присутствуют интен-
метил)алкоксихлорсиланы
3 и
4 реагируют с
сивный сигнал Me3SiCl и сигналы интермедиатов
амидом 1 образуя соответствующие N-метил-N-
реакции 7а, 7и и 7′. Через 6 ч в спектрах ЯМР при-
[(метилалкоксихлорсилил)метил]-N-метилацет-
сутствуют только сигналы Me3SiCl и соединения
амиды 6 и 7 (cхема 5).
7. Образование триметилхлорсилана однозначно
Соединения 6 и 7 выделены в виде светло-жел-
свидетельствует о том, что протекает реакция пе-
тых масел с высоким выходом, их строение дока-
ресилилирования, как и в случае других (хлорме-
зано методом спектроскопии ЯМР. Эти соедине-
тил)хлорсиланов (см., например, [20, 21]). Ее воз-
ния легко гидролизутся влагой воздуха, образуя
можный механизм представлен на схеме 6 (стадии
смесь силоксанов, на это указывает появление в
комплексообразования и переходные состоянии
спектрах ЯМР 29Si нескольких сигналов в области
опущены), подробно этот механизм обсуждается
между -1.00 и 10.00 м. д. Как и в случае соединения
на примере реакции CH2ClSiF3 в работе [19].
5, при хранении соединений 6 и 7 при комнатной
Мониторинг методом ИК спектроскопии реак-
температуре протекают процессы диспропорцио-
ции силана 4 с амидом 1 в растворе дейтерохлоро-
нирования и уже через несколько дней изменяются
форма показал, что при смешивании реагентов в
спектральные характеристики. Соединения 6 и 7
спектре наблюдается интенсивная полоса ν(C=O)
стабильны в запаянных дегазированных ампулах
исходного амида 1 при 1628 см-1, содержащая пле-
при их хранении при температуре жидкого азота.
чи при 1669 и 1610 см-1. Высокочастотное плечо
Изучение реакционной смеси силана 4 с ами-
относится к колебанию ν(C=N) промежуточного
дом 1 методом спектроскопии ЯМР показал, что
имидата 7и (схема 6), а низкочастотное к ν(C=O)
уже через 2 ч в спектре ЯМР 1Н отсутствуют сиг-
конечного продукта 7 с внутримолекулярной коор-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1892
ЛАЗАРЕВА и др.
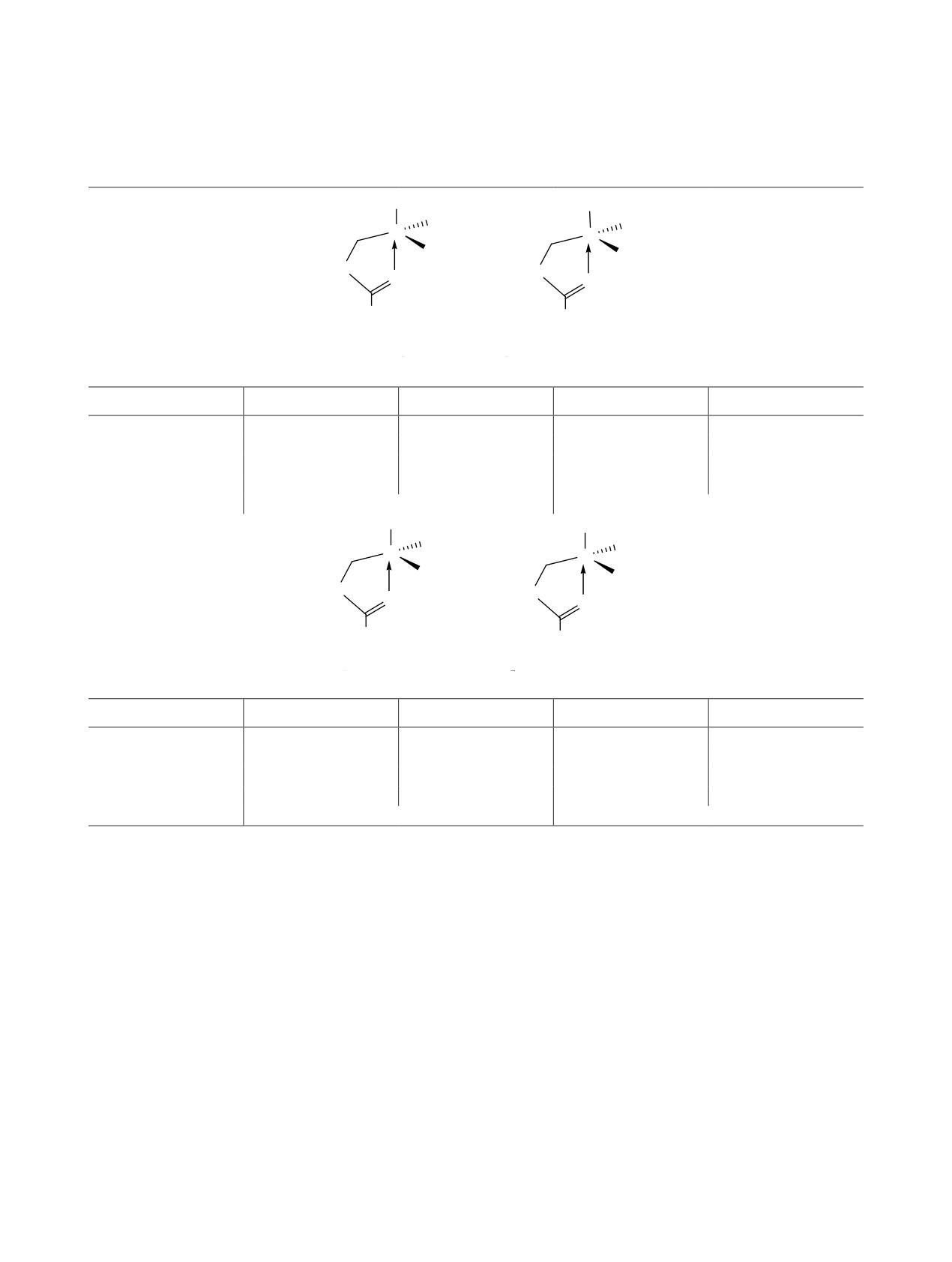
Таблица 1. Значения полной E и относительной энергии ΔE° = E°а - E°б, длины связей аксиального фрагмента
C=O→Si и Si-X (X = F, Cl, OR) согласно данным расчетов методом B3LYP/6-311++G(d,p)
F
RO
F
F
Si
Si
OR
F
MeN
MeN
O
O
Me
Me
a
б
5a,б (R = Oi-Pr); 8a,б (R = Ot-Bu)
Параметр
5a
5б
8a
8б
d(O→Si), Å
2.043
2.155
2.065
2.223
d(Si-Fax), Å
1.669
1.671
d(Si-ORax), Å
1.668
1.660
–E, ккал/моль
970.598013
970.593719
1009.922702
1009.918709
ΔE°, ккал/мольa
2.35
2.17
Cl
OR1
2
R
R2
Si
Si
OR1
Cl
MeN
MeN
O
O
Me
Me
a
бб
7a, б (R1 = Ot-Bu, R2 = Me); 9a,бб (R1 = Oi-Pr, R2 = Cl)
Параметр
9a
9б
7a
7б
d(O→Si), Å
2.066
2.219
2.383
3.603
d(Si-Clax), Å
2.196
2.194
d(Si-ORax), Å
1.668
1.641
–E, ккал/моль
1691.265285
1691.261972
1310.252591
1310.251766
ΔE°, ккал/моль
1.91
0.35
динационной связью C=O→Si. Далее быстро про-
нии к донорному атому расположен электроот-
исходит рост относительной интенсивности поло-
рицательный лиганд (F, Cl, O). Апикофильность
сы конечного продукта 7, при этом уменьшается
лиганда зависит от его электроотрицательности
лиганда, стереоэлектронных эффектов и поля-
интенсивность полосы ν(C=O) исходного амида 1.
ризуемости и, как правило, следует порядку: Cl,
В спектре конечного продукта этой реакции при-
OCOR > F ~ SR > OR, NR2 > Ar > Alk > H [22, 23],
сутствует только низкочастотная полоса ν(C=O)
однако в литературе имеются и примеры наруше-
1607 см-1.
ния этого порядка. Теоретическая оценка апико-
К сожалению, мы не имели возможности для
фильности как уходящей способности апикально-
изучения структуры соединений 5-7 методом РСА,
го заместителя в тригонально-бипирамидальных
соединения выделены в виде масел. Дативная
структурах фосфора и кремния используется при
связь занимает аксиальное положение в координа-
анализе реакций SN2 замещения [24-27]. При те-
ционном узле атома кремния, и в транс-положе-
оретическом исследовании соединений фосфора и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
(ХЛОРМЕТИЛ)АЛКОКСИГАЛОГЕНСИЛАНЫ
1893
кремния в ряду заместителей F, Cl и H было пока-
зи Si-Оi-Pr в изомерах 5б и 9б. Замещение одного
зано, что в изомерах с однотипными экваториаль-
из атомов хлора в экваториальном положении на
ными заместителями атомы хлора в аксиальном
метильную группу [соединение 7, координацион-
положении характеризуются более высокой апи-
ный узел ClMe(i-PrO)CSiO] приводит к значитель-
кофильностью, чем аксиальные атомы фтора [24].
ному увеличению расстояние O→Si до 2.383 Å
Изучение апикофильности заместителей в ряду
в изомере 7а. У изомера 7б расстояние между кар-
(O-Si)-хелатных соединений N-(силилметил)кар-
бонильным атомам кислорода и атомом кремния
боксамидов и родственных соединений вызывает
становится близким к сумме их ван-дер-ваальсо-
интерес и полученные результаты могут быть по-
вых радиусов (3.62 Å [29]) и составляет 3.603 Å,
лезны при изучении их реакционной способности.
что свидетельствует об отсутствии дативного
В этой работе для изомеров N-метил-N-(силил)
связывания.
метилацетамидов 5, 7-9 с заместителями F, Cl,
Согласно значениям относительной энергии
Oi-Pr и Ot-Bu при их различных комбинациях в
ΔE° наибольшая апикофильность 2.35 ккал/моль
аксиальном (ax) или экваториальном (eq) поло-
присуща атому фтора в соединении
5, его
жениях относительно дативной связи C=O→Si
апикофильность в соединении
8 понижается
нами выполнены квантово-химические расчеты
до
2.17 ккал/моль вследствие увеличения
на уровне B3LYP/6-311++G(d,p). Вычисления про-
стерического объема алкоксильного заместителя
водили с использованием программы Gaussian 09
(при прочих равных условиях). Апикофильность
[28] при полной оптимизации геометрии молекул
атома хлора ниже, чем апикофильность атома
и расчете колебательных частот. Принадлежность
фтора и в соединении 9 составляет 1.91 ккал/моль.
стационарных точек к энергетическим минимумам
Изменение экваториального окружения путем за-
доказана положительными значениями гессиана,
мены атома хлора на метильную группу и увеличе-
результаты приведены в табл. 1). Апикофильность
ние стерического объема алкоксильного замести-
аксиального заместителя у более стабильных изо-
теля путем замены Oi-Pr на Ot-Bu (соединение 7)
меров 5а, 7а-9а по отношению к изомерам 5б,
приводит к резкому понижению апикофильности
7б-9б определялась как разность энергий (ΔE° =
атома хлора до 0.35 ккал/моль.
E°а - E°б) с учетом поправки на энергию нулевых
Апикофильность алкоксильных заместителей в
колебаний, когда апикальные (аксиальные) и эква-
соединениях 5, 7-9 представляет собой значение
ториальные заместители меняются положениями.
относительной энергии с обратным знаком (-ΔE°).
Самое короткое расстояние O→Si 2.043 Å в
Отсюда следует, что в этом ряду наибольшей апи-
ряду изомеров, соответствующее наиболее проч-
кофильностью характеризуется заместитель Ot-Bu
ной внутримолекулярной дативной связи, обра-
в соединении 7, а наименьшей - Oi-Pr соединении
зуется в изомере 5а, где атомы фтора находятся в
5. Следует отметить, что в изученных соединениях
аксиальном и экваториальном положениях. Обмен
апикофильность как атомов F и Cl так и алкоксиль-
атома фтора в апикальном положении на группу
ного заместителя зависит от природы экваториаль-
Oi-Pr (изомер 5б) приводит к удлинению дативной
ных заместителей у атома кремния, причем наряду
связи на 0.112 Å. Увеличение стерического объема
с их электроотрицательностью определенное вли-
алкоксильного заместителя в результате замены
яние могут оказывать стерические факторы.
группы Oi-Pr на Ot-Bu, при прочих равных усло-
В заключение отметим, что синтезированные
виях, привело к удлинению дативной связи O→Si
нами (O-Si)-хелатные N-(силилметил)ацетамиды,
как в изомере 8а, так и в изомере 8б по сравне-
содержащие у атома кремния заместители различ-
нию с соответствующими изомерами соединения
ной природы потенциально пригодны в качестве
5. Длина дативной связи O→Si в соединении 9 с
полифункциональных синтонов в синтетической
координационным узлом Cl2(i-PrO)CSiO увели-
органической химии и химии материалов. По-
чивается для каждого изомера по сравнению с
лученные результаты показали, что в отличие от
подобными изомерами соединения 5 с координа-
известных в литературе данных для межмолеку-
ционным узлом F2(i-PrO)CSiO. Однако замена ато-
лярных комплексов кремния [26], апикофильность
мов фтора на атомы хлора не влияет на длину свя-
атома фтора выше апикофильности атома хлора в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1894
ЛАЗАРЕВА и др.
изоструктурных (O-Si)-хелатных N-(силилметил)-
температуре в течение 19 ч. Осадок гидрохлорида
ацетамидах.
триэтиламина отфильтровывали, промывали диэ-
тиловым эфиром, который объединяли с фильтра-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
том. Растворитель удаляли в вакууме. Перегонкой
в вакууме выделяли продукт с т. кип. 147-151°С.
Спектры ЯМР 1H, 13C и 29Si записаны на
Выход 13.48 г (72%), n20 1.4212. ИК спектр (тон-
спектрометре Bruker DPX 400 (400.13, 100.61 и
кий слой), ν, см-1: 630, 700, 740, 800, 890, 1040, 1120,
79.5 МГц соответственно) в CDCl3 с использова-
1160, 1258, 1370, 1450, 2884, 2922, 2965. Спектр
нием ГМДС или циклогексана в качестве внутрен-
ЯМР 1H, δ, м. д.: 0.57 с (3H, Me), 1.23 д (6H, Me2C,
него стандарта. ИК спектры записаны на приборе
3J 6.1 Гц), 2.87 д (1H, SiCHACl, 2JAB 14.3 Гц), 2.96
FT-IR Varian 3100.
д (1H, SiCHBCl, 2JAB 14.3 Гц), 4.29 квинтет (1H,
Все экспериментальные процедуры проводили
Me2CH, 3J 6.1 Гц). Спектр ЯМР 13C, δС, м. д.:
в атмосфере сухого аргона. Коммерчески доступ-
-0.87 (MeSi), 25.54 (ClCH2), 28.19 (Me2C), 67.51
ные (хлорметил)трихлорсилан, метил(хлорметил)
(Me2CH). Спектр ЯМР 29Si: δSi -0.48 м. д. Найдено,
дихлорсилан, эфират трехфтористого бора перед
%: C 32.49; H 6.89. C5H12Cl2OSi. Вычислено, %: C
применением очищали перегонкой. трет-Бута-
32.09; H 6.46.
нол и изопропанол перегоняли и выдерживали
Метил(хлорметил)-трет-бутокси(хлор)си-
2 сут над молекулярными ситами 4Å. Растворите-
лан (4) получали аналогично. Выход 15.25 г (75.8
ли, подготовленные с применением стандартных
ммоль, 85%), т. кип. 43°С (2 мм рт. ст.), n20 1.4274.
методик [30], хранили над молекулярными ситами
ИК спектр (тонкий слой), ν, см-1: 474, 495, 614, 637,
4Å.
658, 686, 733, 797, 812, 842, 910, 1031, 1072, 1190,
(Хлорметил)дифтор(изопропокси)силан
(2).
1244, 1262, 1368, 1393, 1469, 2876, 2906, 2935, 2979.
В тщательно высушенную и продутую сухим ар-
Спектр ЯМР 1H, δ, м. д.: 0.57 с (3H, Me), 1.35 c (9H,
гоном ампулу помещали 12.75 г (50 ммоль) (хлор-
Me3C), 2.83 д (1H, SiCHACl, 2JAB 14.3 Гц), 2.91 д
метил)триизопропоксисилана. Ампулу охлаждали
(1H, SiCHBCl, 2JAB 14.3 Гц). Спектр ЯМР 13C, δС,
до 0°С и добавляли 14.8 г (~110 ммоль, 10% из-
м. д.: 1.06 (MeSi), 30.73 (ClCH2), 31.44 и 31.80
быток) (хлорметил)трифторсилана. Ампулу тща-
(Me3C),
76.06 (Me3C). Спектр ЯМР 29Si: δSi
тельно дегазировали и запаивали. Ампулу вы-
–7.58 м. д. Найдено, %: C 36.05; H 6.93. C6H14Cl2OSi.
держивали при комнатной температуре в течение
Вычислено, %: C 35.82; H 7.03.
15 сут, затем охлаждали и вскрывали. Перегонкой
N-Метил-N-[(изопропоксидифторсилил)ме-
на ректификационной колонке выделяли продукт
тил]ацетамид (5). К раствору N-метил-N-ТМС-
с т. кип. 88-90°С. Выход 14.67 г (56%), n20 1.4328.
ацетамида (1.45 г, 10 ммоль) в 30 мл гексана при
ИК спектр (тонкий слой), ν, см-1: 584, 686, 735, 824,
перемешивании прибавляли раствор силана
2
912, 1091, 1142, 1207, 1328, 1391, 1456, 1658, 2940,
(1.75 г, 10 ммоль) в 30 мл гексана. Реакционную
2978, 3307. Спектр ЯМР 1H, δ, м. д.: 1.11 д (6H,
смесь выдерживали при комнатной температуре
Me2C, 3J 6.2 Гц), 2.88 т (2Н, ClCH2Si, 3J 7.5 Гц),
24 ч. Образуется масляный слой. Растворитель
4.32 квинтет (1H, CHMe2, 3J 6.2 Гц). Спектр ЯМР
декантировали, остаток промывали смесью эти-
13C, δС, м. д.: 20.27 т (ClCH2Si, 2J 29.8 Гц), 24.35
лацетат-диэтиловый эфир (1:1, 2×3 мл) и вакуу-
(Me2C), 64.78 (Me2C). Спектр ЯМР 29Si, δSi, м. д.:
мировали до постоянной массы. Выход 1.46 г
-67.96 т (J 266.9 Гц). Найдено, %: C 27.92; H 5.58.
(69%), белый порошок, т. разл. >100°C. ИК спектр
C4H9ClF2OSi. Вычислено, %: C 27.51; H 5.19.
(тонкий слой), ν, см-1: 476, 496, 610, 645, 676, 704,
Метил(хлорметил)изопропоксихлорсилан
762, 787, 858, 892, 919, 994, 1043, 1122, 1151, 1174,
(3). К раствору метил(хлорметил)дихлорсила-
1228, 1255, 1370, 1424, 1527, 1609, 1661, 2852, 2929,
на (16.4 г, 100 ммоль) и триэтиламина (11.1 г,
2975, 3465, 3619. Спектр ЯМР 1H, δ, м. д.: 1.19 д
100 ммоль) в диэтиловом эфире (200 мл) при 5°С
(6H, Me2C, 3J 6.1 Гц), 2.24 с [3H, MeC(O)], 2.48
был добавляли по каплям раствор изопропанола
c (2H, NCH2Si), 3.17 c (3H, MeN), 4.35 квинтет
(6.00 г, 100 ммоль) в 50 мл диэтилового эфира. Ре-
(1H, CHMe2, 3J 6.1 Гц). Спектр ЯМР 13C, δC, м. д.:
акционную смесь перемешивали при комнатной
16.55 [MeC(O)], 25.21 (Me2C), 35.03 т (NCH2Si, 2J
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
(ХЛОРМЕТИЛ)АЛКОКСИГАЛОГЕНСИЛАНЫ
1895
37.6 Гц), 36.82 (MeN), 65.58 (Me2C), 173.34 (C=O).
КОНФЛИКТ ИНТЕРЕСОВ
Спектр ЯМР 29Si, δSi, м. д.: -100.26 т (J 223.9). Най-
Авторы заявляют об отсутствии конфликта
дено, %: C 39.55; H 7.02, N 6.74. C7H15F2NO2Si.
интересов.
Вычислено, %: C 39.79; H 7.16; N 6.63.
N-Метил-N-[(метилизопропоксихлорсилил)-
СПИСОК ЛИТЕРАТУРЫ
метил]ацетамид (6) получали аналогично. Выход
1.
George P.D., Prober M., Eliott J.R. // Chem. Rev. 1956.
90%, желтоватое масло. ИК спектр (тонкий слой),
Vol. 56. N 6. P. 1065. doi 10.1021/cr50012a001
ν, см-1: 433, 468, 531, 608. 636, 647, 710, 780. 790,
2.
Lawrence N.J. In: Science of Synthesis / Ed. I. Fleming.
857, 912, 1008, 1058, 1148, 1190, 1256, 1366, 1409,
Stuttgart: Georg Thieme Verlag, 2002. Vol. 4. P. 579.
1524, 1573, 1607, 1636, 1682, 2823, 2974. Спектр
3.
Kobayashi T., Pannell K.H. // Organometallics. 1990.
ЯМР 1H, δ, м. д.: 0.52 с (3H, Me), 1.16 д (6H, Me2C,
Vol. 9. N 8. P. 2201. doi 10.1021/om00158a012
4.
Kobayashi T., Pannell K.H. // Organometallics. 1991.
3J 6.1 Гц), 2.27 с [3H, MeC(O)], 2.73 c (2H, NCH2Si),
Vol. 10. N 6. P. 1960. doi 10.1021/om00052a049
3.22 c (3H, MeN), 4.41 квинтет (1H, Me2CH, 3J 6.1
5.
Daiss J.O., Barth K.A., Burschka C., Hey P.,
Гц). Спектр ЯМР 13C, δC, м. д.: 6.34 (MeSi), 16.28
Reiner llg., Klemm K., Richter I., Wagner S.A.,
[MeC(O)], 24.61 (Me2C), 36.48 (NCH2Si),
42.63
Tacke R. // Organometallics. 2004. Vol. 23. N 22. P.
(MeN), 65.06 (Me2C), 172.96 (C=O). Спектр ЯМР
5193. doi 10.1021/om040086v
29Si: δSi -19.09 м. д. Найдено, %: C 43.15; H 8.37;
6.
Troegel D., Lippert W.P., Möller F., Burschka C.,
N 6.04. C8H18ClNO2Si. Вычислено, %: C 42.94; H
Tacke R. // J. Organomet. Chem. 2010. Vol. 695.
8.11; N 6.26.
N 12-13. P. 1700. doi 10.1016/j.jorganchem.2010.03.024
7.
Шипов А.Г., Крамарова Е.П., Артамкина О.Б., Ов-
N-Метил-N-[(метил(трет-бутокси)хлорси-
чинников Ю.Е., Бауков Ю.И. // ЖОХ. 1997. Т. 67.
лил)метил]ацетамид (7) получали аналогично.
№ 10. C. 1680; Shipov A.G., Kramarova E.P., Artamki-
Выход 94%, желтоватое масло. ИК спектр (тон-
na O.B., Ovchinnikov Yu.E., Baukov Yu.I. // Russ. J.
кий слой), ν, см-1: 433, 468, 531, 608. 636, 647, 710,
Gen. Chem. 1997. Vol. 67. N 10. P. 1580.
780. 790, 857, 912, 1008, 1058, 1148, 1190, 1256,
8.
Shen Q.H., Iterrante L.V. // J. Polym. Sci. (A).
1997. Vol. 35. N 15. P. 3193. doi 10.1002/
1366, 1409, 1524, 1573, 1607, 1636, 1682, 2823,
(SICI)1099-0518(19971115)35:15<3193::AID-
2974. Спектр ЯМР 1H, δ, м. д.: 0.43 с (3H, Me),
POLA12>3.0.CO;2-6
1.30 с (9H, Me3C), 2.26 с [3H, MeC(O)], 2.82 c (2H,
9.
Jin Y., Pu Q., Fan H. // ACS Appl. Mater. Interfaces.
NCH2Si), 3.21 c (3H, MeN). Спектр ЯМР 13C, δC,
2015. Vol. 7. N 14. P. 7552. doi 10.1021/am5088743
м. д.: 2.55 (MeSi), 20.30 [MeC(O)], 31.33 (Me3C),
10.
Li J., Du M., Zhao Z., Liu H. // Macromolecules. 2016.
36.83 (NCH2Si), 42.83 (MeN), 71.29 (Me3C), 172.92
Vol. 49. N 2. P. 445. doi 10.1021/acs.macromol.5b02142
(C=O). Спектр ЯМР Si: δSi -16.84 м. д. Найдено, %:
11.
Zhiltsov A.S., Boldyrev K.L., Gorbatsevitch O.B.,
C 45.86; H 8.67; N 6.11. C9H20ClNO2Si. Вычислено,
Kazakova V.V., Demchenko N.V., Cherkaev G.V.,
Muzafarov A.M. // Silicon. 2015. Vol. 7. N 2. P. 165.
%: C 45.46; H 8.48; N 5.89.
doi 10.1007/s12633-014-9229-8
ИНФОРМАЦИЯ ОБ АВТОРАХ
12.
Kimura T., Shimizu T., Kanamori K., Maeno A., Kaji H.,
Nakanishi K. // Langmuir. 2017. Vol. 33. N 48. P.13841.
Лазарева Наталья Федоровна, ORCID: https://
doi 10.1021/acs.langmuir.7b03013
orcid.org/0000-0003-0877-9656
13.
Lazar M.M., Varganici C.-D., Cazacu M., Dragan E.S. //
J. Appl. Polym. Sci. 2016. Vol. 133. N 37. 43942. doi
Чипанина Нина Николаевна, ORCID: https://
10.1002/APP.43942
orcid.org/ 0000-0001-6073-1786
14.
Liu J., Kigure M., Okawa R., Takeda N., Unno M.,
Ознобихина Лариса Петровна, ORCID: https://
Ouali A. // Dalton Trans. 2021. Vol. 50. N 10. P. 3473.
orcid.org/0000-0003-0499-4842
doi 10.1039/d1dt00042j
15.
Воронков М.Г. // Изв. АН СССР. Cер. хим. 1991. № 12.
БЛАГОДАРНОСТЬ
С. 2664; Voronkov M.G. // Russ. Chem. Bull. 1991.
Vol. 40. N 12. P. 2319. doi 10.1007/BF00959700
Работа выполнена с использованием аналити-
16.
Chuit C., Corriu R.J.P., Reye C., Young J.C. //
ческого оборудования Байкальского центра кол-
Chem. Rev. 1993. Vol. 93. N 4. P. 1371. doi 10.1021/
лективного пользования СО РАН.
cr00020a003
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1896
ЛАЗАРЕВА и др.
17.
Воронков М.Г., Пестунович В.А., Бауков Ю.И. //
27.
Liang J., Wang Y., Liu L. // J. Chin. Chem. Soc. 2018.
Металлoорг. xим. 1991. Т. 4. № 6. С. 1210.
Vol. 65. N 10. P. 1179. doi 10.1002/jccs.201700421
18.
Негребецкий В.В., Бауков Ю.И. // Изв. АН. Cер. хим.
28.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
1997. № 11. С. 1807; Negrebetsky V.V., Baukov Yu.I. //
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
Russ. Chem. Bull. 1997. Vol. 46. N. 11. P. 1807. doi
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
10.1007/BF02503766
19.
Lazareva N.F., Chipanina N.N., Oznobikhina L.P,
Li X., Hratchian H.P., Izmaylov A.F., Bloino J.,
Shainyan B.A. // J. Organomet. Chem. 2018. Vol. 876.
Zheng G., Sonnenberg J.L., Hada M., Ehara M.,
P. 66. doi 10.1016/j.jorganchem.2018.09.007
Toyota K., Fukuda R., Hasegawa J., Ishida M.,
20.
Kalikhman I.D., Albanov A.I., Bannikova O.B.,
Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T.,
Belousova L.I., Voronkov M.G., Pestunovich V.A.,
Montgomery J.A., Peralta J.E., Ogliaro F., Bear-
Shipov A.G., Kramarova E.P., Baukov Yu. I. // J.
Organomet. Chem. 1989. Vol. 361. N 2. P. 147. doi
park M., Heyd J.J., Brothers E., Kudin K.N., Starove-
10.1016/0022-328X(89)85379-3
rov V.N., Kobayashi R., Normand J., Raghavachari K.,
21.
Lazareva N.F, Chipanina N.N, Oznobikhina L.P,
Rendell A., Burant J.C., Iyengar S.S., Tomasi J.,
Shainyan B.A. // J. Organomet. Chem. 2016. Vol. 824.
Cossi M., Rega N., Millam N.J., Klene M.,
P. 48. doi 10.1016/j.jorganchem.2016.09.028
Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramil-
22.
Corriu R.J.P., Kpoton A., Poirier M., Royo G., De
Saxce A., Young J.C. // J. Organomet. Chem. 1990.
lo J., Gomperts R., Stratmann R.E., Yazyev O.,
Vol. 395. N. 1. P 1. doi 10.1016/0022-328X(90)85258-Z
Austin A.J., Cammi R., Pomelli C., Ochterski J.W.,
23.
Corriu R.J.P., Poirier M., Royo G. // J. Organomet.
Martin R.L., Morokuma K., Zakrzewski V.G.,
Chem. 1982. Vol. 233. N 2. P. 165. doi 10.1016/S0022-
Voth G.A., Salvador P., Dannenberg J.J., Dapprich S.,
328X(00)82695-9
Daniels A.D., Farkas O., Foresman J.B., Ortiz J.V.,
24.
Deiters J.A., Holmes R.R., Holmes J.N. // J. Am.
Chem. Soc. 1988. Vol. 110. N 23. P.7672. doi 10.1021/
Cioslowski J., Fox D.J. Gaussian 09, Revision E.01;
ja00231a015
Gaussian, Inc.: Wallingford,CT, 2009.
25.
Wladkowski B.D., Krauss M., Stevens W.J. // J. Phys.
29.
Bondi A. // J. Phys. Chem. 1964. Vol. 68. N 3. P. 441.
Chem. 1995. Vol. 99. N 13. P. 4490. doi 10.1021/
doi 10.1021/j100785a001
j100013a019
30.
Armarego W.L.F., Chai C.L.L. Purification of Laboratory
26.
Leiding J., Woon D.E., Dunning T.H. // Theor. Chem.
Acc. 2014. Vol. 133. N 2. P.1428. doi 10.1007/s00214-
Chemicals. Butterworth-Heinemann: Elsevier, 2009.
013-1428-7
752 p.
(Chloromethyl)alkoxyhalogenosilanes in Reaction
with N-Trimethylsilyl-N-methylacetamide
N. F. Lazareva*, N. N. Chipanina, A. S. Soldatenko, and L. P. Oznobikhina
Favorsky Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences, Irkutsk, 664033 Russia
*e-mail: nataly_lazareva@irioch.irk.ru
Received August 31, 2021; revised August 31, 2021; accepted September 18, 2021
The reaction of N-trimethylsilyl-N-methylacetamide with polyfunctional silanes, namely methyl(chloromethyl)
alkoxychlorosilanes and (chloromethyl)difluoro(isopropoxy)silane, was studied. Structure of the synthesized
(O-Si)-chelates was studied by the quantum chemistry methods. Data on the apicophilicity of fluorine and
chlorine atoms in these compounds were obtained.
Keywords: methyl(chloromethyl)alkoxychlorosilanes, (chloromethyl)difluoro(isopropoxy)silane, N-trimethyl-
silyl-N-methylacetamide, apicophilicity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021