ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 12, с. 1954-1961
УДК 547.593.212
СИНТЕЗ, СТРОЕНИЕ И ГЕМОРЕОЛОГИЧЕСКАЯ
АКТИВНОСТЬ ПЕНТАЗАМЕЩЕННОГО
ЦИКЛОГЕКСАНОЛА
© 2021 г. И. В. Паламарчукa, З. Т. Шульгауb,*, Ш. Д. Сергазыb, А. М. Жуликееваb,
Ю. В. Гатиловc, И. В. Кулаковa
a Тюменский государственный университет, Тюмень, 625003 Россия
b Республиканское государственное предприятие «Национальный центр биотехнологии» Комитета науки
Министерства образования и науки Республики Казахстан, ш. Кургальжинское 13/5, Нур-Султан, 010000 Казахстан
с Новосибирский институт органической химии имени Н. Н. Ворожцова Сибирского отделения Российской
академии наук, Новосибирск, 630090 Россия
*e-mail: shulgau@biocenter.kz
Поступило в Редакцию 13 сентября 2021 г.
После доработки 15 ноября 2021 г.
Принято к печати 17 ноября 2021 г.
Реакцией халкона (бензилиденацетофенона) в растворе ДМСО в присутствии KOH получен продукт
внутримолекулярной конденсации аддукта взаимодействия двух молекул халкона и ацетофенона по
реакции Михаэля - (4-гидрокси-2,4,6-трифенилциклогексан-1,3-диил)бис(фенилметанон). Строение
синтезированного производного доказано методами ЯМР 1Н, 13С, масс-спектрометрии и рентгенострук-
турного анализа. Показано, что производное циклогексанола обладает гемореологическими свойствами,
а именно способно препятствовать росту вязкости цельной крови при формировании синдрома повы-
шенной вязкости крови в условиях in vitro.
Ключевые слова: внутримолекулярная циклизация, реакция Михаэля, халкон, производное циклогек-
санола, рентгеноструктурный анализ, гемореологическая активность
DOI: 10.31857/S0044460X21120155
Ранее нами был предложен способ получе-
ния антиоксидантной активности, превышающие
ния труднодоступных (и в литературе практиче-
стандарт - Тролокс (синтетический аналог вита-
ски неописанных) 4-арил-(гетарил-)замещенных
мина Е) и аскорбиновую кислоту [1, 2].
3-аминопиридин-2(1Н)-онов 6a-в, основанный на
С целью возможного упрощения схемы превра-
внутримолекулярнойциклизацииN-(3-оксоалкенил)-
щений и выбора менее токсичных реагентов для
амидов [1] (схема 1).
нас представлял интерес также поиск новых спосо-
Этот способ позволил нам получать в доста-
бов получения 3-аминопиридонов. Так, например,
точных количествах для последующих химиче-
в работе [3] была показана возможность альтер-
ских исследований ряд 4-замещенных 3-амино-
нативного получения 3-амино-6-метил-4-фенил-
пиридин-2(1Н)-онов
6a-в из соответствующих
пиридин-2(1Н)-она 6б (схема 2). Взаимодействи-
1,3-дикетонов
1a-в. Кроме того, биоскрининг
ем 2-цианоацетамида 8 с бензилиденацетоном
приведенных соединений и их N-арилметильных
7 в ДМСО, содержащем трет-бутилат калия,
производных на антирадикальную активность (в
синтезирован
6-метил-4-фенил-3-цианопири-
двух тестах) выявил у них очень высокие значе-
дин-2(1Н)-он 9, который кислотным гидролизом
1954
СИНТЕЗ, СТРОЕНИЕ И ГЕМОРЕОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1955
Схема 1.
R
R
O
AcONH4, PhH, ∆
ClCH2C(O)Cl
O
O
NH
-H2O
Cl
O
NH2
O
1а-в
2а-в
3а-в
ClCH2CONH2
pTSA, PhH, ∆, 24 ч
R
R
R
Cl
O
N
N2H4⋅H2O
NH2
Py
–H2O
∆, 3 ч
BuOH, ∆, 5 ч
Cl
NH
N
O
N
O
N
H
H
O
5а-в
6а-в
4а-в
R = Me (a), Ph
(б),
(в).
S
Схема 2.
Ph
Ph
Ph
CN
t-BuOK, [O]
CN
H2O
CONH2
+
ДМСО
H2SO4
O H2N O
N
O
N
O
H
H
7
8
9
10
Ph
Ph
1.NaOH
Cl2
H
2. H+
NH2
N
Ca(OH)2
O
EtOH
H2O
N O
N
O
H
11
6б
был превращен в 6-метил-2-оксо-4-фенил-1,2-ди-
был превращен в целевой 3-амино-6-метил-4-фе-
гидропиридин-3-карбоксамид 10. Далее по ре-
нилпиридин-2(1Н)-он 6б.
акции Гофмана действием хлорной извести был
В связи с этим, нами были осуществлены но-
получен
5-метил-7-фенилоксазоло[5,4-b]пири-
вые попытки синтеза производных 3-аминопири-
дин-2(1H)-он 11, который при нагревании с NaOH
дин-2(1Н)-она по аналогичной схеме, но вместо
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1956
ПАЛАМАРЧУК и др.
Схема 3.
Ph
NO2
Ph
N
O
H
Ph
NaNO2
Cl
14
KOH, [O]
+
ДМСО
OH
Ph
H2N O
Ph
O
Ph
12
13
PhOC
COPh
15
Ph
бензальацетона 7 был взят более доступный хал-
254-256°С, элементный анализ которого показал
кон 12, а вместо амида циануксусной кислоты 8
полное отсутствие в структуре атома азота, т. е. ис-
также более доступный 2-хлорацетамид 13 и ни-
ходный хлорацетамид 13 не прореагировал с хал-
трит натрия [в надежде, что в процессе реакции
коном 12 по предполагаемому нами направлению
в растворе ДМСО произойдет нуклеофильное за-
реакции. Дополнительно проведенные масс-спек-
мещение атома хлора на нитрогруппу и приведет
трометрические исследования высокого разреше-
по аналогии схемы 2 к получению 3-нитропири-
ния выявили пик интенсивного иона с высоким
значением m/z 518.2240 (как потом оказалось [М+ -
дин-2(1Н)-она 14] (схема 3), из которого было бы
легко восстановлением получить соответствую-
Н2О]) и брутто-формулой C38H30O2, а проведенные
ЯМР 1H, 13C спектральные исследования вещества
щий 3-аминопиридин-2(1Н)-он 6б.
подтвердили наличие пяти фенильных замести-
Однако обработка реакционной смеси показала,
телей (двадцать пять ароматических протонов) и
что в качестве основного продукта реакции было
мультиплетную систему из шести алифатических
выделено белое кристаллическое вещество с т. пл.
протонов в области 2.22-4.47 м. д. И только прове-
денный дополнительно рентгеноструктурный ана-
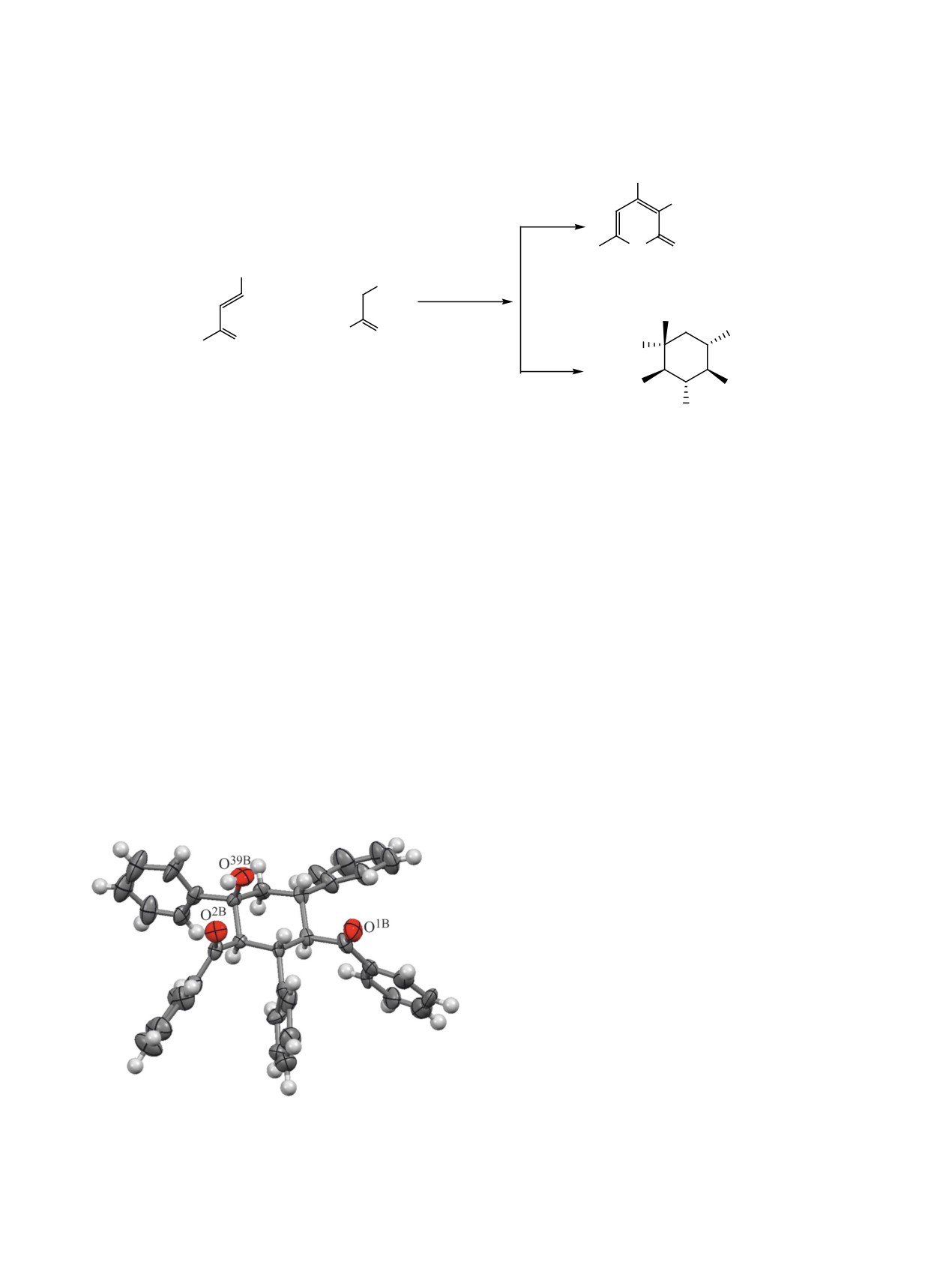
лиз выращенных кристаллов однозначно показал,
что выделенное соединение 15 является пентаза-
мещенным производным циклогексанола с пятью
хиральными центрами (рис. 1).
Таким образом, в условиях щелочного катали-
за произошла не ожидаемая нами циклизация вы-
бранных реагентов в пиридоновое ядро, а превра-
щения исходного субстрата - халкона. Проведение
холостого опыта, без хлорацетамида и нитрита
натрия в аналогичных условиях также привела к
продукту 15, что подтверждает независимость их
влияния на реакцию при комнатной температуре.
Полученное производное циклогексанола
15
Рис. 1. Общий вид молекулы производного циклогек-
было получено ранее из бензальдегида и ацетофе-
санола 15.
нона в отсутствие растворителя, либо из соответ-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
СИНТЕЗ, СТРОЕНИЕ И ГЕМОРЕОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1957
Схема 4.
O Ph
O
Ph
O O
PhOC
COPh
NaOH, K2CO
3
Ph
Ph
+
+
Ph
Ph
Ph
OH
Ph
O
16 (<5%)
15 (91%)
O
O
O Ph
O
Ph
PhOC
COPh
Ph
Ph
+
NaOH, K2CO3
(тв.)
Ph
Ph
Ph
12
OH
Ph
O
16 (12%)
15 (36%)
ствующего халкона и ацетофенона в присутствии
(1R,2S,3R,4S,6S)-изомера с более высокой темпе-
твердой гидроокиси натрия и K2CO3 (схема 4) [4].
ратурой плавления (254-256°С). Образование три-
При этом авторы с разным выходом выделяли и
кетона Костанецкого 16 в наших условиях прове-
промежуточный продукт реакции - трикетон Ко-
дения синтеза мы не фиксировали.
станецкого 16, который был дополнительно оха-
Подобные превращения халконов (с первона-
рактеризован ими рентгеноструктурным анализом.
чальным присоединением по Михаэлю метиле-
Однако перекристаллизованный и охарактери-
новой группы по активированной двойной связи
зованный авторами пентазамещенный циклогек-
халкона) в основной среде в производное цикло-
санол 15 имел температуру плавления 188-190°С,
гексанола описаны в работе [9], где на примере
что, вероятно, соответствовало смеси всех воз-
взаимодействия двукратного избытка бензальаце-
можных энантиомерных форм.
тона 17 и малонодинитрила 18 показано образова-
Однако авторы [4] приводят также ряд лите-
ние промежуточного соединения 19 (не выделен-
ратурных ссылок, в которых описываются про-
ного, кстати, авторами в чистом виде), близкого по
тиворечивые данные по синтезу трикетона Ко-
структуре нашему производному 15 (схема 5).
станецкого 16, охарактеризованного с разными
Вероятно, в нашем случае образование произ-
температурами плавления (т. пл. 256°С [5, 6] и
водного циклогексанола 15 произошло по анало-
189°С [7]). Но позже в работе [8] структура соеди-
гичной схеме, с распадом одной молекулы халкона
нения с т. пл. 189°С была установлена как 2,4-ди-
на исходные бензальдегид и ацетофенон, сшивкой
бензоил-1,3,5-трифенилциклогексанол
15, в то
двух молекул халкона по Михаэлю, затем присое-
время как структура соединения с т. пл. 256°С так
динение по Михаэлю СН-кислотного протона ме-
и не была выяснена.
тиленовой группы этого аддукта по двойной связи
Выделенный нами первоначально продукт ре-
енольной формы ацетофенона и последующим за-
акции 15, также имел более низкую температу-
мыканием в цикл также присоединением по Ми-
ру плавления (134-150°С). Но многократная его
хаэлю метинового протона при гидроксильной
перекристаллизация и медленное выращивание
группе по оставшейся активированной двойной
кристаллов для последующего РСА позволили
связи (схема 6). Так, проведение холостого опыта
выделить и охарактеризовать пространствен-
в присутствии ацетофенона также привело к полу-
ную конфигурацию, вероятно, более выгодного
чению продукта циклизации 15. Отсутствие после
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1958
ПАЛАМАРЧУК и др.
Схема 5.
Ph
Ph
O
KOH, EtOH
2
NC
+ NC CN
70-80°C
O
O
NC
17
18
Ph
Ph
Ph O
NC
Ph
NC
O
Ph
N
OH
H
19
O
Схема 6.
O Ph
Ph
O Ph
Ph
Ph
O
Ph
O
KOH, ДМСО
H
Ph
25°C
Ph
O
CH2
Ph
Ph
Ph
HO
-PhCHO
O Ph
Ph
Ph
PhOC
COPh
Ph
O
HO
Ph
Ph
Ph
C
Ph
H
OH
2
15
окончания реакции в реакционной среде даже сле-
гемореологической активности в условиях модели
довых количеств ацетофенона однозначно свиде-
синдрома повышенной вязкости крови in vitro. В
тельствовало об его непосредственном участии в
экспериментах по исследованию гемореологиче-
механизме реакции.
ской активности установлено, что инкубирование
С целью возможного установления биологи-
крови в течение 60 мин при 43°С приводит к до-
ческой активности полученного производного
стоверному повышению вязкости крови по срав-
циклогексанола 15, нами проведено исследование
нению с исходными значениями вязкости крови
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
СИНТЕЗ, СТРОЕНИЕ И ГЕМОРЕОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1959
Таблица 1. Влияние соединения 15 на вязкость крови при различной скорости вращения шпинделя на модели гипер-
вязкости крови in vitroа
Вязкость крови при различной скорости вращения шпинделя (скорости сдвига, об/мин), мПа·с
Соединение
60 (450)
40 (300)
20 (150)
12 (90)
8 (60)
6 (45)
4 (30)
2 (15)
Холостой опыт
2.18±0.04
2.25±0.05
2.34±0.06
2.59±0.11
3.01±0.10
3.16±0.07
3.50±0.14
4.00±0.27
(n = 6)
Контроль
2.59±0.09
2.81±0.10
3.23±0.15
3.81±0.18
4.29±0.15
4.67±0.17
5.27±0.23
6.72±0.35
p1 0.0076
p1 0.0019
p1 0.0007
p1 0.0004
p1 0.00002
p1 0.00001
p1 0.0001
p1 0.0001
15 (n = 12)
2.43±0.08
2.77±0.14
3.03±0.16
3.40±0.16
3.79±0.13
4.19±0.12
4.70±0.12
5.78±0.20
p1 0.0529
p1 0.0223
p1 0.0078
p1 0.0037
p1 0.0015
p1 0.00003
p1 0.00001
p1 0.0001
p2 0.2078
p2 0.8561
p2 0.3547
p2 0.1126
p2 0.0187
p2 0.0287
p2 0.0436
p2 0.0340
а n - количество проб в группе; p - уровень значимости; p1 < 0.05 - статистически значимые различия по сравнению с исходны-
ми значениями; p2 < 0.05 - статистически значимые различия по сравнению с соответствующими значениями в контрольных
пробах.
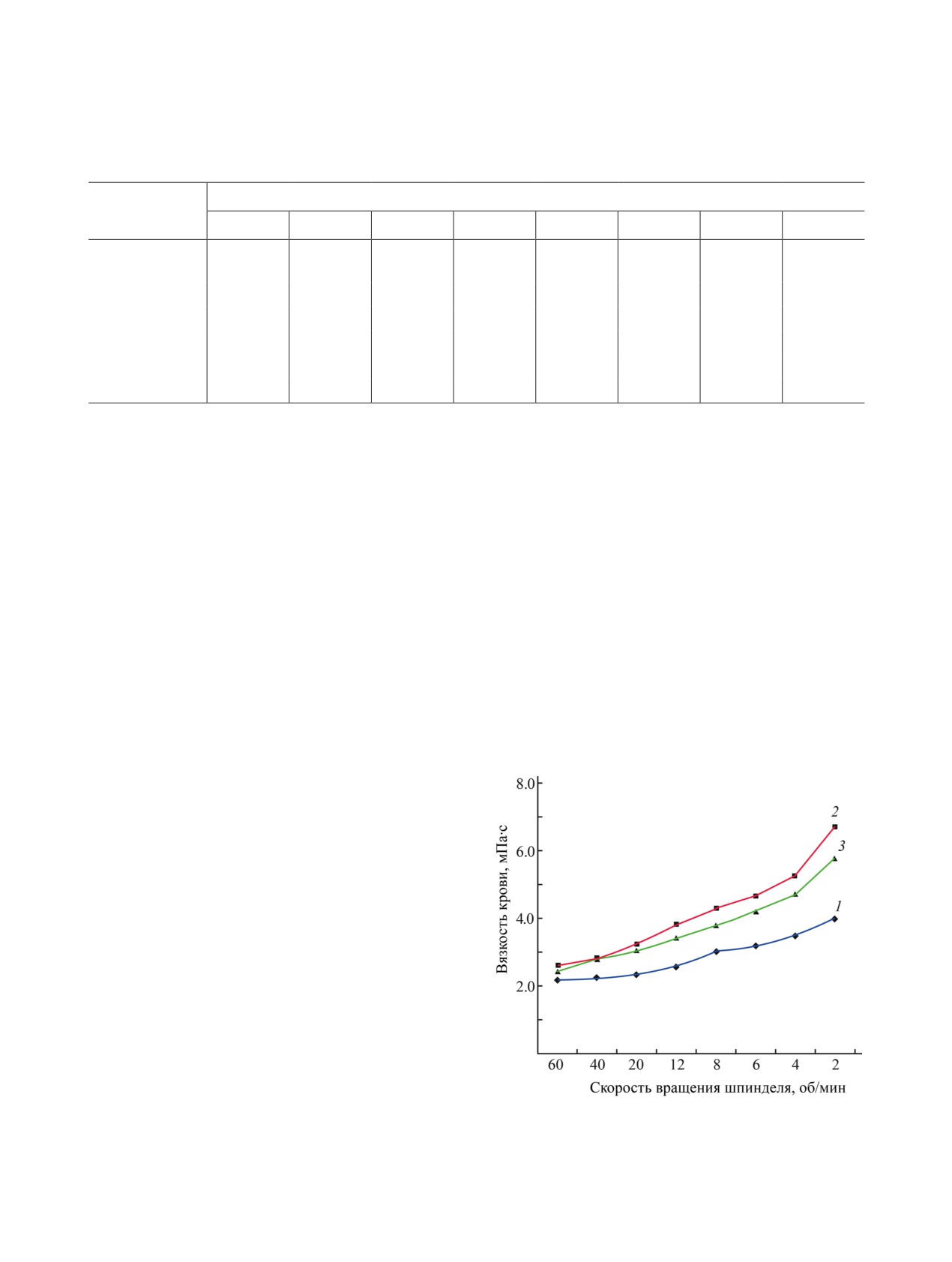
при различной скорости вращения шпинделя от 2
ветственно) в CDCl3, внутренний стандарт - ТМС.
до 60 об/мин, что свидетельствует о формирова-
Масс-спектры и точные измерения молекулярных
нии гипервязкости крови.
масс производили на масс-спектрометре высоко-
Образец соединения 15, добавленный в пробы
го разрешения Thermo Eletctron Double Focusing
крови в конечной концентрации 10-5 г/мл крови,
System (DFS, Thermo Eletctron Corp., США).
препятствовал росту вязкости крови в сравнении с
Температуру плавления определяли на приборе
контрольными значениями при разных скоростях
Stuart™ Digital Melting Point Apparatus, SMP10
вращения шпинделя, причем на низких скоростях
Model. Рентгеноструктурный анализ проводили
вращения это различие носит достоверный харак-
на дифрактометре Bruker KAPPA APEX II [MoKα-
тер (рис. 2, табл. 1).
Таким образом, нами показано, что межмолеку-
лярная реакция халкона (бензилиденацетофенона)
в растворе ДМСО в присутствии KOH приводит
к продукту внутримолекулярной конденсации
образующегося первоначально аддукта взаимо-
действия двух молекул халкона и ацетофенона по
реакции Михаэля - пентазамещенному 2,4-ди-
бензоил-1,3,5-трифенилциклогексанолу. Методом
РСА установлена пространственная конфигура-
ция, вероятно, более выгодного (1R,2S,3R,4S,6S)-
изомера. Полученное производное циклогексано-
ла обладает гемореологическими свойствами, т. е.
способно препятствовать росту вязкости цельной
крови при формировании синдрома повышенной
вязкости крови в условиях in vitro.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1H и 13С зарегистрированы на
Рис. 2. Гемореологическая активность соединения 15.
1 - Исходная вязкость, 2 - контроль, 3 - соединение 15.
приборе Jeol JNM-ECA 400 (400 и 100 МГц соот-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
1960
ПАЛАМАРЧУК и др.
излучение, графитовый монохроматор, детектор
определяли исходную вязкость крови, а затем про-
CCD, 296(2) K].
бы крови инкубировали с испытуемым веществом
при 43°С в течение 60 мин и затем производили из-
Кристаллографические данные: кристал-
мерение исследуемых показателей. Кровь инкуби-
лы моноклинные, пространственная группа
ровали с исследуемыми объектами, растворенны-
P21, a 12.0340(11), b 24.239(3), c 24.313(2) Å, β
ми в ДМСО, конечная концентрация соединения
102.538(4)°, V 6922.8(12) Å3, Z 8, 24016 независи-
15 составляла 10-5 г/мл крови. Контролем служили
мых отражений с θ < 25.2°, wR2 0.4201 для всех
пробы крови, в которые добавляли растворитель
отражений, R 0.1318 для 10431 отражений с I > 2σ,
ДМСО в эквиобъемном количестве. Инкубация
S 1.225 (CCDC 2115136).
крови в течение 1 ч в этих условиях сопровожда-
[(1R,2S,3R,4S,6S)-4-Гидрокси-2,4,6-трифе-
лась формированием гипервязкости крови [10].
нилциклогексан-1,3-диил]бис(фенилметанон).
Исходную вязкость крови от каждого животного
К смеси 1.0 г. (4.8 ммоль) халкона в 10 мл ДМСО
измеряли однократно, вязкость крови после инку-
добавляли 0.27 г (4.8 ммоль) KОН. Реакционную
бации измеряли в двух пробах от каждого живот-
смесь перемешивали при 25°С в течение 24 ч. По
ного как в контрольных, так и в опытных пробах.
окончании реакции смесь обрабатывали ледяной
Статистическую обработку результатов проводили
водой (150 мл), полученный раствор подкисляли
с использованием программы Excel. Полученные
соляной кислотой до pH 5. Образовавшийся осадок
результаты представлены в виде «среднее значе-
отфильтровывали, промывали дистиллированной
ние±стандартная ошибка среднего значения».
водой и сушили на воздухе. После перекристал-
Все исследовательские работы с лабораторны-
лизации из смеси 2-пропанол-хлороформ (1:1)
ми животными выполняли в соответствии с обще-
получили 365 мг (42%) мелкокристаллического
принятыми этическими нормами по обращению
порошка белого цвета с т. пл. 254-256°С. Спектр
с животными, на основе стандартных операцион-
ЯМР 1Н (СDCl3), δ, м. д.: 2.24 д. д (1H, CH2а, J 14.0,
ных процедур, которые соответствуют правилам,
3.6 Гц), 2.51 д. т (1H, CH2b, J 13.2, 2.5 Гц), 4.05 д. т
принятым Европейской Конвенцией по защите
(1H, CH-Ph, J 11.6, 3.6 Гц), 4.13-4.25 м (2H, CH-Ph,
позвоночных животных, используемых для иссле-
CH-Bz,), 4.49 д (1Н, CH-Bz, J 11.0 Гц), 5.40 с (1H,
довательских и иных научных целей (Страсбург,
ОН), 6.69 т (1H, Н4, Ph, J 7.3 Гц), 6.8 т (2 H, Н3,5,
1986). Протокол исследования проекта «Поиск
Ph, J 7.6 Гц), 6.93-7.27 м (20H, Н2,6, Ph + H2-6,
средств фармакологической коррекции синдрома
Ph + H3-5, Bz), 7.53 д (2Н, Н2,6, Bz, J 7.3 Гц). Спектр
повышенной вязкости крови, ассоциированного с
ЯМР 13С, δС, м. д.: 43.3, 45.8, 48.0, 56.7 (2C), 75.3,
эндокринной патологией» одобрен 01 августа 2019
124.8 (2C), 126.7, 126.9, 127.0, 127.3 (2C), 127.5
года Локальной этической комиссией Республи-
(2C), 127.7 (6C), 127.9 (2C), 128.0 (2C), 128.2 (2C),
канского государственного предприятия «Нацио-
128.3 (2C), 131.8, 132.7, 138.0, 138.6, 138.9, 142.0,
нальный центр биотехнологии» Комитета науки
145.8, 203.6, 207.2. Масс-спектр, m/z:
518.2246
Министерства образования Республики Казахстан.
[M - H2O]+ (вычислено для C38H30O2+: 518.2240).
Изучение гемореологических эффектов иссле-
ИНФОРМАЦИЯ ОБ АВТОРАХ
дуемого вещества осуществляли в условиях моде-
Шульгау Зарина Токтамысовна, ORCID: https://
ли синдрома повышенной вязкости крови in vitro.
orcid.org/0000-0001-8148-0816
Синдром повышенной вязкости крови в условиях
Кулаков Иван Вячеславович, ORCID: https://
in vitro воспроизводили инкубацией крови при
orcid.org/0000-0001-5772-2096
43°С в течение 60 мин. Вязкость крови измеряли
на ротационном вискозиметре Brookfield DV2T
БЛАГОДАРНОСТЬ
при различных скоростях вращения шпинделя (60,
40, 20, 12, 8, 6, 4, 2 об/мин). Исследования гемо-
Спектрофотометрические исследования прове-
реологической активности образца соединения
дены с использованием оборудования Центра кол-
15 проведены на 6 крысах-самках линии Wistar,
лективного пользования «Рациональное природо-
12-недельного возраста, массой тела 220-240 г.
пользование и физико-химические исследования»
После забора крови у лабораторных животных
Тюменского государственного университета.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021
СИНТЕЗ, СТРОЕНИЕ И ГЕМОРЕОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1961
ФОНДОВАЯ ПОДДЕРЖКА
3. Шацаускас А.Л., Абрамов А.А., Сайбулина Э.Р., Па-
ламарчук И.В., Кулаков И.В., Фисюк А.С. // ХГС.
Работа выполнена при финансовой поддержке
2017. Т. 53. № 2. С 186; Shatsauskas А.L., Abra-
Комитета науки Министерства образования и на-
mov A.A., Saibulina E.R., Palamarchuk I.V., Kula-
уки Республики Казахстан (грант «Поиск средств
kov I.V., Fisyuk A.S. // Chem. Heterocycl. Compd. 2017.
фармакологической коррекции синдрома повы-
Vol. 53. P. 186. doi 10.1007/s10593-017-2038-4
шенной вязкости крови, ассоциированного с эндо-
4. Shan Z., Hu X., Hu L., Peng X. // Helv. Chim. Acta.
2009. Vol. 92. P. 1102. doi 10.1002/hlca.200800413
кринной патологией», ИРН AP09058121).
5. Kostanecki S.V., Rossbach G. // Ber. 1896. Bd 29.
КОНФЛИКТ ИНТЕРЕСОВ
S. 1488.
6. Hodnett E.M., Ross W.W. // Proc. Oklahoma Acad. Sci.
Авторы заявляют об отсутствии конфликта
1951. Vol. 32. P. 69.
интересов.
7. Georgi R., Schwyzer A. // J. Prakt. Chem. 1913. Bd 86.
S. 273.
СПИСОК ЛИТЕРАТУРЫ
8. Ansari F.L., Nazir S., Noureen H., Mirza B. // Chem.
1. Кулаков И.В., Мацукевич М.В., Шульгау З.Т., Сер-
Biodiversity. 2005. Vol. 2. P. 1656. doi 10.1002/
газы Ш., Сейлханов Т.М., Пузари А., Фисюк А.С. //
cbdv.200590135
ХГС. 2015. Т. 51. № 11-12. С. 991; Kulakov I.V.,
9. Носова Н.В., Вагапов А.В., Слепухина П.А.,
Matsukevich M.V., Shulgau Z.T., Sergazy S., Seilkha-
Гейн В.Л. // ХГС. 2012. Т. 48. № 11. С. 1841; Nosova N.V.,
nov T.M., Puzari A., Fisyuk A.S. // Chem. Heterocycl.
Vagapov A.V., Gein V.L. // Chem. Heterocycl. Compd.
Compd. 2015. Vol. 51. P. 991. doi 10.1007/s10593-016-
2013. Vol. 48. N 11. P. 1725. doi 10.1007/s10593-013-
1809-7
1201-9
2. Kulakov I.V., Palamarchuk I.V., Shulgau Z.T., Seilkha-
10. Плотников М.Б., Колтунов А.А., Алиев О.И. //
nov T.M., Gatilov Y.V., Fisyuk A.S // J. Mol. Struct. 2018.
Экспериментальная и клиническая фармакология.
Vol. 1166. P. 262. doi 10.1016/j.molstruc.2018.04.036
1996. Т. 6. С. 57.
Synthesis, Structure, and Hemorheological Activity
of Pentasubstituted Cyclohexanol
I. V. Palamarchuka, Z. T. Shulgaub,*, Sh. D. Sergazyb, A. M. Zhulikeevab,
Yu. V. Gatilovc, and I. V. Kulakova
a Tyumen State University, Tyumen, 625003 Russia
b Republican State Enterprise “National Center for Biotechnology”, Science Committee of the Ministry
of Education and Science of the Republic of Kazakhstan, Nur-Sultan, 010000 Kazakhstan
c Vorozhtsov Novosibirsk Institute of Organic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
*e-mail: shulgau@biocenter.kz
Received September 13, 2021; revised November 15, 2021; accepted November 17, 2021
The reaction of chalcone (benzylideneacetophenone) in a DMSO solution in the presence of KOH gave the
product of intramolecular condensation of the Michael adduct of the reaction of two molecules of chalcone and
acetophenone according to the reaction, namely (4-hydroxy-2,4,6-triphenylcyclohexane-1,3-diyl)bis(phenyl-
methanone). Structure of the synthesized derivative was proved by 1H, 13C NMR spectroscopy, mass spectrom-
etry and X-ray diffraction analysis. The obtained cyclohexanol derivative shows hemorheological activity: it
is able to inhibit the growth of the viscosity of whole blood during the formation of the syndrome of increased
blood viscosity in vitro.
Keywords: intramolecular cyclization, Michael reaction, chalcone, cyclohexanol derivative, X-ray diffraction
analysis, hemorheological activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 12 2021