ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 7, с. 1059-1067
УДК 547.341
ФОСФОРИЛИРОВАННЫЕ 2-ХЛОРЭТИНЫ В
РЕАКЦИЯХ С ПРОИЗВОДНЫМИ МАЛОНОВОЙ
КИСЛОТЫ: АЗИРИН ИЛИ ОКСАЗОЛ?
© 2021 г. Н. Б. Викторовa, В. В. Гуржийb, А. В. Догадинаa,*
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
b Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: dog_alla@mail.ru
Поступило в Редакцию 30 апреля 2021 г.
После доработки 30 апреля 2021 г.
Принято к печати 15 мая 2021 г.
Реакции (2-хлорэтинил)дифенилфосфиноксида с 2-аминодиэтилмалонатом и диметил-(2-хлорэтинил)-
фосфоната с 2-амино-N1,N3-ди(п-толил)малоноамидом или 2-аминомалоноамидом протекают хемо- и
региоселективно, приводя к образованию соответствующих 2-метиленфосфорилированных оксазолов,
а именно дифенил-[(5-этокси-4-этоксикарбонил-1,3-оксазол-2-ил)метил]фосфиноксида, диметил-{[5-(п-
толиламино)-4-(п-толилкарбамоил)-1,3-оксазол-2-ил]метил}фосфоната, диметил-[(5-амино-4-карбамо-
ил-1,3-оксазол-2-ил)метил]фосфоната.
Ключевые слова: хлорэтинфосфонат, 2Н-азирин, оксазол, фосфорилирование
DOI: 10.31857/S0044460X21070106
В 21 веке существенно возросло внимание к
β-кетоксимов [7]. Этой же научной школой были
химии гетероциклических соединений, вызванное
позднее осуществлены асимметрические синтезы
широким применением гетероциклов в медицин-
2Н-азиридинфосфонатов и аминофосфонатов из
ской и фармацевтической химии. Как показано в
соответствующих 2Н-азиринов [8, 9].
фундаментальных обзорах [1-4], особенно при-
Наиболее простые и известные способы по-
стальное внимание ученых привлекают высокоре-
лучения
2-фосфорилирированных
2Н-азиринов
акционноспособные напряженные гетероциклы:
представлены в обзоре [10]: реакция фосфитов с
азирины, азиридины, азетины и т. п. Азирины,
β-нитростиролом [5], присоединение (фосфино)-
содержащие фосфорную группу, достаточно мало
(силил)карбена к ароматическим нитрилам [11],
известны. Основную часть их составляют 2-фос-
термолиз винилазидов [9], реакция фосфорилиро-
форилированные 2Н-азирины.
ванных алленов с азидом натрия [12].
Первый представитель этого класса, 2-(диэток-
Гораздо менее известны 3-фосфорилированные
сифосфорил)-3-метил-2-фенил-2Н-азирин, был
2Н-азирины. В 1990 году было сообщено о син-
получен с выходом 22% реакцией триэтилфос-
тезе двух представителей 2-азидоаллилфосфона-
фита с β-нитростиролом [5]. Более широкий ряд
тов и их дальнейшем превращении при фотолизе
2-фосфорилированных 2Н-азиринов был получен
(λ 350 нм) в ацетонитриле с высоким выходом в
в 1994 году из региоизомерных азидоаллилфос-
2Н-азиринил-3-фосфонаты
[13].
3-Фосфорили-
фонатов [6]. Используется также удобный способ
рованные азирины образуются в реакции окисле-
получения фосфорилированных 2Н-азиринов мо-
ния по Сверну из соответствующих азиридинов
дифицированной реакцией Небера из тозилатов
[14,
15]. Один из представителей этого класса,
1059
1060
ВИКТОРОВ и др.
Схема 1.
O
Ph2POCH3 +Cl
Cl
Et2O Ph2P
Cl
1
2
3
Схема 2.
CO2Et
O
O O
N
K2CO3, 20oC, 18 ч
Ph2P
Cl
+
EtO
OEt
O OEt
CH3CN
O
PPh2
NH2
3
4
5
метил-3-(диэтилфосфонил)-2-(трифторметил)-
диметилхлорэтинилфосфонатом 6 привела к по-
2Н-азирин-2-карбоксилат, был получен много-
лучению кристаллического продукта 8б, для кото-
стадийной реакцией [16]. Позднее в рамках си-
рого удалось вырастить монокристаллы. Методом
стематических исследований реакций хлорэтин-
РСА было доказано, что полученное соединение
фосфонатов с нуклеофильными реагентами мы
8б имеет структуру оксазола (рис. 1).
установили, что данная реакция с незамещенным
Аналогично проходит и реакция хлорэтинфос-
2-аминодиэтилмалонатом с хорошим выходом
приводит к получению соединений, которые были
отнесены нами к азиринам [13], а именно 3-мети-
ленфосфорилированным 2H-азиринам [17].
Отметим, что полученные 3-фосфонилазирины
в работах [13, 17] описаны как вязкие жидкости
и охарактеризованы данными ЯМР 1Н, 13С, 31Р и
масс-спектроскопии высокого разрешения [16, 17].
Все характеристики данных соединений согласу-
ются друг с другом. Однако в означенных публи-
кациях нет данных РСА. Наши попытки получить
кристаллические
3-метиленфосфонил-2Н-азири-
ны, аналогичные описанным ранее [17], оказа-
лись безуспешными при изменении алкильных
заместителей в фосфонильном и малонатном
фрагментах. Только получение (2-хлорэтинил)ди-
фенилфосфиноксида 3, синтезированного по реак-
ции Михаэлиса-Арбузова (схема 1), и последую-
щая реакция его с 2-аминомалонатом 4, привели
к образованию кристаллического фосфиноксида 5
(схема 2). К сожалению, вырастить монокристал-
лы фосфиноксида 5, подходящие для проведения
рентгеноструктурного анализа, не удалось.
Рис. 1. Общий вид молекулы диметил-{[5-(п-толил-
Замена заместителей в малонатном фрагменте
амино)-4-(п-толилкарбамоил)-1,3-оксазол-2-ил]метил}-
позволила достичь поставленной цели. Так, реак-
фосфоната 8б в кристалле (комплекс с CH2Cl2) (CCDC
ция 2-амино-N1,N3-ди(п-толил)малонамида 7б с
1579955).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
ФОСФОРИЛИРОВАННЫЕ 2-ХЛОРЭТИНЫ
1061
Схема 3.
O
O
O
(CH3O)2P
NHR
K2CO3, 20oC, 18 ч
N
(CH3O)2P
Cl+H2N
NHR
O
CH3CN
NHR
O
O
NHR
6
7
а, б
8а, б
R = H (a), 4-CH3C6H4
(б).
фоната с незамещенным 2-аминомалонодиамидом
подтверждено данными рентгеноструктурного
7а с получением оксазола 8а (схема 3).
анализа [19]. В их спектрах ЯМР 13С углерод С4
Проведенные нами исследования заставляют
резонирует дублетным сигналом в области 84 м. д.
перепроверить данные о получении нами азирино-
(3JCP 11.0 Гц). Оксазол, полученный декарбоксили-
вой структуры в работе [17]. Сравнение спектраль-
рованием одного из оксазолинов, в спектре ЯМР
ных характеристик ЯМР 13С азиринов, получен-
13С имеет дублетный сигнал углерода С4 в области
ных в работах [16, 17], при наличии акцепторных
128 м. д. и КССВ с ядром фосфора 3JCP 9.0 Гц.
заместителей в положении 2 двух групп CO2Et
В наших последних работах было показано, что
[17] и групп CO2Et, CF3 [16] позволяло допустить
хемонаправленность реакций хлорэтинфосфона-
для них похожую азириновую структуру. Одним
тов с такими С,N-бинуклеофильными реагентами,
из доказательств являются данные спектроскопии
как
[(арил,алкил)амино)]малонаты, существен-
ЯМР 13С. Так, углерод в положении 2 азирина в
но зависит от их нуклеофильности (основности)
работе [16] резонирует в достаточно сильном поле
[20]. Так, 2-(ариламино)малонаты в реакции с
дублетом квартетов при 105.85 м. д. (2JСP 5.0, 2JСF
2-хлорэтинфосфонатами в отличие от 2-ацила-
40.9 Гц). Аналогичный атом углерода азиринов в
мидомалонатов селективно реализуют только
работе [17] представлен в спектрах ЯМР 13С син-
С-нуклеофильное замещение хлора в
2-хлор-
глетными сигналами при 107.4, 107.5, 107.1 м. д.
этинфосфонате с образованием 2-этинилфосфо-
Однако и в спектрах ЯМР 13С синтезированных
нилированных 2-(ариламино)малонатов, строение
оксазолов 5, 8а, 8б, которые можно считать струк-
которых однозначно подтверждено данными РСА
турными изомерами соответствующих азири-
[21]. При взаимодействии хлорэтинфосфонатов с
нов, углерод в положении 4 оксазольного кольца
более основными 2-(циклогексиламино)диэтилма-
представлен синглетным сигналом в области 105-
лонатом и 2-(бензиламино)диэтилмалонатом нару-
107 м. д., т. е. в той же области, что и для азиринов
шается хемо- и региоселективность реакции из-за
в работах [16, 17]. Близкое значение химического
сдвига (107 м. д.) имеет углерод С4 в 5-этокси-4-
активности С- и N-нуклеофильных центров суб-
этоксикарбонилоксазолах в работе [18].
стратов. В спектрах ЯМР31Р реакционной массы в
интервале от -10 до 30 м. д. представлены сигна-
Похожие по структуре
2-замещенные
лы сложной смеси соединений [20]. Проведенные
Z-4,4-бис(этоксикарбонил)-5-(диметоксифосфо-
нами исследования с незамещенными аминопро-
рилметилиден)-1,3-оксазолины были синтезиро-
изводными малоновой кислоты позволяют пред-
ваны реакцией диметил(2-хлорэтинил)фосфоната
с бинуклеофильными диэтил-2-амидомалоната-
положить, что первичная атака N-нуклеофилом
ми через первичную нуклеофильную атаку атома
(NH2) по углеродному атому этинфосфоната, свя-
углерода малоната по атому углерода этинилфос-
занному с хлором, и последующая циклизация по
фоната, связанному с хлором, и последующую
дигональному атому промежуточно образующего-
циклизацию с участием карбонильного кислоро-
ся кетенимина приводят к образованию оксазола
да амидомалоната. Строение Z-оксазолинов было
(схема 4).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1062
ВИКТОРОВ и др.
Схема 4.
O
O
O
O
O
O
NHR
NHR
NHR
H
(AlkO)2P
Cl
+H2N
(AlkO)2P
N
(AlkO)2P
C
N
NHR
NHR
NHR
O
O
O
H
7
O
(AlkO)2P
N
O
CONHR
NHR
8
Схема 5.
EtO
EtO
EtO
O
O
O
O
O
O
H
(AlkO)2P
Cl
+
H2N
(AlkO)2P
N
(AlkO)2P
C
C
N
CH
H
O
O
O
EtO
EtO
EtO
O
(AlkO)2P
CH2
C
N
O
N
CO2Et
(AlkO)2P
CH2
O
CCO2Et
O
O
OEt
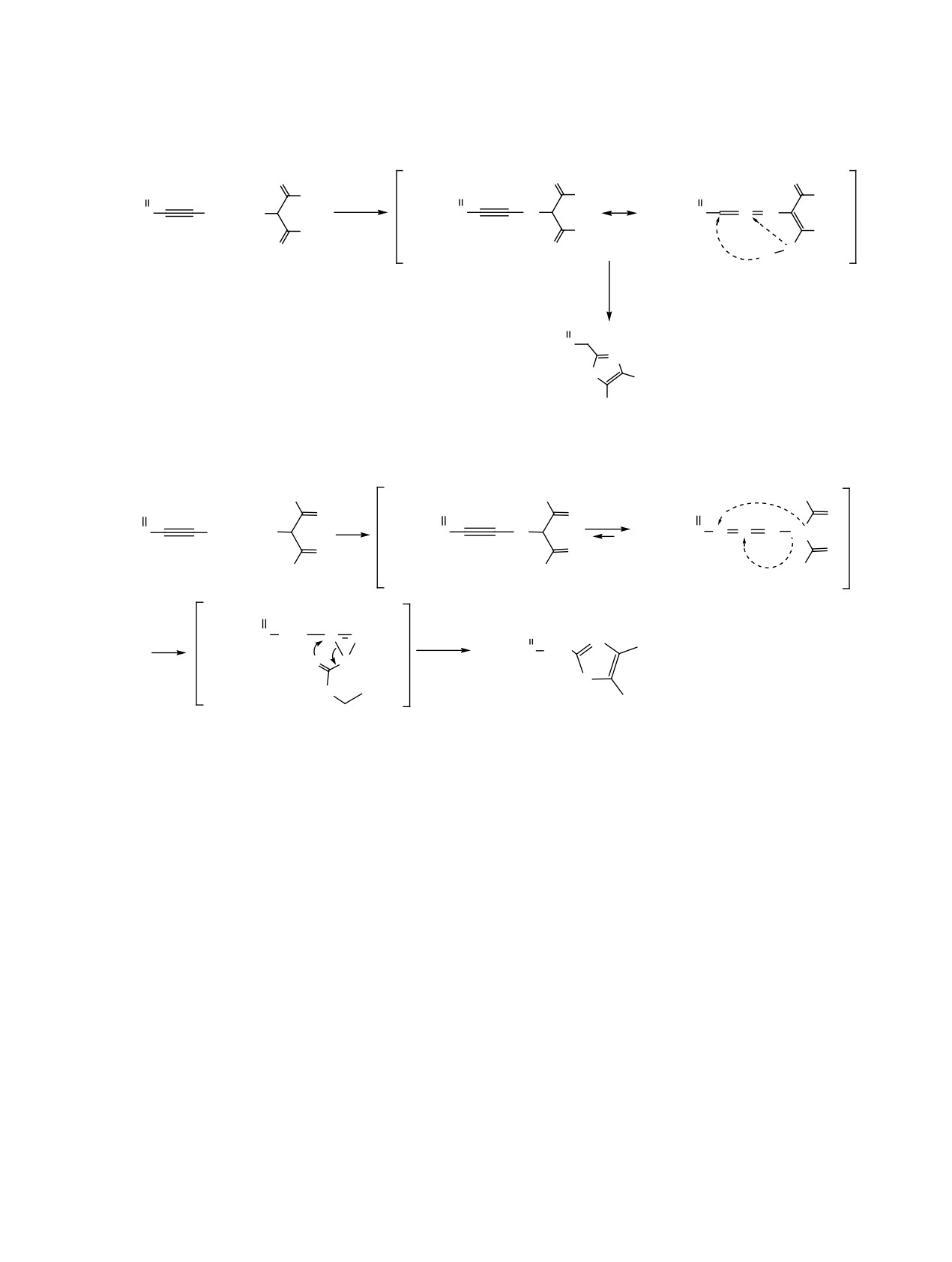
Альтернативой этого пути может выступить об-
ненными заместителями у атома азота [24, 25]. Все
разование интермедиата азириновой структуры в
эти данные позволяют предположить, что реакция
изучаемой реакции. Косвенным доказательством
2-хлорэтинфосфоната с незамещенным 2-амино-
возможности образования азирина могут служить
малонатом проходит по другому пути - через
исследования, проводимые нами по каталитиче-
высоко активный кетениминный интермедиат и
ской циклизации
2-[(2-(ариламино)диэтилмало-
циклизацию его по дигональному атому углерода
нил]этинфосфонатов. Под действием кислоты
до соответствующего азирина с последующей ази-
Льюиса (эфирата трихлорида бора) через внутри-
рин-оксазольной перегруппировкой (схема 5).
молекулярную циклизацию были с высоким вы-
Образование оксазолов из азиринов вполне
ходом получены 3-фосфонилированные индолы
допустимо. В последних обзорах по синтезу и ре-
[22], а при действии оснований (t-BuOK, AcOK) -
акциям азиринов [3, 4] представлено достаточно
дифосфонилированные
2,3-дигидро-1Н-пироллы
много данных по реакциям изомеризации азири-
(строение доказано РСА) и 4-фосфонилирован-
нов. Фотохимические и термические перегруппи-
ные 1-азабута-1,3-диены, предположительно через
ровки азиринов в димерные и другие гетероцикли-
1Н-азириновые интермедиаты [23]. Известно еще
с 80 годов прошлого века, что реакция хлорэтин-
ческие структуры были описаны еще в 1975-1976
фосфонатов с первичными аминами проходит с
годах в работах [26-28]. Аналогичные сведения об
образованием фосфонилированных кетениминов,
азирин-оксазольной изомеризации приведены в
в том числе стабильных с пространственно затруд-
сборниках Катрицкого [29]. Там же представлены
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
ФОСФОРИЛИРОВАННЫЕ 2-ХЛОРЭТИНЫ
1063
результаты исследований итальянских ученых (см.
диэтилмалонатом и 2-хлорэтинфосфоната с 2-ами-
схему 212 [29]) по катализируемому Fe(II)·4H2O
но-N1,N3-ди-п-толилмалоноамидом и
2-амино-
сжатию 5-членного изоксазольного кольца с обра-
малоноамидом показало, что реакции протекают
зованием ацил-2-азиринов.
хемо- и региоселективно, приводя к образованию
Димеризация 2-фосфонилированного 2Н-ази-
соответствующих метиленфосфонилированных
рина и
2Н-азирин-2-фосфиноксида описана в
оксазолов. Предложены возможные пути проте-
2002 году [30]. Позднее фотохимическая изоме-
кания реакций через кетенимин-енольную форму
ризация азирина в оксазол и далее при участии
для 2-аминоамидомалонатных субстратов и кете-
катализатора Граббса в изоксазольную структуру
нимин-азирин-оксазольный интермедиат для неза-
были представлены в исследованиях [31]. Так-
мещенного 2-аминомалоната.
же сообщалось о термической изомеризации 2-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
галоген-2-бензоил-2Н-азирин-3-карбоксилатов в
Cпектры ЯМР 1Н, 13С, 31Р сняты на спектроме-
4-галоген-1,3-оксазолы [32, 33]. Как новую страте-
тре Bruker Avance III HD 400 NanoBay на рабочих
гию синтеза полифункционализированных окса-
частотах 400.17, 100.63 и 161.99 МГц соответ-
золов представляют китайские исследователи кас-
ственно. Для отнесения сигналов в спектрах ЯМР
кадную реакцию замещения-циклизации 2Н-ази-
ринов [34]. Недавно японские ученые опубликова-
1H, 13C использовали методы двумерной гомо-
ли большую статью с расчетами по индуцируемому
и гетероядерной спектроскопии ЯМР HMQC и
основаниями превращению
2-ацил-3-алкил-2Н-
HSQC. Масс-спектры высокого разрешения запи-
азиринов в оксазолы [35]. На основании экспери-
саны на масс-спектрометре Bruker MicrOTOF при
ментальных и расчетных данных авторы трактуют
ионизации вещества распылением в электриче-
протекание изучаемой изомеризации азирин→ок-
ском поле (ESI). ИК спектры записаны на спектро-
сазол через кетениминный интермедиат как более
метре Shimadzu IR-100 trAcer, метод НПВО. Тем-
стабильный, чем предложенный ранее нитрили-
пературы плавления измерены на столике Кофлера
минный. В литературе представлена также фото-
(VEB Wagetechnik Rapido, PHMK 81/2969). Ренге-
химическая изомеризация 2Н-азирина с акцептор-
ноструктурный анализ выполнен на дифрактоме-
ными заместителями в положении 2 в оксазол [36].
тре Agilent Technologies Xcalibur при 100 K.
Примечательно, что изомеризация азирин→
Дифенил(2-хлорэтинил)фосфиноксид (3). К
оксазол проходит в достаточно жестких услови-
раствору дихлорацетилена [22] (~50 ммоль, боль-
ях, в то время как реакция хлорэтинфосфонатов
шой избыток, чтобы не допустить замещение обо-
с незамещенным аминомалонатом [17] не требует
их атомов хлора) в абсолютном диэтиловом эфире
нагрева и фотохимического воздействия. Но неза-
(50 мл) при интенсивном перемешивании и охлаж-
мещенный аминомалонат - единственное соеди-
дении 0-10°С добавляли медленно по каплям рас-
нение, которое может дать промежуточный кете-
твор 3.6 г (16.6 ммоль) метилдифенилфосфинита
ниминный интермедиат и предполагаемый азирин
в 5 мл абсолютного эфира. Наблюдалось помутне-
с тремя акцепторными группами (метиленфосфо-
ние и окрашивание раствора сначала в желтый, а
натная и две ацетильные), что сдвигает таутомер-
со временем в черный цвет. Смесь перемешивали
ное равновесие азирин-оксазол преимущественно
4 ч при комнатной температуре, затем упаривали в
к оксазольной структуре. Квантово-химические
вакууме. После колоночной хроматографии (SiO2,
расчеты структурных, энергетических и зарядо-
элюент гептан-этилацетат 4:1) получили 1.15 г
вых характеристик оптимизированных структур
фосфиноксида 3, выход 27%, вязкая жидкость
изомеров азирин/оксазол, выполненные по стан-
светло-желтого цвета. Спектр ЯМР 1Н (CDCl3),
дартному базису 6-31G в программе Gaussian 09
δ, м. д.: 7.49-7.54 м (4H), 7.55-7.62 м (2H), 7.80-
[37], демонстрируют ярко выраженную энергети-
7.88 м (4H). Спектр ЯМР 13C (CDCl3), δС, м. д.:
ческую разницу в 26.9 ккал/моль в пользу оксазо-
64.75 д (C≡CP, 1JCP 165.4 Гц), 84.37 д (C≡CP, 2JCP 3
льной структуры.
0.0 Гц), 128.38 д (Ph, 3JCP 13.7 Гц), 130.44 д (Ph,
Таким образом, исследование взаимодействия
2JCP 11.3 Гц), 131.79 д (Ph, 1JCP 122.8 Гц), 132.22
(2-хлорэтинил)дифенилфосфиноксида с 2-амино-
д (Ph, 4JCP 2.9 Гц). Спектр ЯМР 31P (CDCl3): δР
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1064
ВИКТОРОВ и др.
8.62 м. д. Масс-спектр (HRMS-ESI), m/z: 283.0037
методике [38]. К суспензии N1,N3-бис(4-метилфе-
[M + Na]+ (вычислено для C14H10ClOP: 283.0056).
нил)малонамида (1.40 г, 5.0 ммоль) в 25 мл дихлор-
метана добавляли 1.03 г трет-бутилнитрита, за-
Дифенил-[(5-этокси-4-этоксикарбонил-
тем в течение 10 мин добавляли 5 мл 2 н. раствора
1,3-оксазол-2-ил)метил]фосфиноксид (5). К сме-
HCl в этилацетате (10 ммоль) при охлаждении
си гидрохлорида 2-аминодиэтилмалоната (0.49 г,
2.3 ммоль) и K2CO3 (0.64 г, 4.6 ммоль) в 6 мл аб-
водой и перемешивании. Прозрачный раствор пе-
солютного CH3CN добавляли дифенил(2-хлор-
ремешивали при 20°С в течение 1 ч, затем упари-
вали в вакууме и добавляли 10 мл гексана. Осадок
этинил)фосфиноксид 3 (0.60 г, 2.3 ммоль). По-
отфильтровывали, промывали гексаном и сушили
лученную смесь перемешивали при комнатной
температуре 18 ч. Осадок отфильтровывали и
в вакууме. Выход 1.40 г (90%), желтые кристаллы.
промывали 4 мл CH3CN, растворитель удаляли
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 2.26 с, 2.27
с (6Н, СН3), 7.13 д (2H, CH, 3JHH 8.8 Гц), 7.14 д
в вакууме. Остаток (0.95 г) хроматографировали
(SiO2, элюент гептан-этилацетат 1:1, затем этила-
(2H, CH, 3JHH 8.4 Гц), 7.53 д (2H, CH, 3JHH 8.8 Гц),
цетат), получили 0.55 г соединения 5, выход 60%.
7.60 д (2H, CH, 3JHH 8.4 Гц), 9.98 с (1H, NH), 10.42
Бесцветные кристаллы, т. пл. 84-85°С (гептан).
с (1H, NH), 12.37 с (1H, NOH). Спектр ЯМР 13C
ИК спектр: 3059 сл. ш, 2989 сл. ш, 2908 сл, 1709
(ДМСО-d6), δС, м. д.: 20.96 (СН3), 119.67, 120.85,
с, 1622 с, 1437 ср, 1236 ср, 1182 с, 1076 с. Спектр
129.53, 129.69, 133.26, 133.49, 136.13, 136.40,
ЯМР 1Н (CDCl3), δ, м. д.: 1.22 т (3Н, CH3, 3JHH
149.26 (C=N), 159.95 и 160.14 (С=О). Спектр ЯМР
7.0 Гц), 1.23 т (3Н, CH3, 3JHH 7.1 Гц), 3.76 д (2Н,
13C (CDCl3), δС, м. д.: 21.12 и 21.18 (СН3), 120.72,
CH2P, 2JHP 14.0 Гц), 4.11 к (2Н, CH2O, 3JHH 7.0 Гц),
121.30, 129.90 (4С), 133.26, 133.89, 135.39, 136.13,
4.21 к (2Н, CH2O, 3JHH 7.1 Гц), 7.35-7.50 м (6H,
137.42 (C=N), 161.01 и 161.13 (С=О). Масс-спектр
Ph), 7.70 д. д. (4Н, Ph, 3JHH 7.3, 3JHP 12.0 Гц). Спектр
(HRMS-ESI), m/z: 334.1168 [M + Na]+ (вычислено
ЯМР 13C (CDCl3), δС, м. д.: 14.47 (CH3), 14.86
для C17H17N3O3: 334.1162).
(CH3), 32.59 д (CH2P, 1JCP 64.8 Гц), 60.62 (OCH2),
Диметил-[(5-амино-4-карбамоил-1,3-окса-
69.83 (OCH2), 107.29 (C4),
128.89 д (Ph, 3JCP
зол-2-ил)метил]фосфонат (8а). К смеси диамида
12.3 Гц), 131.13 д (Ph, 2JCP 9.7 Гц), 131.47 д (Ph, 1JCP
2-аминомалоновой кислоты 7а (0.60 г, 5.1 ммоль) и
102.3 Гц), 132.48 д (Ph, 4JCP 2.7 Гц), 145.77 д (C2, 2JCP
K2CO3 (1.38 г, 1.0 ммоль) в 6 мл безводного CH3CN
10.3 Гц), 161.36 (C5), 161.64 (C=O). Спектр ЯМР 31P
добавляли диметил(2-хлорэтинил)фосфонат 6 [22]
(CDCl3): δР 26.74 м. д. Спектр ЯМР 15N (CDCl3): δN
(0.90 г, 5.3 ммоль) и перемешивали при комнат-
257.3 м. д. Масс-спектр (HRMS-ESI), m/z: 400.1299
ной температуре 18 ч. Образующуюся суспензию
[M + H]+ (вычислено для C21H22N1O5P: 400.1308).
фильтровали, осадок промывали CH3CN (2×5 мл).
2-Амино-N1,N3-бис(4-метилфенил)малон-
Осадок содержал основное количество продукта.
амид (7б). Раствор 2-гидроксимино-N1,N3-бис(4-ме-
Для выделения аналитического образца осадок
тилфенил)малонамида (0.60 г, 1.9 ммоль) [38] в
обрабатывали кипящим хлороформом (3×10 мл).
20 мл этилацетата гидрировали в присутствии
После упаривания раствора в вакууме получи-
0.1 г 5% Pd/C. После перекристаллизации из
ли 0.15 г соединения 8а в виде серого порошка,
метанола получили 0.45 г соединения 7б, выход
т. пл. 119-121°С (разл.). Спектр ЯМР 1Н (CDCl3),
79%. Белые кристаллы, т. пл. 165-166°С. Спектр
δ, м. д.: 3.25 д (2Н, CH2P, 2JHP 21.2 Гц), 3.80 д (6Н,
ЯМР1Н (CDCl3), δ, м. д.: 2.34 с (6Н, СН3), 2.50 уш. с
CH3O, 3JHP 11.2 Гц), 5.40 уш. с (2Н, NH2), 6.25 уш.
(2Н, NH2), 4.31 с (1Н, CНN), 7.16 д (4H, CH, 3JHH
с (2Н, NH2). Спектр ЯМР 31P (CDCl3): δР 22.57 м. д.
8.4 Гц), 7.47 д (4H, CH, 3JHH 8.4 Гц), 9.81 уш. с (2H,
Спектр ЯМР 31P (ДМСО-d6): δР 23.63 м. д. Спектр
NHСО). Спектр ЯМР 13C (CDCl3), δС, м. д.: 21.04
ЯМР 15N (ДМСО-d6), δN, м. д.: 58.58 (NH2), 97.82
(СН3), 57.59 (СHN), 120.04, 129.68, 134.51, 134.75,
(CONH2). Масс-спектр (HRMS-ESI), m/z: 272.0419
167.35 (С=О). Масс-спектр (HRMS-ESI), m/z:
[M + Na]+ (вычислено для C7H12N3O5P: 272.0407).
298.1555 [M + H]+ (вычислено для C17H19N3O2:
Диметил-{[5-(п-толиламино)-4-(п-толил-
298.1550).
карбамоил)-1,3-оксазол-2-ил]метил}фосфо-
2-Гидроксимино-N1,N3-бис(4-метилфенил)-
нат (8б). К смеси 2-амино-N1,N3-бис(4-метилфе-
малонамид был получен по модифицированной
нил)малонамида 7б (0.16 г, 0.54 ммоль) и K2CO3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
ФОСФОРИЛИРОВАННЫЕ 2-ХЛОРЭТИНЫ
1065
(0.149 г, 1.08 ммоль) в 3.5 мл безводного ацетонитри-
КОНФЛИКТ ИНТЕРЕСОВ
ла добавляли диметил(2-хлорэтинил)фосфонат 6
Авторы заявляют об отсутствии конфликта
(0.10 г, 0.59 ммоль) и перемешивали при комнат-
интересов.
ной температуре 18 ч. Коричневую суспензию
СПИСОК ЛИТЕРАТУРЫ
фильтровали, осадок промывали CH3CN (2×3 мл).
Фильтрат упаривали, остаток перекристаллизова-
1.
Palacios F., Ochoa de Retana A.M., Martı´nez de
Marigorta E., de los Santos J.M. // Eur. J. Org.
ли из смеси гептан-дихлорметан, 3:1. Получили
Chem. Vol.
2001. N
13. P.
2401. doi
0.05 г соединения 8б, выход 22%. Бесцветные кри-
10.1002/1099-0690(200107)2001:13<2401::AID-
сталлы, т. пл. 195-196°С (гептан). Спектр ЯМР 1Н
EJOC2401>3.0.CO;2-U
(CDCl3), δ, м. д.: 2.32 с (3Н, CH3Ar), 2.33 с (3Н,
2.
Khlebnikov A.F., Novikov M.S. // Tetrahedron. 2013.
CH3Ar), 3.38 д (2Н, CH2P, 2JHP 21.2 Гц), 3.83 д (6Н,
Vol. 69. P. 3363. doi 10.1016/j.tet.2013.02.020
3.
Khlebnikov A.F., Novikov M.S. // Top. Heterocycl. Chem.
CH3O, 3JHP 11.2 Гц), 7.10-7.17 м (4Н, Ar), 7.19 д
2016. Vol. 41. P. 143. doi 10.1007/7081_2015_154
(2Н, Ar, 3JHH 8.6 Гц), 7.49 д (2Н, Ar, 3JHH 8.6 Гц),
4.
Khlebnikov A.F., Novikov M.S., Rostovskii N.V. //
8.14 с (1Н, NH), 8.64 с (1Н, CONH). Спектр ЯМР
Tetrahedron. 2019. Vol. 75. P. 2555. doi 10.1016/j.
13C (CDCl3), δС, м. д.: 20.85 (CH3Ar), 20.99 (CH3Ar),
tet.2019.03.040
5.
Russel G.A., Yao C.F. // J. Org. Chem. 1992. Vol. 57.
26.42 д (CH2P, 1JCP 142.8 Гц), 53.43 д (CH3O, 2JCP
P. 6508. doi 10.1021/jo00050a026
6.4 Гц), 107.91 (C4), 117.87, 119.73, 129.65, 130.07,
6.
Öhler E., Kanzler S. // Lieb. Ann. Chem. 1994. N 9.
132.8, 133.64, 135.33, 135.72, 143.93 д (C2, 2JCP
P. 867. doi 10.1002/jlac.199419940904
11.7 Гц), 154.69 (C5), 161.40 (C=O). Спектр ЯМР
7.
Palacios F., Ochoa de Retana A.M., Gil J.I. //
31P (CDCl3): δР 22.42 м. д. Масс-спектр (HRMS-
Tetrahedron Lett. 2000. Vol. 41. N 28. P. 5363. doi
10.1016/S0040-4039(00)00843-1
ESI), m/z:
430.1538
[M + H]+ (вычислено для
8.
Palacios F., Aparicio D., Ochoa de Retana A.M.,
C21H24N3O5P: 430.1526).
de los Santos J.M., Gil J.I., Lo´pez de Munain R. //
ИНФОРМАЦИЯ ОБ АВТОРАХ
Tetrahedron: Asym. 2003. N 14. P. 689. doi 10.1016/
S0957-4166(03)00089-2
Викторов Николай Борисович, ORCID: https://
9.
Palacios F., Ochoa de Retana A.M., Gil J.I., Ezpe-
orcid.org/0000-0002-8369-2537
leta J.M. // J. Org. Chem. 2000. Vol. 65. N 10. doi
10.1021/jo9915426 CCC: $19.00
Гуржий Владислав Владимирович, ORCID:
10.
Lemos A. // Molecules. 2009. Vol. 14. P. 4098. doi
https://orcid.org/0000-0003-2730-6264
10.3390/molecules.14104098.
Догадина Альбина Владимировна, ORCID:
11.
Piquet V., Baceiredo A., Gornitzka H., Dahan F.,
Bertrand G. // Chem. Eur. J. 1997. Vol. 3. N 11. P. 1757.
doi 10.1002/chem.19970031106
ФОНДОВАЯ ПОДДЕРЖКА
12.
Brel B.K. // Synthesis. 2007. N 17. P. 2674. doi 10.1055/
s-2007-3837
Работа выполнена в рамках базовой части госу-
13.
Abramovitch R.A., Konieczny M., Pennington W.,
дарственного задания Министерства образования
Kanamathareddy S.,
и науки РФ (№ 785.00.Х6019) с использованием
14.
Vedachal M. // J. Chem. Soc. Chem. Commun. 1990.
N 3. P. 269. doi 10.1039/C39900000269
оборудования Инжиниригового центра Санкт-
15.
Davis F.A., McCoull W. // Tetrahedron Lett. 1999. Vol. 40.
Петербургского государственного технологиче-
N 2. P. 249. doi 10.1016/S0040-4039(98)02331-4
ского института, ресурсных центров «Рентгено-
16.
Davis F.A., Wu Y., Yan H., Prasad K.R., McCoull. // Org.
дифракционные методы исследования» и «Ме-
Lett. 2002. Vol. 4. N 4. P. 655. doi 10.1021/ol017289p
тоды анализа состава вещества» Научного парка
17.
Skarpos H., Vorob,eva D.V., Osipov S.N., Odinets I.L.,
Breuer E., Röschenthaler G.-V. // Org. Biomol. Chem.
Санкт-Петербургского государственного универ-
2006. Vol. 4. P. 3669. doi 10.1039/b607060d
ситета, а также при финансовой поддержке Рос-
18.
Ляменкова Д.В., Викторов Н.Б., Догадина А.В. //
сийского фонда фундаментальных исследований
ЖОХ. 2015. Т. 85. Вып. 2. С. 330; Lyamenkova D.V.,
(грант № 19-03-00365).
Viktorov N.B., Dogadina A.V. // Russ. J. Gen. Chem.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1066
ВИКТОРОВ и др.
2015. Vol.
85. N
2. P.
500. doi
10.1134/
30.
Padwa A. // Compr. Heterocycl. Chem. III. 2008.
S1070363215020243
Vol. 1. P. 1.
19.
Marsden S.P., Steer J.T., Orlek B.S. // Tetrahedron.
31.
Palacios F., Ochoa de Retana A.M., Gil J.I., López de
2009. Vol. 65. P. 5503. doi 10.1016/j.tet.2009.03.105
Munain R. // Org. Lett. 2002. Vol. 24. N 14. 2405. doi
20.
Храмчихин В.А., Догадина А.В., Храмчихин А.В.,
10.1021/ol0261534
Ионин Б.И. // ЖОХ. 2012. Т. 82. Вып. 4. С. 694;
32.
Padwa A., Stengel T. // Tetrahedron Lett. Vol. 45. N 31.
Khramchikhin V.A., Dogadina A.V., Khramchikhin A.V.,
P. 5991. doi 10.1016/j.tetlet.2004.06.046
Ionin B.I. // Russ. J. Gen. Chem. 2012. Vol. 82. N 4.
33.
Pinho e Melo T., Lopes C., Rocha Gonsalves A.,
P. 776. doi 10.1134/S1070363212040299
Storr R. // Synthesis. 2002. N 5. P. 605. doi 10.1055/s-
21.
Eгорова A.В., Боярская И.А., Догадина А.В. //
2008-1083376
ЖОХ. 2019. Т. 89. Вып. 10. С. 1504; Egorova A.V.,
34.
Lopes S., Nunes C.M., Fausto R., Pinho e Melo T.M.V.D. //
Boyarskaya I.A., Dogadina A.V. // Russ. J. Gen.
Chem. 2012. Vol. 89. N 4. P. 2005. doi 10.1134/
J. Mol. Struct. 2009. Vol. 919. P. 47. doi 10.1016/j.
S1070363219100049
molstruc.2008.08.014
22.
Eгорова A.В., Викторов Н.Б., Ляменкова Д.В., Свин-
35.
Duan X., Yang K., Lu J., Kong X., Liu N., Ma J. // Org.
цицкая Н.И., Гарабаджиу А.В., Догадина А.В. //
Lett. 2017. Vol. 19. N 13. P. 3370. doi 10.1021/acs.
ЖОХ. 2016. Т. 86. Вып. 11. С. 1803. Egorova A.V.,
orglett.7b01305
Viktorov N.B., Lyamenkova D.V., Svintsitskaya N.I.,
36.
Ning Y., Otani Y., Ohwada T. // J. Org. Chem. 2017.
Garabadziu A.I., Dogadina A.V. // Russ. J. Gen.
Vol. 82. N 12. P. 6313. doi 10.1021/acs.joc.7b00904
Chem. 2016. Vol. 86. N 11. P. 2446. doi 10.1134/
37.
Sauers R.R., Hadel L.M., Scimone A.A., Stevenson T.A. //
S1070363216110086
J. Org. Chem. 1990. Vol. 55. N 13. P. 4011. doi 10.1021/
23.
Egorova A.V., Viktorov N.B., Starova G.L., Svintsits-
jo00300a013
kaya N.I., Garabadziu A.V., Dogadina A.V. //
38.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Tetrahedron Lett. 2017. Vol. 58. N 30. P. 2997. doi
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
10.1016/j.tetlet.2017.06.062
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
24.
Eгорова А.В., Викторов Н.Б., Старова Г.Л., До-
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
гадина А.В. // ЖОХ. 2019. Т. 89. Вып. 9. С. 1352;
doi 10.1134/S0044460X19090063. Egorova A.V.,
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
Viktorov N.B., Starova G.L., Dogadina A.V. // Russ. J.
FukudaR., Hasegawa J., Ishida M., Nakajima T.,
Gen. Chem. 2016. Vol. 89. N 9. P. 1765. doi 10.1134/
Honda Y., Kitao O., Nakai H., Vreven T., Montgo-
S1070363219090068
mery J.A., Jr., Peralta J.E., Ogliaro F., Bearpark M.,
25.
Петров А.А., Догадина А.В., Ионин Б.И., Гариби-
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
на В.А., Леонов А.А. // Усп. хим. 1983. Т. 52. № 11.
Kobayashi R., Normand J., Raghavachari K., Ren-
С. 1793.
dell A.V., Adamo C., Jaramillo J., Gomperts R.,
26.
Леонов А.А., Догадина А.В., Ионин Б.И., Петров А.А. //
Stratmann R.E., Yazyev O., Austin A.J., Cammi R.,
ЖОХ. 1983. Т. 53. № 1. С. 233.
Pomelli C., Ochterski J.W., Martin R.L., Morokuma K.,
27.
Padwa A., Dharan M., Smolanoff J., Wetmore S.I.Jr. //
Zakrzewski V.G., Voth G.A., Salvador P., Dannen-
J. Am. Chem. Soc. 1973. Vol. 95. N 6. P. 1954. doi
berg J.J., Dapprich S., Daniels A.D., Farkas O.,
10.1021/ja00787a040
Foresman J.B., Ortiz J.V., Cosłowski J., Fox D.J.
28.
Padwa A., Smolanoff J., Tremper A. // J. Am. Chem. Soc.
Gaussian 09, revision A.01, Gaussian, Inc., Wallingford,
1975. Vol. 97. N 16. P. 4682. doi 10.1021/ja00849a034
29.
Padwa A., Rasmussen J.K., Tremper A. // J. Am.
2009.
Chem. Soc. 1976. Vol. 98. N 9. P. 2605. doi 10.1021/
39.
Просяник А.В, Зорин Я.З., Соловьев Е.Л. // ЖОрХ.
ja00425a033
1985. Т. 21. Вып. 7. С. 1485.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
ФОСФОРИЛИРОВАННЫЕ 2-ХЛОРЭТИНЫ
1067
Phosphorylated 2-Chloroethynes in Reactions
with Malonic Acid Derivatives: Azirine or Oxazole?
N. B. Viktorova, V. V. Gurzhiyb, and A. V. Dogadinaa,*
aSt. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
bSt. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: dog_alla@mail.ru
Received April 30, 2021; revised April 30, 2021; accepted May 15, 2021
The reactions of (2-chloroethynyl)diphenylphosphine oxide with diethyl 2-aminomalonate and dimethyl (2-chlo-
roethynyl)phosphonate with 2-amino-N1,N3-di(p-tolyl)malonamide or 2-aminomalonamide proceed chemo- and
regioselectively to form the corresponding 2-(phosphorylmethylene)oxazoles, namely diphenyl-[(4-ethoxy-
carbonyl-5-ethoxyoxazol-2-yl)methyl]phosphine oxide, dimethyl {[5-(p-tolylamino)-4-(p-tolylcarbamoyl)-
oxazol-2-yl]methyl}phosphonate and dimethyl [(5-amino-4-carbamoyloxazol-2-yl)methyl]phosphonate,
respectively.
Keywords: chloroethynylphosphonate, 2H-azirine, oxazole, phosphorylation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021