ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 9, с. 1340-1350
УДК 547.812.6:547.825:547.863.19
СИНТЕЗ И СВОЙСТВА НОВЫХ 5-ГИДРОКСИ-
2-[(ГЕТАРИЛТИО)МЕТИЛ]-4H-ПИРАН-4-ОНОВ
© 2021 г. В. В. Доценкоa,b,*, Д. Д. Гузьa, Д. Т. Тебиевa, В. К. Киндопa, Н. А. Аксеновb,
И. В. Аксеноваb, Е. Е. Нетребаc
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
b Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
c Таврическая академия Крымского федерального университета имени В. И. Вернадского,
Симферополь, 295007 Россия
*e-mail: victor_dotsenko_@mail.ru
Поступило в Редакцию 10 июля 2021 г.
После доработки 28 июля 2021 г.
Принято к печати 29 июля 2021 г.
Взаимодействие 2-тиоксоазинов с хлоркойевой кислотой в присутствии KОН в ДМФА приводит к
образованию новых гибридных молекул, содержащих связанные SCH2-спейсером фрагменты койевой
кислоты и азагетероцикла. Проведено прогнозирование параметров биодоступности in silico, методом
протеин-лигандного докинга спрогнозированы возможные белковые мишени.
Ключевые слова: хлоркойевая кислота, 3-цианопиридин-2(1Н)-тионы, 2-тиоксо-1,2-дигидрохинокса-
лины, S-алкилирование, расчетная биологическая активность
DOI: 10.31857/S0044460X21090055
Койевая кислота 1 (5-гидрокси-2-гидроксиме-
сочетающих в себе остаток койевой кислоты и аро-
тил-4H-пиран-4-он) широко применяется как в
матического/гетероциклического фрагмента - на-
фарминдустрии, агрохимии, косметологии [1-5],
пример, основания Манниха 2 [18], производные
так и в качестве лиганда для комплексных соеди-
1,2,3-триазола 3 [19, 20], замещенный тиофенол 4
нений [6] и строительных блоков для построения
[21] или 4-амино-1,2,4-триазолы 5 [22] (схема 1).
гетероциклических молекул с биологической ак-
Помимо этого, известен ряд гибридных структур
тивностью [7-9]. Будучи одним из самых изучен-
с фрагментом койевой кислоты, демонстрирую-
ных и доступных нетоксичных ингибиторов тиро-
щих иной спектр биологического действия. Так,
зиназы [10, 11], койевая кислота как биоактивная
функционализация фрагментом койевой кислоты
молекула в то же время не лишена недостатков,
использована для создания меченых изотопом 10В
среди которых следует отметить недостаточную
производных додекаборантиола 6 для бор-нейтро-
стабильность при хранении в составе композиций
нозахватной терапии рака [23]; соединение ML221
и относительно невысокую ингибирующую актив-
7 является высокоэффективным антагонистом
ность. По этой причине в последние годы получило
апелинового рецептора APJ с возможным приме-
развитие направление химии γ-пиронов, связанное
нением в терапии заболеваний сердечно-сосуди-
с получением конъюгатов койевой кислоты, либо
стой системы [24] (схема 1). Эфиры пивалиновой
иных производных, обычно функционализирован-
кислоты 8 зарекомендовали себя как эффективные
ных по спиртовым группам или положению С6 [12-
ингибиторы эластазы нейтрофилов, пригодные
-18]. Среди новых эффективных ингибиторов ти-
для лечения воспалительных заболеваний легких
розиназы стоит отметить ряд гибридных молекул,
[25], тогда как производные пиперазина 9 обнару-
1340
СИНТЕЗ И СВОЙСТВА НОВЫХ 5-ГИДРОКСИ-2-[(ГЕТАРИЛТИО)МЕТИЛ]-4H-ПИРАН-4-ОНОВ
1341
Схема 1.
O
O
O
OH
OH
HO
( )n
N
Ar
N N
O Ar
HO
N
N
N
O
O
O
койевая кислота, 1
2
3
OH
O
2
O
O
HO
HO
2Na
NH2
HO
S
S
•
N
•
O
O
10B
•
R
•
•
S
•
•
O
•
•
N N
• = 10BH
•
•
5
6
4
O O
H3C
O
O
O2N
H3C
H
O
N
O
N
3C
O
S
O S
R
X
ML221, 7
N
8 (X = O, S)
O
O
O
N NH
OH
OH
R
O
N
R
Hlg
X
N
S
O
O
O
9 (X = OH, Cl)
10
11 (Hlg = Cl, Br)
живают противотуберкулезное [26] и антираковое
как регуляторы роста и гербициды, сравнимые
[27] действие. Согласно патентным данным [28],
по эффективности с Флуазифопом-П [29], либо
производные 2-меркаптоимидазолина 10 проявля-
как инсектициды [45, 46]. В целом, анализ лите-
ют антибактериальное действие.
ратурных позволяет заключить, что вопрос взаи-
модействия галогенкойевых кислот с S-нуклеофи-
Одним из наиболее доступных способов функ-
лами гетероциклического ряда относительно мало
ционализации койевой кислоты является ее транс-
изучен. Например, доступные и хорошо зареко-
формация в бромкойевую или хлоркойевую кисло-
мендовавшие себя в гетероциклическом синтезе
ту 11, с дальнейшим замещением атома галогена
3-цианопиридин-2(1Н)-тионы и таутомерные им
различными нуклеофилами. Из числа S-нуклеофи-
меркаптаны (обзорные работы см. [47-54]) ранее в
лов в реакцию замещения вводились тиомочевины
реакцию с 5-гидрокси-2-хлорметил-4H-пиран-4-о-
[28-33], алкилмеркаптаны [29, 30, 34], тиофенолы
ном не вводились. В то же время, ожидаемые про-
[21, 35], арилсульфинаты натрия [36], тиоцианаты
щелочных металлов [36-39], соли S-гликозилизо-
дукты представляют интерес как перспективные
фармпрепараты, агрохимикаты и реагенты для
тиурония [40], различные меркаптоазолы [22, 25,
тонкого органического синтеза.
28, 29, 41], 2-меркаптопиримидины [24, 42], 2-мер-
каптохиназолины [43, 44], моно- и дитиофосфаты
Нами было изучено взаимодействие ряда ак-
[45, 46]. Многие из полученных таким образом
тивных S-нуклеофилов азагетероциклического
соединений представляют интерес для агрохимии
ряда с хлоркойевой кислотой 11 (Hlg = Cl). Уста-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1342
ДОЦЕНКО и др.
Схема 2.
Ar
O
Ar
CN
OH
CN
KOH, ДМФА
Cl
O
Ph
N
S
O
Ph
N
S
H
O
12а, б
13а, б
OH
11
OCH3
OCH3
O
N
OH
KOH, ДМФА
N
Cl
O
N
S
O
N S
H
O
14
11
15
OH
Ar = Ph (a), 2,4-Cl2C6H3 (б).
новлено, что 2-тиоксопиридины 12а, б реагируют
нонитрилов и хиноксалинов (недавние обзорные
с хлоридом 11 в присутствии 1 экв. 10%-ного во-
работы см. [55-58] и [59-67] соответственно),
дного KОН с образованием ранее не описанных
представлялось целесообразным провести пред-
гибридных молекул 13а, б, содержащих фрагмен-
варительное исследование in silico возможных
ты койевой кислоты и никотинонитрила (cхема 2).
мишеней, параметров ADMET и соответствия
В аналогичных условиях 2-тиоксо-1,2-дигидрохи-
критериям биодоступности для новых гибрид-
ных молекул. Анализ структур на соответствие
ноксалин 14 превращается в соединение 15 с вы-
ходом 28%.
«правилу пяти» К. Липински [молекулярная масса
(MW) ≤ 500, сLogP ≤ 5.0, TPSA ≤ 140 Å2, число
Строение полученных соединений подтвержда-
акцепторов водородных связей ≤ 10, доноров ≤ 5]
ется комплексом спектральных данных. В ИК спек-
[68-70] проведен с использованием программного
трах соединений 13, 15 обнаруживается полоса
сервиса OSIRIS Property Explorer [71]. Рассчитаны
поглощения при 1646-1649 см-1, соответствующая
следующие параметры: сLogP (логарифм коэффи-
валентным колебаниям сопряженной карбониль-
циента распределения между н-октанолом и водой
ной группы γ-пирона, а также широкая полоса при
log(coctanol/cwater), растворимость (logS), площадь то-
3226-3253 см-1 (О-Н); в спектрах соединений 13а,
пологической полярной поверхности (Topological
б также наблюдается полоса поглощений в обла-
Polar Surface Area, TPSA), ряд токсикологических
сти 2218-2223 см-1 (сопряженная цианогруппа). В
характеристик - рисков побочных эффектов (му-
спектрах ЯМР 1Н соединений 13, 15 наблюдаются
тагенные, онкогенные, репродуктивные эффекты),
синглеты при 4.47-4.64 м. д. (SCH2), а также сиг-
параметр сходство с известными лекарственными
налы 5-гидроксипиран-4-онового фрагмента при
препаратами (drug-likeness), а также общая оценка
6.47-6.59 (Н3), 8.01-8.09 (Н6), 9.11-9.15 м. д. (ОН).
фармакологического потенциала соединения (drug
В спектрах ЯМР 13С соединений 13, 15 характер-
score). Полученные расчетные данные представле-
ными являются сигналы при 30.8-31.6 (SCH2),
ны в табл. 1.
112.1-112.9 (С3-пиран), 139.6-139.8 (С6-пиран),
Как следует из приведенных в табл. 1 данных,
143.5-145.8 (С5-пиран), 163.1-163.8 (С2-пиран) и
значение сLogP для всех структур указывает на
173.6 м. д. (С=О).
вероятную хорошую абсорбцию и проницаемость
В контексте известной биологической активно-
[68-70]. В то же время, для всех соединений значе-
сти производных койевой кислоты [7-11], никоти-
ние logS < -4.0 указывает на невысокую раствори-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ И СВОЙСТВА НОВЫХ 5-ГИДРОКСИ-2-[(ГЕТАРИЛТИО)МЕТИЛ]-4H-ПИРАН-4-ОНОВ
1343
Таблица 1. Риски токсичности и физико-химические параметры соединений 13а, б, 15, спрогнозированные с
помощью OSIRIS Property Explorer
Риск токсичностиа
Физико-химические параметры
Соединение
drug-
drug
А
В
С
D
сLogP
logS
MW
TPSA
likeness
score
13а
-
±
-
-
3.81
-6.86
412
108.5
-2.83
0.18
13б
-
±
-
-
5.02
-8.34
480
108.5
-1.53
0.14
15
+
±
-
+
2.69
-4.62
392
106.8
1.93
0.31
а Знаком «+» показан высокий риск токсичности, «±» - умеренный риск, «-» - отсутствие токсичности. A - Мутагенность, B -
канцерогенность, С - раздражающее действие, D - репродуктивные эффекты.
Таблица 2. Расчетные параметры ADMET для соединений 13а, б, 15а
Острая токсичность (крысы), ЛД50
Ингибирование
цитохромов Р450
Проникновение
Гастроинтестинальная
№
через ГЭБ
абсорбция
IP
IV
Oral
13а
-
+
+
+
+
+
+
0.215
-0.429
0.472
677.4
153.7
1224.0
13б
-
-
+
+
+
-
+
0.167
-0.484
0.728
706.5
157.8
2571.0
15
-
+
+
+
+
+
+
-0.007
-0.423
0.716
385.9
148.2
2040.0
а Знаком «+» или «-» показано наличие или отсутствие эффекта, число означает вероятность эффекта в долях от единицы.
б IP (IntraPeritoneal) - внутрибрюшинное введение, IV (IntraVenous) - внутривенное введение, Oral - пероральное введение.
мость (менее 1×10-4 моль/л). Молекулярные массы
V классам опасности согласно критериям OECD
всех соединений и показатели параметра TPSA со-
[74]. Для всех соединений постулируется инги-
ответствует критериям пероральной биодоступно-
бирующее действие в отношении широкого круга
сти. Соединения демонстрируют умеренный риск
изоформ цитохрома Р450.
онкогенного действия, ассоциированный с нали-
Возможные протеиновые мишени для полу-
чием 5-гидроксипиран-4-онового фрагмента. Од-
ченных соединений были спрогнозированы с
нако суммарные предсказанные значения показа-
использованием нового протокола протеин-ли-
теля фармакологического потенциала соединения
гандного докинга GalaxySagittarius [75] на базе
(drug score) достаточно высоки. Для прогнозирова-
веб-сервера GalaxyWeb [76, 77]. 3D-Структуры
ния параметров ADMET (Absorption, Distribution,
соединений были предварительно оптимизиро-
Metabolism, Excretion, Toxicity) и вероятных ми-
ваны средствами молекулярной механики в си-
шеней также использовали программные пакеты
ловом поле ММ2 для оптимизации геометрии и
SwissADME [72] и GUSAR [73]. Результаты при-
минимизации энергии. Докинг с использованием
ведены в табл. 2. В целом, оценка острой токсич-
протокола GalaxySagittarius проводили в режи-
ности позволяет отнести все соединения к IV и
мах Binding compatability prediction и Re-ranking
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1344
ДОЦЕНКО и др.
Таблица 3. Результаты прогнозирования протеин-лигандного взаимодействия для соединений 13а, б, 15
Пре-докинговая
Свободная
Общая оценка
оценка
энергия связы-
Идентификатор
Идентификатор
протеин-
протеин-лиганд-
вания,
Соединение
протеина
протеина
лигандного
ного
ккал/моль
PDB ID
UniProt ID
взаимодей-
взаимодействия
(Docking
ствия
(Predock score)
score)
4luv
P27694
0.283
-18.510
0.422
OH
O
5l7h
P08235
0.183
-27.591
0.390
N
S
5dx4
O60885
0.181
-24.010
0.361
O
2yek
P25440,P25440
0.144
-25.314
0.334
6qfq
Q07820
0.144
-25.224
0.333
N
2vv2
P37231
0.124
-26.546
0.323
3zk6
Q07817,Q07817
0.113
-26.689
0.313
4kiq
Q16539
0.120
-24.931
0.307
13a
6azv
P14902,P14902
0.092
-28.363
0.305
4rqv
O15530
0.140
-21.431
0.301
4luv
P27694
0.263
-18.691
0.403
OH
O
4rqv
O15530
0.229
-20.030
0.379
N
S
6icj
P37231
0.151
-26.877
0.352
O
4mdn
Q00987
0.160
-24.357
0.342
N
5nkh
P29317
0.135
-23.493
0.311
Cl
6qfq
Q07820
0.104
-26.915
0.306
5nxd
P53671,P53671
0.075
-30.235
0.302
4rak
P55055
0.104
-26.374
0.302
Cl
13б
5yxl
Q96RI1
0.077
-29.239
0.297
4tpw
P06730
0.127
-21.695
0.290
5d3s
O60885
0.292
-21.774
0.455
OH
4alg
P25440
0.201
-22.203
0.367
O
5l7e
P08235
0.159
-23.347
0.334
N S
O
4luv
P27694
0.211
-15.684
0.328
2yw5
Q15059
0.168
-20.611
0.322
N
6s56
Q6PL18
0.148
-20.850
0.304
OCH3
5o2d
Q460N5
0.108
-24.657
0.293
15
3l3z
P10275,Q9Y6Q9
0.098
-25.460
0.289
6qfq
Q07820
0.112
-22.685
0.282
5ugm
P37231
0.087
-25.772
0.280
using docking. В табл. 3 представлены результаты
щий за репликацию и репарацию ДНК у эукари-
докинга по каждому из соединений 13а, б, 15 для
от, 3-фосфоинозитол-зависимая протеинкиназа-1
10 комплексов мишень-лиганд с минимальным
(PDK1, PDB ID 4rqv), и регулятор апоптоза Mcl-1
значением свободной энергии связывания ΔGbind и
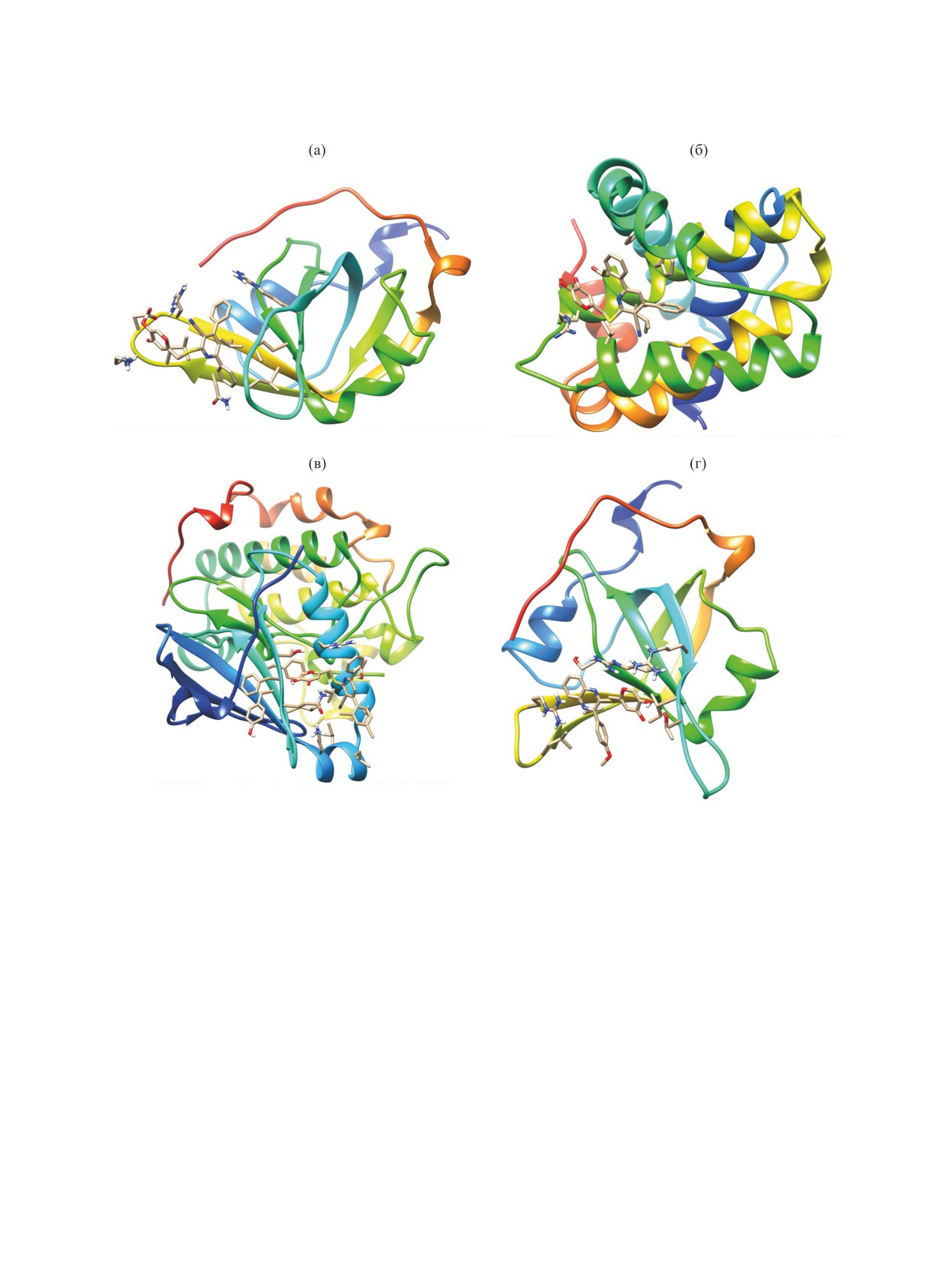
(PDB ID 6qfq) (рис. 1). Таким образом, 5-гидрок-
наилучшей оценкой протеин-лигандного взаимо-
си-2-[(гетарилтио)метил]-4Н-пиран-4-оны 13а, б,
действия. Прогнозируемые протеиновые мишени
15 могут рассматриваться как перспективные объ-
указаны с помощью ID-идентификаторов в Protein
екты для скрининга с целью поиска новых агентов
Data Bank (PDB) и в базе данных UniProt. Как
для лечения и терапии онкозаболеваний.
можно заметить из табл. 3, общими рецепторами
для соединений 13а, б, 15 являются фосфопротеин
Таким образом, нами разработан способ по-
RPA (Replication Protein A, PDB ID 4luv), отвечаю-
лучения ранее неописанных 5-гидрокси-2-[(гета-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ И СВОЙСТВА НОВЫХ 5-ГИДРОКСИ-2-[(ГЕТАРИЛТИО)МЕТИЛ]-4H-ПИРАН-4-ОНОВ
1345
Рис. 1. Прогнозируемая структура протеин-лигандных комплексов для соединения 13а и фосфопротеина RPA (PDB ID
4luv) (а), соединения 13а и протекина Mcl-1 (PDB ID 6qfq) (б), соединения 13б и протеинкиназы PDK1 (PDB ID 4rqv) (в),
хиноксалина 15 и фосфопротеина RPA (PDB ID 4luv) (г) (получено с использованием протокола GalaxySagittarius). Моле-
кулярная графика визуализирована с использованием программного комплекса UCSF Chimera [78, 79].
рилтио)метил]-4Н-пиран-4-онов взаимодействи-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ем соединений ряда
2-тиоксоникотинонитрила
ИК спектры получали на спектрометре Bruker
и 2-тиоксо-1,2-дигидрохиноксалина с 5-гидрок-
Vertex 70 с приставкой НПВО методом нарушен-
си-2-хлорметил-4H-пиран-4-оном (хлоркойевой
ного полного внутреннего отражения на кристалле
кислотой). Результаты экспериментов in silico по
оценке вероятных протеиновых мишеней, токсич-
алмаза, погрешность ± 4 см-1. Спектры ЯМР 1Н и
ности и параметров биодоступности позволяют
13С регистрировали на приборе Bruker Avance III
рассматривать полученные соединения как пер-
HD 400MHz (400.17 и 100.63 МГц соответственно)
спективные объекты для разработки новых препа-
в растворе ДМСО-d6. Хромато-масс-спектры сое-
ратов с противоопухолевым действием.
динений записывали на приборе Bruker Customer
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1346
ДОЦЕНКО и др.
MicrOTOF в диапазоне 50-1200 m/z, метод иони-
2-{[(5-Гидрокси-4-оксо-4H-пиран-2-ил)ме-
зации - электроспрей (ESI). Элементный анализ
тил]тио}-6-фенил-4-(2,4-дихлорфенил)никоти-
проводили на приборе Elementar vario Micro cube.
нонитрил (13б). Выход 30%, коричневый поро-
Индивидуальность полученных образцов контро-
шок. ИК спектр, ν, см-1: 1649 (С=О), 2223 (C≡N),
лировали методом ТСХ на пластинах Сорбфил-А
3226 (O-H). Спектр ЯМР 1Н, δ, м. д.: 4.64 с (2Н,
(производство «ООО Имид», Краснодар), элюент -
SCH2), 6.47 с (1Н, Н3пиран), 7.52-7.56 м (5Н, Н-Ar),
ацетон-гексан (1:1) или этилацетат, проявитель -
7.65-7.66 м (2Н, Н-Ar), 7.90 д (1Н, H-Ar, 4J 0.9 Гц),
пары иода, УФ детектор.
7.99 с (1Н, H5-Py), 8.01 с (1Н, Н6пиран), 8.22-8.24 м
(2Н, Н-Ar). Сигнал ОН не проявляется вследствие
Исходные 3-цианопиридин-2(1Н)-тионы 12а, б
дейтерообмена. Спектр ЯМР 13С DEPTQ, δC, м. д.:
[80, 81] и 2-тиоксо-1,2-дигидрохиноксалин 14 [82]
30.8 (SCH2), 104.6 (С-С≡N), 112.1* (C3Н, пиран),
получали по известным методикам. Хлоркойевая
114.5 (С≡N), 117.5* (C5, Py), 127.6* (СH, Ar), 127.9*
кислота 11 получена обработкой коммерческой
(СH, Ar), 129.1* (СH, Ar), 131.2* (СH, Ar), 132.3*
койевой кислоты хлористым тионилом [83].
(СH, Ar), 132.5 (Ar), 133.6 (Ar), 135.4 (Ar), 136.1
Общая методика синтеза 5-гидрокси-2-[(ге-
(Ar), 139.6* (C6H, пиран), 145.8 (C5, пиран), 151.5
тарилтио)метил]-4H-пиран-4-онов 13а, б,
15.
(Py), 158.3 (Py), 160.1 (Py), 163.1 (C2, пиран), 173.6
Соответствующий 2-тиоксоникотинонитрил 12а,
(C=O). Масс-спектр, m/z (Iотн, %): 481.50 [M + Na]+
б или тион 14 (2 ммоль) суспендировали в 2 мл
(100), 985.02 [2M + Na]+. Найдено, %: C 59.74; H
ДМФА, затем добавляли водный 10%-ный раствор
3.10; N 5.94. C24H14Cl2N2O3S (M 481.35). Вычисле-
KОН (1.03 мл, 2 ммоль, d 1.09 г/мл). Полученную
но, %: C 59.89; H 2.93; N 5.82.
суспензию перемешивали при комнатной тем-
5-Гидрокси-2-({[3-(4-метоксифенил)хинок-
пературе до растворения, затем через бумажный
салин-2-ил]тио}метил)-4H-пиран-4-он
(15).
фильтр по каплям прибавляли к раствору 321 мг
Выход 28%, коричневый порошок. ИК спектр, ν,
(2 ммоль) хлоркойевой кислоты 11 в 0.5 мл ДМФА.
см-1: 1646 (С=О), 3253 (O-H). Спектр ЯМР 1Н, δ,
Смесь перемешивали 30 мин, образовавшийся
м. д.: 3.85 с (3Н, MeO), 4.47 с (2Н, SCH2), 6.59 с
осадок продукта S-алкилирования отфильтровы-
(1Н, Н3пиран), 7.10-7.12 м (2Н, Н-Ar), 7.72-8.03 м
вали, промывали 50%-ным этанолом и сушили при
(8Н, Н-Ar, наложение с Н5пиран), 9.11 с (1Н, OH).
60°С.
Спектр ЯМР 13С DEPTQ, δC, м. д.: 31.6 (SCH2),
2-{[(5-Гидрокси-4-оксо-4H-пиран-2-ил)ме-
55.3* (MeO), 112.9* (C3Н, пиран), 113.9* (CH, Ar),
тил]тио}-4,6-дифенилникотинонитрил
(13а).
127.1* (CH, Ar), 128.8* (CH, Ar), 129.0* (CH, Ar),
Выход
75%, светло-коричневый порошок. ИК
129,1* (CH, Ar), 130.4* (CH, Ar), 130.5* (CH, Ar),
спектр, ν, см-1: 1647 (С=О), 2218 (C≡N), 3239 (O-H).
139.1 (Ar), 139.8* (CH, пиран), 143.5* (C5, пиран),
Спектр ЯМР 1Н, δ, м. д.: 4.64 с (2Н, SCH2), 6.50 с
145.7 (Ar), 152.4 (Ar), 152.9 (Ar), 160.6 (Ar), 163.6
(1Н, Н3пиран), 7.53-7.59 м (6Н, Н-Ph), 7.74-7.77 м
(C2, пиран), 173.6 (C=O).. Найдено, %: C 64.15; H
(2Н, Н-Ph), 7.96 с (1Н, H5-Py), 8.09 с (1Н, Н6пиран),
4.22; N 7.24. C21H16N2O4S (M 392.43). Вычислено,
8.24-8.26 м (2Н, Н-Ph), 9.15 уш. с (1Н, OH). Спектр
%: C 64.27; H 4.11; N 7.14.
ЯМР 13С DEPTQ, δC, м. д.: 30.8 (SCH2), 103.1 (С-
ИНФОРМАЦИЯ ОБ АВТОРАХ
С≡N), 112.2* (C3Н, пиран), 115.5 (С≡N), 116.9*
(C5, Py), 127.6* (2C, СН, Ph), 128.7* (2C, СН, Ph),
Доценко Виктор Викторович, ORCID: http://
128.9* (2C, СН, Ph), 129.0* (2C, СН, Ph), 130.2*
orcid.org/0000-0001-7163-0497
(С4Н, Ph), 131.0* (С4Н, Ph), 135.5 (C1, Ph), 136.4
(C1, Ph), 139.8* (C6H, пиран), 145.8 (C5, пиран),
org/0000-0003-1230-1305
154.5 (Py), 158.1 (Py), 160.6 (Py), 163.8 (C2, пиран),
Тебиев Дмитрий Тимурович ORCID: http://
173.6 (C=O). Здесь и далее звездочкой обозначены
orcid.org/0000-0003-2855-2205
сигналы в противофазе. Масс-спектр, m/z (Iотн, %):
Киндоп Вячеслав Константинович, ORCID:
451.05 [M + K]+ (100), 863.15 [2M + K]+. Найдено,
%: C 69.77; H 4.06; N 6.90. C24H16N2O3S (M 412.46).
Вычислено, %: C 69.89; H 3.91; N 6.79.
Аксенов Николай Александрович, ORCID:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ И СВОЙСТВА НОВЫХ 5-ГИДРОКСИ-2-[(ГЕТАРИЛТИО)МЕТИЛ]-4H-ПИРАН-4-ОНОВ
1347
Аксенова Инна Валерьевна, ORCID: http://
10.
Saruno R., Kato F., Ikeno T. // Agric. Biol. Chem. 1979.
orcid.org/0000-0002-8083-1407
Vol. 43. N 6. P. 1337. doi 10.1271/bbb1961.43.1337
11.
Cabanes J., Chazarra S., Garcia-Carmona F. // J.
Нетреба Евгений Евгеньевич, ORCID: http://
Pharm. Pharmacol. 1994. Vol. 46. N 12. P. 982. doi
orcid.org/0000-0001-9292-1904
10.1111/j.2042-7158.1994.tb03253.x
12.
Noh J.M., Kwak S.Y., Kim D.H., Lee Y.S. // Biopolymers
БЛАГОДАРНОСТЬ
(Pept. Sci.). 2007. Vol. 88. N 2. P. 300. doi 10.1002/
Исследования проведены с использованием
bip.20670
оборудования научно-образовательного центра
13.
Noh J.M., Kwak S.Y., Seo H.S., Seo J.H., Kim B.G., Lee
Y.S. // Bioorg. Med. Chem. Lett. 2009. Vol. 19. N 19. P.
«Диагностика структуры и свойств наноматериа-
5586. doi 10.1016/j.bmcl.2009.08.041
лов» и оборудования Эколого-аналитического цен-
14.
Lee Y.S., Park J.H., Kim M.H., Seo S.H., Kim H.J. //
тра Кубанского государственного университета.
Arch. Pharm. 2006. Vol. 339. N 3. P. 111. doi 10.1002/
ФОНДОВАЯ ПОДДЕРЖКА
ardp.200500213
15.
Singh B.K., Park S.H., Lee H.B., Goo Y.A., Kim H.S.,
Работа выполнена при финансовой поддержке
Cho S.H., Lee J.H., Ahn G.W., Kim J.P., Kang S.M.,
Российского фонда фундаментальных исследова-
Kim, E.K. // Ann. Dermatol. 2016. Vol. 28. N 5. P. 555.
ний и администрации Краснодарского края в рам-
doi 10.5021/ad.2016.28.5.555
ках научного проекта № 19-43-230007 р_а, а также
16.
Lachowicz J.I., Nurchi V.M., Crisponi G.,
Pelaez M.D.G.J., Rescigno A., Stefanowicz P., Cal M.,
Министерства образования и науки Российской
Szewczuk Z. // J. Inorg. Biochem. 2015. Vol. 151. P. 36
Федерации (тема 0795-2020-0031).
17.
Hashemi S.M., Emami S. // Pharm. Biomed. Res. 2015.
КОНФЛИКТ ИНТЕРЕСОВ
Vol. 1. N 1. P. 1. doi 10.18869/acadpub.pbr.1.1.1
18.
Karakaya G., Türe A., Ercan A., Öncül S., Aytemir M.D. //
Авторы заявляют об отсутствии конфликта
Bioorg. Chem. 2019. Vol. 88. paper N 102950. doi
интересов.
10.1016/j.bioorg.2019.102950
19.
Ashooriha M., Khoshneviszadeh M., Khoshneviszadeh M.,
СПИСОК ЛИТЕРАТУРЫ
Moradi S.E., Rafiei A., Kardan M., Emami S. //
Bioorg. Chem. 2019. Vol. 82. P. 414. doi 10.1016/j.
1. Beélik A. // Adv. Carbohyd. Chem. 1956. Vol. 11. P. 145.
bioorg.2018.10.069
doi 10.1016/S0096-5332(08)60118-6
20.
Ashooriha M., Khoshneviszadeh M., Khoshneviszadeh M.,
2. Saeedi M., Eslamifar M., Khezri K. // Biomed.
Rafiei A., Kardan M., Yazdian-Robati R., Emami S. //
Pharmacother. 2019. Vol. 110. P. 582. doi 10.1016/j.
Eur. J. Med. Chem. 2020. Vol. 201. Paper N 112480.
biopha.2018.12.006
doi 10.1016/j.ejmech.2020.112480
3. Aytemir M.D., Karakaya G. Kojic acid derivatives.
21.
Rho H.S., Baek H.S., Ahn S.M., Kim M.K., Ghimeray A.K.,
Medicinal Chemistry and Drug Design. Rijeka: InTech
Cho D.H., Hwang J.S. // Bull. Korean Chem. Soc. 2010.
Open Access Publisher, 2012, P. 1. doi 10.5772/31006
Vol. 31. N 8. P. 2375. doi 10.5012/bkcs.2010.31.8.2375
4. Chaudhary J., Pathak A.N., Lakhawat S. // Ann.
Res. Rev. Biol. 2014. P. 3165. doi 10.9734/
22.
Xie W., Zhang J., Ma X., Yang W., Zhou Y., Tang X.,
Zou Y., Li H., He J., Xie S., Zhao Y., Liu F. // Chem.
ARRB/2014/10643
Biol. Drug Des. 2015. Vol. 86. N 5. P. 1087. doi 10.1111/
5. Mohamad R., Mohamed M.S., Suhaili N., Salleh M.M.,
Ariff A.B. // Biotech. Mol. Biol. Rev. 2010. Vol. 5. N 2.
cbdd.12577
P. 24. doi 10.5897/BMBR2010.0004
23.
Takeuchi K., Hattori Y., Kawabata S., Futamura G.,
6. Kandioller W., Kurzwernhart A., Hanif M., Meier
Hiramatsu R., Wanibuchi M., Tanaka H., Masunaga S-i.,
S.M., Henke H., Keppler B.K., Hartinger C.G. // J.
Ono K., Miyatake S-I., Kirihata M. // Cells. 2020. Vol. 9.
Organomet. Chem. 2011. Vol. 696. N 5. P. 999. doi
N 6. Paper N 1551. doi 10.3390/cells9061551
10.1016/j.jorganchem.2010.11.010
24.
Maloney P.R., Khan P., Hedrick M., Gosalia P.,
7. Zirak M., Eftekhari-Sis B. // Turk. J. Chem. 2015.
Milewski M., Li L., Roth G.P., Sergienko E., Suyama E.,
Vol. 39. N 3. P. 439. doi 10.3906/kim-1502-55
Sugarman E., Nguyen K., Mehta A., Vasile S., Su Y.,
8. Mohajer F., Mohammadi Ziarani G. // Heterocycles.
Stonich D., Nguyen H., Zeng F.-Y., Novo A.M.,
2021. Vol. 102. N 2. P. 211. doi 10.3987/REV-20-936
Vicchiarelli M., Diwan J., Chung T.D.Y., Smith L.H.,
9. Chaudhary A. // Curr. Org. Chem. 2020. Vol. 24. N 14.
Pinkerton A.B. // Bioorg. Med. Chem. Lett. 2012.
P. 1643. doi 10.2174/1385272824999200622113153
Vol. 22. N 21. P. 6656. doi 10.1016/j.bmcl.2012.08.105
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1348
ДОЦЕНКО и др.
25.
Lucas S.D., Gonçalves L.M., Carvalho L.A.R., Cor-
44.
Sepehri N., Iraji A., Yavari A., Asgari M.S., Zamani S.,
reia H.F., Da Costa E.M.R., Guedes R.A., Moreira R.,
Hosseini S., Bahadorikhalili S., Pirhadi S., Larijani B.,
Guedes R.C. // J. Med. Chem. 2013. Vol. 56. N 23.
Khoshneviszadeh M., Hamedifar H., Mahdavi M.,
P. 9802. doi 10.1021/jm4011725
Khoshneviszadeh M. // Bioorg. Med. Chem. 2021.
26.
Karakaya G., Aytemir M.D., Özçelik B., Çalış Ü. // J.
Vol. 36. Paper N 116044. doi 10.1016/j.bmc.2021.116044
Enzyme Inhib. Med. Chem. 2013. Vol. 28. N 3. P. 627.
45.
Schrader G., Lorenz W., Cölin R., Schlör H.-H. Pat. US
doi 10.3109/14756366.2012.666538
3232830 (1966) // C. A. 1966. Vol. 64. 15923.
27.
Karakaya G., Ercan A., Öncül S., Aytemir M.D. // J.
46.
Metivier J. Pat. US 2752283 (1956).
Res. Pharm. 2019. Vol. 23. N 4. P. 596. doi 10.12991/
47.
Litvinov V.P., Rodinovskaya L.A., Sharanin Yu.A.,
jrp.2019.167
Shestopalov A.M., Senning A. // J. Sulfur Chem. 1992.
28.
Krimmel C. P. Pat. US 2700045 (1955) // C. A. 1956.
Vol. 13. N 1. P. 1. doi 10.1080/01961779208048951
Vol. 50. 411.
48.
Litvinov V.P. // Phosphorus, Sulfur, Silicon,
29.
Veverka M. // Chem. Pap. 1992. Vol. 46. N 3. P. 208.
Relat. Elem. 1993. Vol. 74. N 1. P. 139. doi
30.
Kipnis F., Soloway H., Ornfelt J. // J. Am. Chem. Soc.
10.1080/10426509308038105
1948. Vol. 70. N 12. P. 4264. doi 10.1021/ja01192a080
49.
Литвинов В.П. // Изв. АН. Сер. xим. 1998. № 11.
31.
Krimmel C. P. Pat. US 2715130 (1955).
С. 2123; Litvinov V.P. // Russ. Chem. Bull. 1998.
32.
Krimmel C. P. Pat. US 2851467 (1958).
Vol. 47. N 11. P. 2053. doi 10.1007/BF02494257
33.
White R.L., Jr., Schwan T.J., Alaimo R.J. // J. Heterocycl.
50.
Литвинов В.П., Кривоколыско С.Г., Дяченко В.Д. //
Chem. 1980. Vol. 17. N 4. P. 817. doi 10.1002/
ХГС. 1999. № 5. С. 579; Litvinov V.P., Krivokolys-
jhet.5570170442
ko S.G., Dyachenko V.D. // Chem. Heterocycl. Compd.
34.
Rho H.S., Ahn S.M., Yoo D.S., Kim M.K., Cho D.H.,
1999. Vol. 35. N 5. P. 509. doi 10.1007/BF02324634
Cho J.Y. // Bioorg. Med. Chem. Lett. 2010. Vol. 20.
51.
Литвинов В.П., Доценко В.В., Кривоколыско С.Г. //
N 22. P. 6569. doi 10.1016/j.bmcl.2010.09.042
Изв. АН. Сер. xим. 2005. № 4. С. 847; Litvinov V.P.,
35.
Rho H.S., Yoo D.S., Ahn S.M., Kim M.K., Cho D.H.,
Dotsenko V.V., Krivokolysko S.G. // Russ. Chem. Bull.
Cho J.Y. // Bull. Korean Chem. Soc. 2010. Vol. 31. N 11.
2005. Vol. 54. N 4. P. 864. doi 10.1007/s11172-005-
P. 3463. doi 10.5012/bkcs.2010.31.11.3463
0333-1
36.
Uher M., Kyselicova L., Rajniakova O., Hudecova D.,
52.
Литвинов В.П. // Усп. хим. 2006. Т. 75. № 7. С. 645;
Bransova J., Brtko J. // Chem. Pap. 1997. Vol. 51.
Litvinov V.P. // Russ. Chem. Rev. 2006. Vol. 75. N 7.
N 6B. P. 421
P. 577. doi 10.1070/RC2006v075n07ABEH003619
37.
Rondahl L., Uher Μ., Brtko J. // Heterocycl. Commun.
53.
Litvinov V.P., Dotsenko V.V., Krivokolysko S.G. // Adv.
2003. Vol. 9. N 3. P. 257. doi 10.1515/HC.2003.9.3.257
Heterocycl. Chem. 2007. Vol. 93. P. 117. doi 10.1016/
38.
Uher M., Szymońska J., Korenova A., Tomasik P.
S0065-2725(06)93003-7
// Monatsh. Chem. 2000. Vol. 131. N 3. P. 301. doi
54.
Доценко В.В., Бурый Д.С., Лукина Д.Ю., Кривоколы-
10.1007/s007060070106
ско С.Г. // Изв. АН. Сер. xим. 2020. № 10. С. 1829;
39.
Bransova J., Uher M., Novotny L., Brtko J. // Anticancer
Dotsenko V.V., Buryi D.S., Lukina D.Yu., Krivokolys-
Res. 1997. Vol. 17. P. 1175.
ko S.G. // Russ. Chem. Bull. 2020. Vol. 69. N 10. P.
40.
Wu Z., Cao A., Ding W., Zhu T., Shen P. // J.
1829. doi 10.1007/s11172-020-2969-2
Carbohydr. Chem. 2016. Vol. 35. N 7. P. 355. doi
55.
Salem M.A., Helel M.H., Gouda M.A., Ammar Y.A.,
10.1080/07328303.2016.1261881
El-Gaby M.S.A. // Synth. Commun. 2018. Vol. 48. N 4.
41.
Xie W., Zhang H., He J., Zhang J., Yu Q., Luo C., Li S.
P. 345. doi 10.1080/00397911.2017.1394468
// Bioorg. Med. Chem. Lett. 2017. Vol. 27. N 3. P. 530.
doi 10.1016/j.bmcl.2016.12.027
56.
Gouda M.A., Attia E., Helal M.H., Salem M.A. // J.
Heterocycl. Chem. 2018. Vol. 55. N 10. P. 2224. doi
42.
Raje M., Hin N., Duvall B., Ferraris D.V., Berry J.F.,
Thomas A.G., Alt J., Rojas C., Slusher B.S., Tsukamo-
10.1002/jhet.3298
to T. // Bioorg. Med. Chem. Lett. 2013. Vol. 23. N 13.
57.
Gouda M.A., Hussein B.H., Helal M.H., Salem M.A. //
P. 3910. doi 10.1016/j.bmcl.2013.04.062
J. Heterocycl. Chem. 2018. Vol. 55. N 7. P. 1524. doi
43.
Sherafati M., Mirzazadeh R., Barzegari E., Mohammadi-
10.1002/jhet.3188
Khanaposhtani M., Azizian H., Asgari M.S., Hosseini S.,
58.
Shamroukh A.H., Kotb E.R., Anwar M.M., Sharaf M. //
Zabihi E., Mojtabavi S., Faramarzi M.A., Mahdavi M.,
Egypt. J. Chem. 2021. Vol. 64. N 8. P. 4509. doi
Larijani B., Rastegar H., Hamedifar H., Hajimiri M.H. //
10.21608/EJCHEM.2021.64971.3392
Bioorg. Chem. 2021. Vol. 109. Paper N 104703. doi
59.
Quiliano M., Aldana I. // Rev. Virtual Quim. 2013.
10.1016/j.bioorg.2021.104703
Vol. 5. N 6. P. 1120. doi 10.5935/1984-6835.20130081
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ И СВОЙСТВА НОВЫХ 5-ГИДРОКСИ-2-[(ГЕТАРИЛТИО)МЕТИЛ]-4H-ПИРАН-4-ОНОВ
1349
60.
Mamedov V.A., Zhukova N.A. // Progress Heterocycl.
Document on Acute oral Toxicity Testing. ENV/JM/
Chem. 2012. Vol. 24. P. 55. doi 10.1016/B978-0-08-
096807-0.00002-6
officialdocuments/publicdisplaydocumentpdf/?cote=e
61.
Mamedov V.A., Zhukova N.A. // Progress Heterocycl.
nv/jm/mono(2001)4&doclanguage=en
Chem. 2013. Vol. 25. P. 1. doi 10.1016/B978-0-08-
75.
Yang J., Kwon S., Bae S.H., Park K.M., Yoon C.,
099406-2.00001-7
Lee J.H., Seok C. // J. Chem. Inf. Model. 2020. Vol. 60.
62.
Cheng G., Sa W., Cao C., Guo L., Hao H., Liu Z., Wang X.,
N 6. P. 3246. doi 10.1021/acs.jcim.0c00104
Yuan Z. // Front. Pharmacol. 2016. Vol. 7. Paper N 64.
76.
GalaxyWEB. A web server for protein structure
doi 10.3389/fphar.2016.00064
prediction, refinement, and related methods.
63.
González M., Cerecetto H.
// Exp. Opin.
Computational Biology Lab, Department of Chemistry,
Therap. Pat. 2012. Vol. 22. N 11. P. 1289. doi
10.1517/13543776.2012.724677
seoklab.org/index.html
64.
Pereira J.A., Pessoa A.M., Cordeiro M.N.D.S.,
77.
Ko J., Park H., Heo L., Seok C. // Nucleic Acids Res.
Fernandes R., Prudêncio C., Noronha J.P., Vieira M. //
2012. Vol. 40. Iss. W1. P. W294. doi 10.1093/nar/gks493
Eur. J. Med. Chem. 2015. Vol. 97. P. 664. doi 10.1016/j.
78.
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S.,
ejmech.2014.06.058
Greenblatt D.M., Meng E.C., Ferrin T.E. // J. Сomput.
65.
Montana M., Mathias F., Terme T., Vanelle P. // Eur.
Chem. 2004. Vol. 25. N 13. P. 1605. doi 10.1002/
J. Med. Chem. 2019. Vol. 163. P. 136. doi 10.1016/j.
jcc.20084
ejmech.2018.11.059
79.
UCSF Chimera. Visualization system for exploratory
66.
Ajani O.O. // Eur. J. Med. Chem. 2014. Vol. 85. P. 688.
research and analysis developed by the Resource for
doi 10.1016/j.ejmech.2014.08.034
Biocomputing, Visualization, and Informatics at the
67.
El Newahie A.M.S., Ismail N.S.M., Abou El Ella D.A.,
University of California, San Francisco, US. https://
Abouzid K.A.M. // Arch. Pharm. 2016. Vol. 349. N 5.
P. 309. doi 10.1002/ardp.201500468
80.
Бурый Д.С., Доценко В.В., Левашов А.С., Лукина Д.Ю.,
68.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
Стрелков В.Д., Аксенов Н.А., Аксенова И.В., Не-
Adv. Drug. Delivery Rev. 1997. Vol. 23. N 1-3. P. 4. doi
треба Е.Е. // ЖОХ. 2019. Т. 89. № 5. с. 690; Buryi
10.1016/S0169-409X(96)00423-1
D.S., Dotsenko V.V., Levashov A.S., Lukina D.Yu., Strel-
69.
Lipinski C.A. // Drug Discov. Today: Technologies. 2004.
kov V.D., Aksenov N.A., Aksenova I.V., Netreba E.E.
Vol. 1. N 4. P. 337. doi 10.1016/j.ddtec.2004.11.007
// Russ. J. Gen. Chem. 2019. Vol. 89. N 5. P. 886. doi
70.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
10.1134/S1070363219050050
Adv. Drug. Delivery Rev. 2012. Vol. 64. Suppl. P. 4. doi
81.
Шестопалов А.М, Никишин К.Г., Громова А.В., Ро-
10.1016/j.addr.2012.09.019
диновская Л.А. // Изв. АН. Сер. xим. 2003. № 10.
71.
Sander T. OSIRIS Property Explorer. Idorsia
С. 2087; Shestopalov A.M., Nikishin K.G., Gromova
chemistry.org/prog/peo/
A.V., Rodinovskaya L.A. // Russ. Chem. Bull. 2003.
72.
Daina A., Michielin O., Zoete V. // Sci. Rep. 2017.
Vol. 52. N 10. P. 2203. doi 10.1023/B:RUCB.000001
Vol. 7. Article N 42717. doi 10.1038/srep42717
1879.89900.1f
73.
Lagunin A., Zakharov A., Filimonov D., Poroikov V. //
82.
Viola H., Mayer R., Jähne E. Pat. DD144917 (1980).
Mol. Inform. 2011. Vol. 30. N 2-3. P. 241. doi 10.1002/
GDR.
minf.201000151
83.
Aghbash K.O., Pesyan N.N., Marandi G., Dege N.,
74.
OECD Environment, Health and Safety Publications
Şahin E. // Res. Chem. Intermed. 2019. Vol. 45. N 9.
Series on Testing and Assessment No 24. Guidance
P. 4543. doi 10.1007/s11164-019-03848-7
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1350
ДОЦЕНКО и др.
Synthesis and Properties of New
5-Hydroxy-2-[(hetarylthio)methyl]-4H-pyran-4-ones
V. V. Dotsenkoa,b,*, D. D. Guza, D. T. Tebieva, V. K. Kindopa, N. A. Aksenovb,
I. V. Aksenovab, and E. E. Netrebac
a Kuban State University, Krasnodar, 350040 Russia
b North Caucasus Federal University, Stavropol, 355009 Russia
c Taurida Academy of the V.I. Vernadsky Crimean Federal University, Simferopol, 295007 Russia
*e-mail: victor_dotsenko_@mail.ru
Received July 10, 2021; revised July 28, 2021; accepted July 29, 2021
The reaction of 2-thioxoazines with chlorokojic acid in the presence of KOH in DMF led to the formation of
new hybrid molecules containing fragments of kojic acid and azaheterocycle linked by the SCH2 spacer. In
silico prediction of bioavailability parameters was carried out, possible protein targets were predicted by the
protein ligand docking method.
Keywords: chlorokojic acid, 3-cyanopyridine-2(1H)-thiones, 2-thioxo-1,2-dihydroquinoxalines, S-alkylation,
calculated biological activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021