ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 9, с. 1426-1437
УДК 541.49;543.428.3;544.52;546.47;547.574
СИНТЕЗ, СТРОЕНИЕ,
СПЕКТРАЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ
СВОЙСТВА И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
ХЛОРЗАМЕЩЕННЫХ АЗОМЕТИНОВ И
КОМПЛЕКСОВ ЦИНКА(II) НА ИХ ОСНОВЕ
© 2021 г. М. С. Милуткаа, А. С. Бурлова,*, В. Г. Власенкоb, Ю. В. Кощиенкоа,
Н. И. Макароваа, А. В. Метелицаа, Е. В. Коршуноваа, А. Л. Тригубc,
А. А. Зубенкоd, А. И. Клименкоd
a Научно-исследовательский институт физической и органической химии Южного федерального университета,
пр. Стачки 194/2, Ростов-на-Дону, 344090 Россия
b Научно-исследовательский институт физики Южного федерального университета,
Ростов-на-Дону, 344090 Россия
c Национальный исследовательский центр «Курчатовский институт», Москва, 123182 Россия
d Северо-Кавказский зональный научно-исследовательский ветеринарный институт, Новочеркасск, 346421 Россия
*e-mail: anatoly.burlov@yandex.ru
Поступило в Редакцию 12 июля 2021 г.
После доработки 20 июля 2021 г.
Принято к печати 22 июля 2021 г.
Синтезирован ряд хлорзамещенных азометинов 2-гидроксибензальдегидов и комплексов цинка(II) на
их основе. Структура азометинов и комплексов цинка установлена методами элементного анализа, ИК,
ЯМР 1Н и рентгеновской спектроскопии. Комплексы ZnL2 имеют тетраэдрическое строение. В хлори-
стом метилене комплексы проявляют слабые фотолюминесцентные свойства, тогда как для твердых
комплексов квантовые выходы фотолюминесценции в 100 раз выше. Изучена биологическая активность
азометинов и комплексов цинка.
Ключевые слова: азометины, комплексы цинка, фотолюминесценция, биологическая активность
DOI: 10.31857/S0044460X21090146
Хелатообразующие азометиновые соединения
Комплексы металлов с основаниями Шиффа
и комплексы металлов на их основе привлекают
находят применение в гомогенном и гетерогенном
постоянное внимание исследователей [1-12]. Это
катализе. Например, комплексы меди N-(2-гидрок-
обусловлено их относительной синтетической
сибензилиден)арил(алкил)аминов используются в
доступностью, большой вариабельностью струк-
качестве катализаторов эпоксидирования и окис-
тур и целым рядом практически важных свойств.
ления олефинов [32-34]. Комплексы цинка, кад-
Азометины и комплексы металлов на их основе
мия, бериллия и др. с азометиновыми лигандами,
обладают широким спектром биологической ак-
проявляющие фотолюминесцентные свойства, мо-
тивности [13-18], в том числе противогрибковой
гут быть использованы при изготовлении электро-
[19, 20], антибактериальной [21, 22], противомаля-
люминесцентных устройств, например, в качестве
рийной [23-25], противораковой [26-29], противо-
эмиссионных слоев OLED [35, 36-38]. Они обла-
вирусной [30, 31], что делает их востребованными
дают термической стабильностью, высокими элек-
в медицине, ветеринарии, сельском хозяйстве.
тронно-транспортными свойствами, легко субли-
1426
СИНТЕЗ, СТРОЕНИЕ, СПЕКТРАЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
1427
Схема 1.
R2
H2N
R3
R2
R6
R4
R1
OH
R5
1
R
OH
N R3
CH3COOH
CHO
R6
R4
R5
1а-1г
R5
R4
R6
R2
R3
N
Zn(CH3COO)2 . 2H2O
R1
O
Zn O
R1
N R3
R2
R6
R4
R5
2а-2г
R1 = R5 = Cl, R2 = R3 = R4 = R6 = H (а); R1 = R4 = R5 = Cl, R2 = R3 = R6 = H (б); R1 = R2 = R5 = Cl, R3 = R4 = R6 = H (в);
R1 = R2 = R4 = R5 = Cl, R3 = R6 = H (г).
мируются при формировании пленок. Наиболее
ства, одно из которых имело максимальную яр-
востребованы люминесцентные соединения, излу-
кость около 8000 кд/м2 при 17 В, а для двух других
чающие в диапазоне 400-450 нм, - основные со-
яркость составила 2500 и 3000 кд/м2 соответствен-
ставляющие синих, красных и белых излучателей
но. Синтез новых азометиновых комплексов цин-
в оптоэлектронике [39-41]. На основе комплексов
ка, обладающих фото- и электролюминесцентны-
цинка с N-(2-гидроксибензилиден)ариламинами
ми свойствами, по-прежнему актуален.
изготовлены OLED устройства различных конфи-
Нами получена серия хлорзамещенных азоме-
гураций, которые продемонстрировали изменение
тинов и комплексов цинка(II) на их основе, изу-
характеристик яркости в зависимости от структу-
чены фотолюминесцентные свойства и биологи-
ры комплексов [35, 36-38].
ческая активность этих соединений. Азометины
Ранее получена серия обладающих фотолюми-
1а-г получали конденсацией замещенных 2-ги-
несцентными свойствами, λфл 465-541 нм, ком-
дроксибензальдегидов и аминов в ледяной уксус-
плексов цинка с бидентатными азометиновыми
ной кислоте (схема 1).
лигандами
- N-[2-гидрокси-3-метокси(метил)-
Азометины 1а-г - мелкокристаллические ве-
бензилиден]-2,4,6-триметилиминами [42]. На их
щества от светло-желтого до оранжевого цвета с
основе изготовлены три различные OLED устрой-
т. пл. от 122 до 172°С. Их строение установлено
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1428
МИЛУТКА и др.
Схема 2.
Cl
Cl
Cl
OH
Cl
O
N
NH
Cl
Cl
A
Б
на основании элементного анализа, ИК, ЯМР 1Н
Бисхелатные комплексы цинка 2а-г синтези-
спектроскопии. В ИК спектрах соединений 1а-г
ровали кипячением в смеси метанол-хлороформ
наблюдаются полосы поглощения ν(СH=N) в об-
(1:1) азометина 1а-г и метанольного раствора ди-
ласти 1615-1620 см-1 и ν(Ph-O) 1277-1278 см-1. В
гидрата ацетата цинка в мольном отношении 2:1
спектрах ЯМР 1Н азометинов 1а, б, г присутству-
(схема 1). Комплексы 2а-г - желтые мелкокри-
ют сигналы протонов, соответствующих их струк-
сталлические вещества с высокими температура-
турам. Сигналы протонов фенольных групп ОН
ми плавления. от 262 до >290°С. Согласно дан-
проявляются в виде синглета в интервале 12.36-
ным элементного анализа, комплексы цинка 2а-г
13.57 м. д., а сигналы протонов групп СH=N - в
имеют состав ZnL2. В ИК спектрах комплексов
интервале 8.52-8.92 м. д. В спектре ЯМР 1Н азоме-
цинка полосы поглощения ν(СH=N) наблюдаются
тина 1в наряду с сигналом протона группы ОН при
при 1599-1606 см-1, смещаясь в низкочастотную
12.70 м. д. и сигнала протона группы СН=N при
область на 9-16 см-1 по сравнению с исходными
8.91 м. д. появляются сигнал протона группы NH
азометинами 1а-г, тогда как полосы поглощения
хиноидной формы при 14.11 м. д. и сигнал протона
ν(Ph-O) смещаются в высокочастотную область на
при атоме углерода в группе СН-NН при 9.00 м.
25-42 см-1 до 1301-1319 см-1.
д. Как известно [43, 44], для N-(2-гидроксибензил-
В спектрах ЯМР 1Н комплексов 2а-г исчеза-
иден)арилиминов возможна бензоидно-хиноидная
ют сигналы протонов групп ОН азометинов 1а-г,
таутомерия (схема 2), обусловленная переносом
а сигналы протонов в группах СH=N по сравне-
протона от атома кислорода к атому азота. Таким
нию с азометинами незначительно сдвигаются на
образом, на основании проявления в спектре ЯМР
0.06-0.48 м. д. в сильное поле и проявляются при
1Н сигналов протонов групп OH, CH=N, CH-NH
8.46-8.53 м. д. Изменения, наблюдаемые в спек-
и анализа их интегральных интенсивностей в рас-
трах комплексов 2а-г, по сравнению с исходными
творе в ДМСО предполагается существование
азометинами, характерны для образования хелат-
смеси бензоидного (А) и хиноидного (Б) таутоме-
ных структур [19, 20, 42, 45, 46].
ров азометина 1в в соотношении 1:1.
В спектре ЯМР 1Н комплекса цинка 2в исчеза-
С целью подтверждения этого предположения
ют сигналы протонов групп ОН и NH лиганда 1в, и
проведены квантово-химические расчеты методом
координация атома цинка, как и в других комплек-
функционала плотности для определения относи-
сах 2а, б, г, осуществляется с бензоидной формой,
тельной устойчивости в ДМСО двух таутомерных
о чем свидетельствует вид и характер ЯМР 1Н и
форм А и Б азометина 1в. Из данных расчетов
ИК спектров.
установлено, что энергия хиноидной формы тау-
Локальное атомное строение ближайшего атом-
томера Б всего на 0.66 ккал/моль ниже, чем энер-
ного окружения ионов цинка в комплексах 2а-г
гия бензоидной формы А, что указывает на суще-
установлено по данным рентгеновской спектроско-
ствование таутомерного равновесия комплекса 1в
пии из анализа XANES (X-Ray Absorption Near Edge
в ДМСО.
Structure - околопороговая тонкая структура рентге-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ, СТРОЕНИЕ, СПЕКТРАЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
1429
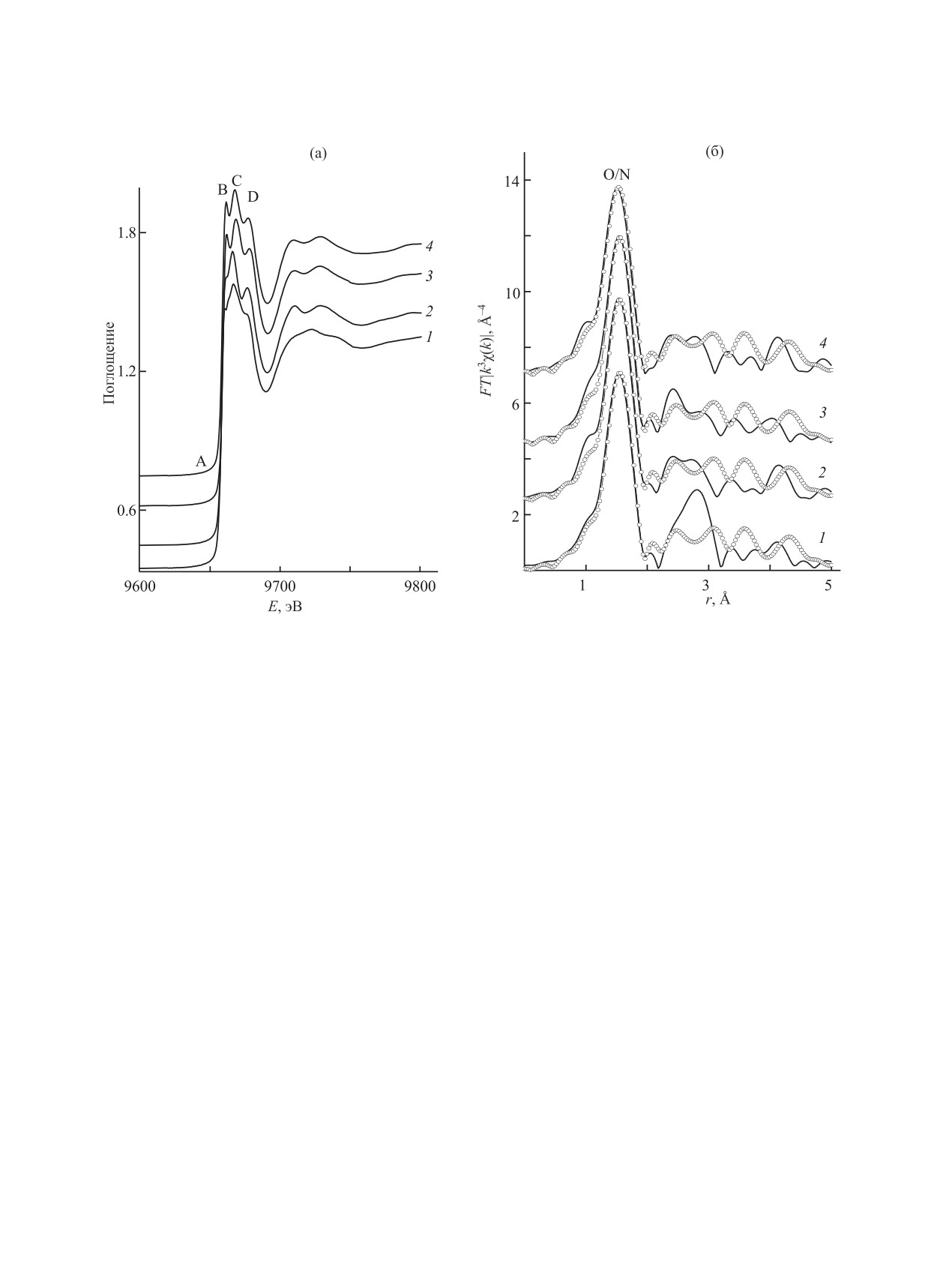
Рис. 1. Нормированные спектры XANES (а) и МФТ EXAFS (б) Zn K-краев поглощения комплексов 2а (1), 2б (2), 2в (3),
2г (4), сплошная линия - экспериментальные данные, светлые кружки - теория.
новского спектра поглощения) и EXAFS (Extended
МФТ имеют основной пик при r 1.51-1.53 Å, ко-
X-Ray Absorption Fine Structure
- протяжен-
торый соответствует рассеянию фотоэлектронной
ная тонкая структура рентгеновского спек-
волны на ближайшей координационной сфере из
тра поглощения) Zn K-краев поглощения. На
атомов азота и кислорода лигандов. Пики МФТ
рис. 1 показаны нормированные спектры XANES
при больших значениях r связаны с последующи-
и соответствующие модули Фурье-трансформант
ми координационными сферами, включающими
(МФТ) EXAFS для полученных соединений. Мож-
различные атомы лигандов, в основном атомы
но отметить, что положение и форма Zn K-краев
углерода. В результате произведенных расчетов
поглощения комплексов 2а-г очень близки, указы-
модельных спектров EXAFS установлено, что бли-
вая на одинаковое окружение ионов цинка в этих
жайшее окружение ионов цинка в комплексах 2а-г
соединениях. В спектрах XANES (рис. 1а) ком-
одинаково и состоит из двух атомов азота и двух
плексов 2а-г отсутствует предкраевой пик А из-
атомов кислорода со средними расстояниями Zn
за заполненной 3d-орбитали Zn(II). Наличие не-
…O около 1.92 Å, Zn …N около 2.01 Å (табл. 1). По-
скольких максимумов B, C и D обычно указывает
лученные факторы Дебая-Уоллера около 0.0032 Å2
на смешанный состав ближайшего окружения ио-
типичны для таких расстояний Zn…O/N в близких
нов цинка (в нашем случае - атомы кислорода и азота).
по строению координационных соединениях [47].
Количественные характеристики координаци-
Проведено сравнительное исследование элек-
онного полиэдра в комплексах 2а-г получены из
тронных спектров азометинов 1а-г и комплексов
анализа EXAFS Zn K-краев поглощения. На рис.
цинка 2а-г, снятых при комнатной температуре в
1б показаны МФТ EXAFS этих соединений. Все
хлористом метилене и в твердом состоянии. Элек-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1430
МИЛУТКА и др.
Таблица 1. Параметрыа локального атомного окружения в комплексах цинка(II)б 2а-г, полученные из анализа
EXAFS Zn K-краев поглощения
Комплекс
Связь
r, Å
σ2, Å2
Q, %
2а
Zn-O
1.90
0.0031
3.0
Zn-N
2.02
0.0031
2б
Zn-O
1.92
0.0032
1.9
Zn-N
2.01
0.0032
2в
Zn-O
1.92
0.0032
1.1
Zn-N
2.01
0.0032
2г
Zn-O
1.92
0.0033
6.1
Zn-N
2.01
0.0033
а r - межатомные расстояния, σ2 - фактор Дебая-Уоллера, Q - функция качества подгонки. Область аппроксимации в простран-
стве Δr = 1.00-1.9 Å.
б Координационное число N = 2.
тронные спектры поглощения (ЭСП) растворов
Азометины 1а-г не люминесцируют. Комплек-
комплексов цинка 2а-г приведены на рис. 2, спек-
сы 2а-г в хлористом метилене проявляют слабую
тральные и фотолюминесцентные характеристики
фотолюминесценцию, квантовые выходы фото-
исследованных соединений даны в табл. 2. В спек-
люминесценции незначительны, φ 0.002-0.008.
тральном диапазоне от 300 до 400 нм электронные
Полосы фотолюминесценции комплексов цинка
спектры поглощения азометинов 1а-г характери-
по сравнению с азометинами 1а-г претерпевают
зуются близкими по форме, положению и интен-
батохромный сдвиг. Стоксов сдвиг (разница мак-
сивности тремя полосами поглощения (табл. 2).
симумов спектров длинноволновых полос погло-
щения и флуоресценции) составил 4431 (2а), 4584
В ЭСП комплексов цинка 2а-г в хлористом ме-
(2б), 4643 (2в), 4903 см-1 (2г) в хлористом метиле-
тилене наблюдаются 4 полосы поглощения в обла-
не и 4923 (2а), 5923 (2б), 6626 (2в), 6634 см-1 (2г)
сти 309-418 нм. Наиболее длинноволновые поло-
для комплексов в твердом виде.
сы поглощения в спектрах комплексов цинка 2а-г
смещены батохромно по сравнению с азометина-
Максимумы полос фотолюминесценции λфл
ми 1а-г на 58-60 нм и наблюдаются при 412 (2а),
комплексов 2а-г в твердом виде еще более сме-
418 (2б), 413 (2в) и 417 нм (2г) соответственно.
щены батохромно по сравнению со спектрами их
Рис. 2. Электронные спектры поглощения (1-4) и фо-
Рис. 3. Спектры фотолюминесценции (λex 390 нм) ком-
толюминесценции (1′-4′) (λex 410 нм) комплексов 2а-г
плексов 2а (1), 2б (2), 2в (3) и 2г (4) в твердом виде при
в хлористом метилене при комнатной температуре.
комнатной температуре.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ, СТРОЕНИЕ, СПЕКТРАЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
1431
Таблица 2. Параметры электронных спектров поглощения и фотолюминесценции азометинов 1а-г и комплексов
2а-г в хлористом метилене и в твердом виде при 293 K
Фотолюминесценция
Соединение
λmax, нм (ε×104, M-1·см-1)
возбуждение
эмиссия
φ
фл
λmax, нм
λmax, нм
1а
311 (11.53), 326 (11.74), 354 (12.84)
2а
268 (2.68), 309 (2.65), 353 (1.97), 412 (1.09)
410/390а
504/543а
0.002/0.147а
1б
310 (10.16), 327 (9.94), 358 (10.96)
2б
269пл (2.50), 310 (2.41), 358 (1.70), 416 (0.99)
416/390а
514/552а
0.002/0.191а
1в
314 (12.58), 328 (12.42), 355 (12.20)
2в
274 (2.62), 314 (2.75), 354 (2.28), 413пл (0.49)
412/390а
511/560а
0.008/0.108а
1г
315 (11.92), 331 (11.74), 359 (10.36)
2г
278 (2.55), 315 (2.76), 355пл (1.82), 415пл (0.70)
418/390а
521/572а
0.003/0.077а
а Данные для комплексов в твердом виде.
Таблица 3. Протистоцидная, фунгистатическая и антибактериальная активности азометинов 1а-г и комплексов
цинка 2а-г
MIC, мкг/мл
Диаметр зоны задержки роста, мм
Cоединение
Staphylococcus aureus
Colpoda steinii
Penicillium italicum
Escherichia coli F 50
6538 P
1а
>500
0
0
0
1б
>500
0
9
8
1в
250
0
0
0
1г
500
0
0
0
2а
>500
0
0
0
2б
500
0
10
8
2в
>500
0
0
0
2г
500
0
0
0
Байкокс (толтразурил)
62.5
-
-
-
Фундазол
-
40
-
-
Фуразолидон
20
18
растворов (на 38-41 нм, рис. 3). Квантовые вы-
азометин 1б, но его активность в 2 раза слабее
ходы фотолюминесценции комплексов в твердом
препарата сравнения фуразолидона. В отношении
виде значительно выше (почти в 100 раз) кванто-
Escherichia coli средне активным оказался азоме-
вых выходов их растворов в хлористом метилене
тин 1б (его активность в 2.2 раза слабее фуразо-
(табл. 2). Наиболее высокие квантовые выходы у
лидона). Комплексы 2 не проявили бактериоста-
комплексов 2а (φ 0.147) и 2б (φ 0.191).
тической активности в отношении Staphylococcus
Азометины 1а-г и комплексы цинка 2а–г были
aureus и Escherichia coli, за исключением ком-
исследованы на антибактериальную, протисто-
плекса 2б, активность которого в отношении этих
цидную и фунгистатическую активности (табл. 3).
бактерий по сравнению с препаратом сравнения
Азометины 1а-г и комплексы цинка 2а-г не про-
фуразолидоном оказалось в 2 и 2.2 раза слабее со-
явили фунгистатическую активность в отношении
ответственно.
Penicillium italicum. Антибактериальной активно-
При изучении протистоцидных свойств (табл. 3)
стью в отношении Staphylococcus aureus обладал
обнаружено, что среди азометинов наиболее ак-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1432
МИЛУТКА и др.
тивен в отношении Colpoda steinii азометин 1в,
и 3,4-дихлоранилин (CAS № 95-76-1) (Alfa Aesar)
активность которого в 4 раза слабее активности
без предварительной очистки.
препарата сравнения, в то время как активность
Элементный анализ С, H, N выполняли на при-
азометина 1г в 8 раз меньше активности байкокса.
боре Carlo Erba Instruments TCM 480. Количество
Азометины 1а, б не проявили протистоцидной ак-
металла определяли весовым методом. Темпе-
тивности. Наибольшей активностью в отношении
ратуру плавления измеряли на столике Кофлера.
Colpoda steinii обладали комплексы цинка 2б и 2г,
ИК спектры образцов регистрировали на при-
но их активность была в 8 раз слабее по сравне-
боре Varian 3100-FTIR Excalibur в области 4000-
нию с препаратом байкоксом. У комплексов 2а и
400 см-1 методом нарушенного полного внутрен-
2в протистоцидная активность отсутствовала.
него отражения. Спектры ЯМР 1Н регистрировали
Таким образом, получен ряд хлорзамещенных
на приборе Varian Unity-300 (300 МГц) в ДМСО-d6
азометинов 2-гидроксибензальдегидов и комплек-
и CDCl3. Химические сдвиги ядер 1H приведены
сов цинка(II) на их основе. Структура комплексов
относительно остаточных сигналов дейтерора-
установлена методом рентгеновской спектроско-
створителя. Электронные спектры поглощения
пии поглощения. Во всех полученных комплексах
получены для 2.0×10-5 М. растворов на спектро-
вокруг ионов цинка(II) реализуется тетраэдриче-
фотометре Agilent
8453. Фотолюминесцентные
ская конфигурация из двух атомов кислорода и
спектры регистрировали для 5.0×10-6 М. раство-
двух атомов азота. Комплексы цинка в хлористом
ров на флуоресцентном спектрофотометре Varian
метилене проявляют слабые фотолюминесцент-
Cary Eclipse. Все спектры записаны для раство-
ные свойства, однако в твердом виде квантовые
ров в дихлорметане (для спектроскопии, Acros
выходы фотолюминесценции для этих комплексов
Organics) при комнатной температуре. Квантовый
примерно в 100 раз выше.
выход флуоресценции определяли относительно
Изучена биологическая активность азомети-
3-метоксибензантрона в толуоле в качестве стан-
нов и комплексов цинка. Азометин, имеющий
дарта (φфл 0.1, возбуждение при 365 нм) [48]. Спек-
два атома хлора в положениях 4, 6 альдегидного
тры фотолюминесценции соединений в твердом
фрагмента и один атом хлора в положении 4 амин-
состоянии регистрировали с помощью спектро-
ного фрагмента, проявил наибольшую протисто-
метра абсолютного квантового выхода Hamamatsu
цидную активность среди изученных азометинов
C11347-01. Абсолютный квантовый выход фото-
и комплексов цинка. Наибольшей антибактери-
альной активностью обладали 2-[(E)-(3,4-дихлор-
люминесценции определяли с помощью интегри-
фенил)иминометил]-4-хлорфенол и его комплекс
рующей сферы спектрометра Hamamatsu C11347-
с цинком, но их активность в 2-2.2 раза слабее
01 (возбуждение при 390 нм).
активности препарата сравнения фуразолидона.
Рентгеновские Zn K-края поглощения комплек-
Полученные результаты изучения биологической
сов цинка получены на станции «Структурного
активности позволяют считать поиск антипрото-
материаловедения» в Курчатовском синхротрон-
зойных препаратов среди хлорзамещенных азо-
ном центре (Москва) [49]. Энергия электронного
метинов 2-гидроксибензальдегида и комплексов
пучка, который использовался в качестве источ-
металлов на их основе перспективным.
ника рентгеновского синхротронного излучения,
2.5 ГэВ при среднем токе 100-120 мА. Рентгенов-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ские спектры поглощения обрабатывали путем
В работе использовали коммерчески доступ-
стандартных процедур выделения фона, норми-
ные растворители, дигидрат ацетата цинка (CAS
рования на величину скачка K-края и выделения
№ 5970-45-6), 2-гидроксибензальдегид (CAS №
атомного поглощения μ0, после чего проводили
90-02-8),
2-гидрокси-5-хлорбензальдегид (CAS
Фурье-преобразование выделенного EXAFS
№ 635-93-8),
2-гидрокси-3,5-дихлорбензальде-
(χ)-спектра в интервале волновых векторов фотоэ-
гид (CAS № 90-60-8), 2-гидрокси-3,4-дихлорбен-
лектронов k от 2.5 до 12-13 Å-1 с весовой функцией
зальдегид, уксусную кислоту (CAS № 64-19-7),
k3. Точные параметры ближайшего окружения иона
гидроксид натрия (CAS № 1310-73-2), 4-хлорани-
цинка в исследованных соединениях определяли
лин (CAS № 106-47-8), анилин (CAS № 62-53-3),
нелинейной подгонкой параметров соответству-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ, СТРОЕНИЕ, СПЕКТРАЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
1433
ющих координационных сфер при сопоставлении
Уровень антибактериальной активности определя-
рассчитанного EXAFS и выделенного из полного
ли по размеру зон ингибирования роста.
спектра поглощения методом Фурье-фильтрации.
Изучение фунгистатической активности но-
Указанную процедуру производили с использова-
вых веществ проводили на культуре грибов рода
нием пакета программ IFFEFIT [50]. Необходимые
Penicillium, вида Penicillium italicum Wehmer
для построения модельного спектра фазы и ам-
(1894) (полевой изолят) из коллекции микромице-
плитуды рассеяния фотоэлектронной волны рас-
тов лаборатории микотоксикологии ФГБНУ Севе-
считывали по программе FEFF7 [51]. В качестве
ро-Кавказского зонального научно-исследователь-
исходных атомных координат, необходимых для
ского ветеринарного института по методике [20].
расчета фаз и амплитуд рассеяния и дальнейшей
Препаратом сравнения служил фундазол.
подгонки, использовали рентгеноструктурные
Протистоцидную активность изучали на про-
данные для монокристаллов комплексов металлов
стейших вида Colpoda steinii (полевой изолят),
с близкой молекулярной структурой из Кембридж-
коллекция лаборатории паразитологии СКЗНИВИ.
ской базы данных. Функцию качества подгонки Q,
Протистоцидную активность изучали методом се-
минимизацию которой проводили при нахожде-
рийных разведений по методике [20, 57, 58] на
нии параметров структуры ближайшего окруже-
культуре простейших вида Colpoda steinii.. Препа-
ния, рассчитывали по формуле (1).
ратом сравнения служил байкокс (2.5 %-ный рас-
твор толтразурила) в виде водных растворов в тех
же концентрациях, что испытуемые соединения.
(1)
Общая методика синтеза азометинов 1a-г.
К горячему раствору 10 ммоль хлорзамещенного
анилина в 5 мл ледяной уксусной кислоты прибав-
ляли горячий раствор 10 ммоль хлорзамещенного
Здесь w(ki) - весовая функция, m - количество
2-гидроксибензальдегида в 5 мл ледяной уксус-
экспериментальных точек, χdata(Ri) и χth(Ri)
-
ной кислоты. Реакционную массу перемешива-
EXAFS-функции в r-пространстве.
ли 1 ч при 100°С, затем охлаждали до комнатной
Квантово-химические расчеты проводили в
температуры и приливали 10 мл этанола. Осадок
рамках теории функционала плотности с исполь-
отфильтровывали, промывали этанолом и сушили
зованием гибридного обменно-корреляционного
в вакуумном шкафу при 100°С. Перекристаллизо-
функционала B3LYP [52,53] и валентно-расще-
вывали из ледяной уксусной кислоты и промывали
пленного базиса гауссовых функций, расширен-
этанолом.
ного поляризационными d-функциями на тяже-
4-Хлор-2-[(E)-(4-хлорфенил)иминометил]-
лых атомах
6-311++G(d,p)
[54]. Использовали
фенол (1а) получен из 1.56 г 2-гидрокси-5-хлор-
программу Gaussian’03 [55]. Геометрию молекул
бензальдегида и 1.27 г 4-хлоранилина. Выход
оптимизировали без ограничения по симметрии,
2.07 г (78%), желтые кристаллы, т. пл. 151-152°С
минимумы поверхности потенциальной энергии
(AcOH). ИК спектр, ν, см-1: 1615 ср (СH=N), 1276
характеризовали отсутствием мнимых частот рас-
c (Ph-O). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 6.99
считанных нормальных колебаний. Влияние сре-
д (1НAr, 3J 8.7 Гц), 7.41-7.53 м (5НAr), 7.74 д (1НAr,
ды учитывали в рамках модели непрерывной поля-
4J 2.7 Гц), 8.91 с (1Н, СH=N), 12.70 с (1Н, ОН).
ризуемой среды [56] с использованием параметров
Найдено, %: С 58.63; Н 3.47; N 5.23. C13H9Cl2NO.
для растворителя (ДМСО).
Вычислено, %: С 58.67; Н 3.41; N 5.26.
Антибактериальную активность оценивали с
2-[(E)-(3,4-Дихлорфенил)иминометил]-
использованием штаммов Staphylococcus aureus
4-хлорфенол (1б) получен из 1.56 г 2-гидрок-
6538 P и Escherichia coli F 50 (полевые изоляты
си-5-хлорбензальдегида и 1.62 г 3,4-дихлорани-
из коллекции Ростовской областной ветеринарной
лина. Выход 2.4 г (80%), оранжевый порошок,
лаборатории) методом диффузии в агар [20, 57].
т. пл. 137-138°С (AcOH). ИК спектр, ν, см-1:
Фуразолидон использовали в качестве эталона.
1620 с (СH=N), 1278 c (Ph-O). Спектр ЯМР 1Н
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1434
МИЛУТКА и др.
(ДМСО-d6), δ, м. д.: 6.99 д
(1НAr, 3J 9.0 Гц),
4.73; Zn 10.95. C26H16Cl4N2O2Zn. Вычислено, %: С
7.38-7.47 м (2НAr), 7.68 с (1НAr.), 7.71-7.73 м
52.43; Н 2.71; N 4.70; Zn 10.98.
(2НAr), 8.92 с (1Н, СH=N), 12.36 с (1Н, ОН). Най-
Бис{2-[(E)-(3,4-дихлорфенил)иминометил]-
дено, %: С 51.93; Н 2.65; N 4.62. C13H8Cl3NO. Вы-
4-хлорфенокси}цинк
(2б) получен из
0.6 г
числено, %: С 51.95; Н 2.68; N 4.66.
(2 ммоль) азометина 1б. Выход 0.49 г (73%), жел-
2,4-Дихлор-6-[(E)-(4-хлорфенил)имино-
тый порошок, т. пл. 261-262°С. ИК спектр, ν, см-1:
метил]фенол (1в) получен из 1.91 г 2-гидрок-
1604 ср (СH=N), 1312 cр (Ph-O). Спектр ЯМР 1Н
си-3,5-дихлорбензальдегида и 1.27 г 4-хлорани-
(ДМСО-d6), δ, м. д.: 6.62 д (2НAr, 3J 9.0 Гц), 7.24 д
лина. Выход 2.52 г (84%), оранжевый порошок,
(2НAr, 3J 8.4 Гц), 7.34 д. д (2НAr,3J 8.4, 4J 2.1 Гц),
т. пл. 121-122°С (AcOH). ИК спектр, ν, см-1:
7.45 с (2НAr), 7.6 д (2НAr, 3J 8.4 Гц), 7.69 c (2НAr),
1615 ср (СH=N), 1277 cр (Ph-O). Спектр ЯМР 1Н
8.45 с (2Н, СH=N). Найдено, %: С 46.94; Н 2.16; N
(ДМСО-d6), δ, м. д.: 7.41-7.46 м (1.5НAr), 7.49-7.57
4.25; Zn 9.85. C26H14Cl6N2O2Zn. Вычислено, %: С
м (3НAr.), 7.71-7.74 м (1.5НAr), 8.91 с (0.5Н, СH=N),
46.99; Н 2.12; N 4.22; Zn 9.84.
9.00 с (0.5Н, СH-NН),12.70 с (0.5Н, ОН), 14.11 с
Бис{2,4-дихлор-6-[(E)-(4-хлорфенил)имино-
(0.5Н, NН). Найдено, %: С 51.98; Н 2.63; N 4.69.
метил]фенокси]цинк
(2в) получен из
0.6 г
C13H8Cl3NO. Вычислено, %: С 51.95; Н 2.68; N
(2 ммоль) азометина 1в. Выход 0.51 г (76%), жел-
4.66.
тый порошок, т. пл. >290°С. ИК спектр, ν, см-1:
2,4-Дихлор-6-[(E)-(3,4-дихлорфенил)имино-
1599 с (СH=N), 1319 сл (Ph-O). Спектр ЯМР 1Н
метил]фенол (1г) получен из 1.91 г 2-гидрок-
(ДМСО-d6), δ, м. д.: 7.24 д (2НAr, 3J 8.1 Гц), 7.35-7.52
си-3,5-дихлорбензальдегида и 1.62 г 3,4-дихлор-
м (10НAr), 8.47 с (2Н, СH=N). Найдено, %: С 46.95;
анилина. Выход 2.58 г (77%), оранжевый поро-
Н 2.16; N 4.27; Zn 9.80. C26H14Cl6N2O2Zn. Вычис-
шок, т. пл. 171-172°С (AcOH). ИК спектр, ν, см-1:
лено, %: С 46.99; Н 2.12; N 4.22; Zn 9.84.
1615 ср (СH=N), 1278 cр (Ph-O). Спектр ЯМР 1Н
Бис[2,4-дихлор-6-[(E)-(3,4-дихлорфенил)-
(СDCl3), δ, м. д.: 7.13 д. д (1НAr, 3J 8.7, 4J 2.4 Гц),
иминометил]фенокси]цинк
(2г) получен из
7.3 д (1НAr, 4J 2.7 Гц), 7.38 д (1НAr, 4J 2.4 Гц), 7.47
0.67 г (2 ммоль) азометина 1г. Выход 0.52 г (71%),
д (1НAr, 4J 2.4 Гц), 7.5 д (1НAr, 3J 8.7 Гц), 8.52 с (1Н,
желтый порошок, т. пл. >290°С. ИК спектр, ν,
СH=N), 13.57 с (1Н, ОН). Найдено, %: С 46.54; Н
см-1: 1606 с (СH=N), 1318 сл (Ph-O). Спектр ЯМР
2.15; N 4.12. C13H7Cl4NO. Вычислено, %: С 46.61;
1Н (ДМСО-d6), δ, м. д.: 7.46-7.49 м (6НAr), 7.61
Н 2.11; N 4.18.
д (2НAr, 3J 7.2 Гц), 7.93 уш. с (2НAr), 8.46 с (2Н,
Общая методика синтеза комплексов 2а-г.
СH=N). Найдено, %: С 42.53; Н 1.69; N 3.86; Zn
К кипящему раствору 2 ммоль азометина 1а-г в
8.95. C26H12Cl8N2O2Zn. Вычислено, %: С 42.58; Н
30 мл смеси метанола и хлороформа (1:1) при-
1.65; N 3.82; Zn 8.91.
бавляли раствор дигидрата ацетата цинка (0.22 г,
ИНФОРМАЦИЯ ОБ АВТОРАХ
1 ммоль) в 5 мл метанола. Далее по каплям прили-
вали раствор 0.08 г (2 ммоль) гидроксида натрия в
Милутка Максим Сергеевич, ORCID: https://
5 мл метанола. Реакционную массу кипятили 2 ч,
orcid.org/0000-0003-4265-8540
осадок отфильтровывали, промывали метанолом и
Бурлов Анатолий Сергеевич, ORCID: https://
сушили в вакуумном шкафу при 100°С.
orcid.org/0000-0002-9532-7801
Бис{4-хлор-2-[(E)-(4-хлорфенил)имино-
Власенко Валерий Григорьевич, ORCID: https://
метил]фенокси}цинк
(2а) получен из
0.53 г
orcid.org/0000-0001-5470-1564
(2 ммоль) азометина 1а. Выход 0.42 г (70%), жел-
Кощиенко Юрий Владимирович, ORCID:
тый порошок, т. пл. 267-268°С. ИК спектр, ν, см-1:
1600 ср (СH=N), 1301 cр (Ph-O). Спектр ЯМР 1Н
(ДМСО-d6), δ, м. д.: 6.67 д (2НAr, 3J 9.0 Гц), 7.27 д.
Макарова Надежда Ивановна, ORCID: https://
orcid.org/0000-0002-7196-9842
д (2НAr, 3J 9.3, 4J 2.7 Гц), 7.28 д (4НAr, 3J 9.0 Гц),
7.33 д (4НAr, 3J 9.0 Гц), 7.49 д (2НAr, 4J 2.7 Гц),
Метелица Анатолий Викторович, ORCID:
8.53 с (2Н, СH=N). Найдено, %: С 52.47; Н 2.76; N
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ, СТРОЕНИЕ, СПЕКТРАЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
1435
Коршунова Евгения Васильевна, ORCID:
Heterocycl. Chem. 2009. Vol. 97. P. 291. doi 10.1016/
S0065-2725(08)00205-5
10.
Darensbourg D.J., Mackiewicz R.M., Phelps A.L.,
Тригуб Александр Леонидович, ORCID: https://
Billodeaux D.R. // Acc. Chem. Res. 2004. Vol. 37.
orcid.org/0000-0003-1823-887X
N 11. P. 836. doi 10.1021/ar030240u
Зубенко Александр Александрович, ORCID:
11.
Miyasaka H., Saitoh A., Abe S. // Coord. Chem. Rev.
2007. Vol. 251. N 21-24. P. 2622. doi 10.1016/j.
ccr.2007.07.028
ФОНДОВАЯ ПОДДЕРЖКА
12.
Gupta K.S., Sutar A.K. // Coord. Chem. Rev. 2008.
Vol. 252. N 12-14. P. 1420. doi 10.1016/j.
Работа выполнена при финансовой поддержке
ccr.2007.09.005
Российского фонда фундаментальных исследо-
13.
Yousif E., Majeed A., Al-Sammarrae K., Salih N.,
ваний в рамках научного проекта № 20-33-90044
Salimon J., Abdullah B. // Arab. J. Chem. 2017.
«Аспиранты».
Vol. 10. S1639. doi 10.1016/j.arabjc.2013.06.006
14.
Arunadevi A., Raman N. // J. Coord. Chem. 2020.
КОНФЛИКТ ИНТЕРЕСОВ
Vol. 73. P. 2095. doi 10.1080/00958972.2020.1824293
15.
More M.S., Joshi P.G., Mishra Y.K., Khanna P.K. // Mat.
Авторы заявляют об отсутствии конфликта
Today Chem. 2019. Vol. 14. P. 100195. doi 10.1016/j.
интересов.
mtchem.2019.100195
16.
Loginova N.V., Harbatsevich H.I., Osipovich N.P.,
СПИСОК ЛИТЕРАТУРЫ
Ksendzova G.A., Koval’chuk T.V., Polozov G.I. // Curr.
Med. Chem. 2020. Vol. 27. P. 5213. doi 10.2174/09298
1.
Hernandez Molina R., Mederos A. In: Comprehensive
67326666190417143533
Coordination Chemistry II / Ed. A.B.P. Lever.
17.
Erxleben A. // Inorg. Chim. Acta. 2018. Vol. 472. P. 40.
Amsterdam; Oxford; New York: Elsevier-Pergamon
doi 10.1016/j.ica.2017.06.060
Press, 2003. Vol. 1. P. 411.
18.
Kumar S., Dhar D.N., Saxena P. N. // J. Sci. Ind. Res.
2.
Synthetic Coordination and Organometallic Chemistry /
2009. Vol. 68. P. 181.
Eds A.D. Garnovskii, B.I. Kharisov. New York; Basel:
19.
Vlasenko V.G., Burlov A.S., Koshchienko Yu.V.,
Marcel Dekker, 2003. 513 p. doi 10.1023/B:RU
Kiskin M.A., Garnovskii D.A., Zubavichus Ya.V.,
CO.0000011647.15103.04
Kolodina A.A., Trigub A.L., Zubenko A.A., Drobin Yu.D. //
3.
Vigato P.A., Tamburini S. // Coord. Chem. Rev.
Inorg. Chim. Acta 2020. Vol. 510. P. 119776. doi
2004. Vol. 248. N 17-20. P. 1717. doi 10.1016/j.
10.1016/j.ica.2020.119766
cct.2003.09.003
20.
Burlov A.S., Vlasenko V.G., Koshchienko Yu.V., Makaro-
4.
Vigato P.A., Tamburini S., Bertolo L. // Coord. Chem.
va N.I., Zubenko A.A., Drobin Yu.D., Fetisov L.N.,
Rev. 2007. Vol. 251. N 11-12. P. 1311. doi 10.1016/j.
Kolodina A.A., Zubavichus Ya.V., Trigub A.L.,
ccr.2006.11.016
Levchenkov S.I., Garnovskii D.A. // Polyhedron. 2018.
5.
Vigato P.A., Tamburini S. // Coord. Chem. Rev.
Vol. 154. P. 65. doi 10.1016/j.poly.2018.07.034
2008. Vol. 252. N 18-20. P. 1871. doi 10.1016/j.
21.
Hui R.-H., Zhou P., You Z.-L. // Indian J. Chem. (A).
ccr.2007.10.030
2009. Vol. 48. P. 1102.
6.
Гарновский А.Д., Васильченко И.С., Гарновский Д.А. //
22.
Adhikary C., Banerjee S., Chakraborty J., Ianelli S. //
Усп. хим. 2002. Т. 71. № 11. С. 1064; Garnovskii A.D.,
Polyhedron 2013. Vol. 65. P. 48. doi 10.1016/j.
Vasil’chenko I.S., Garnovskii D.A. // Russ. Chem.
poly.2013.08.019
Rev. 2002. Vol. 71. N 11.P. 943. doi 10.1070/
23.
Lopes F., Capela R., Goncaves J.O., Horton P.N.,
RC2002v071n11ABEH000759
Hursthouse M.B., Iley J., Casimiro C.M., Bom J.,
7.
Гарновский А.Д., Васильченко И.С. // Усп. хим. 2005.
Moreira R. // Tetrahedron Lett. 2004. Vol. 45. P. 7663.
Т. 74. № 3. С.211; Garnovskii A.D., Vasil’chenko I.S. //
doi 10.1016/j.tetlet.2004.08.093
Russ. Chem. Rev. 2005. Vol. 74. N 3. P. 193. doi
24.
Savir S., Wei Z.J., Liew J.W.K., Vythilingam I.,
10.1070/RC2005v074n03ABEH001164
Lim Y.A.L., Saad H.M., Sim K.S., Tan K.W. // J. Mol.
8.
Garnovskii A.D., Vasilchenko I.S., Garnovskii D.A.,
Struct. 2020. Vol. 1211. P. 128090. doi 10.1016/j.
Kharisov B.I. // J. Coord. Chem. 2009. Vol. 62. N 2.
molstruc.2020.128090
Р. 151. doi 10.1080/00958970802398178
25.
Mehta J.V., Gajera S.B., Patel M.N. // Spectrochim.
9.
Garnovskii A.D., Sadimenko A.P., Vasilchenko I.S.,
Acta (A). 2015. Vol. 136. P. 1881. doi 10.1016/j.
Garnovskii D.A., Sennikova E.V., Minkin V.I. // Adv.
saa.2014.10.103
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1436
МИЛУТКА и др.
26.
Tadele K.T., Tsega T.W. // Med. Chem. 2019. Vol. 19.
Электролюминесцентные органические светодиоды
P. 1786. doi 10.2174/1871520619666190227171716
на основе координационных соединений металлов.
27.
Parsekar S.U., Haldar P., Antharjanam P.K.S., Kumar M.,
Ростов-на-Дону: Изд. ЮФУ, 2015. 232 с.
Koley A.P. // Appl. Organomet. Chem. 2021. e6152. doi
41.
Пушкарев А.П., Бочкарев М.Н. // Усп. хим. 2016.
10.1002/aoc.6152
Т. 85. № 12. С.1338; Pushkarev A.P., Bochkarev M.N. //
28.
Kargar H., Behjatmanesh-Ardakani R., Torabi V.,
Russ. Chem. Rev. 2016. Vol. 85. N 12. P. 1338. doi
Sarvian A., Kazemi Z., Chavoshpour-Natanzi Z.,
10.1070/RCR4665
Mirkhani V., Sahraei A., Tahir M.N., Ashfaq M. // Inorg.
42.
Burlov A.S., Vlasenko V.G., Koshchienko Yu.V., Milut-
Chim. Acta 2021. Vol. 514. P. 120004. doi 10.1016/j.
ka M.S., Mal’tsev E.I., Dmitriev A.V., Lypenko D.A.,
ica.2020.120004
Nekrasova N.V., Kolodina A.A., Makarova N.I.,
29.
Ribeiro N., Bulut I., Cevatemre B., Teixeira C., Yildi-
Metelitsa A.V., Lazarenko V.A., Zubavichus Y.V.,
zhan Y., Andre V., Adao P., Pessoa J.C., Acilan C.,
Khrustalev V.N., Garnovskii D.A. //Appl. Organomet.
Correia I. // Dalton Trans. 2021. Vol. 50. P. 157. doi
Chem. 2021. Vol. 35. N 2. P. e6107. doi 10.1002/
10.1039/d0dt03331f
aoc.6107
30.
Malik M.A., Dar O.A., Gull P., Wani M.Y., Hashmi A.A. //
43.
Кузнецова Л.И., Бурлов А.С., Волбушко Н.В., Кор-
Med. Chem. Commun. 2018. Vol. 9. P. 409. doi 10.1039/
шунов О.Ю., Залетов В.Г., Гарновский А.Д. // ЖОХ.
c7md00526a
1998. Т. 68. Вып. 8. С. 1338.
31.
Shah S.S., Shah D., Khan I., Ahmad S., Ali U., Rah-
44.
Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е. //
man A.U. // Res. Appl. Chem. 2020. Vol. 10. P. 6936.
Кристаллография. 2020. Т. 65. № 1. С. 59; Sergien-
doi 10.33263/BRIACI06.69366963
ko V.S., Abramenko V.L., Gorbunova Yu.E. // Crystallogr.
32.
Das G., Shukla R., Mandal S., Singh R., Bharadwaj P.K. //
Rep. 2020. Vol. 65. N 1. P. 53. doi 10.31857/
Inorg. Chem. 1997. Vol. 36. P. 323. doi 10.1021/
S0023476120010233
ic9510371
45.
Burlov A.S., Mal’tsev E.I., Vlasenko V.G., Garnovskii D.A.,
33.
Lu X.-H., Xia Q.-H., Zhan H.-J., Yuan H.-X., Ye C.-P.,
Dmitriev A.V., Lypenko D.A., Vannikov A.V., Doro-
Su K.-X., Xu G. // J. Mol. Catal. (A). 2006. Vol. 250.
vatovskii P.V., Lazarensko V.A., Zubavichus Ya.V.,
P. 62. doi 10.1016/j.molcata.2006.01.055
Khrustalev V.N. // Polyhedron. 2017. Vol. 133. P. 231.
34.
Bunce S., Cross R.J., Farrugia L.J., Kunchandy S.,
doi 10.1016/j.poly.2017.05.045
Meason L.L., Muir K.W., O’Donnell M., Peacock R.D.,
46.
Лысакова Т.П., Бурлов А.С., Власенко В.Г., Кощиен-
Stirling D., Teat S.J. // Polyhedron. 1998. Vol. 17.
ко Ю.В., Александров Г.Г., Левченков С.И., Зубави-
P. 4179. doi 10.1016/S0277-5387(98)00226-5
чус Я.В., Чепрасов А.С., Гарновский Д.А., Метели-
35.
Chen L., Qiao J., Xie J., Duan L., Zhang D., Wang L.,
ца А.В. // Коорд. хим. 2016. Т. 42. № 11. С. 701;
Qiu Y., Chen L. // Inorg. Chim. Acta. 2009. Vol. 362.
Lysakova T.P., Burlov A.S., Vlasenko V.G., Koshchien-
P. 2327. doi 10.1016/J.ICA.2008.10.016
ko Yu.V., Aleksandrov G.G., Levchenkov S.I., Zubavi-
36.
Sano T., Nishio Y., Hamada Y., Takahashi H., Usuki T.,
chus Ya.V., Cheprasov A.S., Garnovskii D.A., Meteli-
Shibata K. // J. Mater. Chem. 2000. Vol. 10. P. 157. doi
tsa A.V. // Russ. J. Coord. Chem. Vol. 42. N 11. P. 701.
10.1039/A903239H
doi 10.1134/S1070328416110075
37.
Пивоваров А.П., Каплунов М.Г., Якущенко И.К., Бе-
47.
Burlov A.S., Vlasenko V.G., Dmitriev A.V., Chesnokov V.V.,
лов М.Ю., Николаева Г.В., Ефимов О.Н. // Изв. АН.
Uraev A.I., Garnovskii D.A., Zubavichus Y.V., Tri-
Сер. хим. 2002. № 1. С. 65; Pivovarov A.P., Kaplu-
gub A.L., Vasilchenko I.S., Lypenko D.A., Mal’tsev E.I.,
nov M.G., Yakushchenko I.K., Belov M.Y., Nikolae-
Lifintseva T.V., Borodkin G.S. // Synth. Met. 2015.
va G.V., Efimov O.N. // Russ. Chem. Bull. 2002. Vol. 51.
Vol. 203. P. 156. doi 10.1016/j.synthmet.2015.02.028
N 1. P. 67. doi 10.1023/A:1015053512033
48.
Красовицкий Б.М., Болотин Б.М. Органические
38.
Каплунов М.Г., Якущенко И.К, Красникова С.С.,
люминофоры. Москва: Химия, 1984. С. 292.
Шамаев С.Н., Пивоваров А.П., Ефимов О.Н. // Изв.
49.
Chernyshov A.A., Veligzhanin A.A., Zubavichus Ya.V. //
РАН. Сер.хим. 2004. № 10. C. 2056; Kaplunov M.G.,
Nucl. Instr. Meth. Phys. Res. (A). 2009. Vol. 603. P. 95.
Yakushchenko I.K., Krasnikova S.S., Shamaev S.N.,
doi 10.1016/j.nima.200812.167
Pivovarov A.P., Efimov O.N. // Russ. Chem. Bull. 2004.
50.
Newville M. // J. Synchrotron Rad. 2001. Vol. 8. P. 96.
Vol. 53. N 10. P. 2148. doi 10.1007/s11172-005-0088-8
doi 10.1107/S0909049500016290
39.
Ma D.Y., Zhang L.X., Rao X.Y., Wu T.L., Li D.H.,
51.
Zabinski S.I., Rehr J.J., Ankudinov A., Alber R.C. //
Xie X.Q., Guo H.F., Qin L. // J. Coord. Chem. 2013. Vol. 66.
Phys. Rev. 1995. Vol. 52. P. 2995. doi 10.1103/
N 18. P. 3261. doi 10.1080/00958972.2013.832230
PhysRevB.52.2995
40.
Бурлов А.С., Власенко В.Г., Гарновский Д.А., Ура-
52.
Lee C., Yang W., Parr R.G. // Phys. Rev. (B). 1988.
ев А.И., Мальцев Е.И., Лыпенко Д.А., Ванников А.В.
Vol. 37. N 2. P. 785. doi 10.1103/PhysRevB.37.785
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ, СТРОЕНИЕ, СПЕКТРАЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
1437
53. Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7. P. 5648.
Keith T., Al-Laham M.A., Peng C.Y., Nanayakkara A.,
doi 10.1063/1.464913
Challacombe M., Gill P.M.W., Johnson B., Chen W.,
54. Ditchfield R., Hehre W.J., Pople J.A. // J. Chem. Phys.
Wong M.W., Gonzalez C., Pople J.A. Gaussian 03,
1971. Vol. 54. N 2. P. 724. doi 10.1063/1.1674902
55. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Revision A.1 // Gaussian, Inc., Pittsburgh PA, USA
Robb M.A., Cheeseman J.R., Montgomery J.A.,
(2003).
Vreven Jr.T., Kudin K.N., Burant J.C., Millam J.M.,
56. Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005.
Iyengar S.S., Tomasi J., Barone V., Mennucci B.,
Cossi M., Scalmani G., Rega N., Petersson G.A.,
Vol. 105. P. 2999.
Nakatsuji H., Hada M., Ehara M., Toyota K., Fukuda R.,
57. Burlov A.S., Vlasenko V.G., KoshchienkoYu.V.,
Hasegawa J., Ishida M., Nakajima T., Honda Y.,
Makarova N.I., Zubenko A.A., DrobinYu.D., Borod-
Kitao O., Nakai H., Klene M., Li X., Knox J.E.,
Hratchian H.P., Cross J.B., Adamo C., Jaramillo J.,
kin G.S., Metelitsa A.V., ZubavichusYa.V., Garnov-
Gomperts R., Stratmann R.E., Yazyev O., Austin A.J.,
skii D.A. // Polyhedron. 2018. Vol. 144. P. 249. doi
Cammi R., Pomelli C., Ochterski J.W., Ayala P.Y.,
10.1016/j.poly.2018.01.020
Morokuma K., Voth G.A., Salvador P., Dannenberg J.J.,
Zakrzewski V.G., Dapprich S., Daniels A.D., Strain M.C.,
58. Фетисов Л.Н., Зубенко А.А., Бодряков А.Н., Бодря-
Farkas O., Malick D.K., Rabuck A.D., Raghavachari K.,
кова М.А. // Международный паразитологический
Foresman J.B., Ortiz J.V., Cui Q., Baboul A.G., Clif-
симпозиум «Современные проблемы общей и част-
ford S., Cioslowski J., Stefanov B.B., Liu G., Liashen-
ko A., Piskorz P., Komaromi I., Martin R.L., Fox D.J.,
ной паразитологии» 2012. С. 70.
Synthesis, Structure, Spectral-Luminescent Properties
and Biological Activity of Chlorine-Substituted Azomethines
and Their Zinc(II) Complexes
M. S. Milutkaa, A. S. Burlova,*, V. G. Vlasenkob, Yu. V. Koschienkoa, N. I. Makarovaa,
A. V. Metelitsaa, E. V. Korshunovaa, A. L. Trigubc, A. A. Zubenkod, and A. I. Klimenkod
a Scientific Research Institute of Physical and Organic Chemistry, Southern Federal University,
Rostov-on-Don, 344090 Russia
b Research Institute of Physics, Southern Federal University, Rostov-on-Don, 344090 Russia
c National Research Center «Kurchatov Institute», Moscow, 123182 Russia
d North Caucasian Zonal Research Veterinary Institute, Novocherkassk, 346421 Russia
*e-mail: anatoly.burlov@yandex.ru
Received July 12, 2021; revised July 20, 2021; accepted July 22, 2021
A number of chlorine-substituted azomethines 2-hydroxybenzaldehydes and zinc(II) complexes based on them
were synthesized. Structure of azomethines and zinc complexes was established by elemental analysis, IR, 1H
NMR and X-ray spectroscopy data. ZnL2 complexes have a tetrahedral structure. In methylene chloride, the
complexes exhibit weak photoluminescent properties, while for solid complexes the quantum yields of photo-
luminescence are 100 times higher. Biological activity of azomethines and zinc complexes was studied.
Keywords: azomethines, zinc complexes, photoluminescence, biological activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021