ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 9, с. 1438-1445
УДК 546.86;546.712;547.53.024;548.312.5
РЕАКЦИИ ДИБРОМИДОВ ТРИАРИЛСУРЬМЫ
Ar3SbBr2 С СОЛЯМИ НАТРИЯ NaX (X = NO3, NCS, F)
© 2021 г. В. В. Шарутин*, О. К. Шарутина, Д. М. Сопшина
Национальный исследовательский Южно-Уральский государственный университет,
пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: vvsharutin@rambler.ru
Поступило в Редакцию 22 июля 2021 г.
После доработки 11 августа 2021 г.
Принято к печати 13 августа 2021 г.
Взаимодействие дибромида триарилсурьмы с нитратом, роданидом и фторидом натрия в водно-ацетоно-
вом растворе при комнатной температуре приводит к образованию биядерных мостиковых соединений
сурьмы [(4-МеС6Н4)3SbОNO2]2O, (Ph3SbNCS)2O, [(3-MeС6Н4)3SbNCS]2O, [(4-МеС6Н4)3SbNCS]2O и моно-
ядерных производных (2-МеС6Н4)3Sb(NCS)2 и (3-FC6H4)3SbF2. Атомы металла в молекулах полученных
соединений имеют искаженную тригонально-бипирамидальную координацию с электроотрицательными
атомами в аксиальных положениях.
Ключевые слова: дибромид триарилсурьмы, нитрат натрия, роданид натрия, фторид натрия, моно(би)
ядерные соединения сурьмы
DOI: 10.31857/S0044460X21090158
Особенности синтеза, строения и химического
ний [3-6]. Однако дибромиды и дихлориды три-
поведения арильных соединений сурьмы описаны
фенилсурьмы гидролизуются в жестких условиях
в монографии [1] и обзорной статье [2], в которых
(кипячение в спиртовом растворе щелочи) [1], а
достаточно подробно рассмотрены реакции обмена
эти же дигалогениды трис(пентафторфенил)сурь-
между дигалогенидами триарилсурьмы и солями
мы легко превращаются в «ангидридные» струк-
щелочных металлов, серебра или аммония (моль-
туры в водно-спиртовом растворе [7].
ное соотношение 1:2, полярный растворитель,
Нами исследовано взаимодействие дибромидов
комнатная температура), позволяющие получать
трифенил-, трис(4-метилфенил)-, трис(3-метилфе-
самые разнообразные соединения сурьмы в зави-
нил)-, трис(2-метилфенил)- и трис(3-фторфенил)-
симости от аниона соли. Как правило, в указанных
сурьмы с нитратом, роданидом и фторидом натрия
реакциях получаются соединения Ar3SbX2, однако
при комнатной температуре в водно-ацетоновой
в некоторых случаях удается выделить только бия-
среде при комнатной температуре.
дерные соединения сурьмы с мостиковым атомом
Реакции дибромидов трифенил-, трис(4-метил-
кислорода (Ar3SbX)2O, которые образуются, как
фенил)-, трис(3-метилфенил)сурьмы с нитратом и
предполагают авторы [1], в результате частичного
роданидом натрия приводят к образованию мости-
гидролиза дигалогенидов Ar3SbX2, если их гидро-
ковых соединений сурьмы [(4-МеС6Н4)3SbОNO2]2O
литическая устойчивость недостаточно высока.
(1), [Ph3SbNCS]2O (2), [(3-МеС6Н4)3SbNCS]2O (3),
Стойкость к гидролизу определяется не только
[(4- МеС6Н4)3SbNCS]2O (4, схема 1).
группой Х, но и органическими лигандами при
атоме сурьмы. Например, устойчивые к гидролизу
В аналогичных реакциях дибромидов трис-
дифториды триарилсурьмы с практически кова-
(2-метилфенил)сурьмы и трис(3-фторфенил)-
лентными связями SbF не претерпевают измене-
сурьмы с роданидом натрия и фторидом натрия
1438
РЕАКЦИИ ДИБРОМИДОВ ТРИАРИЛСУРЬМЫ
1439
Схема 1.
2 Ar3SbBr2 + 4 NaX + H2O/Me2CO → (Ar3SbX)2O + 4 NaBr
1-4
1, Ar = 4-MeC6H4, X = NO3; 2, Ar = Ph, X = NCS; 3, Ar = 3-MeC6H4, X = NCS; 4, Ar = 4-MeC6H4, X = NCS.
Схема 2.
(2-MeC6H4)3SbBr2 + 2 NaNCS → (2-MeC6H4)3Sb(NCS)2 + 2 NaBr
5
(3-FC6H4)3SbBr2 + 2NaF → (3-FC6H4)3SbF2 + 2NaBr
6
Схема 3.
Ar3Sb(OH)2 + 2Hlg + 2H3O+
Ar3SbHlg2 + 4H2O
Ar3SbHlg2 + Hlg + H3O+
Ar3Sb(OH)Hlg + 2H2O
1/2(Ar3SbHlg)2O + 1/2H2O
образуются только моноядерные производные
от природы и количества заместителей в арильных
(2-МеС6Н4)3Sb(NCS)2 (5) и (3-FC6H4)3SbF2 (6) со-
лигандах при атоме сурьмы [1-6].
ответственно (схема 2).
О влиянии стерических факторов на устойчи-
Можно предположить, что стадии гидролиза
вость металлоорганических соединений сооб-
соединений Ar3SbХ2 обратимы, и тогда строение
щалось ранее [8, 9]. С учетом пространственных
продукта реакции дибромида триарилсурьмы с
факторов, образование соединения с мостиковым
солями натрия определяется не только склонно-
атомом кислорода в реакции дибромида триc(2-ме-
стью к гидролизу дигалогенида триарилсурьмы (а
тилфенил)сурьмы с роданидом натрия было бы
значит, количеством галогенид-ионов и ионов ги-
предпочтительным. Однако продуктом реакции
дроксония), но также растворимостью соединений
был дитиоизоцианат трис(2-метилфенил)сурьмы
Ar3SbHlg2, (Ar3SbHlg)2O /Ar3SbХ2 и (Ar3SbХ)2O
5. Следовательно, стерические затруднения в ис-
(схема 3).
ходном дибромиде триарилсурьмы не оказывают
Следовательно, соединения (Ar3SbX)2O полу-
влияния на структуру продукта реакции, а решаю-
чаются либо в реакции обмена с последующим ги-
щую роль играют факторы, перечисленные выше.
дролизом образующегося дигалогенида Ar3SbX2,
При добавлении растворов дибромида триарил-
либо на первой стадии гидролизуется исходный
сурьмы в ацетоне к водному раствору соли натрия
дигалогенид триорганилсурьмы до (Ar3SbHlg)2O,
при комнатной температуре образуется бесцвет-
который затем реагирует с солью NaХ.
ный осадок. С целью получения монокристаллов,
В реакции трис(3-фторфенил)сурьмы с фтори-
пригодных для рентгеноструктурных исследова-
дом натрия ожидаемо образуется дифторид три-
ний, осадок сушили и перекристаллизовывали из
арилсурьмы, как и в других случаях, независимо
смесей ацетонитрил-октан (1), бензол-октан (2,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1440
ШАРУТИН и др.
Таблица 1. Основные геометрические параметры комплексов (Ar3SbX)2O
Длина связи, Å
Угол, град
№
Соединение
Sb-X
Sb-O
мост
Sb-C
SbOSb
XSbO
1
(4-МеС6Н4)3SbОNO2)2O
2.277(2),
1.956(2),
2.068(2)-2.094(3)
140.64(9)
176.93(6),
2.288(2)
1.959(2)
179.35(6)
2
(Ph3SbNCS)2O
2.282(6)
1.952(1)
2.104(6)-2.116(6)
180.0
178.37(18)
3
(3-МеС6Н4)3SbNCS)2O
2.333(5),
1.967(3),
2.097(4)-2.116(5)
141.91(17)
179.02(14),
2.356(6)
1.979(3)
175.05(15)
4
(4-МеС6Н4)3SbNCS)2O
2.275(8)
1.952(3)
2.076(13)-2.087(10)
180.0
179.80(19)
4), ацетонитрил-бутан-1-ол (3, 6), хлороформ-
но-бипирамидальную координацию с мостиковым
октан (5). Полученные соединения 1-6 представ-
атомом кислорода и монодентатным лигандом Х в
ляют собой бесцветные кристаллические веще-
аксиальных положениях (рис. 1).
ства, устойчивые к действию влаги и кислорода
В экваториальной плоскости располагаются
воздуха, хорошо растворимые в ароматических
арильные заместители. Такой же координацион-
углеводородах, четыреххлористом углероде, те-
ный полиэдр для атомов сурьмы реализуется в
трагидрофуране, хлороформе, ацетонитриле.
моноядерных комплексах 5 и 6. Молекулы соеди-
В ИК спектрах соединений 1-6 наблюдаются
нений 2, 4 с линейным фрагментом Sb-O-Sb цен-
интенсивные полосы в областях 424-484 (Sb-C),
тросимметричны (центр симметрии - мостиковый
1470-1493 (Ar), 3022-3067 см-1 (H-CAr), а так-
атом кислорода); в «уголковых» молекулах сое-
же при 2920 (1), 2918 (3), 2818 (4), 2924 (5) см-1
динений 1, 3 [углы SbOSb 140.64(9), 141.91(17)°
(H-CAlk). Кроме того, в ИК спектрах соединений
соответственно] два фрагмента Ar3SbX несколько
2-5 наблюдаются интенсивные полосы в области
2018-2045 см-1, отвечающие валентным колебани-
ям групп NCS, а в спектре комплекса 6 - полосы
при 1211 и 1086 см-1 (C-F) [10, 11].
Из анализа данных РСА полученных соедине-
ний (табл. 1) следует, что атомы сурьмы в биядер-
ных структурах 1-4 имеют искаженную тригональ-
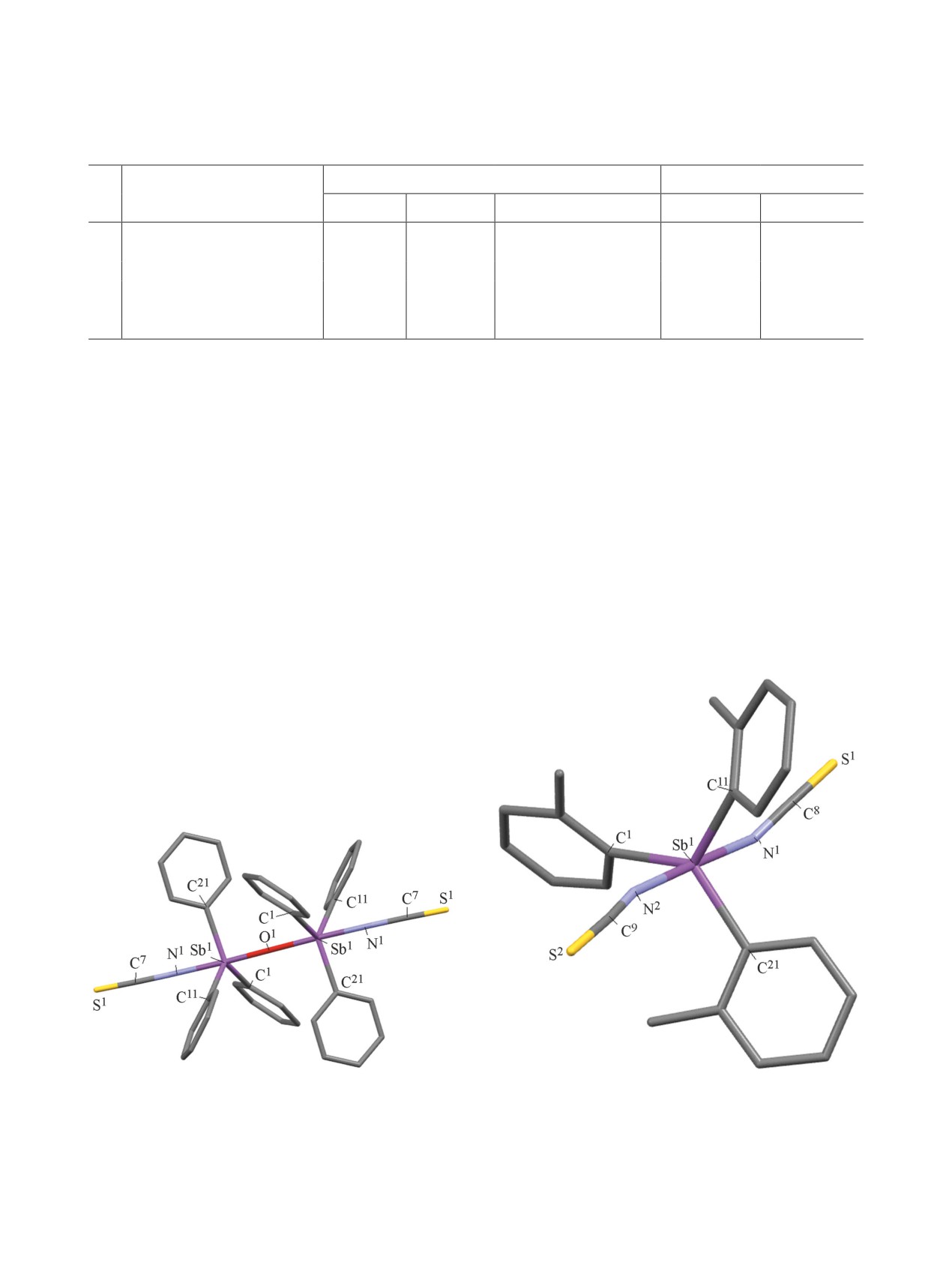
Рис. 1. Общий вид молекулы μ-оксобис[(изотиоциа-
Рис. 2. Общий вид молекулы ди(тиоцианато)трис(2-ме-
нато)трифенилсурьмы] 2 в кристалле (атомы водорода
тилфенил)сурьмы 5 в кристалле(атомы водорода не
не показаны).
показаны).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
РЕАКЦИИ ДИБРОМИДОВ ТРИАРИЛСУРЬМЫ
1441
Таблица 2. Кристаллографические данные, примеры эксперимента и уточнения структур соединений 1-6
Параметр
1
2
3
4
5
6
М
971.33
838.26
922.42
922.41
511.29
445.03
Сингония
Триклинная
Моноклинная
Моноклинная
Триклинная
Моноклинная
Триклинная
-
-
-
Пространственная
Р1
P21/n
P21/c
Р1
P21/n
Р1
группа
a, Å
10.790(8)
10.591(7)
10.729(4)
10.92(2)
12.162(13)
6.867(6)
b, Å
11.474(10)
9.309(5)
30.355(11)
10.923(18)
14.693(14)
8.558(10)
c, Å
18.308(12)
19.118(11)
13.097(5)
10.923(19)
12.721(11)
14.431(11)
α, град
75.78(3)
90.00
90.00
69.59(13)
90.00
88.19(3)
β, град
83.95(3)
97.66(2)
92.451(16)
69.6(2)
91.42(5)
85.56(3)
γ, град
75.88(4)
90.00
90.00
69.60(15)
90.00
78.68(4)
V, Å3
2128(3)
1868.1(19)
4261(3)
1106(4)
2272(4)
828.9(13)
Z
2
2
4
1
4
2
dвыч, г/см3
1.516
1.490
1.438
1.385
1.494
1.783
μ, мм
1.321
1.588
1.399
1.348
1.408
1.711
F(000)
976.0
828.0
1848.0
462.0
1024.0
432.0
Размер кристалла,
0.27×0.24×0.2
0.65×0.11×0.1
0.5×0.35×0.28
0.3×0.27×0.19
0.38×0.2×0.11
0.24×0.19× 0.17
мм
Область сбора
5.882-56.998
5.84-66.26
5.882-56.998
7.614-56.94
6.404-57.652
5.662-56.994
данных по 2θ, град
Интервалы индек-
–14≤ h ≤ 14,
-16 ≤ h ≤ 16,
-17≤ h ≤ 17,
-13 ≤ h ≤ 13,
-16 ≤ h ≤ 16,
-9 ≤ h ≤ 9,
сов
-15 ≤ k ≤15,
-14≤ k ≤ 14,
-49 ≤ k ≤48,
-14 ≤ k ≤ 14,
-19 ≤ k ≤ 19,
-11 ≤ k ≤ 11,
отражений
-24 ≤ l ≤ 24
-29 ≤ l ≤ 29
-21 ≤ l ≤ 20
-14 ≤ l ≤ 14
-17 ≤ l ≤ 17
-19 ≤ l ≤ 19
Измерено
101685
56396
179247
7823
35915
34155
отражений
Независимых
10799
7074
18720
3774
5890
4196
отражений
(Rint 0.0318)
(Rint 0.1168)
(Rint 0.0571)
(Rint 0.0637)
(Rint 0.0844)
(Rint 0.0228)
Отражений
10799
7074
18720
3774
5890
3835
с I > 2σ(I)
Переменных
520
205
466
259
248
218
уточнения
GOOF
1.049
1.073
1.198
1.089
1.004
1.096
R-Факторы по
R1 0.0238,
R1 0.1017,
R1 0.0744,
R1 0.0756,
R1 0.0614,
R1 0.0259,
F2 > 2σ(F2)
wR2 0.0519
wR2 0.1218
wR2 0.1228
wR2 0.1433
wR2 0.1157
wR2 0.0599
R-Факторы по
R1 0.0356,
R1 0.1970,
R1 0.1210,
R1 0.1364,
R1 0.1469,
R1 0.0302,
всем
wR2 0.0585
wR2 0.1452
wR2 0.1359
wR2 0.1732
wR2 0.1465
wR2 0.0615
отражениям
Остаточная
0.76/-0.55
1.30/-1.54
1.77/-1.82
1.43/-1.04
0.63/-0.57
0.58/-0.42
электронная
плотность
(min/max), e/Å3
отличаются друг от друга. Величина угла SbOSb
Вопрос о факторах, влияющих на величину
изменяется от 125.5° [12] до 180° [17], причины,
угла при мостиковом атоме кислорода, остается от-
вызывающие его изменение, являются предметом
крытым, и нельзя спрогнозировать, линейную или
дискуссии [13-20].
угловую форму будет иметь фрагмент Sb-O-Sb
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1442
ШАРУТИН и др.
Рис. 3. Межмолекулярные контакты в кристалле соединения 5.
той или иной молекулы. Искажение тригональ-
Sb-N - 2.507(2) Å [22] и 2.128(4)-2.162(4) Å [23]
но-бипирамидальной конфигурации молекул 1-4
соответственно, в соединениях 2, 3, 4 -2.282(6);
проявляется в отклонении валентных углов от
2.333(5), 2.356(6); 2.275(8) Å соответственно, при
теоретических значений и в выходе атомов сурь-
этом в молекулах соединений 2, 4 с линейным цен-
мы из экваториальной плоскости к мостиковому
тральным фрагментом указанные связи короче,
атому кислорода. Длины связей между атомами
чем в молекуле соединения 3 с угловым строением
этого фрагментом. Несмотря на одинаковую кон-
сурьмы и мостиковым атомом кислорода Sb-O
фигурацию молекул 2 и 4, эти соединения не изо-
меньше суммы ковалентных радиусов атомов су-
структурны: сингония моноклинная и триклинная,
рьмы и кислорода (2.07 Å [21]). Расстояния Sb-X в
пространственные группы P21/n и P-1 соответ-
µ-оксопроизводных (Ar3SbX)2O значительно мень-
ственно (табл. 2).
ше аналогичных связей в соединениях Ar4SbX и
По данным РСА, атом сурьмы в соединении 5
немного больше, чем в соединениях Ar3SbX2 [12].
имеет искаженную тригонально-бипирамидаль-
В молекулах изотиоционата тетрафенилсурьмы и
ную координацию с атомами азота изотиоцианат-
ди(изотиоционата) трифенилсурьмы длины связей
ных лигандов в аксиальных положениях (рис. 2).
Величина аксиального угла NSbN составляет
178.9(2)°, сумма углов в экваториальной плоско-
сти равна 359.9°. Углы между экваториальны-
ми фенильными заместителями неравноценны
[124.3(2), 123.6(4), 112.0(4)°] и существенно от-
личаются от теоретического значения. Подобное
неравенство экваториальных углов отмечалось во
многих арильных производных сурьмы Ar3SbX2
[12]. Длины связей Sb-N [2.177(6), 2.170(6) Å] и
Sb-C [2.077(7)-2.108(7) Å] в комплексе 5 незначи-
тельно превышают сумму ковалентных радиусов
указанных атомов (2.15 и 2.19 Å [21]). Кристалл
соединения 5 включает полимерные цепи молекул,
связанных между собой межмолекулярными кон-
тактами S∙∙∙H (2.80 Å) (рис. 3).
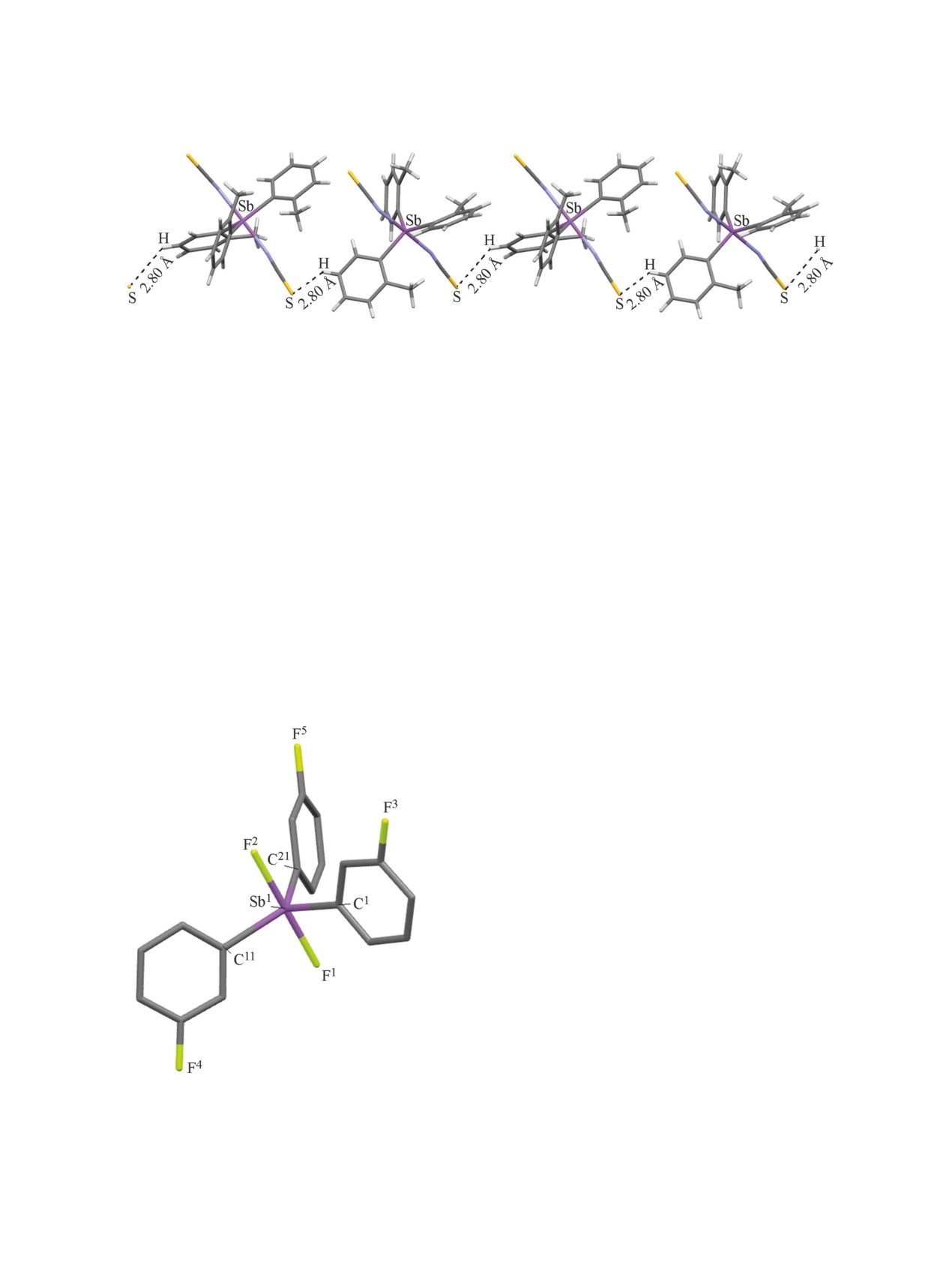
Молекула дифторида (3-фторфенил)сурьмы
имеет мало искаженную тригонально-бипирами-
Рис. 4. Общий вид молекулы дифторида трис(3-
дальную конфигурацию с атомами фтора в акси-
фторфенил)сурьмы 6 в кристалле (атомы водорода не
альных положениях и атомами углерода ариль-
показаны).
ных групп в экваториальной плоскости (рис. 4).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
РЕАКЦИИ ДИБРОМИДОВ ТРИАРИЛСУРЬМЫ
1443
Углы в экваториальной плоскости CSbC [115.92-
SMART и SAINT-Plus [25]. Все расчеты по опреде-
122.16(10)°], сумма углов в экваториальной пло-
лению и уточнению структуры выполнены по про-
скости (359.99°) близки по своим значениям к
граммам SHELXL/PC [26] и OLEX2 [27]. Структу-
наблюдаемым в дифториде трифенилсурьмы [24].
ры соединений 1-6 определены прямым методом
и уточнены методом наименьших квадратов в
Длины связей Sb-F [1.970(2) и 1.976(2) Å] короче
анизотропном приближении для не водородных
суммы ковалентных радиусов атомов (2.13 Å [21]).
атомов. Основные кристаллографические данные
Все три бензольных кольца в молекуле 6 имеют
и результаты уточнения структур 1-6 приведены в
стерически напряженную конформацию, близ-
табл. 2. Полные таблицы координат атомов, длин
кую к заслоненной с аксиальными связями Sb-F
связей и валентных углов депонированы в Кем-
и диапазоном соответствующих торсионных углов
бриджском банке структурных данных [ССDC
FSbCC 8.04-15.51°.
2070388 (1), 2076856 (2), 2074538 (3), 2074510 (4),
В структуре соединения 6 обнаружена сложная
2076852 (5), 2074518 (6)].
система внутримолекулярных водородных связей
[(4-МеС6Н4)3SbОNO2]2O
(1)∙MeCN. К рас-
С-Н···F, в которых участвуют шесть орто-атомов
твору 0.13 г (0.8 ммоль) нитрата серебра в 100 мл
водорода трех фенильных заместителей. Все рас-
воды прибавляли раствор 0.22 г (0.4 ммоль) дибро-
стояния Н···F (2.29, 2.34, 2.35 Å с одним атомом
мида трис(4-метилфенил)сурьмы в 10 мл ацетона
фтора и 2.39, 2.41, 2.41 Å - с другим атомом фтора)
и выдерживали 24 ч при 20°С. Нерастворимый в
заметно меньше суммы ван-дер-ваальсовых ради-
воде остаток перекристаллизовывали из смеси ок-
усов атомов водорода и фтора (2.7 Å [21]), и это -
тан-ацетонитрил (1:2, по объему). Выход 0.22 г,
главный геометрический критерий существования
(68%), бесцветные кристаллы, т. пл. 205°С. ИК
водородных связей. Сокращенные контакты могли
спектр, ν, см-1: 3024, 2920, 2253, 1591, 1491, 1395,
бы легко исчезнуть при повороте бензольных ко-
1314, 1283, 1272, 1209, 1186, 1119, 1070, 982, 799,
лец вокруг связей Sb-C. То, что этого не происхо-
733, 714, 696, 586, 484. Найдено, %: С 54.29; Н 4.53.
дит, свидетельствует об энергетически выгодном
C44H45N3O7Sb2. Вычислено, %: С 54.38; Н 4.63.
взаимодействии орто-атомов водорода с атомами
Соединения 2-6 получали аналогично.
фтора. Внутримолекулярные водородные связи
[Ph3SbNCS]2O (2). Выход 60%, бесцветные
не вызывают искажения аксиального угла FSbF
кристаллы, т. пл. 228°С. ИК спектр, ν, см-1: 3051,
и углов между аксиальными и экваториальными
2043, 1477, 1435, 1306, 1180, 1067, 1020, 997,
связями FSbC, которые имеют практически иде-
735, 718, 689, 455. Найдено, %: С 54.38; Н 3.62.
альные значения [179.86(6) и 89.70(10)-90.44(9)°].
C38H30N2OS2Sb2. Вычислено, %: С 54.54; Н 3.58.
Таким образом, из дибромида триарилсурьмы и
[(3-МеС6Н4)3SbNCS]2O (3). Выход 55%, бес-
цветные кристаллы, т. пл. 164°С. ИК спектр, ν,
солей натрия по реакции замещения синтезирован
см-1: 3051, 2918, 2035, 2018, 1589, 1472, 1402,
ряд биядерных и моноядерных арилпроизводных
1097, 991, 772, 726, 687, 505, 424. Найдено, %: С
сурьмы и изучены особенности их строения.
57.12; Н 4.62. C44H42N2OS2Sb2. Вычислено, %: С
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
57.27; Н 4.56.
[(4-МеС6Н4)3SbNCS]2O (4). Выход 82%, бес-
ИК спектры записывали на ИК Фурье-спектро-
цветные кристаллы, т. пл. 269°С. ИК спектр, ν,
метре Shimadzu IRAffinity-1S; образцы готови-
см-1: 3022, 2918, 2045, 1591, 1493, 1447, 1395, 1312,
ли таблетированием с KBr (область поглощения
1188, 1119, 1067, 804, 770, 698, 586, 480. Найдено,
4000-400 см-1).
%: С 57.16; Н 4.61. C44H42N2OS2Sb2. Вычислено,
Рентгеноструктурный анализ (РСА) кристал-
%: С 57.27; Н 4.56.
лов соединений 1-6 проводили на автоматиче-
(2-МеС6Н4)3Sb(NCS)2 (5). Выход 57%, бес-
ском четырехкружном дифрактометре D8 QUEST
цветные кристаллы, т. пл. 230°С. ИК спектр, ν,
Bruker (MoKα-излучение, λ 0.71073 Å, графитовый
см-1: 3040, 2924, 2018, 1537, 1560, 1470, 1446,
монохроматор). Сбор, редактирование данных и
1363, 1274, 1204, 1183, 1121, 1026, 858, 799, 748,
уточнение параметров элементарной ячейки, а
700, 540, 436, 409. Найдено, %: С 53.98; Н 4.18.
также учет поглощения проведены по программам
C23H21N2S2Sb. Вычислено, %: С 54.01; Н 4.11.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1444
ШАРУТИН и др.
(3-FC6H4)3SbF2 (6). Выход 85%, бесцветные
12.
Шарутин В.В., Шарутина О.К., Молокова О.В.,
кристаллы, т. пл. 276°С. ИК спектр, ν, см-1: 3067,
Пакусина А.П., Бондарь Е.Н., Криволапов Д.Б.,
1578, 1521, 1474, 1412, 1304, 1267, 1211, 1161,
Губайдуллин А.Т., Литвинов И.А. // ЖОХ. 2001.
Т. 71. Вып. 9. С. 1507; Sharutin V.V., Sharutina
1124, 1086, 1061, 999, 980, 899, 856, 765, 679, 662,
O.K., Molokova O.V., Pakusina A.P., Bondar’ E.N.,
544, 525, 505, 440. Найдено, %: С 48.47; Н 2.81.
Krivolapov D.B., Gubaidullin A.T., Litvinov I.A. //
C18H12F5Sb. Вычислено, %: С 48.54; Н 2.70.
Russ. J. Gen. Chem. 2001. Vol. 71. N 9. P. 1426. doi
ИНФОРМАЦИЯ ОБ АВТОРАХ
10.1023/A:1013910120594
13.
Grigsby Е.W.J., Hart R.D., Raston C.L., Skelton B.W.,
Шарутин Владимир Викторович, ORCID:
White A.H. // Aust. J. Chem. 1997. Vol.50. N 6. Р. 675.
doi 10.1071/C96042
Сопшина Дарья Михайловна, ORCID: https://
14.
Tiekink E.R.T. // J. Organomet. Chem. 1987. Vol. 333.
orcid.org/0000-0003-3402-621X
N 2. P. 199. doi 10.1016/0022-328X(87)85152-5
15.
Ouchi A., Sato S. // Bull. Chem. Soc. Jap. 1988. Vol. 61.
КОНФЛИКТ ИНТЕРЕСОВ
N 5. P. 1806. doi 10.1246/bcsj.61.1806
16.
Шарутин В.В., Шарутина О.К., Пакусина А.П.,
Авторы заявляют об отсутствии конфликта
Смирнова С.А. // ЖНХ. 2009. Т. 54. № 10. С. 1705;
интересов,
Sharutin V.V., Sharutina O.K., Pakusina A.P., Smirno-
va S.A. // Russ. J. Inorg. Chem. 2009. Vol. 54. N 10.
СПИСОК ЛИТЕРАТУРЫ
P. 1630. doi 10.1134/S0036023609100209
1.
Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Ме-
17.
Gibbons M.N., Blake A.J., Sowerby D.B. // J.
тоды элементоорганической химии. Сурьма, висмут.
Organomet. Chem. 1997. Vol. 543. N 2. P. 217. doi
М.: Наука, 1976, 483 с.
10.1016/S0022-328X(97)00208-8
2. Шарутин В.В., Поддельский А.И., Шарутина О.К. //
18.
Balazs L., Breunig H.J., Ghesher I., Lork E. // J.
Коорд. хим. 2020. Т. 46. № 10. С. 579; Sharutin V.V.,
Organometal. Chem. 2002. Vol. 648. N 1. P. 33. doi
Poddel’skiy A.I., Sharutina O.K. // Russ. J. Coord.
10.1016/S0022-328X(01)01467-X
Chem. 2020. Vol. 46. N 10. P. 663. doi 10.31857/
19.
Taylor M.J., Baker L.-J., Rickard C.E.F., Surman P.W.J. //
S0132344X20100011
J. Organomet. Chem. 1995. Vol. 498. N 1. P. С14. doi
3.
Чехлов A.Н. // Докл. АН СССР. 1993. Т. 328. № 2.
10.1016/0022-328X(95)05555-4
С. 205.
20.
Almond M.J., Drew M.G.B., Rice D.A., Salisbury G.,
4.
Шарутин В.В., Сенчурин В.С., Шарутина О.К.,
Taylor M.J. // J. Organomet. Chem. 1996. Vol. 522.
Акулова Е.В. // ЖОХ. 2008. Т. 78. Вып. 12. С. 1999;
N 2. P. 265. doi 10.1016/0022-328X(96)06304-8
Sharutin V.V., Senchurin V.S., Sharutina O.K., Akulo-
21.
Бацанов С.С. // ЖНХ. 1991. Т. 36. № 12. С. 3015.
va E.V. // Russ. J. Gen. Chem. 2008. Vol. 78. N 12.
22.
Шарутин В.В., Пакусина А.П., Шарутина О.К.,
P. 2344. doi 10.1134/S1070363208120098
Платонова Т.П., Смирнова С.А., Герасименко А.В.,
5.
Sen S., Ke I.S., Gabbai F.P. // J. Inorg. Chem. 2016.
Пушилин М.А. // Бутлеровск. сообщ. Химия и ком-
Vol.
55. N
18. P.
9162. doi
10.1021/acs.
пьютерное моделирование. 2003. № 1. С. 22.
inorgchem.6b01290
23.
Forster G.E., Begley M.J., Sowerby D.B. // J.
6.
Jones J.S., Wade C.R. Gabbai F.P. // Organometallics.
Organomet. Chem. 1996. Vol. 507. N 1-2. P. 263. doi
2015. Vol. 34. N 11. P. 2647. doi 10.1021/om501291g
10.1016/0022-328X(95)05775-K
7.
Otero A., Royo P. // J. Organomet. Chem. 1978.
24.
Чехлов А.Н. // Докл. РАН. 1993. Т. 328. № 2. С. 205.
Vol. 154. N. 1. P. 13. doi 10.1016/S0022-
25.
SMART and SAINT-Plus. Version 5.0. Data Collection
328X(00)82787-4
and Processing Software for the SMART System.
8.
Tolman C.A. // J. Am. Chem. Soc. 1970. Vol. 92. N 10.
Madison (WI, USA): Bruker AXS Inc., 1998.
P. 2956. doi 10.1021/ja00713a007
26.
SHELXTL/PC. Version 5.10. An Integrated System for
9.
Захаров Л.Н., Домрачев Г.А., Стручков Ю.Т. // ЖСХ.
1982. Т. 24. № 3. С. 75.
Solving, Refining and Displaying Crystal Structures
10.
Васильев А.В., Гриненко Е.В., Щукин А.О., Федули-
from Diffraction Data. Bruker AXS Inc., Madison: (WI,
на Т.Г. Инфракрасная спектроскопия органических и
USA), 1998.
природных соединений. СПб: СПбГЛТА, 2007. 54 c.
27.
Dolomanov O.V., Bourhis L.J., Gildea R.J. // J. Appl.
11.
Тарасевич Б.Н. ИК спектры основных классов орга-
Cryst. 2009. Vol. 42. P. 339. doi 10.1107/
нических соединений. М.: МГУ, 2012. 55 c.
S0021889808042726
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
РЕАКЦИИ ДИБРОМИДОВ ТРИАРИЛСУРЬМЫ
1445
Reactions of Triarylantimony Dibromides Ar3SbBr2
with Sodium Salts NaX (X = NO3, NCS, F)
V. V. Sharutin*, O. K. Sharutina, and D. M. Sopshina
National Research South Ural State University, Chelyabinsk, 454080 Russia
*e-mail: vvsharutin@rambler.ru
Received July 22, 2021; revised August 11, 2021; accepted August 13, 2021
The reaction of triarylantimony dibromide with sodium nitrate, thiocyanate and fluoride in an aqueous
acetone solution at room temperature leads to the formation of bridging binuclear antimony compounds
(p-Tol3SbONO2)2O, (Ph3SbNCS)2O, (m-Tol3SbNCS)2O, (p-Tol3SbNCS)2O and mononuclear derivatives
o-Tol3Sb(NCS)2 and (3-FC6H4)3SbF2. The metal atoms in the molecules of the obtained compounds have a
distorted trigonal-bipyramidal coordination with electronegative atoms in the axial positions.
Keywords: triarylantimony dibromide, sodium nitrate, sodium thiocyanate, sodium fluoride, mono(bi)nuclear
antimony compounds
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021