ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 9, с. 1459-1464
УДК 547.455.522:546.59
ГЛИКОНАНОЧАСТИЦЫ ЗОЛОТА НА ОСНОВЕ
1-[2-(6-СУЛЬФАНИЛГЕКСАНОИЛ)ГИДРАЗИНИЛ]-
АЛЬДОЗ И ИХ ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ
© 2021 г. А. Ю. Ершовa,*, А. А. Мартыненковa, И. В. Лагодаb, М. А. Копаницас,
В. В. Зарубаевd, А. В. Слитаd, Е. В. Бучковd, Е. Ф. Панарина, А. В. Якиманскийa,e
a Институт высокомолекулярных соединений Российской академии наук,
Большой пр. В.О. 31, Санкт-Петербург, 199004 Россия
b Государственный научно-исследовательский испытательный институт военной медицины
Министерства обороны России, Санкт-Петербург, 195043 Россия
c Рязанский государственный медицинский университет имени И. П. Павлова
Министерства здравоохранения России, Рязань, 390026 Россия
d Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера,
Санкт-Петербург, 197101 Россия
e Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*е-mail: ershov305@mail.ru
Поступило в Редакцию 16 июня 2021 г.
После доработки 25 июня 2021 г.
Принято к печати 1 июля 2021 г.
На основе 1-[2-(6-сульфанилгексаноил)гидразинил]альдоз - продуктов конденсации природных альдоз
(N-ацетиламино-D-глюкозы, D-маннозы, D-галактозы и L-фукозы) с гидразидом 6-сульфанилгексановой
кислоты - разработан метод синтеза смешанно-лигандных гликонаночастиц золота с варьированием
соотношения исходных гликолигандов в широких пределах и co средним размером частиц 20-25 нм.
Полученные гликонаночастицы золота обладают низкой токсичностью и высокой активностью против
вируса гриппа А/Puerto Rico/8/34 (H1N1) в концентрациях 3 и 6 мкг/мл.
Ключевые слова: монозы с тиольными группами, гликонаночастицы золота, антивирусная активность
DOI: 10.31857/S0044460X21090183
Моделирование естественной клеточной по-
имеющими в своей структуре набор углеводных
верхности - важная задача современной молеку-
фрагментов, характерный для поверхностных
лярной биологии. Особое место в таких исследо-
клеточных рецепторов. Подходящие объекты ис-
ваниях отводится гликопротеиновым клеточным
следования - гликонаночастицы серебра и золота,
рецепторам - лектинам, отвечающим за механиз-
поскольку они открывают возможность варьиро-
мы распознавания и связывания клеткой произво-
вания структуры углеводного лиганда, а наличие
дных углеводов [1-6]. Интенсивно развиваются
в их составе металлического ядра придает им уни-
направления, связанные с исследованием струк-
кальные оптические свойства [7-16].
туры, биосинтеза и функций углеводных цепей, а
Основу углеводной части клеточных рецепто-
также причин их патологий.
ров млекопитающих и человека преимущественно
При изучении таких систем целесообразно
составляют фрагменты четырех моносахаридов:
располагать модельными супрамолекулярны-
N-ацетиламино-D-глюкозы (GlcNAc), D-маннозы
ми системами заданного химического строения,
(Man), D-галактозы (Gal) и L-фукозы (Fuc) [17].
1459
1460
ЕРШОВ и др.
Схема 1.
R
O
HO
OH
R
H
O
HO
O
O
XH
HO
SH
N
SH
N
H2NHN
HO
XH
H
1
2а-г
R = CH2OH, X = NCOMe, N-ацетиламино-D-глюкоза (а); R = CH2OH, X = О, D-манноза (б), D-галактоза (в); R = Me,
X = О, L-фукоза (г).
Разработанный ранее [18] метод синтеза лиган-
лектины, с варьированием состава углеводных ли-
дов с тиольными группами, основанный на взаи-
гандов в широких пределах, а также изучена про-
модействии вышеуказанных альдоз с гидразидом
тивовирусная активность полученных соединений
6-сульфанилгексановой кислоты, предполагает
против вируса гриппа А/Puerto Rico/8/34 (H1N1).
возможность получения гликонаночастиц Au сме-
Гидразид
6-сульфанилгексановой кислоты
1
шанно-лигандного типа с регулируемым составом
был получен с выходом 85% по известной мето-
исходных гликолигандов. Это открывает перспек-
дике [19]; его физико-химические и спектральные
тивы моделирования лектин-углеводных взаимо-
характеристики полностью соответствовали ли-
действий и использования подобных супрамоле-
тературным данным. Лиганды 2а-г с тиольными
кулярных систем как для изучения их собственной
группами получены с выходами 60-85% при кипя-
биологической активности, так и для целевой до-
чении эквимольных количеств исходных альдоз и
ставки лекарственного препарата, иммобилизиро-
гидразида 1 в метаноле в течение 5 ч (схема 1) [18].
ванного на их поверхности, в определенный орган
Коллоидное золото диаметром 14 нм получено
или ткань живого организма.
восстановлением золотохлористоводородной кис-
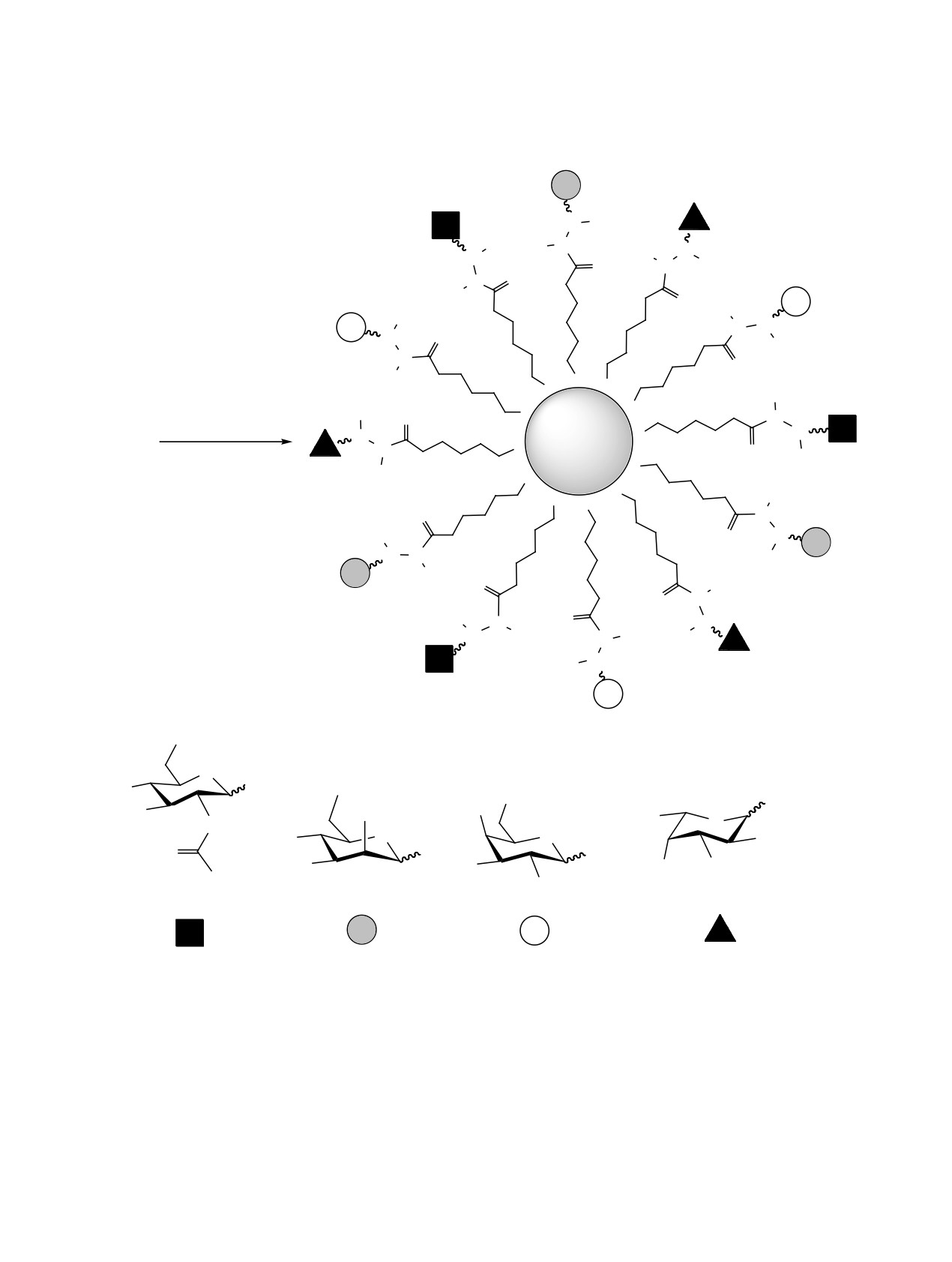
Нами получены гликонаночастицы Au смешан-
лоты цитратом натрия по методу Туркевича [20].
но-лигандного типа, моделирующие природные
Образование гликонаночастиц Au 3 начинает-
ся через несколько часов после смешивания ис-
ходных соединений 2а-г с коллоидным золотом в
смеси Н2О-ДМСО (10:1) и завершается через 2-
3 сут (схема 2). Для изучения физико-химических
параметров синтезированных гликонаночастиц Au
3 использовались методы электронной спектро-
скопии, динамического светорассеяния и просве-
чивающей электронной микроскопии (рис. 1). В
электронных спектрах гликонаночастиц Au 3а-д
с различным соотношением углеводных лигандов
наблюдается плазмонноe поглощениe, максимум
которого находится в диапазоне 523-524 нм (табл. 1).
Для предотвращения агрегации полученных
гликонаночастиц Au 3 в качестве стабилизатора
использовали додецилсульфат натрия, который
добавляли в реакционную смесь при синтезе гли-
конаночастиц Au в количестве 10 мас% от суммар-
ной массы исходных гликолигандов.
Рис. 1. Распределение размера гликонаночастиц Au 3г
Оценку противовирусной активности глико-
по диаметру.
наночастиц золота 3 проводили по отношению к
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ГЛИКОНАНОЧАСТИЦЫ ЗОЛОТА
1461
Схема 2.
N H
H
H
N
H N
N
O
N
H
N O
H
O
H
H
N
N
N
O
H
N
O
H
S
S
S
H
Коллоидное золото
S
S
H O
N
d = 14 нм
N
2а-г
N
S
Au
N
S
O
H
S
H
S
S
H
S
S
O
N
H
O
N
N
N
H
H
O
H
O
N
H
O
N
N
N
H
H
N
H
H
N
3а-д
OH
O
HO
OH
OH
HO
OH
HO
Me
NH
O
;
O
;
O
HO
;
OH
O
HO
HO
HO OH
Me
OH
GlcNAc
Man
Gal
Fuc
вирусу гриппа А/Puerto Rico/8/34 (H1N1) по стан-
его структуру гликолигандов GlcNAc:Man:Fuc =
дартной методике [21]. Наночастицы 3а-д пока-
20:75:5 мол% соответственно (табл. 2).
зали низкую цитотоксичность на клетках MDCK
Таким образом, на основе разработанного ранее
(более 100 мкг/мл) и высокую противовирусную
метода синтеза производных сахаров с тиольными
активность в концентрациях 3 и 6 мкг/мл. Hаи-
большая противовирусная активность прояви-
группами - продуктов конденсации серии природ-
лась у образца 3а с соотношением входящих в
ных альдоз с гидразидом 6-сульфанилгексановой
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1462
ЕРШОВ и др.
Таблица 1. Данные об углеводном составе, размере, полидисперсности и световому поглощению водных растворов
гликонаночастиц Au 3а-д через 72 ч после приготовления
Состав, мол%
Индекс
Образец
Средний диаметр, нм
λ, нм
GlcNAc
Man
Gal
Fuc
полидисперсности
3а
20
75
-
5
21
0.28
523
3б
20
55
20
5
21
0.28
523
3в
45
45
-
10
23
0.24
524
3г
50
20
20
10
24
0.30
523
3д
30
30
30
10
24
0.28
524
кислоты [18] - были получены гликонаночастицы
Изучение антивирусной активности гликона-
Au с варьированием соотношения исходных гли-
ночастиц Au 3а-д проводили в Государственном
колигандов в широких пределах. Предваритель-
научно-исследовательском институте эпидемиоло-
ные данные по активности в отношении вируса
гии и микробиологии им. Пастера (Санкт-Петер-
гриппа А/Puerto Rico/8/34 (H1N1) позволяют ре-
бург). Развернутые результаты этих исследований
комендовать данные соединения для дальнейшего
будут представлены в виде отдельных публикаций
углубленного изучения с целью поиска эффектив-
в специализированных журналах.
ных средств профилактики и лечения ряда острых
Раствор коллоидного золота. К 200 мл 2.5×
вирусных респираторных заболеваний.
10-4 М. раствора HAuCl4 при кипячении и интен-
сивном перемешивании добавляли горячий рас-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
твор 0.075 г дигидрата цитрата натрия в 10 мл
Н2О. После появления ярко-красного окрашивания
Электронные спектры поглощения гликона-
смесь кипятили 30 мин при перемешивании, затем
ночастиц Au регистрировали на спектрофотоме-
охлаждали до комнатной температуры, фильтрова-
тре СФ-2000 в диапазоне длин волн 300-750 нм
ли и использовали в синтезе гликонаночастиц Au
в кварцевой кювете толщиной 1 см. Диаметр и
3а-д. Судя по данным динамического светорас-
индекс полидисперсности полученных гликона-
сеяния и электронной спектроскопии, в получен-
ночастиц Au определяли методом динамического
ном растворе присутствовала основная фракция
светорассеяния на анализаторе Malvern Zetasizer
коллоидного золота с диаметром частиц 14.0±1 нм
Nano-ZS с длиной волны лазерного излучения 633
(максимум поглощения при λ 520 нм).
нм. Морфологию гликонаночастиц Au исследова-
Гликонаночастицы золота (3а-д). К 10 мл
ли методом просвечивающей электронной микро-
раствора коллоидного золота при перемешивании
скопии на микроскопе Jeol JEM 100 S.
добавляли смесь соединений 2а-г с суммарной
концентрацией 2.5×10-5 моль/л и 2-3 мг додецил-
Таблица 2. Активность гликонаночастиц Au 3а-д с раз-
сульфата Na в 1 мл ДМСО. Полученную смесь
личным соотношением углеводных лигандов против
выдерживали при 25°С 48-72 ч. Протекание ре-
вируса гриппа А/Puerto Rico/8/34 (H1N1)
акции контролировали с использованием методов
динамического светорассеяния, просвечивающей
Снижение титра вируса
электронной микроскопии и электронной спектро-
(lgTCID/0.2 мл)
Наночастицы
скопии.
при концентрации
3 мкг/мл
6 мкг/мл
ИНФОРМАЦИЯ ОБ АВТОРАХ
3а
3.0
4.0
3б
0.0
1.5
org/0000-0002-2266-4380
3в
2.0
3.5
Мартыненков Александр Алексеевич, ORCID:
3г
2.5
3.5
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ГЛИКОНАНОЧАСТИЦЫ ЗОЛОТА
1463
nanoparticles, and hydrogels / Ed. R. Narain.
org/0000-0002-3906-2909
New Jersey: John Wiley & Sons, 2011. 424 p. doi
10.1002/9780470 944349.ch6
Зарубаев Владимир Викторович, ORCID:
9.
Yilmaz G., Becer C.R. // Polym. Chem. 2015. Vol. 6.
N 31. P. 5503. doi 10.1039/c5py00089k
Слита Александр Валентинович, ORCID:
10.
Jayawardena H.S.N., Wang X., Yan M. // Anal. Chem.
2013. Vol. 85. N 21. P. 10277. doi: 10.1021 /ac402069j
Бучков Егор Владимирович, ORCID: https://
11.
Application of Nanotechnology in Biomedical Sciences /
orcid.org/0000-0002-9121-3049
Ed. F.A. Sheikh. Singapore: Springer Nature Singapore
Pte Ltd, 2020. 164 p. doi 10.1007/978-981-15-5622-7
Панарин Евгений Фёдорович, ORCID: https://
12.
Carbohydrate Nanotechnology / Ed. K.J. Stine. New
orcid.org/0000-0002-7005-5838
Jersey: John Wiley & Sons, 2016. 470 p. doi 10.1002/
Якиманский Александр Вадимович, ORCID:
9781118 860212.ch3
13.
Carbohydrate / Eds M. Caliskan, I.H. Kavakli,
G.C. Oz. Istanbul: InTech Publisher, 2017. 164 p. doi
КОНФЛИКТ ИНТЕРЕСОВ
10.5772/66194
Авторы заявляют об отсутствии конфликта
14.
Zhang X., Huang G., Huang, H. // Drug Deliv. 2018.
Vol. 25. N 1. P. 1840. doi 10.1080/ 10717544.2018.
интересов.
1519001
СПИСОК ЛИТЕРАТУРЫ
15.
Martínez-Ávila O., Hijazi K., Marradi M., Clavel C.,
Campion C., Kelly C., Penadés S. // Chem. Eur. J. 2009.
1. Lectins / Eds N. Sharon, H. Lis. New Delhi: Thomson
Vol. 15. N 38. P. 9874. doi 10.1002/chem. 200900923
Press, 1989. 127 p. doi 10.1007/978-94-011-4846-7
16.
Van Breedam W., Pöhlmann S., Favoreel H.W., de
2. Lectins. Methods and protocols. / Ed. J. Hirabayashi.
Groot R.J., Nauwynck H.J. // FEMS Microbiol. Rev.
Tsukuba: Humana Press, 2014. 599 p. doi 10.1007/978-
2014. Vol. 38. N 4. P. 598. doi 10.1111/1574-6976.
1-4939-1292-6
12052
3. Ghazarian H., Idoni B., Oppenheimer S.B. // Acta
17.
Дорохов Ю.Л., Шешукова Е.В., Кособокова Е.Н.,
Histochem. 2011. Vol. 113. N 3. P. 236. doi 10.1016/
Шиндяпина А.В., Косоруков В.С., Комарова Т.В. //
j.acthis.2010.02.004
Биохимия. 2016. Т. 81. № 8. С. 1069; Dorokhov Y.L.,
4. Nascimento K.S., Silva M.T.L., Oliveira M.V., Lossio C.F.,
Sheshukova E.V., Kosobokova E.N., Shindyapina A.V.,
Pinto-Junior V.R., Osterne V.J.S., Cavada B.S. // Int. J.
Kosorukov V.S., Komarova T.V. // Biochemistry
Biol. Macromol. 2020. Vol. 144. P. 509. doi 10.1016/j.
(Moscow). 2016. Vol. 81. N 8. С. 835. doi 10.1134/
ijbiomac. 2019.12.117
S0006297916080058
5. Valverde P., Ardá A., Reichardt N.-C., Jiménez-Barbero J.,
18.
Ершов А.Ю., Мартыненков А.А., Лагода И.В.,
Gimeno A. // Med. Chem. Commun. 2019. Vol. 10.
Якиманский А.А. // ЖОХ. 2020. Т. 90. Вып. 10.
P. 1678. doi 10.1039/C9MD 00292H
С. 1863; Ershov A.Yu., Martynenkov A.A., Lagoda I.V.,
6. Van Breedam W., Pöhlmann S., Favoreel H.W., de
Groot R.J., Nauwynck H.J. // FEMS Microbiol. Rev.
Yakimansky A.V. // Russ. J. Gen. Chem. 2020. Vol. 90.
2014. Vol. 38. N 4. P. 598. doi10.1111/1574-6976.12052.
N 10. P. 1863. doi 10.1134/S107036322 0100084
7. Glycochemical synthesis: strategies and applications /
19.
von Delius M., Geertsema E.M., Leigh D.A. // Nat. Chem.
Eds S.-C. Hung, M.M.L. Zulueta. Hoboken, New
2010. Vol. 2. N 2. P. 96. doi 10.1038/nchem.481
Jersey: John Wiley & Sons, Inc., 2016, 576 p. doi
20.
Turkevich J. // Gold Bull. 1985. Vol. 18. P. 125. doi 10.
10.1002/ 97811190 06435.ch16
1007/ BF03214694
8. Engineered carbohydrate-based materials for biomedical
21.
Mosmann T. // J. Immun. Methods. 1983. Vol. 65.
applications: polymers, surfaces, dendrimers,
N 1-2. P. 55. doi 10.1016/0022-1759(83)90303-4
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1464
ЕРШОВ и др.
Gold Glyconanoparticles Based on Aldose 6-Mercaptohexanoyl
Hydrazones and their Anti-Influenza Activity
А. Y. Ershovа,*, А. А. Martynenkovа, I. V. Lagodab, M. A. Kopanitsaа, V. V. Zarubaevd,
A. V. Slitad, E. V. Buchkovd, E. F. Panarina, and А. V. Yakimanskyа,e
a Institute of Macromolecular Compound, Russian Academy of Sciences, St. Petersburg, 199004 Russia
b State Research Testing Institute of Military Medicine, Ministry of Defense of Russian Federation,
St. Petersburg, 195043 Russia
c I.P. Pavlov Ryazan Medical University, Ryazan, 390026 Russia
d St. Petersburg Pasteur Research Institute of Epidemiology and Microbiology, St. Petersburg, 197101 Russia
e St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: ershov305@mail.ru
Received June 16, 2021; revised June 25, 2021; accepted July 1, 2021
On the basis of 6-mercaptohexanoylhydrazones aldoses - condensation products of a series of natural aldoses
(N-acetylamino-D-glucose, D-mannose, D-galactose and L-fucose) with 6-mercaptohexanoic acid hydrazide -
a method for the synthesis of mixed-ligand gold glyconanoparticles has been developed with varying the ratio
of the initial glycoligands in a wide range and with an average particle size of 20-25 nm. It was shown that
the obtained gold glyconanoparticles have low toxicity and high activity against influenza A/Puerto Rico/8/34
(H1N1) virus at concentrations of 3 and 6 mg/mL.
Keywords: thiol-containing monoses, gold glyconanoparticles, anti-influenza activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021