ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 1, с. 38-43
УДК 547.874
СИНТЕЗ И ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ
ПРОИЗВОДНЫХ 1,3,5-ТРИАЗИНАНА НА ОСНОВЕ
ПЕРВИЧНЫХ АМИНОВ И ЭФИРОВ АМИНОКИСЛОТ
© 2022 г. Д. Р. Кирееваa,*, С. С. Садретдиновa, А. И. Мусинаa, Д. В. Ишметоваb,
В. А. Вахитовb, Ю. И. Муриновa, В. А. Докичевa
a Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 69, Уфа, 450054 Россия
b Институт биохимии и генетики Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 71, Уфа, 450054 Россия
*e-mail: hetcom@anrb.ru
Поступило в Редакцию 7 октября 2021 г.
После доработки 30 ноября 2021 г.
Принято к печати 5 декабря 2021 г.
Синтезирован ряд производных 1,3,5-триазинана и исследованы их цитотоксические свойства in vitro с
использованием клеточных линий нормального (HEK293) и опухолевого (SH-SY5Y, MCF-7, A549) проис-
хождения. Показано, что исследованные соединения обладают умеренной цитотоксической активностью
в отношении клеток опухолевого и условно-нормального происхождения.
Ключевые слова: 1,3,5-триазинаны, цитотоксичность, аминокислоты, циклоконденсация
DOI: 10.31857/S0044460X22010061
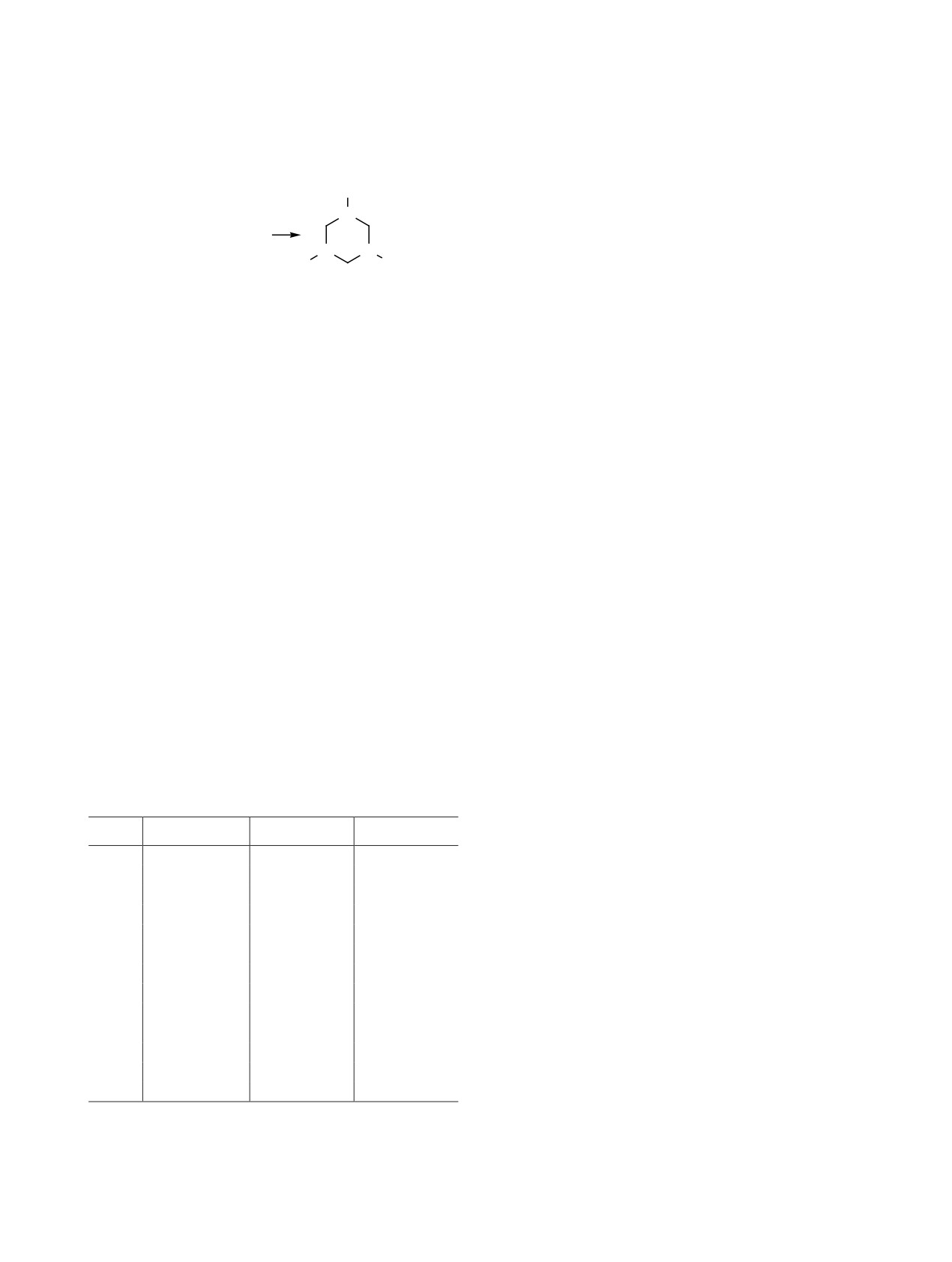
1,3,5-Триазинаны - важный класс органиче-
эфиров аминокислот и исследованы их цитоток-
ских соединений, обладающий широким спектром
сические свойства на клеточных линиях нормаль-
фармакологической активности: противоопухо-
ного (HEK293) и опухолевого (SH-SY5Y, MCF-7,
левой [1, 2], антимикробной и цитотоксической
A549) происхождения.
[2, 3]. Они находят применение в качестве гер-
Симметрично замещенные
1,3,5-триазинаны
бицидов, канцеролитиков и стимуляторов роста
1-13 были синтезированы конденсацией различ-
[4], являются важными структурными блоками
ных аминов с формальдегидом. В качестве аминов
во взрывчатых соединениях [5] и представляют
использовали пропиламин, бутиламин, N,N-ди-
интерес в качестве лигандов в комплексах с пере-
метил-1,3-диаминопропан, моноэтаноламин, бен-
ходными металлами [6]. В нефтегазовой промыш-
зиламин, гидрохлориды этиловые эфиры глицина
ленности производные 1,3,5-триазинана хорошо
и L-фенилаланина, метиловые эфиры L-алани-
зарекомендовали себя как поглотители сероводо-
на, D-аланина, L-валина, D-валина, L-лейцина,
рода [7], ингибиторы коррозии и солеотложения
D-фенилаланина. Ожидалось, что синтезирован-
[8, 9]. В то же время данные по синтезу и биологи-
ные триазинаны с различными функциональными
ческой активности 1,3,5-триазинанов немногочис-
ленны в сравнении с 1,3,5-триазинами [1, 10, 11].
группами будут обладать высокой биологической
активностью.
Учитывая их перспективность как потенциальных
противоопухолевых препаратов, в рамках данной
1,3,5-Триазинаны 1-5 были получены в резуль-
работы нами синтезирована серия замещенных
тате трехкратной циклической конденсации соот-
1,3,5-триазинанов на основе первичных аминов/
ветствующего первичного амина с параформом в
38
СИНТЕЗ И ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ
39
Цитотоксические свойства синтезированных
Схема 1.
соединений 1-13 исследовали in vitro на клеточ-
R
ных линиях опухолевого (SH-SY5Y, MCF-7, A549)
N
и условно-нормального (HEK293) происхождения.
3RNH2 + 3CH2O
Как следует из данных, представленных в табл. 2,
N N
все соединения данного ряда обладают умеренной
R
R
(диапазон значений IC50 ~18 мкМ. ~ 65 мкМ.) ци-
1-13
тотоксической активностью в отношении клеточ-
ных линий опухолевого (SH-SY5Y, MCF-7, A549)
и условно-нормального происхождения (HEK293).
среде метанола в присутствии 3.8 мол% триэти-
Наиболее активным в отношении клеток опу-
ламина с выходами 68-86% (схема 1, табл. 1). В
холевого происхождения является соединение 6,
выбранных условиях и при 5-кратном мольном из-
содержащее фрагмент этилового эфира глицина,
бытке метанола в расчете на формальдегид пара-
со значениями IC50 ~23-27 мкМ. Отметим также
форм полностью превращался в метоксиметанол
более высокую активность соединений 8 (с заме-
[8].
стителями D-Ala) и 9 (с заместителями L-Val) в
1,3,5-Триазинаны
6-13, содержащие амино-
отношении линии нейробластомы (IC50 18.8 мкМ.)
кислотный фрагмент, синтезированы путем взаи-
и клеток карциномы легкого соответственно
модействия трех молекул формальдегида с тремя
(18.5 мкМ.). В сравнении с s-триазинами [13-15]
молекулами гидрохлорида эфира аминокислоты
1,3,5-триазинаны 1-13 показали более выражен-
в водно-бензольной среде в присутствии 1 н. рас-
ную активность и селективность в отношении кле-
твора NaOH при охлаждении до 5-7°С с выходами
ток карциномы легкого A549.
53-87% (табл. 1). Следует отметить, что использо-
Таким образом, в результате циклоконденсации
вание ацетатного буфера (pH 4) в качестве среды
первичных аминов/эфиров аминокислот с фор-
для проведения реакции с гидрохлоридами эфиров
мальдегидом получен ряд производных 1,3,5-три-
аминокислот [12] в нашем случае привело к труд-
азинана с выходами до 87%. Исследования цито-
но идентифицируемой смеси продуктов. Строение
токсической активности in vitro с использованием
полученных соединений подтверждено данными
клеточных линий нормального (HEK293) и опухо-
спектроскопии ЯМР 1Н и 13С.
левого (SH-SY5Y, MCF-7, A549) происхождения
показало умеренную цитотоксическую активность
полученных соединений. В сравнении с s-триа-
Таблица 1. Выходы 1,3,5-триазинанов 1-13
зинами полученный 1,3,5-триазинаны показали
более выраженную активность и селективность в
№
R
Метода
Выход, %
отношении клеток карциномы легкого A549.
1
Pr
а
81
2
Bu
а
78
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3
(CH2)3N(Me)2
а
84
Спектры ЯМР 1Н, 13С зарегистрированы на
4
(CH2)2OH
а
86
спектрометре Bruker Avance III (США) (500 и
5
Bn
а
68
6
Glu
б
87
125 МГц соответственно) в CDCl3, внутрен-
7
L-Ala
б
70
ний стандарт - ТМС. Масс-спектры записаны на
8
D-Ala
б
56
жидкостном хроматомасс-спектрометре LC-MS-
9
L-Val
б
68
2010EV Shimadzu (Япония) (химическая иони-
10
D-Val
б
56
зация при атмосферном давлении). Элементный
11
L-Leu
б
71
анализ соединений проведен на CHNS-анализа-
12
L-Phe
б
53
торе EuroEA-3000 (HEKAtech GmbH, Германия).
13
D-Phe
б
60
ТСХ-Анализ проведен на аналитических пласти-
O, 1 н.
а а, MeOH, 3.8 мол% Et3N, 20-25°C, 24 ч; б, С6H6-H2
нах Sorbfil ПТСХ-АФ-А (ООО «ИМИД», Красно-
NaOH, 5-7°C, 7 ч.
дар), элюент - гексан-AcOEt, 7:3. Препаративное
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022
40
КИРЕЕВА и др.
Таблица 2. Цитотоксическая активность 1,3,5-триазинанов 1-13a
IC50, мкМ.
№
HEK293
SH-SY5Y
MCF-7
A549
1
42.74±2.68
44.70±8.11
43.59±1.74
31.89±1.52
(p 0.04)
2
>100
43.29±2.16
41.57±4.94
41.68±1.21
3
>100
>100
>100
39.31±1.82
4
36.43±3.17
64.99±8.11
25.35±1.60
30.12±2.91
(p 0.0002)
(p 0.05)
5
52.33±4.29
44.79±5.65
63.30±1.97
20.43±2.90
(p 0.02)
(p 0.00003)
6
47.28±0.92
24.92±5.48
22.72±2.90
27.34±2.45
(p 0.00009)
(p 0.00005)
(p 0.0002)
7
36.88±0.95
22.94±4.23
52.02±3.09
32.03±0.42
(p 0.0003)
(p 0.0002)
8
33.41±1.32
18.85±0.97
48.61±2.78
22.90±1.17
(p 0.00001)
(p 0.00001)
(p 0.00005)
9
50.85±4.78
26.20±6.97
32.77±0.80
18.50±1.37
(p 0.0003)
(p 0.002)
(p 0.00005)
10
71.39±0.26
34.96±5.85
54.10±4.77
43.25±3.15
(p 0.00001)
(p 0.0004)
(p 0.000020)
11
43.53±1.07
44.41±3.47
51.31±3.54
64.67±3.08
(p 0.02)
(p 0.00004)
12
>100
90.61±2.74
>100
>100
(p 0.00002)
13
83.62±5.66
34.75±9.22
49.64±1.44
34.27±2.31
(p 0.00002)
(p 0.0001)
(p 0.00002)
a Данные представлены в виде среднего арифметического значений выживаемости клеток± стандартная ошибка среднего (N =
3, выполненные трижды для каждой концентрации тестируемого соединения). Различия значений IC50 в клетках SH-SY5Y,
MCF-7, A549 относительно значений IC50 в клетках HEK293 статистически достоверны (однофакторный дисперсионный анализ
(ANOVA) с последующим апостериорным тестом Даннета).
разделение осуществляли с помощью колоночной
вали на колонке (Kieselgel 60, гексан-этилацетат,
хроматографии на силикагеле Macherey-Nagel
10:0→7:3).
Kieselgel 60 (70-230 меш) (Германия).
1,3,5-Трипропил-1,3,5-триазинан (1) [16] по-
Коммерчески доступные первичные ами-
лучали из 5.9 г (0.1 моль) пропиламина. Выход
ны (Acros) и гидрохлориды эфиров аминокис-
81%, прозрачная маслообразная жидкость. Спектр
лот (Aldrich) использованы без дополнительной
ЯМР 1H, δ, м. д.: 0.81 т (9H, Me, J 7.6 Гц), 1.35-
очистки.
1.42 м (6H, CH2Me), 2.28 т (6H, NCH2, J 7.6 Гц),
3.26 уш. с (6H, NCH2N). Спектр ЯМР 13С, δС, м. д.:
Общая методика получения
1,3,5-триази-
11.85 (Me), 20.71 (CH2Me), 54.69 (NCH2), 74.62
нанов 1-5. К 0.1 моль амина прибавляли раствор
(NCH2N).
3.0 г (0.1 моль в перерасчете на формальдегид) па-
раформа в 20 мл метанола и 0.38 г триэтиламина.
1,3,5-Трибутил-1,3,5-триазинан (2) [17] полу-
Полученную смесь перемешивали при комнатной
чали из 7.3 г (0.1 моль) бутиламина. Выход 78%,
температуре 24 ч. Растворитель удаляли при по-
прозрачная маслообразная жидкость. Спектр ЯМР
ниженном давлении. Остаток хроматографиро-
1H, δ, м. д.: 0.88 т (9H, Me, J 7.6 Гц), 1.27-1.34 м
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022
СИНТЕЗ И ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ
41
(6H, CH2Me), 1.38-1.45 м (6H, CH2CH2Me), 2.38
бесцветное масло. Спектральные данные идентич-
т (6H, NCH2, J 7.6 Гц), 3.27 уш. с (6H, NCH2N).
ны опубликованным ранее.
Спектр ЯМР 13С, δС, м. д.: 13.98 (Me),
20.65
1,3,5-Трис[(R)-1′-(метоксикарбонил)этил)]-
(CH2Me), 29.76 (CH2CH2Me), 52.55 (NCH2), 74.71
1,3,5-триазинан (8) получали из 1.5 г гидрохлори-
(NCH2N).
да метилового эфира D-аланина. Выход 56%, бес-
(3-{3,5-Бис[3-(диметиламино)пропил]-
цветное масло, [α]20 46.9±0.2 (с 1, CH3Cl). Спек-
1,3,5-триазинан-1-ил}пропил)диметиламин
(3)
тральные характеристики совпадали с таковыми
[18] получали из 10.2 г (0.1 моль) диметиламино-
для соединения 7.
пропиламина. Выход 84%, светло-желтая маслоо-
1,3,5-Трис[(S)-(2-метил-1-метоксикарбонил-
бразная жидкость. Спектр ЯМР 13С, δС, м. д.: 25.77
пропил)]-1,3,5-триазинан (9) получали из 1.7 г
(CH2CH2), 45.45 (NMe), 50.69 (NCH2CH2), 57.74
гидрохлорида метилового эфира L-валина. Вы-
(CH2N(Me)2), 74.56 (NCH2N).
ход 68%, желтое масло. Спектр ЯМР 1H, δ, м. д.:
0.85 д (9H, Me, J 6.7 Гц), 0.98 д (9H, Me, J 6.7 Гц),
2,2′,2′′-(1,3,5-Триазинан-1,3,5-триил)триэта-
1.96-2.01 м (3H, CH), 3.15 д (3H, NCH, J 8.6 Гц),
нол (4) [8] получали из 6.1 г (0.1 моль) моноэтано-
3.56 с (6H, NCH2N), 3.66 с (9H, OMe). Спектр
ламина. Выход 86%, вязкая жидкость светло-жел-
ЯМР13 С, δС, м. д.: 18.46, 19.57 (2Me), 26.94 (CH)
того цвета. Спектр ЯМР 1H, δ, м. д.: 2.53-2.56 м
31.35 (CH), 50.89 (OMe), 69.14 (CH2N), 69.24 (CH),
(6H, NCH2), 3.12-3.45 м (6H, NCH2N), 3.53-3.64
172.08 (C=О). Найдено, %: C 59.01; H 9.13; N 9.83.
м (6H, CH2OH). Спектр ЯМР 13С, δС, м. д.: 55.02
C21H39N3O6. Вычислено, %: C 58.72; H 9.15; N 9.78.
(NCH2), 59.19 (CH2OH), 73.81 (NCH2N).
1,3,5-Трис[(R)-(2-метил-1-метоксикарбонил-
1,3,5-Трибензил-1,3,5-триазинан (5) [2], полу-
пропил)]-1,3,5-триазинан (10) получали из 1.7 г
чали из 10.7 г (0.1 моль) бензиламина. Выход 68 %,
гидрохлорида метилового эфира D-валина. Выход
белое аморфное вещество. Спектральные данные
56%, бесцветное масло. [α]20 41±0.2 (с 1, CH3Cl).
идентичны опубликованным ранее.
Спектральные характеристики совпадали с тако-
Общая методика получения 1,3,5-триазина-
выми для соединения 9.
нов 6-12. К 0.01 моль гидрохлорида эфира амино-
1,3,5-Трис[(S)-(3-метил-1-метоксикарбонил-
кислоты приливали 10 мл воды и 25 мл бензола.
бутил)]-1,3,5-триазинан
(11)
получали из
К полученной смеси добавляли 12 мл 1 н. раство-
1.82 г гидрохлорида метилового эфира L-лейцина.
ра гидроксида натрия по каплям при температуре
Выход 71%, светло-желтое масло. Спектр ЯМР 1H,
5-7°С и затем 1.1 мл 37%-ного раствора формаль-
δ, м. д.: 0.89 д (9H, Me, J 6.5 Гц), 0.92 д (9H, Me, J
дегида. Реакционную смесь перемешивали при
6.5 Гц), 1.50-1.54 м (6H, CH2CH), 1.60-1.64 м (3H,
охлаждении 7 ч. После окончания реакции орга-
CH), 3.52 т (3H, NCH, J 7.5 Гц), 3.65 с (6H, NCH2N),
нический слой отделяли, водный слой промывали
3.67 с (9H, OMe). Спектр ЯМР13 С, δС, м. д.: 22.35,
CH2Cl2 (3×10 мл). Органические слои объединяли,
22.81 (Me), 24.93 (CH), 38.34 (CH2CH),
51.22
сушили безводным Na2SO4, растворитель удаля-
(OMe), 61.12 (NCH), 68.42 (NCH2N), 173.35 (C=О).
ли при пониженном давлении. Остаток хромато-
Найдено, %: C 61.73; H 9.64; N 9.00. C24H45N3O6.
графировали на колонке (Kieselgel 60, элюент -
Вычислено, %: C 61.12; H 9.62; N 8.91.
хлористый метилен-MeOH с градиентом метано-
1,3,5-Трис[(S)-(2-фенил-1-этоксикарбонил-
ла от 0 до 10%).
этил)]-1,3,5-триазинан (12) получали из 2.3 г
1,3,5-Трис(этоксикарбонилметил)-1,3,5-три-
гидрохлорида этилового эфира L-фенилаланина.
азинан (6) [19] получали из 1.5 г (0.01 моль) ги-
Выход 53%, белое твердое вещество. Спектр ЯМР
дрохлорида этилового эфира глицина. Выход 87%,
1H, δ, м. д.: 1.09 т (9H, Me, J 7.1 Гц), 2.85-2.94 м
бесцветное масло. Спектральные данные идентич-
(6H, CH2Ph), 3.67 д. д (3H, CH, J 6.7, J 8.6 Гц),
ны опубликованным ранее.
3.81 с (6H, NCH2N), 4.03 к (6H, OCH2, J 7.1 Гц),
1,3,5-Трис[(S)-1′-(метоксикарбонил)этил)]-
7.11-7.13 м (6H, Ph), 7.19-7.29 м (9H, Ph). Спектр
1,3,5-триазинан (7) [7] получали из 1.5 г гидрох-
ЯМР 13С, δС, м. д.: 14.21 (Me), 35.81 (CH2Ph), 60.37
лорида метилового эфира L-аланина. Выход 70%,
(OCH2), 64.86 (CH), 68.97 (NCH2N), 126.46 (CHPh),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022
42
КИРЕЕВА и др.
128.29, 129.25 (CHPh), 137.81 (CHPh), 171.80 (C=О).
ИНФОРМАЦИЯ ОБ АВТОРАХ
Найдено, %: C 71.05; H 7.40; N 6.91. C36H45N3O6.
Киреева Дилара Роландовна, ORCID: https://
Вычислено, %: C 70.22; H 7.37; N 6.82.
orcid.org/0000-0002-0149-4300
1,3,5-Трис[(R)-(2-фенил-1-метоксикарбонил-
Ишметова Диана Валиевна, ORCID: https://
этил)]-1,3,5-триазинан (13) получали из 2.16 г
orcid.org/0000-0001-9393-2875
гидрохлорида метилового эфира D-фенилаланина.
Выход 60%, белое твердое вещество, [α]
20 44±0.1
(с 1, CH3Cl). Спектр ЯМР 1H, δ, м. д.: 2.84-2.92
org/0000-0002-8199-1912
м (6H, CH2Ph), 3.54 с (9H, OMe), 3.67-3.74 м (3H,
БЛАГОДАРНОСТЬ
CH), 3.77 с (6H, NCH2N), 7.09-7.15 м (6H, Ph),
, м. д.:
7.17-7.29 м (9H, Ph). Спектр ЯМР 13С, δС
Спектральные исследования (спектры ЯМР и
Ph), 51.34 (OMe), 64.85 (CH),
68.93
35.74 (CH2
масс-спектры) выполнены с использованием обо-
),
(NCH2N), 126.52 (CHPh), 128.35, 129.14 (CHPh
рудования Центра коллективного пользования
), 172.27 (C=О). Масс-спектр (APCI),
137.71 (CHPh
«Химия» Уфимского Института химии Уфимского
. Найдено, %: C
m/z: 596 [M + Na]+, 603 [M + K]+
федерального исследовательского центра Россий-
. Вычислено, %:
68.65; H 6.76; N 7.28. C33H39N3O6
ской академии наук.
C 69.09; H 6.85; N 7.32.
Биологические исследования. Для исследо-
ФОНДОВАЯ ПОДДЕРЖКА
вания цитотоксических свойств соединений ис-
Работа выполнена в рамках научно-исследо-
пользовали клеточные линии HEK293 (клетки
вательских работ Уфимского Института химии
эмбриональной почки человека), SH-SY5Y (ней-
Уфимского федерального исследовательского цен-
робластома человека), A549 (аденокарцинома лег-
тра Российской академии наук (№ госрегистрации
кого человека), MCF-7 (аденокарцинома протоков
AAAA-A20-120012090031-3).
молочной железы человека), полученные из Рос-
сийской коллекции клеточных культур (Институт
КОНФЛИКТ ИНТЕРЕСОВ
цитологии РАН, Санкт-Петербург). Клетки ли-
нии HEK293 (2.5×104 клеток на лунку), SH-SY5Y
Авторы заявляют об отсутствии конфликта
(5×104 клеток на лунку), MCF-7 (1.2×104 клеток на
интересов.
лунку), A549 (1×104 клеток на лунку) высаживали
СПИСОК ЛИТЕРАТУРЫ
в 96-луночные планшеты в 100 мкл среды DMEM,
содержащей 10% эмбриональной бычьей сыво-
1. Liu B., Sun T., Zhou Z., Du L. // Med. Chem. 2015.
ротки (Gibco, США), 2 мM. L-глутамин (ПанЭко,
Vol. 5. N 3. P. 131. doi 10.4172/2161-0444.1000255
Россия), 50 мкг/мл гентамицина (Биолот, Россия).
2. Song M.B., Sung Y.K., Ju H.S. // Bull. Korean Chem.
Через 24 ч вносили соединения в конечных кон-
Soc. 2021. Vol. 42. N 6. P. 840. doi 10.1002/bkcs.12266
центрациях 1, 10, 100 мкМ. (0.1% ДМСО) с после-
3. Al-Khamees H.A. // Arch. Pharm. Res. 1990. Vol. 13.
N 1. P. 19. doi 10.1007/BF02857828
дующей инкубацией в течение 48 ч при 37°С, 5%
4. Qin Y., Zhang J., Song D., Duan H., Li W., Yang X. //
СО2. Цитотоксические свойства веществ оценива-
Molecules. 2016. Vol. 21. N 7. P. 825. doi 10.3390/
ли с помощью витального красителя PrestoBlue со-
molecules21070825
гласно протоколу изготовителя (Invitrogen, США).
5. Adamia G., Ghoghoberidze M., Graves D., Khatisash-
Детекцию флуоресценции проводили, исполь-
vili G. // Ecotoxicol. Environ. Saf. 2006. Vol. 64. N 2.
зуя мультипланшетный анализатор 2300 EnSpire
P. 136. doi 10.1016/j.ecoenv.2005.05.001
Multimode Plate Readers (PerkinElmer, США).
6. Муринов Ю.И., Голубятникова Л.Г., Хисамутди-
(концентрация соединения,
Расчет значений IC50
нов Р.А., Бадамшин А.Г., Докичев В.А. // ЖОХ. 2020.
которая вызывает ингибирование жизнеспособ-
T. 90. Вып. 11. С. 1667; Murinov Yu.I., Golubyatniko-
ности клеток на 50%) осуществляли с помощью
va L.G., Khisamutdinov R.A., Badamshin A.G.,
программы GraphPad Prizm 4.0 (GraphPad Software
Dokichev V.A. // Russ. J. Gen. Chem. 2020. Vol. 90.
Inc.).
N 11. 2048. doi 10.1134/S1070363220110055
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022
СИНТЕЗ И ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ
43
7. Wylde J.J., Taylor G.N., Sorbie K.S., Samaniego W.N. //
Tomilov Y.V., Dokichev V.A. // Med. Chem. Res. 2017.
Energy & Fuels. 2020. Vol. 34. N 11. P. 13883. doi
Vol. 26. P. 900. doi 10.1007/s00044-017-1802-4
10.1021/acs.energyfuels.0c02652
13. Fatima A.I. Al-Khodir, Hana M.A. Abumelha,
8. Ишмияров Э.Р., Рахимова Н.Т., Латыпова Д.Р.,
Tarfah Al-Warhi, S.A. Al-Issa // Biomed. Res. Int. 2019.
Абдуллин М.И., Волошин А.И., Докичев В.А. //
Article ID 9835745. doi 10.1155/2019/9835745
ЖПХ. 2015. Т. 88. Вып. 7. С.1083; Ishmiyarov E.R.,
14. Srivastava J.K., Pillai G.G., Bhat H.R., Verma A.,
Rakhimova N.T., Latypova D.R., Abdullin M.I., Volo-
Singh U.P. // Sci. Rep. 2017. Vol. 7. P. 5851. doi
shin A.I., Dokichev V.A. // Russ. J. Appl. Chem. 2015.
10.1038/s41598-017-05934-5
Vol. 88. P. 1174. doi 10.1134/S1070427215070113
15. Bhat H.R., Masih A., Shakya A., Ghosh S.K., Singh U.P. //
9. Salman M., Ansari K.R., Haque J., Srivastava V.,
J. Heterocycl. Chem. 2019. Vol. 57. N 12. P. 390. doi
Quraishi M.A., Mazumder M. // J. Heterocycl. Chem.
10.1002/jhet.3791
2020. Vol. 57. P. 2157. doi 10.1002/jhet.3936
16. Ulrich H., Rubinfeld J. // J. Org. Chem. 1961. Vol. 26.
10. Cascioferro S., Parrino B., Spanò V., Carbone A.,
N 5. P. 1637. doi 10.1021/jo01064a606
Montalbano A., Barraja P., Diana P., Cirrincione G. //
17. Barluenga J., Bayon A.M., Campos P., Asensio G.,
Eur. J. Med. Chem. 2017. Vol. 142. P. 523. doi
Gonzalez-Nunez E., Molina Y. // J. Chem. Soc. Perkin
10.1016/j.ejmech.2017.09.035
Trans. 1. 1988. P. 1631. doi 10.1039/P19880001631
11. Al Rasheed H.H., Malebari A.M., Dahlous K.A., Fayne D.,
18. Kauffman W.J. // J. Heterocycl. Chem. 1975. Vol. 12.
El-Faham A. // Molecules. 2020. Vol. 25. P. 4065. doi
N 2 P. 409. doi 10.1002/jhet.5570120244
10.3390/molecules25184065
19. Tsuge O., Kanemasa S., Ohe M., Takenaka S. // Bull.
12. Latypova D.R., Badamshin A.G., Gibadullina N.N.,
Chem. Soc. Japan. 1987. Vol. 60. P. 4079. doi 10.1246/
Khusnutdinova N.S., Zainullina L.F., Vakhitova Y.V.,
bcsj.60.4079
Synthesis and Cytotoxic Activity of 1,3,5-Triazinane Derivatives
Based on Primary Amines and Amino Acids Esters
D. R. Kireevaa,*, S. S. Sadretdinova, A. I. Musinaa, D. V. Ishmetovab, V. A. Vakhitovb,
Yu. I. Murinova, and V. A. Dokicheva
a Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences, Ufa, 450054 Russia
b Institute of Biochemistry and Genetics, Ufa Science Center of the Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: hetcom@anrb.ru
Received October 7, 2021; revised November 30, 2021; accepted December 5, 2021
A series of 1,3,5-triazinane derivatives was synthesized and their cytotoxic activity was studied in vitro on
normal cell line (HEK293) and tumor cell lines (SH-SY5Y, MCF-7, A549). It was shown that the studied com-
pounds have moderate cytotoxic activity against normal and tumor cell lines.
Keywords: 1,3,5-triazinane, cytotoxic activity, amino acid, cyclocondensation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022