ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 1, с. 121-127
УДК 546.92:544.47:547.1
ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ
ПЛАТИНЫ(II) ДЛЯ ПОЛУЧЕНИЯ
ФЕНИЛСОДЕРЖАЩИХ СИЛИКОНОВЫХ
РЕЗИН ПО РЕАКЦИИ КАТАЛИТИЧЕСКОГО
ГИДРОСИЛИЛИРОВАНИЯ
© 2022 г. М. В. Добрынин, С. О. Касаткина, С. В. Байков, П. Ю. Савко,
Н. С. Антонов, А. С. Михердов, В. П. Боярский, Р. М. Исламова*
Санкт-Петербургский государственный университет, Университетская наб. 7-9, 199034 Россия
*e-mail: r.islamova@spbu.ru
Поступило в Редакцию 8 сентября 2021 г.
После доработки 28 октября 2021 г.
Принято к печати 31 октября 2021 г.
Исследованы C,N-хелатные депротонированные диаминокарбеновые комплексы платины(II) в качестве
катализаторов реакции гидросилилирования для полисилоксановых систем. Получены фенилсодержащие
силиконовые резины.
Ключевые слова: циклометаллированные комплексы платины(II), полисилоксаны, гидросилилирование,
фенилсодержащие силиконовые резины
DOI: 10.31857/S0044460X22010139
Силиконовые резины являются одними из наи-
это вулканизация (сшивка) по реакции гидросили-
более востребованных материалов в быту и техни-
лирования между винил- и гидридсодержащими
ке, спрос на которые в последние годы постоянно
полисилоксанами, катализируемая соединениями
растет [1-4]. Наиболее часто силиконовые резины
металлов платиновой группы [12-17]. Преиму-
получают на основе полидиметилсилоксанов. В
ществами данного подхода являются отсутствие
частности, широко распространены коммерчески
побочных продуктов, малая токсичность продук-
доступные силиконовые композиции Sylgard 182
тов реакции и минимальная усадка при получении
или 184 (Dow Corning). Однако наряду с полиди-
силиконовых изделий [18]. Наиболее часто в этих
метилсилоксанами научный и практический инте-
процессах используется катализатор Карстедта -
рес представляют функционализированные поли-
комплекс платины(0) с дивинилтетраметилдиси-
силоксаны. Так, известно, например, что замена
локсаном. Однако этот катализатор отличается
в полидиметилсилоксанах метильных групп на
гиперактивностью, которая, в свою очередь, мо-
фенильные позволяет улучшить термостойкость
жет привести к преждевременной вулканизации и,
[5-7], устойчивость к радиационному облучению
следовательно, к ухудшению качества получаемых
[8, 9], в том числе от ядерного реактора [10], а так-
силиконовых резин - появлению трещин, пузырь-
же теплоизоляционные свойства [11] получаемых
ков и пр. дефектов [14, 16]. В связи с этим возни-
на их основе материалов.
кает необходимость использования в сочетании с
Один из успешных и распространенных на
катализатором Карстедта ингибиторов, в качестве
практике методов получения силиконовых резин -
которых были апробированы непредельные спир-
121
122
ДОБРЫНИН и др.
Схема 1.
O
O
N
N
N
N
N
N
N
N
Pt
Pt
N Cl
N Cl
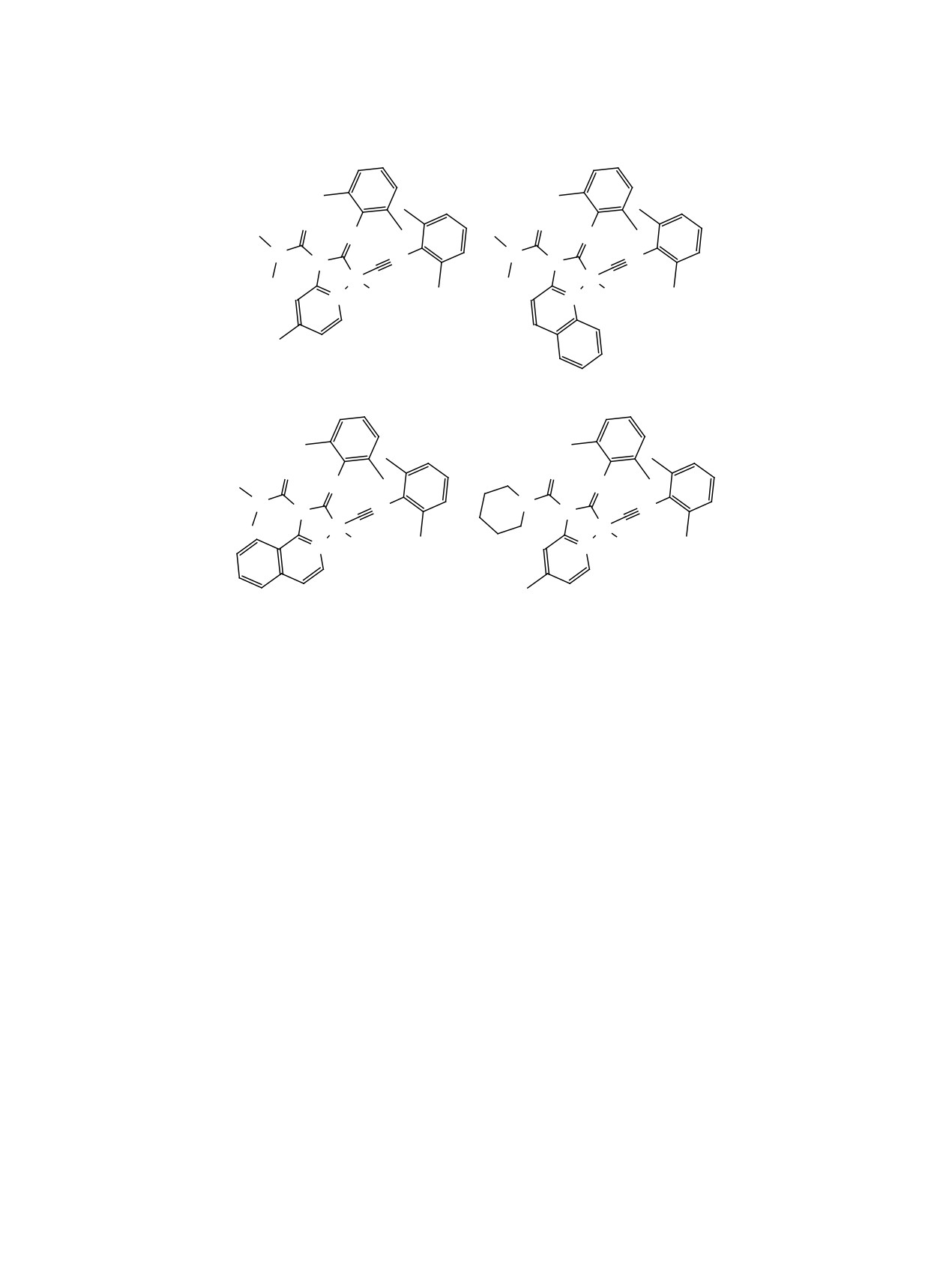
1
2
O
O
N
N
N
N
N
N
N
N
Pt
Pt
N Cl
N Cl
3
4
ты, кетоны, нитрилы, фосфины и др. [17, 19]. В
ные депротонированные диаминокарбеновые ком-
промышленности наиболее часто применяют ма-
плексы платины(II) успешно катализируют сшив-
леаты и фумараты [20]. Ингибиторы позволяют
ку винилсодержащего полидиметилсилоксана с
использовать катализатор Карстедта как при ком-
гидридсодержащим аналогом [22].
натной температуре, так и при нагревании в зави-
Целью данной работы является исследова-
симости от концентрации последнего [19]. Однако
ние влияния циклометаллированных комплек-
введение ингибиторов усложняет реакционную
сов платины(II) 1-4 (схема 1) на процесс сшивки
систему. Кроме того, может повлиять на токсич-
α,ω-дивинилполи(диметилсилоксан-cо-дифенил-
ность получаемых с их помощью силиконовых
силоксана) 5 с поли(диметилсилоксан-cо-метил-
материалов, так как не все ингибиторы безопасны
гидросилоксаном) 6 по реакции каталитического
для жизни и здоровья человека.
гидросилилирования и получение фенилсодержа-
Актуальным и по сей день остается поиск но-
щей силиконовой резины 7 (схема 2).
вых катализаторов платиновой группы, которые
Для достижения поставленной цели были син-
позволят проводить вулканизацию полисилокса-
тезированы C,N-хелатные депротонированные
нов и получать, в частности, фенилсодержащие
диаминокарбеновые комплексы платины(II) 1-4
силиконовые резины без указанных выше недо-
(схема 1), среди которых соединения 1-3 были ис-
статков.
следованы ранее в качестве катализаторов получе-
ния аналогичной силиконовой резины на основе
На основании предыдущих исследований
[21, 22] полагаем, что перспективными для реше-
полидиметилсилоксана [22], тогда как соединение
ния данной проблемы будут диаминокарбеновые
4 было получено впервые (схема 3).
комплексы платины(II). Так, недавно нами было
Исследована каталитическая активность плати-
продемонстрировано, что некоторые C,N-хелат-
новых комплексов 1-4 при концентрациях 1×10-3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022
ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
123
Схема 2.
CH3
CH3
CH3
CH3
H3C
Si O
Si O
Si O
Si
CH3
n
m
CH3
CH3
CH3
CH3
CH3
CH3
Si O
Si O
Si O
Si
l
H3C
Si
CH3
k
CH3
CH3
CH3
O
катализатор
1-4
H3C
Si
CH3
5
O
k
+
Si
O
CH3
CH3
CH3
CH3
l
H3C
Si O
Si O
Si O
Si
CH3
H3C
Si CH3
n
m
CH3
CH3
H
CH3
CH3
CH3
CH3
6
H3C
Si O
Si O
Si O
Si
CH3
n
m
CH3
CH3
CH3
CH3
7
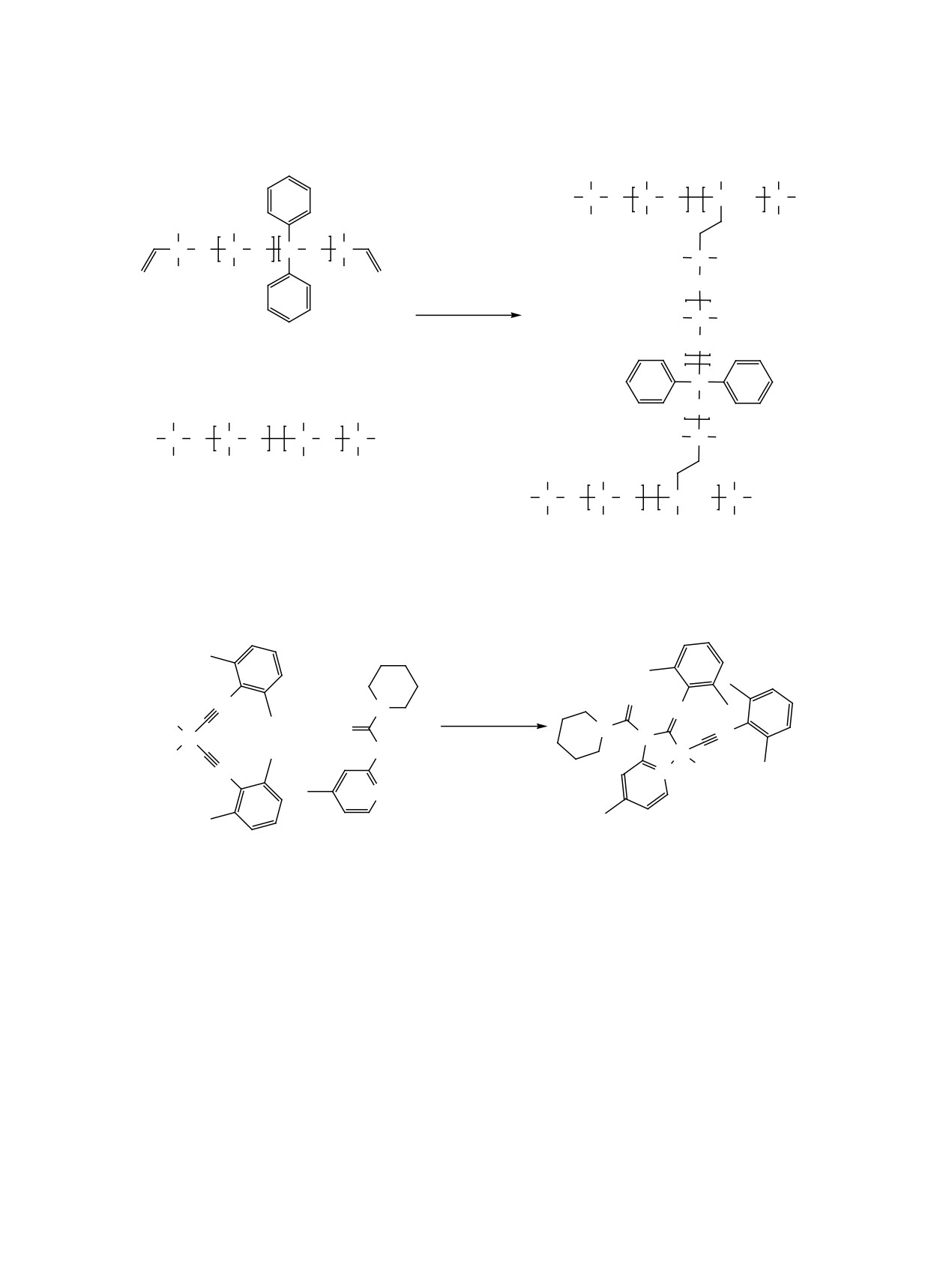
Схема 3.
O
N
N
N(CH2CH2OH)3
N
Cl
+
O
N
N
Pt
CHCl3, 35°C, 72 ч
N
NH
Pt
Cl
N
N Cl
N
4 (93%)
8
9
и 1×10-4 моль/л в реакции гидросилилирования
являются прозрачными, что заметно расширяет их
с участием функционализированных полисилок-
потенциальные области применения, например, в
санов 5 и 6 (схема 2) при комнатной температуре
оптоэлектронике. Кроме того, они однородны по
(20-23°C) и при нагревании (80 и 100°C). Обна-
структуре, не содержат дефектов, пузырьков, тре-
ружено, что предложенные катализаторы активны
щин и т. п.
только при 100°C (табл. 1). В изученных услови-
При более низких температурах (80°C и ниже)
ях исходные жидкие полимеры вулканизируются
вязкость реакционной полисилоксановой смеси в
и превращаются в твердые, при этом эластичные,
присутствии комплексов 1-4 не изменяется в те-
резиноподобные материалы. Следует отметить,
чение недели, а значит, реакция гидросилилирова-
что все полученные силиконовые резины 7, неза-
ния между соединениями 5 и 6 в данных условиях
висимо от типа используемого катализатора 1-4,
не протекает.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022
124
ДОБРЫНИН и др.
Следует отметить, что замена диметиламино-
вого лиганда в комплексе 1 на пиперидиновый в
комлексе 4 заметно снижает каталитическую ак-
тивность последнего. Так, время вулканизации по-
лисилоксанов 5 и 6 в присутствии катализатора 4
возрастет примерно в 2 раза (табл. 1). Это может
быть обусловлено бóльшим объемом лиганда в
комплексе 4.
На основании литературных данных можно
предположить, что реакция гидросилилирования
между винил- и гидридсодержащими полисилок-
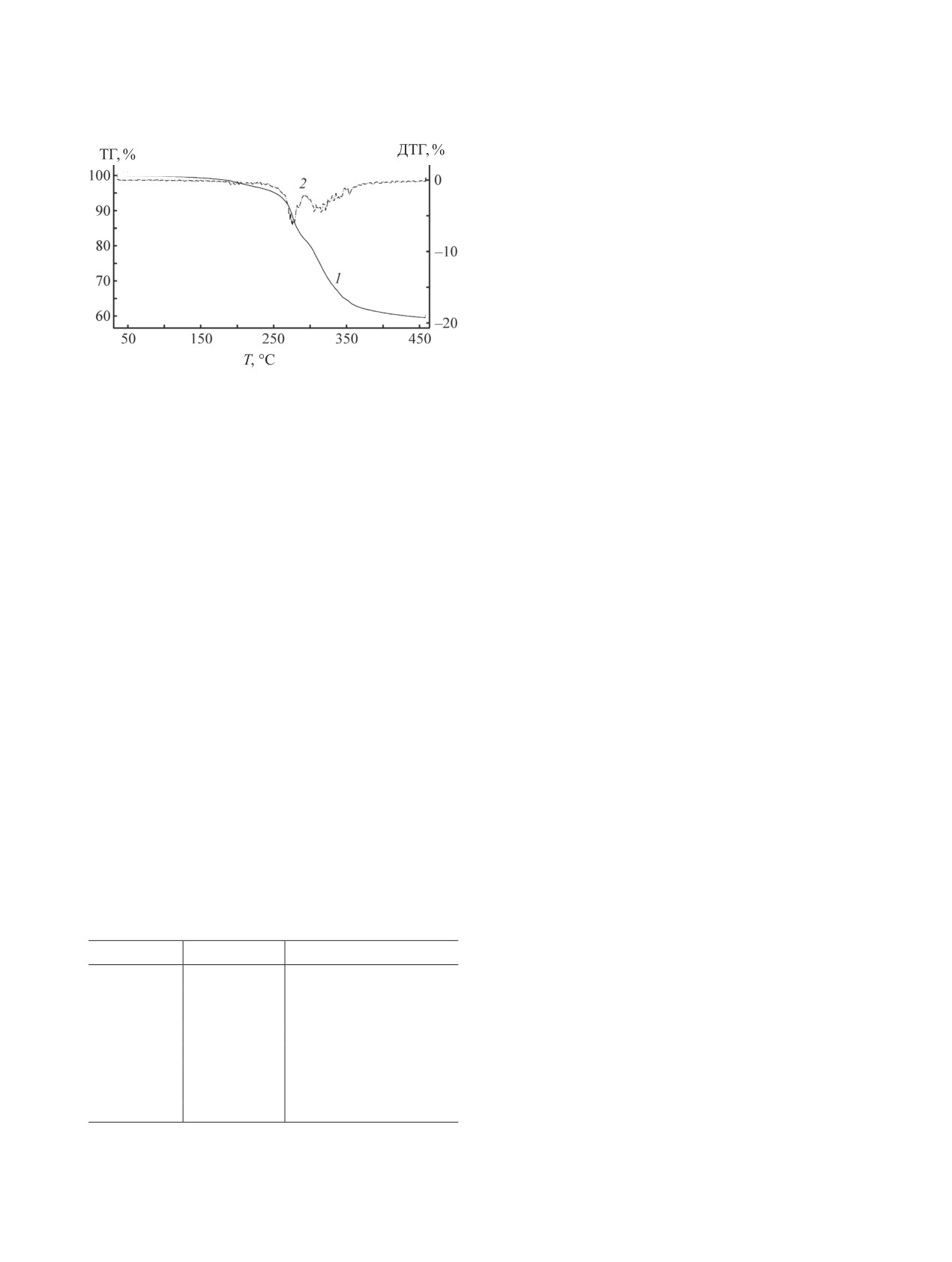
Рис. 1. Термогравиграмма комплекса 1. 1
- ТГ,
санами 5 и 6 в присутствии платиновых катали-
2 - ДТГ.
заторов 1-4 протекает по известному механизму
Чока-Харрода [19, 25]. Данный механизм включа-
ет последовательные стадии окислительного при-
На примере комплекса 1 показано, что темпера-
соединения кремнийгидрида к комплексу металла
тура начала его разложения равна примерно 150°C
платиновой группы ([M]), координации алкена,
внедрения алкена по связи [M]-H и последующего
(рис. 1). В связи с этим температура вулканизации
не должна превышать указанное значение.
восстановительного элиминирования. По всей ви-
димости, комплекс 4 из-за стерических факторов
Обнаружено, что природа комплексов 1-3, а
затрудняет подход алкена к координационному
именно наличие
4-пиколинового, хинолиново-
центру, что и приводит к относительному умень-
го и изохинолинового заместителей в структуре
шению каталитической активности комплекса 4
(схема 1), практически не влияет на их каталитиче-
по сравнению с комплексом 1. Другой возможной
скую активность в изученной полисилоксановой
причиной этого является то, что пиперидинзаме-
системе. Так, время вулканизации (время, за ко-
щенный мочевиновый фрагмент в комплексе 4 об-
торое жидкие полисилоксаны 5 и 6 превращаются
ладает бóльшей способностью при определенных
в твердый сшитый продукт 7) равно одному часу
условиях разлагаться с образованием изоцианата и
независимо от типа используемого катализатора
амина [23, 24].
1-3, при концентрации последних 1×10-3 моль/л.
Таким образом, изученные C,N-хелатные де-
Уменьшение концентрации комплексов 1-3 до
протонированные диаминокарбеновые комплексы
1×10-4 моль/л увеличивает время вулканизации до
платины(II) 1-4 являются катализаторами реакции
2 ч (с учетом погрешности измерения, равной при-
гидросилилирования между винилтерминиро-
мерно 10%) (табл. 1).
ванным фенилсодержащим и гидридсодержащим
полисилоксанами, которые позволяют получать
Таблица 1. Каталитическая активность комплексов 1-4
прозрачные однородные (без дефектов, трещин и
при вулканизации полисилоксанов 5 и 6 по реакции ги-
т. п.) фенилсодержащие силиконовые резины при
дросилилирования (T 100°C)
температуре 100°C, не требуют использования ин-
Катализатор
скат, моль/л
Время вулканизации, ч
гибиторов и особых условий при хранении.
1
1×10-3
1.0
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1×10-4
2.2
2
1×10-3
1.0
Комплексы 1-3 были получены согласно лите-
1×10-4
1.9
ратурной методике [22]. Полисилоксаны 5 (16%
3
1×10-3
1.0
дифенилсилоксановых звеньев, содержание ви-
1×10-4
2.0
нильных групп - 7.6×10-4 моль/г, среднечисленная
4
1×10-3
2.5
молекулярная масса - 9300) и 6 (вязкость - 25-
-4
1×10
3.5
35 сСт, содержание гидридных групп
-
3.5×
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022
ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
125
10-3 моль/г) были получены из коммерческих
стеклянной палочки. После этого смесь сушили
источников (Sigma-Aldrich) и использовались без
в вакууме при комнатной температуре в течение
дополнительной очистки. Дихлорметан был очи-
12 ч, чтобы избавиться от растворителя. Компонент
щен в соответствии с литературной методикой [26]
Б: готовили смесь полисилоксанов 5 и 6. Соотно-
перед использованием.
шение полимеров в компоненте Б были расчитаны
таким образом, чтобы соотношение гидридных
Спектры ЯМР 1H, 13C и 195Pt были сняты на
и винильных групп составило 3:1 в конечной ре-
приборе Bruker AVANCE III 400 при комнатной
температуре на частотах 400, 101 и 86 МГц соот-
акционной смеси. Для проведения вулканизации
0.5 мл компонента А помещали в алюминиевую
ветственно; растворитель - CDCl3. Инфракрасные
форму, добавляли 0.5 мл компонента Б и затем
спектры (4000-400 см-1) были сняты на приборе
активно перемешивали стеклянной палочкой в те-
Shimadzu FTIR 8400S в таблетках KBr. Масс-спек-
чение 30 с. После этого алюминиевую форму по-
тры высокого разрешения (HRESIMS) были сня-
ты на приборе Bruker Maxis HRMS-ESI-qTOF
мещали в термостат, заранее разогретый до 100°C.
Каждые 10-15 мин проводили проверку состояния
(ионизация электроспреем). Указан наиболее ин-
реакционной смеси. Время вулканизации опреде-
тенсивный сигнал в изотопном распределении.
ляли как время между смешиванием компонентов
Термогравиметрический анализ комплекса 1 был
и получением готовой силиконовой резины. Изме-
проведен на приборе Netzsch TG 209 F1 Libra.
Образец предварительно сушили в вакууме при
рения проводились по методике dry-to-touch в со-
ответствии со стандартом ASTM D1640 [27].
50°C, затем нагревали от 40 до 450°C со скоростью
10 K/мин. Образец обдували током сухого аргона
ИНФОРМАЦИЯ ОБ АВТОРАХ
со скоростью 10 мл/мин.
Синтез комплекса
4.
Триэтаноламин
Добрынин Михаил Валерьевич, ORCID: https://
(0.36 ммоль, 0.048 мл) добавляли к смеси мочевины
orcid.org/0000-0002-6041-4104
9 (0.30 ммоль, 66 мг) и раствора cis-[PtCl2(CNXyl)2]
Касаткина Светлана Олеговна, ORCID: https://
(комплекс 8) (0.30 ммоль, 160 мг) в хлороформе
orcid.org/0000-0002-7943-7525
(5 мл). Смесь перемешивали при 35°C в течение
Байков Сергей Валентинович, ORCID: https://
3 сут, затем фильтровали и упаривали досуха при
orcid.org/0000-0002-8912-5816
45°C в вакууме. Выход 93% (198 мг), белый по-
Антонов Никита Сергеевич, ORCID: https://
рошок. ИК спектр, ν, см-1: 2196 с (C≡N), 1695 с
orcid.org/0000-0001-5161-9098
(C=O), 1609 с (C=N). Спектр ЯМР 1H, δ, м. д.: 9.12
Михердов Александр Сергеевич, ORCID:
д (1H, J 6.4 Гц), 7.13 т (1H, J 7.6 Гц), 6.99 д (2H,
J 7.6 Гц), 6.82-6.70 м (3H), 6.64 д (1H, J 7.6 Гц),
6.15 т (1H, J 7.6 Гц), 4.21-4.12 м (1H), 3.76-3.68
Боярский Вадим Павлович, ORCID: https://
м (1H), 3.46-3.36 м (2H), 2.42 с (3H), 2.27 с (6H),
orcid.org/0000-0002-6038-0872
2.23 д (6H, J 2.8 Гц), 1.86-1.37 м (6H). Спектр ЯМР
Исламова Регина Маратовна, ORCID: https://
13С, δС, м. д.: 156.91, 153.88, 152.61, 150.93, 149.10,
orcid.org/0000-0003-1180-6539
145.26, 134.40, 128.80, 128.73, 127.77, 127.33,
127.22, 123.01, 116.69, 107.85, 48.00, 44.91, 26.88,
ФИНАНСОВАЯ ПОДДЕРЖКА
25.68, 24.25, 21.94, 19.57, 19.42, 18.41. Спектр ЯМР
Работа выполнена при финансовой поддержке
195Pt: δPt -3808.96 м. д. Масс-спектр (ESI), m/z:
Российского фонда фундаментальных исследо-
675.2395 [M - Cl]+ (вычислено для C30H34ClN5OPt:
ваний (проект № 19-33-90130) с использованием
675.2406).
оборудования ресурсных центров Санкт-Петер-
Вулканизация. Готовили двухкомпонентную
бургского государственного университета «Нано-
систему А и Б. Компонент А: расчетное количе-
технологии», «Магнитно-резонансные методы ис-
ство катализатора 1-4, растворенного в CH2Cl2
следования», «Методы анализа состава вещества»,
(≈0.5 мл), добавляли к полисилоксану 5. Далее
«Термогравиметрические и калориметрические
смесь перемешивали в течение 5 мин с помощью
методы исследования».
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022
126
ДОБРЫНИН и др.
КОНФЛИКТ ИНТЕРЕСОВ
15.
Islamova R.M., Dobrynin M.V., Vlasov A.V., Eremi-
na A.A., Kinzhalov M.A., Kolesnikov I.E., Zolota-
Боярский В.П. является членом редколлегии
rev A.A., Masloborodova E.A., Luzyanin K.V. // Catal.
Журнала общей химии. Остальные авторы заявля-
Sci. Technol. 2017. Vol. 7. P. 5843. doi 10.1039/
ют об отсутствии конфликта интересов.
C7CY02013A
СПИСОК ЛИТЕРАТУРЫ
16.
Islamova R.M., Dobrynin M.V., Ivanov D.M.,
Vlasov A.V., Kaganova E.V., Grigoryan G.V., Kukush-
1.
Moretto H.-H., Schulze M., Wagner G. // Silicones,
kin V.Y. // Molecules. 2016. Vol. 21. P. 311. doi 10.3390/
Ullmann’s Encycl. Ind. Chem. Weinheim: Wiley-
molecules21030311
VCH Verlag GmbH & Co. KGaA, 2000. doi
17.
Исламова Р.М., Власов А.В., Добрынин М.В., Мас-
10.1002/14356007.a24_057
лобородова Э.А., Каганова Е.В. // ЖОХ. 2015. Т. 85.
2.
Park S., Mondal K., Treadway R.M., Kumar V.,
Ma S., Holbery J.D., Dickey M.D. // ACS Appl. Mater.
C. 1868; Islamova R.M., Vlasov A.V., Dobrynin M.V.,
Interfaces. 2018. Vol. 10. P. 11261. doi 10.1021/
Masloborodova E.A., Kaganova E.V. // Russ. J.
acsami.7b18394
Gen. Chem. 2015. Vol. 85. Р. 2609. doi 10.1134/
3.
Brook M. // Biomaterials. 2006. Vol. 27. P. 3274. doi
S1070363215110171
10.1016/j.biomaterials.2006.01.027
18.
Shit S.C., Shah P. // Natl. Acad. Sci. Lett. 2013. Vol. 36
4.
Eduok U., Faye O., Szpunar J. // Prog. Org.
P. 355. doi 10.1007/s40009-013-0150-2
Coatings. 2017. Vol. 111. P. 124. doi 10.1016/j.
19.
Marciniec B. Hydrosilylation. Amsterdam: Springer,
porgcoat.2017.05.012
2009. P. 176. doi 10.1007/978-1-4020-8172-9
5.
Grassie N., Francey K.F., Macfarlane I.G. // Polym.
Degrad. Stab. 1980. Vol. 2. P. 67. doi 10.1016/0141-
20.
Lewis L.N., Stein J., Colborn R.E., Gao Y., Dong J. //
3910(80)90016-6
J. Organomet. Chem. 1996. Vol. 521. P. 221. doi
6.
Hamdani S., Longuet C., Perrin D., Lopez-cuesta J.-M.,
10.1016/0022-328x(96)06247-x
Ganachaud F. // Polym. Degrad. Stab. 2009. Vol. 94.
21.
Afanasenko A.M., Chulkova T.G., Boyarskaya I.A.,
P. 465. doi 10.1016/j.polymdegradstab.2008.11.019
Islamova R.M., Legin A.A., Keppler B.K., Seliva-
7.
Li R., Zhang B.T., Liu B.L., Chen X.N., Wang G.Y. //
nov S.I., Vereshchagin A.N., Elinson M.N., Haukka M. //
Adv. Mater. Res. 2012. Vol. 496. P. 109. doi 10.4028/
J. Organomet. Chem. 2020. Vol. 923. P. 121435. doi
10.1016/j.jorganchem.2020.121435
8.
Peng D., Mu Q.H., Zhang S., Li J.H., Wang F. // Mater.
Sci. Forum. 2018. Vol. 926. P. 39. doi 10.4028/www.
22.
Dobrynin M.V., Kasatkina S.O., Baykov S.V.,
scientific.net/MSF.926.39
Savko P.Yu., Antonov A., Mikherdov A.S., Boyarskiy
9.
Aksüt D., Demeter M., Vancea C., Şen M. // Radiat.
V.P., Islamova R.M. // Dalton Trans. 2021. doi 10.1039/
Phys. Chem. 2019. Vol. 158. P. 87. doi 10.1016/j.
D1DT02823E
radphyschem.2019.01.024
23.
Hutchby M., Houlden C.E., Ford J.G., Tyler S.N.G.,
10.
Labouriau A., Robison T., Shonrock C., Simmonds S.,
Gagné M.R., Lloyd-Jones G.C., Booker-Milburn K.I. //
Cox B., Pacheco A., Cady C. // Radiat. Phys.
Angew. Chemie Int. Ed. 2009. Vol. 48. P. 8721. doi
Chem. 2018. Vol. 144. P. 288. doi 10.1016/j.
10.1002/anie.200904435
radphyschem.2017.08.027
11.
Wu S., Zhang S., Akram R., Yasir A., Wang B., Han Z.,
24.
Kasatkina S.O., Geyl K.K., Baykov S.V., Boyar-
Wu Z., Wu D. // High Perform. Polym. 2019. Vol. 31.
skaya I.A., Boyarskiy V.P. // Org. Biomol. Chem. 2021.
P. 1112. doi 10.1177/0954008318824861
Vol. 19. P. 6059. doi 10.1039/D1OB00783A
12.
Wang D., Klein J., Mejía E. // Asian J. 2017. Vol. 12.
25.
Meister T.K., Riener K., Gigler P., Stohrer J., Herr-
P. 1180. doi 10.1002/asia.201700304
mann W.A., Kühn F.E. // ACS Catal. 2016. Vol. 6.
13.
Dobrynin M.V., Sokolova E.V., Kinzhalov M.A., Smir-
P. 1274. doi 10.1021/acscatal.5b02624
nov A.S., Starova G.L., Kukushkin V.Y., Islamova R.M. //
26.
Armarego W.L.F., Chai C.L.L. Purification of laboratory
ACS Appl. Polymer Mater. 2021. Vol. 3. P. 857. doi
chemicals. Waltham: Elsevier, 2013. P. 141.
10.1021/acsapm.0c01190
27.
Handbook G., Koleske J.V. Paint and Coating Testing
14.
Dobrynin M.V., Pretorius C., Dumisani K., Roodt A.,
Boyarskiy V.P., Islamova R.M. // J. Catal. 2019. Vol.
Manual. Bridgeport: ASTM International, 2012. P. 529.
372. P. 193. doi 10.1016/j.jcat.2019.03.004
doi 10.1520/MNL17-2ND-EB
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022
ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
127
Cyclometallated Platinum(II) Complexes
for Obtaining Phenyl-Containing Silicone Rubbers
via Catalytic Hydrosilylation Reaction
M. V. Dobrynin, S. O. Kasatkina, S. V. Baykov, P. Yu. Savko, N. S. Antonov,
A. S. Mikherdov, V. P. Boyarskiy, and R. M. Islamova*
St. Petersburg State University, Saint Petersburg, 199034 Russia
*e-mail: r.islamova@spbu.ru
Received September 8, 2021; revised October 28, 2021; accepted October 31, 2021
C,N-Chelate deprotonated diaminecarbene platinum(II) complexes were studied as polysiloxane system hydro-
silylation catalysts. Phenyl-containing silicone rubbers were obtained.
Keywords: cyclometallated platinum(II) complexes, polysiloxanes, hydrosilylation, phenyl-containing silicone
rubbers
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 1 2022