ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 11, с. 1655-1667
УДК 544.43:547-39:(543.429.23+544.18)
ИЗУЧЕНИЕ ВЛИЯНИЯ N-ВИНИЛПИРРОЛИДОНА НА
РАСПАД ПЕРОКСИДА БЕНЗОИЛА
© 2022 г. Т. Г. Тюринаa,*, О. М. Заречнаяa
a Институт физико-органической химии и углехимии имени Л. М. Литвиненко,
ул. Р. Люксембург 70, Донецк, 283114 Россия
*e-mail: t_tiurina@mail.ru
Поступило в редакцию 12 июля 2022 г.
После доработки 23 августа 2022 г.
Принято к печати 25 августа 2022 г.
Методом спектроскопии ЯМР 1Н изучен распад пероксида бензоила в растворе или массе N-винилпир-
ролидона, его смесях с малеиновым ангидридом и/или метилметакрилатом. Обнаружено, что константы
скорости распада пероксида изменяются от 10-3 с-1 для смеси N-винилпирролидона с малеиновым анги-
дридом (1:1, 313 K) до 10-4 с-1 для смеси с метилметакрилатом (1:1, 333 K). Энергия активации распада
пероксида бензоила в N-винилпирролидоне составила 75.5±6.8 кДж/моль. Предложены возможные
реакции взаимодействия N-винилпирролидона с бензоатным радикалом, на уровне ωB97x-V/def2-TZVP
оценены их термохимические характеристики.
Ключевые слова: пероксид бензоила, N-винилпирролидон, спектроскопия ЯМР, квантово-химические
расчеты
DOI: 10.31857/S0044460X22110014, EDN: LNBQDB
Изучение распада пероксида бензоила, начатое
пероксида бензоила чаще всего связывают с ме-
в 50-х годах ХХ века, продолжается до настояще-
ханизмом индуцированного распада, при котором
го времени. Такая ситуация обусловлена широким
радикалы, образующиеся в мономолекулярной
применением пероксида бензоила как инициатора
реакции гомолитического разрыва пероксидной
в промышленных процессах, а также возможно-
связи, реагируют с молекулами растворителя или
стью создания инициирующих систем на его ос-
мономера.
нове, позволяющих ускорять распад пероксидной
Полимеризация N-винилпирролидона, содер-
связи и снижать температуру полимеризационных
жащего азот в лактамном цикле, в присутствии
процессов [1-3].
пероксида бензоила практически не изучалась,
Ранее в ряде работ, например [1, 4], были пред-
так как полагалось, что в протонных растворите-
ставлены результаты, показывающие, что низко-
лях, используемых для получения поли-N-винил-
температурное (278-308 K) инициирование перок-
пирролидона, могут протекать побочные реак-
сидами характерно для гомо- и сополимеризации
ции образования бензойной кислоты и гидролиза
азотсодержащих виниловых мономеров. Факты
N-винилпирролидона [6]. Этот полимер весьма
специфического увеличения скорости распада
перспективен в качестве носителя в фармацевтике
в присутствии некоторых мономеров привели к
[7], но его молекулярная масса и разветвленность
появлению гипотезы о распаде комплексно-свя-
цепей существенно зависят от условий синтеза
занных молекул инициатора, что в ряде случаев
[8]. В работе [9] показана возможность получения
подтверждено методом спектроскопии ЭПР [5]. В
поли-N-винилпирролидона при использовании пе-
то же время влияние среды на кинетику термолиза
роксида бензоила в качестве инициатора в отсут-
1655
1656
ТЮРИНА, ЗАРЕЧНАЯ
[10] при ~ 353 K привела к следующим результа-
там. Величина kd в среде ацетонитрила в данном
эксперименте составила (7.3±0.2)×10-6 с-1. Это
значение в 2.4 раза меньше, чем опубликованное
ранее (1.76×10-5 с-1) [11], и в 2.6 раза больше,
чем рассчитанное по данным работы [2] (2.8×
10-6 с-1), что можно считать удовлетворительным
совпадением. В растворе, содержащем 2.6 моль/л
N-метилпирролидона, величина kd ≈ 10-4 с-1 в
14 раз больше, чем в чистом ацетонитриле, что
свидетельствует о существенном ускорении рас-
пада пероксида в присутствии насыщенного со-
единения с лактамным циклом. При введении в
раствор пероксида 2.2 моль/л N-винилпирроли-
дона, имеющего лактамный цикл и винильную
группу, активный распад пероксида бензоила про-
ходит уже во время подготовки к анализу при тем-
пературе 298-303 K. По титрованию пробы в этих
условиях найдено, что kd составляет ~ 1.4×10-4
с-1, тогда как в ацетонитриле при 303 K kd равна
1.76×10-8 с-1 [2]. Таким образом, вследствие высо-
кой скорости распада пероксида бензоила в среде
N-винилпирролидона метод иодометрии оказался
непригодным. Для исследования данной системы
мы использовали метод ЯМР 1Н спектроскопии,
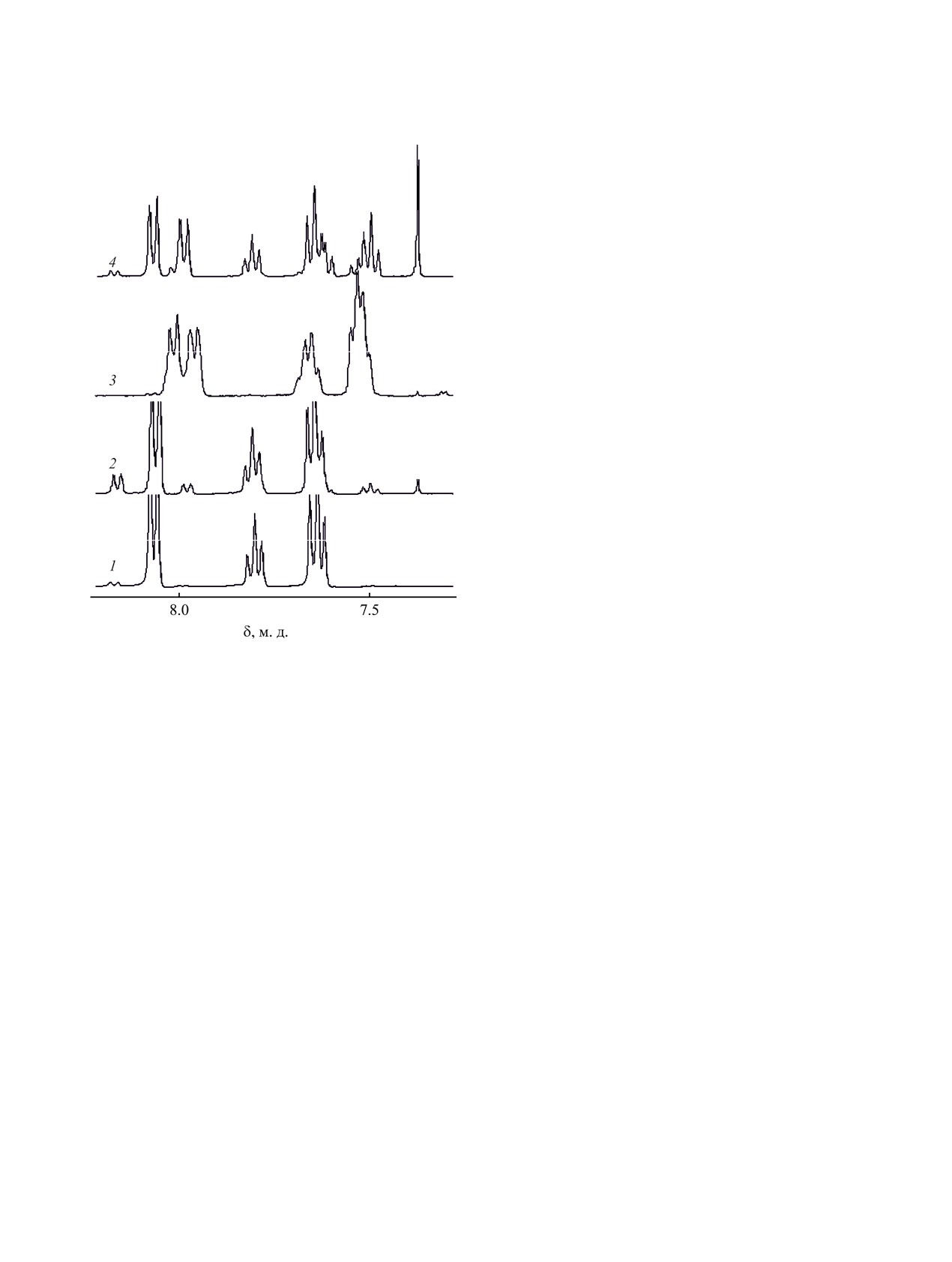
Рис. 1. Спектр ЯМР 1Н пероксида бензоила (0.1 моль/л)
в ацетонитриле: исходный раствор (1); через 100 мин
применявшийся ранее для сравнительного анализа
выдержки при 333 K (2-4). Добавки: 2 моль/л N-винил-
продуктов разложения диацилпероксидов под дей-
пирролидона (3), 2 моль/л N-метилпирролидона (4).
ствием СВЧ-излучения и температуры [12].
В спектре анализируемой пробы молекула
N-винилпирролидона характеризуется 5 мульти-
ствие растворителя. Нами в аналогичных условиях
плетами в области от 7.1 до 2.0 м. д., группа СН3
были получены (со)полимеры N-винилпирролидо-
ацетонитрила представлена синглетом с центром
на. При этом вопрос о том, каким образом протека-
при 2.029 м. д., тогда как сигналы орто-, пара- и
ет распад пероксида в присутствии N-винилпирро-
мета-протонов пероксида бензоила регистриру-
лидона, нельзя считать вполне выясненным.
ются при 8.066, 7.826, 7.661 м. д. (растворитель -
Цель работы состоит в исследовании экспери-
ДМСО-d6). Таким образом, сигналы пероксида
ментальными и теоретическими методами про-
бензоила не перекрываются сигналами N-винил-
цесса распада пероксида бензоила в N-винилпир-
пирролидона и ацетонитрила, что позволяет выя-
ролидоне и в его смесях с другими мономерами, а
вить их в исследуемых смесях.
также специфических особенностей полимериза-
Первоначально было рассмотрено протека-
ции N-винилпирролидона, инициируемой перок-
ние процесса распада пероксида бензоила в аце-
сидом бензоила.
тонитриле. В ходе прогрева бесцветный раствор
Попытка определить величины константы рас-
приобретал слабо-желтое окрашивание, которое
пада пероксида бензоила (kd) в ацетонитриле с
несколько усиливалось во времени, что может ука-
добавками N-винилпирролидона или N-метилпир-
зывать на образование ненасыщенных продуктов с
ролидона, насыщенного аналога N-винилпирро-
атомом N при кратной связи. При этом на протяже-
лидона, распространенным методом иодометрии
нии 10 ч вид спектров в области 8.2-7.6 м. д. (рис. 1)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
ИЗУЧЕНИЕ ВЛИЯНИЯ N-ВИНИЛПИРРОЛИДОНА
1657
Таблица 1. Величина интегральной интенсивности сигналов протонов пероксида бензоила и продуктов его распада
в различных средаха
Интегральная интенсивность сигналов в области δ, м. д.
Время,
пероксид бензоила
продукты (бензоаты)
бензол
мин
8.12-8.04
7.86-7.77
7.71-7.60
8.04-7.90
7.71-7.60б
7.58-7.46
7.42-7.33
(орто-Н)
(пара-Н)
(мета-Н)
Раствор 0.1 моль/л пероксида бензоила в ацетонитриле (333 K)
0
0.368
0.207
0.425
-
-
-
-
100
0.369
0.202
0.411
-
-
-
0.013
360
0.384
0.196
0.395
-
-
-
0.035
600
0.372
0.190
0.381
-
-
-
0.052
Раствор 0.1 моль/л пероксида бензоила в ацетонитриле + 2 моль/л N-метилпирролидона (333 K)
0
0.392
0.202
0.407
100
0.181
0.099
0.166
0.279
0.171
0.091
150
0.127
0.069
0.208
0.244
0.217
0.108
210
0.122
0.063
0.241
0.244
0.247
0.125
Раствор 0.1 моль/л пероксида бензоила в ацетонитриле + 2 моль/л N-винилпирролидона (333 K)
0
0.414
0.202
0.383
-
60
0.015
0.008
0.385
0.203
0.390
-
100
0.006
0.003
0.405
0.205
0.411
-
210
0
0
0.392
0.185
0.397
-
Раствор 0.1 моль/л пероксида бензоила в N-винилпирролидоне (313 K)
0
0.386
0.204
0.406
20
0.232
0.103
0.192
0.296
0.199
40
0.117
0.064
0.270
0.253
0.292
60
0.067
0.039
0.338
0.241
0.358
80
0.033
0.021
0.349
0.221
0.381
Раствор 0.1 моль/л пероксида бензоила в N-винилпирролидоне (333 K)
0
0.386
0.204
0.406
5
0.061
0.036
0.349
0.246
0.372
15
0.025
0.014
0.389
0.226
0.422
25
0.010
0.005
0.372
0.201
0.380
45
0.005
0.002
0.373
0.197
0.393
Раствор 0.01 моль/л пероксида бензоила в смеси N-винилпирролидон:метилметакрилат 1:1 (333 K)
0
0.375
0.202
0.424
21
0.343
0.176
0.394
0.088
33
0.298
0.175
0.052
0.357
0.119
51
0.308
0.154
0.019
0.373
0.145
71
0.293
0.146
0.018
0.355
0.138
а Сумма интенсивностей сигналов пероксида бензоила приведена к 1.
б Суммарная интенсивность сигналов 7.71-7.60 (пероксид бензоила) и 7.74-7.60 м. д. (продукты распада).
не изменялся, а интенсивность сигналов пара-Н
[13], интенсивность которого возрастала со време-
пероксида бензоила уменьшалась примерно на 4,
нем прогрева (рис. 1, табл. 1).
7 и 10% за 1.7, 6 и 10 ч (табл. 1). Единственным
Из этих результатов следует, что в растворе
новым сигналом в спектрах этих растворов был
соответствующий бензолу синглет при 7.37 м. д.
ацетонитрила распад пероксида бензоила (1) со-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
1658
ТЮРИНА, ЗАРЕЧНАЯ
провождается выделением СО2 (2) и образованием
акции снижается медленнее, чем сигналов орто-
радикала ацетонитрила за счет отрыва фенильным
и пара-Н (табл. 1) и удовлетворительно соответ-
радикалом атома водорода от молекулы раствори-
ствует сумме удвоенной интенсивности сигнала
теля (3):
пара-Н пероксида бензоила при 7.87-7.78 м. д. и
половине интенсивности сигнала при
8.04-
(С6Н5СОО)2 → 2 С6Н5СОО•,
(1)
7.91 м. д. Таким образом, сигналы при 8.04-7.91 и
С6Н5СОО• → С6Н5• + СО2,
(2)
7.60-7.47 м. д. соответствуют орто- и мета-про-
тонам бензоатных остатков, а мультиплет при
С6Н5• + СН3СN → С6Н6 + •СН2СN.
(3)
7.71-7.60 м. д. является неразделенной суммой
Протекание реакции (3) вполне вероятно, так
сигналов мета-протонов пероксида бензоила и
как ранее [14, 15] на примере радикала адамантана
пара-протонов образовавшегося бензоата, что под-
было показано, что в растворе ацетонитрила осу-
тверждается сопоставлением со спектрами эфиров
ществляется отрыв атома водорода от молекулы
бензойной кислоты [17].
растворителя или присоединение к ней этого ра-
Из сравнения результатов распада пероксида
дикала, причем скорость отрыва в 4 раза больше.
бензоила в ацетонитриле без добавок и с добав-
Учитывая, что продукты, полученные при участии
кой N-метилпирролидона (рис. 1, 2 и 4) следует,
радикала ацетонитрила, предположительно имеют
что за одинаковое время нагрева в смеси с N-ме-
кратные связи, можно представить их образование
тилпирролидоном происходит существенное сни-
следующей реакцией (4).
жение интенсивности сигналов протонов перок-
2•СН2СN + СН3СN → СН3-С(СН2СN)=N-СН2СN. (4)
сида бензоила и образование намного большего
количества бензола (синглет при 7.42-7.33 м. д.),
Безусловно, реакция (4) не доказана экспери-
интенсивность сигнала которого составила
1.3
ментально, однако представляется весьма вероят-
и 9.2% от общей интенсивности сигналов при
ной. Так, сигналы протонов образующегося в ней
8.2-7.3 м. д. без и в присутствии N-метилпирро-
нитрила, согласно инкрементам заместителей [16],
лидона соответственно (100 мин нагрева). Уста-
должны находиться примерно при ~ 4.4 (NСН2),
новлено, что на протяжении 210 мин соотношение
~ 3.4 (С-СН2) и ~ 2.3 м. д. (СН3). Действительно,
количества образовавшихся бензоатов и бензола в
в спектре раствора после 10 ч распада обнаружи-
смеси с N-метилпирролидоном оставалось посто-
вается сигнал при 4.28 м. д. с интенсивностью,
янным и равным 3, что соответствует протеканию
составляющей 1/7 от таковой для сигнала бензола
параллельных реакций присоединения бензоат-
(теоретически ожидаемое соотношение по реак-
ного радикала к молекуле добавки и его участию
циям (3) и (4) 1:6). Два других сигнала продукта
в реакциях образования бензола подобно реак-
реакции (4) не могут быть видны, поскольку в со-
циям (2)-(3), как показано на схеме 1.
ответствующей области спектра находятся интен-
сивные сигналы протонов воды из ДМСО-d6 и
Возможность образования радикала N-метил-
СН3-группы ацетонитрила.
пирролидона обусловлена характерной для N-за-
мещенных пирролидонов лабильностью связей
При сопоставлении спектров реакционных
C-H в α-положении к гетероатому или карбонилу
смесей с добавками N-винилпирролидона и N-ме-
[18, 19], которая должна быть присуща также и
тилпирролидона, выдержанных при 333 K, обна-
ружено, что интенсивность мультиплетов орто- и
N-винилпирролидону. Такой путь передачи цепи
пара-протонов пероксида бензоила снижается в
на этот мономер с созданием центров разветвле-
ходе распада при соблюдении их соотношения
ния поли-N-винилпирролидона рассмотрен в ра-
~2:1 (табл. 1) и сохранении формы сигналов
боте [8].
(рис. 1, 2), вместе с тем наблюдается появление но-
В спектре реакционной смеси с 2 моль/л N-ви-
вых сигналов с δ 8.04-7.90 и 7.60-7.47 м. д., кото-
нилпирролидона в ацетонитриле после 100 мин
рые характеризуют продукты распада.
выдержки при 333 K сигналы исходного перокси-
Интенсивность сигнала при 7.71-7.60 м. д.
да бензоила отсутствуют (рис. 1, 3), поэтому рас-
(мета-Н исходного пероксида бензоила) в ходе ре-
пад в массе N-винилпирролидона изучали, сокра-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
ИЗУЧЕНИЕ ВЛИЯНИЯ N-ВИНИЛПИРРОЛИДОНА
1659
Схема 1.
Me
Me
PhCOO
N O
•
N O
PhCOO
+
Me
Me
N O
N O
C6H6 + CO2 +
•
•
тив время реакции, либо уменьшив температуру
спектрах реакционных смесей отсутствуют сигна-
до 313 K (рис. 2, табл. 1). Обнаружено, что при
лы кислотных (~12.5 м. д. для бензойной кислоты
333 K в ацетонитриле с добавкой 2 моль/л N-ви-
в ДМСО-d6) и фенильных протонов (~7.37 м. д.),
нилпирролидона и в массе N-винилпирролидона
т. е. в данных условиях в ходе распада пероксида
через 60 и 45 мин реакции интенсивность сигна-
лов орто- и пара-протонов пероксида бензоила
составляет ~4 и ~ 1% от исходной соответственно
(табл. 1), тогда как в смеси N-винилпирролидона с
метилметакрилатом (1:1, [N-винилпирролидон] ~
4.6 моль/л) за 51 мин реакции она снижается всего
на ~20%.
В смесях N-винилпирролидона с малеиновым
ангидридом, N-винилпирролидона с малеиновым
ангидридом и метилметакрилатом интенсивный
синглет малеинового ангидрида при ~7.46 м. д.
перекрывает малоинтенсивные сигналы пара-
и мета-протонов пероксида бензоила, однако
имеется возможность следить за концентрацией
орто-Н пероксида. Оказалось, что что в смеси
N-винилпирролидона с малеиновым ангидридом
уже через 52 мин выдержки при 313 K дублет
орто-Н пероксида не виден, но появляется муль-
типлет орто-Н бензоата при 8.00-7.95 м. д., тогда
как в трехкомпонентной смеси сигнал орто-Н об-
наруживается еще через 94 мин с начала реакции
(313 K). Таким образом, введение метилметакри-
лата в N-винилпирролидон существенно замедля-
ет распад пероксида бензоила, видимо, вследствие
увеличения вклада основного процесса роста цепи
и снижения вклада побочных реакций.
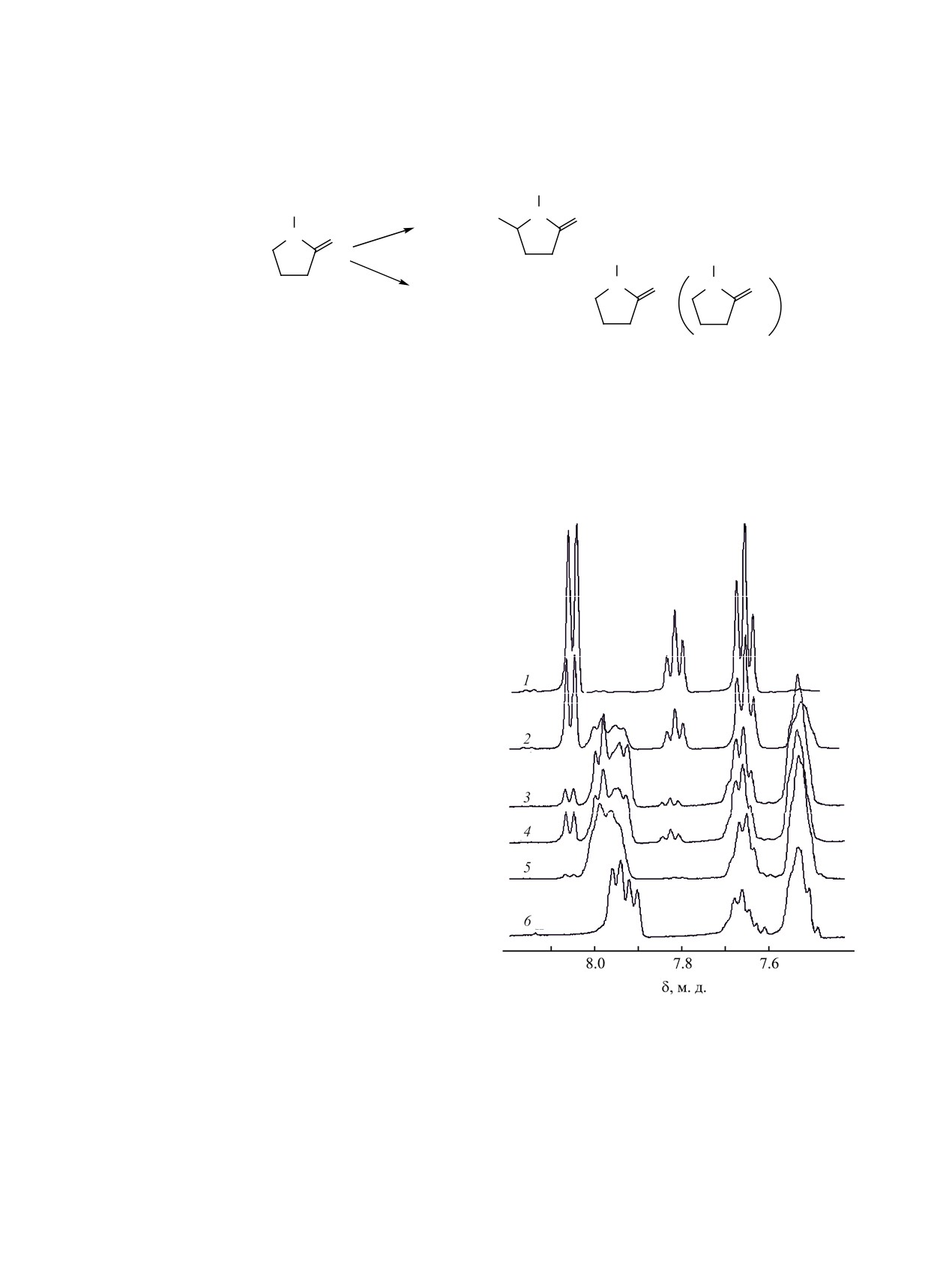
Рис. 2. Изменения в спектре ЯМР 1Н пероксида бен-
зоила (0.1 моль/л) в N-винилпирролидоне (1) после
Установлено, что при нормировке к 1 суммар-
нагревания при 313 K в течение 20 (2) и 80 мин (3), при
ная интенсивность сигналов в диапазоне 8.2-
333 K в течение 5 (4) и 25 мин (5). 6 - фрагмент спектра
7.4 м. д. для каждой серии опытов с участием N-ви-
поли-N-винилпирролидона, выделенного из смеси, вы-
нилпирролидона остается постоянной (в пределах
держанной при 313 K в течение 80 мин в присутствии
0.1 моль/л пероксида бензоила.
стандартной ошибки ее определения 5-10%). В
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
1660
ТЮРИНА, ЗАРЕЧНАЯ
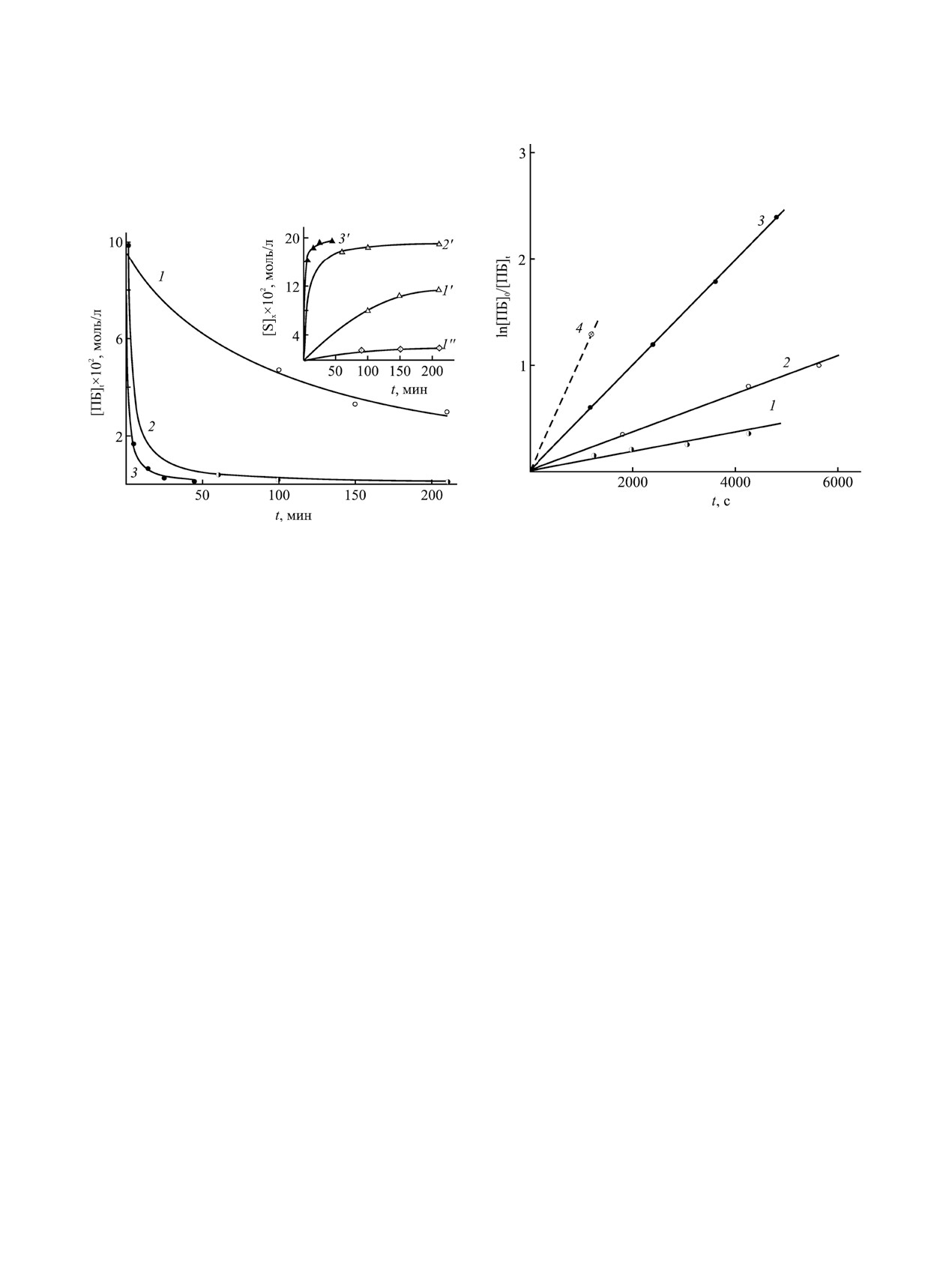
Рис. 4. Анаморфоза в полулогарифмических координа-
Рис. 3. Изменение концентрации пероксида бензоила в
тах кривых расходования пероксида бензоила в смеси
ацетонитриле, содержащем 2 моль/л N-метилпирроли-
N-винилпирролидон-метилметакрилат (50:50) при 333
дона (1) или N-винилпирролидона (2), а также в массе
K (1), N-винилпирролидон-малеиновый ангидрид-
N-винилпирролидона (3) и накопление (S) продуктов
метилметакрилат (45:45:10) (2), N-винилпирролидо-
распада: бензоатов (1′-3′) и бензола (1′′) в указанных
на (3) и N-винилпирролидон-малеиновый ангидрид
выше средах (1-3) при 333 K.
(50:50) (4) при 313 K.
выделения СО2 не происходит, и других продуктов
продуктов распада (рис. 3) рассчитывали, исполь-
распада пероксида, кроме бензоатов, не образует-
зуя начальную и текущую величину интегральной
ся. Это означает, что в процессе инициированной
интенсивности сигналов (I0, It) (табл. 1) только
пероксидом полимеризации N-винилпирролидона
орто- или суммы орто- и пара-Н пероксида при
или его сополимеризации с метилметакрилатом в
8.12-8.04 и 7.87-7.78 м. д., что приводит к практи-
массе рост макромолекулярной цепи начинается с
чески одинаковому результату.
реакций присоединения мономеров к бензоатным
Константу скорости распада пероксида бен-
радикалам. Действительно, в спектрах смесей,
зоила (kd) определяли по зависимости lnI0/It ≡
содержащих пероксид бензоила и N-винилпир-
ln[ПБ]0/[ПБ]t от продолжительности реакции, ко-
ролидон, сигналы бензоатных протонов имеют
торая является линейной (рис. 4), подтверждая,
сглаженную структуру, характерную для высоко-
что распад пероксида бензоила в изучаемых сре-
молекулярных продуктов, что особенно ярко про-
дах протекает как реакция первого порядка. Най-
является в отсутствие растворителя (рис. 2). Более
денная таким образом величина kd в ацетонитри-
того, три мультиплета в области 8.05-7.45 м. д.,
ле при 333 K составила 2.9×10-6 с-1 (табл. 2), что
аналогичные по положению, форме и соотноше-
хорошо согласуется с теоретически ожидаемым
нию интенсивностей, присутствуют в спектрах
значением, 2-3×10-6 с-1 (по данным публикаций
выделенного из этих смесей поли-N-винилпирро-
kd×106 = 0.018, 0.26 и 17.6 с-1 при 303, 323 [2] и
лидона (рис. 2).
343 K [11] соответственно). Это еще раз под-
Концентрацию пероксида бензоила при распа-
тверждает, что метод ЯМР можно применять для
де в различных средах [ПБ]t, а также содержание
контроля за количеством пероксида бензоила в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
ИЗУЧЕНИЕ ВЛИЯНИЯ N-ВИНИЛПИРРОЛИДОНА
1661
Таблица 2. Константы распада пероксида бензоила (kd) в растворителях, мономерах и их смесях
kd, c-1
Среда, в которой проводили распад пероксида бензоила
313 K
333 K
Aцетонитрил
8.5×10-8 а
(2.9±0.3)×10-6
2 моль/л N-метилпирролидона в ацетонитриле
(1.3±0.1)×10-4
2 моль/л N-винилпирролидона в ацетонитриле
4×10-3
N-Bинилпирролидон
(5±1)×10-4
6×10-3 б
N-Bинилпирролидон-малеиновый ангидрид, 50:50
1×10-3 б
-
N-Винилпирролидон-малеиновый ангидрид-метилметакрилат, 45:45:10
(1.79±0.08)×10-4
-
N-Винилпирролидон-метилметакрилат, 50:50
(0.81±0.08)×10-4
Метилметакрилат [16]
3.6×10-6
а Значение kd рассчитано по данным для 303, 323 [2] и 343 K [11].
б Оценка по одной точке.
процессе распада при условии, что сигналы про-
емо, так как величина kd в метилметакрилате не-
тонов среды полностью или частично не перекры-
значительно выше (на ~20%), чем в ацетонитриле
вают область 8.1-7.4 м. д.
(при 333 K). При введении 2 моль/л N-метилпир-
ролидона в ацетонитрил величина kd возрастает в
Определенные в среде N-винилпирролидона
при температурах от 298 до 323 K величины кон-
~40 раз, а такого же количества N-винилпирроли-
дона - на ~2 порядка по сравнению с ацетонитри-
стант распада пероксида бензоила (kd от 0.84×
10-4 до 1.15×10-3 с-1 соответственно) линеари-
лом (табл. 2), что свидетельствует как о возмож-
ности реакции радикалов пероксида бензоила с
зуются в координатах уравнения Аррениуса и
дают активационные параметры реакции: Ea 75.5±
лактамным кольцом N-метилпирролидона или
6.8 кДж/моль, lnA 21.1±2.6 (R2 0.976). Таким об-
N-винилпирролидона, так и активации винильной
разом, найденная величина энергии активации
группы, находящейся при атоме азота N-винил-
распада пероксида бензоила в массе N-винилпир-
пирролидона по сравнению с группой С-СН=СН2
ролидона примерно в 2 раза меньше, чем в ацето-
в составе традиционных виниловых мономеров.
нитриле (136±4 кДж/моль [2]).
Несмотря на то, что скорость распада перок-
Из величин констант распада (табл. 2) следует,
сида бензоила в N-винилпирролидоне намного
что с наименьшей скоростью распад пероксида
превышает таковую в среде других виниловых мо-
бензоила протекает в ацетонитриле, а с максималь-
номеров, образование поли-N-винилпирролидона
ной - в смеси N-винилпирролидона с малеиновым
при инициировании пероксидом бензоила проте-
ангидридом, что может быть связано с образовани-
кает с относительно малой скоростью - 10.1%/ч
ем в этой смеси радикальных частиц в отсутствие
(0.01 моль/л пероксида бензоила, 333 K), что в
инициатора, как было показано в работе [20]. Из-за
~5 раз меньше, чем в присутствии азобисизобу-
высокой скорости реакции определение константы
тиронитрила (51.9%/ч) в аналогичных условиях.
распада пероксида в смеси N-винилпирролидон-
Более того, скорость полимеризации N-винилпир-
малеиновый ангидрид (1:1) при 313 K оказалось
ролидона в присутствии пероксида бензоила сни-
затруднительным.
жается со временем (рис. 5).
Таким образом, введение малеинового анги-
Действительно, высокая скорость реакции
дрида в среду N-винилпирролидона (1:1) ускоряет
распада и образование большого количества пер-
распад пероксида бензоила примерно в 2 раза, тог-
вичных радикалов могут приводить к появлению
да как добавка 10 мол% метилметакрилата к этой
небольших цепей, участвующих далее в реакциях
смеси замедляет его в ~5 раз, что вполне ожида-
обрыва и передачи цепи. Это наиболее заметно
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
1662
ТЮРИНА, ЗАРЕЧНАЯ
ство ди- и олигомерных продуктов или продуктов
замещения по кольцу.
При уменьшении содержания пероксида бен-
зоила в смеси до 0.01 моль/л количество бен-
зоатных остатков в поли-N-винилпирролидоне
(~48 звеньев N-винилпирролидона/бензоат) при-
ближается к рассчитанному по конверсии N-винил-
пирролидона и концентрации пероксида бензоила
в реакционной среде (~33 звена N-винилпирроли-
дона/бензоат), хотя и в этом случае распад перок-
сида протекает с высокой скоростью: через 60 мин
(333 K) его присутствие в смеси не обнаруживается.
Отсутствие в реакционных смесях с N-винил-
пирролидоном следов бензойной кислоты или бен-
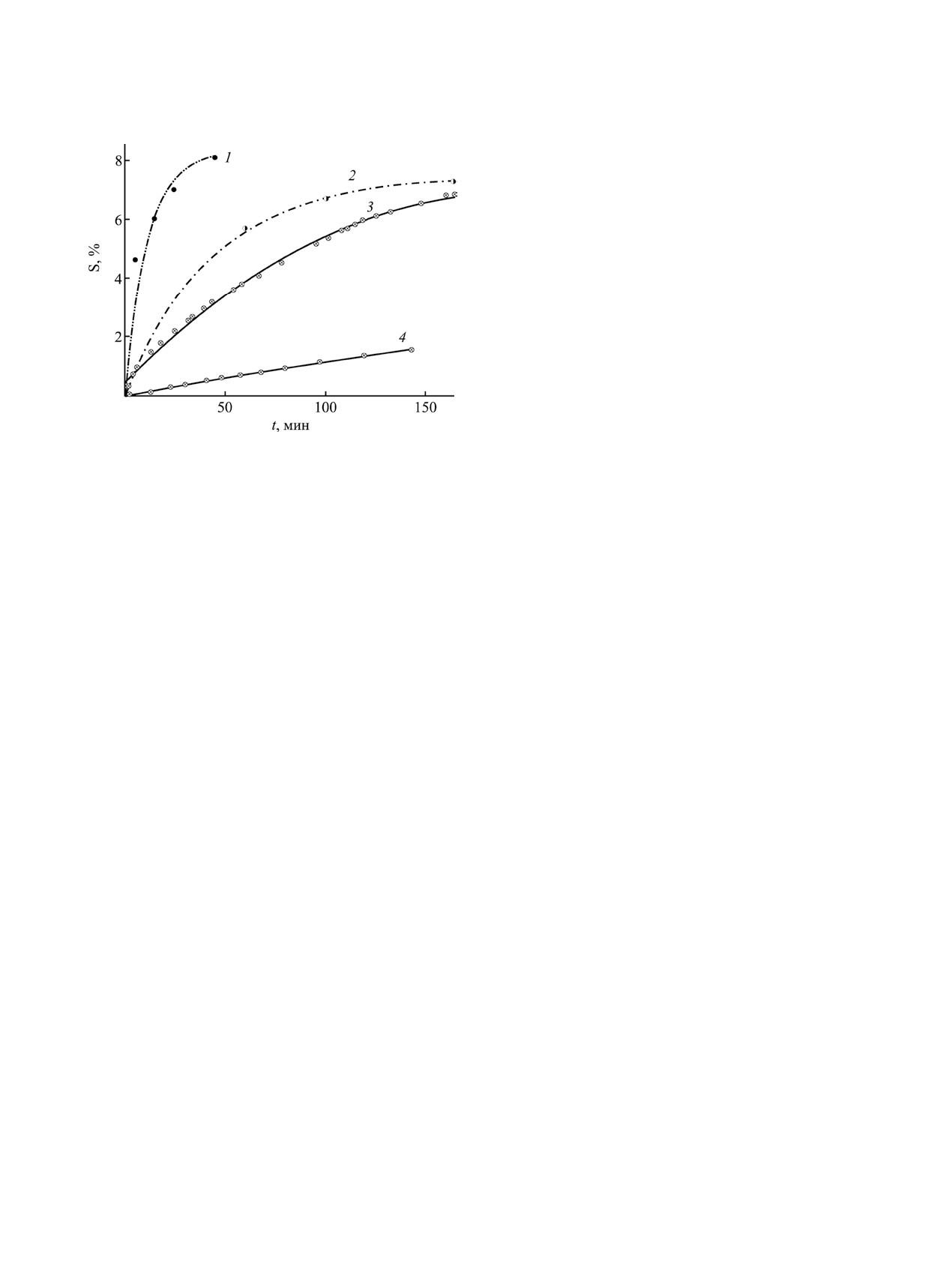
Рис. 5. Накопление поливинилпирролидона в течение
зола позволяет полагать, что бензоатные радика-
полимеризации при 333 (1-3) и 313 K (4) в присутствии
лы присоединяются к кольцу или группе двойной
0.1 (1), 0.01 (2, 3) и 0.001 (4) моль/л пероксида бензо-
связи N-винилпирролидона (1 или 2 бензоатных
ила. Контроль за конверсией осуществлялся методами
фрагмента на молекулу N-винилпирролидона). К
ЯМР (1, 2) и дилатометрии (3, 4).
сожалению, такие соединения невозможно иден-
тифицировать методом ЯМР 1Н на фоне суще-
ственного
(10-50-кратного) избытка мономера
должно проявляться при высокой концентрации
N-винилпирролидона относительно продуктов
пероксида бензоила, что подтверждает ход кривых
полимеризации (или замещения/присоединения)
накопления полимера на рис. 5.
вследствие близкого соответствия положения сиг-
Для проверки этого предположения был про-
налов протонов исходного, замещенного N-ви-
веден анализ содержания групп двойной связи
нилпирролидона и поли-N-винилпирролидона.
N-винилпирролидона в его смесях с пероксидом
В спектрах образцов полимеров, выделенных из
бензоила по данным ЯМР, который показал, что
этих смесей, имеются слабые уширенные сигналы
при высокой концентрации пероксида бензоила
с центрами при 6.45, 5.75 (5.47, 5.25) и 4.8 м. д.,
(0.1 моль/л) распад пероксида и полимеризация
которые могут быть отнесены к резонансу прото-
N-винилпирролидона идут со скоростями, обеспе-
нов в замещенных радикалом бензоата (R) группах
чивающими соотношение раскрытых двойных свя-
цикла N-СНR, СНR-С(=О) и С-СНR-С соответ-
зей N-винилпирролидона и бензоатных остатков
ственно со слабой интенсивностью до 5-6% от
звена N-винилпирролидона.
на уровне ~2 и 2.5-4 при 313 и 333 K (в растворе
2 моль/л N-винилпирролидона в ацетонитриле
В спектрах выделенных полимеров обнаружи-
это соотношение близко к 1). Вместе с тем в об-
вается также дублетный сигнал при 1.19, 1.18 (1.15,
разцах поли-N-винилпирролидона, выделенных
1.14) м. д., интенсивность которого составляет от
из указанных реакционных смесей, обнаружи-
1 до 3 мол% относительно звена поли-N-винил-
вается ~8 и ~13 звеньев N-винилпирролидона на
пирролидона. Это свидетельствует о присутствии
1 бензоатную группу соответственно, т. е. полиме-
примеси, содержащей группу -СНСН3. Таким со-
ры содержат в 3-4 раза меньше бензоатных остат-
единением может быть димер [20] или олигомер
ков, чем находилось в смеси. Масса выделенного
N-винилпирролидона.
поли-N-винилпирролидона ниже, чем рассчитан-
Подводя краткий итог экспериментальных
ная по количеству прореагировавших групп двой-
исследований, можно констатировать специфи-
ной связи N-винилпирролидона по результатам
ческие особенности процесса инициированной
ЯМР (ср. кривые 2 и 3 на рис. 5). Это означает, что
пероксидом бензоила полимеризации N-винил-
в реакционной смеси находится большое количе-
пирролидона и предложить схему взаимодействия
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
ИЗУЧЕНИЕ ВЛИЯНИЯ N-ВИНИЛПИРРОЛИДОНА
1663
Схема 2.
•
R
•
R
R
•
R
+R
N O
+R•
N O
N O
N O
1
2a
2б
6
+ 1
R
O
R
•
N
N O
N O
N O
N
+
•
O
R
3a
O
4a
4б
5
•
+R
N
N
•
N O
O
R
R
3б
7
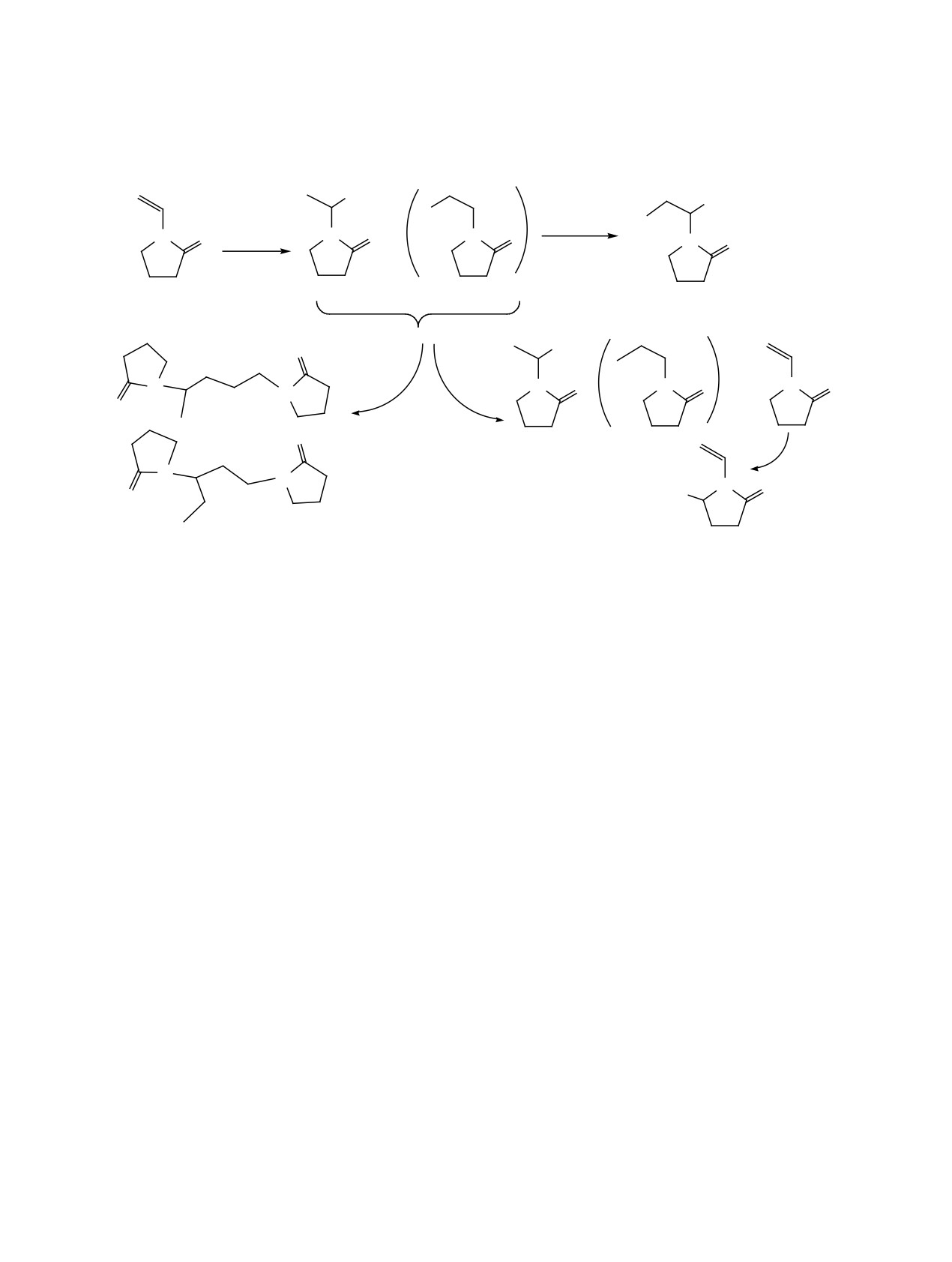
N-винилпирролидона с бензоатными радикалами
дикалом в рамках теории переходного состояния
(схема 2).
(TS) был проведен квантово-химический расчет на
Единственным продуктом распада пероксида в
уровне DFT ωB97x-V/def2-TZVP//BP86/def2-SVP,
присутствии N-винилпирролидона являются бен-
результаты которого приведены в табл. 3. Судя по
зоатные радикалы С6Н5С(О)О• (R•), присоедине-
рассчитанным значениям ΔG, реакции иницииро-
ние которых к «голове» или «хвосту» винильной
вания, роста и передачи цепи протекают самопро-
группы мономера (N-винилпирролидона) иници-
извольно (за исключением реакции образования
ирует реакции роста цепи с образованием пер-
радикала 3б) с барьерами свободной энергии ΔG≠,
вичных радикалов 2а или 2б, а затем димеров или
возрастающими в порядке: инициирование < рост <
олигомеров N-винилпирролидона (через образо-
передача.
вание радикалов 3а или 3б). Вследствие высокой
Присоединение бензоатного радикала к «го-
скорости распада пероксида бензоила и образова-
лове» (образование радикала 2а) характеризует-
ния большого количества бензоатных радикалов
ся более низким активационным барьером, хотя
возможно присоединение второго радикала R• к
термодинамические параметры присоединения к
радикалу 2а (2б), обрывающее цепь с образовани-
«хвосту» ниже; в то же время для дальнейшего ро-
ем продукта 6. Возможно также взаимодействие
ста цепи энергетически выгоднее присоединение
молекулы N-винилпирролидона с первичным ра-
молекулы N-винилпирролидона к радикалу 2а.
дикалом 2а (2б) с отрывом атома Н от лактамно-
Последнее справедливо также для реакции пере-
го кольца [продукты 4а (4б) и радикал 5], что при
дачи цепи с образованием продукта 4 и радикала
присоединении R• приводит к обрыву цепи с обра-
зованием продукта 7.
5; участием в ней радикала 2б можно практически
пренебречь.
Для кинетической и термодинамической оцен-
ки вероятности предполагаемых путей взаимо-
В реакциях обрыва цепи отсутствует барьер ак-
действия N-винилпирролидона с бензоатным ра-
тивации ΔG≠ и имеется существенный выигрыш в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
1664
ТЮРИНА, ЗАРЕЧНАЯ
Таблица 3. Активационные и термодинамические параметры реакций (кДж/моль) при 298.15 K
Активационные
Термодинамические
Реакция
ΔH≠
TΔS≠
ΔG≠
ΔH
TΔS
ΔG
1 + R▪ → TS1a → 2a
-35.8
-55.1
19.3
-99.7
-53.3
-46.4
1 + R▪ → TS1б → 2б
-25.0
-57.0
32.0
-130.7
-57.6
-73.1
1 + 2a → TS2a → 3a
-24.2
-63.5
39.4
-153.1
-66.1
-86.9
1 + 2б → TS2б→ 3б
-0.8
-60.5
59.7
-103.6
-59.2
-44.4
1 + 2a → TS3a → 4a + 5
19.2
-58.4
77.6
-43.1
-1.1
-42.0
1 + 2б → TS3б → 4б + 5
38.9
-57.2
96.1
10.6
3.6
7.0
2а + R▪ → TS4 → 6
-
-
-
-388.7
-68.8
-319.9
2б + R▪ → TS4 → 6
-
-
-
-357.7
-64.5
-293.2
5 + R▪ → TS5 → 7
-
-
-
-372.3
-65.1
-307.2
ΔG, что неизбежно должно привести к превалиро-
щей в своем составе лабильные атомы водорода
ванию их относительно реакции роста.
лактамного цикла.
Из этого анализа следует, что радикал перок-
Вследствие расходования инициатора на по-
сида бензоила с смесях с N-винилпирролидоном
бочные процессы инициирование полимеризации
может активно расходоваться в реакциях обры-
N-винилпирролидона пероксидом бензоила отно-
ва, в том числе за счет отрыва лабильных атомов
сительно малоэффективно, особенно в смесях с
водорода лактамного цикла. Образующиеся сое-
малеиновым ангидридом, где возможно образова-
динения (радикал 5, продукт 7) могут также уча-
ние радикалов и в отсутствие инициатора. Повы-
ствовать в росте и включаться в полимерную цепь,
шение эффективности инициирования перокси-
на что указывает наличие сигналов в области 6.5-
дом бензоила систем с N-винилпирролидоном и
4.8 м. д. в спектрах выделенных образцов полиме-
снижение вероятности побочных процессов воз-
ров. Этот результат совпадает с выводом авторов
можно при введении в систему виниловых моно-
[18], которыми было показано, что при полимери-
меров и снижении концентрации инициатора.
зации N-винилпирролидона в водных растворах
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
наиболее вероятным является передача цепи с об-
разованием радикала 5. Кроме того, полученные
Определение концентрации пероксида методом
результаты не противоречат предложенной авто-
иодометрии проводили по стандартной методике
рами [8] схеме образования разветвленных цепей
[10], нагревая пробу 10-15 мин при ~353 K.
поли-N-винилпирролидона.
Для анализа расходования пероксида бензо-
Таким образом, применение метода спектро-
ила методом ЯМР приготовленную весовым ме-
скопии ЯМР при изучении распада пероксида
тодом реакционную смесь, содержащую 0.1 или
бензоила в N-винилпирролидоне, его растворах и
0.02 моль/л пероксида бензоила, заливали в ам-
смесях позволило не только определить константы
пулы, продували аргоном и запаивали, после чего
скорости распада, но и количественно проанали-
погружали в термостаты с температурой от 298 до
зировать кинетику расходования групп двойных
333 K (термостатирование ±0.1°), отсчет времени
связей и бензоатных радикалов, и тем самым полу-
начинали через 5 мин после погружения. Через
чить экспериментальное свидетельство их участия
заданные промежутки времени ампулы вынимали
в побочных реакциях обрыва и передачи цепи.
и резко охлаждали погружением в воду со льдом,
Последнее подтверждается проведенными теоре-
после чего вскрывали и отбирали аликвоту для
тическими расчетами и объясняется спецификой
анализа (0.2 мл), которую вносили в ампулы для
строения молекулы N-винилпирролидона, имею-
ЯМР, добавляя 0.5 мл ДМСО-d6.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
ИЗУЧЕНИЕ ВЛИЯНИЯ N-ВИНИЛПИРРОЛИДОНА
1665
Спектры ЯМР 1Н полученных растворов ре-
приближение Split-RI-J [27] для аппроксимации
гистрировали с помощью прибора Bruker Avance
кулоновских интегралов). На этом же уровне были
II (400 МГц) при 298 K. В качестве внутреннего
рассчитаны частоты колебаний при стандартных
стандарта использовали ТМС, погрешность изме-
условиях (298 K, 1 атм) для верификации характе-
рения химических сдвигов составляет ±0.0005 м. д.
ра стационарных точек (локальный минимум или
(1Н), стандартная ошибка определения интеграль-
TS) и определения поправок на энергию нулевых
ной интенсивности 5-10%. Для количественного
колебаний, величин энтропии (S), термических по-
анализа данных интенсивности всех сигналов, име-
правок к энтальпии (H) и энергии Гиббса (G).
ющихся в спектре, проводили нормировку интен-
сивности Ii каждого i-сигнала по соотношению с
Для всех равновесных структур уровня BP86/
общей интенсивностью сигналов исходного перок-
def2-SVP была проведена одноточечная оценка
сида бензоила и бензоатов в области 8.2-7.4 м. д.,
электронных энергий более высокого уровня с ис-
а также бензола при 7.37 м. д.
пользованием функционала ωB97x-V в сочетании
Для изучения полимеризации N-винилпир-
с трехэкспоненциальным базисом с добавлением
ролидона методом дилатометрии использовали
поляризационных функций def2-TZVP [25, 26].
дилатометры с объемом баллончика ~5 см3 и ди-
Применялось приближение RIJCOSX [28, 29] для
аметром калиброванного капилляра 1 мм. После
аппроксимации кулоновских и обменных интегра-
заполнения мономером и его дегазации в токе ар-
лов (дополнительный базис def2/J). (Гибридный
гона дилатометр помещали в термостат, в котором
функционал ωB97x-V [30] с разделением по диапа-
поддерживали необходимую температуру с точ-
зонам и поправкой на дисперсию VV10 [31] реко-
ностью ±0.1 K, изменение объема фиксировали с
мендован в исследовании [32] как один из лучших
помощью катетометра В-630. Процесс проводили
для общей термохимии на основе тестирования
до степени конверсии не более 8-10%, после чего
обширной эталонной базы данных GMTKN55).
смесь охлаждали и высаживали в диэтиловый
эфир. Степень конверсии рассчитывали, используя
Окончательные значения свободной энергии
определенную ранее величину коэффициента кон-
и энтальпии получены добавлением соответ-
тракции 0.133 или 0.148 для 313 или 333 K.
ствующих термических поправок из вычислений
Все расчеты выполнены с пакетом ORCA 4.2.1
BP86/def2-SVP к потенциальной энергии уровня
[21] в рамках теории функционала плотности DFT
ωB97x-V/def2-TZVP.
в газовой фазе, в основном состоянии. Для систем
На основе полученных термохимических дан-
с закрытыми и открытыми оболочками использо-
ных были оценены активационные (как разница
вали соответственно ограниченный (RKS) и нео-
сумм значений S, H и G для TS и несвязанных реа-
граниченный по спину (UKS) методы Кона-Шэма.
гентов) и термодинамические (как разница сумм S,
Поиск переходных состояний (TS) осущест-
H и G несвязанных продуктов и реагентов) харак-
вляли, используя одномерное сканирование по-
теристики реакций.
верхности потенциальной энергии с релаксацией
вдоль выбранной координаты реакции (расстояние
ИНФОРМАЦИЯ ОБ АВТОРАХ
между атомами), с последующей оптимизацией
геометрии полученной седловой точки. Далее ре-
Тюрина Татьяна Григорьевна, ORCID: hppts://
левантность структуры TS проверяли построени-
orcid.org/0000-0003-2950-3616
ем путей IRC [22], соединяющих TS с реактантами
Заречная Ольга Михайловна, ORCID: https://
и продуктами реакций.
orcid.org/0000-0002-6069-3967
Равновесные геометрические параметры ре-
агентов, TS и продуктов рассчитывали с исполь-
КОНФЛИКТ ИНТЕРЕСОВ
зованием GGA-функционала BP86 [23, 24] в соче-
тании с основным def2-SVP и вспомогательным
Авторы заявляют об отсутствии конфликта
def2/J базисными наборами [25, 26] (использовали
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
1666
ТЮРИНА, ЗАРЕЧНАЯ
СПИСОК ЛИТЕРАТУРЫ
16.
Günter H. NMR Spectroscopy Basic Principles,
Concepts, and Applications in Chemistry. Weinheim:
1.
Ибрагимов А.Т., Рафиков А.С., Исмаилов И.И., Аска-
Wiley-VCH, 2013. P. 121, 124.
ров М.А. // Высокомол. соед. (Б). 1992. Т. 34. № 12.
17.
Spectral Database for Organic Compounds, SDBS.
С. 27.
2.
Туровский Н.А., Целинский С.Ю., Опейда И.А., Ша-
cgi
пиро Ю.Е. // ТЭХ. 1992. Т. 28. № 4. С. 324.
18.
Deglmann P., Hellmund M., Hungenberg K.-D.,
3.
Sideridou I.D., Achilias D.S., Karava O. / /
Nieken U., Schwede C., Zander C. // Macromol. React.
Macromolecules. 2006. Vol. 39. N 6. Р. 2072. doi
Eng. 2019. Vol. 13. N 5. Р. 1900021. doi 10.1002/
10.1021/ma0521351
mren.201900021
4.
Трубицина С.Н., Исмаилов И.И., Аскаров М.А. // Вы-
19.
Dispenza C., Sabatino M.A., Grimaldi N., Dahlgren B.,
сокомол. соед. (A). 1978. Т. 20. № 11. С. 2608.
Al-Sheikhly M., Wishart J.F., Tsinas Z., Poster D.L.,
5.
Большаков А.И., Гордон Д.А., Емельянова Н.С.,
Jonsson M. // Radiat. Phys. Chem. 2020. Vol. 174.
Кузина С.И., Кирюхин Д.П. // Химия высоких
Р. 108900. doi 10.1016/j.radphyschem.2020.108900
энергий. 2019. Т. 53. № 5. С. 354. doi 10.1134/
20.
Тюрина Т.Г., Заречная О.М., Зайцева В.В.,
S0023119319050048; Bol’shakov A.I., Gordon D.A,
Зайцев С.Ю. // ЖОХ. 2020. Вып. 5. С. 664; Tyuri-
Emel’yanova N.S., Kuzina S.I., Kiryukhin D.P. // High
na T.G., Zarechnaya O.M., Zaitseva V.V., Zaitsev S.Yu. //
Energy Chem. 2019. Vol. 53. Р. 356. doi 10.1134/
Russ. J. Gen. Chem. 2020. Vol. 90. N 5. P. 773. doi
S0018143919050047
10.1134/S1070363220050023
6.
Кирш Ю.Э. Поли-N-винилпирролидон и другие по-
21.
Neese F., Wennmohs F., Becker U., Riplinger C. //
ли-N-виниламиды: Синтез и физико-химические
J. Chem. Phys. 2020. Vol. 152. Р.
224108.
свойства. М.: Наука, 1998. 252 с.
doi10.1063/5.0004608
7.
Franco P., De Marco I. // Polymers. 2020. Vol. 12. N 5.
22.
Fukui K. // Acc. Chem. Res. 1981. Vol. 14. P. 363. doi
Р. 1114. doi 10.3390/polym12051114
10.1021/ar00072a001
8.
Welzel S., Zander C., Hungenberg K.-D., Nieken U. //
23.
Becke A.D. // J. Chem. Phys. 1993. Vol. 98. Р. 5648. doi
Macromol. React. Eng. 2022. Vol. 16. N 3. P. 2200005.
10.1063/1.464913
doi 10.1002/mren.202200005
24.
Perdew J.P. // Phys. Rev. (B). 1986. Vol. 33. P. 8822. doi
9.
Camilo A.P.R., Felisberti M.I., Mano V. // IX Brazilian
10.1103/PhysRevB.33.8822
MRS Meeting, 2010, Ouro Preto. Vol. 1. P. 638.
25.
Weigend F., Ahlrichs R. // Phys. Chem. Chem. Phys.
10.
Антоновский В.П., Бузанова М.М. Аналитическая
2005. Vol. 7. P. 3297. doi 10.1039/B508541A
химия органических пероксидных соединений. М.:
26.
Weigend F. // Phys. Chem. Chem. Phys. 2006. Vol. 8.
Химия, 1978. 309 с.
Р. 1057. doi 10.1039/B515623H.
11.
Hammond G.S., Nandi U.S. // J. Am. Chem. Soc. 1961.
27.
Neese F. // J. Comput. Chem. 2003. Vol. 24. N 14.
Vol. 83. N 5. Р. 1213. doi 10.1021/ja01466a044
12.
Гайдукевич О.А., Скаковский Е.Д., Тычинская
P. 1740. doi 10.1002/jcc.10318
Л.Ю., Зверева Т.Д., Дикусар Е.А., Ламоткин С.А.,
28.
Neese F., Wennmohs F., Hansen A., Becker U. //
Рыков С.В. // Ж. прикл. спектр. 2012. Т. 79. № 2.
Chem. Phys. 2009. Vol. 356. Р. 98. doi 10.1016/j.
С. 323; Haidukevich O.A., Skakovskii E.D., Tychin-
chemphys.2008.10.036.
skaya L.Y. Zvereva T.D., Dikusar E.A., Lamotkin S.A. //
29.
Izsák R., Neese F. // J. Chem. Phys. 2011. Vol. 135.
J. Appl. Spectrosc. 2012. Vol. 79. N 2. P. 302. doi
Р. 144105. doi 10.1063/1.3646921
10.1007/s10812-012-9598-y
30.
Mardirossian N., Head-Gordon M. // Phys. Chem.
13.
Gottlieb H.E., Kotlyar V., Nudelman A. // J. Org. Chem.
Chem. Phys. 2014. Vol. 16. Р. 9904. doi 10.1039/
1997. Vol. 62. N 21. P. 7512. doi 10.1021/jo971176v
C3CP54374A
14.
Engel P.S., Lee W.-K., Marschke G.E., Shine H.J. //
31.
Vydrov O.A., Van Voorhis T. // J. Chem. Phys. 2010. Vol.
J. Org. Chem. 1987. Vol. 52. N 13. P. 2813. doi
133. N 24. Р. 244103. doi 10.1063/1.3521275
org/10.1021/jo00389a031
32.
Goerigk L., Hansen A., Bauer C., Ehrlich S., Najibi A.,
15.
de Lijser H.J.P., Arnold D.R. // J. Phys. Chem. (A).
Grimme S. // Phys. Chem. Chem. Phys. 2017. Vol. 19.
1998. Vol. 102. N 28. P. 5592. doi 10.1021/jp980204q
Р. 32184. doi 10.1039/C7CP04913G
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
ИЗУЧЕНИЕ ВЛИЯНИЯ N-ВИНИЛПИРРОЛИДОНА
1667
Study of The N-Vinylpirrolidone Effect on Destruction
of Benzoyl Peroxide
T. G. Tyurinaa,* and O. M. Zarechnayaa
a L.M. Litvinenko Institute of Physical Organic and Coal Chemistry, Donetsk, 83114 Ukraine
*e-mail: t_tiurina@mail.ru
Received July 12, 2022; revised August 23, 2022; accepted August 25, 2022
The decomposition of benzoyl peroxide in a solution or bulk of N-vinylpyrrolidone, its mixtures with maleic
anhydride and/or methyl methacrylate was studied by 1Н NMR spectroscopy. It was found that the peroxide
decomposition rate constants vary from 10-3 s-1 for a mixture of N-vinylpyrrolidone with maleic anhydride (1:1,
313 K) to 10-4 s-1 for a mixture with methyl methacrylate (1:1, 333 K). The activation energy for the decom-
position of benzoyl peroxide in N-vinylpyrrolidone was 75.5±6.8 kJ/mol. Possible reactions of the interaction
of N-vinylpyrrolidone with the benzoate radical were proposed, and their thermochemical characteristics were
evaluated at the level of ωB97x-V/def2-TZVP.
Keywords: benzoyl peroxide, N-vinylpyrrolidone, NMR spectroscopy, quantum-chemical calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022