ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 11, с. 1728-1734
УДК 547.341;547.787.1
РЕАКЦИИ ТЕТРАМЕТИЛЭТИНИЛДИФОСФОНАТА
С ЗАМЕЩЕННЫМИ 2-АМИНОПИРИДИНАМИ
© 2022 г. К. Н. Дакуоa, А. С. Крыловa, Н. И. Свинцицкаяa,*
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: nsvincickaya@mail.ru
Поступило в редакцию 14 июля 2022 г.
После доработки 5 августа 2022 г.
Принято к печати 7 августа 2022 г.
Изучена реакция гидроаминирования тераметилэтинилдифосфоната замещенными 2-аминопиридинами
под действием основания. Реакция протекает стереоселективно с образованием (Е)-енаминофосфонатов.
Получен ряд новых фосфоноенаминов - диметил-[2-(диметоксифосфорил)-2-(пиридин-2-иламино)-
винил]фосфонатов.
Ключевые слова: енамины, енаминофосфонаты, алкинилфосфонаты, аминопиридины, вицинальные
бисфосфонаты
DOI: 10.31857/S0044460X22110105, EDN: LOIIPL
Органические производные фосфоновой кис-
годаря их способность к комплексообразованию
лоты, представляющие собой группу как синте-
с ионами металлов [18, 19]. Растущий интерес к
тических, так и биогенных веществ, характери-
биологической активности аминобисфосфонатов
зующихся наличием групп С-Р(ОR)2 (R = H, Alk,
стимулировал и разработку методов их синтеза
Ar), - это перспективный класс соединений с ши-
[2, 14, 20, 21].
роким спектром практического применения [1-7].
Наибольшую известность имеют геминальные
Среди них большое внимание в последнее время
аминобисфосфонаты - их производные (памидро-
уделяется бисфосфонатам (см. обзоры [8-10]) и, в
нат, алендронат, этидронатом, ибандронат, золе-
частности, их важному подклассу - аминобисфос-
дроновая кислота и др.) зарекомендовали себя в
фонатам. Этот повышенный интерес обусловлен
качестве эффективных средств при лечении остео-
наличием у данных соединений различной биоло-
пороза [22]. В отличие от геминальных вициналь-
гической активности. Эти соединения действуют
ные бисфосфонаты (соединения типа Р-С-С-Р),
как сильные ингибиторы резорбции костной ткани,
а также соединения, в которых расстояние между
поэтому могут использоваться в качестве препара-
фосфорильными группами больше (Р-Сn-P, n ≥ 2)
тов для лечения остеопороза, скелетных осложне-
неактивны при нарушениях, связанных с обменом
ний злокачественных новообразований, болезни
кальция. Тем не менее известны примеры, когда
Педжета, гиперкальциемии и фиброзной диспла-
введение потенциальных донорных групп по со-
зии [11-13]. Растет интерес к их применению в ка-
седству с фосфонатной приводило к проявлению
честве противоопухолевых и антибактериальных
такой активности за счет возможности образова-
агентов [14-17]. Кроме того, аминобисфосфоно-
ния бидентатных хелатов с переходными металла-
вые кислоты имеют важное промышленное значе-
ми и кальцием [23, 24], в связи с чем вицинальные
ние и, в частности, находят применение в качестве
аминобисфосфонаты и разработка методов их син-
ингибиторов образования накипи и коррозии бла-
теза также заслуживают отдельного внимания.
1728
РЕАКЦИИ ТЕТР
АМЕТИЛЭТИНИЛДИФОСФОНАТА
1729
Схема 1.
CH2Cl2
(EtO)2(O)P
P(O)(OEt)2
(EtO)2(O)P
P(O)(OEt)2
R1R2NH
25°C
H NR1R2
R1 = H, R2 = Me, c-Hex, Bn; R1, R2 = (CH2)4.
Схема 2.
O
H3CO O
H
P(OCH3)2
P
H3CO
R
K2CO3, MeCN
+
(H3CO)2P
NH
80°C, 48-72 ч
2
H3CO
H2N
N
1
P
O N
3
H3CO O
6
4
2а-д
1
5
R
3а-д
R = H (a), 3-Me (б), 4-Me (в), 6-Me (г), 5-Br (д).
Фосфонилированные енамины являются цен-
торы указывают, что полученные енамины могут
ными интермедиатами в органической химии.
служить предшественниками иминиевых анионов
Например, их литиированные производные оказа-
при алкилировании и в реакциях Виттига-Хорнера-
лись эффективными замаскированными гомоено-
Эммонса [37].
лятными анионами карбоновой кислоты, которые
В качестве N-нуклеофильных агентов для при-
могут использоваться в синтезе различных гете-
соединения по тройной связи алкинилбисфосфо-
роциклических систем [25-27]. С другой стороны,
ната 1 нами были выбраны 2-аминопиридины,
фосфоноенамины, которые можно рассматривать
которые являются удобными лигандами для соз-
как аналоги дегидроаминокислот, могут быть
дания различных металлокомплексов, а также
удобными предшественниками при получении
универсальными предшественниками для созда-
α,β-аминофосфонатов посредством каталитиче-
ния молекул с широким спектром биологической
ского гидрирования [28-31]. В связи с этим наблю-
активности [38, 39]. Реакцией гидроаминирования
дается интерес к совершенствованию и разработке
тетраметилэтинилдифосфоната
1
2-аминопири-
новых методов синтеза данных соединений (см.
динами 2а-д под действием безводного K2CO3
обзор [32]).
(5 мол%) нами получен ряд новых фосфорилиро-
В продолжение исследований по химии алки-
ванных енаминов - диметил-[2-(диметоксифос-
нилфосфонатов [33-35] нами предложен подход к
форил)-2-(пиридин-2-иламино)винил]фосфонатов
синтезу новых енаминобисфосфонатов на основе
(схема 2). В отличие от реакций с алифатическими
реакций диметилового эфира этинилдифосфоно-
аминами взаимодействие алкинилбисфосфоната 1
вой кислоты с замещенными 2-аминопиридинами.
с 2-аминопиридинами, более слабыми нуклеофи-
На сегодняшний день в литературе представлено
лами, проходит в более жестких условиях: кипяче-
всего два примера подобного взаимодействия эти-
ние реакционной массы при 80°С в ацетонитриле в
нилдифосфонатов с аминами (схема 1) [36, 37]. Ав-
течение 48-72 ч в присутствии безводного K2CO3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
1730
ДАКУО и др.
Схема 3.
O
H
P(OCH3)2
O
H
P(OCH3)2
H3CO O
(H3CO)2P
NH
P
H2N
N
H3CO
2
O
1
или
K2CO3, MeCN
3
(H
NH
N
3CO)2P
+
или
8
1
80°C, 48-72 ч
9
9
4
H3CO
8
O 2
7
P
10
H
N
3CO O
3
6
7
5
10
4
6
5
1
NH
2
5б
4а, б
5a
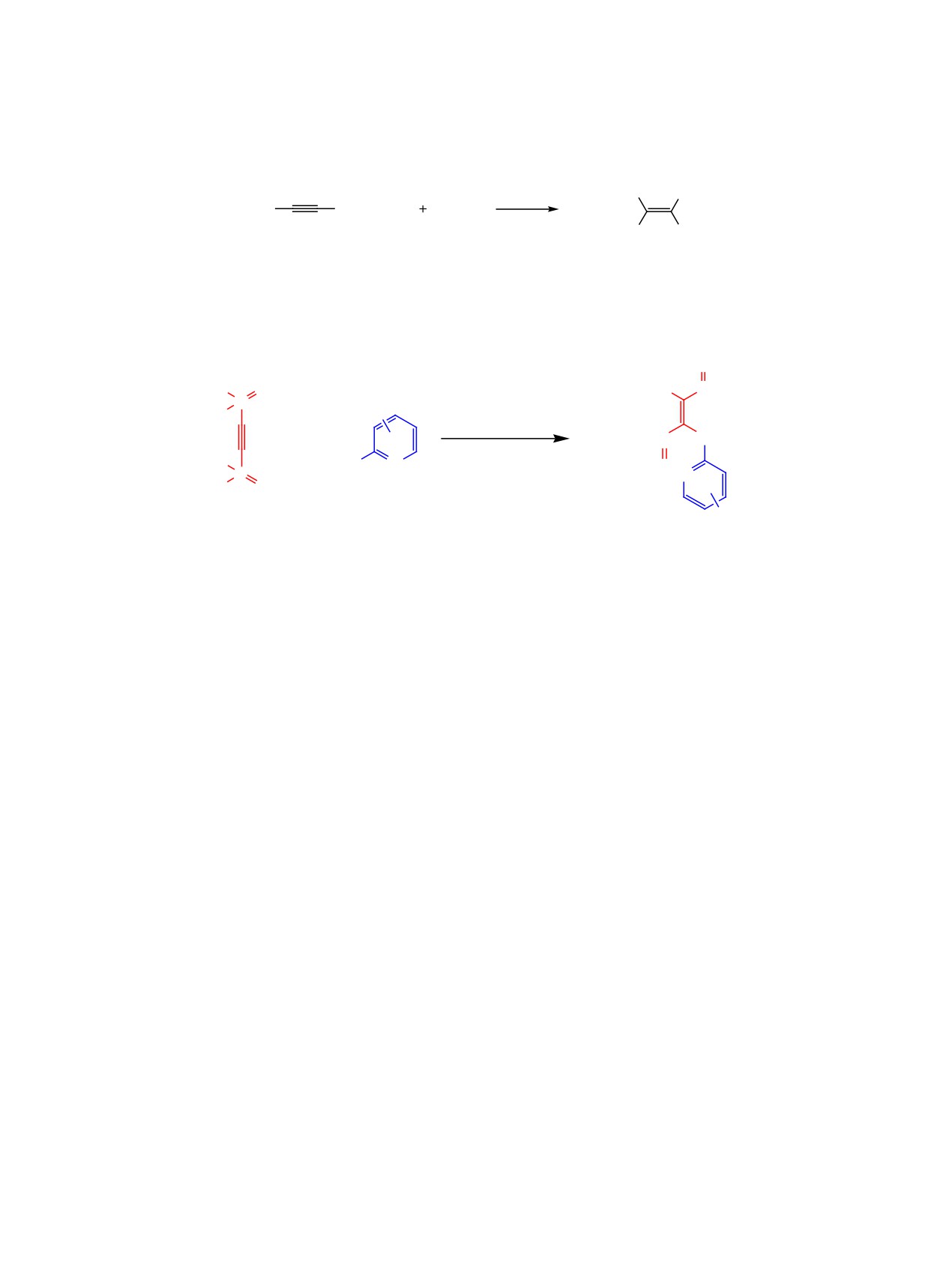
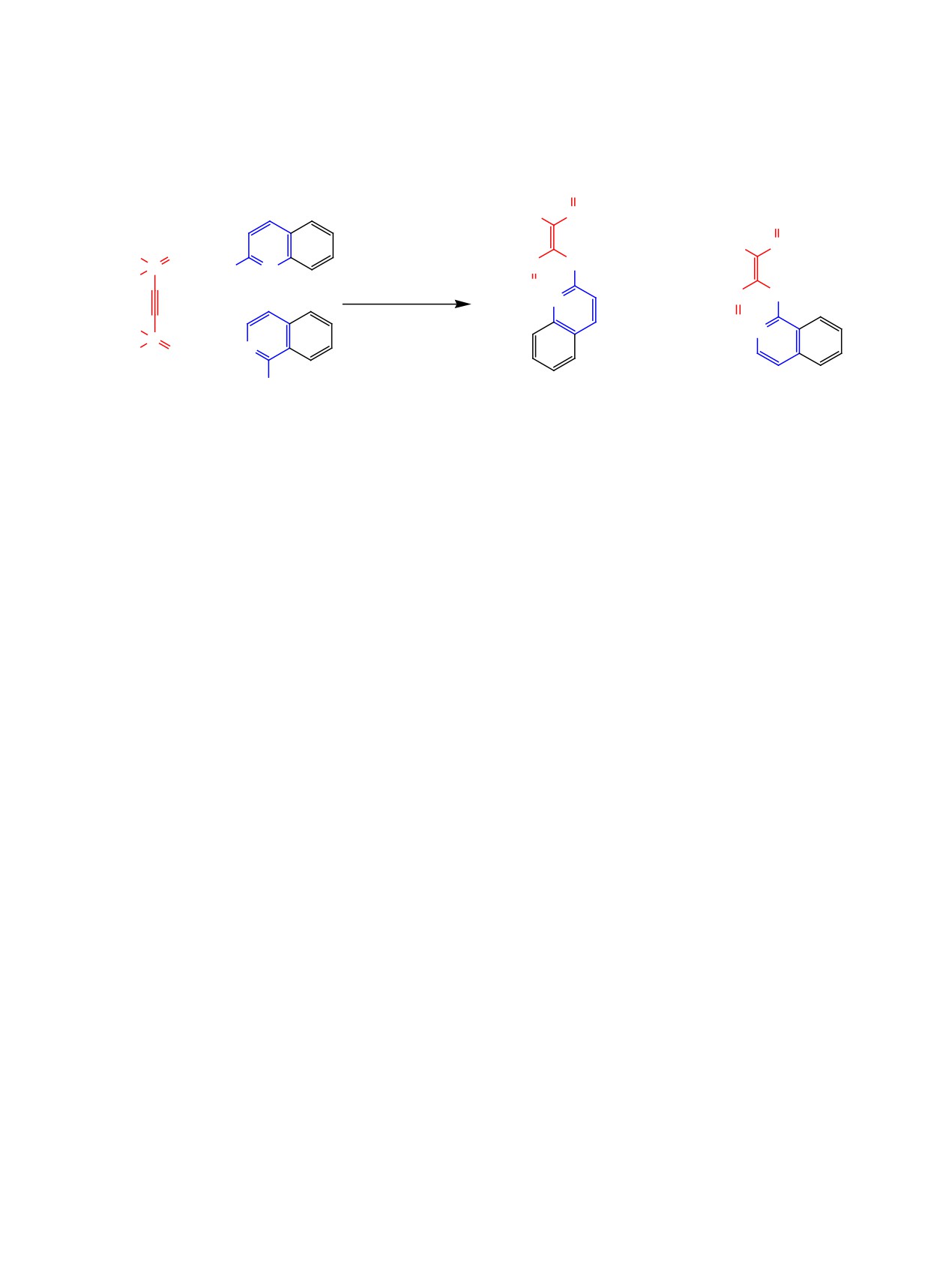
Выход целевых диметил-[2-(диметоксифосфо-
Реакция тетраметилэтинилдифосфоната
1
рил)-2-(пиридин-2-иламино)винил]фосфонатов
с аналогами 2-аминопиридина - 2-аминохиноли-
3а-д после очистки методом колоночной хрома-
ном 4а и 1-аминоизохинолином 4б - требует более
тографии составил 32-78%. Реакция протекает
длительного нагревания (более 5 сут), однако и это
стреоселективно с образованием исключительно
не позволяет довести ее до конца. Соответствую-
E-изомера.
щие [2-(изо)хинолиниламино)винил]бисфосфона-
ты 5а, б были выделены с выходом 15-28%. При
Следует отметить, что в проведение реакции в
этом конверсия исходного этинилдифосфоната 1
отсутствие K2CO3 или с использованием других
не превышала 50% (по данным ЯМР 31Р).
катализаторов и растворителей не привело к ожи-
даемому результату: реакция либо не протекала
Строение полученных соединений подтвержде-
вовсе, либо требовала более длительного нагре-
но данными спектроскопии ЯМР 1Н, 13С и 31Р. Так,
вания, при этом конверсия исходного тетраметил-
в спектрах ЯМР 1Н аминовинилдифосфонатов
этинилдифосфоната и выход конечного продукта
3а-д и 5а, б характерным является сигнал мети-
реакции были крайне низкими.
нового протона РCH=, представленный дублетом
дублетов в области 5.08-5.88 м. д. с константами
Лучше всего в реакцию вступают 2-аминопири-
спин-спинового взаимодействия 2JHP 15.2-16.5 и
дины, имеющие донорные заместители в кольце.
При этом легче всего протекает реакция с 2-ами-
3JHР 18.2-18.3 Гц, что указывает на транс-распо-
ложение фосфонатных групп. В спектрах ЯМР 13С
нопиридинами
2б-г, содержащими метильную
атомы углерода при двойной связи резонируют ду-
группу в орто-, мета- или пара-положении к ами-
блетными сигналами в области 104.15-109.15 м. д.
ногруппе. Однако в случае 2-амино-3-гидрокси-
с константами спин-спинового взаимодействия с
пиридина реакция сопровождается значительным
ядром фосфора 1JСP 187.9-204.1 Гц. Наличие двух
осмолением реакционной смеси, вследствие чего
дублетных сигналов в спектрах ЯМР 31Р алкенди-
выделить ожидаемый енаминобисфосфонат нам
не удалось. Более длительное нагревание требу-
фосфонатов 3а-д, 5а, б в области 12.35-22.18 м. д.
с константой спин-спинового взаимодействия 3JРP
ется при использовании 2-амино-5-бромпиридина
89.6-92.5 Гц свидетельствует о Е-конфигурации
2д. Следует отметить, что в случае менее реакци-
кратной связи. Для сравнения, в случае Z-алкен-
онноспособных 5-хлор-, 4-нитро- и 4-трифторме-
дифосфонатов величина 3JРP составляет 27-30 Гц
тил-2-аминопиридинов длительное нагревание
[33, 35, 40].
реакционной смеси приводило к образованию
целевого енаминобисфосфоната лишь в следовых
Таким образом, на основе стереоселективной
количествах, выделить который нам не удалось.
реакции гидроаминирования тетраметилового
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
РЕАКЦИИ ТЕТР
АМЕТИЛЭТИНИЛДИФОСФОНАТА
1731
эфира этинилдифосфоновой кислоты замещенны-
δP, м. д.: 12.86 д и 19.42 д (3JPP 91.6 Гц). Масс-
ми 2-аминопиридинами и амино(изо)хинолинами
спектр, m/z: 359.0517 [M + Na]+ (вычислено для
получен новый ряд (Е)-енаминобисфосфонатов.
C11H18N2NaO6P2+: 359.0532).
Полученные фософоноенамины могут представ-
Диметиловый эфир (Е)-[2-(диметоксифос-
лять интерес как ценные синтоны для построения
форил)-2-(3-метилпиридин-2-иламино)винил]-
фармацевтически активных молекул.
фосфоновой кислоты (3б). Выход 78%, желтое
масло. Спектр ЯМР 1H, δ, м. д.: 2.15 с (3Н, CH3),
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
JHP 11.2 Гц), 3.59 д (6H, CH3OP,
3.53 д (6H, CH3OP, 3
Замещенные 2-аминопиридины, 2-аминохино-
3JHP 11.2 Гц), 4.45 уш. с (1H, NH), 5.08 д. д (1H,
лин и 1-аминоизохинолин - коммерческие продук-
РСH=, 2JHP 15.2, 3JHP 18.3 Гц), 6.23 т (1H, С5Н,
ты, использовались без дополнительно очистки.
3JHH 6.8 Гц), 6.64 т (1H, С4Н, 3JHH 5.8 Гц), 7.97 д
Тетраметиловый эфир этинилдифосфоновой кис-
(1H, С6Н, 3JHH 5.8 Гц). Спектр ЯМР 13C, δC, м. д.:
лоты 1 был получен по методике, описанной ранее
д 17.12 (СH3), 53.26 д (CH3OP, 2JCP 5.7 Гц), 53.53 д
[41].
(CH3OP, 2JCP 6.3 Гц), 105.77 д (РСН=, 1JCP 187.9 Гц),
Спектры ЯМР 1Н, 13С и 31Р регистрировали на
106.39 д (РC=, 1JCP 204.1 Гц), 108.08 (C3), 114.49
спектрометре Bruker Avance III HD 400 NanoBay с
(C5), 137.83 (C4), 145.49 (C6), 156.98 (C2). Спектр
ЯМР 31P, δP, м. д.: 15.20 д и 22.18 д (3JPP 92.0 Гц).
использованием рабочих частот 400.17 (1Н), 100.62
Масс-спектр, m/z: 373.0649 [M + Na]+ (вычислено
(13С) и 161.98 МГц (31Р). Масс-спектры (HMR-ESI)
снимали на масс-спектрометре Bruker MicroTOF.
для C12H20N2NaO6P2+: 373.0689).
Для колоночной хроматографии использовали си-
Диметиловый эфир (Е)-[2-(диметоксифос-
ликагель 60 (Merck, 0.063-0.100 мм).
форил)-2-(4-метилпиридин-2-иламино)винил]-
Общая методика получения соединений 3а-д,
фосфоновой кислоты (3в). Выход 72%, желтое
5а, б. К раствору 1 ммоль тетраметилэтинилди-
масло. Спектр ЯМР 1H, δ, м. д.: 2.01 с (3Н, CH3),
фосфоната 1 в 5 мл безводного ацетонитрила при-
3.65 д (6H, CH3OP, 3JHP 11.3 Гц), 3.81 д (6H, CH3OP,
бавляли 1 ммоль соответствующего 2-аминопири-
3JHP 10.5 Гц), 4.62 уш. с (1H, NH), 5.69 д. д (1H,
дина 2а-д или амино(изо)хинолина 4а, б и 1 ммоль
РСH=, 2JHP 16.5, 3JHP 18.3 Гц), 6.23 д (1H, С5Н,
безводного K2CO3. Полученную смесь перемеши-
3JHH 8.4 Гц), 6.27 с (1H, С3Н), 7.01 д (1H, С6Н, 3JHH
вали при 80°С течение 48-72 ч (3а-д) или 5 сут
6.7 Гц). Спектр ЯМР 13C, δC, м. д.: 21.52 (СH3),
(5а, б). Контроль за ходом реакции осуществляли
53.28 д (CH3OP, 2JCP 6.7 Гц), 53.92 д (CH3OP, 2JCP
методом ЯМР 31Р. После окончания реакции оса-
5.7 Гц), 104.15 д (РCH=, 1JCP 190.6 Гц), 105.96 д
док отфильтровывали и промывали хлористым
(РС=, 1JCP 200.2 Гц), 107.77 (C3), 113.60 (C5), 137.27
метиленом. Фильтрат упаривали в вакууме. Оста-
(C4), 147.52 (C6), 157.45 (C2). Спектр ЯМР 31P, δP,
ток хроматографировали, элюент - CH2Cl2-MeOH
м. д.: 12.85 д и 19.72 д (3JPP 92.5 Гц).
(9:1).
Диметиловый эфир (Е)-[2-(диметоксифос-
Диметиловый эфир (Е)-2-(диметоксифос-
форил)-2-(6-метилпиридин-2-иламино)винил]-
форил)-2-(пиридин-2-иламино)винил]фосфо-
фосфоновой кислоты (3г). Выход 57%, желтое
новой кислоты (3а). Выход 57%, желтое масло.
масло. Спектр ЯМР 1H, δ, м. д.: 2.41 с (3Н, CH3),
Спектр ЯМР 1H, δ, м. д.: 3.65 д (6H, CH3OP, 3JHP
3.53 д (6H, CH3OP, 3JHP 11.3 Гц), 3.69 д (6H, CH3OP,
11.3 Гц), 3.81 д (6H, CH3OP, 3JHP 10.5 Гц), 4.58
3JHP 10.8 Гц), , 4.63 уш. с (1H, NH), 5.73 д. д (1H,
уш. с (1H, NH), 5.77 д. д (1H, РСH=, 2JHP 16.5, 3JHP
РСH=, 2JHP 16.4, 3JHP 18.1 Гц), 6.34 д (1H, С5Н, 3JHH
18.2 Гц), 5.99 т (1H, С5H, 3JHH 6.7 Гц), 6.50 д (1H,
8.2 Гц), 6.53 д (1H, С3Н, 3JHH 7.8 Гц), 7.36 т (1H,
С3H, 3JHH 8.2 Гц), 6.52 т (1H, С4H, 3JHH 6.7 Гц), 8.06
С4Н, 3JHH 7.8 Гц). Спектр ЯМР 13C, δC, м. д.: 21.13
д (1H, С6H, 3JHH 6.4 Гц). Спектр ЯМР 13C, δC, м. д.:
(СH3), 52.07 д (CH3OP, 2JCP 5.7 Гц), 53.32 д (CH3OP,
53.37 д (CH3OP, 2JCP 6.2 Гц), 52.08 д (CH3OP, 2JCP
2JCP 6.4 Гц), 104.22 д (РCH=, 1JCP 189.9 Гц), 106.03
5.7 Гц), 105.02 (C5), 106.49 д (РC=, 1JCP 189.4 Гц),
д (РС=, 1JCP 195.8 Гц), 105.51 (C5), 106.23 (C3),
107.99 д (РСН=, 1JCP 187.9 Гц), 108.86 (C3), 136.09
138.09 (C4), 156.47 (C2), 158.04 (C6). Спектр ЯМР
(C4),
138.04 (C6), 155.53 (C2). Спектр ЯМР 31P,
31P, δP, м. д.: 13.07 д и 19.74 д (3JPP 92.2 Гц).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
1732
ДАКУО и др.
Диметиловый эфир (Е)-[2-(диметоксифосфо-
ИНФОРМАЦИЯ ОБ АВТОРАХ
рил)-2-(5-бромпиридин-2-иламино)винил]фос-
Свинцицкая Наталья Иосифовна, ORCID:
фоновой кислоты (3д). Выход 32%, оранжевое
масло. Спектр ЯМР 1H, δ, м. д.: 3.78 д (6H, CH3OP,
3JHP 11.1 Гц), 3.81 д (6H, CH3OP, 3JHP 11.1 Гц), 4.57
Крылов Александр Сергеевич, ORCID: https://
уш. с (1H, NH), 5.80 д. д (1H, РСH=, 2JHP 16.4, 3JHP
orcid.org/0000-0003-1773-7802
18.3 Гц), 7.26 д (1H, С3Н, 3JHH 7.2 Гц), 7.50 д (1H,
ФИНАНСОВАЯ ПОДДЕРЖКА
С4Н, 3JHH 7.2 Гц), 8.11 с (1H, С6Н). Спектр ЯМР
13C, δC, м. д.: 52.20 д (CH3OP, 2JCP 5.7 Гц), 53.41
Работа выполнена при финансовой поддерж-
д (CH3OP, 2JCP 6.2 Гц), 106.44 д (РCH=, 1JCP 190.3
ке Российского фонда фундаментальных иссле-
Гц), 107.99 д (РС=, 1JCP 197.4 Гц), 117.52 (C3),
дований (проект № 0785.00.Х6019) с использо-
138.52 (C4), 143.35 (C5), 154.02 (C6), 157.32 (C2).
ванием оборудования Инжинирингового центра
Спектр ЯМР 31P, δP, м. д.: 12.37 д и 18.74 д (3JPP
Санкт-Петербургского государственного техноло-
90.0 Гц).
гического института (технического университета).
Диметиловый эфир (Е)-[2-(диметоксифос-
форил)-2-(хинолин-2-иламино)винил]фосфо-
КОНФЛИКТ ИНТЕРЕСОВ
новой кислоты (5а). Выход 28%, желтое масло.
Н.И. Свинцицкая является членом редколлегии
Спектр ЯМР 1H, δ, м. д.: 3.63 д (6H, CH3OP, 3JHP
Журнала общей химии. Остальные авторы заявля-
10.7 Гц), 3.69 д (6H, CH3OP, 3JHP 10.7 Гц), 4.82
ют об отсутствии конфликта интересов.
с (1H, NH), 5.82 д. д (1H, РСH=, 2JHP 16.2, 3JHP
18.1 Гц), 7.23 д (1H, С3Н, 3JHH 7.2 Гц), 7.55 д (1H,
СПИСОК ЛИТЕРАТУРЫ
С5Н, 3JHH 8.1 Гц), 7.57 т (1H, С6Н, 3JHH 8.1 Гц), 7.65
т (1H, С7Н, 3JHH 8.1 Гц), 8.44 д (1H, С8Н, 3JHH 7.2),
1. Quin L.D. A guide to organophosphorus chemistry.
8.51 д (1H, С4Н, 3JHH 7.2 Гц). Спектр ЯМР 13C, δC,
Toronto: John Wiley & Sons Inc., 2000.
м. д.: 52.65 д (CH3OP, 2JCP 5.8 Гц), 54.35 д (CH3OP,
2. Gałęzowska J., Gumienna-Kontecka E. // Coord. Chem.
Rev. 2012. Vol. 256. N 1-2. P. 105. doi 10.1016/j.
2JCP 6.0 Гц), 106.31 д (РCH=, 1JCP 189.7 Гц), 109.15
ccr.2011.07.002
д (РС=, 1JCP 198.4 Гц), 121.58 (C3), 125.11 (C6),
3. Yücesan G., Zorlu Y., Stricker M., Beckmann J. // Coord.
128.59 (C5), 129.64 (C8), 129.80 (C10), 130.75 (C7),
Chem. Rev. 2018. Vol. 369. P. 105. doi 10.1016/j.
135.49 (C4), 140.74 (C9), 155.79 (C2). Спектр ЯМР
ccr.2018.05.002
31P, δP, м. д.: 12.35 д и 18.77 д (3JPP 89.6 Гц). Масс-
4. Manghi M.M., Masiol M., Calzavara R., Graziano P.L.,
спектр, m/z: 409.0632 [M + Na]+ (вычислено для
Peruzzi E., Pavoni B. // Chemosphere. 2021. Vol. 283.
C15H20N2NaO6P2+: 409.0689).
P. 131187. doi 10.1016/j.chemosphere.2021.131187
Диметиловый эфир (Е)-[2-(диметоксифосфо-
5. Cao H.-Q., Li J.-K., Zhang F.-G., Cahard D., Ma J.-A. //
рил)-2-(изохинолин-1-иламино)винил]фосфо-
Adv. Synth. Catal. 2021. Vol. 363. N 3. P. 688. doi
новой кислоты (5б). Выход 15%, желтое масло.
10.1002/adsc.202001345
Спектр ЯМР 1H, δ, м. д.: 3.75 д (6H, CH3OP, 3JHP
6. Maeda K. // Micropor. Mesopor. Mater. 2004. Vol. 73. N
1-2. P. 47. doi 10.1016/j.micromeso.2003.10.018
11.3 Гц), 3.78 д (6H, CH3OP, 3JHP 11.3 Гц), 5.02
7. Krečmerová M., Majer P., Rais R., Slusher B.S. // Front.
с (1H, NH), 5.88 д. д (1H, РСH=, 2JHP 16.8, 3JHP
Chem. 2022. doi 10.3389/fchem.2022.889737
18.5 Гц), 7.55 д (1H, С4Н, 3JHH 8.3 Гц), 7.58 т (1H,
8. Popov K., Oshchepkov M., Tkachenko S., Sergienko V.,
С7Н, 3JHH 7.9 Гц), 7.66 т (1H, С6Н, 3JHH 8.1 Гц), 7.84
Oshchepkov A. // J. Mol. Liq. 2022. Vol. 351. P. 118619.
д (1H, С5Н, 3JHH 8.2 Гц), 8.29 д (1H, С8Н, 3JHH 7.8),
doi 10.1016/j.molliq.2022.118619
8.53 д (1H, С3Н, 3JHH 7.2 Гц). Спектр ЯМР 13C, δC,
9. Ebetino F.H., Sun S., Cherian P., Roshandel S.,
м. д.: 52.56 д (CH3OP, 2JCP 6.0 Гц), 54.35 д (CH3OP,
Neighbors J.D., Hu E., Dunford J.E., Sedghizadeh P.P.,
2JCP 6.0 Гц), 107.27 д (РCH=, 1JCP 188.4 Гц), 109.86
McKenna C.E., Srinivasan V., Boeckman R.K.,
д (РС=, 1JCP 197.8 Гц), 121.36 (C4), 125.88 (C9),
Russell R.G. // Bone. 2022. Vol. 156. P. 116289. doi
126.49 (C8), 126.69 (C5), 132.35 (C6), 132.71 (C7),
10.1016/j.bone.2021.116289
135.22 (C10), 137.84 (C3), 153.50 (C1). Спектр ЯМР
10. Золотухина М.М., Крутиков В.И., Лаврен-
31P, δP, м. д.: 12.12 д и 20.68 д (3JPP 90.9 Гц).
тьев А.Н. // Усп. хим. 1993. Т. 62. № 7. С. 691;
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
РЕАКЦИИ ТЕТР
АМЕТИЛЭТИНИЛДИФОСФОНАТА
1733
Zolotukhina M.M., Krutikov V.I., Lavrent’ev A.N. //
27.
Palacios F., Ochoa de Retana A.M., Oyarzabal J. //
Russ. Chem. Rev. 1993. Vol. 62. N 7. P. 647. doi
Tetrahedron. 1999. Vol. 55. N 10. P. 3091. doi 10.1016/
10.1070/RC1993v062n07ABEH000038
S0040-4020(99)00068-X
11.
Russell R.G. // Bone. 2011. Vol. 49. P. 2. doi 10.1016/j.
28.
Zhang Z., Tamura K., Mayama D., Sugiya M.,
bone.2011.04.022
Imamoto T. // J. Org. Chem. 2012. Vol. 77. P. 4184. doi
12.
Ebetino F.H., Hogan A.M., Sun S., Tsuompra M.K.,
10.1021/jo300454n
Duan X., Triffitt J.T., Kwaasi A.A., Dunford J.E.,
29.
Zhang J., Li Y., Wang Z., Ding K. // Angew. Chem.
Barnett B.L., Oppermann U., Lundy M.W., Boyde A.,
Int. Ed. 2011. Vol. 50. P. 11743. doi 10.1002/
Kashemirov B.A., McKenna C.E., Russell R.G. // Bone.
ange.201104912
2011. Vol. 49. P. 20. doi 10.1016/j.bone.2011.03.774
30.
Wassenaar J., Kuil M., Lutz M., Spek A.L., Reek J.N.H. //
13.
Maraka S., Kennel K.A. // Br. Med. J. 2015. Vol. 351.
Chem. Eur. J. 2010. Vol. 16. P. 6509. doi 10.1002/
P. h3783. doi 10.1136/bmj.h3783
chem.200903476
14.
Kaboudin B., Daliri P., Faghih S., Esfandiari H. //
Front. Chem. 2022. doi 10.3389/fchem.2022.890696
31.
Zhou M., Xue Z., Cao M., Dong X.-Q., Zhang X. //
15.
Shi C.G., Zhang Y., Yuan W. // Am. J. Ther. 2016. Vol. 3.
Org. Biomol. Chem. 2016. Vol. 14. N 20. P. 4582. doi
P. e894. doi 10.1097/MJT.0000000000000236
10.1039/c6ob00540c
16.
Chmielewska E., Kafarski P. // Open Pharm. Sci. J.
32.
Adler P., Fadel A., Rabasso N. // Tetrahedron. 2014.
2016. Vol. 3. P. 56. doi 10.2174/1874844901603010056
Vol. 70. N 30. P. 4437. doi 10.1016/j.tet.2014.04.086
17.
Demkowicz S., Rachón J., Daśko M., Kozak W. // RSC
33.
Журавлева П.А., Колина А.И., Свинцицкая Н.И.,
Adv. 2016. Vol. 6. P. 7101. doi 10.1039/C5RA25446A
Догадина А.В. // ЖОХ. 2021. Т. 91. № 10. С. 1479;
18.
Studnik H., Liebsch S., Forlani G., Wieczorek D.,
Zhuravleva P.A., Kolina A.I., Svintsitskaya N.I.,
Kafarski P., Lipok J. // New Biotechnol. 2015. Vol. 32.
Dogadina A.V. // Russ. J. Gen. Chem. 2021. Vol. 91.
P. 1. doi 10.1016/j.nbt.2014.06.007
N 10. P. 2031. doi 10.1134/S1070363221100169
19.
Turhanen P.A., Vepsäläinen J.J., Peräniemi S. // Sci.
34.
Krylov A.S., Petrosian A.A., Piterskaya J.L., Svintsits-
Rep. 2015. Vol. 5. Article no. 8992.
kaya N.I., Dogadina A.V. // Beilstein J. Org. Chem.
20.
Chmielewska E., Kafarski P. // Molecules. 2016.
2019, Vol. 15. P. 1563. doi 10.3762/bjoc.15.159
Vol. 21. N 11. P. 1474. doi 10.3390/molecules21111474
35.
Svintsitskaya N.I., Dogadina A.V., Starova G.L.,
21.
Chmielewska E., Kafarski P. // Molecules. 2012. Vol.
17. N 9. P. 10928. doi 10.3390/molecules170910928
Trifonov R.E. // Tetrahedron Lett. 2014. Vol. 55. N 39.
22.
Widler L., Jaeggi K.A., Glatt M., Müller K., Bachmann R.,
P. 5381. doi 10.1016/j.tetlet.2014.08.018
Bisping M., Born A.-R., Cortesi R., Guiglia G., Jeker H.,
36.
Whitesell M.A., Kyba E.P. // Tetrahedron Lett. 1983.
Klein R., Ramseier U., Schmid J., Schreiber G.,
Vol. 24. N 16. P. 1679. doi 10.1016/S0040-
Seltenmeyer Y., Green J.R. // J. Med. Chem. 2002.
4039(00)81743-8
Vol. 45. N 17. P. 3721. doi 10.1021/jm020819i
37.
Whitesell J.K., Whitesell M.A. // Synthesis. 1983. N 7.
23.
Van Gelder J.M., Breuer E., Ornoy A., Schlossman A.,
P. 517. doi 10.1055/s-1983-30409
Patlas N., Golomb G. // Bone. 1995. Vol. 16. P. 511. doi
38.
Berry J.F., Roy M. // Compr. Coord. Chem. III. 2021.
10.1016/8756-3282(95)00081-N
Р. 406. doi 10.1016/B978-0-08-102688-5.00075-1
24.
Golomb G., Schlossman A., Saadeh H., Levi M.,
39.
Rao R.N., Chanda K. // Chem. Commun. 2022. Vol. 58.
Van Gelder J.M., Breuer E. // Pharm. Res. 1992.
N 3. P. 343. doi 10.1039/D1CC04602K
Vol. 9. P. 143. doi 10.1023/A:1018956516640
40.
Шехаде А., Дидковский Н.Г., Догадина А.В.,
25.
Palacios F., Ochoa de Retana A.M., Pascual S.,
Ионин Б.И. // ЖОХ. 2004. Т. 74. Вып. 10. С. 1750;
López de Munain R., Oyarzabal J., Ezpeleta J.M. //
Shekhade A., Didkovskii N.G., Dogadina A.V., Ionin B.I. //
Tetrahedron. 2005. Vol. 61. N 5. P. 1087. doi 10.1016/j.
tet.2004.11.061
Russ. J. Gen. Chem. 2004. Vol. 74. N 10. P. 1627. doi
26.
Palacios F., Ochoa de Retana A.M., Oyarzabal J. //
10.1007/s11176-005-0071-y
Tetrahedron. 1999. Vol. 55. N 18. P. 5947. doi 10.1016/
41.
Ионин Б.И., Петров А.А. // ЖОХ. 1965. Т. 35.
S0040-4020(99)00257-4
С. 1917.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022
1734
ДАКУО и др.
Reactions of Tetramethyl Ethynyldiphosphonate
with Substituted 2-Aminopyridines
K. N. Dakuoa, A. S. Krylova, and N. I. Svintsitskayaa,*
a St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: nsvincickaya@mail.ru
Received July 14, 2022; revised August 5, 2022; accepted August 7, 2022
The base-catalyzed hydroamination reaction of teramethyl ethynyldiphosphonate with substituted 2-aminopy-
ridines was studied. The reaction proceeds stereoselectively with the formation of (E)-enaminophosphonates. A
series of new phosphonoenamines, namely dimethyl [2-(dimethoxyphosphoryl)-2-(pyridin-2-ylamino)vinyl]-
phosphonates, was obtained.
Keywords: enamines, enaminophosphonates, alkinylphosphonates, aminopyridines, vicinal bisphosphonates
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 11 2022