ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 2, с. 181-188
УДК 547.854.4:544.362
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА
6-МЕТИЛУРАЦИЛ-5-КАРБОНИТРИЛА И ЕГО
N-МЕТИЛПРОИЗВОДНЫХ
© 2022 г. А. А. Ахияров, А. Н. Лобов, И. Б. Черникова, С. П. Иванов*
Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 71, Уфа, 450054 Россия
*e-mail: ivanov_sp@anrb.ru
Поступило в Редакцию 18 октября 2021 г.
После доработки 17 ноября 2021 г.
Принято к печати 18 ноября 2021 г.
Спектрофотометрическим методом определены константы кислотно-основного равновесия 6-метил-
урацил-5-карбонитрила в воде. Впервые получены 1,6-диметилурацил-5-карбонитрил и 3,6-диметил-
урацил-5-карбонитрил, их строение доказано методами спектроскопии ЯМР 1Н, 13С и 15N. На основе
полученных значений рKа всех трех соединений определена последовательность диссоциации в молекуле
6-метилурацил-5-карбонитрила в щелочных водных растворах.
Ключевые слова: производные урацила, кислотно-основное равновесие, 6-метилурацил-5-карбонитрил,
алкилирование
DOI: 10.31857/S0044460X22020032
6-Метилурацил - широко известное и применя-
для картирования белков в качестве вибрацион-
емое лекарственное средство [1]. Его химическая
ного зонда биомолекулы. Изучение производных
модификация по положениям С5 или С6 гетеро-
5-цианоурацила [7, 8] показало, что нитрильная
циклического кольца может привести к улучше-
группа в пиримидиновом кольце может использо-
нию известных и появлению новых биологических
ваться как вибрационный зонд в ИК спектроско-
свойств. Так, например, соединения с амино- или
пии при исследовании олигомеров ДНК.
гидроксигруппой в положении С5 6-метилурацила
Урацил и его С5 и/или С6 замещенные отно-
относятся к перспективным антиоксидантам [2-5].
сятся к слабым двухосновным кислотам [9]. При
Нитрильная группа [6] может быть использована
их взаимодействии с основаниями в водных рас-
Схема 1.
O
O
O
X
X
X
HN
H+
HN
3
4 5
OH-
N
OH-
2
1
6
H+
O
N Y
O
N
Y
O
N
Y
H
H
A
Б
X = Y = H - урацил; X = CH3, Y = H - тимин; X = H, Y = CH3 - 6-метилурацил; X = Br, Y = H - 5-бромурацил; X = NO2,
Y = H - 5-нитроурацил; X = NO2, Y = CH3 -6-метил-5-нитроурацил; X = OCH3, Y = CH3 - 5-метокси-6-метилурацил;
X = H, Y = NH2 - 6-аминоурацил; X = NH2, Y= NH2 - 5,6-диаминоурацил.
181
182
АХИЯРОВ и др.
свойства 5-фтор-, 5-хлор- и 5-бромурацилов [13]
в разных растворителях. Методом ЯМР было по-
казано, что в водно-щелочном растворе 5-фтору-
рацила образуются преимущественно анионы Б, а
из 5-хлор- и 5-бромурацилов - анионы А, однако
в диметилсульфоксиде при взаимодействии всех
5-галогенопроизводных урацила с эквимолярным
количеством KOH образуется анионная форма А.
Поскольку существует вероятность параллель-
ного образования обеих анионных форм произво-
дных урацила, для понимания механизма диссо-
циации необходимо исключить одновременный
отрыв протона от атомов N1 и N3. Константы
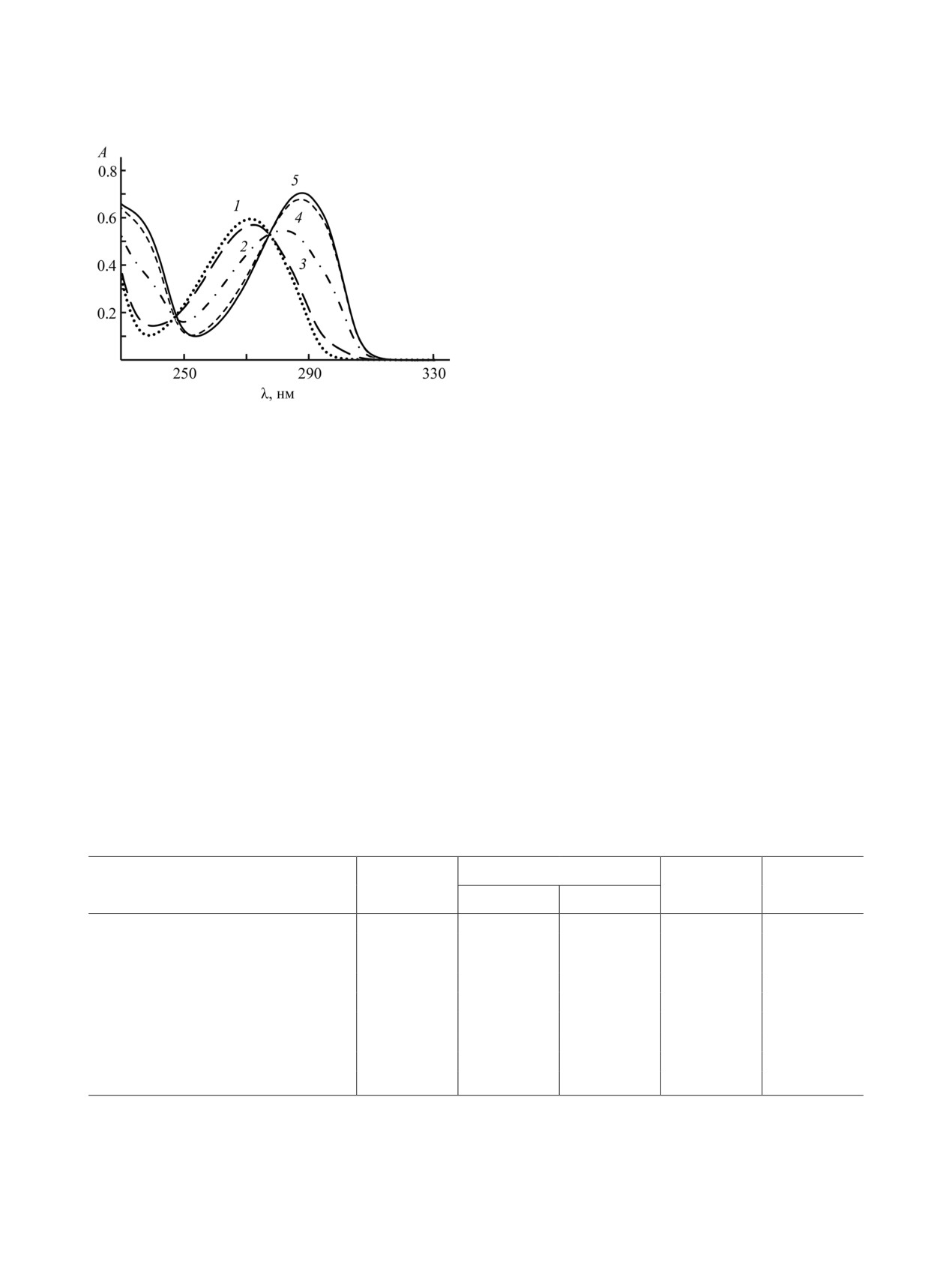
Рис. 1. УФ спектры водных растворов 6-метилура-
диссоциации по первой и второй ступени можно
цил-5-карбонитрила 1 при рН 2.8 (1), 5.9 (2), 7.0 (3),
определить исходя из значений pKa модельных со-
7.9 (4), 11.0 (5).
единений - производных урацила, в которых атом
водорода при N1 или N3 пиримидинового кольца
замещен метильной группой.
творах протон отрывается от атома N1 или N3
В ряде работ были экспериментально опреде-
(схема 1) с образованием анионов А или Б соответ-
лены константы диссоциации урацила, модельных
ственно. Место депротонирования по первой сту-
соединений, метилированных по атомам N1 и N3
пени зависит от природы заместителей при атомах
пиримидинового кольца урацила, и его некото-
углерода С5 и С6 пиримидинового кольца [10-12].
рых С5- и/или С6-замещенных (табл. 1). Как видно
Квантово-химическими методами изучено
из табл. 1, у большинства соединений разница в
влияние природы заместителей в положениях С5
значениях pKa N1- и N3-метилпроизводных менее
и С6 пиримидинового кольца на кислотно-основ-
0.5 ед. Исходя из этого можно предположить, что
ные свойства производных урацила в воде [12].
в щелочных водных растворах этих производных
В щелочных водных растворах для большинства
урацила одновременно могут образоваться анио-
рассмотренных производных урацила вероятность
ны А и Б.
образования аниона А больше, чем аниона Б. Ра-
Из 5-нитроурацила, 6-аминоурацила и 6-ме-
нее нами были исследованы кислотно-основные
тил-5-нитроурацила преимущественно образует-
Таблица 1. Значения рKа урацила и его производных в водных растворах (20-25°C)
рKа
Соединение
Метода
|ΔрKa|
Ссылка
N1CH3
N3CH3
Урацил
СТ
9.72
9.85
0.13
[9]
Тимин (5-метилурацил)
СТ
10.09
10.52
0.43
[14]
5-Нитроурацил
СТ
7.34
5.65
1.69
[15]
5-Бромурацил
СТ
8.30
8.30
0
[16]
6-Метилурацил
КТ
10.06
10.13
0.07
[17]
6-Аминоурацил
СТ
11.00
8.63
2.37
[18]
5-Метокси-6-метилурацил
ПТ
9.38
9.62
0.24
[19]
5-Нитро-6-метилурацил
СТ
7.40
6.78
0.62
[15]
5,6-Диаминоурацил
ПТ
9.50
8.75
0.75
[20]
а Методы определения: СТ - спектрофотометрическое титрование; КТ - кондуктометрическое титрование; ПТ-потенциометри-
ческое титрование.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА 6-МЕТИЛУРАЦИЛ-5-КАРБОНИТРИЛА
183
Таблица 2. Химические сдвиги 6-метилурацил-5-кар-
бонитрила 1 в нейтральном и щелочном водном рас-
творе в сравнении с химическими сдвигами соли 2 из
первой фракции
Химический сдвиг, м. д.
№ атома
1
1-NaOH
2
C2
149.81
157.86
156.76
C4
161.83
166.78
164.26
C5
86.48
84.20
80.87
C6
163.83
173.04
171.24
C7
114.90
117.28
118.88
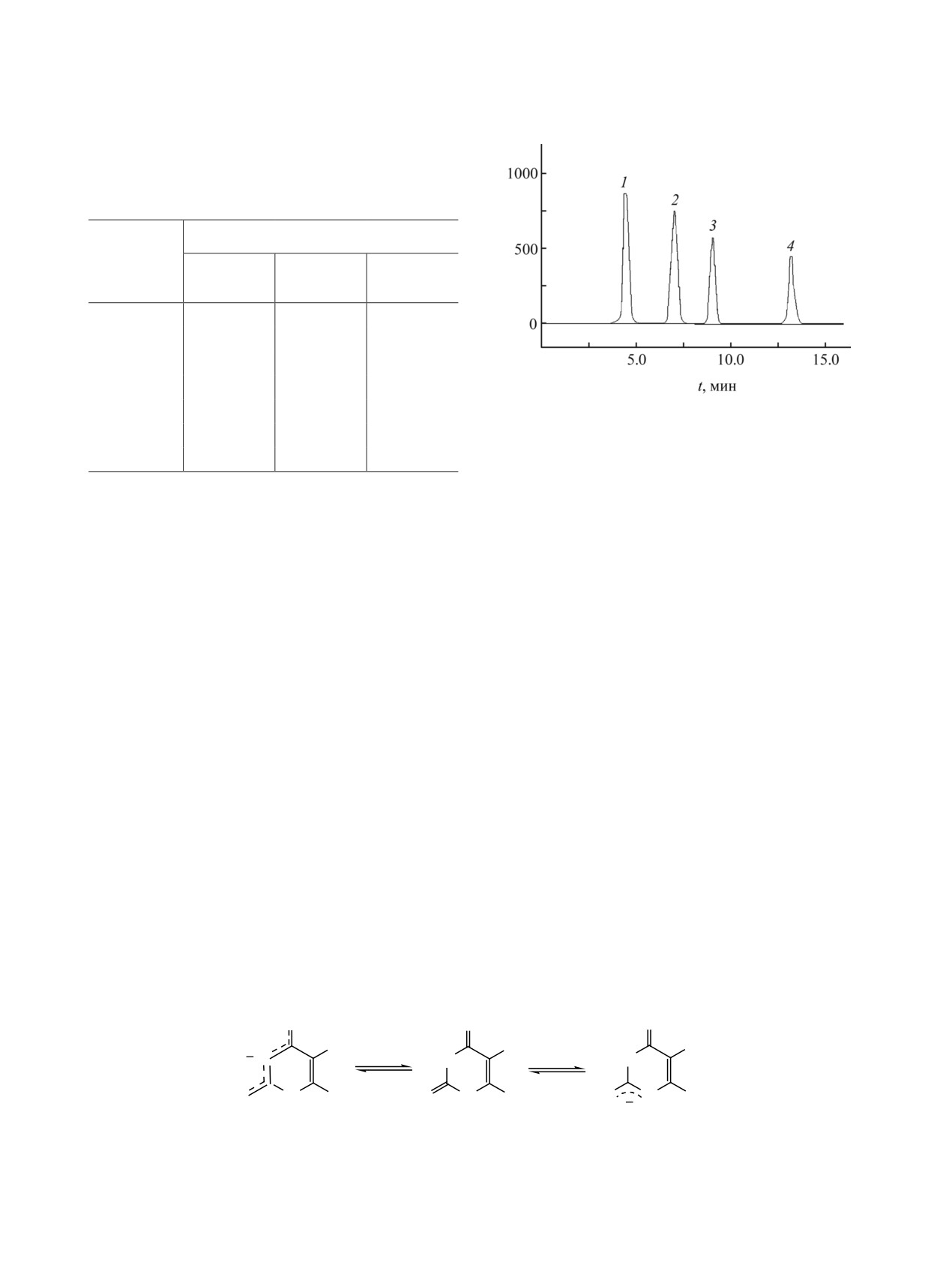
Рис. 2. Хроматограмма реакционной смеси после ме-
тилирования 6-метилурацил-5-карбонитрила 1 диме-
C8
18.45
20.87
22.43
тилсульфатом; пик 2 - исходное соединение 1, 1 - его
N1
148.55
197.20
215.06
натриевая соль 2, 3, 4 - метилпроизводные 3, 4.
ся анион А, следовательно, введение различных
записаны спектры ЯМР 1Н, 13С и 15N исходного
функциональных групп в положения 5 и 6 пири-
соединения и образца 1-NaOH в водном растворе.
мидинового кольца может существенно влиять на
При добавлении к водному раствору соединения
последовательность диссоциации производных
1 гидроксида натрия в мольном соотношении 1:1
урацила. Механизм диссоциации до конца не ис-
происходит существенное смещение в слабое поле
следован, в связи с чем актуально изучение кис-
сигналов атомов С2, С4 и С6, а также N1 (табл. 2).
лотно-основных свойств производных урацила.
Такие изменения в спектрах ЯМР свидетельству-
Для исследования кислотно-основных свойств
ют, видимо, об образовании анионных форм с от-
6-метилурацил-5-карбонитрила 1 были записаны
рывом протонов от атомов N1 и N3 пиримидиново-
спектры поглощения его водных растворов при
го кольца (схема 2).
различных значениях pH (рис. 1). При возраста-
Для изучения механизма депротонирования
нии рН наблюдается увеличение интенсивности
соединения 1 в водных растворах были синтези-
полосы поглощения при 271 нм с батохромным
рованы его N1- и N3-метилпроизводные. Ход ре-
смещением на 16 нм. Это обусловлено, вероятно,
акции контролировали методом ВЭЖХ. На рис. 2
образованием анионных форм соединения 1 или
приведена хроматограмма продуктов реакции ме-
его таутомерной перегруппировкой в водных рас-
тилирования. Как видно из рис. 2, образуются три
творах с рН > 7.
новых соединения, при этом в реакционной смеси
С целью изучения структурных изменений со-
присутствует неизрасходованное исходное соеди-
единения 1 в щелочных водных растворах были
нение.
Схема 2.
O
O
O
7
CN
CN
CN
N
H+
OH-
HN
HN
3
4 5
1
+
OH-
2
6
8
H
O N
CH3
O
N
CH3
H
N CH3
H
H
1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
184
АХИЯРОВ и др.
м. д.
м. д.
м. д.
м. д.
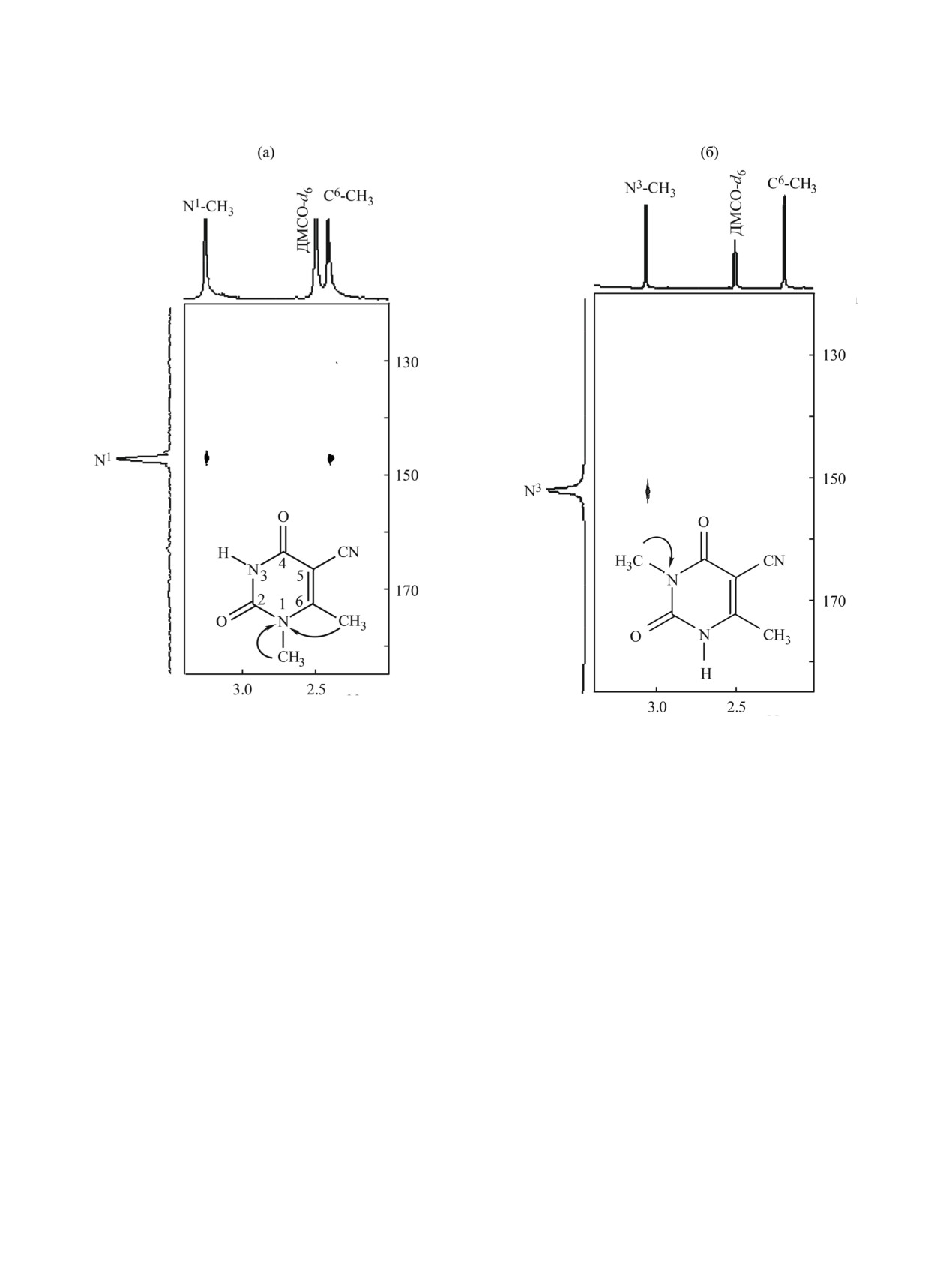
Рис. 3. Корреляционные спектры ЯМР {1H, 15N} HMBC соединений из 3-й (а) и 4-й (б) фракций.
Синтезированные вещества фракционирова-
и в незначительной степени - с отрывом протона
ли методом полупрепаративной ВЭЖХ. Номера
от атома N3 (табл. 2).
фракций соответствуют пикам на хроматограмме
Данные спектров {1H, 13C} HMBC 3-й фракции,
(рис. 2). При идентификации соединений мето-
в которых сигнал протонов метильной группы при
дом ЯМР спектроскопии установлено, что хими-
3.25 м. д. коррелирует с сигналами углеродных ато-
ческие сдвиги атомов углерода в спектре ЯМР 13С
мов С2 (152.53 м. д.) и С6 (167.63 м. д.), свидетель-
соединения из 1-й фракции близки по значениям
ствуют об образовании 1,6-диметилурацил-5-кар-
с химическими сдвигами смеси соединения 1 с
бонитрила 3. Это подтверждается корреляциями в
NaOH в соотношении 1:1 (табл. 2). По сравнению
спектре {1H, 15N} HMBC сигналов протонов обеих
с нейтральной формой соединения 1 (фракция 2)
метильных групп (2.45 и 3.25 м. д.) с сигналом ато-
в обоих спектрах наибольшие изменения происхо-
ма N1 (147.06 м. д.) (рис. 3а).
дят у сигналов атомов С2, С6 и N1, сигнал атома
Анализ 4-й фракции методом спектроскопии
С4 изменяется в меньшей степени. Эти результаты
ЯМР показал в спектрах {1H, 13C} HMBC взаи-
свидетельствуют об образовании натриевой соли
модействие между протонами метильной груп-
6-метилурацил-5-карбонитрила 2 (фракция 1) с
пы (3.05 м. д.) при атоме N3 и атомами углерода
преимущественным отрывом протона от атома N1
С2 (154.05) и С4 (162.28 м. д.), а также протонов
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА 6-МЕТИЛУРАЦИЛ-5-КАРБОНИТРИЛА
185
Схема 3.
O
O
O
O
CN
CN
CN
H3C
CN
HN
Me2SO4
HN
HN
N
+
+
NaOH
O
N
CH3
O
N CH3
O
N CH3
O
N
CH3
H
H
CH3
Na
1
2
3
4
метильной группы при атоме С6 (2.26 м. д.) с
N1, сходство УФ спектров соединений 1 и 4 при
нитрильной группой (117.42 м. д.) и атомом С5
увеличении pH их водных растворов подтвержда-
(82.74 м. д.). В спектре ЯМР {1H, 15N} HMBC на-
ет образование анионной формы соединения 1 с
блюдается корреляция между протонами метиль-
отрывом протона от атома азота N1.
ной группы (3.05 м. д.) и атомом N3 (151.92 м. д.)
Методом спектрофотометрического титрования
(рис. 3б). Следовательно, в 4-й фракции находится
определены рKа соединения 1 и его моно-N-ме-
3,6-диметилурацил-5-карбонитрил 4.
тилзамещенных (табл. 3) в водных растворах.
Образования соединения с метильными груп-
Поскольку константы диссоциации соединения
пами при атомах N1 и N3 не наблюдалось. Реакция
1 определены впервые, сравнить их с литератур-
алкилирования соединения 1 диметилсульфатом в
ными данными не представляется возможным,
щелочном водном растворе приведена на схеме 3.
однако у близкого соединения - 2′-дезоксиури-
дин-5-карбонитрила - рKа 6.47 [21], что немного
Для изучения последовательности диссоци-
меньше полученного нами значения рKа для сое-
ации соединения 1 необходимо определить рKа
динения 1.
его N-метилпроизводных. На рис. 4 представлены
наиболее характерные для выделенных продуктов
Исходя из полученных значений рKа (табл. 3)
алкилирования УФ спектры в кислой, нейтраль-
можно предположить порядок диссоциации сое-
ной и щелочной средах (растворитель - вода).
динения 1: отрыв протона по первой ступени про-
исходит от атома N1, по второй - от атома N3, рKа
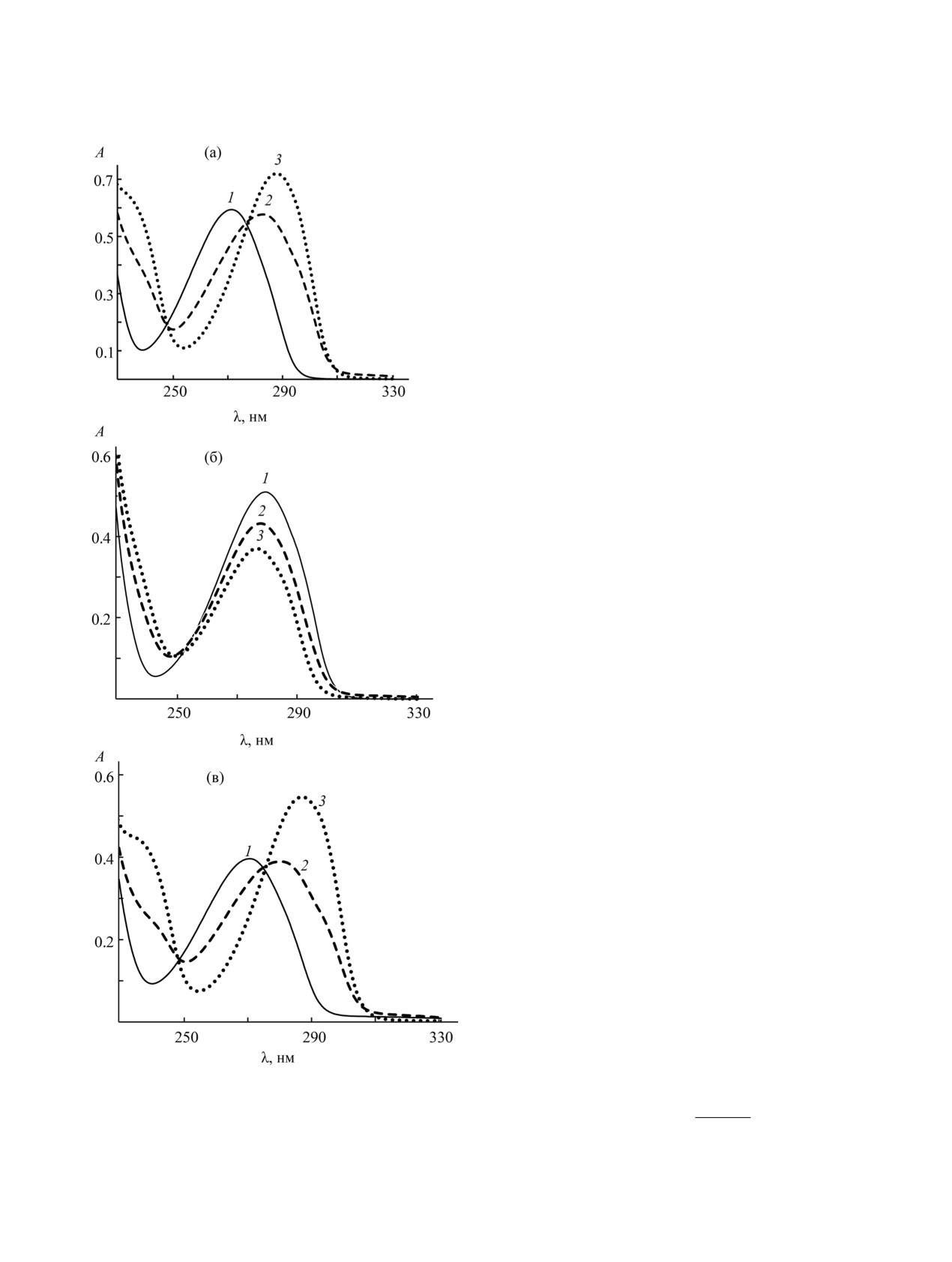
Максимум полосы поглощения в спектрах со-
7.23 и 7.87 соответственно.
единений 1 и 4 находится при 271 нм, при увели-
чении значений рН происходит смещение макси-
Полученные константы диссоциации соеди-
мума на 16 и 17 нм соответственно (рис. 4а, в). В
нения 1 и его метилпроизводных можно исполь-
спектре водного раствора соединения 3 (рис. 4б),
зовать при определении соотношения анионных
λmax 279 нм, с увеличением рН интенсивность
форм соединения 1 по системе уравнений (1) [22].
полосы поглощения уменьшается. Так как отрыв
протона в соединении 4 возможен только от атома
(1)
Здесь рKа(3), pKa(4) - константы диссоциации
соединений 3 и 4 - метилированных форм соеди-
Таблица 3. Значения рKа соединений 1, 3, 4, найденные
нения 1; рKа(1) - константа диссоциации 6-мети-
спектрофотометрическим методом в воде при 25°С
- мольные доли
лурацил-5-карбонитрила; x1 и x2
A-
Соединение
рKа
λmaxHA → λmax
анионных форм, образующиеся при диссоциации
1
7.00±0.02
271 → 287
метилпроизводных. Рассчитанные доли анионных
3
7.87±0.04
279 → 279
форм, образующиеся при отрыве протона от ато-
4
7.23±0.06
271 → 288
мов N1 и N3, составляют 0.64 и 0.36 соответственно.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
186
АХИЯРОВ и др.
Таким образом, при исследовании кислотно-ос-
новного равновесия
6-метилурацил-5-карбони-
трила в водно-щелочных растворах методами УФ
и ЯМР спектроскопии с использованием синтези-
рованных N-метилзамещенных производных было
установлено, что по первой ступени происходит
отрыв протона от атома азота N1, по второй сту-
пени - от атома азота N3. При этом соотношение
анионных форм составляет 2:1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали реактивы: NaOH (Ч,
1310-58-3, Реахим), фиксанальный 0.1 М. рас-
твор HCl, КН2РО4 квалификации ХЧ (7778-77-0,
ОАО «Реатэкс») и Na2B4O7 (ХЧ, 12045-88-4, ОАО
«Реатэкс»). 6-Метилурацил-5-карбонитрил 1 син-
тезирован по методике [23, 24] с чистотой более
95% (ВЭЖХ).
Алкилирование соединения 1 диметилсульфа-
том проводили в водно-щелочных растворах по
методике [25]. За ходом реакции следили методом
ВЭЖХ. После прекращения реакции продукты
алкилирования фракционировали методом полу-
препаративной ВЭЖХ на хроматографе Стайер
(Аквилон, Россия) с использованием колон-
ки Pursuit C18 250×10.0 мм, 10 мкм. Элюент -
CH3CN-H2O, 10:90 (об.), скорость потока - 3 мл/
мин. Спектры ЯМР 1Н и 13С записывали на им-
пульсном спектрометре Bruker Avance III, рабочие
частоты: 500.13 (1Н), 125.47 (13С) и 50.67 МГц (15N)
с использованием 5 мм датчика с Z-градиентом
РАВВО при постоянной температуре (298 K) об-
разца в ДМСО-d6. Химические сдвиги приведены
относительно сигналов растворителя. Химические
сдвиги ЯМР 15N приведены относительно сигнала
внешнего стандарта - жидкого аммиака. Спектры
поглощения в водных растворах при различных
рН записаны на спектрофотометре Shimadzu UV-
1800 в диапазоне 230-330 нм, кварцевые кюветы с
толщиной поглощающего слоя 1 см.
Значения рKа определяли спектрофотометриче-
ским методом [26] по формуле (2).
Рис. 4. УФ спектры водных растворов соединений:
(а) 1, 1 - рН 3.1, 2 - рН 7.0, 3 - рН 11.1; (б) 3, 1 - рН
A
A
- -
A
(2)
3.0, 2 - рН 7.9, 3 - рН 11.0; (в) 4, 1 - рН 3.1, 2 - рН 7.1,
pK
=
pH+lg
a
HA
A−A
3 - рН 11.2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА 6-МЕТИЛУРАЦИЛ-5-КАРБОНИТРИЛА
187
Здесь А - оптическая плотность смеси нейтраль-
ной молекулы и аниона; АА- - оптическая плот-
org/0000-0002-1918-7210
ность анионной формы молекулы; АНA - оптиче-
ФОНДОВАЯ ПОДДЕРЖКА
ская плотность нейтральной формы молекулы.
Для определения констант диссоциации ис-
Работа выполнена в рамках государствен-
пользовали буферные растворы, приготовленные
ных заданий Министерства науки и высшего
смешиванием 0.1 М. раствора KН2РО4 и 0.05 М.
образования
(№ AAAA-A20-120012090029-0 и
раствора Na2B4O7. Значения рН регистрировали на
AAAA-A20-120012090026-9) с использованием
рН-метре рН-150МИ с использованием комбини-
оборудования Центров коллективного пользова-
рованного стеклянного электрода ЭСК-10307. На-
ния «Химия» и «Агидель» Уфимского федераль-
стройку электрода проводили методом двухточеч-
ного исследовательского центра РАН.
ной калибровки с использованием фиксанальных
стандартных буферных растворов, рН 6.86 и 9.18
КОНФЛИКТ ИНТЕРЕСОВ
(ЗАО НПИП «Уралхиминвест»), растворитель -
Авторы заявляют об отсутствии конфликта
бидистиллят.
интересов.
Натриевая соль 6-метилурацил-5-карбони-
трила (2). Выход 0.011 г (11%). Спектр ЯМР 1H
СПИСОК ЛИТЕРАТУРЫ
(ДМСО-d6), δ, м. д.: 2.26 с (3Н, С6CН3). Спектр
1.
Мышкин В.А., Бакиров А.Б. Оксиметилурацил
ЯМР 13С (ДМСО-d6), δС, м. д.: 22.43 (С6CН3), 80.87
(Очерки экспериментальной фармакологии). Уфа:
(С5), 118.88 (С7), 156.76 (С2), 164.26 (С4) 171.24
ДАР, 2001. 218 с.
(C6). Спектр ЯМР 15N (ДМСО-d6): δN 215.06 м. д.
2.
Гимадиева А.Р., Мышкин В.А., Мустафин А.Г.,
(N1).
Чернышенко Ю.Н., Фаттахов А.Х., Абдрахма-
1,6-Диметилурацил-5-карбонитрил (3). Вы-
нов И.Б., Толстиков Г.А. // Докл. АН. 2013. Т. 448. № 4.
ход 0.005 г (5%). Спектр ЯМР 1H (ДМСО-d6), δ,
С. 484. doi 10.7868/S0869565213040294; Gimadie-
м. д.: 2.45 с (3Н, С6CН3), 3.25 с (3Н, N1CН3). Спектр
va A.R., Mustafin A.G., Chernyschenko Y.N., Fatta-
ЯМР 13С (ДМСО-d6), δС, м. д.: 21.10 (С6CН3), 33.52
khov A.K., Abdrakhmanov I.B., Myshkin V.A., Tolsti-
(N1CH3), 89.60 (С5), 117.05 (С7), 153.53 (С2), 164.69
kov G.A. // Doklady Biol. Sci. 2013. Vol. 448. N 1. P. 7.
(С4) 167.63 (C6). Спектр ЯМР 15N (ДМСО-d6): δN
doi 10.1134/S0012496613010110
147.06 м. д. (N1). Масс-спектр, m/z (Iотн, %): 163.9
3.
Кабальнова Н.Н., Грабовский С.А., Нугуманов Т.Р.,
(100) [M]-.
Иванов С.П., Муринов Ю.И. // Изв. АН. Сер. хим.
2008. № 11. С. 2223; Kabalnova N.N., Grabov-
3,6-Диметилурацил-5-карбонитрил (4). Вы-
skiy S.A., Nugumanov T.R., Ivanov S.P., Murinov Y.I. //
ход 0.010 г (10%). Спектр ЯМР 1H (ДМСО-d6), δ,
Russ. Chem. Bull. 2008. Vol. 57. N 11. P. 2265. doi
м. д.: 2.26 с (3Н, С6CН3), 3.05 с (3Н, N3CН3). Спектр
10.1007/s11172-008-0318-y
ЯМР 13С (ДМСО-d6), δС, м. д.: 20.81 (С6CН3), 26.82
4.
Якуповa Л.Р., Насибуллинa Р.А., Гимадиева А.Р., Са-
(N3CH3), 82.74 (С5), 117.42 (С7), 154.05 (С2), 162.28
фиуллин Р.Л. // Кинетика и катализ. 2019. Т. 60. № 6.
(С4) 166.28 (C6). Спектр ЯМР 15N (ДМСО-d6): δN
С. 763; Yakupova L.R., Nasibullina R.A., Gimadieva A.R.,
151.92 м. д. (N3). Масс-спектр, m/z (Iотн, %): 163.9
Safiullin R.L. // Kinet. Catal. 2019. Vol. 60. N 6. P. 783.
(100) [M]-.
doi 10.1134/S0453881119060169
5.
Гимадиева А.Р., Чернышенко Ю.Н., Абрахма-
ИНФОРМАЦИЯ ОБ АВТОРАХ
нов И.Б., Мустафин А.Г. Синтез, модификации и
биологическая активность урацилов, Уфа: Гилем,
Ахияров Айдар Айратович, ORCID: https://
2013. 176 с.
orcid.org/0000-0001-5852-8447
6.
Suydam I.T., Boxer S.G. // Biochem. 2003. N 42.
Лобов Александр Николаевич, ORCID: https://
P. 12050. doi 10.1021/bi0352926
orcid.org/0000-0002-9223-508X
7.
Watson M.D., Gai X.S., Gillies A.T., Brewer S.H.,
Черникова Инна Борисовна, ORCID: https://
Fenlon E.E. // J. Phys. Chem. (B). 2008. Vol. 112.
orcid.org/0000-0002-1773-855X
N 42. Р. 13188. doi 10.1021/jp8067238
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
188
АХИЯРОВ и др.
8.
Schmitz A.J. Hogle D.G., Gai, X.S., Fenlon E.E.,
Gen. Chem. 2018. Vol. 88. N 6. P. 1076. doi 10.1134/
Brewer S.H. Tucker M.J. J. // Phys. Chem. (B). 2016.
S107036321806004X
Vol. 120. N 35. P. 9387. doi 10.1021/acs.jpcb.6b07212
20.
Pfeiderer W. // Lieb. Ann. Chem. 1971. Bd 747. S. 111.
9.
Jonas J., Gut J. // Collect. Czech. Chem. Commun.
doi 10.1002/jlac.19717470113
1962. Vol. 27. N 3. P. 716. doi 10.1135/cccc19620716
21.
Ishikawa R., Kojima C., Ono A., Kainosho M. // Magn.
10.
Ilyina M.G., Khamitov E.M., Ivanov S.P., Mustafin A.G.
Res. Chem. 2001. Vol. 39. P. 159. doi 10.1002/mrc.941
Khursan S.L. // J. Phys. Chem. (A). 2018. Vol. 122. N 1.
22.
Петрова С.Ф., Нугуманов Т.Р., Хазимуллина Ю.З.,
P. 341. doi 10.1021/acs.jpca.7b09330
Гимадиева А.Р., Иванов С.П. // ЖОХ. 2020. Т. 90.
11.
Pfleiderer W., Deiss H. // Isr. J. Chem. 1968. N 6. P. 603.
Вып. 5. С. 690. doi 10.31857/S0044460X20050054;
doi 10.1002/ijch.196800078
Petrova S.F., Nugumanov T.R., Khazimullina Y.Z.,
12.
Ilyina M.G., Khamitov E.M., Mustafin A.G., Khur-
Gimadieva A.R., Ivanov S.P. // Russ. J. Gen. Chem. 2020.
san S.L. // J. Mol. Graph. Model. 2018. Vol. 79. P. 65.
Vol. 90. N 5. P. 794. doi 10.1134/S1070363220050059
doi 10.1016/j.jmgm.2017.11.007
13.
Abdrakhimova G.S., Ovchinnikov M.Yu., Lobov A.N.,
23.
Wiley R.H., Yamamoto Yu. // J. Org. Chem. 1960.
Spirikhin L.V., Khursan S.L., Ivanov S.P. // J.
Vol. 25. N 11. P. 1906. doi 10.1021/jo01081a020
Mol. Struct. 2018. Vol. 1158. P. 51. doi 10.1016/j.
24.
Черникова И.Б., Сагадатова И.З., Юнусов М.С.,
molstruc.2018.01.013
Талипов Р.Ф. // ЖОрХ. 2019. Т. 55. Вып. 3. C. 380;
14.
Wittenburg E. // Chem. Ber. 1966. Bd 99. S. 2391. doi
Chernikova I.B., Sagadatova I.Z., Yunusov M.S., Tali-
10.1002/cber.19660990737
pov R.F. // Russ. J. Org. Chem. 2019. Vol. 55 N 3.
15.
Blank H.U., Fox J.J. // J. Heterocycl. Chem. 1970. Vol. 7.
P. 325. doi 10.1134/S1070428019030084
N 3. P. 735. doi 10.1002/jhet.5570070351
25.
Кривоногов В.П., Толстиков Г.А., Муринов Ю.И., За-
16.
Berens K., Shugar D. // Acta biochim. Pol. 1963.
рудий Ф.С., Лазарева Д.Н., Исмагилова А.Ф., Волко-
Vol. 10. N 1. P. 25.
ва С.С., Сахаутдинова Г.М., Спирихин Л.В., Абдрах-
17.
Wood J.K. // J. Chem. Soc. Trans. 1906. Vol. 89. P. 1831.
манов И.Б., Хисамутдинов Р.А., Кривоногова И.И. //
18.
Станкевич Э.И., Попелис Ю.Ю., Гринштейн Э.Э.,
Хим.-фарм. ж. 1993. Т. 27. № 2. С. 38; Krivono-
Озола А.Я., Дубур Г.Я. // ХГС. 1970. Т. 6 № 1. С. 122;
gov V.P., Tolstikov G.A., Murinov Yu.I., Zarudii F.S.,
Stankevich E.I., Popelis Yu.Yu., Grinshtein E.E.,
Lazareva D.N., Ismagilova A.F., Volkova S.S.,
Ozola A.Ya., Dubur G.Y. // Chem. Heterocycl. Compd.
Sakhautdinova G.M., Spirikhin L.V., Abdrakhmanov I.B.,
1970. Vol. 6. N 1. P. 116. doi 10.1007/BF00475441
19.
Петрова С.Ф., Нугуманов Т.Р., Спирихин Л.В.,
Krivonogova I.I. // Pharm. Chem. J. 1993. Vol. 27. N 2.
Муринов Ю.И., Иванов С.П. // ЖОХ. 2018. Т. 88.
P. 112. doi 10.1007/BF00781072
Вып. 6. С. 895; Petrova S.F., Nugumanov T.R.,
26.
Albert A., Serjeant E.P. Ionization constants of acids and
Spirikhin L.V., Murinov Y.I., Ivanov S.P. // Russ. J.
bases. London: Wiley, 1962. P. 179.
Acid-Basic Properties of 6-Methyluracil-5-carbonitrile
and Its N-Methyl Derivatives
A. A. Akhiyarov, A. N. Lobov, I. B. Chernikova, and S. P. Ivanov*
Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: ivanov_sp@anrb.ru
Received October 18, 2021; revised November 17, 2021; accepted November 18, 2021
The constants of acid-base equilibrium of 6-methyluracil-5-carbonitrile in water were determined spectropho-
tometrically. For the first time, 1,6-dimethyluracil-5-carbonitrile and 3,6-dimethyluracil-5-carbonitrile were
obtained, their structures were proved by 1H, 13C and 15N NMR spectroscopy. Based on the pKa values obtained
for all three compounds, the sequence of dissociation in the 6-methyluracil-5-carbonitrile molecule in alkaline
aqueous solutions was determined.
Keywords: uracil derivatives, acid-base equilibrium, 6-methyluracil-5-carbonitrile, alkylation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022