ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 2, с. 195-203
УДК 547.594.3
СИНТЕЗ И АНТИМИКРОБНАЯ АКТИВНОСТЬ
НОВЫХ ПРОИЗВОДНЫХ ГИДРАЗОНОВ
И 1,2,4-ТРИАЗОЛ-3-ТИОНА
© 2022 г. А. Н. Янкинa, Н. В. Носоваb, В. В. Новиковаb, В. Л. Гейнb,*
a Национальный исследовательский университет ИТМО, Санкт-Петербург, 197101 Россия
bПермская государственная фармацевтическая академия Министерства здравоохранения Российской Федерации,
ул. Полевая 2, Пермь, 614990 Россия
*e-mail: geinvl48@mail.ru
Поступило в Редакцию 12 ноября 2021 г.
После доработки 12 ноября 2021 г.
Принято к печати 28 ноября 2021 г.
Взаимодействие N1,N3,2-триарил-6-гидрокси-6-метил-4-оксоциклогексан-1,3-дикарбоксамидов с ги-
дразидами кислот и тиосемикарбазидом привело к образованию новых производных гидразонов и
1,2,4-триазол-3-тиона соответственно. Структура полученных соединений установлена с помощью ИК
и ЯМР 1Н спектроскопии. Исследована антимикробная активность некоторых полученных соединений.
Ключевые слова: гидразиды кислот, тиосемикарбазид, гидразоны, 1,2,4-триазол-3-тион, антимикробная
активность
DOI: 10.31857/S0044460X22020056
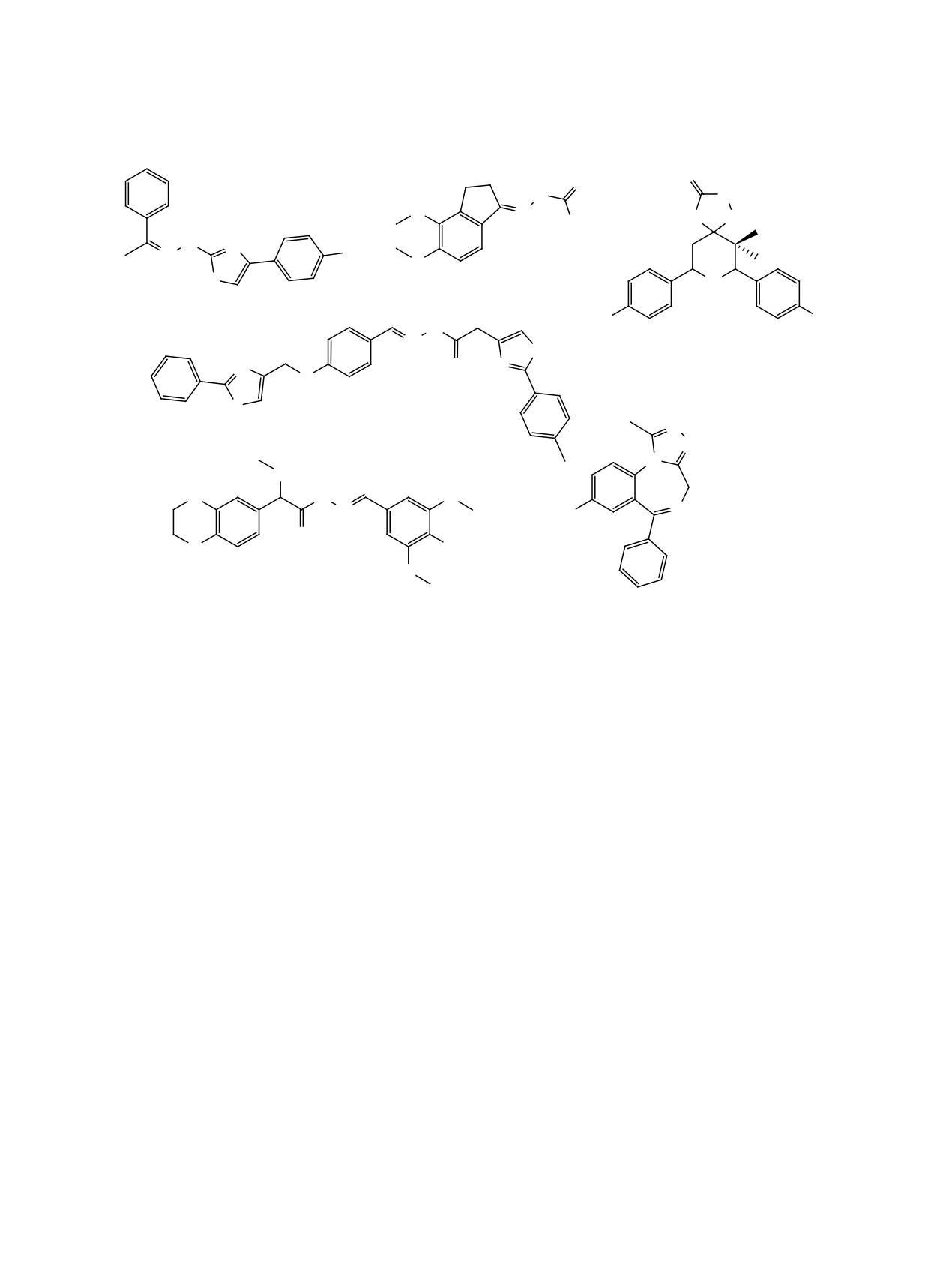
Синтез и установление практической цен-
активных соединений [16, 17], например, в би-
ности гидразонов актуальны, так как фрагмент
циклических анксиолитических лекарственных
гидразона присутствует в структуре ряда биоло-
средствах - эстазоламе, алпразоламе (схема 1),
гически активных соединений [1], обладающих
в триптановом препарате агониста 5-HT1 (риза-
антимикробной [2-5], противовоспалительной [6],
триптане) и в антимикробных препаратах на осно-
анальгетической [7], антипротозойной [8], проти-
ве спиропиперидинил-1,2,4-триазолидин-3-тиона
вотуберкулезной [9], противосудорожной [10] и
[18-22]. Для синтеза обладающих антимикроб-
кардиопротекторной активностью [11]. Комбина-
ной активностью гетероциклических соединений
ция различных функциональных групп в гидразо-
с фрагментом 1,2,4-триазола-3-тиона используют
нах приводит к большому количеству соединений
реакцию кетонов с тиосемикарбазидом [23-27].
с уникальными физическими и химическими свой-
Таким образом, синтез соединений с фрагмен-
ствами. Некоторые из них могут применяться в ле-
тами гидразонов и 1,2,4-триазола-3-тиона пер-
чении заболеваний центральной нервной системы
спективен при получении биологически активных
[12], а также в молекулярно-таргетной терапии
соединений и для создания на их основе новых ле-
медикаментозного лечения рака [13, 14]. Струк-
карственных препаратов.
турные аналоги гидразонов показали хорошие ре-
На схеме 1 приведены примеры биологически
зультаты при исследовании их в качестве промо-
активных гидразонов и производного 1,2,4-триа-
торов роста растений вида Nicotiana tabacum L. и
зол-3-тиона, обладающие антимикробной (1) [4],
Arabidopsis thaliana [15].
антипротозойной (2) [8], антимикробной (3) [21],
Фрагмент 1,2,4-триазола-3-тиона встречается
противовоспалительной активностью (4) [6]. Ги-
в структуре многих природных и биологически
дразон 5 ингибирует фермент фосфодиэстеразу
195
196
ЯНКИН и др.
Схема 1.
S
H
S
N
NH
O
N
HN
NH
NH2
H
N
N
N
I
O
2
S
N
H
1
H
R
R
N
R = Me; OMe
N
S
N
O
N
3
O
S
4
N
N
N
O
H
O
N
O
N
Cl
N
O
O
Br
O
5
Aлпразолам
10А, ответственный за неврологические и психо-
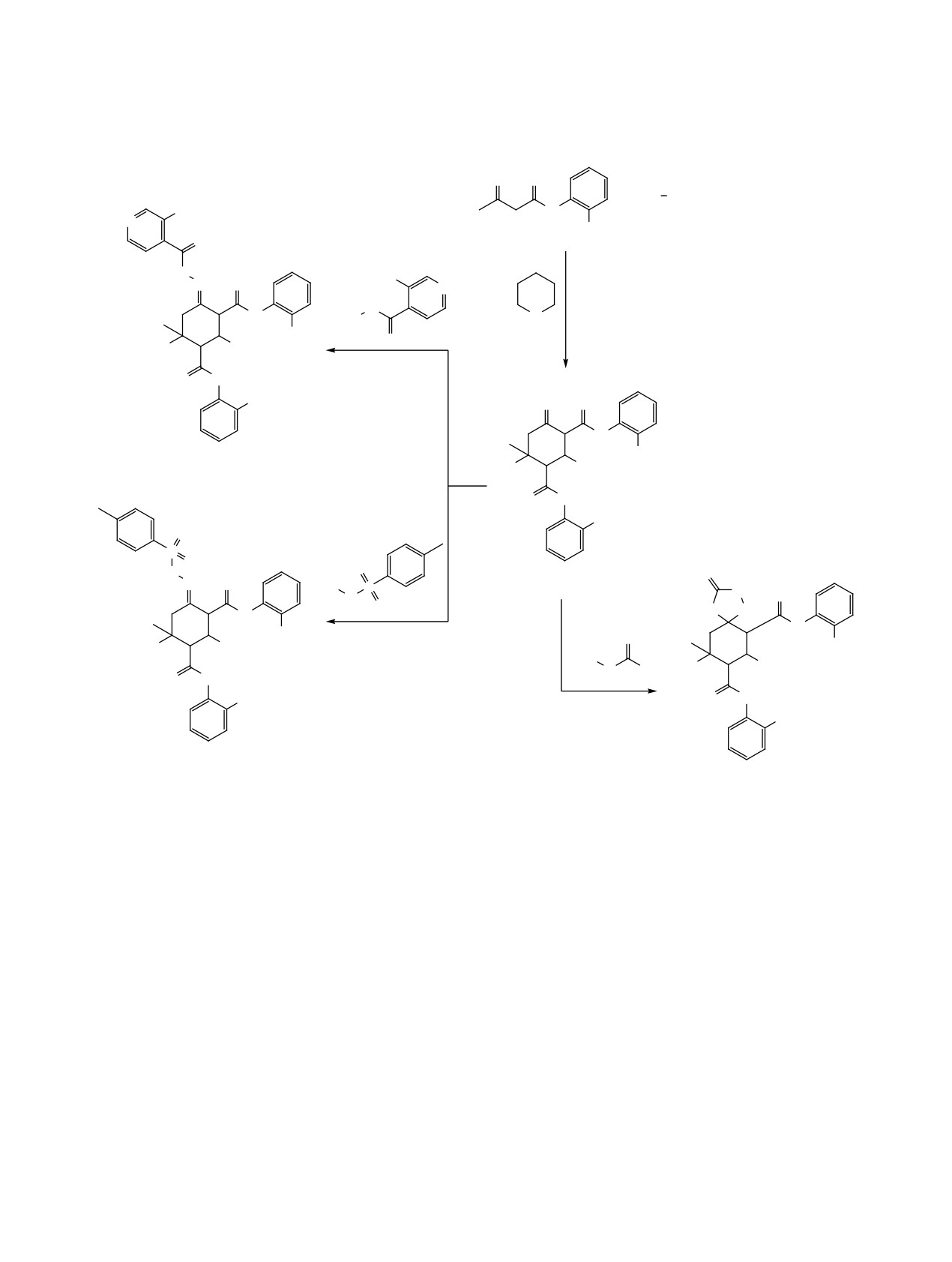
гексан-1,3-дикарбоксамидов 6а-м с гидразидами
логические расстройства (шизофрения) [14].
салициловой, изоникотиновой и п-толуолсульфо-
новой кислот при кипячении в этаноле протекает
Ранее нами были получены новые производные
по карбонильной группе алицикла с образовани-
оксоциклогексан-1,3-дикарбоксамидов конденса-
ем соответствующих гидразонов 7а-г, 8а, б, 9а-е
цией амидов ацетоуксусной кислоты с ароматиче-
(схема 2).
скими альдегидами в присутствии основного ка-
тализатора пиперидина в этаноле при комнатной
Гидразонная форма соединений
7-9 под-
температуре [28-31]. Были изучены реакции полу-
тверждается присутствием в спектрах ЯМР дан-
ченных соединений с N-нуклеофилами [29] и их
ных соединений взаимодействия протона при
окисление по Байеру-Виллигеру [33].
атоме С3 цикла (3.65-4.42 м. д.) с протоном при
атоме С2 цикла (3.12-4.04 м. д.). Сигнал протона
В продолжение изучения свойств производных
группы NH, не связанной с бензольным циклом,
циклогексанона [28-34] и с целью получения но-
также доказывает предложенную структуру. Ве-
вых соединений, обладающих потенциальной
биологической активностью, мы исследовали вза-
личины химических сдвигов синглетов протонов
двух групп NH ариламидных заместителей сдви-
имодействие N1,N3,2-триарил-6-гидрокси-6-ме-
нуты в область более сильного поля по сравнению
тил-4-оксоциклогексан-1,3-дикарбоксамидов
с химическими сдвигами исходных соединений
с гидразидами кислот и с тиосемикарбазидом.
6а-п [28-30].
Были получены новые производные гидразонов
и 1,2,4-триазола-3-тиона соответственно. Взаимо-
Образование гидразоной формы в соединениях
действие эквимолярных количеств 4-оксоцикло-
7-9 можно объяснить ее стабилизацией за счет ме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
СИНТЕЗ И АНТИМИКРОБНАЯ АКТИВНОСТЬ
197
Схема 2.
O
O
2
+ R2 CHO
R3
N
X
H
R1
O
HN
R3
N O
X
H
EtOH
N
N
N
-H2O
H2N
H
H
R1
O
HO
R2
EtOH, ∆
O NH
-H2O
R1
O O
N
H
7а-г, 8а, б
R1
HO
R2
O NH
R1
O
S
O
O
HN
S
N O
H2N
S
6а-п
NH
N
3
O
H O
HN 5 NH
N
H
N
R1
EtOH, ∆
S
10
6
H
HO
R2
R1
-H2O
987
H2N
N
NH
HO
R2
2
O NH
H
R1
O NH
EtOH, ∆
-H2O
R1
9а-е
10а-е
R1 = H, R2 = 4-BrC6H4, R3 = OH, X = CH (6а, 7a); R1 = Me, R2 = 4-ClC6H4, R3 = OH, X = CH (6б, 7б); R1 = Me, R2 = пири-
дин-3-ил, R3 = OH, X = CH (6в, 7в); R1 = Cl, R2 = 4-Me2NC6H4, R3 = OH, X = CH (6г, 7г); R1 = H, R2 = 3,4-(MeO)2C6H3,
R3 = H, X = N (6д, 8a); R1 = MeO, R2 = 4-MeC6H3, R3 = H, X = N (6е, 8б); R1 = H, R2 = Ph (6ж, 9a), 4-Me2NC6H4 (6з, 9б),
4-Et2NC6H4 (6и, 9в); R1 = MeO, R2 = Ph (6к, 9г), 4-i-PrC6H4 (6л, 9д), 4-Me2NC6H4 (6м, 9е); R1 = H, R2 = 4-EtOC6H4 (6н,
10а); R1 = MeO, R2 = тиен-2-ил (6о, 10б), пиридин-3-ил (6п, 10в); R1 = Cl, R2 = 4-Me2NC6H4 (6г, 10г).
жмолекулярных водородных связей. Гетероцикли-
Отсутствие в ИК спектрах соединений 10а-г
зация, по-видимому, не протекает из-за низкой ну-
валентных колебаний сопряженной группы СО
клеофильности атомов азота в гидразидах кислот.
алицикла, связи С=С и присутствие полос валент-
При взаимодействии производных циклогекса-
ных колебаний фрагмента N(C=S)N при 1336-
нона 6г, н-п с тиосемикарбазидом в эквимолярном
1360 см-1, С=S при 1592-1600 см-1, а также нали-
соотношении в аналогичных условиях получе-
чие сигналов протонов групп NH при атомах С1 и
ны N6,N8,7-триарил-9-гидрокси-9-метил-3-тиок-
С2 (8.05-8.54 м. д.), С4 (10.33-10.46 м. д.) и сигна-
со-1,2,4-триазаспиро[4.5]декан-6,8-дикарбоксами-
ла протона при атоме С6 (3.54-4.46 м. д.), резони-
ды 10а-г.
рующего с протоном при атоме С7 (3.67-4.00 м. д.),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
198
ЯНКИН и др.
Таблица 1. Антимикробная активность соединений 7б, 8б, 9в, 10а, 10в
МПК, мкг/мл
Соединение
Staphylococcus aureus ATCC
Candida albicans NCTC
Escherichia сoli ATCC 6538-P
25922
885-653
7б
1000
1000
1000
8б
1000
1000
1000
9в
>1000
>1000
1000
10а
500
500
1000
10в
500
500
1000
Фурацилин
250
125
-
Диоксидин
62.5-1000
3.9-62.5
-
Флуконазол
-
-
8-31
в спектрах ЯМР 1Н подтверждают предложенную
силан. Масс-спектры сняты на спектрометре уль-
структуру спиросоединений 10а-г и исключают
тра-ВЭЖХ-МС (колонка Waters Acquity UPLC
возможные альтернативные енаминную и имин-
BEH C18 1.7 мкм, подвижные фазы - ацетонитрил
ную структуры. При сравнении спектральных ха-
и вода, скорость потока - 0.6 мл/мин, детектор ESI
рактеристик спиросоединений 10а-г с исходными
MS Xevo TQD). Элементный анализ выполнен на
циклогесанонами 6г, н-п обнаружено, что величи-
элементном анализаторе Euro EA3028-НТ для од-
на химического сдвига дублета протона при атоме
новременного определения C, H, N. Температуры
С8 цикла в спектрах соединений 10а-г смещена
плавления определены на приборе Melting Point
в область более сильного поля (2.78-3.12 м. д.,
M-565.
J 11.4-12.0 Гц) [29, 30].
N1,N3,2-Триарил-6-гидрокси-6-метил-4-оксо-
Соединения 2б, 3б, 4в, 5а, в исследованы на
циклогексан-1,3-дикарбоксамиды 6а-п получали
проявление антимикробной активности к штаммам
по известным методикам [28-30].
грамотрицательных (Escherichia coli ATCC 25922)
Общая методика синтеза соединений 7-10.
и грамположительных бактерий Staphylococcus
Смесь
0.005 моль N,N′,2-триарил-6-гидрок-
aureus ATCC 6538-P, низших грибов рода Candida -
си-6-метил-4-оксоциклогексан-1,3-дикарбокса-
Candida albicans NCTC 885-653. Были установ-
мида и 0.005 моль гидразида салициловой (7а-г),
лены минимальные подавляющие концентрации
изоникотиновой (8а, и), п-толуолсульфоновой кис-
(МПК), которые варьируются от 500 до 1000 мкг/
лоты (9а-е) или тиосемикарбазида (10а-г) в 25 мл
мл (табл. 1).
этилового спирта кипятили 2.5 ч, затем охлажда-
Таким образом, взаимодействием замещенных
ли. Выпавшие кристаллы отфильтровывали и кри-
6-гидрокси-6-метил-4-оксоциклогексан-1,3-дикар-
сталлизовали из этилового спирта.
боксамидов с гидразидами кислот и тиосемикар-
2-(4-Бромфенил)-6-гидрокси-4-[2-(2-гидрок-
базидом получены новые производные гидразонов
сифенил)гидразинилиден]-6-метил-N1,N3-ди-
и 1,2,4-триазол-3-тиона.
фенилциклогексан-1,3-дикарбоксамид
(7а).
Выход 56%, т. пл. 200-201°С. Спектр ЯМР 1Н
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(400 МГц, ДМСО-d6), δ, м. д.: 1.33 с (3Н, Me), 2.35
ИК спектры зарегистрированы на прибо-
д (1Н, С5НАНВ, J 14.0 Гц), 3.01 д (1Н, С5НАНВ,
ре Specord М-80 в таблетках KBr. Спектры ЯМР
J 14.0 Гц), 3.31 д (1Н, С1Н, J 12.0 Гц), 3.75 д (1Н,
1Н получены на спектрометрах Bruker DRX 500
С3Н, J 12.0 Гц), 3.88 т (1Н, С2Н, J 12.0 Гц), 4.94 с
(500 МГц) и Bruker AVANCE III HD 400 (400 МГц)
(1Н, ОН), 6.77-7.87 м (18Н, 2С6Н5, 2С6Н4), 9.55 с
в ДМСО-d6), внутренний стандарт - тетраметил-
(1Н, С1СОNH), 9.66 с (1Н, С3СОNH), 11.21 уш. с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
СИНТЕЗ И АНТИМИКРОБНАЯ АКТИВНОСТЬ
199
(2H, 2-HOC6H4CONH). Найдено, %: C 63.34; H
6-Гидрокси-4-(2-изоникотиноилгидрази-
4.87; N 8.81. C33H31BrN4O4. Вычислено, %: C
нилиден)-6-метил-2-(3,4-диметоксифенил-
63.16; H 4.98; N 8.93.
N1,N3-дифенилциклогексан-1,3-дикарбоксамид
(8а). Выход 30%, т. пл. 231-232°С. Спектр ЯМР
6-Гидрокси-4-[2-(2-гидроксифенил)ги-
1Н (500 МГц, ДМСО-d6), δ, м. д.: 1.30 с (3Н, Me),
дразинилиден]-6-метил-N1,N3-ди(2-метил-
2.48 д (1Н, С5НАНВ, J 14.0 Гц), 2.93 д (1Н, С5НАНВ,
фенил)-2-(4-хлорфенил)циклогексан-1,3-ди-
J 14.0 Гц), 3.10 д (1Н, С1Н, J 12.0), 3.58 с (3Н,
карбоксамид (7б). Выход 32%, т. пл. 245-247˚С.
2-MeОС6Н3), 3.60 с (3Н, 2-MeОС6Н3), 3.90 т (1Н,
Спектр ЯМР 1Н (500 МГц, ДМСО-d6), δ, м. д.: 1.40
С2Н, J 12.0), 4.42 д (1Н, С3Н, J 12.0), 4.88 уш. с (1Н,
с (3Н, СН3), 1.80 с (6Н, (2-MeС6Н4)2), 2.05 д (1Н,
ОН), 6.70-7.50 м (17Н, 2С6Н5, С6Н3, Py), 9.48 с (1Н,
С5НАНВ, J 14.0 Гц), 2.48 д (1Н, С5НАНВ, J 14.0
С1СОNН), 9.67 с (1Н, С3СОNН), 10.80 с (1Н, NH).
Гц), 3.10 д (1Н, С1Н, J 12.0 Гц), 3.70 т (1Н, С2Н J
Найдено, %: С 67.60; Н 5.66; N 11.23. С35Н35N5О6.
12.0 Гц), 3.90 д (1Н, С3Н, J 12.0 Гц), 5.10 с (1Н, ОН),
Вычислено, %: С 67.62; Н 5.67; N 11.27.
6.88-7.30 м (16Н, 4С6Н4), 7.86 с (1Н, С1СОNН),
6-Гидрокси-4-(2-изоникотиноилгидра-
9.18 с (1Н, С3СОNН), 11.15 с (1Н, С4=NNНСО),
зинилиден)-6-метил-2-(4-метилфенил)-
11.70 с (1Н, 2-НОC6H4). Найдено, %: С 67.62; Н
N1,N3-ди(2-метоксифенил)циклогексан-1,3-ди-
5.50; N 8.75. С36Н35ClN4О5. Вычислено, %: С
карбоксамид (8б). Выход 30%, т. пл. 231-232°С.
67.65; Н 5.52; N 8.77.
Спектр ЯМР 1Н (500 МГц, ДМСО-d6), δ, м. д.:
6-Гидрокси-4-[2-(2-гидроксифенил)ги-
1.31 с (3Н, Me), 2.13 с (3Н, 4-MeС6Н4), 2.35 д (1Н,
дразинилиден]-6-метил-N1,N3-ди(2-метил-
С5НАНВ, J 14.0 Гц), 2.84 д (1Н, С5НАНВ, J 14.0 Гц),
фенил)-2-(пиридин-3-ил)циклогексан-1,3-ди-
3.12 (1Н, С1Н, J 12.0), 3.69 с (3Н, 2-MeОС6Н4), 3.75
карбоксамид (7в). Выход 51%, т. пл. 234-235°С.
с (3Н, 2-MeОС6Н4), 4.00 т (1Н, С2Н, J 12.0), 4.31
Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м. д.:
д (1Н, С3Н, J 12.0), 5.51 уш. с (1Н, ОН), 6.70-7.11
1.41 с (3Н, Me), 1.81 с (3Н, 2-MeС6Н4), 1.82 с
м (16Н, 3С6Н4, Py), 8.73 с (1Н, С1СОNН), 9.12 с
(3Н, 2-MeС6Н4), 2.36 д (1Н, С5НАНВ, J 14.0 Гц),
(1Н, С3СОNН), 10.78 с (1Н, NH). Найдено, %: С
2.99 д (1Н, С5НАНВ, J 14.0 Гц), 3.18 д (1Н, С1Н,
68.00; Н 5.85; N 11.00. С36Н37N5О6. Вычислено, %:
J 12.0), 3.90 д (1Н, С3Н, J 12.0), 3.95 т (1Н, С2Н,
С 68.02; Н 5.87; N 11.02.
J 12.0), 5.11 с (1Н, ОН), 6.76-8.43 м (16Н, 3С6Н4,
6-Гидрокси-6-метил-4-(2-тозилгидразинили-
Py), 9.06 с (1Н, С1СОNH), 9.23 с (1Н, С3СОNH),
ден)-N1,N3,2-трифенилциклогексан-1,3-дикар-
11.12 с (1H, 2-HOC6H4CONH), 11.60 уш. с (1H,
боксамид (9а). Выход 60%, т. пл. 235-236°С. ИК
2-OHC6H4CONH). Найдено, %: C 70.86; H 6.00; N
спектр (KBr), ν, см-1: 3400 (OH), 3342 (CONHAr),
12.24. C34H35N5O4. Вычислено, %: C 70.69; H 6.11;
3200 (NH), 1668 (CONHAr), 1552 (NH, C=N), 1344,
N 12.12.
1168 (SO2), 904 (S-N). Спектр ЯМР 1Н (400 МГц,
6-Гидрокси-4-[2-(2-гидроксифенил)ги-
ДМСО-d6), δ, м. д.: 1.30 с (3Н, Me), 2.18 с (3H,
дразинилиден]-6-метил-2-(4-диметилами-
4-MeC6H4SO2), 2.49 д (1Н, С5НАНВ, J 14.0 Гц),
нофенил)-N1,N3-ди(2-хлорфенил)циклогек-
2.81 д (1Н, С5НАНВ, J 14.0 Гц), 3.18 д (1Н, С1Н, J
сан-1,3-дикарбоксамид (7г). Выход 53%, т. пл.
12.0 Гц), 3.86 д (1Н, С3Н, J 12.0 Гц), 3.97 т (1Н,
203-204°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6),
С2Н, J 12.0 Гц), 5.03 с (1Н, ОН), 6.90-7.44 м (19Н,
δ, м. д.: 1.37 с (3Н, Me), 2.47 д (1Н, С5НАНВ, J
3С6Н5, С6Н4), 9.38 с (1Н, С1СОNH), 9.56 с (1Н,
14.0 Гц), 2.93 с [6Н, 4-(Me)2NC6H4], 3.04 д (1Н,
С3СОNH), 10.12 c (1H, C4NNHSO2). Найдено, %:
С5НАНВ, J 14.0 Гц), 3.69 д (1Н, С1Н, J 12.0), 3.85
C 66.62; H 5.68; N 9.08. C34H34N4O5S. Вычислено,
т (1Н, С2Н, J 12.0), 4.09 д (1Н, С3Н, J 12.0), 5.49
%: C 66.87; H 5.61; N 9.17.
с (1Н, ОН), 6.46-7.87 м (16Н, 4С6Н4), 9.39 с (1Н,
6-Гидрокси-6-метил-2-(4-диметиламино-
С1СОNH), 9.41 с (1Н, С3СОNH), 11.21 уш. с (2H,
фенил)-4-(2-тозилгидразинилиден)-N1,N3-ди-
2-OHC6H4CONH). Найдено, %: C 63.87; H 5.41; N
фенилциклогексан-1,3-дикарбоксамид
(9б).
10.43. C35H35Сl2N5O4. Вычислено, %: C 63.64; H
Выход 54%, т. пл. 213-214°С. ИК спектр (KBr), ν,
5.34; N 10.60.
см-1: 3440 (OH), 3344 (CONHAr), 3200 (NH), 1672
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
200
ЯНКИН и др.
(CONHAr), 1552 (NH, C=N), 1344, 1168 (SO2), 968
(9д). Выход 58%, т. пл. 234-235°С. ИК спектр
(S-N). Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м. д.:
(KBr), ν, см-1: 3460 (OH), 3360 (CONHAr), 3254
1.27 с (3Н, Me), 2.18 с (3H, 4-CH3C6H4SO2), 2.48 д
(NH), 1660 (CONHAr), 1555 (NH, C=N), 1330,
(1Н, С5НАНВ, J 14.0 Гц), 2.72 с (6Н, 4-Me2NC6H4),
1168 (SO2), 910 (S-N). Спектр ЯМР 1Н (400 МГц,
2.90 д (1Н, С5НАНВ, J 14.0 Гц), 3.11 д (1Н, С1Н, J
ДМСО-d6), δ, м. д.: 1.08 д (6Н, 4-Me2CHC6H4, J 7.0),
12.0 Гц), 3.65 д (1Н, С3Н, J 12.0 Гц), 3.78 т (1Н,
1.26 с (3Н, Me), 2.18 с (3H, 4-MeC6H4SO2), 2.47 д
С2Н, J 12.0 Гц), 4.80 с (1Н, ОН), 6.37-7.39 м (18Н,
(1Н, С5НАНВ, J 14.0 Гц), 2.63 м (1Н, 4-Me2CHC6H4,
2С6Н5, 2С6Н4), 9.31 с (1Н, С1СОNH), 9.42 с (1Н,
J 7.0 Гц), 2.73 д (1Н, С5НАНВ, J 14.0 Гц), 3.10 д (1Н,
С3СОNH), 9.50 c (1H, C4NNHSO2). Найдено, %: C
С1Н, J 12.0 Гц), 3.51 т (1Н, С2Н, J 12.0 Гц), 3.66
66.38; H 5.94; N 10.60. C36H39N5O5S. Вычислено,
с (3Н, 2-MeОС6Н4), 3.75 с (3Н, 2-MeОС6Н4), 4.21
д (1Н, С3Н, J 12.0 Гц), 5.24 с (1Н, ОН), 6.58-8.16
%: C 66.14; H 6.01; N 10.71.
м (16Н, 4С6Н4), 8.48 с (1Н, С1СОNH), 9.04 с (1Н,
6-Гидрокси-6-метил-4-(2-тозилгидразини-
С3СОNH), 10.01 c (1H, C4NNHSO2). Найдено, %: C
лиден)-N1,N3-дифенил-2-(4-диэтиламинофе-
70.49; H 6.58; N 5.26. C32H36N2O6. Вычислено, %:
нил)циклогексан-1,3-дикарбоксамид (9в). Вы-
C 70.57; H 6.66; N 5.14.
ход 64%, т. пл. 207-208°С. ИК спектр (KBr), ν,
6-Гидрокси-6-метил-2-(4-диметиламинофе-
см-1: 3400 (OH), 3344 (CONHAr), 3232 (NH), 1668
нил)-N1,N3-ди(2-метоксифенил)-4-(2-тозилги-
(CONHAr), 1552 (NH, C=N), 1380, 1168 (SO2),
дразинилиден)циклогексан-1,3-дикарбоксамид
912 (S-N). Спектр ЯМР 1Н (400 МГц, ДМСО-d6),
(9е). Выход 48%, т. пл. 241-242°С. ИК спектр
δ, м. д.: 0.92 т [6Н, 4-(CH3CH2)2NC6H4, J 7.0 Гц],
(KBr), ν, см-1: 3400 (OH), 3380 (CONHAr), 3304
1.16 с (3Н, Me), 1.92 д (1Н, С5НАНВ, J 14.0 Гц),
(NH), 1664 (CONHAr), 1552 (NH, C=N), 1312,
2.18 с (3H, 4-MeC6H4SO2), 2.74 д (1Н, С5НАНВ, J
1168 (SO2), 912 (S-N). Спектр ЯМР 1Н (400 МГц,
14.0 Гц), 3.12 д (1Н, С1Н, J 12.0 Гц), 3.13 к [4Н,
ДМСО-d6), δ, м. д.: 1.25 с (3Н, Me), 2.17 с (3H,
4-(CH3CH2)2NC6H4, J 7.0 Гц], 3.41 д (1Н, С3Н, J
4-MeC6H4SO2), 2.47 д (1Н, С5НАНВ, J 14.0 Гц), 2.73
12.0 Гц), 3.74 т (1Н, С2Н, J 12.0 Гц), 4.80 с (1Н,
с (6Н, 4-Me2NC6H4), 2.84 д (1Н, С5НАНВ, J 14.0 Гц),
ОН), 6.39-7.44 м (18Н, 2С6Н5, 2С6Н4), 9.25 с (1Н,
3.27 д (1Н, С1Н, J 12.0 Гц), 3.78 с (3Н, 2-MeОС6Н4),
С1СОNH), 9.41 с (1Н, С3СОNH), 10.02 c (1H,
3.94 с (3Н, 2-MeОС6Н4), 3.95 д (1Н, С3Н, J
C4NNHSO2). Найдено, %: C 67.11; H 6.27; N 10.41.
12.0 Гц), 4.00 т (1Н, С2Н, J 12.0 Гц), 5.32 с (1Н, ОН),
C38H43N5O5S. Вычислено, %: C 66.94; H 6.36; N
6.35-8.28 м (16Н, 4С6Н4), 8.40 с (1Н, С1СОNH),
10.27.
9.07 с (1Н, С3СОNH), 9.97 c (1H, C4NNHSO2). Най-
6-Гидрокси-6-метил-N1,N3-ди(2-метоксифе-
дено, %: C 63.73; H 6.14; N 9.92. C38H43N5O7S. Вы-
нил)-4-(2-тозилгидразинилиден)-2-фенилци-
числено, %: C 63.94; H 6.07; N 9.81.
клогексан-1,3-дикарбоксамид (9г). Выход 54%,
9-Гидрокси-9-метил-3-тиоксо-N6,N8-дифе-
т. пл. 227-228°С. ИК спектр (KBr), ν, см-1: 3450
нил-7-(4-этоксифенил)-1,2,4-триазаспиро[4.5]-
(OH), 3352 (CONHAr), 3240 (NH), 1672 (CONHAr),
декан-6,8-дикарбоксамид (10a). Выход 79%, т. пл.
1540 (NH, C=N), 1336, 1168 (SO2), 904 (S-N).
180-181°С. ИК спектр (KBr), ν, см-1: 3460 (OH),
Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м. д.: 1.28
3360, 3240, 3200, 3080 (NH), 1664 (CONHAr), 1600
с (3Н, Me), 2.19 с (3H, 4-MeC6H4SO2), 2.47 д (1Н,
(C=S), 1376 (N-CS-N). Спектр ЯМР 1Н (400 МГц,
С5НАНВ, J 14.0 Гц), 2.85 д (1Н, С5НАНВ, J 14.0 Гц),
ДМСО-d6), δ, м. д.: 1.19 т (3H, 4-MeCH2OC6H4, J
3.10 д (1Н, С1Н, J 12.0 Гц), 3.67 с (3Н, 2-MeОС6Н4),
7.0 Гц), 1.28 с (3Н, СН3), 2.14 д (1Н, С10НАНВ, J
3.77 с (3Н, 2-MeОС6Н4), 3.86 д (1Н, С3Н, J 12.0 Гц),
14.6 Гц), 2.89 д (1Н, С8Н, J 12.0 Гц), 3.28 д (1Н,
4.04 т (1Н, С2Н, J 12.0 Гц), 5.32 с (1Н, ОН), 6.59-
С10НАНВ, J 14.6 Гц), 3.55 д (1Н, С6Н, J 12.0 Гц),
8.25 м (17Н, 3С6Н4, С6Н5), 8.46 с (1Н, С1СОNH),
3.89 к (2H, 4-MeCH2OC6H4, J 7.0 Гц), 3.91 т (1Н,
9.12 с (1Н, С3СОNH), 9.99 c (1H, C4NNHSO2). Най-
С7Н, J 12.0 Гц), 4.87 с (1Н, ОН), 6.59-7.34 м (14Н,
дено, %: C 64.69; H 5.62; N 8.24. C36H38N4O7S. Вы-
2С6Н5, С6Н4), 8.05 c (1H, N1H), 8.52 с (1H, N2H),
числено, %: C 64.46; H 5.71; N 8.35.
9.42 с (1Н, С8СОNH), 9.62 с (1Н, С6СОNH), 10.46
6-Гидрокси-2-(4-изопропилфенил)-6-ме-
уш. с (1H, N4H). Масс-спектр, m/z: 559 [M + H]+.
тил-N1,N3-ди(2-метоксифенил)-4-(2-тозилги-
Найдено, %: C 64.56; H 5.88; N 12.39. C30H33N5O4S.
дразинилиден)циклогексан-1,3-дикарбоксамид
Вычислено, %: C 64.38; H 5.94; N 12.51. M 558.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
СИНТЕЗ И АНТИМИКРОБНАЯ АКТИВНОСТЬ
201
9-Гидрокси-9-метил-N6,N8-ди(2-метоксифе-
уш. с (1H, N4H). Найдено, %: C 57.62; H 5.07; N
нил)-7-(тиен-2-ил)-3-тиоксо-1,2,4-триазаспи-
13.27. C30H32Cl2N6O3S. Вычислено, %: C 57.41; H
ро[4.5]декан-6,8-дикарбоксамид
(10б). Выход
5.14; N 13.39.
74%, т. пл. 163-164°С. ИК спектр (KBr), ν, см-1:
Антимикробную активность соединений
3460 (OH), 3390, 3280, 3180, 3010 (NH), 1676
7б, 8б, 9в, 10а, 10в по отношению к штаммам
(CONHAr), 1604 (C=S), 1360 (N-CS-N). Спектр
Escherichia сoli ATCC
6538-P, Staphylococcus
ЯМР 1Н (400 МГц, ДМСО-d6), δ, м. д.: 1.33 с (3Н,
aureus ATCC 25922 и Candida albicans NCTC
Me), 2.14 д (1Н, С10НАНВ, J 14.8 Гц), 2.78 д (1Н,
885-653 определяли методом последовательных
С8Н, J 11.4 Гц), 3.23 д (1Н, С10НАНВ, J 14.8 Гц),
разведений раствора исследуемых веществ в мя-
3.54 д (1Н, С6Н, J 11.4 Гц), 3.90 с (3Н, 2-MeОС6Н4),
сопептонном бульоне при бактериальной нагруз-
3.93 с (3Н, 2-MeОС6Н4), 4.00 т (1Н, С7Н, J 11.4
ке 250 тыс. микробных единиц на 1 мл раствора.
Гц), 5.40 с (1Н, ОН), 6.71-7.76 м (13Н, 2С6Н5, тие-
нил), 8.20 c (1H, N1H), 8.54 с (1H, N2H), 9.67 с (1Н,
За действующую дозу принимали минимальную
С1СОNH), 9.71 с (1Н, С3СОNH), 10.33 уш. с (1H,
подавляющую концентрацию соединения - мак-
N4H). Масс-спектр, m/z: 581 [M + H]+. Найдено, %:
симальное разведение, приводящее к полному
C 57.99; H 5.45; N 11.90. C28H31N5O5S2. Вычисле-
подавлению развития тест-микробов. В качестве
но, %: C 57.81; H 5.37; N 12.04. M 580.
препаратов сравнения использовали фурацилин
9-Гидрокси-9-метил-N6,N8-ди(2-метоксифе-
и диоксидин для Escherichia coli ATCC 25922 и
нил)-7-(пиридин-3-ил)-3-тиоксо-1,2,4-триаза-
Staphylococcus aureus ATCC 6538-P, флуконазол -
спиро[4.5]декан-6,8-дикарбоксамид (10в). Вы-
для Candida albicans NCTC 885-653.
ход 81%, т. пл. 188-189°С. ИК спектр (KBr), ν,
ИНФОРМАЦИЯ ОБ АВТОРАХ
см-1: 3380 (OH), 3288, 3240, 3120, 3000 (NH), 1648
(CONHAr), 1592 (C=S), 1336 (N-CS-N). Спектр
Янкин Андрей Николаевич, ORCID: https://
ЯМР 1Н (400 МГц, ДМСО-d6), δ, м. д.: 1.42 с (3Н,
orcid.org/0000-0003-4221-5619
Me), 2.19 д (1Н, С10НАНВ, J 14.8 Гц), 3.12 д (1Н,
Носова Наталья Владимировна, ORCID:
С8Н, J 11.6), 3.46 д (1Н, С10НАНВ, J 14.8 Гц), 3.89
с (3Н, 2-MeОС6Н4), 3.91 с (3Н, 2-MeОС6Н4), 3.98
т (1Н, С7Н, J 11.6), 4.46 д (1Н, С6Н, J 11.6), 5.12
Гейн Владимир Леонидович, ORCID: https://
с (1Н, ОН), 6.87-7.76 м (12Н, 2С6Н4, Py), 8.41 c
orcid.org/0000-0002-8512-0399
(1H, N1H), 8.52 с (1H, N2H), 9.23 с (1Н, С8СОNH),
КОНФЛИКТ ИНТЕРЕСОВ
9.26 с (1Н, С6СОNH), 10.36 уш. с (1H, N4H). Масс-
спектр, m/z: 576 [M + H]+. Найдено, %: C 60.21;
Авторы заявляют об отсутствии конфликта
H 5.66; N 14.72. C29H32N6O5S. Вычислено, %: C
интересов.
60.40; H 5.59; N 14.57; M 575.
9-Гидрокси-7-(4-диметиламинофенил)-9-ме-
СПИСОК ЛИТЕРАТУРЫ
тил-3-тиоксо-N6,N8-ди(2-хлорфенил)-1,2,4-триаза-
1. Verma G., Marella A. Shaquiquzzaman M., Akhtar M.R.,
спиро[4.5]декан-6,8-дикарбоксамид
(10г). Вы-
Ali M.M., Alam M. // Pharm. J. Bioall. Sci. 2014. Vol. 6.
ход 71%, т. пл. 190-191°С. ИК спектр (KBr), ν,
N 2. P. 69. doi 10.4103/0975-7406.129170
2. Rollas S., Gulerman N., Erdeniz H. // Il Farmaco.
см-1: 3410 (OH), 3280, 3250, 3131, 3000 (NH), 1668
2002. Vol. 57. N 2. P. 171. doi 10.1016/S0014-
(CONHAr), 1552 (C=S), 1330 (N-CS-N). Спектр
827X(01)01192-2
ЯМР 1Н (400 МГц, ДМСО-d6), δ, м. д.: 1.35 с (3Н,
3. Гейн В.Л., Зорина А. А., Носова Н.В., Воронина Э.В.,
Me), 2.16 д (1Н, С10НАНВ, J 14.6 Гц), 2.81 с (6Н,
Вахрин М.И., Кривенько А.П. // Хим.-фарм. ж. 2007.
4-Me2NC6H4), 2.96 д (1Н, С8Н, J 11.6), 3.39 д (1Н,
Т. 41. № 6. С. 31; Gein V.L., Zorina A.A., Nosova N.V.,
Voronina E.V., Vahrin M.I., Kriven’ko A.P. // Pharm.
С10НАНВ, J 14.6 Гц), 3.67 т (1Н, С7Н, J 11.6), 4.26
Chem. J. 2007. Vol. 41. N 6. P. 319. doi 10.1007/
д (1Н, С6Н, J 11.6), 5.45 с (1Н, ОН), 6.46-7.43 м
s11094-007-0072-8
(12Н, 3С6Н4), 8.13 c (1H, N1H), 8.15 с (1H, N2H),
4. Secci D., Bizzarri B., Bolasco A., Carradori S.,
9.28 с (1Н, С8СОNH), 9.33 с (1Н, С6СОNH), 10.34
D’Ascenzio M., Rivanera D., Mari E., Polletta L.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
202
ЯНКИН и др.
Zicari A. // Eur. J. Med. Chem. 2012. Vol. 53. P. 246.
21.
Thanusu J., Kanagarajan V., Gopalakrishnan M. // ХГС.
doi 10.1016/j.ejmech.2012.04.006
2011. Т. 47. № 5. С. 696. Thanusu J., Kanagarajan V.,
5.
Ibrahim M. N., Al-Difar H. A. // Der Chemica Sinica
Gopalakrishnan M. // Chem. Heterocycl. Compd. 2011.
2011. Vol. 2. N 1. P. 171.
Vol. 47. N 5. P. 575. doi 10.1007/s10593-011-0801-5
6.
Moldovan C.M., Oniga O., Pârvu A., Tiperciuc B., Verite P.,
22.
Hussein A.Q., Herzberger S., Jochims J.C. // Chem.
Pîrna¢u A., Crişan O., Bojiţă M., Pop R. // Eur. J.
Ber. 1979. Bd 112. N 4. S. 1102. doi 10.1002/
Med. Chem. 2011. Vol. 46. N 2. P. 526. doi 10.1016/j.
cber.19791120406
ejmech.2010.11.032
23.
Ramesh R., Lalitha A. // RSC Adv. 2015. Vol. 5. N 63.
7.
Dandawate P., Khan E., Padhye S., Gaba H., Sinha S.,
P. 51188. doi 10.1039/c5ra07726e
Deshpande J., Wamy K.V., Khetmalas M., Ahmad A.,
24.
Arai I., Abe S., Hagitani A. // Bull. Chem. Soc. Japan.
Sarkar F.H. // Bioorg. Med. Chem. Lett. 2012. Vol. 22.
1973. Vol. 46. N 2. P. 677. doi 10.1246/bcsj.46.677
N 9. P. 3104. doi 10.1016/j.bmcl.2012.03.060
25.
Щелочкова О.А., Григорьева Э.А., Кривенько А.П. //
8.
Caputto M.E., Ciccarelli A., Frank F., Moglioni A.G.,
Изв. вузов. Сер. хим. и хим. технол. 2006. Т. 49.
Moltrasio G.Y., Vega D., Lombardo L., Finkiel-
№ 11. С. 139.
sztein L.M. // Eur. J. Med. Chem. 2012. Vol. 55. P. 155.
26.
Kanagarajan V., Thanusu J., Gopalakrishnan M. // Med.
doi 10.1016/j.ejmech.2012.07.013
Chem. Res. 2011. Vol. 21. N 12. P. 3965. doi 10.1007/
9.
El-Husseiny W.M., Magda A.A., Abdel-Aziz N.I.,
s00044-011-9949-x
El-Azab A.S., Asiri Y.A., Alaa A.M. // Eur. J. Med.
27.
Patil P.B., Patil J.D., Korade S.N., Kshirsagar S.D.,
Chem. 2018. Vol. 158. P. 134. doi 10.1016/j.
Govindwar S.P., Pore D.M. // Res. Chem. Intermed.
ejmech.2018.09.007
Vol. 42. N 5. P. 4171. doi 10.1007/s11164-015-2267-z
10.
Jain J., Kumar Y., Sinha R., Kumar R., Stables J. //
28.
Гейн В.Л., Левандовская Е.Б., Носова Н.В., Анто-
Med. Chem. 2011. Vol. 7. N 1. P. 56. doi
нова Н.В., Воронина Э.В., Вахрин М.И., Кривенко
10.2174/157340611794072689
11.
Leal C.M., Pereira S.L., Kümmerle A.E., Leal D.M.,
А.П. // Хим.-фарм. ж. 2007. Т. 41. № 12. С. 21; Gein
Tesch R., de Sant’Anna C.M., Fraga C.D.M., Barreiro
V.L., Levandovskaya E.V., Nosova N.V., Antonova N.V.,
E.J., Sudo R. T., Zapata-Sudo G. // Eur. J. Med. Chem.
Voronina E.V., Vahrin M.I., Kriven’ko A.P. // Pharm.
2012. Vol. 55. P. 49. doi 10.1016/j.ejmech.2012.06.056
Chem. J. 2007. Vol. 41. N 12. P. 643. doi 10.1007/
12.
Cutshall N.S., Onrust R., Rohde A., Gragerov S.,
s11094-008-0043-8
Hamilton L., Harbol K., Shen H.-R., McKee S., Zuta C.,
29.
Гейн В.Л., Одегова Т.Ф., Янкин А.Н., Носова Н.В. //
Graderova G., Florio V., Wheeler T.N., Gage J.L. //
ЖОХ. 2015. Т. 85. Вып. 1. С. 51; Gein V.L.,
Bioorg. Med. Chem. Lett. 2012. Vol. 22. N 17. P. 5595
Odegova T.F., Yankin A.N., Nosova N.V. // Russ. J.
13.
Wahbeh J., Milkowski S. // SLAS TECHNOL.: Transl.
Gen. Chem. 2015. Vol. 85. N 1. P. 46. doi 10.1134/
Life Sci. Innovat. 2019. Vol. 24. N 2. P. 161. doi
S1070363215010089
10.1177/2472630318822713
30.
Гейн В.Л., Одегова Т.Ф., Янкин А.Н., Носова Н.В. //
14.
Kucukguzel I., Rollas S., Cevikbas A. // Drug Metab.
Хим.-фарм. ж. 2015. Т. 49. № 4. С. 36; Gein V.L.,
Drug lnteract. 1995. Vol. 12. N 2. P. 151. doi 10.1515/
Odegova T.F., Yankin A.N., Nosova N.V. // Pharm. Chem.
DMDI.1995.12.2.151
J. 2015. Vol. 49. N 4. P. 245. doi 10.1007/s11094-015-
15.
Chuprov-Netochin R., Neskorodov Y., Marusich E.,
1264-2
Mishutkina Y., Volynchuk P., Leonov S., Skryabin K.,
31.
Gein V.L., Nosova N.V., Yankin A.N., Bazhina A.Y.,
Ivashenko A., Palme K., Touraev A. // BMC Plant
Dmitriev M.V. // Tetrahedron Lett. 2019. Vol. 60. N 24.
Biology 2016. Vol. 16. N 1. doi 10.1186/s12870-016-
P. 1592. doi 10.1016/j.tetlet.2019.05.023
0875-4
32.
Гейн В.Л., Янкин А.Н., Носова Н.В., Дмитриев М.В. //
16.
Islam M.R., Huda Q.N., Duddeck H. // Indian J. Chem.
ЖОрХ. 2016. Т. 52. Вып. 3. С. 400; Gein V.L.,
1990. Vol. 298. P. 376.
Yankin A.N., Nosova N.V., Dmitriev M.V. // Russ. J.
17.
Ferrari M.D., Roon K.I., Lipton R.B., Goadsby P.J. //
Org. Chem. 2016. Vol. 52. N 3. P. 379. doi 10.1134/
Lancet. 2001. Vol. 358. N 9294. P. 1668. doi 10.1016/
S1070428016030143
S0140-6736(01)06711-3
33.
Гейн В.Л., Янкин А.Н., Носова Н.В., Дмитриев М.В.,
18.
Chemistry of the Alkaloids / ed. by S. W. Pelletier. New
Насакин О.Е. // ЖОХ. 2016. Т. 86. Вып. 1. С. 63;
York: Van Nostrand Reinhold, 1970. P. 503.
19.
The Merck Index: An Encyclopedia of Chemicals,
Gein V.L., Yankin A.N., Nosova N.V., Dmitriev M.V.,
Drugs, and Biologicals / Ed. M.J. O’Neil. New Jersey:
Nasakin O.E. // Russ. J. Gen. Chem. 2016. Vol. 86.
Merck & Co, Inc. Whitehouse Station, 2006. 2564 p.
N 1. P. 58. doi 10.1134/S1070363216010114
20.
Gopalakrishnan M., Thanusu J., Kanagarajan V.,
34.
Gein V.L., Yankin A.N., Nosova N.V., Dmitriev M.V.,
Govindaraju R. // J. Enzyme Inhib. Med. Chem. 2009.
Slepukhin P.A. // Tetrahedron Lett. 2016. Vol. 57. N 22.
Vol. 24. N 2. P. 406. doi 10.1080/14756360802188099
P. 2441. doi 10.1016/j.tetlet.2016.04.082
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
СИНТЕЗ И АНТИМИКРОБНАЯ АКТИВНОСТЬ
203
Synthesis and Antimicrobial Activity of Novel Hydrazone
and 1,2,4-Triazole-3-thione Derivatives
A. N. Yankina, N. V. Nosovab, V. V. Novikovab, and V. L. Geinb,*
a National Research University ITMO, St. Petersburg, 197101 Russia
b Perm State Pharmaceutical Academy, Perm, 614990 Russia
*e-mail: geinvl48@mail.ru
Received November 12, 2021; revised November 12, 2021; accepted November 28, 2021
Novel hydrazone and 1,2,4-triazole-3-thione derivatives were obtained via the reaction of N1,N3,2-triaryl-
6-hydroxy-6-methyl-4-oxocyclohexane-1,3-dicarboxamides with acid hydrazides and thiosemicarbazide,
respectively. Structure of the products was proved using IR and 1H NMR spectroscopy methods. Some of the
synthesized compounds were tested for antimicrobial activity
Keywords: acid hydrazides, thiosemicarbazide, hydrazones, 1,2,4-triazole-3-thiones, antimicrobial activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022