ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 2, с. 266-276
УДК 535.37;539.19;543.42.062
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ СОЗДАНИЯ
ЖИДКОФАЗНЫХ СЕНСОРНЫХ МАТЕРИАЛОВ НА
ОСНОВЕ ТЕТРААРИЛДИТИАПОРФИРИНОВ
© 2022 г. Ю. Б. Ивановаa,*, С. Г. Пуховскаяb, А. Н. Киселевa, С. А. Сырбуa
a Институт химии растворов имени Г. А. Крестова Российской академии наук,
ул. Академическая 1, Иваново, 153045 Россия
b Ивановский государственный химико-технологический университет, Иваново, 153460 Россия
*e-mail: jjiv@yandex.ru
Поступило в Редакцию 8 октября 2021 г.
После доработки 22 ноября 2021 г.
Принято к печати 25 ноября 2021 г.
Спектрофотометрическим методом исследованы основные свойства 5,10,15,20-тетраарил-21-тиа- и
5,10,15,20-тетраарил-21,23-дитиапорфиринов в ацетонитриле. Проведена оптимизация геометрических
параметров молекул тиапорфиринов в приближении DFT (гибридный функционал B3LYP/6-311 G) и
исследована взаимосвязь их геометрического строения с основными и спектральными свойствами. Впер-
вые обнаружена способность дипротонированных форм тиапорфиринов координировать перхлорат- и
трифторацетат-ионы в нейтральных растворителях, которая может быть использована при создании
жидкофазных сенсорных материалов.
Ключевые слова: порфирин, гетеропорфирин, кислотно-основные свойства
DOI: 10.31857/S0044460X22020123
Создание новых материалов для решения кон-
достаточно интенсивной флуоресценцией, а также
кретных научно-практических задач - одна из ос-
другими хорошо регистрируемыми оптическими
новных тенденций развития современной химии.
свойствами. Порфирины и их производные вос-
Макрогетероциклические соединения зарекомен-
требованы для создания новых сенсорных соеди-
довали себя как прекрасные строительные блоки
нений в биомедицине [1-7] и катализе [8-10], а
для материалов нового поколения. Благодаря вну-
также новых материалов [11-15].
трициклическим координационным центрам они
Функционализированные порфирины получа-
способны образовывать как стабильные комплек-
ют путем введения необходимых заместителей в
сы практически со всеми металлами, обладающие
реакционный центр. При замене одного или двух
уникальными физико-химическими свойствами,
пиррольных атомов азота на атомы C, S, Se, Te,
так и устойчивые ионизированные формы.
P и Si существенно изменяются физико-химиче-
Одно из наиболее перспективных направле-
ские свойства образующихся гетеропорфиринов
ний - это создание материалов, обладающих чув-
по сравнению с обычными порфиринами [16-18].
ствительностью по отношению к газам, ионам или
Модификация порфиринового ядра способствует
малым неорганическим молекулам. Тетрапирроль-
усилению взаимодействия субстрата с рецептор-
ные соединения могут использоваться в качестве
ной платформой сенсора [19-27], по данным ис-
преобразователей первичного аналитического сиг-
следования структурных, спектральных и электро-
нала в оптический отклик сенсора. Они обладают
химических свойств гетеропорфиринов [19, 20,
266
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
267
Схема 1.
OH
S
O LiBut
+
S
ТГФ
OH
A
HO
OH
S
O
+
3
+ 2
N
H
Хлоранил
2
CH2Cl
BF3⋅MeOH
NH
N
S
N
+
N
S
N
S
1
2
28-32]. Для создания химических сенсоров наи-
сравнительный анализ их свойств со свойствами
более существенны кислотно-основные свойства
5,10,15,20-тетрафенилпорфирина (H2TPP) 1, про-
исходных соединений [33].
анализирована способность дипротонированных
форм гетеропорфиринов координировать перхло-
Методом спектрофотометрического титро-
рат-ионы в ацетонитриле и хлороформе.
вания нами исследованы основные свойства
5,10,15,20-тетрафенил-21-тиапорфирина
(HPS)
Синтез 21-тиа- и 21,23-дитиапорфиринов вклю-
2 и
5,10,15,20-тетрафенил-21,23-дитиапорфири-
чал предварительный этап получения диола A по
на (PS2) 3 в ацетонитриле при 298 K, проведен
методике, описанной в работах [34-36]. Диол А
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
268
ИВАНОВА и др.
Рис. 1. Cтруктуры порфиринов 2, 3 по данным расчетов методом B3LYP/6-311G.
конденсировали с бензальдегидом и пирролом (в
центральных атомах серы находится значитель-
мольном соотношении 1:2:3) в условиях образова-
ный положительный заряд; происходит некоторое
ния порфирина [37] и получили 21-тиапорфирин 2
искажение плоского строения макроциклического
с выходом 15.7% (схема 1). В качестве побочного
фрагмента из-за большего ионного радиуса атомов
продукта был выделен 21,23-дитиапорфирин 3 c
серы по сравнению с атомом азота.
выходом 3.2%.
Порфирины (H2P) в органических растворите-
По данным РСА [38] и результатам кванто-
лях проявляют амфотерные свойства и в присут-
во-химических расчетов [39], молекула H2TPP 1
ствии кислот и оснований могут протонироваться
имеет близкое к плоскостному строение с неболь-
и депротонироваться по внутрициклическим ато-
шим рифлением порфиринового макроцикла. По
мам азота. В первом приближении (без участия
растворителя и без стабилизации образующихся
данным расчетов, мезо-фенильные группы, про-
частиц противоионами) кислотно-основное вза-
являя слабые электроноакцепторные свойства, от-
имодействие порфиринов может быть описано
тягивают электронную плотность из макрокольца.
уравнениями (1)-(4) [43].
Замещение на фенильные группы уменьшает элек-
тронную плотность на мезо-атомах углерода пор-
2+
1
(1)
H
P
→
HP++H+,
фина на ~0.03 ē, а эффективный заряд на атомах
4
←
азота практически не изменяется.
Квантово-химические расчеты структурных
+
2
(2)
H
P
→
H
P+H+,
3
←
2
параметров порфиринов 2 и 3 выполнены с ис-
пользованием пакета программ Gaussian 09 [42]
в приближении DFT
[гибридный функционал
1
→
(3)
H
P
HP +H+,
2
←
B3LYP/6-311+g(d,p)]. Использовавшийся набор
базисных функций 6-311+g(d,p) заимствован из
библиотеки EMSL [41, 42]. Структуры порфири-
K
−
2
2−
(4)
HP
→
P
+H+.
←
нов 2, 3 и заряды на атомах показаны на рис. 1. На
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
269
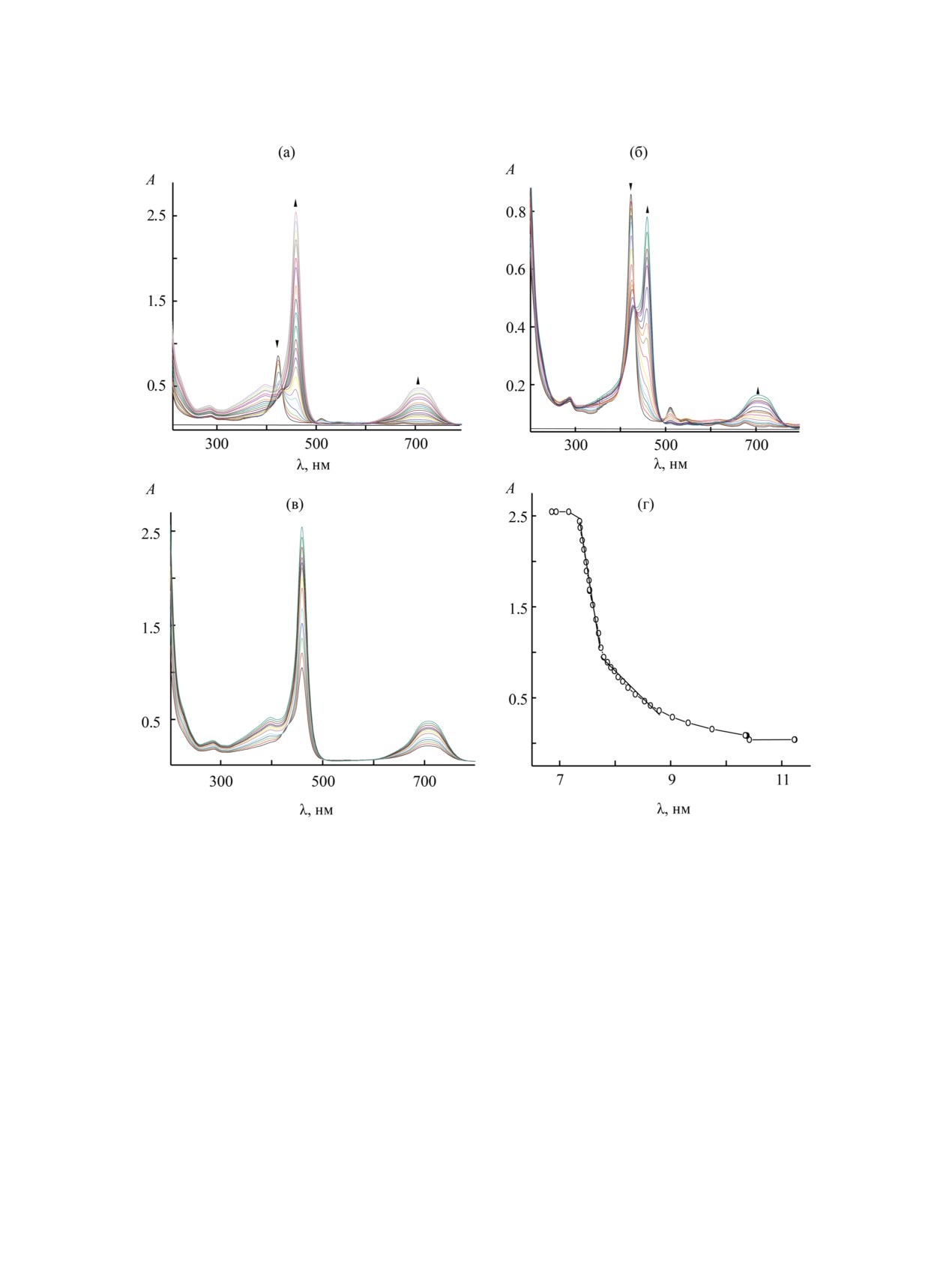
Рис. 2. Изменения электронных спектров поглощения соединения 2 (спорф 2.33×10-6 моль/л) в системе CH3CN-HClO4
(0-3.01×10-4 моль/л): (а) обе ступени; (б) 1-я ступень, HClO4 (0-1.40×10-4 моль/л); (в) - 2-я ступень, HClO4
(1.40×10-4-3.01×10-4 моль/л); (г) зависимость оптической плотности А соединения 2 от концентрации кислоты в титранте
CH3CN-HClO4 (0-3.01×10-4 моль/л) при λ 460 нм.
Здесь Н2Р, HР-, Р2-, H3P+, H4P2+ - молекулярная,
сравнении с соединением 1 в ацетонитрильных
депротонированные и протонированные формы
растворах показал, что соединения 2 и 3 обладают
порфирина.
очень слабыми кислотными свойствами. В соеди-
Соединения 2 и 3 исследовали спектрофото-
нениях 1-3 реализуется диссоциация протониро-
метрическим методом в бинарном растворителе
ванных форм (1), (2), что позволяет исследовать и
HClO4-CH3CN при 298 K. Спектрофотометри-
сравнить их основные свойства. Известно, что при
ческий анализ реакционной способности полу-
протонировании изменяется симметрия молекулы
ченных гетерозамещенных порфиринов 2 и 3 в
[44].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
270
ИВАНОВА и др.
4 - PS2
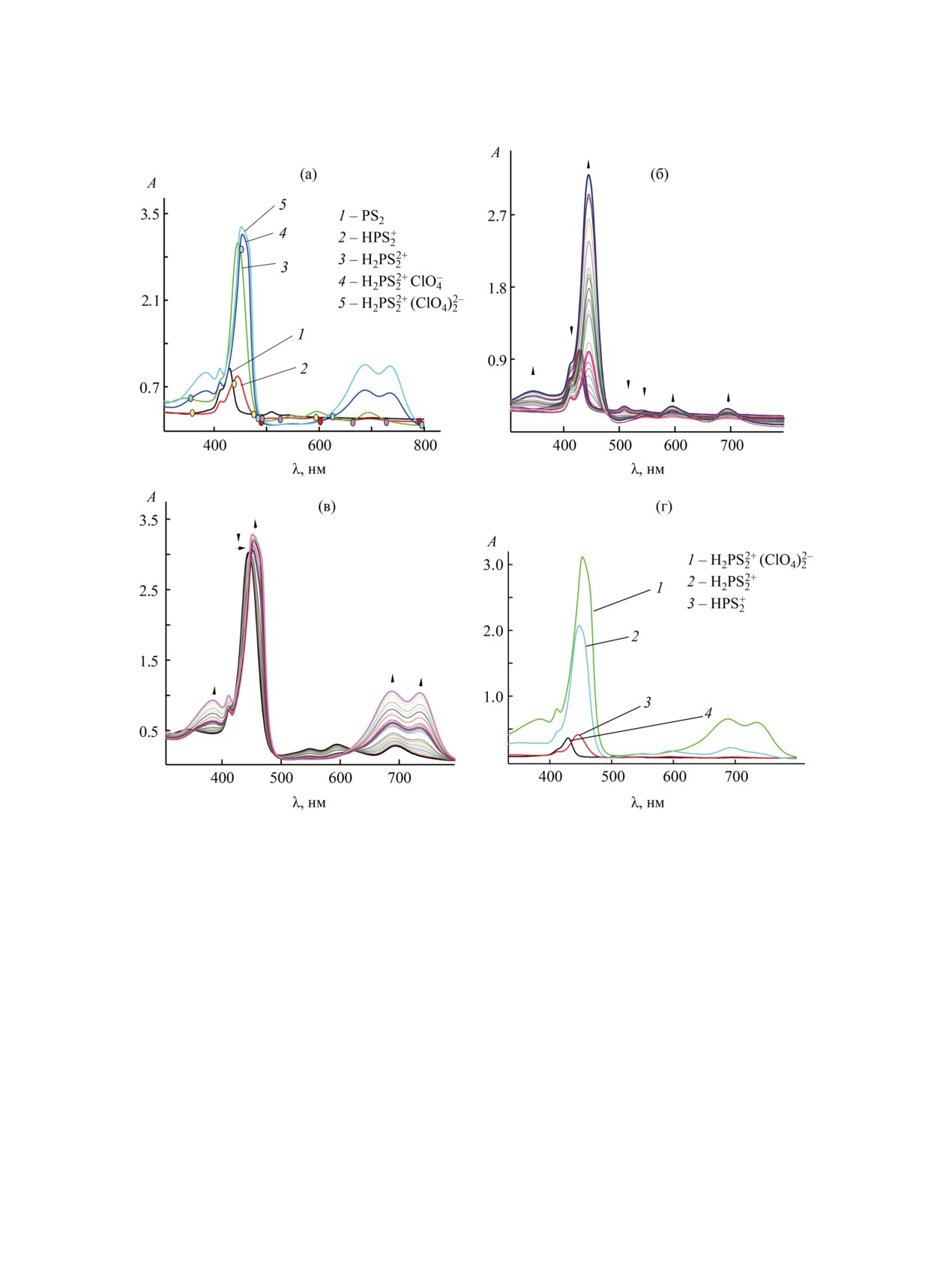
Рис. 3. Изменения электронных спектров поглощения соединения 3 (спорф 4.98×10-6 моль/л) в системе CH3CN-
HClO4 (0-4.08×10-3 моль/л): (а) 1-4-я ступени; (б) 1-я и 2-я ступени, HClO4 (0-1.77×10-4 моль/л); (в) 3-я и 4-я ступени
(1.77×10-4-4.08×10-3 моль/л); (г) изменение ЭСП соединения 3 при добавлении раствора хлорной кислоты (образуются
формы HPS+, H2PS2+) и (C2H5)4ClO4 (0.01 моль/л) к дипротонированной форме H2PS22+ (образуется форма H2PS2+(ClO4)2-)
в ацетонитриле при 298 K.
Основные контуры сопряжения молекул Н2P,
титровании 0.01 М. растворами HClO4 в ацетони-
Н3Р+ и Н4Р2+ образуют ароматические системы,
триле. В этих условиях хлорная кислота полно-
включающие π-электроны и различающиеся раз-
стью диссоциирована и протонирование осущест-
мером, зарядом и симметрией [45, 46]. Все кис-
вляется за счет сольватированного протона [47]. С
лотно-основные формы порфиринов интенсивно
увеличением концентрации HClO4 в системе HPS-
окрашены и имеют характерные различия в элек-
HClO4-CH3CN в электронных спектрах поглоще-
тронных спектрах поглощения (ЭСП).
ния соединения 2 наблюдается образование двух
На рис. 2, 3 приведены электронные спектры
семейств изобестических точек, что обусловлено
поглощения соединений 2 и 3 в ацетонитриле при
двумя индивидуальными равновесиями между
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
271
(5) и распределение текущей концентрации всех
форм (6), путем несложных расчетов можно полу-
чить распределение концентраций молекулярной
и протонированных форм при титровании (7)-(9).
2+
c
(100%)=c(H
P)+c(H
P+)+c(H
P
),
(5)
2
3
4
2
A
t
=
(
A
H2P
kb
1
⋅ kb
2
+
+
A a⋅kb
2
+a
A
2+
)/
H3P
H4P
2
(6)
(kb
⋅
kb
+
a⋅kb
+
a
),
1
2
2
2
[H
P] = (kb
⋅ kb
/ (kb
⋅ kb
+a⋅kb
+a
))×100%,
(7)
2
1
2
1
2
2
2
[H
P+]=(a⋅kb
/ (kb
⋅
kb
+
a⋅kb
+
a
))
×100%,
(8)
Рис. 4. Распределение концентраций молекулярных,
3
2
1
2
2
моно- и дипротонированных форм соединения 2 в ходе
титрования раствором HClO4 в CH3CN.
2
+
2
2
[H
P
]= (a
/ (kb
⋅
kb
+a⋅kb
+a
))×100%.
(9)
4
1
2
2
парами светопоглощающих центров: HSP/H2SP+
Здесь a2, kb2, kb1 соответственно 10-рН, константы
и H2SP+/H3SP2+. Экспериментальными данными
протонирования по первой и второй ступеням.
(кривая спектрофотометрического титрования,
Распределение концентраций молекулярных,
рис. 2г) подтверждается ступенчатость взаимодей-
моно- и дипротонированных форм соединения 2
ствия порфирина 2 с HClO4.
в ходе титрования (система HPS-CH3CN-HClO4),
Учитывая диссоциацию протонированых
согласно уравнениям
(6)-(9), представлено на
форм (1), (2), уравнение материального баланса
рис. 4.
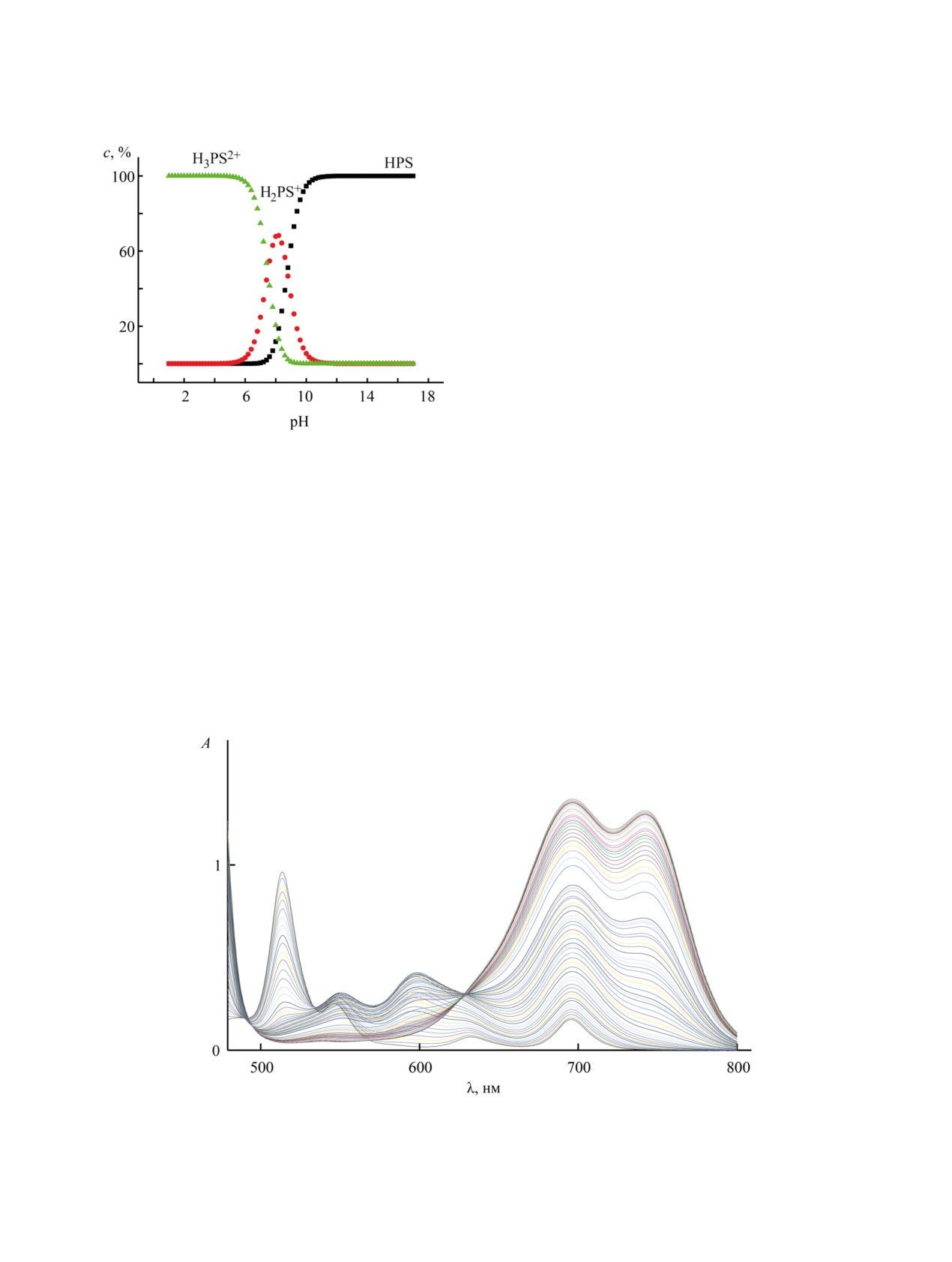
Рис. 5. Изменения электронных спектров поглощения соединения 3 (спорф 3.15×10-4 моль/л) в системе CHCl3-CF3COOH
(0-4.08×10-3 моль/л).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
272
ИВАНОВА и др.
траций молекулярной и протонированных форм
(рис. 6), а затем, возможно, присоединение одно-
го (3-я ступень титрования) и второго ионов ClO‒
(4-я стадия титрования).
С учетом слабой координирующей способно-
сти ацетонитрила лигандный обмен с растворите-
лем не вносит существенного вклада, и ступени
3 и 4 можно разделить. Для подтверждения это-
го предположения мы провели дополнительный
эксперимент, в котором, рассчитав область кон-
центрации дипротонированной формы по уравне-
нию (9), довели реакционную смесь до рН ~6.3-6.5
и провели титрование полученного двухзарядно-
го катиона ацетонитрильным 0.01 М. раствором
(C2H5)4ClO4. Наблюдался переход спектра дваж-
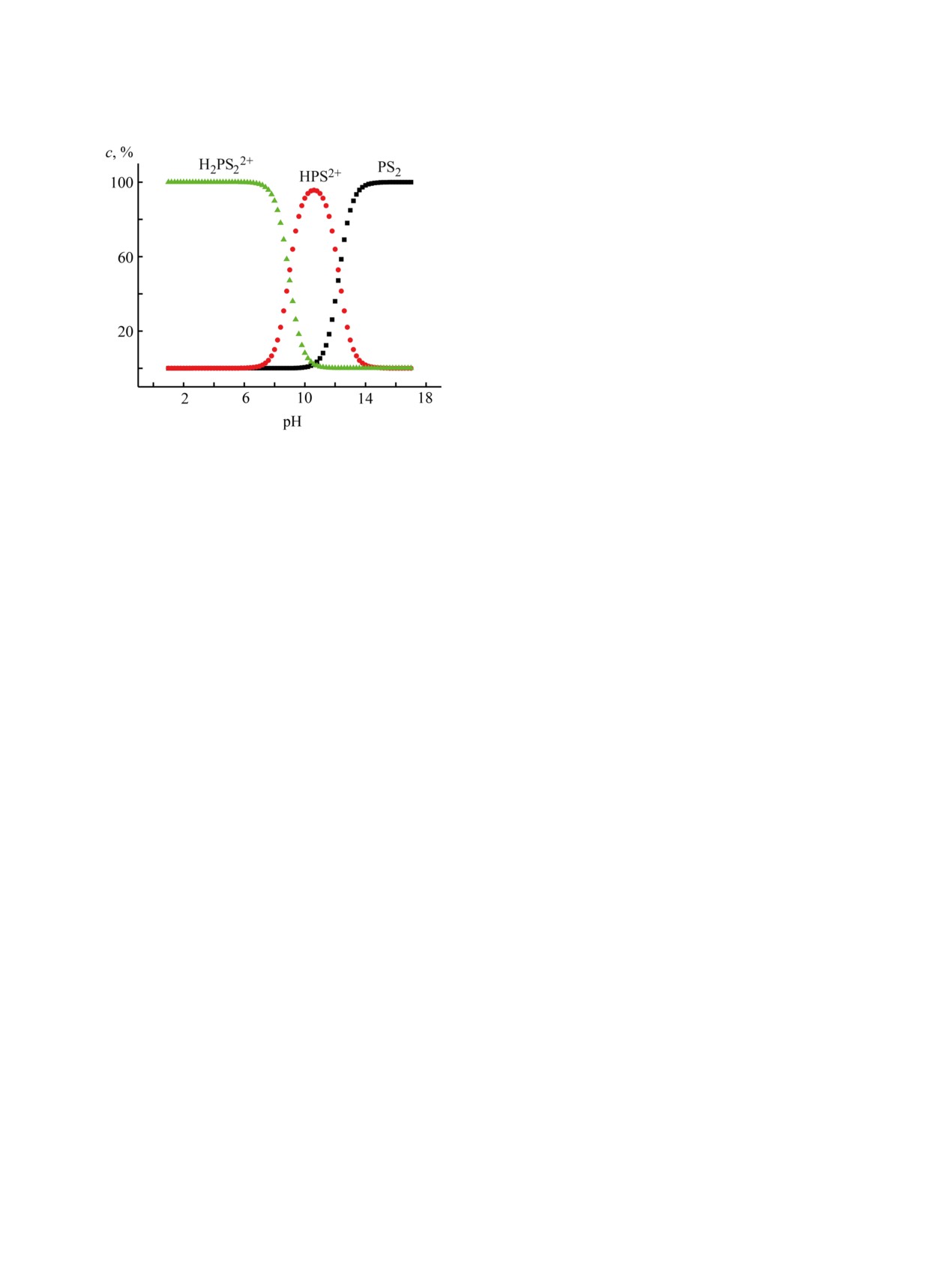
Рис. 6. Распределение концентраций молекулярных,
моно- и дипротонированных форм соединения 3 в ходе
ды депротонированной формы в спектр ассоци-
титрования раствором HClO4 в CH3CN.
ата H2PS2+(ClO4)2- (рис. 3г), что свидетельствует
о возможности ассоциации между двухзарядным
катионом и перхлорат ионами.
В ходе титрования соединения 3 (система
Состояние CF3COOH в хлороформе изучено
PS2~CH3CN~HClO4) наблюдались
4 семейства
недостаточно хорошо. Мы предполагаем, что при
спектральных кривых, каждому из которых со-
использованных для титрования концентрациях
ответствует свой набор изобестических точек
происходит взаимодействие дипротонированной
(рис. 3), свидетельствующих о последовательном
формы дитиапорфирина 3 с молекулами CF3COOH
протекании четырех стадий. Аналогичные резуль-
(3-я и 4-я ступени). Спектр ЯМР 1H соединения 3 в
таты получены при титровании 21,23-дитиапор-
дейтерохлороформе с избытком трифторуксусной
фирина 3 и в системе CHCl3-CF3COOH (рис. 5).
кислоты представлен в Дополнительных материа-
лах.
Дипротонированный порфириновый макро-
цикл Н4Р2+ в ряде случаев может проявлять свой-
Количественные величины ступенчатых и сум-
ства анион-молекулярного рецептора
[48,
49].
марных констант ионизации для исследованных
соединений при 298 K вычислены по уравнению
Внутрициклические группы NH способны коор-
(10), их соответствующие значения и параметры
динировать молекулы оснований различной при-
ЭСП молекулярных и ионизированных форм в си-
роды (молекулы растворителя Solv и анионы An-)
стеме ацетонитрил-HClO4 представлены в табл. 1.
с образованием индивидуальных и/или смешан-
ных комплексов [Н4P2+](Solv)2, [Н4P2+](An-)(Solv),
рK = -lgK = pH - lg Ind.
(10)
(Н4P2+)(An-)2. Ацетонитрил - растворитель, слабо
сольватирующий как катионные, так и анионные
Здесь K - константа основности по первой (kb1)
частицы [50, 51]. Глубина протонирования (глу-
или второй (kb2) ступеням, Ind - индикаторное от-
бина внедрения протона в электронную оболочку
ношение соответственно для ступеней 1-4: [H2P]/
донорного атома) в этом растворителе достаточно
[H3P+], [H3P+]/[H4P2+], [H2P]/[H4P2+], [H4P2+ClO–]/
высока, поскольку протоны в растворе слабо свя-
[H4P2+(ClO–)2-], pH = -(2.48-2.65)·lgcHClO4 [52].
зываются растворителем и степень специфической
Погрешность измерения констант не превышала
сольватации на центральных атомах невелика.
3-5%.
По-видимому, при титровании соединения 3
Проведенные исследования позволяют оценить
раствором HClO4 в CH3CN происходит последо-
рецепторные свойства протонированных форм те-
вательное присоединение двух протонов (1-я и
трапиррольных соединений, полученных разными
2-я ступени титрования); распределение концен-
методами. Это существенно расширяет возмож-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
273
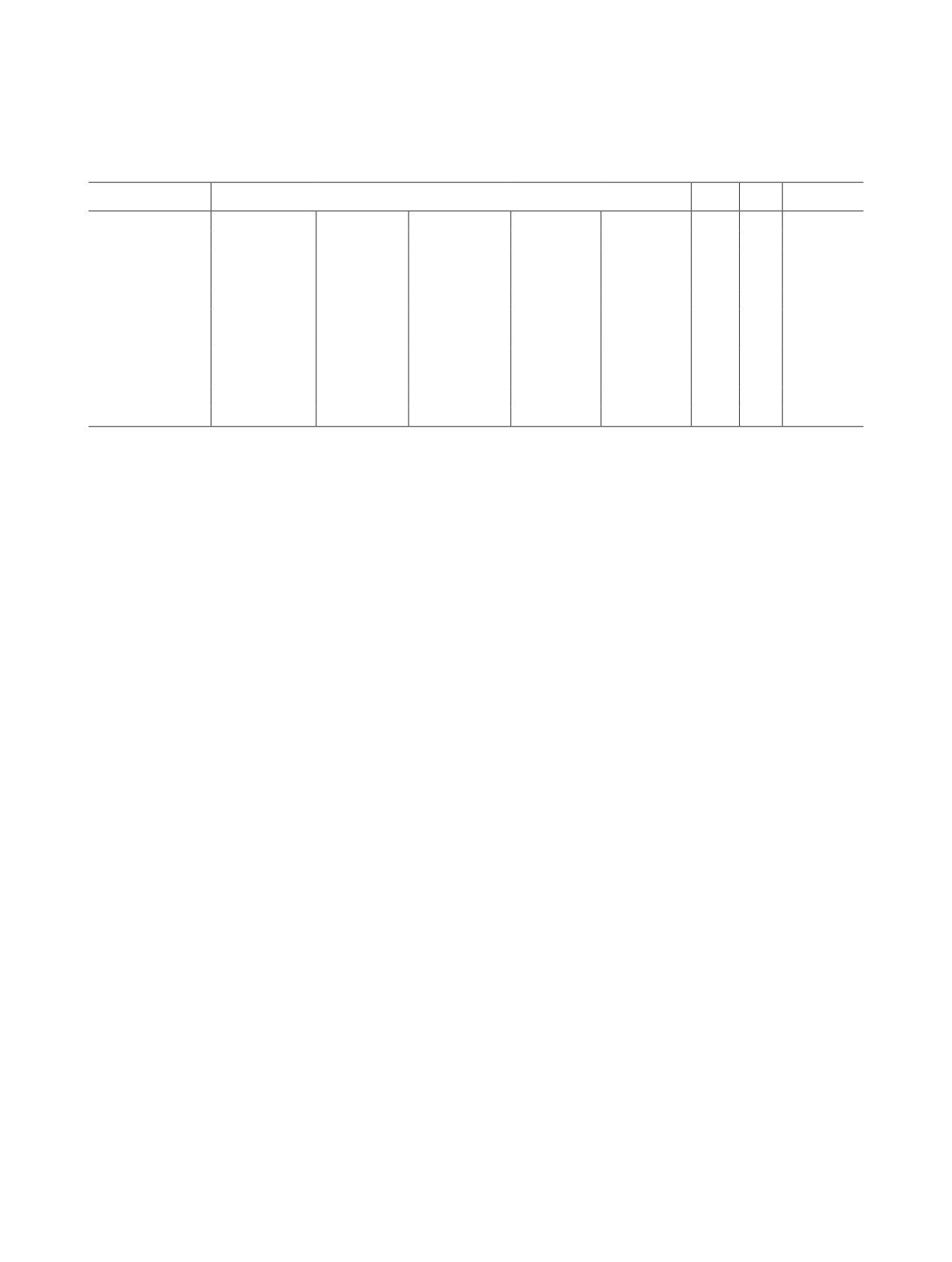
Таблица 1. Показатели констант основности и спектральные характеристики молекулярных и протонированных
форм порфиринов 1-3 в системе ацетонитрил-HClO4 при 298 Ka
Порфирин
λ(lgε)a
рKb1
рKb2
∑рKб
Н2TPP 1
413 (5.02)
512 (3.56)
546 (3.12)
589 (2.92)
646 (2.96)
-
-
18.67 [54]
H4TPP2+
441 (5.04)
-
-
-
661 (4.17)
19.8 [45]
HPS 2
423 (5.56)
510 (4.49)
544 пл (3.90)
616 (3.63)
676 (3.83)
8.76
7.48
16.24
H2PS+
430 (5.29)
459 (5.60)
-
-
708 (4.20)
H3PS2+
395 пл (5.34)
460 (5.11)
-
-
710 (5.39)
PS2 3
412 пл (5.12)
509 (4.36)
541 (3.80)
700 (3.66)
12.25
8.95
21.20
429 (5.30)
HPS+
413 пл (4.97)
444 (5.24)
546 (4.19)
594 (3.70)
693 (3.66)
H2PS2+
345 (5.01)
445 (5.37)
548 (3.77)
594 (3.83)
694 (3.82)
H2PS2+ClO–
381 пл (5.10)
412 (4.77)
451 (5.39)
689 (4.17)
738 (4.12)
5.93
4.29
10.22
H2PS2+(ClO4)2-
385 пл (5.27)
411 (5.30)
454 (5.82)
686 (5.33)
735 (5.32)
а Погрешность в определении коэффициентов экстинкции по результатам трех параллелей опытов 1-3%.
б
∑K = kb1∙kb2.
ности создания новых макрогетероциклических
фенил, Ho), 7.80 м (12H, фенил, Hм,п), 8.75 м (8H,
соединений для детектирования и селективного
пиррол), -3.75 с (2H, NH).
связывания анионов различной природы.
5,10,15,20-Тетрафенил-21-тиапорфирин
(2).
Выход 15.7%. Спектр ЯМР 1H (CDCl3), δ, м. д.:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
-2.76 уш. с. (1H, NH), 7.77 м (12H, фенил, Нм,п),
8.20 д (8H, фенил, Но, J 7.0 Гц), 8.56 д (2H, пиррол,
Соединения 2 и 3 получали по методикам
J 4.4 Гц), 8.63 д (2H, пиррол, J 4.4 Гц), 8.89 д (2H,
[34-36] и очищали хроматографированием на
пиррол, J 4.4 Гц), 9.19 д (2H, тиофен, J 4.3 Гц).
Al2O3 (III степень активности по Брокману), элю-
ент - дихлорметан. Индивидуальность соедине-
5,10,15,20-Тетрафенил-21,23-дитиапорфирин
ний контролировали методом ТСХ на пластинах
(3). Выход 3.2%. Спектр ЯМР 1H (CDCl3), δ, м. д.:
7.82 м (12 H, фенил, Нм,п), 8.26 д (8 H, фенил, Но,
Silufol (Merck), толщина слоя 0.5 мм, элюент -
J 7.0 Гц), 8.70 с (4H, пиррол), 9.70 c (4H, тиофен).
CH2Cl2. Спектральные характеристики использо-
ванных в работе соединений соответствовали ли-
ИНФОРМАЦИЯ ОБ АВТОРАХ
тературным данным [34-36].
В качестве растворителя использовали дипо-
org/0000-0002-2580-1328
лярный апротонный растворитель - ацетонитрил
высокой степени очистки (менее 0.03% воды), в ко-
Пуховская Светлана Генадьевна, ORCID:
тором исходные объекты находились в молекуляр-
ной форме, что подтверждалось спектральными
Киселев Алексей Николаевич, ORCID: https://
данными. Спектрофотометрическое титрование
orcid.org/0000-0002-6664-6221
ацетонитрильными растворами хлорной кислоты
Сырбу Сергей Александрович, ORCID: https://
растворов порфиринов в ацетонитриле проводи-
orcid.org/0000-0003-1482-2809
ли на спектрофотометре Cary 100 Varian. Спектры
ФОНДОВАЯ ПОДДЕРЖКА
ЯМР 1H записаны на спектрометре Bruker-500
(Германия) на рабочей частоте 500 МГц в CDCl3,
Работа выполнена при финансовой поддержке
внутренний стандарт - ТМС. Методика экспери-
Министерства науки и высшего образования Рос-
мента и обработки экспериментальных данных
сийской Федерации (грант № 075-15-2021-579) с
подробно представлена в работах [48, 52].
привлечением оборудования Верхневолжского ре-
5,10,15,20-Тетрафенилпорфирин (1). Выход
гионального центра физико-химических исследо-
38%. Спектр ЯМР 1H (CDCl3), δ, м. д.: 8.30 м (8H,
ваний.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
274
ИВАНОВА и др.
КОНФЛИКТ ИНТЕРЕСОВ
13.
Calvete M.J.F. // Int. Rev. Phys. Chem. 2012. Vol. 31.
P. 319. doi 10.1080/0144235X.2012.713210
Авторы заявляют об отсутствии конфликта ин-
14.
Pinto S.M.A., Neves A.C.B., Calvete M.J.F., Abreu A.R.,
тересов.
Rosado M.T.S., Costa T., Burrows H.D., Pereira M.M. //
J. Photochem. Photobiol. (A). 2012. Vol. 242. P. 59. doi
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
10.1016/j.jphotochem.2012.05.031
15.
Marques A.T., Pinto S.M.A., Monteiro C.J.P., de
Дополнительные материалы для этой статьи
Melo J.S.S., Burrows H.D., Scherf U., Calvete M.J.F.,
доступны по doi
10.31857/S0044460X22020123
Pereira M.M. // J. Polym. Sci. Pol. Chem. 2012. Vol. 50.
для авторизованных пользователей.
P. 1408. doi 10.1002/pola.25908
16.
Latos-Grazynski L. The Porphyrin Handbook.
СПИСОК ЛИТЕРАТУРЫ
Singapore: World Scientific: Singapore, 2000. Vol. 2.
P. 361.
1.
Calvete M.J.F., Pinto S.M.A., Pereira M.M., Geral-
17.
Kaur T., Lee Way-Zen, Ravikanth M. // Inorg.
des C.F.G.C. // Coord. Chem. Rev. 2017. Vol. 333. P. 82.
Chem. 2016. Vol. 55. P. 5305. doi 10.1021/acs.
doi 10.1016/j.ccr.2016.11.011
inorgchem.6b00214
2.
Giuntini F., Boyle R., Sibrian-Vazquez M.,
18.
Białek M.J., Latos-Grazynski L. // Inorg. Chem. 2016.
Vicente M.G.H. Handbook of Porphyrin Science.
Vol. 55. P. 1758. doi 10.1021/acs.inorgchem.5b02684
Singapore: World Scientific Publishers, 2013. Vol. 27.
19.
Chmielewski P.J., Grzeszczuk M., Latos-Grazynski L.,
P. 303. doi 10.1142/9789814407755_0017
Lisowski J. // Inorg. Chem. 1989. Vol. 28 P. 3546. doi
3.
Sekkat N., Van den Bergh H., Nyokong T.,
10.1021/ic00317a030
Lange N. // Molecules. 2012. Vol. 17. P. 98. doi 10.3390/
20.
Latos-Grazynski L., Lisowski J., Olmstead M.M.,
molecules17010098
Balch A.L. // Inorg. Chem. 1989. Vol. 28. P. 3328. doi
4.
Calvete M.J.F., Simões A.V.C., Henriques C.A.,
10.1021/ic00316a015
Pinto S.M.A., Pereira M.M. // Curr. Org. Synth. 2014.
21.
Latos-Grazynski L., Lisowski J., Olmstead M.M.,
Vol. 11. P. 127. doi 10.2174/15701794113106660090
Balch A.L. // Inorg. Chem. 1989. Vol. 28. P. 4065. doi
5.
Simões A.V.C., Adamowicz A., Dabrowski J.M.,
10.1021/ic00321a005
Calvete M.J.F., Abreu A.R., Stochel G., Arnaut L.G.,
22.
Lisowski J., Grzeszczuk M., Latos-Grazynski L. // Inorg.
Pereira M.M. // Tetrahedron. 2012. Vol. 68. P. 8767. doi
Chim. Acta. 1989. Vol. 161. P. 153. doi 10.1016/S0020-
10.1016/j.tet.2012.08.007
1693(00)83086-8
6.
Pinto S.M.A., Tome V.A., Calvete M.J.F.,
23.
Pandian R.P., Chandrashekar T.K. // Inorg. Chem. 1994.
Pereira M.M., Burrows H.D., Cardoso A.M.S., Pallier A.,
Vol. 33. P. 3317. doi 10.1021/ic00093a020
Castro M.M.C.A., Toth E., Geraldes C.F.G.C. // J.
24.
Pandian R.P., Chandrashekar T.K. // J. Chem. Soc.
Inorg. Biochem. 2016. Vol. 154. P. 50. doi 10.1016/j.
Dalton Trans. 1994. P. 119. doi 10.1007/BFb0036827
jinorgbio.2015.10.013
25.
Chmielewski P.J., Latos-Grazynski L., Olmstead M.M.,
7.
Simões A.V.C., Pinto S.M.A., Calvete M.J.F.,
Balch A.L. // Chem. Eur. J. 1997. Vol. 3. P.268. doi
Gomes C.M.F., Ferreira N.C., Castelo-Branco M.,
10.1002/chem.19970030216
Llop J., Pereira M.M., Abrunhosa A.J. // RSC Adv.
26.
Chmielewski P.J., Latos-Grazynski L. // Inorg. Chem.
2015. Vol. 5. P. 99540. doi 10.1039/C5RA16103G
1998. Vol. 37. P. 4179. doi 10.1021/ic971387i
8.
Marfin Yu S., Vashurin A.S., Rumyantsev E.V.,
27.
Paolesse R., Lvova L., Nardis S., Di Natale C.,
Puhovskaya S.G. // J. Sol-Gel Sci. Technol. 2013.
D’Amico A. // Microchim. Acta. 2008. Vol. 163. P. 103.
Vol. 66. P. 306. doi 10.1007/s10971-013-3009-6
doi 10.1007/s00604-008-0949-6
9.
Calvete M.J.F., Silva M., Pereira M.M.,
28.
Latos-Grazynski L., Lisowski J., Chmielewski P.J.,
Burrows H.D. // RSC Adv. 2013. Vol. 3. P. 22774. doi
Grzeszczuk M., Olmstead M.M., Balch A.L. // Inorg.
10.1039/C3RA44038A
Chem. 1994. Vol. 33. P. 192. doi 10.1021/ic00080a004
10.
Cuesta-Aluja L., Castilla J., Masdeu-Bulto A.M.,
29.
Latos-Grazynski L., Pacholska E., Chmielewski P.J.,
Henriques C.A., Calvete M.J.F., Pereira M.M. // J.
Olmstead M.M., Balch A.L. // Inorg. Chem. 1996.
Mol. Catal. A. 2016. Vol. 423. P. 489. doi 10.1016/j.
Vol. 35. P. 566. doi 10.1021/ic950329z
molcata.2015.10.025
30.
Gross Z., Saltsman I., Pandian R.P., Barzilay C. //
11.
Li L.L., Diau E.W.G. // Chem. Soc. Rev. 2013. Vol. 42.
Tetrahedron Lett. 1997. Vol. 38 P. 2383. doi 10.1016/
P. 291. doi 10.1039/C2CS35257E
S0040-4039(97)00357-2
12.
Dini D., Calvete M.J.F., Hanack M. // Chem. Rev. 2016.
31.
Chang-Hee Lee, Won- Seob Cho // Tetrahedron Lett.
Vol. 116. P. 13043. doi 10.1021/acs.chemrev.6b00033
1999. P. 8879. doi 10.1016/S0040-4039(99)01901-2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
275
32.
Chmielewski P.J., Latos-Grazynski L. // Inorg. Chem.
42.
Schuchardt K.L., Didier B.T., Elsethagen T., Sun L.,
1992. Vol. 31. P. 5231. doi 10.1021/ic00051a014
Gurumoorthi V., Chase J., Li J., Windus T.L. // J. Chem.
33.
Никольский Б.П., Евстропьев К.С. // ЖФХ. 1930.
Inf. Model. 2007. Vol. 47. N 3. P. 1045. doi 10.1021/
Т. 1. С. 729.
ci600510j
34.
Latos-Grazynski L., Lisowski J., Olmstead M.M.,
43.
Andrianov V.G., Malkova O.V. // Macroheterocycles.
Balch A.L. // J. Am. Chem. Soc. 1987. Vol. 109. P. 4428.
2009. Vol. 2. P. 130. doi 10.6060/mhc2009.2.130
doi 10.1021/ja00248a067
44.
Berezin B.D. Coordination compounds of porphyrins
35.
Heo P.-Y., Shin K., Lee C.-H. // Bull. Korean Chem.
and phthalocyanines. New York: John Wiley & Sons,
1981. P. 280.
bkcs.2010.31.5.1400
45.
Гуринович Г.П., Севченко А.Н., Соловьев К.Н. Спек-
36.
Gross Z., Saltsmann I., Pandian R.P., Barzilay C. //
троскопия хлорофилла и родственных соединений.
Tetrahedron Lett. 1997. Vol. 38. P. 2383. doi 10.1016/
S0040-4039(97)00357-2
Минск: Наука и техника, 1968. C. 520.
37.
Ullman A., Manassen J. // J. Am. Chem. Soc. 1975.
46.
Tagawa K., Mori S., Okujima T., Takase M., Uno H. //
Vol. 97. P. 6540. doi 10.1021/ja00855a042
Tetrahedron. 2017. Vol. 73. P. 794. doi 10.1016/j.
38.
Schmidt N., Fink R., Hieringer W. // J. Chem. Phys.
tet.2016.12.067
2010. Vol. 133. N 5. P. 54703. doi 10.1063/1.3435349
47.
Kolthoff I.M., Chantooni M.K., Sadhana Ir. // Anal.
39.
Słota R., Broda M.A., Dyrda G., Ejsmont K., Mele G. //
Chem. 1967. Vol. 39. N 13. P. 1627. doi 10.1021/
Molecules. 2011. Vol. 16. N 12. P. 9957. doi 10.3390/
ac50156a039
molecules16129957
48.
Иванова Ю.Б., Шейнин В.Б., Мамардашви-
40.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
ли Н.Ж. // ЖОХ. 2007. Т. 77. Вып. 8. С 1448;
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
Ivanova Yu.B., Sheinin V.B., Mamardashvili N.Zh. //
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Russ. J. Gen. Chem. 2007. Vol. 77. N 8. Р. 1458. doi
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
10.1134/S1070363207080270.
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
49.
Крук М.М., Иванова Ю.Б., Шейнин В.Б., Стару-
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
Honda Y., Kitao O., Nakai H., Vreven T., Montgo-
хин А.С., Мамардашвили Н.Ж., Койфман О.И. //
mery J.A., Peralta J.E., Ogliaro F., Bearpark M.,
Макрогетероциклы. 2008. Т. 1. С. 50; Kruk M.M.,
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
Ivanova Yu.B., Sheinin V.B., Starukhin A.S.,
Kobayashi R., Normand J., Raghavachari K., Rendell A.,
Mamardashvili N.Zh., Koifman O.I.
/ /
Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N.,
Macroheterocycles. 2008. Vol. 1. P. 50. doi 10.6060/
Millam J.M., Klene M., Knox J.E., Cross J.B.,
mhc2008.1.50
Bakken V., Adamo C., Jaramillo J., Gomperts R.,
50.
Reimers J.R., Hall L.E. // J. Amer. Chem. Soc. 1999.
Stratmann R.E., Yazyev O., Austin A.J., Cammi R.,
Vol. 121. P. 3730. doi 10.1021/ja983878n
Pomelli C., Ochterski J.W., Martin R.L., Morokuma K.,
51.
Kruk M.M., Starukhin A.S., Maes W.
/ /
Zakrzewski V.G., Voth G.A., Salvador P., Dannen-
Macroheterocycles. 2011. Vol. 4. N 2. P. 69. doi
berg J.J., Dapprich S., Daniels A.D., Farkas Ö.,
10.6060/mhc2011.2.01
Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J.
52.
Пуховская С.Г., Иванова Ю.Б., Дао Тхе Нам, Ва-
Gaussian 09, Revision D.01. Gaussian Inc.: Wallingford
шурин А.С. // ЖФХ. Т. 88. № 10. С. 1670; Pukhov-
CT. 2009.
41.
Feller D. // J. Comp. Chem. 1996. Vol.
17.
skaya S.G., Ivanova Yu.B., Nam D.T., Vashurin A.S. //
N 13. P.
1571. doi
10.1002/(SICI)1096-
Russ. J. Phys. Chem. (A). 2014. Vol. 88. N 10. P. 1670.
987X(199610)17:13<1571:AID-JCC9>3.0.CO;2-P
doi 10.1134/S0036024414100288
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022
276
ИВАНОВА и др.
Physico-Chemical Basis for Creation of Liquid-Phase Sensor
Materials Based on Tetraaryldithiaporphyrins
Y. B. Ivanovaa,*, S. G. Pukhovskayab, A. N. Kiseleva, and S. A. Syrbua
a G.A. Krestov Institute of Solution Chemistry of the Russian Academy of Sciences, Ivanovo, 153045 Russia
b Ivanovo State University of Chemistry and Technology, Ivanovo, 153460 Russia
*e-mail : jjiv@yandex.ru
Received October 8, 2021; revised November 22, 2021; accepted November 25, 2021
Basic properties of 5,10,15,20-tetraaryl-21-thia- and 5,10,15,20-tetraaryl-21,23-dithiaporphyrins in acetonitrile
were investigated spectrophotometrically. The optimization of the geometric parameters of heteroporphyrins
in the DFT approximation (hybrid functional B3LYP/6-311G) was carried out. Тhe results of a study of the
relationship between the geometric structure of the studied porphyrins and the main and spectral properties
are presented. For the first time, the ability of doubly protonated forms of thia-substituted heteroporphyrins
to coordinate perchlorate- and trifluoroacetate-ions in neutral solvents was discovered, which can be used to
create liquid-phase sensor materials.
Keywords: porphyrin, heteroporphyrin, acid-base properties
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 2 2022