ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 3, с. 331-392
УДК 542.973
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ В
ОРГАНИЧЕСКОМ СИНТЕЗЕ (ОБЗОР)
© 2022 г. Е. А. Поповаа-с, Ю. А. Пронинаа, А. В. Давтяна, Г. Д. Непочатыйа, М. Л. Петрова,
В. М. Бойцовd,e, А. В. Степакова,f,*
a Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
b Санкт-Петербургский государственный химико-фармацевтический университет,
Санкт-Петербург, 197376 Россия
с Институт высокомолекулярных соединений Российской академии наук, Санкт-Петербург, 199004 Россия
d Санкт-Петербургский национальный исследовательский академический университет имени Ж. И. Алфёрова
Российской академии наук, Санкт-Петербург, 194021 Россия
е Первый Санкт-Петербургский государственный медицинский университет имени академика И. П. Павлова,
Санкт-Петербург, 197022 Россия
f Санкт-Петербургский государственный университет, Санкт-Петербург, 198504 Россия
*e-mail: alstep@yandex.ru
Поступило в Редакцию 3 февраля 2021 г.
После доработки 16 февраля 2022 г.
Принято к печати 18 февраля 2022 г.
В обзоре рассмотрены опубликованные за последние 5 лет работы, посвященные синтезу, модификаци-
ям и применению хиральных катализаторов на основе скварамидов в органическом синтезе. Материал
обзора представлен по типам реакций, катализируемым скварамидными органокатализаторами: реакции
Михаэля, Манниха, Пикте-Шпенглера, Фриделя-Крафтса, Генри, альдольной конденсации, циклопри-
соединения. Для каждой реакции рассмотрен механизм, демонстрирующий каталитическое действие
скварамидных органокатализаторов.
Ключевые слова: органический синтез, хиральные скварамиды, энантиоселективный органокатализ,
реакция Манниха, реакция Фриделя-Крафтса, реакция Генри, реакция Пикте-Шпенглера, реакции
циклоприсоединения
DOI: 10.31857/S0044460X22030015
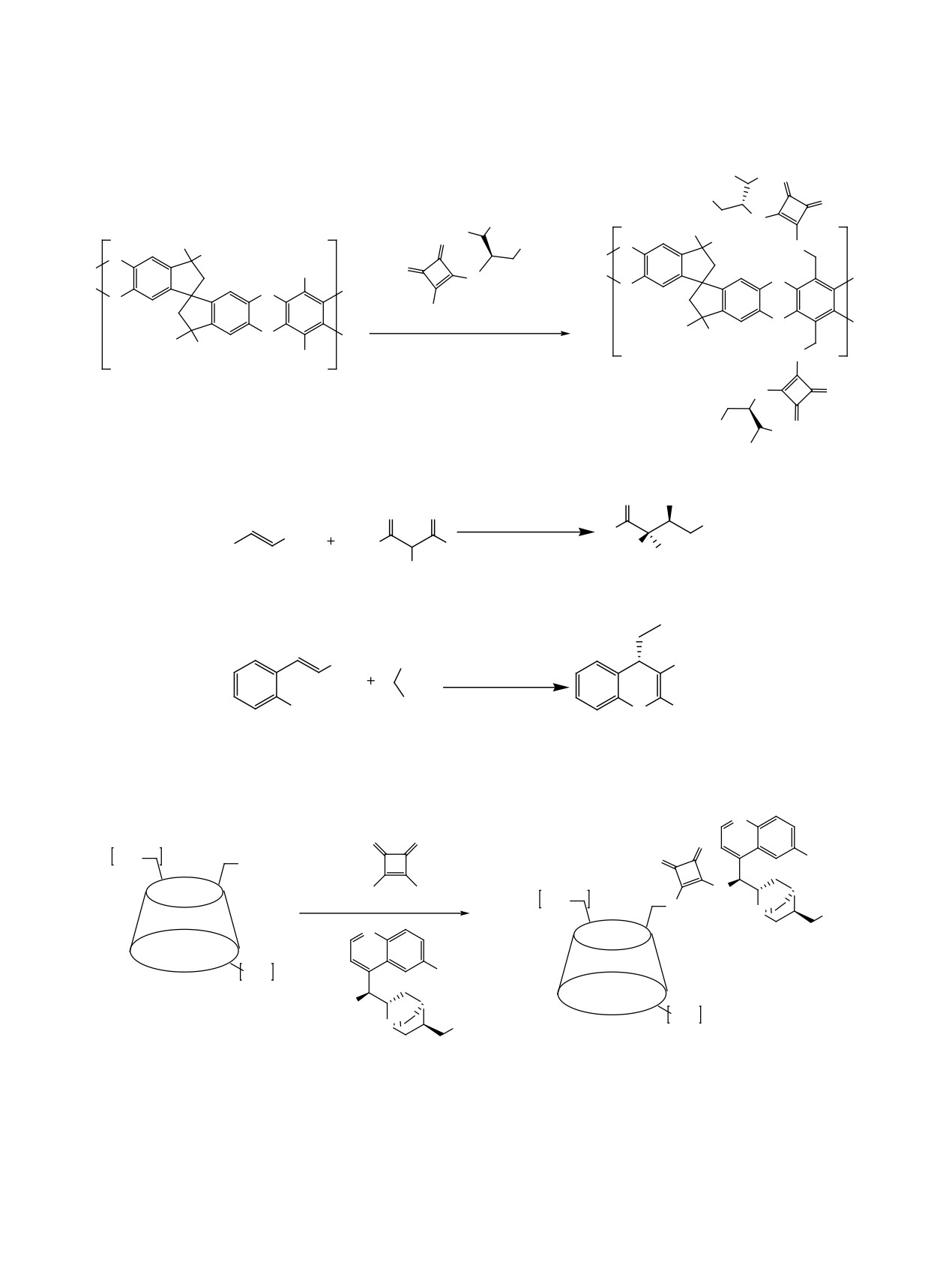
1. Введение
332
2. Реакция присоединения по Михаэлю
333
3. Реакция Манниха
353
4. Реакция Пикте-Шпенглера
358
5. Реакция Фриделя-Крафтса
360
6. Реакция альдольной конденсации
369
7. Реакция Генри
374
8. Циклоприсоединение
379
9. Заключение
386
331
332
ПОПОВА и др.
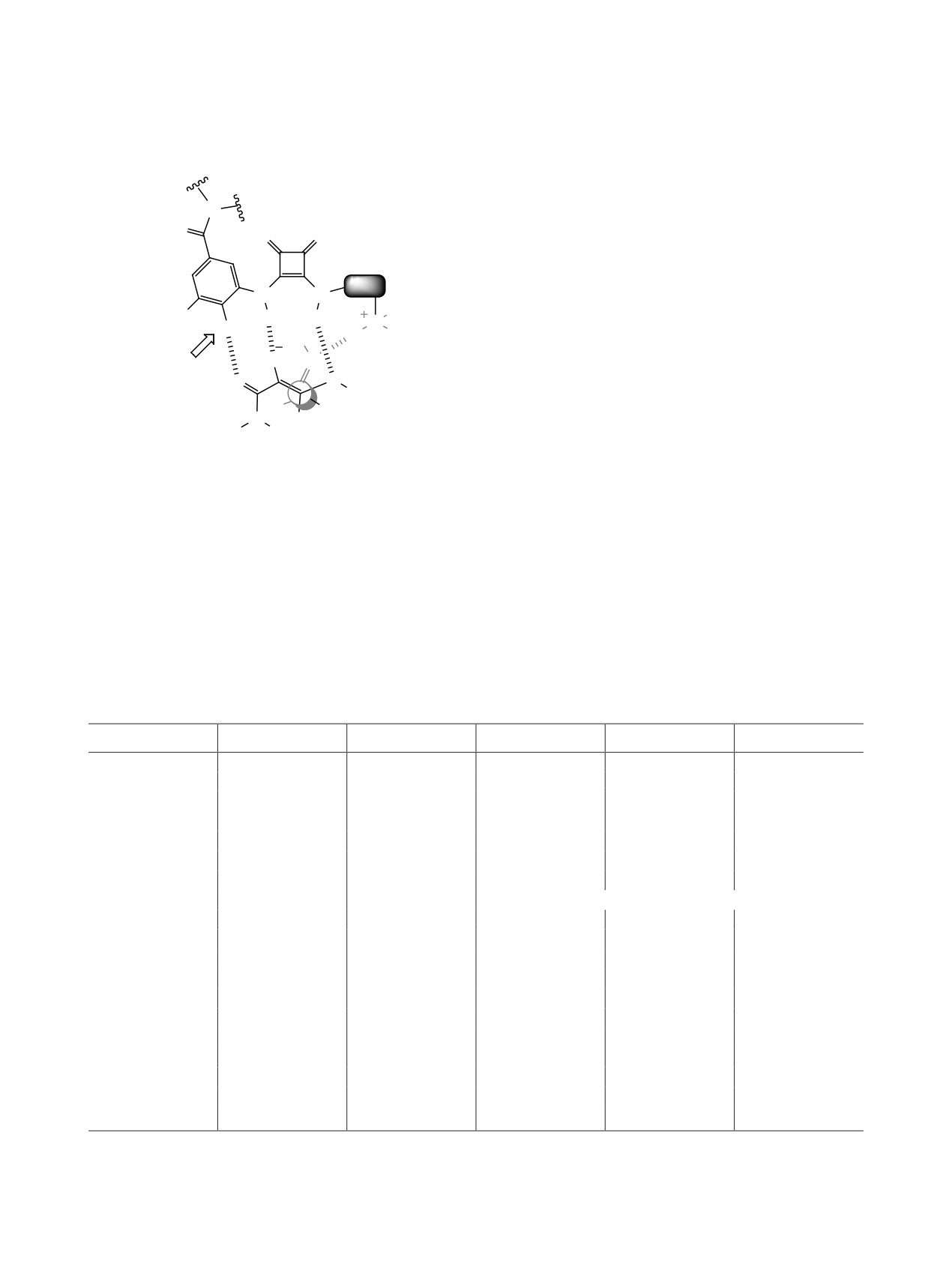
1. ВВЕДЕНИЕ
самого вещества. Подводя итог вышесказанному:
влияние скварамидов на энантиоселективность
В настоящей работе сделана попытка система-
реакции сводится к созданию хиральной клетки
тического обзора материала, относящегося к при-
внутри среды растворителя, которая формируется
менению хиральных скварамидных соединений
благодаря образованию водородных связей между
в качестве органокатализаторов различных реак-
катализатором и реагентами [2-4].
ций. Проанализированы работы, опубликованные
С помощью метода перекрывающихся инди-
за последние 5 лет. Отдельно отметим, что приме-
каторов в работе [5] было установлено, что сква-
нение скварамидов не ограничивается только хи-
рамиды имеют более высокую кислотность по
ральным катализом, их успешно используют как
сравнению с органокатализаторами на основе ти-
строительные блоки супрамолекулярных систем,
омочевины. Из этого был сделан вывод, что сква-
в качестве хемосенсоров распознавания анионов
рамидные катализаторы могут образовывать более
и лекарственных веществ [1]. Применение сквара-
сильные водородные связи с реагентами катализи-
мидов в качестве энантиоселективных катализато-
руемого процесса. Различие в кислотности объяс-
ров можно образно сравнить с пошивом обуви на
няется не только псевдоароматичностью и разли-
заказ: подобно мастеру, создающему обувь, в точ-
чием в электроотрицательности атомов кислорода
ности по лекалам заказчика, исследователь, прово-
и серы, но и расстоянием между атомами азота (у
дя химические модификации, может настраивать
скварамидов оно больше на 0.6 Å).
структуру катализатора под определенную реак-
цию. Именно эта уникальная особенность данных
Синтез скварамидов был впервые осуществлен
каталитических систем вызывает к ним повышен-
в 1966 г. [6]. Ставший классическим метод полу-
ный интерес широких кругов химиков-синтети-
чения скварамидов дает большое разнообразие
ков. Органокатализаторы на основе скварамида
производных, в зависимости от строения ами-
отличаются простотой и экономичностью синте-
нов, вводимых в реакцию с диметиловым эфиром
за, они устойчивы к влаге и кислороду воздуха,
сквараиновой кислоты. В качестве катализаторов
легко регенерируются из реакционной среды. Все
скварамиды впервые были использованы в 2008 г.
перечисленное выше делает их привлекательны-
[7]. Авторами был синтезирован хиральный сква-
ми объектами для использования в органическом
рамидный катализатор С1 (схема 2), каталитиче-
синтезе.
ская активность которого была изучена в реакции
Михаэля (схема 3). Выходы продуктов реакции
Молекула скварамида, представляющая собой
и энантиоселективность процесса оказались до-
совокупность жесткой плоской циклобутеновой
статочно высокими. С этого момента и по сегод-
системы, двух доноров (NH) и двух акцепторов
няшний день наблюдается бурное развитие химии
(С=O) водородной связи, имеет частично арома-
скварамидных катализаторов, и с каждой последу-
тический характер (схема 1). Ароматичность в
ющей работой открываются новые возможности
скварамидах возникает благодаря делокализации
их применения.
неподеленной электронной пары одного из ато-
мов азота, что подтверждается правилом Хюкке-
ля. Делокализация электронной плотности может
возрастать при комплексообразовании, которое
Схема 1.
происходит посредством анион-π-, неподеленная
Акцепторы водородных связей
пара–π и C-H/π-взаимодействий. Протон у атома
N в этом случае становится более подвижным бла-
O
O
годаря делокализации неподеленной электронной
пары азота, что усиливает возможности системы
R
R
к образованию водородных связей. Свобода вра-
N
N
щения вокруг связи СAr-N в молекуле скварами-
H
H
да зависит от строения заместителей при атомах
Доноры водородных связей
азота, температуры, растворителя, и концентрации
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
333
Схема 2.
O
O
F3C
O
O
NH
2
F3C
CH2Cl2
OMe
N
H
MeO
OMe
CF3
CF
3
(85%)
H
NH2
H
N
O
O
N
H
F3C
N
HN
N
H
MeOH
H
CF3
N
C1 (72%)
Схема 3.
O
O
O O
0.5 мол% C1
Me
Me
NO2
Me
Me
Ph
CH2Cl2, 20oC, 8 ч
NO2
Ph
2
(94%, ee >99%)
1
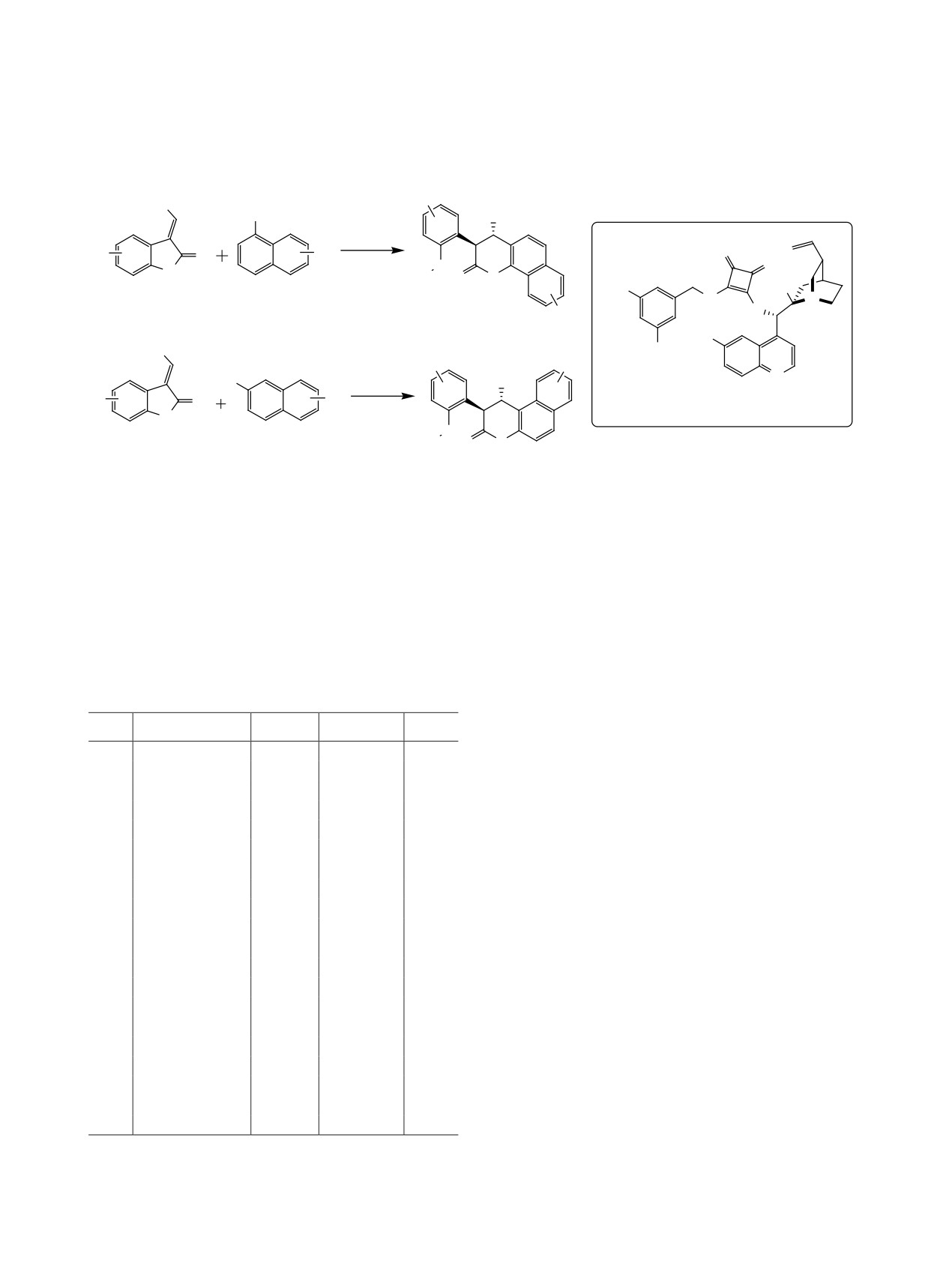
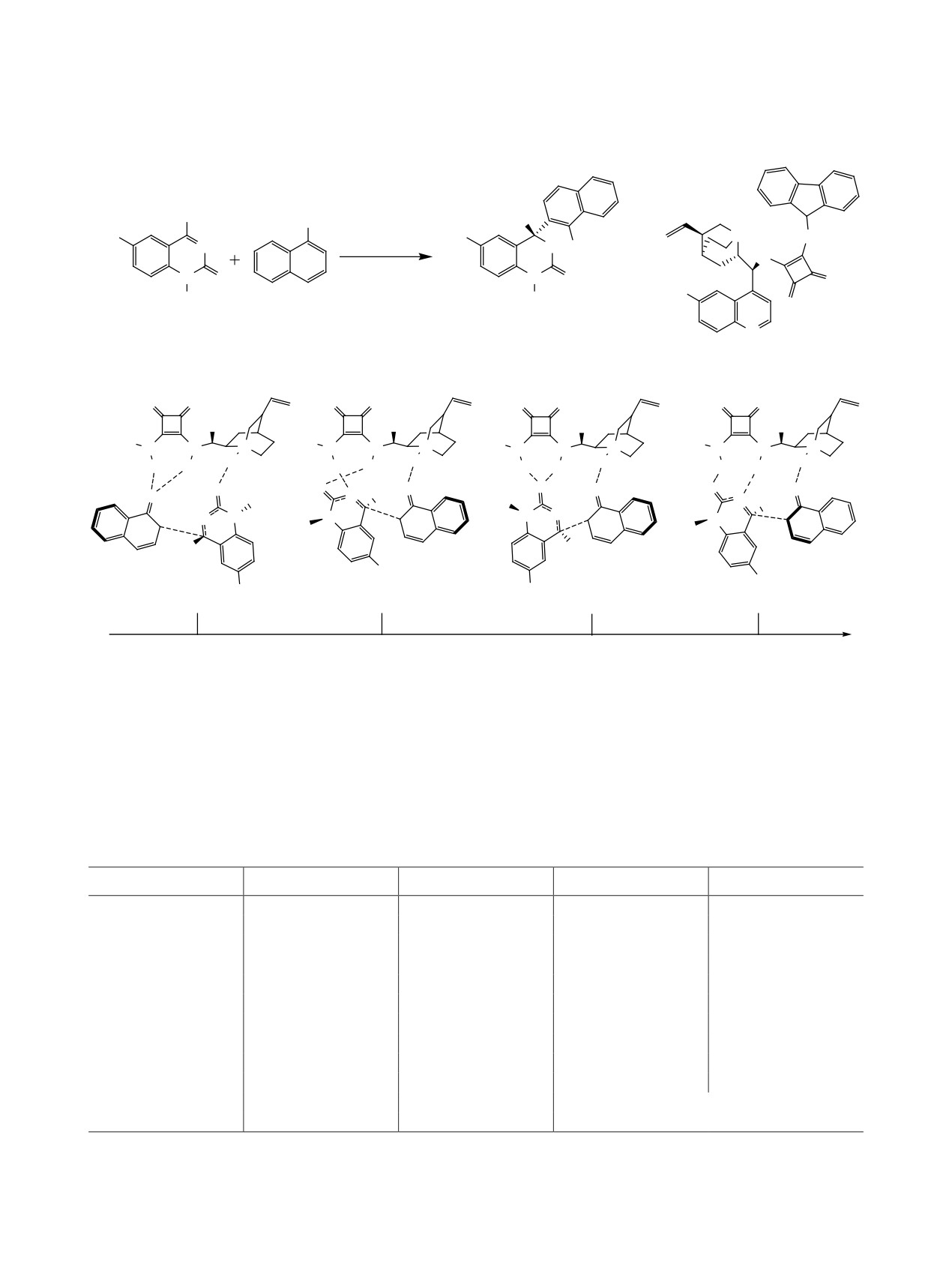
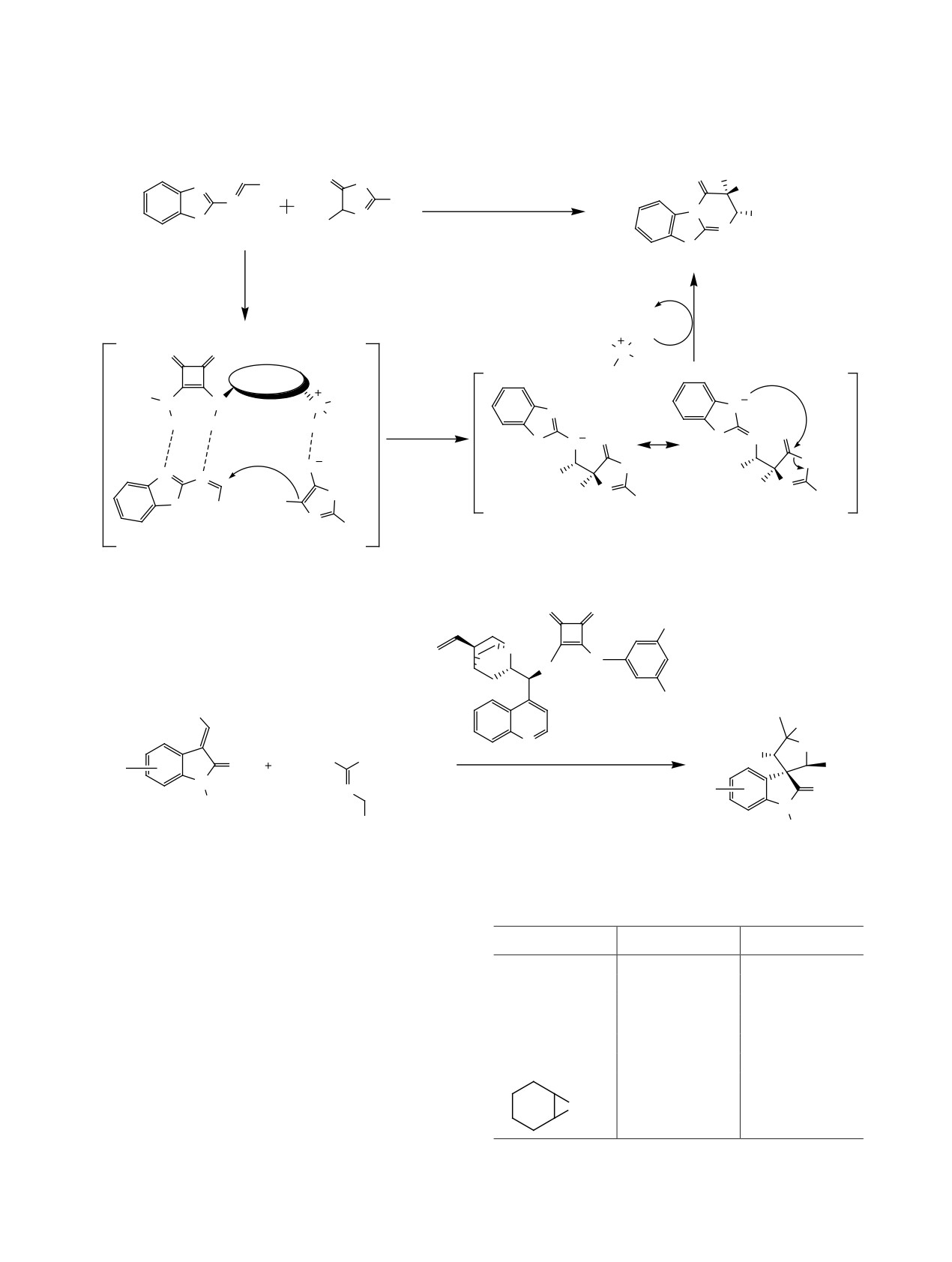
Ранее было опубликовано несколько обзоров,
В данном обзоре мы постарались показать
посвященных синтезу и использованию сквара-
всю красоту и разнообразие структур хиральных
мидных катализаторов. В обзоре [1] рассмотрены
скварамидных органокатализаторов, для которых
последние достижения в использовании сквара-
доступна широкая возможность варьирования за-
мидов в химических исследованиях. Авторами
местителей при атомах азота для получения соеди-
представлена информация о применении сквара-
нений с необходимыми свойствами, что позволяет
мидов в супрамолекулярной химии, органоката-
использовать их для проведения разнообразных
лизе, технологиях молекулярно распознавания,
реакций с хорошими выходами и высокой энанти-
медицинской химии и биоконъюгации. В работе
оселективностью.
[8] большое внимание уделено сравнению свойств
2. РЕАКЦИЯ ПРИСОЕДИНЕНИЯ
органокатализаторов на основе тиомочевины и
ПО МИХАЭЛЮ
скварамида. В 2017 г. была опубликована обзорная
работа по скварамидам, в которой основное вни-
Реакция присоединения по Михаэлю является
мание акцентировалось на использовании этих со-
одной из базовых реакций формирования связей
единений в реакциях присоединения по Михаэлю [9].
С-С в органической химии и признанным мощ-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
334
ПОПОВА и др.
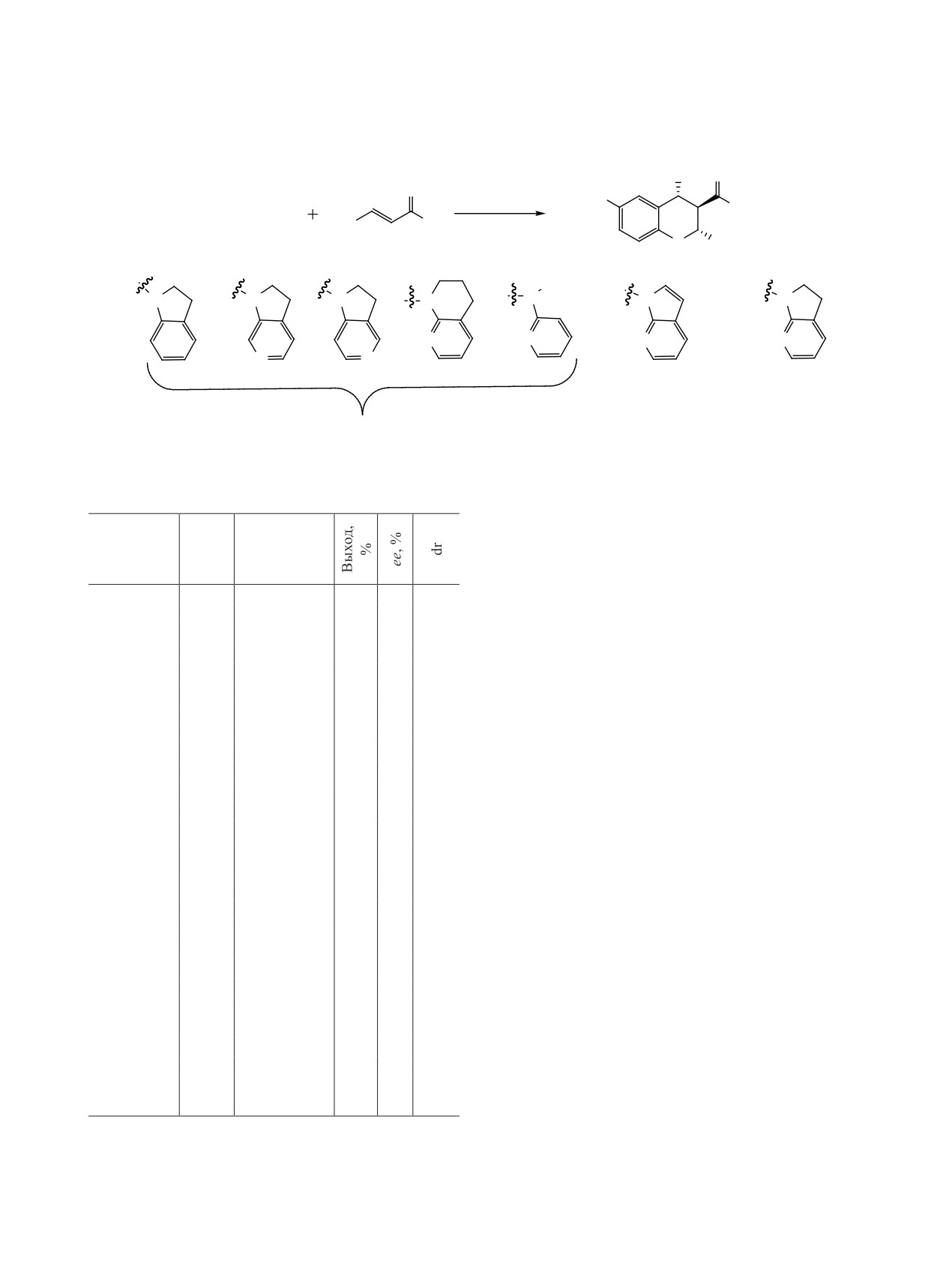
Таблица 1. Препаративные и оптические выходы сое-
ном типе реакций, протекающих в присутствии
динений 7
скварамидного органокатализатора С2, электро-
фил активируется протонированным амином ка-
Выход,
R1
R2
Время, ч
ee, %
%
тализатора, а нуклеофил связывается со сквара-
мидом посредством водородной связи (Б, схема 5)
Ph
Ph
25
>99
97
[10]. Переходные состояния А и В энергетически
Ph
3-Tol
22
>99
95
Ph
4-Tol
23
>99
96
менее выгодны на 2.1 ккал/моль.
4-Tol
Ph
22
>99
97
В работе [11] изучена реакция между метилтио-
Ph
2-MeOC6H4
21
>99
82
гликолатом 5 и производными халкона 6 в при-
Ph
3-MeOC6H4
25
>99
96
сутствии сквадрамидных катализаторов (схема 6,
Ph
4-MeOC6H4
42
>99
99
табл. 1). Авторы провели скрининг десяти сква-
Ph
3-FC6H4
19
>99
96
рамидов С3а-С3д и С4а–С4д (схема 6), среди
Ph
2-ClC6H4
19
>99
86
которых, субстраты, содержащие адамантильные
Ph
3-ClC6H4
23
>99
96
фрагменты, показали лучшую энантиоселектив-
Ph
4-ClC6H4
21
>99
96
ность. По реакционным условиям следует отме-
Ph
2-BrC6H4
22
>99
81
тить, что толуол оказался оптимальным раствори-
Ph
3-BrC6H4
20
>99
96
телем, не влияющим на каталитические свойства
4-BrC6H4
Ph
21
>99
96
скварамида, а самая высокая энантиоселектив-
Ph
2-CF3C6H4
20
>99
79
ность была достигнута в присутствии 10 мол%
Ph
4-CF3C6H4
20
>99
95
катализатора С4б при -40°С. Полученные продук-
Ph
2-NO2C6H4
25
>99
68
ты сульфоприсоединения по Михаэлю (в данном
Ph
3-NO2C6H4
22
>99
76
Ph
4-NO2C6H4
20
>99
95
случае R-энантиомеры) являются ценными строи-
4-NO2C6H4
Ph
21
>99
91
тельными блоками для получения лекарственных
Ph
2-Фурил
41
>99
91
препаратов, например, они используются в синте-
Ph
2-Тиенил
41
>99
95
зе противоастматического средства Монтелукаст
Phа
Ph
24
>99
93
(Montelukast) [12].
а Синтез в граммовом масштабе.
В 2018 г. группа С.Г. Злотина разработала
С2-симметричные бифункциональные тетраами-
носкварамидные органокатализаторы (схема 7),
ным синтетическим инструментом при создании
которые были использованы в ассимметричной
огромного числа биологически активных веществ.
домино-реакции присоединения по Михаэлю/
Грейсон показал на примере реакции присоеди-
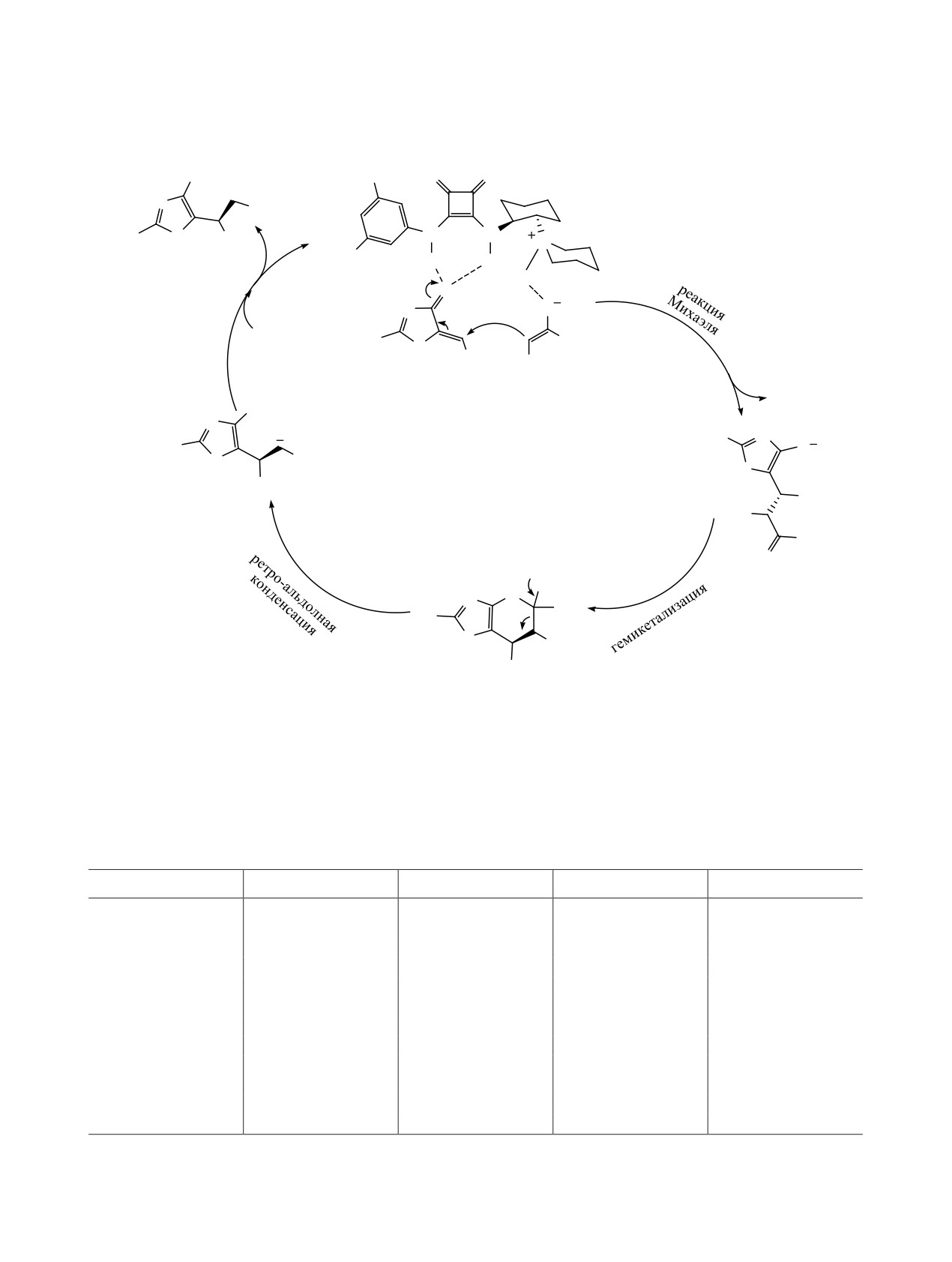
гемикетализации между производными койевой
нения нитроалкана 4 к енону 3 (схема 4), что в дан-
кислоты 8 и β,γ-ненасыщенными α-кетоэфирами 9
Схема 4.
MeO
N
CF3
NH
N
N
O
H
CF3
O
NO2
O
O
C2 (2 мол%)
CH3NO
2
Ph
Ph
Ph
Ph
1,2-C2H4Cl2, 80°C
1
2
(ee 95%)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
335
Схема 5.
O
O
O
O
O
O
N
N
N
N
N
N
H H
H H
H H
N
N
N
Nu
H
H
E
H
Nu
E
Nu
E
A
Б
B
O
O
Nu =
N
еноновый
E =
электрофил
Схема 6.
OCH3
O
O
O S
O
10 мол%
С4б
SH
2
R1
R2
R1
R
H3CO
толуол, -40°C
5
6
7
(>99%, ee 68-99%)
F3C
CF3
O
R
O
O
NH
X NH
R
O
N
NH
H
NH
HN
H
H
H
H
N
NH
N
F3C
N
N
NH
OMe
N
N
N
X
OMe
Me2N
Me2N
CF3
N
C3г,
X = O
C4a,
R = 1-адамантил
R = 1-адамантил
C3a,
X = O
C4г,
C3д,
X = S
C4б,
R = 2-адамантил
X = S
R = 2-адамантил
C3б,
C4д,
трет-бутил
C4в,
R =
трет-бутил
R =
C3в,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
336
ПОПОВА и др.
Схема 7.
N
N
(R)(R)
(S)(S)
(R)(R)
O
O
O
O
O
O
NH
HN
NH
HN
NH
HN
O
O
O
O
O
O
NH
HN
NH
HN
NH
HN
N
(R)
N
N
(R)
N
N
(R)
N
(R)
(R)
(R)
(R)
(R)
(R)
(R)
(R)
(R)
C5
C6
C7
(R)(R)
(R)(R)
(S)(S)
N
N
N
N
O
O
O
O
O
O
NH
HN
NH
HN
NH
HN
O
O
O
O
O
O
NH
HN
NH
HN
NH
HN
N
N
N
(R)
N
N
(S)
(S)(S)
N
(R)
(R)
(R)
(S)
(R)
(R)
(R)
(R)
C8
C9
C10
Схема 8.
O
O
OH
O
OH
O
CO2Me
OMe
1 мол% C7
R2
O
O
CH2Cl2, 20oC, 8 ч
O
R1
R2
R1
8
9
10
(84-99%, ee 92-99%)
(схема 8) [13]. Реакции проводили с использовани-
хинолиновые группы, возможно депротониро-
ем 1 мол% катализатора в среде дихлорметана при
вание производных койевой кислоты основным
комнатной температуре в течение 8 ч, в результате
атомом азота хинолина, что в свою очередь ведет
продукты 10 были получены с высокими выхода-
к нарушению стереохимической целостности са-
ми (94-99%) и высокой энантиоселективностью
мого каталитического процесса. Наблюдаемую
(ее 92-99%, табл. 2). Стоит отметить, что при ис-
стереохимию авторы объясняют двумя возмож-
пользовании водной среды реакция проходит за
ными переходными состояниями ПС-1 и ПС-2
30 мин с аналогичными выходами, но энантиосе-
(схема 9). В обоих случаях атака депротонирован-
лективность понижается до 70%. При скрининге
ного пиперидиновым фрагментом производного
катализаторов, лучшими оказались катализаторы
койевой кислоты на α-кетоэфир обеспечивается за
С7 и С8, содержащие нафталиновые группы. Для
счет образования водородных связей со стериче-
реакций с участием скварамидов, содержащих
ски затрудненным катализатором.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
337
Таблица
2. Препаративные и оптические выходы
Таблица 3. Препаративные и оптические выходы сое-
2,3,4,8-тетрагидропирано[3,2-b]пиранов 10
динений 12
R1
R2
Выход, %
еe, %
R1
R2
H
Ph
99
96
H
Ph
6
99
97
MeO
4-CNC6H4
95
99
Cl
Ph
8
99
>99
MeO
1-Фурил
84
99
OMe
Ph
6
99
>99
C6H5S
Ph
98
99
SPh
Ph
8
99
>99
4-FC6H4S
Ph
98
96
2-FC6H4S
Ph
12
99
>99
2-FC6H4S
Ph
97
99
2-ClC6H4S
Ph
12
99
>99
2-FC6H4S
4-CNC6H4
98
95
1-Пиперидинил
Ph
6
99
53
2,4-F2C6H3S
Ph
96
98
4-Морфолинил
Ph
6
99
90
2,4-F2C6H3S
4-CNC6H4
96
99
Me
4-MeOC6H4
6
95
92
4-ClC6H4S
Ph
93
97
Me
2,4-Cl2C6H3
24
95
91
4-ClC6H4S
4-CNC6H4
98
99
Me
3-Циклопентил-4-
24
80
99
Cl
Ph
91
94
MeOC6H4
4-Морфолинил
Ph
99
92
OMe
2-Тиенил
20
99
98
В работе [14] был синтезирован С2-симметрич-
и тот же катализатор до 7 раз, выделяя его из реак-
ный хиральный скварамид C11, который в даль-
ционной среды. Реакция также может протекать в
нейшем использовали в реакции Михаэля между
воде. По мнению авторов, доступность и простота
производными койевой кислоты 8 и нитроолефи-
синтеза данного катализатора делают его привле-
нами 11 (cхема 10). В присутствии 1 мол% катали-
кательным для использования в фармацевтической
затора соответствующие аддукты были получены
промышленности.
с практически количественным выходом и энан-
В работе [15] был разработан бифункциональ-
тиоселективностью до 99% (табл. 3). Из-за своей
ный сквадрамидный органокатализатор на осно-
чрезвычайно низкой растворимости в органиче-
ве ионной жидкости С12, который использовали
ских растворителях катализатор может быть легко
в ассиметричной домино-реакции аза-Михаэля/
регенерирован. Авторы работы использовали один
Михаэля между халконами 13 и β-нитроолефинами
Схема 9.
O
O
O
O
N
N
N
N
N
H
H
N
H
H
H
H
O
O
O
O
O
O
O O
OMe
MeO
O
Ph
Ph
O
MeO
MeO
ПС-2
ПС-1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
338
ПОПОВА и др.
Схема 10.
O
O
N
N
H
H
N
N
O
O
OH
OH
C11 (1 мол%)
NO2
R2
NO2
O
O
EtOH, 20°C, 6-24 ч
1
R
R2
R1
8
11
12
(80-99%, ee 53-99%)
Схема 11.
F3C
O
O
N
N
F3C
H
H
N
PF6
O
N
Me
C(O)Ph
N
O
4
NO2
O
Ph
C12 (5 мол%)
NO2
2
R
, 20oC
CH2Cl2
NH
N
R2
R1
R1
13
11
14
(87-99%, ee 92-99%)
11 (cхема 11). Реакция протекала в среде дихлор-
Продолжая тему каскадных реакций, хочется
метана при комнатной температуре в течение 3-
отметить публикацию [17], посвященную взаи-
20 ч, продукты реакции были получены с высоки-
модействию α,β-ненасыщенных
7-азаиндолино-
ми выходами (до 99%) и энантиоселективностью
вых амидов 15 с 2-меркаптобензальдегидами 16
(до 99%) (табл. 4). Применение скварамидного ка-
в присутствии хирального скварамидного органо-
тализатора в данной реакции обеспечивает легкий
катализатора С13, содержащего фрагмент цинхо-
доступ к хиральным производным ферроцена и
нидина. Реакция протекала в среде дихлорметана
цимантрена, некоторые из которых обладают про-
при комнатной температуре с 1 мол% катализато-
тивоопухолевой активностью [16]. По данным ав-
ра, приводя к образованию с высокими выходами
торов, катализатор может быть регенерирован из
(98-99%), энантиоселективностью (92-99%) и ди-
реакционной смеси до 19 раз. Суммарное время
астереоселективностью (>20:1) тиохроманов
17
работы катализатора первой загрузки составляет,
(схема 12, табл. 5). Природа заместителей R2 в
в среднем, около 230 ч без негативного влияния на
исходных меркаптобензальдегидах 16 не оказы-
конверсию исходных соединений или энантиомер-
вает значительного влияния на ход реакции, в то
ную чистоту продукта.
же время строение амидной части соединения 15
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
339
Таблица 4. Препаративные и оптические выходы сое-
Таблица 5. Препаративные и оптические выходы сое-
динений 14
динений 17
Время,
ee,
R1
Выход, %
dr
ч
%
R1
R2
Время, ч
Выход, %
еe, %
Ph
48
99
>99
>20:1
4-FC6H4
58
99
>99
>20:1
4-ClC6H4
24
92
99
>20:1
4-BrC6H4
47
99
>99
>20:1
Ts
Ph
12
98
98
2-FC6H4
47
99
>99
>20:1
Ts
2-Тиенил
3
99
99
2-ClC6H4
47
99
>99
>20:1
Ts
4-BrC6H4
12
98
97
2-BrC6H4
41
99
>99
>20:1
Ts
2-BrC6H4
12
95
96
3-BrC6H4
48
99
99
>20:1
Ts
4-ClC6H4
5
98
96
2-CF3C6H4
61
99
>99
>20:1
Ts
2,4-Cl2C6H3
10
95
94
2-CNC6H4
11
99
>99
>20:1
Ts
2-ClC6H4
10
99
93
4-CNC6H4
43
99
>99
>20:1
Ts
2-NO2C6H4
5
95
98
4-NO2C6H4
48
99
>99
>20:1
Ts
3-MeOC6H4
10
94
99
2-MeOC6H4
50
99
>99
>20:1
Ts
4-BuOC6H4
15
98
98
3-MeOC6H4
55
99
>99
>20:1
Ts
13
89
92
4-MeOC6H4
62
97
>99
>20:1
2-MeC6H4
48
93
>99
>20:1
Fe
3-MeC6H4
61
88
>99
>20:1
4-MeC6H4
16
98
>99
>20:1
3,4-(MeO)2C6H3
102
94
>99
>20:1
Ts
15
87
99
2-Тиенил
96
98
>99
>20:1
Mn(CO)3
2-Фурил
96
96
99
>20:1
1-Нафтил
14
99
>99
>20:1
Nos
Ph
12
99
97
Циклогексил
15
99
>99
>20:1
Nos
2-BrC6H4
12
95
99
Phа
24
98
>99
>20:1
Nos
3-MeOC6H4
10
98
97
а R2 = Me, в остальных случаях R2 = Н.
оказывает большое влияние на ориентацию и ак-
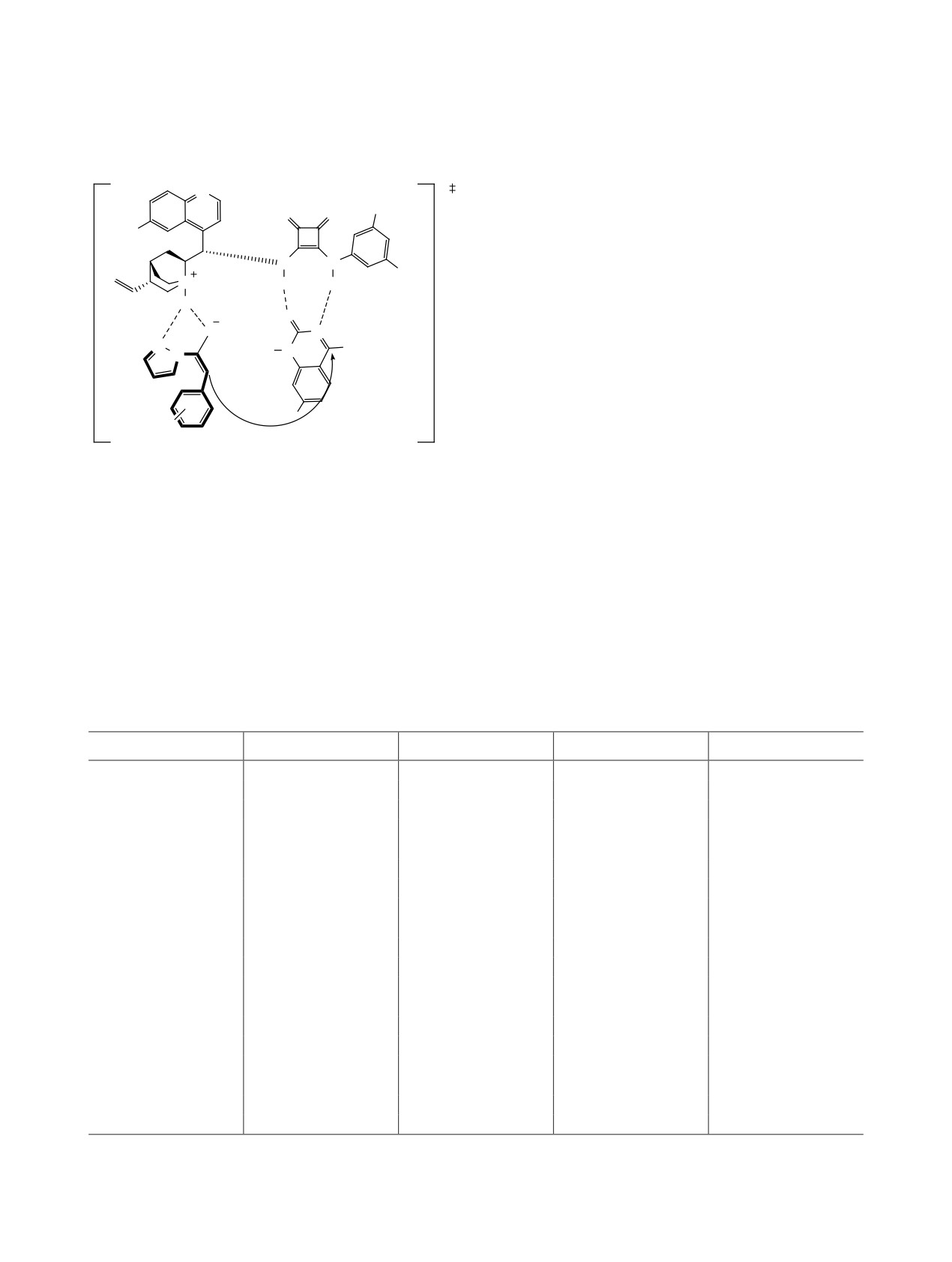
Авторами предложен механизм реакции
тивацию исходных субстратов через N-H связи со
(схема 14), в котором на первом этапе третичная
скварамидным катализатором, что было подтверж-
аминогруппа катализатора депротонирует мер-
дено рядом реакций, в которых у субстрата 15
каптогруппу с образованием аниона, в то же вре-
была заменена 7-азаиндолинамидная группировка
мя субстрат 15 активируется и ориентируется
(схема 13).
посредством двух водородных связей сквадрамид-
Схема 12.
O
OH
O
2
R
R1
N
R2
CHO
C13 (1 мол%)
N
CH2Cl2, 20°C
S
R1
N
SH
N
15
16
17
(88-99%, ee 92-99%)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
340
ПОПОВА и др.
Схема 13.
OH
O
O
C13 (1 мол%)
R2
X
16
Ph
X
CH2Cl2, 0°C
S
Ph
15
Me
N
N
N
N
N
N
X=
N
N
N
N
N
N
N
24 ч, выход 85%,
48 ч, выход 99%,
dr >20:1, ee >99%
dr >20:1, ee >99%
Реакции не прошли
Таблица 6. Препаративные и оптические выходы сое-
ной частью катализатора. После этого происходит
динений 20
Re-поверхностная атака S-аниона в β-положение
амида 15 (ПС-А). Затем протекает внутримолеку-
лярная альдольная конденсация с присоединением
R1
R2
R3
α-карбоаниона к альдегидной группе со стороны
Re-поверхности (ПС-Б). На последнем этапе про-
Ph
Me
Ph
91
94
4:1
исходит регенерация катализатора и образование
4-FC6H4
Me
Ph
77
94
4:1
продукта реакции 17 (ПС-В).
4-ClC6H4
Me
Ph
77
92
5:1
4-BrC6H4
Me
Ph
56
91
7:1
В 2019 г. группа Жао исследовала реакции при-
4-MeC6H4
Me
Ph
84
96
4:1
соединения по Михаэлю между α-замещенными
4-MeOC6H4
Me
Ph
74
97
6:1
изоцианоацетатами 18 и енонами 19, катализиру-
3-FC6H4
Me
Ph
86
90
2.5:1
емые скварамидом С14, который является произ-
3-MeC6H4
Me
Ph
88
93
6:1
водным алкалоида цинхонидина (схема 15) [18].
2-FC6H4
Me
Ph
n.r.
n.d.
n.d.
Соответствующие продукты 20, имеющие два со-
Ph
Bn
Ph
96
94
5:1
седних стереоцентра (один - четвертичный атом
Ph
t-Bu
Ph
59
98
>20:1
углерода, другой - третичный), были получены
а
Bn
Me
Ph
-
-
с высокими выходами (до 99%), энантиоселек-
Ph
Me
4-FC6H4
91
94
5:1
тивностью (до 98%) и диастероселективностью
Ph
Me
4-ClC6H4
96
94
6:1
(>20:1) (табл. 6). Авторами предложен механизм
Ph
Me
4-BrC6H4
86
91
6:1
реакции, включающий переходное состояние
Ph
Me
4-NO2C6H4
99
95
5:1
(ПС), в котором изоцианоацетатный енолят преи-
Ph
Me
4-MeC6H4
55
92
4:1
мущественно реагирует своей Si-поверхностью с
Ph
Me
4-MeOC6H4
77
93
4:1
Re-поверхностью енона 19, что приводит к образо-
Ph
Me
3-FC6H4
98
94
5:1
ванию основного стереоизомера с конфигурацией
Ph
Me
3-ClC6H4
94
94
5:1
Ph
Me
3-MeC6H4
82
94
5:1
(2R,3R) (схема 16).
Ph
Me
2-FC6H4
87
92
11:1
В работе [19] предложен интересный метод
4Ph
Me
2-BrC6H4
83
90
6:1
синтеза
4Н-пиранонафтохинонов
23, основан-
Ph
Me
1-Нафтил
72
90
10:1
ный на двух последовательных реакциях, первая
Ph
Me
2-Фурил
82
86
2.5:1
из которых катализируется хиральным скварами-
Ph
Me
CO2Me
90
94
11:1
дом С15, а вторая - ионами серебра. Тандемная
Ph
Me
Циклогексила
-
-
энантиоселективная реакция присоединения по
а Реакция не идет.
Михаэлю/гидроалкоксилирования между
2-ги-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
341
Схема 14.
O
O
CF3
N
16
17
HN HN
H
CF3
N
15
N
C13
N
O
O
CF3
H
N
O
O
N
N
H
CF3
H
H
H
CF3
N
N
N
H
O
O
H
H
N
CHO
CF3
N
O
N
N
SH
N
S R
R
ПС-В
Re-поверхностная
O
O
атака
CF3
H
N
ПС-А
N
N
H
H
H
Re-поверхностная
CF3
атака
O
O
N
C
H
N
S R
ПС-Б
Схема 15.
Et
MeO
N
CF3
H
H
NH
N
CN
2
N
R1
CO2R
O
CF3
O
(R)
O
O
CN
H
N
N
R3
C14 (20 мол%)
(R) R3
R1
CO2R2
CHCl3, 20oC, 6 сут
18
19
20
(55-99%, ee 86-98%)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
342
ПОПОВА и др.
Таблица 7. Препаративные и оптические выходы сое-
Таблица 8. Препаративные и оптические выходы спи-
рооксиндолов 26
динений 23
R1
R2
R3
Выход, %
ee, %
H
H
Ph
93
98
R1
R2
R3
R4
H
H
1-Нафтил
94
96
H
H
2-Нафтил
88
97
4-BrC6H4
Ph
H
Boc
81
80
H
H
2-ClC6H4
81
95
4-BrC6H4
4-BrC6H4
H
Boc
86
84
H
H
2-BrC6H4
83
96
4-BrC6H4
4-ClC6H4
H
Boc
88
82
H
H
4-CF3C6H4
25
96
4-BrC6H4
4-CNC6H4
H
Boc
65
98
H
H
3-MeOC6H4
77
96
4-BrC6H4
3-BrC6H4
H
Boc
64
82
H
H
3-MeC6H4
91
96
4-BrC6H4
2-BrC6H4
H
Bocа
-
H
H
2-MeC6H4
93
95
4-BrC6H4
4-MeC6H4
H
Boc
73
71
H
H
3,4(-OCH2O-)C6H3
91
92
4-BrC6H4
4-MeOC6H4
H
Boc
81
68
H
H
2-Фурил
Следы
-
4-BrC6H4
2-Тиенил
H
Boc
91
34
H
H
2-Тиенил
23
99
4-BrC6H4
Me
H
Boc
26
34
H
H
н-Бутил
50
95
4-BrC6H4
Ph
H
Ts
61
14
H
H
Циклопентил
19
97
4-BrC6H4
Ph
H
Ms
92
74
MeO
H
Ph
84
97
4-BrC6H4
Ph
H
Moc
88
64
Me
Me
Ph
86
96
4-BrC6H4
Ph
H
Fmoc
70
75
MeO
H
3-MeC6H4
70
97
4-ClC6H4
Ph
H
Boc
65
81
MeO
H
1-Нафтил
84
97
4-NO2C6H4
Ph
H
Boc
54
77
Me
Me
3,4(-OCH2O-)C6H3
76
89
4-CF3C6H4
Ph
H
Boc
85
75
F
H
Ph
70
97
4-CHOC
H4
Ph
H
Boc
61
80
6
3-FC6H4
Ph
H
Boc
68
77
3-ClC6H4
Ph
H
Boc
66
80
дрокси-1,4-нафтохинонами 21 и нитроалкенами
Ph
Ph
H
Boc
66
80
22 протекала в среде дихлорметана в присутствии
4-MeC6H4
Ph
H
Boc
80
80
0.5 мол% органокатализатора и 15 мол% AgOTf
4-MeOC6H4
Ph
H
Boc
81
84
с выходами до 94% и энантиоселективностью до
1-Нафтил
Ph
H
Boc
70
84
4-BrC6H4
Ph
5-Cl
Boc
86
66
98% (схема 17, табл. 7). Авторами был предложен
4-BrC6H4
Ph
6-Cl
Boc
88
81
механизм реакции (схема 18), включающий два
4-BrC6H4
CF2CF3
H
Boc
59
80
каталитических цикла. Первый цикл - это энан-
4-MeC6H4
4-CNC6H4
H
Boc
90
88
тиоселективная реакция Михаэля. Во втором ка-
а Реакция не идет.
талитическом цикле происходит электрофильная
активация алкина ионом Ag+, что облегчает селек-
тивную 6-эндо-диг-циклизацию, приводящую к
промежуточному металлоорганическому соедине-
стероселективностью >25:1, что обусловлено, по
нию, деметаллирование которого приводит к про-
мнению авторов, различием в структуре исходных
дукту 23.
соединений (табл. 8). Скрининг катализаторов
В 2019 г. группой Янга на основе реакции при-
(С13, С16-С26) показал большую эффективность
скварамидных и тиомочевинных производных
соединения по Михаэлю между 3-алкилиденок-
синдолами 24 и замещенными енонами 25 был
цинхонидина по сравнению с исходными алкало-
идами цинхонидинового ряда. В данной реакции
синтезирован спирооксиндол
26, содержащий
наилучшие результаты показал органокатализатор
пять четвертичных стереоцентров (схема 19) [20].
С26, содержащий фрагмент тиомочевины.
Оптимальные условия для проведения реакции -
диэтиловый эфир, 30°С, 5 мол% катализатора.
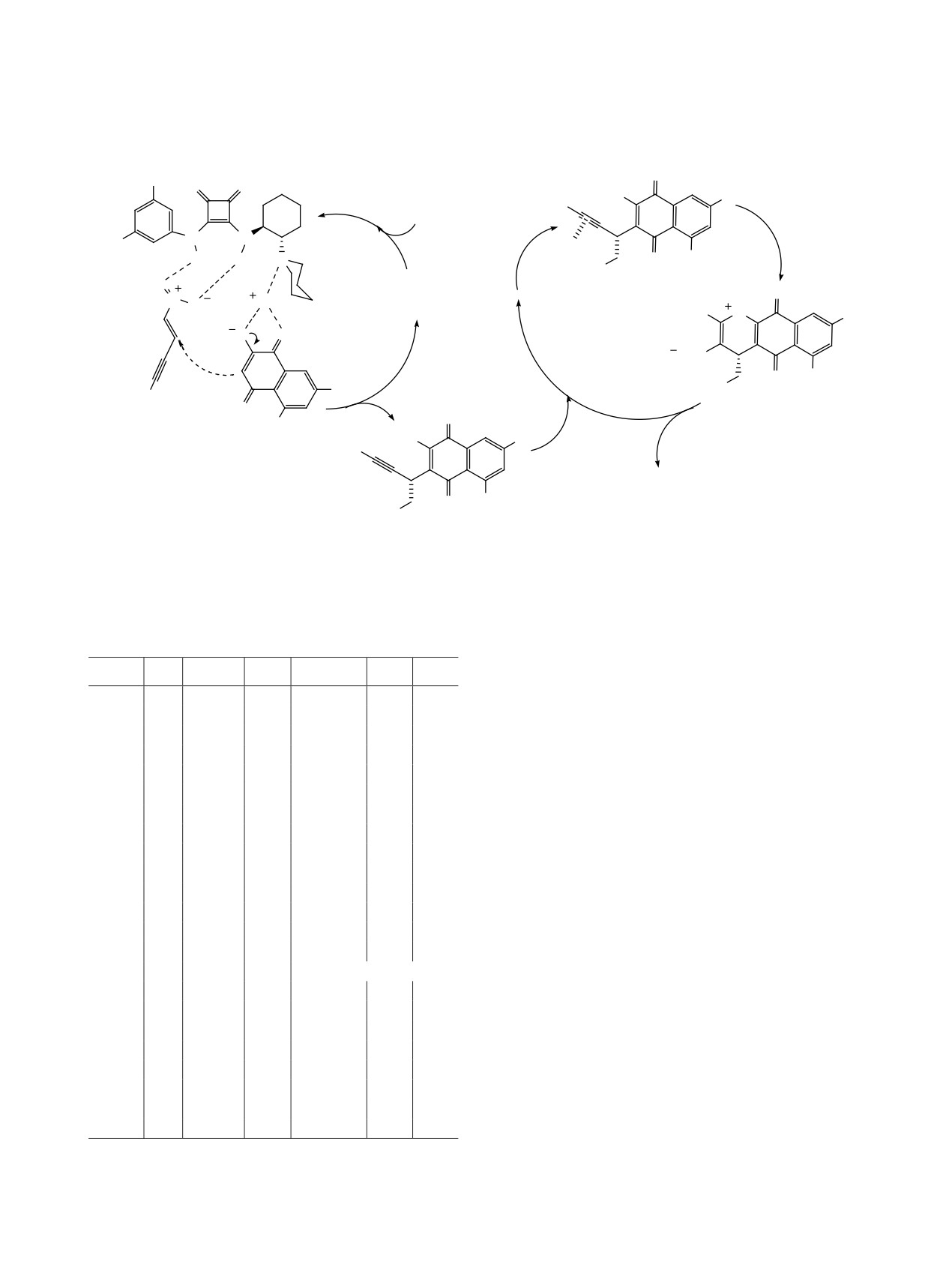
В работе [21] была реализована интересная
Продукты реакции были получены с выходами
реакция между 1,3-дикетонами 27 и ненасыщен-
26-92%, энантиослективностью 14-98% и диа-
ными пиразолонами 28 (схема 20). На первой ста-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
343
Схема 16.
Таблица 9. Препаративные и оптические выходы спи-
ропиразолонов 29
R
Время, ч
Выход, %
ee, %
dr
N
O
O
Ph
8
97
99
>99:1
F3C
2-MeOC6H4
8
86
99
>99:1
3-MeOC6H4
10
80
91
>99:1
N
N
Et
3-MeC6H4
8
80
93
96:4
H H
H
2-FC6H4
8
93
94
97:3
N
F3C
N O
H
3-FC6H4
8
86
99
>99:1
MeO O
4-FC6H4
8
78
99
>99:1
3-ClC6H4
10
92
94
>99:1
Re-поверхностная
атака
3-BrC6H4
12
88
96
>99:1
Ph
CN
Ph
4-BrC6H4
16
73
95
99:1
через Si-поверхность
3-NO2C6H4
20
71
99
98:2
4-NO2C6H4
20
74
91
>99:1
3-CF3C6H4
6
86
98
>99:1
2,4-Cl2C6H3
10
74
96
>99:1
2-Тиенил
10
93
98
>99:1
дии реакция катализируется скварамидом С27,
а циклизация образующегося промежуточного
продукта протекает в присутствии молекулярного
иода (схема 21). Реакция идет с высокими выхода-
этилиденоксидолами 31 (схема 22), протекающую
с образованием хиральных спирооксиндолов 32
ми, а применение хирального органокатализатора
обеспечивает высокую энантиоселективность (до
[22]. Реакция проходит в инертных условиях в
99%) и диастереоселективность (до >99:1) про-
присутствии 10 мол% хирального скварамида С28
цесса (табл. 9). Реакция легко масштабируется и
при комнатной температуре в смеси хлористый
представляет собой полезную стратегию для син-
метилен-ацетонитрил
(10:1). Соответствующие
теза фармацевтических препаратов, содержащих
спиропроизводные 32 были получены с выходами
спиро-дигидрофуранпиразолоновый структурный
50-97% и достаточно высокими энантиоселек-
фрагмент.
тивностью (до 98%) и диастереоселективностью
В 2019 г. Янг с сотр. представил каскадную
(dr 98:2, табл. 10). Предполагается, что первой
реакцию присоединения по Михаэлю/лактониза-
стадией реакции является присоединение по Ми-
ции между 3-гидроксиоксиндолами 30 и 3-фтор-
хаэлю, катализируемое скварамидом С28, затем
Схема 17.
1)
CF3
O
O
N
N
F3C
H
H
N
C15 (0.5 мол%)
O
O
R1
OH
R1
O R
NO2
2) AgOTf (15 мол%)
3
R3
CH2Cl2, 20°C, 3.5 ч
(R)
R2
O
R2
O
NO
2
21
22
23
(19-94%, ee 89-99%)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
344
ПОПОВА и др.
Схема 18.
O
CF3
O
O
HO
R1
R3
21+22
N
N
F3C
[Ag]
H H N
O
R2
O2N
O
C15
AgOTf
O
N O
H
H
R3
O
R1
O
O
[Ag]
O
R2
R1
O
2N
3
R
O
O
Re-поверхностная
R2
атака
HO
R1
[ПС]
R3
23
O
R2
O
2N
Таблица 10. Препаративные и оптические выходы со-
имеет место внутримолекулярная лактонизация
единений 32
(схема 22, ПС), которая сопровождается расщепле-
нием амидной связи С-N.
R1
R2
R3
R4
Выход, %
ee, %
dr
H
Me
Boc
H
96
97
98:2
В работе
[23] изучена каскадная реакция
4-Cl
Me
Boc
H
97
96
98:2
аза-присоединение по Михаэлю/циклизация по
5-Cl
Me
Boc
H
97
96
98:2
Михаэлю между 3-метилениндолинонами 33 и
5-Br
Me
Boc
H
95
97
98:2
акриламидами 34, которая приводит к получению
5-F
Me
Boc
H
95
96
98:2
соответствующих
спиро[индолин-3,3′-пипери-
6-Cl
Me
Boc
H
95
96
98:2
дин]-6′-онов 35 (схема 23). Реакция протекала в
7-Br
Me
Boc
H
82
96
99:1
мягких условиях, с высокими выходами (до 99%),
5-Me
Me
Boc
H
70
96
93:7
энантиоселективностью (>99%) и диастероселек-
5-MeO
Me
Boc
H
76
97
95:5
тивностью (dr >20:1, табл. 11). По мнению авто-
H
Bn
Boc
H
97
98
98:2
ров, активация акриламидов 34 третичным азотом
H
All
Boc
H
93
98
98:2
хинолиновой части катализатора С29 приводит к
H
H
Boc
H
94
96
97:3
N-присоединению по Михаэлю к 3-метилениндо-
H
Me
Cbz
H
90
95
95:5
лину 33 со стороны Re-поверхности, далее следует
H
Me
CO2Me
H
91
96
97:3
внутримолекулярное присоединение по Михаэлю
H
Me
Me
H
Реакция не идет
со стороны Si-поверхности, приводящее к цикли-
H
Me
Boc
5-Me
96
97
98:2
зации с получением стерически наименее затруд-
H
Me
Boc
7-Me
96
97
96:4
ненного продукта (схема 24). Реакция была удачно
H
Me
Boc
5-Cl
60
80
83:17
масштабирована, что продемонстрировало эффек-
H
Me
Boc
5-Br
50
78
83:17
тивность и практическую значимость метода.
H
Me
Boc
5-F
68
85
85:5
H
Me
Boc
6-Cl
59
90
89:11
В последние годы активно начинает развивать-
H
Me
Boc
6-Br
50
83
78:22
ся химия полимерных соединений, содержащих
H
Me
Boc
6-F
60
90
87:13
скварамидные структурные фрагменты. Органо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
345
Схема 19.
F3C
2
*
R1
R
O
Me
O
*
COCF3
O
C26
2
O
R
*
*
R3
O
R1
Et2O, 8-36 ч
*
*
N
O
R3
O
R4
N
R4
24
25
26
CF3
O
O
OH
R
F3C
N
NH
N
H
H
N
N
N
H
N
H
OH
R
N
R
C16, R = H (87%, ee 17%)
C18, R = H (87%, ee 18%)
C20, R = H (30%, ee 37%)
C17, R = OMe (92%, ee 6%)
C19, R = OMe (90%, ee 5%)
C21, R = OMe (48%, ee 43%)
R
CF3
R
H
N
S
H
N
NH
F3C
N
NH
NH
H
N
H
N
N
N
NH
O
S
CF3
CF3
N
H
O
R
F3C
F3C
C13, R = H (72%, ee 49%)
C23, R = H (83%, ee 56%)
C25, R = H (82%, ee 71%)
C22, R = OMe (63%, ee 67%)
C24, R = OMe (84%, ee 60%)
C26, R = OMe (81%, ee 80%)
Схема 20.
CF3
O
O
N
F3C
N
HN
H
N Ph
Me
N
R
R
O
O
N
O
O
O
Me
1) C27 (2 мол%), EtOAc
O
N
N
2) I2, Na2CO3, EtOAc, 2 ч
Me Me
Me Me
Ph
27
28
29
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
346
ПОПОВА и др.
Схема 21.
CF3
O
O
Me
Хиральный
N
Ph
фрагмент
N
F3C
N
N
Присоединение
H
Ph
по Михаэлю
27+28
H
H
O
O
O
O
OH
O
Ph
Ph
N
Me Me
Me Me
N
Me
I2
Me
O
Ph
Электрофил
N
Нуклеофил
N
29
Me
Ph
I
-HI
O
O
Me
H
-HI
Схема 22.
CF3
Et
O
O
4
R
N
R3HN
N
HN
F3C
H
H
O
OMe
F3C
OH
O
C28 (10 мол%)
N
CF3
R1
O
R4
O
R1
O
N
N
CH2Cl2-MeCN (10:1)
N
N2, 20oC
R2
R3
R2
30
31
32
R4
R3
N
O
-O
CF3
O
NR2
R1
ПС
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
347
Таблица 11. Препаративные и оптические выходы спи-
катализаторы на основе таких полимерных цепей
ро[индолин-3,3′-пиперидин]-6′-онов 35
привлекательны тем, что они легко регенерируют-
ся из реакционных смесей без потери активности.
5
R1
R2
R3
R4
R
В 2018 г. Уллах и Итсано сообщили о синтезе
хиральных скварамидных полимеров, содержа-
COOEt
H
H
Bn
H
84
97
щих хининовый фрагмент [24]. Наличие в моле-
COMe
H
H
Bn
H
49
95
куле скварамида винильной группы позволило ис-
COOMe
H
H
Bn
H
88
96
пользовать полимеризацию по Мизороки-Хеку с
COOt-Bu
H
H
Bn
H
83
97
участием ароматических иодидов. Реакция между
COOBn
H
H
Bn
H
91
96
хининовым скварамидным димером 36 и 1,4-ди-
COOEt
H
4-Cl
Bn
H
91
64
иодбезолом протекала гладко в среде ДМФА при
COOEt
H
4-Br
Bn
H
80
58
100°C в присутствии Pd(OAc)2, давая с выходом до
COOEt
H
5-Me
Bn
H
87
97
99% хиральный полимер С30 с молекулярной мас-
COOEt
H
5-NO2
Bn
H
95
97
сой около 4000 г/моль (схема 25). Той же группой
COOEt
H
5-F
Bn
H
99
97
исследователей был описан другой тип хиральных
COOEt
H
5-Cl
Bn
H
95
99
скварамидных полимеров, полученных на основе
COOEt
H
6-Cl
Bn
H
89
>99
реакции метатезиса хинина [25]. Полимеризация
COOEt
H
7-Me
Bn
H
48
96
скварамидного димера 37 в присутствии 5 мол%
COOEt
H
7-F
Bn
H
81
96
катализатора Ховейды-Граббса второго поколения
COOEt
H
H
Me
H
58
96
протекает гладко в среде ДМФА при 100°C и при-
COOEt
H
H
t-Bu
H
34
92
водит к образованию хирального полимера С31
COOEt
H
H
Bn
Me
Реакция не
(Mw ~6000 г/моль) с преперативным выходом 88%
идет
(схема 26). В отличие от полимеризации Мизоро-
COOEt
H
H
Bn
Ph
53
96
COOEt
Me
H
Bn
H
65
96
ки-Хека, полимеризация на основе реакции мета-
COOEt
2-Фурил
H
Bn
H
23
91
тезиса обеспечивает более жесткую конформацию
COOEt
Ph
H
Bn
H
48
92
хирального полимера и не требует использования
COOEt
3-ClС6Н4
H
Bn
H
61
91
вторичных мономеров (например, ароматических
COOEt
4-OMeС6Н4
H
Bn
H
41
91
дииодидов).
COOEt
4-ClС6Н4
H
Bn
H
64
90
Каталитическую активность этих полиме-
COOEt
4-BrС6Н4
H
Bn
H
63
92
ров проверяли в реакции присоединения по
COOEt
4-NO2С6Н4
H
Bn
H
59
89
Михаэлю между
2-оксоциклопентанкарбокси-
Схема 23.
O
F3C
O
HN
HN
N
R4O
O
R1
MeO
F3C
N
R1
R5
O
3
C29 (2 мол%)
N
R
O
R4O
2
R
N
R2
R3
N
CH2Cl2, 20oC
H
N
Boc
R5
Boc
33
34
35
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
348
ПОПОВА и др.
Схема 24.
CF3
F3C
O
CF3
O
O
N
O
N
N
F3C
N
OMe
H N
N
H
33+34
H H
OMe
N
Ph
t-Bu
O
Ph
O
N
H
O
O
O
t-Bu
O
N
N
O
O
O
N
H
N
O
O
H
O
Et
O
O
Et
Re-поверхность
Si-поверхность
N
CF3
O
O
OMe
F3C
N
NH
H
H
N
H
Ph
35
O
t-Bu
O
N
O
O
O
N
H
O
O
Et
Si-поверхность
Схема 25.
N
O O
H
N
Pd(OAc)2, ДМФА,
MeO
OMe
Et3N, 100oC, 24 ч
NH2
NH H
N
HN
N
полимеризация
H
I
I
Мизороки-Хека
H
N
NH2
N
O
O
36
O O
N
H
N
MeO
NH2
OMe
NH H
N HN
N
H
H
N
NH2
O
N
O
C30
n
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
349
латом 38 и транс-β-нитростиролом 2 (схема 27).
полимер (HBP) С32 с помощью реакции Мизоро-
Реакция в присутствии С30 протекала в среде аце-
ки-Хека между хинин-скварамидным димером 37
тонитрила при -10°C, в результате был получен
и разветвленным ароматическим иодидом; выход
продукт 39 с высоким выходом (99%), энантиосе-
полимера составил около 60%, молекулярная мас-
лективностью (98%) и диастероселективностью
са около 46000 г/моль [26] (схема 28). Хиральный
(dr >100:1). Реакция с катализатором С31 протека-
полимер С32 был использован в аналогичной ре-
ла в дихлорметане при 40°C и приводила к обра-
акции Михаэля, в результате которой был получен
зованию энантиомера 40 с выходом 82%, энанти-
энантиомер 40 с выходом до 88% и энантиоселек-
оселективностью 99% и диастероселективностью
тивностью 99% (схема 27). Авторы выдвинули
dr >100:1. Оба полимера хорошо растворимы в
предположение о влиянии структуры полимера на
сильнополярных растворителях, таких как ДМФА
стереоселективность протекания реакции, кото-
и ДМСО, но нерастворимы в большинстве других
рая, по их мнению, может зависеть от конформа-
растворителей, поэтому их легко выделить из ре-
ционной жесткости остова полимерного катализа-
акционной смеси простым фильтрованием и ис-
тора.
пользовать повторно. При повторном использова-
В последнее время стали популярны так на-
нии катализаторов С30 и С31 величины выходов,
зываемые ковалентные органические структуры
диастероселективности и энантиоселективности
(Covalent Organic Frameworks, COFs), которые яв-
продуктов реакции изменяются незначительно.
ляются классом кристаллических полимеров со
В 2019 г. Итсано и Чханда синтезировали хи-
структурной периодичностью, присущей им по-
нинсодержащий хиральный гиперразветвленный
ристостью и состоящие из сшитых органических
Схема 26.
Me
Me
MeO
Me
N N
Me
H
N
Cl
Me
Me
Ru
N
N
OMe
NH
Cl
N
O
H
N
H
[HG2A]=100:5
i-Pr
N
O
NH HN
OMe
ДМФА, 100oC, 36 ч
MeO
H
O
непрерывный поток N2
H
N
N
N
O
O
37
C31
n
Схема 27.
O
COOCH3
C30
NO2
O
H
Ph
COOCH3
NO2
39
Ph
O
C31, C32
COOCH3
NO2
38
2
H
Ph
40
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
350
ПОПОВА и др.
В работе [28] был предложен метод модифи-
Таблица 12. Препаративные выходы соединений 45
кации микропористого полимера PIM1 через
R
R1
R2
Выход, %
введение хирального скварамидного фрагмента
H
H
H
95
(схема 31). Каталитические свойства полученно-
H
H
OCH2CH3
98
го полимерного катализатора PIM2 были изуче-
H
H
OCH3
98
H
CH3
OCH3
71
ны в реакциях транс-β-нитростирола 2 и 1,3-ди-
CH3
H
H
92
карбонильных соединений 46, а также в реакции
OCH3
H
H
74
2-гидроксинитростирола 48 и малононитрила 49
Cl
H
H
63
(схема 32). Для продуктов 47 был достигнут мак-
Br
H
H
73
симальный оптический выход ее 92% (табл. 13).
Br
H
H
73
Хромен 50 был получен с умеренной энантиосе-
лективностью (67%).
На данный момент полимерные скварамидные
строительных блоков. В работе [27] на основе
катализаторы испытывают на возможность вне-
реакций конденсации соединений 41 и 42 были
дрения в химическое производство. В работе [29]
успешно синтезированы каталитические сквара-
сообщалось о получении циклодекстрина, моди-
мид-связанные COFs с высококристаллической
фицированного скварамидом (CD-2) и изучении
структурой и высокой пористостью (схема 29).
его каталитических свойств в реакции Михаэля
Эффективность полученного органокатализатора
между транс-β-нистростиролом 2 и 1,3-дикар-
была проверена на реакциях присоединения по
бонильными соединениями 44 в среде различ-
Михаэлю между 1,3-дикарбонильными соедине-
ных растворителей в реакторе проточного типа
ниями 44 и производными (Е)-(2-нитровинил)-
(схема
33). Наилучший препаративный выход
бензола 43 (схема 30). Реакция протекает в при-
(95%) был получен в среде диметилкарбоната, а
сутствии 10 мол% катализатора COF-SQ в среде
наилучшая энантиоселективность (99%) - при ис-
толуола при 50°С, давая продукты 45 с выходами
пользовании 2-метилтетрагидрофурана в качестве
63-98% (табл. 12).
растворителя и 1,3-дифенилпропан-1,3-диона в
Схема 28.
I
OMe
O O
N
N
N
OMe
H
O
H
NH HN
36
+
N
HN
N H
N
H
MeO
O
N
N
O
O
H
O
O
I
I
O
N
MeO
O
C32
N
H
N
OMe
H
MeO
NH
N
H
N
N
O
O
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
351
Схема 29.
O
O
NH2
N
N
NH N
H
N
N
HN
O
NH
O
NH
HN
O
O
NH
O
NH
O
мезитилен-1,4-диоксан
6 M. HOAc
N
N
(3:3:1)
COF-SQ
120
oC
NH2
N
N
41
O
HN
O
HN
CHO
O
HN
HN
O
N
O
O
OHC
CHO
N
N
42
N
NH
N
H
Схема 30.
O
O
O
O
R2
R3
NO2
COF-SQ (10 мол%)
NO2
+
R2
R3
толуол, 50°C, 24 ч
R1
R1
43
44
45
качестве второго субстрата (схема 34). Используя
токсичности циклодекстрина данный катализатор
встроенную в проточный реактор мембранную се-
хорошо подходит для промышленного использо-
паративную установку, авторам удалось добиться
вания.
100%(!) регенерации катализатора из реакционной
В работе [30] был синтезирован новый, функ-
смеси. В работе сделан вывод о том, что благода-
ционализированный по верхнему ободу, каликса-
ря стабильности, возобновляемости и отсутствию
рен-сквадрамидный катализатор C33, содержа-
Таблица 13. Препаративные и оптические выходы соединений 47
R1
R2
R3
Время, ч
Выход, %
dr
еr
OEt
H
OEt
12
69
-
81:19 (S)
Me
H
Me
1
72
-
96:4 (S)
–(CH2)3-
-(CH2)3-
OEt
1
89
91:9
81:19 (S,R)а
а Для основного диастререомера.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
352
ПОПОВА и др.
Схема 31.
Me MeO
N
Me2
O
Me
N
Me
Me
H
O
Me
Me
NMe2
O
Me
HN
O
NH2
O
N
O
H
O
O
O
EtO
O
Me
O
Me
Me
Me
NH2
HN
n
n
PIM2
PIM1
HN
O
Me2N
O
Me
Me
Схема 32.
O Ph
O
O
PIM2 (5 мол%)
NO2
NO2
R1
Ph
R1
R2
20oC
R2
COR3
R3
2
46
47
NO2
NO2
CN
CN
PIM2 (5 мол%)
CN
CH2Cl2, 20oC
OH
O
NH2
48
49
50
Схема 33.
N
1)
O
O
O
MeO
6
O
OMe
NH2
MeO
OMe
N
MeO
6
H
NH
N
Me
N
2)
CD1
OMe14
OMe
CD2
H2N
OMe14
N
Me
щий циклогександиаминовые фрагменты. Данный
Реакция протекала в среде дихлорметана при ком-
катализатор использовался в энантиоселективной
натной температуре с использованием 2.5 мол%
реакции Михаэля между циклогексан-1,3-дионом
хирального органокатализатора C33, и приво-
53 и (E)-этил-2-оксо-4-фенилбут-3-еноатом
52.
дила к получению продукта 54 с высоким выхо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
353
Схема 34.
O O
O O
CD-2
R
R
NO2
Ph
R
R
25oC, 24 ч
NO2
Ph
2-MeTГФ
44
2
51
R = Ph, Me.
Схема 35.
Me
Me
N
N
Me
Me
HN
NH
O
O
HN
NH
O
O
O
O
O
O
O
Ph
O
Me
Me
Me
Me
O
O
C33 (2.5 мол%)
Ph
CO2Et
CO2Et
CH2Cl2, 20oC
O
OH
52
53
54
(95%, ee 90%)
дом (до 95%) и энантиоселективностью (до 90%,
которые показали меньшую каталитическую ак-
схема 35). Была предложена модель каталитиче-
тивность.
ского переходного состояния, которая включает
3. РЕАКЦИЯ МАННИХА
активацию α-кето-эфирной группы субстрата 52
через две водородные связи, одновременно еноль-
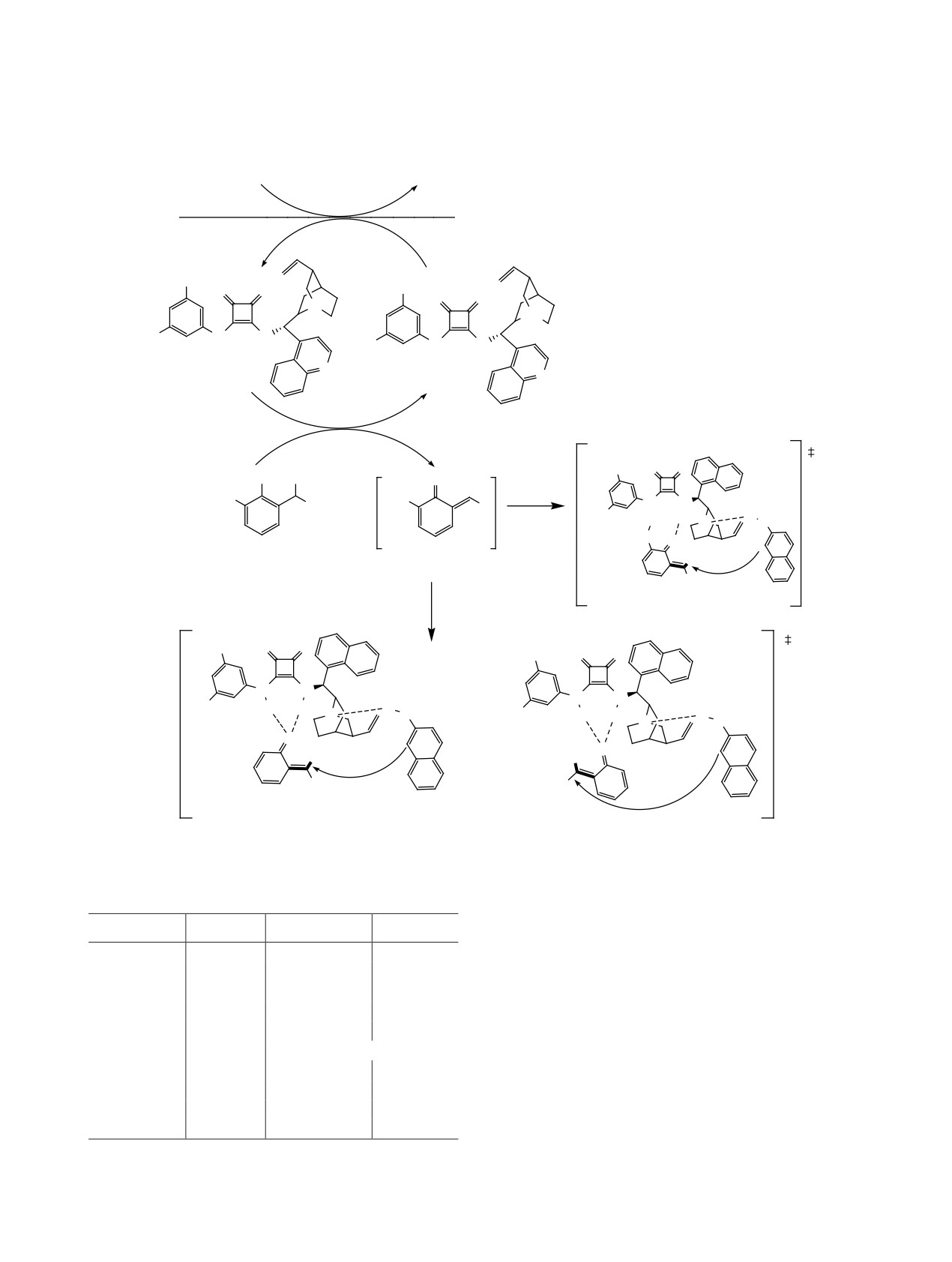
В работе [31] была исследована энантиоселек-
ная форма соединения 53 взаимодействует с тре-
тивная реакция Манниха между α-кетоамидами 55
тичным амином другого скварамидного фрагмен-
и п-нозилиминами 56 (схема 37). Реакция проте-
та. Роль каликсареновой полости заключается в
кала при -20°С в хлороформе. Скрининг различ-
фиксировании бензольного кольца посредством
ных органокатализаторов показал, что сквара-
π···π-стекинг-супрамолекулярного
взаимодей-
мидные катализаторы обеспечивают наилучшую
ствия по типу гость-хозяин, что облегчает стерео-
селективную атаку субстрата 53 (схема 36). В этой
энантиоселективность (до 92%) и высокий выход
же работе были получены каликсарены, функцио-
продукта (более 95%). Большинство реакций про-
нализированные скварамидами по нижнему ободу,
водилось в присутствии 20 мол% катализатора,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
354
ПОПОВА и др.
Таблица 14. Препаративные и оптические выходы соединений 57
R1
R2
R3
Выход, %
ee, %
dr
i-Pr
Bn
Ph
70
99
95:5
i-Pr
Bn
н-Пентил
59
66
99:1
4-Морфолинил
Bn
Ph
71
80
95:5
4-Морфолинил
Bn
4-MeC6H4
73
84
99:1
4-Морфолинил
Bn
4-ClC6H4
75
76
95:5
Bn
Ph
Ph
82
94
95:5
Bn
2-Нафтил
Ph
75
90
99:1
Bn
Аллил
Ph
77
92
97:3
однако при уменьшении загрузки катализатора до
тиоселективностью до 99% при использовании
5 мол% энантиоселективность и выход продукта
0.5 мол% катализатора в среде дихлорметана при
сохранялись (табл. 14). Наблюдаемая диастерео-
-50°С (табл. 15).
селективность и энантиоселективность процесса
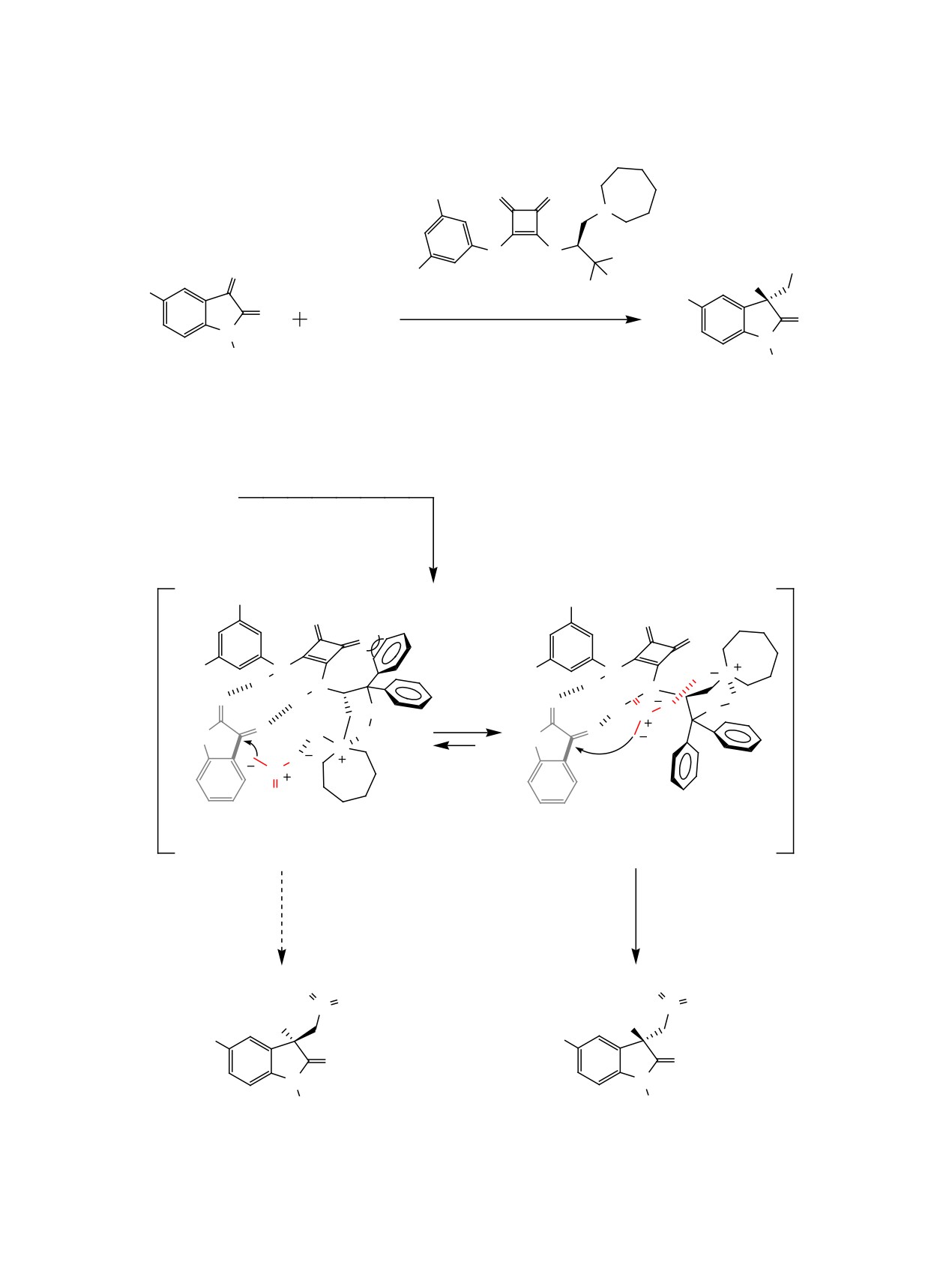
В работе [33] рассмотрен синтез 3-амино-2-ок-
объясняется с помощью реакционной модели, в ко-
сииндолов с помощью катализируемой скварами-
торой Re-поверхность Z-енолята взаимодействует
дом реакции Манниха между ацетилацетоном 1 и
с Re-поверхностью имина. Авторы предположили,
иминами изатина 61 (схема 40, табл. 16). Реакция
что депротонированный нуклеофил фиксируется
протекает в присутствии 1 мол% органокатали-
водородными связями, а протонирование имина
затора в среде диэтилового эфира при комнатной
активирует электрофил, ориентируя его непосред-
температуре. На схеме 40 представлена возможная
ственно в момент взаимодействия (схема 38).
модель переходного состояния: на первом этапе
В работе [32] продемонстрировано влияние
третичный амин хининной части органокатали-
хинин-скварамидного катализатора на протека-
затора активирует 1,3-дикарбонильное соедине-
ние энантиоселективной реакции Манниха меж-
ние через депротонирование, образующийся енол
ду различными иминами 58 и дитиомалонатами
сближается с кетимином, который, в свою очередь,
59 (cхема 39). Продукты реакции были получе-
активирован водородными связями сквадрамид-
ны с препаративными выходами до 99% и энан-
ной группы. При этом стерически объемная ада-
Схема 36.
Таблица 15. Препаративные и оптические выходы со-
единений 60
R
Выход, %
ee, %
Me
Me
O
O
Ph
99
99
H
N
OEt
N
O
4-MeC6H4
90
95
Me
Me
3-MeC6H4
92
95
H
N
H
N
O
O
4-CF3C6H4
85
90
H
H
O
1-Нафтил
87
98
N
N
4-FC6H4
87
88
O
O
4-ClC6H4
90
95
3,5-Cl2C6H4
82
93
Каликсарен
Тиен-3-ил
91
94
Циклогексил
89
92
C6H5C2H5
90
92
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
355
Схема 37.
Et
N
NBn2
O
O
O
O
t-Bu
O
N
N
N
R4
O
N
N
N
H
H
H
H
N
H
N
F3C
C34, R4 = Ph
C36
MeO
C35, R4 = 9-фенантренил
MeO
CF3
O
O
CF3
F3C
N
N
S
S
N
F3C
N
N
N
H
F3C
N
N
H
H
H
N
H
H
N
F3C
N
Me Me
MeO
MeO
C22
C37
C38
CF3
F3C
5
NR
O
O
O
N
N
N
H
H
N
F3C
C39, R5 = H
MeO
C40, R5 = Me
C41, R5 = Bn
мантильная группа препятствует подходу к Si-по-
ли потенциальную противовирусную активность
верхности кетимина и способствует селективной
против вируса табачной мозаики.
атаке енола со стороны Re-поверхности.
В работе [35] исследовано использование раз-
В работе [34] исследована трехкомпопентная
личных органокатализаторов в реакции Манниха
реакция Манниха между 5-фенил-1,3,4-тиадиа-
между α,α-дицианоолефинами 68 и N-Boc-кети-
зол-2-аминами 63, ароматическими альдегидами
минами 67 из изатинов. Лучшие результаты были
64 и эфирами малоновой кислоты 65. Реакция про-
получены при использовании 10 мол% сквара-
текала в среде толуола, в присутствии 10 мол%
мидного органокатализатора С45 в смеси рас-
катализатора при 60°С (схема 41, табл. 17). Не-
творителей CHCl3-метил-трет-бутиловый эфир
которые из полученных производных 66 показа-
(МТБЭ) (1:1) при -20°С: препаративные выходы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
356
ПОПОВА и др.
Схема 38.
активированным α,α-дицианоолефином приводи-
ла к желаемым продуктам реакции Манниха 69
(схема 43). Для проверки синтетической эффек-
N
тивности методики реакцию проводили в грам-
O
O
O
мовых количествах, при этом наблюдалось незна-
чительное снижение энантиоселективности (до
94%). Авторы использовали полученный продукт
N
N
в ряде синтетических трансформаций для постро-
Me
F3C
H H
N
ения гетероциклического остова MDM2 ингибито-
H
H
Me
Ns
ра 70 (схема 44).
O
N
ArHорто
В 2018 г. была описана асимметрическая реак-
O
O
ция Манниха между пиразоламидами 71 и цикли-
R3
H
R4
ческими трифторметилкетиминами 72, катализи-
N
H
R
R
руемая скварамидами [36]. В ходе реакции были
получены производные дигидрохиназолинона 73,
содержащие смежные четвертичные и третичные
продуктов реакции 69 составляли до 96%, энанти-
стереогенные центры (схема 45). Реакция протека-
оселективность - до 96% (схема 42, табл. 18). Ав-
ла в среде дихлорметана при 30°С в присутствии
торами был предложен механизм реакции, в кото-
10 мол% катализатора С22 с высокими препара-
ром третичный азот скварамидного катализатора
тивными выходами (до 99%), энантиоселектив-
депротонирует α,α-дицианоолефин, координируя
ностью (до 99%) и диастереоселективностью (dr
его и удерживая в непосредственной близости от
>20:1, табл. 19). Предложенный механизм про-
второго реактанта, в то же время NH-фрагменты
цесса включает стадию депротонирования пира-
сквадрамида активируют кетимин через водо-
золамида третичным амином хинуклидильного
родные связи. Атака Re-поверхности кетимина
фрагмента катализатора с образованием ионов ам-
Таблица 16. Препаративные и оптические выходы соединений 62
R1
R2
R3
Время, ч
Выход, %
ee, %
Me
H
Boc
3
92
99
H
H
Boc
22
97
98
Ac
H
Boc
29
29
92
Bn
H
Boc
4,5
96
99
Et
H
Boc
29
42
99
H
H
CO2Et
5
70
96
H
H
Cbz
29
72
91
H
H
PMP
Реакция не идет
Me
H
Cbz
26
88
97
Me
H
CO2Et
26
81
98
Me
5-MeO
Boc
5
92
>99
Me
5-Me
Boc
5
89
97
Me
7-Cl
Boc
26
94
97
Me
6-Cl
Boc
4,5
95
85
Me
6-Br
Boc
4,5
92
90
Me
7-F
Boc
5
96
96
H
5-Br
Boc
5
88
41
H
5-F
Boc
5
98
88
H
5,7-Me2
Boc
29
84
88
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
357
Таблица 17. Препаративные и оптические выходы соединений 66
R1
R2
R3
Время, ч
Выход, %
ее, %
H
H
Me
60
84
93
2,4-Cl2
3,4-Cl2
Me
60
85
98
3-F
3,4-Cl2
Me
60
81
87
2,4-Cl2
2,3-Cl2
Et
60
80
95
2,4-Cl2
2-F
Et
72
75
80
4-Cl
2,3-Cl2
Et
60
90
>99
4-Cl
2-F
Et
60
82
90
3-F
3,4-Cl2
Et
72
71
84
Таблица 18. Препаративные и оптические выходы соединений 69
R1
R2
R3
Выход, %
ee, %
H
H
H
87
95
5-СH3O
H
H
80
82
5-СH3
H
H
80
93
5-Cl
H
H
73
88
5-Br
H
H
88
87
6-Br
H
H
92
92
H
4-Cl
H
87
95
H
4-Br
H
88
95
H
3-F
H
83
93
H
H
4-F
80
94
H
H
4-Cl
90
93
H
H
4-Br
87
94
H
H
4-СH3
83
88
H
H
3-Cl
95
96
H
H
3,4-Cl2
96
95
Схема 39.
OMe
N
N
NH
CF3
O
NH
O
Boc
HN
Boc
CF3
N
O O
C42 (0.5 мол%)
COSBn
+
R
BnS
SBn
R H
CH2Cl2, -50oC, 24 ч
COSBn
58
59
60
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
358
ПОПОВА и др.
Схема 40.
O
O
H
N
R
N
HN
H
OMe
O O
N
NR3
Me
R = 2-адамантил
Me
O O
NHR3
C43 (1 мол%)
*
R2
O
R2
O
Me
Me
N
Et2O, 20oC
N
R1
3-29 ч
R1
61
1
62
N
O
O
H3CO
NH
NH
N
O
O
N
N
t-Bu
H
O O
N
Bn
Me
Me
мония и енолята, при этом между азотом пиразо-
в толуоле показал, что скварамидные катализа-
льного кольца и протоном образовавшейся четвер-
торы С48-С50 обеспечивают наиболее высокую
тичной соли возможно образование водородной
энантиоселективность (84-88%) по сравнению с
связи. Одновременно с этим положение кетимина
хинином С46 (ее 56%) и производным тиомочеви-
контролируются непосредственно скварамидной
ны С47 (ее 57%, схема 47). Показавший лучшие
частью катализатора также посредством межмо-
результаты катализатор С50 был затем использо-
лекулярных водородных связей. Дальнейшее взаи-
ван в серии реакций, проведенных в среде опти-
модействие происходит преимущественно между
мального растворителя (ацетонитрила) при 0°С.
Re-поверхностью енолизированного пиразолами-
да и Re-поверхностью кетимина (схема 46).
4. РЕАКЦИЯ ПИКТЕ-ШПЕНГЛЕРА
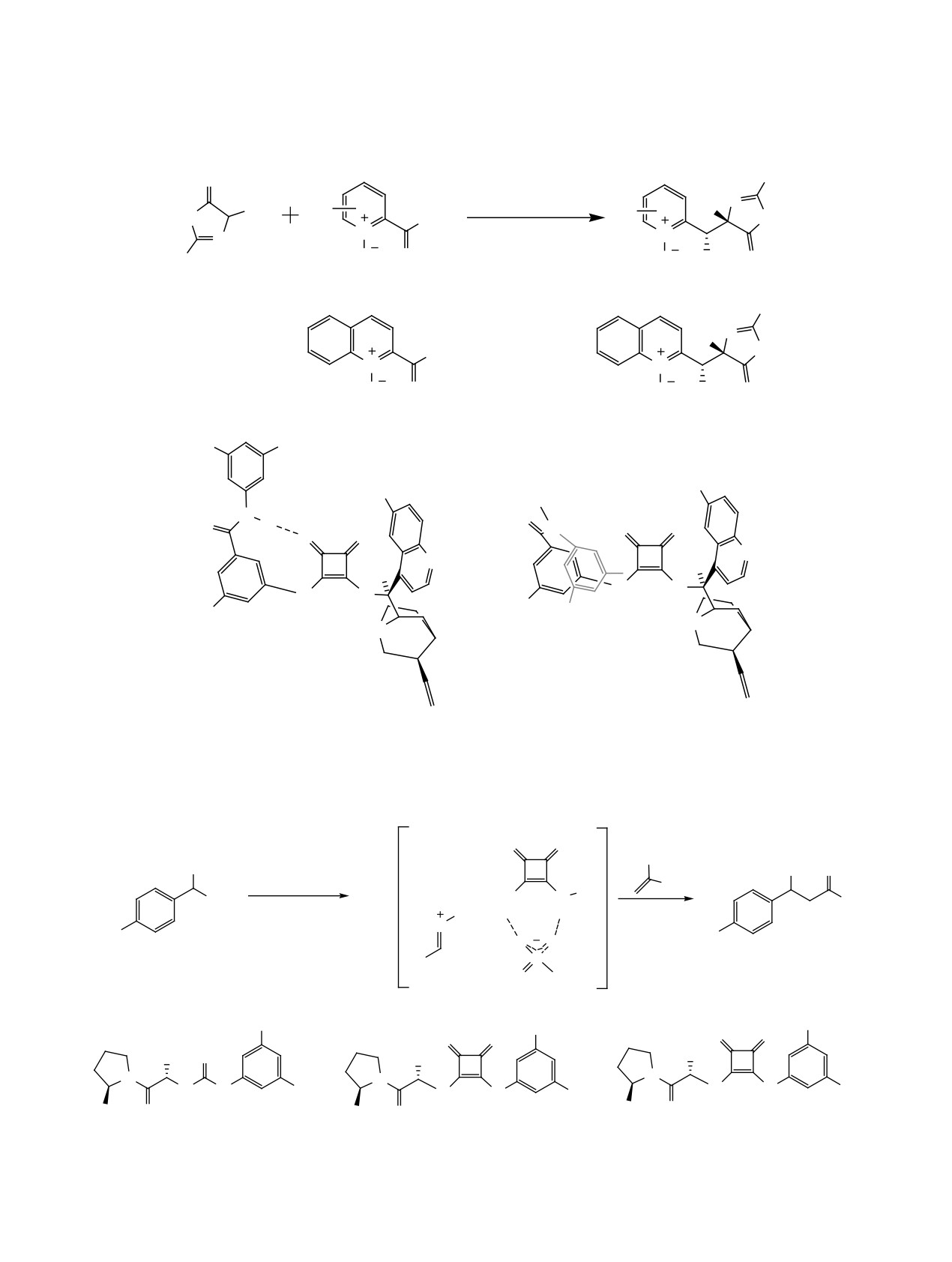
В 2019 г. Юань с сотр. изучили органокатали-
В работе [38], опубликованной в 2018 г., ис-
тическую реакцию различных иминов пиразо-
следована энантиоселективная реакция Пикте-
лин-5-она 74 с кетокислотами 75. Авторами были
получены пиразолоны 76 с высокой энантиоселек-
Шпенглера между производными триптамина 77 и
тивностью (до 94%) и выходами (до 99%, схема 47,
альдегидами 78, катализируемая хиральными про-
табл. 20) [37]. Скрининг катализаторов (20 мол%)
изводными скварамида (схема 48). Реакция протека-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
359
Схема 41.
CF3
O
O
H
N
F3C
N
HN
H
MeO
R1
R1
N
R2
3
R2
COOR
S
C44 (10 мол%)
CHO
H2C
NH2
S H
H
COOR3
толуол, 60oC, 60-72 ч
N
C
N N
*
N N
65
R3OOC COOR3
63
64
66
Схема 42.
N
H
H
N
N
t-Bu
H
NC
CN
H
NBoc
MeO
O
O
NC CN
R1
O
BocHN
N
N
Me
C45 (10 мол%)
R3
3
R1
O
R
N
R2
-20oC, 4 A, CHCl3-МТБЭ
67
68
69
R2
Схема 43.
Схема 44.
N
O
O
OMe
H
t-Bu
H
N
N
H
H
CO2H
N
O
O
O
t-Bu
N
Cl
H
N
O
NBn
N
N
O
N
Cl
H
Ph
70
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
360
ПОПОВА и др.
Таблица 19. Препаративные и оптические выходы дигидрохиназолинонов 73
R1
R2
Ar
Время, ч
Выход, %
ee, %
dr
H
Cl
4-CF3C6H4
11
83
93
>20:1
H
Cl
4-BrC6H4
11
90
98
>20:1
H
Cl
4-ClC6H4
39
49
99
>20:1
H
Cl
4-FC6H4
45
70
95
>20:1
H
Cl
3-ClC6H4
45
83
98
>20:1
H
Cl
2-ClC6H4
64
39
95
>20:1
H
Cl
4-MeC6H4
18
96
99
>20:1
H
Cl
4-MeOC6H4
21
79
98
>20:1
H
Cl
76
99
98
>20:1
O
O
H
Cl
4-PhC6H4
11
99
99
>20:1
H
Cl
2-Нафтил
48
93
99
>20:1
H
Cl
2-Тиенил
64
96
94
>20:1
СH3
Cl
Ph
65
17
85
>20:1
H
СH3
H
70
38
99
>20:1
H
PMB
H
70
51
98
>20:1
H
OСH3
H
70
59
97
>20:1
ла в смеси толуол-дихлорметан (1:1) в присутствии
ванием 83. На последней стадии каталитического
20 мол% катализатора С51 и приводила к про-
цикла происходит протонный сдвиг в 83, что при-
изводным
2,3,4,9-тетрагидро-1H-пиридо[3,4-b]-
водит к продукту реакции 79, при этом катализа-
индола 79 с выходами до 95% и энантиоселектив-
тор возвращается в реакционную систему.
ностью до 99% (табл. 21). По мнению авторов,
5. РЕАКЦИЯ ФРИДЕЛЯ-КРАФТСА
каталитический цикл включает активацию аль-
дегида через образование водородных связей со
В работе [39] изучено влияние скварамидно-
скварамидной частью катализатора (интермедиат
го катализатора на протекание асимметричной
80), затем происходит атака нуклеофила 77, в ре-
каскадной реакции Фриделя-Крафтса/лактони-
зультате которой образуется интермедиат 81, кото-
зации с участием 3-трифторэтилиденоксиндолов
рый после дегидратации превращается в ионную
31 и нафтолов 84, 86, приводящей к производным
пару 82 (схема 49). Интермедиат 82 подвергается
α-арил-β-трифторметилдигидрокумарина 85 и 87
внутримолекулярной реакции Манниха с образо-
с высокими выходами (до 99%), превосходной
Схема 45.
CF3
O
O
R1
N
N
NH
N
O
H
H
CF3
N
1
MeO
R
F3C
Ar
CF3
O
R2
R2
N
Ar
N
C22 (10 мол%%)
N
N
N
R1
CH2Cl2, 30oC, 11-76 ч
N
O
N O
R1
PMB
PMB
71
72
73
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
361
Схема 46.
данная реакция представляет собой первый при-
мер процесса, включающего расщепление амид-
N
ной связи C-N с одновременной этерификацией в
CF3
O
O
мягких органокаталитических условиях.
MeO
В 2016 г. группа исследователей под руковод-
ством Педро разработала энантиоселективный
N
N
CF3
N
H
H
метод алкилирования по Фриделю-Крафтсу ги-
H
дроксииндолов 88 с использованием кетиминов
O
изатина 89 [40]. При проведении реакции в присут-
O
N
ствии скварамидного катализатора С22 были по-
N
CF3
N
PMB
N
лучены продукты алкилирования 90 с выходами до
99% и энантиоселективностью до 99% (схема 51,
табл. 24). Взяв за основу механизм, предложенный
Re
R2
Re поверхность
R
в работе [41], в которой описана реакция нафтолов
поверхность
с кетиминами изатина, катализируемая произво-
дными тиомочевины, авторы предложили пере-
ходное состояние, которое объясняет орто-регио-
селективность алкилирования и абсолютную кон-
энантиоселективностью (до 99%) и диастереосе-
фигурацию конечных продуктов 90 (схема 51).
лективностью (dr >20:1, табл. 22 и 23). Реакцию
Меняя положение активирующей/направляющей
проводили в среде дихлорметана в присутствии
гидроксильной группы, можно региоселективно
2.5 мол% катализатора С52 (схема 50). Данная
вводить заместители в карбоциклическое кольцо
реакция представляет собой новый метод энанти-
индола. Влияние взаимодействия катализатор-
оселективного синтеза дигидрокумаринов с груп-
ОН-группа может быть подтверждено тем фактом,
пой CF3 в β-положении. Также стоит отметить, что
что 5-метоксииндол не участвует в данной реакции.
Таблица 20. Препаративные и оптические выходы пиразолонов 76
R1
R2
R3
Выход, %
er
4-FC6H4
Ph
Me
99
94:6
4-ClC6H4
Ph
Me
99
92:8
4-BrC6H4
Ph
Me
99
88:12
3-FC6H4
Ph
Me
95
91:9
4-MeOC6H4
Ph
Me
96
68:32
3-MeOC6H4
Ph
Me
96
88:12
2-MeC6H4
Ph
Me
96
94:6
2-Нафтил
Ph
Me
96
90:10
Me
Ph
Me
99
91:9
Et
Ph
Me
99
92:8
n-Pr
Ph
Me
99
92:8
2-Тиенил
Ph
Me
99
60:40
2-Фурил
Ph
Me
99
66:34
Ph
4-MeC6H4
Me
99
92:8
Ph
4-FC6H4
Me
99
92:8
Ph
4-ClC6H4
Me
99
93:3
Ph
4-BrC6H4
Me
99
90:10
Ph
Ph
Et
99
91:9
Ph
Ph
п-Pr
99
90:10
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
362
ПОПОВА и др.
Таблица 21. Препаративные и оптические выходы со-
Таблица 22. Препаративные и оптические выходы про-
единений 79
изводных дигидрокумарина 85
R
PG
Выход, %
ee, %
R1
R2
R3
Выход, %
ee, %
Ph
Ph
93
89
H
H
Boc
99
97
4-CF3С6Н4
Ph
95
80
H
4-MeO
Boc
99
98
4-MeС6Н4
Ph
76
74
H
4-BnO
Boc
95
96
4-FС6Н4
Ph
89
84
4-ClС6Н4
Ph
83
72
H
4-CH3CH=CHO
Boc
95
98
2-FС6Н4
Ph
82
32
H
4-CH2=CHCH2O
Boc
95
98
2-MeOС6Н4
Ph
77
58
H
4-Ph
Boc
98
97
4-NO2
Ph
91
50
Ph
2-Нафтил
90
99
H
4-Cl
Boc
85
96
4-CF3С6Н4
2-Нафтил
92
69
H
4-NMe2
Boc
95
97
4-MeС6Н4
2-Нафтил
81
76
H
4-NHBoc
Boc
99
95
4-FС6Н4
2-Нафтил
93
87
4-ClС6Н4
2-Нафтил
84
31
H
6-Me
Boc
98
98
4-BrС6Н4
2-Нафтил
87
23
H
7-Me
Boc
80
90
Циклогексил
2-Нафтил
91
92
H
H
Me
Реакция не идет
i-Pr
2-Нафтил
88
85
Бензил
2-Нафтил
89
87
H
H
Cbz
95
92
2-Пиридил
Ph
76
83
5-Me
H
Boc
95
94
2-Тиенил
Ph
79
65
5-Cl
H
Boc
98
92
Циклогексил
Ph
82
78
Ph
1-Нафтил
94
74
5-Br
H
Boc
90
94
Ph
2,6-Me2С6Н3
82
82
7-F
H
Boc
98
87
4-FС6Н4
2,6-Me2С6Н3
93
81
7-Br
H
Boc
98
96
Циклогексил
2,6-Me2С6Н3
82
99
Схема 47.
Boc
R3
N
HN
R3
Boc
O
O
1
C50 (20 мол%)
R
N
N
R1
OH
CH3CN (0.025 M.), 0oC, 2 ч
N
O
O
N
R2
O
R2
74
75
76
O
O
O
O
S
N
N
N
Ar
OH
NH
N
Ar
Ar
H
NH
N
N
N
H
H
H
H
H
H
MeO
MeO
N
N
N
N
C46
C47
C48
C49
O
O
N
Ar
NH
N
H
H
MeO
Ar = 3,5-(CF3)2C6H3
N
C50
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
363
Схема 48.
O
O
F3C
N
NH
H
N
MeO
F3C
N
N
N
PG
H
PG
C51
RCHO
N
H
R
N
H
77
78
79
Схема 49.
79
C51+Ph-CHO
N
CF3
N
O
O
MeO
O
CF3
MeO
H
H
O
N
N
CF3
N
N
H
H
N
N
H
H
H
O
CF3
H
H
80
N
N
Ph
N
H
83
NH
N
N
CF3
MeO
O
O
O
O
CF3
H
MeO
H
N
N
N
CF3
N
N
H
H
H
N
H
CF3
H
H
H
H O
N
Ph
N
N
N
Bn
Bn
82
81
H2O
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
364
ПОПОВА и др.
Схема 50.
1
R
F3C
OH
CF3
C52
R2
O
R1
O
CH2Cl2
O
NH
NR3
0oC
R3
O
O
MeO
H
N
N
31
84
85
R2
H
HN
MeO
F3C
OMe
R1
R2
N
HO
C52
CF
3
R1
O
R2
C52 (2.5 мол%)
CH
2Cl2
NR3
-30oC
NH
R3
O
O
31
86
87
В работе [42] изучена аза-реакция Фриделя-
5 мол% катализатора С53, при этом были получе-
Крафтса между циклическими трифторметилке-
ны трифторметилдигидрохиназолиноны 93 и 95 с
тиминами 91 и производными нафтола 92/фенола
препаративными выходами до 99% и энантиосе-
94 (схема 52). Реакции проводили в среде хлоро-
лективностью до 98% (табл. 25 и 26). Выход и эна-
форма при комнатной температуре в присутствии
тиоселективность оставались высокими даже при
использовании 1 мол% катализатора. В реакцию
способны вступать 1-нафтол и его производные,
Таблица 23. Препаративные и оптические выходы про-
тогда как 2-нафтол в реакции не участвует. Среди
изводных дигидрокумарина 87
фенолов реагируют только субстраты, имеющие
R1
R2
R3
Выход, %
ee, %
электронодонорные заместители; отметим, что
H
H
Boc
95
95
незамещенный фенол, а также 2-метоксифенол и
H
3-MeO
Boc
95
93
3-хлорфенол в реакцию не вступают. В ходе иссле-
H
3-CH3CH=CHO
Boc
95
92
дования не было выявлено заметного влияния за-
H
6-Br
Boc
95
95
местителей в ароматическом кольце кетиминов на
H
7-Br
Boc
98
92
ход реакции. Предложенную авторами модель пе-
H
6-CN
Boc
80
89
реходного состояния можно рассматривать как хи-
H
7-BnO
Boc
95
94
ральную ячейку, в которой, с одной стороны, про-
H
6-BnO
Boc
95
92
исходит активация кетимина через образование
H
7-MeO
Boc
95
92
двух водородных связей со скварамидной группой,
H
6-CH2=CHCH2O
Boc
95
93
а с другой - повышение нуклеофильности нафтола
H
6-Ph
Boc
90
94
взаимодействием с хиральным третичным амином
H
7-Ph
Boc
85
92
катализатора, который и направляет атаку нукле-
H
8-NHBoc
Boc
60
95
офила (через Re-поверхность) на кетимин. Пред-
H
8-NHMe
Boc
95
90
H
H
Cbz
95
85
ставленная модель показывает образование аддук-
5-Me
H
Boc
90
91
та R-конфигурации (схема 53).
5-Cl
H
Boc
95
90
Механизм реакции Фриделя-Крафтса, пред-
5-Br
H
Boc
95
92
ставленной на схеме 52, был исследован с исполь-
7-F
H
Boc
98
88
зованием метода теории функционала плотности
7-Br
H
Boc
95
80
(DFT) (схема 54) [43]. Анализ проведенных рас-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
365
Таблица 24. Препаративные и оптические выходы продуктов алкилирования
R
R1
R2
С22, мол%
Выход, %
ee, %
Алкилирование 4-гидроксииндолов (продукты 90)
H
H
Bn
1
98
99
H
H
MOM
1
82
96
H
H
All
1
99
98
H
H
Me
1
96
98
H
H
H
1
41
72
Me
H
Bn
1
80
99
H
6-MeO
Bn
1
72
99
H
6-Br
Bn
1
80
99
H
6-Cl
Bn
1
90
98
H
6-NO2
Bn
1
90
97
H
7-F
Bn
1
95
98
H
5,7-Me2
Bn
1
99
98
Алкилирование 5-гидроксииндолов (продукты 90')
H
H
Bn
5
80
96
H
5-Cl
Bn
5
98
95
H
6-Cl
Bn
5
93
98
H
7-Me
Bn
5
99
94
Алкилирование 6-гидроксииндолов (продукты 90'')
H
H
Bn
5
99
99
H
5-MeO
Bn
5
75
98
H
5-Br
Bn
5
70
98
H
5-Me
Bn
5
72
98
Алкилирование 7-гидроксииндолов (продукты 90''')
H
H
Bn
5
99
92
H
5-Cl
Bn
5
72
96
H
7-F
Bn
5
53
96
H
5,7-Me2
Bn
5
99
85
Таблица 25. Препаративные и оптические выходы ди-
Таблица 26. Препаративные и оптические выходы ди-
гидрохиназолинонов 93
гидрохиназолинонов 95
R1
R2
R3
Выход, %
ee, %
R1
R2
R3
Выход, %
ee, %
6-Cl
PMB
H
94
92
6-Cl
PMB
3,4-(MeO)2
87
93
6-Cl
PMB
4-MeO
91
98
6-Cl
PMB
3,4-(-OCH2O-)
92
98
6-Cl
PMB
4-Cl
94
95
6-F
PMB
H
98
88
6-Cl
PMB
3-NMe2
95
97
6-CF3
PMB
H
96
95
6-MeO
PMB
H
98
86
6-CF3
PMB
3-MeO
72
66
6-PMB
PMB
H
99
85
H
PMB
3-NMe2
98
92
H
PMB
H
95
87
6-CF3
PMB
4-MeO
87
97
6-F
PMB
3,4-(MeO)2
98
86
6-Cl
Me
H
85
93
6-Cl
H
H
99
97
6-CF3
H
3,4-(-OCH2O-)
97
90
6-CF3
H
H
99
98
6-CF3
H
3-NMe2
93
96
6-Cl
H
4-Cl
97
92
6-CF3
H
4-MeO
95
99
6-Cl
H
3,4-(MeO)2
99
98
H
H
H
92
94
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
366
ПОПОВА и др.
Схема 51.
CF3
F3C
N
NH
H
N
O
MeO
O
O
OH
OH
NBoc
N
R2N
C22 (0.1-5 мол%)
O
N
N
R1
N
толуол, 20°C
R
R
R1
R2
88
89
90
N
F3C
O
O
OMe
R2
H
R1
N
O
N
1
HO
R
R
N
N
N
NHBoc
BocHN
F
3C
H
H
N
R
H
HO
O
OH
N
R1
N
O
O
O
O
N
R2
N
R2
R
R2 N
Ot-Bu
90'
90''
90'''
N
H
четов показал корректность переходного состоя-
сутствии 0.5 мол% катализатора С22. Продукты 97
ния, представленного на схеме 53, и подтвердил
и 99 были получены с отличными выходами (до
основной постулат механизма об одновременной
98%) и энантиоселективностью (до 98%, табл. 27
активации нуклеофила через N-H-связи сквара-
и 28). При использовании вместо нафтолов элек-
мида, и электрофила - через протонированный
тронообогащенных фенолов наблюдалось умень-
амин. DFT-Расчеты также подтвердили, что наи-
шение препаративных выходов продуктов реакции
более благоприятными нековалентными взаимо-
до 75% и снижение энантиоселективности до 53%.
действиями межу катализатором и субстратами в
Группа Ли в 2017 г. разработала интересные
переходном состоянии являются π···π-, N-H···O-
сульфинильные скварамидные органокатализато-
и C-H···F-взаимодействия. Образование продукта
ры С54-С61 (схема 56), которые были использова-
с R-конфигурацией энергетически и кинетически
ны в реакции Фриделя-Крафтса между индолами
наиболее выгодно, что согласуется с эксперимен-
100 и ацилфосфонатами 101 [45]. При скрининге
тальными данными.
катализаторов оказалось, что классический сква-
Авторами работы [44] была продемонстрирова-
рамид С61 уступает по эффективности сульфи-
на домино-реакция Фриделя-Крафтса/N,O-ацета-
нильным производным, так как N-трет-бутил-
лизации между N-Boc-замещенными кетиминами
сульфинильная группа проявляет более сильные
74, полученными из пиразолин-5-онов, и нафтола-
электронные эффекты, чем фенильный замести-
ми 96 и 98 (схема 55). Реакцию проводили в среде
тель. Наилучшие результаты продемонстрировал
дихлорметана при комнатной температуре в при-
катализатор С55, с которым достигнуты выходы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
367
Схема 52.
R3
CF3
OH
F3C
N
C53
R1
NHOH
R3
CHCl3, 20oC
R1
N
O
N
NH
N O
R2
H
N
R2
91
92
93
R3
O
MeO
O
F3C
CF3
OH
C53
N
NH
OH
1
N
R
R1
R3
CHCl3, 20oC
C53 (5 мол%)
N O
N O
R2
R2
91
94
95
продуктов 102 до 92% и энантиоселективность
В работе [46] продемонстрирована энантиосе-
до 96% (табл. 29). трет-Бутил-N-сульфинильная
лективная реакция алкилирования по Фриделю-
группа известна своей растворимостью в липидах.
Крафтсу между 2-нафтолами 86 и in situ генери-
Это позволило авторам предположить, что новая
руемыми орто-хинонметидами o-QM (cхема 58).
система водородных связей, сочетающая сквадра-
Реакцию проводили в присутствии 5 мол% ката-
мид и N-трет-бутилсульфинильную группу, мо-
лизатора С62 и 2.5 экв. карбоната калия с выхо-
жет решить проблему плохой растворимости сква-
дами до 97% и энантиоселективностью до 97%
драмидных катализаторов. При расчете энергии
(табл. 30). Реакцию проводили в двухфазной си-
промежуточного комплекса было сделано пред-
стеме CH2Cl2-H2O (1:1). Использование воды в ка-
положение, что в механизме реакции участвует
честве второй фазы обеспечивает мягкие условия
кислород сульфониловой группы, который, играя
регенерации катализатора, а также способствует
роль основания Льюиса, образует водородную
пространственному разделению неорганического
связь с NН-группой индола, а енон активируется
основания и органической фазы, что подавляет
тридентатным сквадрамидо-аминоинданольным
рацемический фон реакции и приводит к высо-
фрагментом (схема 57, ПС-2S и ПС-2R).
кой энантиоселективности процесса [47]. Авторы
предложили следующий возможный механизм
реакции: орто-хинонметид генерируется в орга-
нической фазе из соединения 103 с образованием
Схема 53.
TsH, который может протонировать третичный
Таблица 27. Препаративные и оптические выходы со-
Re
поверхность
единений 97
Cl
Время,
Выход,
O
R1
R2
R3
ee, %
N
ч
%
H
F3C
H
Ph
Me
1.5
98
96
Ar
Br
Ph
Me
1
98
98
N
H
N
O
Cl
Ph
Me
1
96
95
N
Cl
4-MeС
6
Н4
Me
1.5
98
95
PMB
O
N H
Cl
4-ClС6Н4
Me
1.5
98
96
O
Br
Ph
i-Pr
24
70
50
R
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
368
ПОПОВА и др.
Схема 54.
CF3
OH
F3C
Cl
Cl
N
NH
N
C53
NH
OH
H
N
CHCl3, 20oC
N
O
N O
O
MeO
PMB
PMB
O
N
C53 (5 мол%)
O
O
O
O
O
O
O
O
Ar
Ar
Ar
Ar
R
R
R
R
N
N
N
N
N
N
N
N
N
N
N
N
H
H
H
H
H H
H H
H H
H H
O
O
O
O
O
O
O
O
N
CF3
PMB
PMB
N CF3
N
N
N
N
N
N
PMB
PMB
F3C
CF3
Cl
Cl
Cl
Cl
9.5
13.1
16.2
24.1
(ккал/моль)
азот катализатора, а полученная соль вступает в
о-QM могут существовать два способа координа-
реакцию с K2CO3, что приводит к регенерации ка-
ции в переходном состоянии (ПС-3), что приво-
тализатора (схема 59). Кроме того, при отсутствии
дит к снижению энантиоселективности. В то же
акцептора Н-связи (OMe) в положении 6 хинона
время, возможен только один способ координации
Таблица 28. Препаративные и оптические выходы соединений 99
R1
R2
R3
Выход, %
ee, %
H
Ph
Me
98
98
7-MeO
Ph
Me
98
97
6-CN
Ph
Me
98
98
3-Br
Ph
Me
98
98
H
4-MeС6Н4
Me
98
98
H
4-ClС6Н4
Me
98
98
6-CN
4-MeС6Н4
Me
98
97
7-MeO
4-ClС6Н4
Me
98
98
H
Ph
i-Pr
95
98
7-MeO
Ph
i-Pr
95
98
H
Ph
t-Bu
Реакция не идет
H
Ph
Ph
Продукт не выделен
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
369
Схема 55.
OH
R3
MeO
N
OH
Boc
C22
R1
R3
N
N
CH2Cl2, 20°C, 1 ч
N
CF3
O
HN
2
N
NH
R
Boc
R1
N
H
O
N
74
96
97
N
R2
O
CF3
R3
O
N
Boc
O
C22
R3
C22 (0.5 мол%)
N
R1
N
CH2Cl2, 20°C
NH
O
OH
R1
HN
R2
N
Boc
O
R2
74
98
99
Схема 56.
O
O
1) C55 (10 мол%), CHCl3, -20°C
R2
Nu
O
40 мг 3 ° MS
R1
R2
P
N
H
MeO
OMe
2) DBU, NuH
R1
100
101
N
102
H
O
O
O
O
O
O
O
O
O
O
O
O
S
S
S
S N
N
N
N
N
N
N
N
t-Bu
H
H
t-Bu
H
H
t-Bu
H
H
t-Bu
H
H
HO
HO
HO
HO
C54
C55
C56
C57
O
O
O
O
O
O
F3C
O
O
O
t-Bu
O
O
S
S
S
N
N
OH
N
N
N
N
N
N
t-Bu
H
H
t-Bu
H
H
t-Bu
H
H
H
H
F3C
HO
HO
HO
C58
C59
C60
C61
(ПС-4) в присутствии акцептора Н-связи (OMe), в
ной нитроальдольной конденсации различных
результате чего реакция протекает с более высокой
изатинов 105 с нитрометаном 4 (схема 60). Реак-
ция протекала в среде тетрагидрофурана при 0°С
энантиоселективностью.
в присутствии 10 мол% катализатора С63 и при-
6. РЕАКЦИЯ АЛЬДОЛЬНОЙ
водила к образованию хиральных 3-гидроксиок-
КОНДЕНСАЦИИ
синдолов 106 с высокими выходами (до 99%) и
энантиоселективностью (до 95%) (табл. 31). Для
В работе [58], опубликованной в 2017 г., была
механизма реакции авторами предложены два
исследована каталитическая активность сквадра-
возможных переходных состояния ПС-5 и ПС-6,
мидных органокатализаторов в энантиоселектив-
в одном из которых, наиболее выгодном (ПС-6),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
370
ПОПОВА и др.
Таблица 29. Препаративные и оптические выходы со-
Таблица 30. Препаративные и оптические выходы про-
единений 102
дуктов алкилирования 104
R1
R2
Nu
Выход %
ee, %
Выход,
ee,
R1
R2
R3
%
%
H
Me
MeO
85
94
H
Me
EtO
84
93
6-OMe
Ph
H
92
96
H
Me
4-Tol-CH2O
80
93
H
Ph
H
68
55
H
Me
NHBn
86
93
4-Me
Ph
H
60
42
5-MeO
Me
MeO
92
93
5-OMe
Ph
H
83
65
5-Me
Me
MeO
87
95
4-Cl
Ph
H
84
52
5-BnO
Me
MeO
78
92
6-F
Ph
H
84
78
5-I
Me
MeO
70
93
4-Br-6-OMe
Ph
H
84
97
5-Cl
Me
MeO
72
86
4-I-6-OMe
Ph
H
92
97
5-Br
Me
MeO
71
86
H
4-MeOC6H4
H
92
72
6-MeO
Me
MeO
86
93
6-OMe
4-MeC6H4
H
95
91
6-Cl
Me
MeO
68
93
6-OMe
3-MeC6H4
H
86
94
H
Me
MeO
60
88
6-OMe
3-MeOC6H4
H
86
91
7-Me
Me
MeO
70
96
6-OMe
4-MeOC6H4
H
88
92
4-Me
Me
MeO
70
92
6-OMe
2-MeOC6H4
H
58
91
H
Me
MeO
40
11
6-OMe
4-FC6H4
H
92
95
H
Et
MeO
80
95
6-OMe
4-ClC6H4
H
77
95
H
i-Pr
MeO
60
93
6-OMe
4-CF3C6H4
H
78
92
H
Ph
MeO
75
85
6-OMe
3,5-(CF3)2C6H4
H
87
94
6-OMe
3,4-(-OCH2O-)C6H4
H
87
94
6-OMe
1-Нафтил
H
64
88
6-OMe
2-Фурил
H
97
91
6-OMe
Ph
3-Br
93
89
нитроенолат, координированный к аммониевому
6-OMe
Ph
6-Br
85
94
фрагменту азепанового кольца, способен атаковать
6-OMe
Ph
7-Br
82
93
изатин со стороны Si-поверхности, что приводит
6-OMe
Et
H
76
68
к преимущественному образованию продукта в
виде (S)-энантиомера (схема 61).
В 2019 г. Искьердо с коллегами исследовали
альдольную конденсацию
1H-имидазол-5(4H)-
альдольной конденсации 109 и 110 были получены
онов 106 с азаарен-2-карбальдегидами 107, ка-
с препаративными выходами до 95%, энантиосе-
тализируемую скварамидами С64 или его N-ме-
лективностью до 98% и диастереоселективностью
тильным аналогом С65 (схема 62) [49]. Авторы
до dr 20:1 (табл. 32).
отметили, что катализатор С65 обладает меньшей
В работе [50] предложена стратегия повышения
активностью, чем катализатор С64, что объясня-
реакционной способности кислот Льюиса посред-
ется, по их мнению, жесткой псевдоспиральной с
ством их взаимодействия с хиральными донорами
перпендикулярным расположением заместителей
водородных связей С66-С68 (схема 63). Методо-
относительно друг друга структурой скварамида
логия была реализована в асимметричной альдоль-
С65. DFT-Исследования поверхности потенциаль-
ной конденсации Мукаямы при использовании в
ной энергии для скварамида С64 подтверждают
качестве исходных субстратов 1-фенил-1-триме-
образование внутримолекулярной Н-связи, акти-
тилсилоксиэтилена и дибензилацеталь-4-бромбен-
вирующей скварамидный фрагмент в переходном
зальдегида 111 (схема 63). Скрининг катализаторов
состоянии каталитической реакции. Взаимодей-
проводили при -78°С в среде трет-бутилметило-
ствие соединений 106 и 107 протекало в среде
вого эфира в присутствии TBSOTf. Использование
дихлорметана при температуре от -10 до -20°С
в реакции только одного TBSOTf или совместно
с 10 мол% катализатора С64, при этом продукты
с производными мочевины или тиомочевины не
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
371
Схема 57.
O
O
O
O
O
t-Bu
S N
N
S
t-Bu
N
N
O
H H
O
H H
O
H
H
H
H
N
O
O
N
O
O
MeO
P
P
MeO
OMe
OMe
Me
Me
ПС-1S
ПС-2S
O
O
O
O
O
t-Bu
S
S N
N
N
N
t-Bu
O
H H
H H
O
O
H
H
H
H
N
O
O
N
O O
MeO
P
P
MeO
OMe
OMe
Me
Me
ПС-1R
ПС-2R
Схема 58.
CF3
O
O
N
F3C
N
N
H
H
3
R
R2
OH
R2
OH
N
Ts
C62 (5 мол%)
R3
R1
R1
OH
CH2Cl2, H2O, 20oC
HO
K2CO3 (2.5 экв.)
103
86
104
приводит к положительным результатам. В то же
Cонг и Ду разработали бифункциональный
время скварамиды способны связываться водород-
сквадрамидный катализатор С15, содержащий
фрагмент хирального циклогександиамина, и
ными связями с трифлат-анионом с образованием
использовали его в альдольной конденсации не-
трифлат-скварамидного комплекса (1:1), который
насыщенных тиазолонов 113 с α-нитрокетонами
катализирует реакцию альдольной конденсации,
114 (схема 64) [51]. В оптимизированных усло-
давая продукты 112 с хорошими выходами и энан-
виях реакции проводили в среде этилацетата при
тиоселективностью (табл. 33).
0°С в присутствии 5 мол% катализатора С15. Ре-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
372
ПОПОВА и др.
Схема 59.
K2CO3
KTs+H2O+CO2
вода
органический
слой
CF3
CF3
O
O
O
O
N
NH
+
-
F3C
N
N
Ts
H
H
F3C
N
N
H
H
N
N
F3C
O O
OH
Ts
O
R
R
C62
R
R
N N
R = OMe
F3C
H H
H
N
O
MeO
O
o-QM
H
R
C62
R = H
ПС-4
F3C
O O
F3C
O O
N N
N N
F3C
H H
H
O
F3C
N
или
H H
H
N
O
O
O
H
H
R
R
ПС-3
Таблица 31. Препаративные и оптические выходы
акция протекает через стадию присоединения по
гидроксиоксиндолов 106
Михаэлю с последующим ацильным переносом,
давая хиральные производные 4-ацилокситиазо-
R1
R2
Выход, %
ee, %
ла 115 с высокими выходами (до 98%) и энанти-
Me
H
97
26
оселективностью (до 93%, табл. 34). Абсолютная
Bn
H
95
67
конфигурация целевых продуктов 115 была уста-
All
H
98
41
Boc
H
82
95
новлена методом рентгеноструктурного анали-
H
5-Me
96
35
за. На основе данных об абсолютной конфигура-
H
5-NO2
Следы
ции авторами был предложен механизм реакции
H
5-F
96
64
(схема 65). Первоначально нитрокетон депротони-
H
5-Cl
89
55
руется третичным амином катализатора, образую-
H
5-Br
92
52
щийся катион аммония связывается с нитроеноля-
H
5-I
97
62
том с помощью водородной связи, в то же время
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
373
Схема 60.
F3C
O
O
N
N
N
Ph
H
H
NO2
O
F3C
Ph
HO
R2
HO
R2
C63 (10 мол%)
O
CH3NO2
O
N
ТГФ, 0oC, 60 ч
N
R1
R1
105
4
106
Схема 61.
105+4
CF3
CF3
O
O
O
O
F3C
N
F3C
N
H
N
H
H
N
N
O
O
H
O
O
H
N
O
O H
O
O
HN
H
H
HN
N
O
N
O
ПС-6
ПС-5
O
O
O
O
N
N
(R)
(S)
HO
HO
R2
R2
O
O
N
N
R1
R1
минорный изомер
основной изомер
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
374
ПОПОВА и др.
Таблица 32. Препаративные и оптические выходы соединений 109 и 110
Ar
R1
R2
Время, ч
Т, °С
Выход, %
ee, %
dr
4-MeС6Н4
Bn
H (107)
48
-15
94 (109)
93
>20:1
4-MeOС6Н4
Bn
H (107)
48
-15
95 (109)
91
>20:1
4-BrС6Н4
Bn
H (107)
48
-20
90 (109)
91
20:1
3-ClС6Н4
Bn
H (107)
48
-20
90 (109)
93
>20:1
2-ClС6Н4
Bn
H (107)
16
-20
91 (109)
92
13:1
Ph
Bn
6-Br (107)
48
-20
90 (109)
98
11:1
Ph
Bn
5-Br (107)
24
-10
94 (109)
94
8:1
Ph
C2H4CO2Me
6-Me (107)
48
-20
91 (109)
88
11:1
4-BrС6Н4
Bn
6-Me (107)
48
-20
88 (109)
94
>20:1
Ph
Bn
H (107)
48
-20
86 (109)
74
4:1
Ph
C2H4CO2Me
(108)
48
-20
93 (110)
94
3,7:1
4-MeС6Н4
Bn
(108)
48
-20
91 (110)
98
12:1
4-CF3С6Н4
Bn
(108)
48
-20
88 (110)
94
6:1
Таблица 33. Препаративные и оптические выходы продуктов 11
X
Ar
Выход, %
ee, %
O (С66)
9-Фенантрил (С66)
<5%
-
S (С66)
9-Фенантрил (С66)
<5%
-
–
H (С67)
10
10
–
Ph (С67)
23
42
–
1-Нафтил (С67)
31
72
–
9-Фенантрил (С67)
100
85
–
1-Пиренил (С67)
100
88
–
1-Фенантрил (С67)
100
87
–
1-Пиренил (С68)
43
2
тиазолинон активируется сквадрамидной группой.
ческие свойства скварамида С69 были изучены в
Поскольку Si-сторона тиазолинона блокирова-
реакции Генри между различными альдегидами 78
на катализатором, то присоединение происходит
и нитрометаном 4 (схема 66). Реакция протекала
с обратной, Re-стороны, c образованием проме-
при -24°С в среде нитрометана с загрузкой сква-
жуточного аниона А. Полученный енолят анион
рамида от 0.25 до 1.00 мол%, приводя к образова-
А атакует карбонильную группу с образованием
нию нитроспиртов 116 с хорошими выходами (от
циклического интермедиата Б, который подвер-
59 до >95%) и энантиоселективностью (82-94%,
гается ретро-альдольной реакции с образованием
табл. 35). Интересен тот факт, что при замене в
нитроаниона В, последний забирает протон от
катализаторе бинафтильной группы с R-конфи-
С15-H+, регенерируя катализатор и превращаясь в
гурацей на ту же группу с S-конфигурацией кон-
продукт 115.
фигурация продукта 116 не изменяется. Авторы
предложили механизм реакции, объясняющий
7. РЕАКЦИЯ ГЕНРИ
трифункциональность катализатора: с одной сто-
В работе [52] сообщалось о получении нового
роны, можно наблюдать привычную активацию
трифункционального скварамида С69, содержа-
альдегида двумя водородными связями с NH-груп-
щего хиральную бинафтильную группу. Каталити-
пами скварамидной части катализатора, с другой,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
375
Схема 62.
O
SBn
N
1
C64 (10 мол%)
R
R2
R2
R1
ArN
H
NAr
N
CH
2Cl2
N
N
BnS
O
O
3
O
OH
O
106
107
109
или
или
SBn
N
R1
H
NAr
N
N
4
O
O
O OH O
108
110
F3C
CF3
MeO
MeO
Me
N
O
O
H
N
O
O
O
O
N
N
H
H
CF3
N
N
N
N
H
H
H
F3C
F3C
H
F3C
N
N
C64
C65
Схема 63.
O
O
TBSOTf (50 мол%)
OTMS
OBn
OBn
O
катализатор
(10 мол%)
*
Ph
R
Ar
N
N
OBn
Ph
МТБЭ, -78°C, 4 ч
Bn
H
H
(1.5 экв.)
O
Br
Br
O O
Ar
S
112
111
O CF3
CF3
CF3
CF3
O
O
O
O
t-Bu
X
t-Bu
t-Bu
N
N
N
N
N
CF3
N
N
CF
N
N
CF3
3
H
H
Me
Me
H
H
Ar
Ar
O
Ar
O
O
C66
C67
C68
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
376
ПОПОВА и др.
Таблица 34. Препаративные и оптические выходы тиазолов 115
R1
R2
R3
Выход, %
ee, %
Ph
Ph
Ph
90
92
4-MeС6Н4
Ph
Ph
97
93
4-ClС6Н4
Ph
Ph
98
91
4-CF3С6Н4
Ph
Ph
94
91
Ph
2-MeС6Н4
Ph
90
89
Ph
3-MeС6Н4
Ph
88
91
Ph
4-MeС6Н4
Ph
96
90
Ph
4-MeOС6Н4
Ph
93
86
Ph
4-FС6Н4
Ph
90
89
Ph
4-ClС6Н4
Ph
80
90
Ph
2-BrС6Н4
Ph
81
90
Ph
3-BrС6Н4
Ph
93
91
Ph
4-BrС6Н4
Ph
96
90
Ph
4-NO2С6Н4
Ph
86
80
Ph
2,4-Cl2С6Н3
Ph
80
90
Ph
2-Фурил
Ph
82
77
Ph
2-Тиенил
Ph
77
84
Ph
2-Нафтил
Ph
79
91
Ph
Ph
4-FС6Н4
82
89
Ph
Ph
4-ClС6Н4
87
88
Ph
Ph
3-BrС6Н4
80
90
Ph
Ph
4-BrС6Н4
80
90
Ph
Ph
4-NO2С6Н4
95
78
Ph
Ph
3-MeС6Н4
90
91
Ph
Ph
4-MeС6Н4
93
92
Ph
Ph
3-MeOС6Н4
85
90
Ph
Ph
2-MeOС6Н4
95
91
Ph
Ph
2-Тиенил
94
74
Ph
Ph
2-Нафтил
95
90
Ph
Ph
Me
60
95
Схема 64.
F3C
O
O
O
N
N
H
H
R3
O
F3C
N
O
N
N
O
NO2
C15 (5 мол%)
1
S
NO2
S
R2
R1
R
R2
R3
EtOAc, 0°C, 24 ч
113
114
115
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
377
Схема 65.
OCOPh
F3C
O
O
N
NO
2
Ph
S
N
N
Ph
N
F3C
H
H
H
O
N
O
C-15-H+
Ph
Ph
S
Ph
NO2
C-15-H+
OCOPh
N
Ph
N
Ph
O
S
NO2
S
Ph
B
Ph
O2N
Ph
O
A
O-
N
O
Ph
Ph
S
NO
2
Б
Ph
Таблица 35. Препаративные и оптические выходы продуктов реакций Генри 116
R
С69, мол%
Время, ч
Выход, %
ee, %
4-NO2C6H4
1
24
>95
82
4-NO2C6H4
0.5
76
>95
82
4-NO2C6H4
0.25
92
86
82
3-NO2C6H4
1
24
>95
94
3-NO2C6H4
0.5
76
>95
94
3-NO2C6H4
0.25
95
92
94
3-NO2C6H4
0.25
96
>95
94
4-CNC6H4
1
95
>95
82
4-CNC6H4
0.5
100
>95
82
4-CNC6H4
0.25
92
59
82
C5F5
0.5
45
>95
86
C5F5
0.25
120
>95
86
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
378
ПОПОВА и др.
Схема 66.
O
O
N
N
H
H
N
OH
O
OH
C69
CH3NO2
NO2
R H
R
-24°C
78
4
116
Схема 67.
NBoc
C71a
NHBoc
(10 мол%)
* NO2
R2CH2NO2
R2
CH2Cl2, 20oC
R1
R1
58
117
118
O
O
OMe
N
Me
N
C70a,
R =трет-бутил
C71a,
R =
трет-бутил
H HN R
C70б,
R = 1-адамантил
C71б,
R = 1-адамантил
N
NH
C70в,
R = 2-адамантил
NH O
C71в,
R = 2-адамантил
Me
N
N
HN
O
R
π-система бинафтилового каркаса стабилизирует
Таблица 36. Препаративные и оптические выходы про-
переходное состояние и активирует альдегид для
дуктов реакций Генри 118
последующей атаки, и, одновременно с этим, атом
R1
R2
Время, ч
Выход, %
ee, %
dr
азота на пипиридиновом кольце активирует нитро-
H
H
24
96
85
-
метан, позволяя ему атаковать альдегид.
4-OMe
H
71
91
75
-
Применение скварамидных катализаторов в
2-Me
H
44
>99
91
-
асимметричной реакции Генри между Boc-за-
3-Cl
H
21
91
64
-
4-Br
H
16
>99
91
-
щищенными иминами 58 и нитроалканами 117
4-Me
H
28
>99
91
-
было продемонстрировано в работе [53]. Реакцию
3-OMe
H
25
98
85
-
проводили в среде дихлорметана в присутствии
2-Br
H
22
93
82
-
10 мол% катализатора при комнатной температуре
H
Me
22
85
90
72:28
(схема 67), в результате были получены амины 118
4-OMe
Me
70
76
44
75:25
с хорошими выходами (более 76%) и энантиосе-
2-Me
Me
26
>99
66
62:38
лективностью 44-91% (табл. 36). Авторами была
H
Et
20
96
89
78:22
H
CH2Ph
26
-
77
62:38
предложена модель переходного состояния, в ко-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
379
Схема 68.
стью (>20:1) и энантиоселективностью (до 92%,
табл. 37). Авторами был предложен следующий
N
механизм реакции (схема 70): 1-азадиен и азлактон
O
O
активируются бифункциональным катализатором
с образованием комплекса, в котором молекулы
MeO
реагентов связаны с катализатором водородными
N
N t-Bu
связями, при этом азлактон находится в форме
H
H
N
енолята; далее в данном комплексе реализуется
H O
BocN
[4+2]-циклоприсоединение через взаимодействие
H
1-азадиенов с енолятами. Полученный промежу-
O N
Ph
точный тетрациклический продукт таутомеризует-
CH2
ся и протонируется, что приводит к образованию
конечного соединения 121 и регенерации катали-
затора.
торой депротонирование нитроалкана достигается
В 2019 г. Сонг с сотр. сообщил об асимме-
через взаимодействие с третичной аминогруппой
тричной реакции [4+2]-циклизации с участием
катализатора, одновременно скварамидный фраг-
2-бензотиазолиминов 121 и азлактонов 120, ката-
мент активирует Boc-имин посредством двух во-
лизируемой хиральными скварамидами [55]. При
дородных связей (схема 68). Нитрометан атакует
оптимизации условий реакции было найдено, что
активированный имин преимущественно со сторо-
лучшие выходы (до 70%) и оптическая чистота (до
ee 99%, dr >20:1) продуктов 122 достигаются при
ны Si-поверхности.
проведении реакции в среде тетрагидрофурана при
8. ЦИКЛОПРИСОЕДИНЕНИЕ
комнатной температуре в присутствии 10 мол% ка-
тализатора С51 (схема 71, табл. 38). В предложен-
В работе [54] описано использование сква-
ном механизме реакции азлактон депротонируется
рамидного катализатора С72 в реакции Дильса-
катализатором с образованием соответствующего
Альдера в условиях обращенного электронного
енолята. В то же время 2-бензотиазолимин акти-
соответствия (схема 69). В данном примере сква-
вируется посредством образования водородных
рамидный катализатор является бифункциональ-
связей со скварамидом (схема 72). Впоследствии
ным основанием Бренстеда, которое катализирует
нуклеофильная атака енолята азлактона со сторо-
реакцию между азадиеном 119, полученным из
ны Si-поверхности 2-бензотиазоламина (реакция
сахарина, и азлактонами 120. Реакция протекает
Манниха) приводит к интермедиату A и, наконец,
при -20°C в 1,2-дихлорэтане с использованием
внутримолекулярная лактамизация интермедиата
5-20 мол% скварамида, и дает продукты 121 с вы-
A приводит к целевому продукту 122 и регенера-
сокими выходами (до 96%), диастереоселективно-
ции катализатора.
Схема 69.
O
O
CF3
N
O
O
N
N
R2
S O
O
Ph
H
H
R2
S O
CF3
N
O
O
O
N
R4
C72 (20 мол%)
R4
N R3
-20oC, CH2Cl2
N R3
H
R1
R1
119
120
121
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
380
ПОПОВА и др.
Схема 70.
O
O
O
S O
S O
O
N
N
O
C72
O
Bn
N
Ph
Bn
N Ph
H
Ph
Ph
C72
O
O
Me
C79
NH
Ar
H
N
N
Me
циклизация
Me
Me
Ph
NH
H H
O O O O
S
N
O O
N
Ph
HH
O
S
Bn
N
O
N
Ph
Ph
Bn
Si-поверхностная атака
Схема 71.
CF3
O
H
F3C
O
N
H
HN
N
MeO
2
O
R
2
NHCOAr
O
N
N
Ar1
O
1
Ar2
R1
N
Ar1
R
N
C51 (10 мол%)
N
N
S
R2
ТГФ, 20oC, 12 ч
S
121
120
122
В работе
[56] исследована реакция
[3+2]-
щие в положении 2′ трифторметильную группу
циклоприсоединения 3-алкенилоксиндолов (дипо-
(схема 73). При оптимальных условиях реакция
лярофилов) 123 с CF3-содержащими кетиминами
протекает в среде толуола с применением 1 мол%
(предшественниками диполя) 124, протекающую
катализатора, при этом циклоаддукты 125 образу-
в присутствии хиральных скварамидов. В ходе
ются с высокими выходами (до 91%), диастерео-
реакции были получены циклоаддукты с остовом
селективностью (>20:1) и энантиоселективностью
спиропирролидин-3,3′-оксиндола
125, имеющие
(до 99%, табл. 39). Предполагаемый механизм
три смежных стереогенных центра, и содержа-
циклизации включает взаимодействие депрото-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
381
Таблица 37. Препаративные и оптические выходы соединений 121
R1
R2
R3
R4
Время, ч
Выход, %
ee, %
dr
2-MeO
H
Ph
Bn
72
96
88
>20:1
1-Нафтил
H
Ph
Bn
72
91
86
>20:1
2-Нафтил
H
Ph
Bn
72
95
92
>20:1
H
Ph
Bn
72
88
90
>20:1
O
O
Ph
4-Br
Ph
Bn
36
36
60
>20:1 (20°С)
Ph
H
Ph
Et
72
89
85
>20:1
Ph
H
Ph
i-Pr
72
86
74
>20:1
Ph
H
4-MeС6Н4
Bn
72
97
90
>20:1
Ph
H
4-ClС6Н4
Bn
72
98
88
>20:1
Ph
H
4-FС6Н4
Bn
72
98
90
>20:1
Ph
H
4-t-BuС6Н4
Bn
72
96
86
>20:1
Ph
H
4-CF3С6Н4
Bn
72
96
74
>20:1
Ph
H
3,5-Me2С6Н3
Bn
72
95
87
>20:1
Ph
H
3,4-Cl2С6Н3
Bn
60
97
77
>20:1
Ph
H
Ph
Bn
72
95
92
>20:1
2-MeС6Н4
H
Ph
Bn
72
80
86
>20:1
3-MeС6Н4
H
Ph
Bn
72
86
92
>20:1
4-MeС6Н4
H
Ph
Bn
72
93
93
>20:1
2-ClС6Н4
H
Ph
Bn
72
83
90
>20:1
3-ClС6Н4
H
Ph
Bn
72
74
92
>20:1
4-ClС6Н4
H
Ph
Bn
72
98
90
>20:1
3-BrС6Н4
H
Ph
Bn
72
98
91
>20:1
4-BrС6Н4
H
Ph
Bn
72
97
90
>20:1
4-FС6Н4
H
Ph
Bn
72
92
88
>20:1
4-CF3С6Н4
H
Ph
Bn
60
79
84
>20:1
4-CNС6Н4
H
Ph
Bn
60
84
76
>20:1
2-Тиенил
H
Ph
Bn
60
99
92
>20:1
3,5-(MeO)2С6Н3
H
Ph
Bn
72
86
86
>20:1
3,4,5-(MeO)3С6Н3
H
Ph
Bn
96
92
91
>20:1
нированной формы CF3-кетимина с третичным
последующих реакций. Этот подход был исполь-
атомом азота скварамидного катализатора, в то же
зован в работе [57], в которой исследована реакция
самое время алкенилоксиндол активируется при
циклоприсоединения между CO2 и эпоксидом в
образовании водородных связей с NH-группами
автоклаве высокого давления (1.5 атм) при 100°С с
скварамида. И на последнем этапе в образовав-
использованием 3 мол% ионно-жидкостного ката-
шейся хиральной каталитической ячейке проте-
лизатора С73 (схема 75, табл. 40). Выход конечно-
кает асимметричное
[3+2]-циклоприсоединение
го продукта составил 96%. Катализатор С73 может
(схема 74).
быть выделен из реакционной смеси простой де-
Cкварамидные группы способны образовывать
кантацией и повторно использован в реакционном
прочные водородные связи с атомом кислорода в
процессе. Механизм превращения, по мнению ав-
эпоксиде, что приводит к его активированию для
торов, заключается во взаимодействии атома кис-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
382
ПОПОВА и др.
Таблица 38. Препаративные и оптические выходы продуктов циклизации 122
R1
Ar1
R2
Ar2
Выход, %
ee, %
dr
H
Ph
Bn
Ph
70
99
>20:1
H
4-MeС6Н4
Bn
Ph
21
92
>20:1
H
4-BrС6Н4
Bn
Ph
74
97
>20:1
H
4-ClС6Н4
Bn
Ph
73
97
>20:1
H
4-FС6Н4
Bn
Ph
65
99
>20:1
H
4-NO2С6Н4
Bn
Ph
81
99
>20:1
H
3-ClС6Н4
Bn
Ph
67
99
>20:1
H
2-BrС6Н4
Bn
Ph
57
83
>20:1
H
1-Нафтил
Bn
Ph
37
71
5:1
H
2-Нафтил
Bn
Ph
57
98
>20:1
H
2-Тиенил
Bn
Ph
60
97
>20:1
5-Br
Ph
Bn
Ph
60
99
5:1
5-OCF3
Ph
Bn
Ph
57
99
5:1
5-Cl
Ph
Bn
Ph
66
93
6:1
5-MeO
Ph
Bn
Ph
69
99
>20:1
6-Br
Ph
Bn
Ph
66
99
>20:1
H
Ph
Bn
1-Нафтил
62
99
>20:1
H
Ph
Bn
4-MeС6Н4
57
94
>20:1
H
Ph
Bn
4-MeOС6Н4
73
93
>20:1
H
Ph
Bn
4-BrС6Н4
70
99
>20:1
H
Ph
2-Нафтил
Ph
77
99
>20:1
H
Ph
4-FС6Н4
Ph
54
99
>20:1
H
Ph
4-ClС6Н4
Ph
65
98
10:1
H
Ph
Me
Ph
67
99
>20:1
Таблица 39. Препаративные и оптические выходы продуктов [3+2]-циклоприсоединения 125
R1
R2
R3
Время, ч
Выход, %
ee, %
dr
Me
H
Me
3
91
>99
>20:1
Et
H
Me
8
57
>99
>20:1
CH2OCH3
H
Me
12
63
>99
>20:1
Ph
H
Me
4
85
>99
6:1
Bn
H
Me
10
76
94
>20:1
Me
5-F
Me
2
81
>99
>20:1
Me
5-Cl
Me
2.5
83
>99
>20:1
Me
5-Br
Me
4
85
>99
>20:1
Me
5-Me
Me
12
88
>99
>20:1
Me
5-MeO
Me
24
91
>99
>20:1
Me
6-Cl
Me
2
90
>99
>20:1
Me
7-Cl
Me
1.5
96
>99
>20:1
Me
7-Br
Me
3
90
>99
>20:1
Me
5-Br-7-Me
Me
40
68
96
>20:1
Me
H
Et
48
83
99
>20:1
Me
H
п-Pr
48
80
>99
>20:1
Me
H
п-Bu
48
76
98
>20:1
Me
H
i-Bu
132
73
99
>20:1
Me
H
Ph
48
65
53
>20:1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
383
Схема 72.
O
O
Bn
O
NHCOPh
N
Ph
N
Ph
стандартные
N
Ph
N
условия
S
Bn
N
S
C51
C51
циклизация
H
R
O
O
N
Me
Me
Хиральный
фрагмент
ArN
N
N Me
N
реакция
N
H H
H Me
Манихa
S
O
S
N O
N
O
O
O
Ph
N
Ph
N
Bn
N
O
Bn
N
Ph
Bn
Ph
S Ph
A
N
Ph
Схема 73.
O
O
CF3
N
HN
NH
CF3
R3
EtOOC
COOEt
N
NH
C13 (1 мол%)
R3
EtOOC COOEt
O
CF3
R2
толуол
N
N
R2
O
R1
N
CF3
123
124
125
R1
лорода эпоксида с двумя группами NH скварамида
Таблица 40. Препаративные выходы циклических кар-
через образование водородных связей, что приво-
бонатов
дит к поляризации связи C-O эпоксида (схема 75,
R
Время, ч
Выход, %
стадия 1). Затем бром-анионы, в качестве нуклео-
Me
3
96
филов, атакуют β-атом углерода в эпоксиде. В ре-
Et
3
92
зультате происходит раскрытие кольца эпоксида с
CH2Cl
3
99
образованием промежуточного оксианиона, кото-
CH2Br
3
98
рый стабилизируется через образование водород-
п-Bu
3
88
ных связей с двумя группами NH (стадия 2). Эта
Ph
3
91
стадия обычно рассматривается как стадия, опре-
12
54
деляющая скорость реакции циклоприсоединения.
O
На третей стадии оксанион реагирует с СО2, при-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
384
ПОПОВА и др.
Таблица 41. Препаративные и оптические выходы бисспиропроизводных 127
R1
R2
R3
R4
Выход, %
ee, %
dr
Ph
Ph
H
H
97
96
>99:1
Ph
Ph
Bn
H
79
82
96:4
Ph
Ph
H
6-F
99
92
98:2
Ph
Ph
H
6-Cl
96
94
98:2
Ph
Ph
H
4-Cl
98
88
>99:1
Ph
Ph
H
6-Br
93
90
98:2
Ph
Ph
H
4-Br
96
89
>99:1
Ph
Ph
H
6-Me
91
91
99:1
4-MeC6H4
Ph
H
H
99
96
99:1
4-CF3C6H4
Ph
H
H
88
96
99:1
4-ClC6H4
Ph
H
H
87
94
98:2
Ph
4-FC6H4
H
H
99
96
99:1
Ph
4-ClC6H4
H
H
97
95
99:1
Ph
2-BrC6H4
H
H
99
98
97:3
Ph
3-BrC6H4
H
H
99
93
>99:1
Ph
4-BrC6H4
H
H
96
95
99:1
Ph
4-NO2C6H4
H
H
98
94
>99:1
Ph
2,4-Cl2C6H4
H
H
89
96
97:3
Ph
2-MeC6H4
H
H
95
99
99:1
Ph
3-MeC6H4
H
H
99
96
>99:1
Ph
4-MeC6H4
H
H
99
97
99:1
Ph
4-MeOC6H4
H
H
98
96
>99:1
Ph
1-Нафтил
H
H
95
98
99:1
Ph
2-Фурил
H
H
90
93
99:1
Ph
2-Тиенил
H
H
95
96
99:1
водя к получению ациклическоко алкилкарбоната,
ключается в
[4+1]-циклоприсоединении орто-
который впоследствии претерпевает циклизацию
хинонметидов, образующихся in situ из 2-[фенил-
с образованием циклического карбоната при одно-
(тозил)метил]фенолов 103, с 4-галогенпиразолона-
временной регенерации скварамидного катализа-
ми 128. Реакция проводилась в двухфазной системе
тора (стадия 4).
хлороформ-вода с добавлением карбоната калия
В работе [58] была исследована асимметричная
в качестве основания, в присутствии хирального
реакция [2+1]-циклоприсоединения между 3-хлор-
скварамида С75 (5-10 мол%), и приводила к обра-
оксиндолами 126 и 5-алкенилтиазолонами 113, ка-
зованию спиропиразолонов 129 с высокими выхо-
тализируемая гидрохининовым скварамидом С74
дами (до 95%), энантиоселективностью (до 99%) и
(схема 76). Реакция протекала в ацетонитриле при
диастероселективностью (dr 98:2) (схема 77, табл.
-10°С в присутствии 10 мол% катализатора С74. В
42). Кроме того, этот метод обеспечивает подход
результате был получен широкий спектр бисспи-
ко всем четырем возможным стереоизомерам cпи-
росочлененных производных 127 с высокими вы-
робензофуранпиразолонов и основан на выборе
ходами (до 99%) и диастереоселективностью (dr
соответствующих 4-галогенпиразолонов и хираль-
>99:1) и энантиоселективностью (до 99%, табл.
ных скварамидов. На основании эксперименталь-
41).
ных данных авторами предложен механизм для
Отметим также работу [59], авторы которой
асимметричной [4+1]-циклизации (схема 78). В
разработали простой путь к оптически активным
органической фазе, под воздействием третичного
спиробензофуранпиразолонам 129, который за-
амина, входящего в состав С75, бензилсульфоны
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
385
Схема 74.
CF3
N
NMe
3
EtO
O
EtOOC COOEt
NH
O OEt
CF3
Me
CF3
_
N
O
EtO
O
N
C13
Me
O OEt
N
F3C
O
O
N
N
H
H
F3C
+
N
O
H
Me
Атака со стороны
N Me
Re-поверхности
O N
-
CF3
Атака со стороны
EtO
OEt
Si-поверхности
O
127 подвергаются отщеплению TsH с образова-
получены оптически активные спироциклогекса-
нием орто-хинонметидов (o-QM). Последующий
диенпиразолоны 132, содержащие четвертичный
домино-процесс - сопряженное присоединение/
углеродный хиральный центр (схема 79). Реакция
нуклеофильное замещение - инициируется двой-
протекала в 1,2-дихлорэтане при 40°С с исполь-
ной активирующей природой бифункционального
зованием 2.5 мол% хирального скварамида С76 и
скварамида С75, который одновременно активи-
приводила к образованию спиропиразолонов 132 с
рует орто-хинонметид и 4-галогенпиразолоны за
хорошими выходами (до 78%), энантиоселектив-
счет образования водородных связей. Более того,
ностью (до 95%) и диастероселективностью (dr
Re-подход 4-галогенпиразолонов привел к обра-
20:1, табл. 43). Возможное переходное состояние,
зованию основного (S,S)-стереоизомера. В водной
по мнению авторов, включает активацию соеди-
фазе реакции нейтрализации K2CO3 аммониевыми
нений 130 и 131 через образование водородных
солями [С75-H]+Ts- и [С75-H]+Br- приводят к ре-
связей с хиральным бифункциональным катали-
генерации катализатора С75.
затором С76, что также обусловливает контроль
В работе [60] авторы сообщили об асимметрич-
за стереоселективностью реакции (схема 80). Ме-
ной реакции [3+3]-циклоприсоединения между
тильная группа α-арилиденпиразолинона сначала
α-арилиденпиразолинонами 130 и 2-бензилиден-
депротонируются с образованием соответствую-
малононитрилами 131, в результате которой были
щего диененолята. Затем енолят взаимодействует
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
386
ПОПОВА и др.
Таблица 42. Препаративные и оптические выходы соединений 129
R1
R2
R3
R4
Выход, %
ee, %
dr
2-OMe
Ph
4-FC6H4
Me
83
98
89:11
2-OMe
Ph
4-BrC6H4
Me
79
98
99:1
2-OMe
Ph
3-BrC6H4
Me
93
98
98:2
2-OMe
Ph
F5C6
Me
91
99
90:10
2-OMe
Ph
4-MeC6H4
Me
84
98
92:8
2-OMe
Ph
2-EtC6H4
Me
81
97
85:15
2-OMe
Ph
2-Нафтил
Me
95
94
80:20
2-OMe
Ph
Cy
Me
76
98
82:18
2-OMe
Ph
Ph
Et
92
97
94:6
2-OMe
Ph
Ph
n-Pr
91
87
91:9
2-OMe
Ph
Ph
i-Pr
90
95
93:7
2-OMe
Ph
Ph
Ph
86
81
97:3
2-OMe
Ph
Ph
Me
95
98
90:10
2-OEt
Ph
Ph
Me
93
92
86:14
3-OMe
Ph
Ph
Me
95
95
94:6
4-Br-2-OMe
Ph
Ph
Me
95
98
80:20
2-OMe
4-FC6H4
Ph
Me
95
98
82:18
2-OMe
4-ClC6H4
Ph
Me
93
98
82:18
2-OMe
4-CF3C6H4
Ph
Me
83
96
88:12
2-OMe
3-CF3C6H4
Ph
Me
95
96
81:19
2-OMe
2-CF3C6H4
Ph
Me
84
99
96:4
2-OMe
4-MeC6H4
Ph
Me
93
94
85:15
2-OMe
3-MeC6H4
Ph
Me
95
94
85:15
2-OMe
2-MeC6H4
Ph
Me
92
96
95:5
2-OMe
3-MeOC6H4
Ph
Me
90
96
87:13
2-OMe
2-MeOC6H4
Ph
Me
92
98
95:5
2-OMe
3,4-(-OCH2O-)C6H3
Ph
Me
89
94
80:20
2-OMe
1-Нафтил
Ph
Me
90
99
96:4
2-OMe
2-Нафтил
Ph
Me
75
99
68:32
2-OMe
2-Фурил
Ph
Me
92
85
83:17
2-OMe
2-Тиенил
Ph
Me
91
92
87:13
2-OMe
Me
Ph
Me
56
60
66:34
2-OMe
Me
Ph
Me
65
60
83:17
H
Ph
Ph
Me
94
50
72:28
H
2-MeOC6H4
Ph
Me
90
61
83:17
с 2-бензилиденмалононитрилом с образованием
9. ЗАКЛЮЧЕНИЕ
аддуктов Михаэля. Последующая внутримолеку-
Исследования по использованию скварамидов
лярная циклизация с участием одной из циано-
в органическом синтезе бурно развиваются в по-
групп приводит к получению оптически активных
следнее время. Стоит отметить, что количество
спироциклогексадиенпиразолонов 132.
публикаций, посвященных этой проблематике,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
387
Таблица 43. Препаративные и оптические выходы продуктов [3+3]-циклоприсоединения 132
R1
R2
R3
R4
Выход, %
ee, %
dr
3-ClC6H4
Ph
Ph
Ph
77
96/70
60:40
3-FC6H4
Ph
Ph
Ph
73
94/70
70:30
4-ClC6H4
Ph
Ph
Ph
69
93/30
57:43
4-BrC6H4
Ph
Ph
Ph
65
96/65
71:29
4-IC6H4
Ph
Ph
Ph
78
96/70
68:32
4-MeC6H4
Ph
Ph
Ph
78
97/67
74:26
4-i-PrC6H4
Ph
Ph
Ph
67
96/65
78:22
2-MeOC6H4
Ph
Ph
Ph
45
99/53
69:31
2-Нафтил
Ph
Ph
Ph
65
94/63
65:35
2-Тиенил
Ph
Ph
Ph
75
95/75
73:27
Ph
Ph
4-MeC6H4
Ph
75
99/53
79:21
Ph
Ph
4-MeOC6H4
Ph
70
96/67
73:27
Ph
Ph
4-CNC6H4
Ph
43
93/19
54:46
Ph
Ph
3-ClC6H4
Ph
57
96/39
71:29
Ph
Ph
Ph
Ph
65
97/60
77:23
Ph
2-ClC6H4
Ph
Ph
72
97/65
75:25
Ph
2-BrC6H4
Ph
Ph
70
96/65
71:29
Ph
2-MeOC6H4
Ph
Ph
54
96/73
80:20
Ph
2,4-Cl2C6H4
Ph
Ph
85
96/60
76:24
Ph
2-FC6H4
Ph
Ph
58
92/58
75:25
Ph
4-MeC6H4
Ph
Ph
76
96/66
76:24
Ph
3-NO2C6H4
Ph
Ph
48
95/60
74:26
Ph
4-ClC6H4
Ph
Ph
70
97/58
76:24
Ph
4-BrC6H4
Ph
Ph
67
97/67
75:25
Ph
4-FC6H4
Ph
Ph
69
96/65
66:34
Ph
Ph
Ph
4-MeC6H4
72
95/46
70:30
Ph
Ph
Ph
4-MeOC6H4
70
>99/60
72:28
Ph
Ph
Ph
4-FC6H4
63
94/58
70:30
увеличилось более чем в 5 раз за последние 10
органокатализ признан передовым направлением
лет. Целый ряд полезных свойств, таких как псев-
в асимметричном синтезе, и хиральные сквара-
доароматичность, структурная жесткость, присут-
миды показали свою эффективность при исполь-
ствие в одной молекуле как доноров, так и акцеп-
зовании в новых энантиоселективных реакциях.
торов водородных связей, а также стабильность и
Говоря о дальнейших перспективах скварамидов,
простые подходы к синтезу, обусловили широкое
нельзя не отметить, что в настоящее время фарма-
использование этих соединений для решения раз-
цевтические компании разрабатывают новые сква-
личных прикладных задач, таких как связывание
рамидные субстраты, способные стать перспек-
анионных субстратов, определения анионных
тивными кандидатами в лекарственные средства,
аналитов, стимулирования трансмембранного
а сам каркас скварамида рассматривается как био-
транспорта анионов. Одним из главных практи-
изостер для биологически вездесущего фосфата.
ческих направлений использования скварамидов
Молекулярная биология также не обошла своим
является их применение как органокатализаторов
вниманием скварамиды, например, чувствитель-
для индукции хиральности в асимметрическом
ная и селективная реакция циклобутеновых эфи-
синтезе. Стоит отметить, что в настоящее время
ров с аминами используется как надежный метод
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
388
ПОПОВА и др.
Схема 75.
O
O
NH
N
N
N
N
HOOCH2C
NH
H
H
CH2COOH
С73
Br
Br
O
стадия 4
стадия 1
O
R
O
O
O
O
R
NH
N
N
N
N
HOOCH2C
NH
CH2COOH
H
H
O
O
O
Br
R
Br
NH
N
N
N
NH
HOOCH2C
N
CH2COOH
H
H
стадия 2
Br
O
Br
Br
O
O
O
O
R
NH
N
N
N
NH
HOOCH2C
N
стадия 3
CO2
CH2COOH
H
H
O
Br
R
Br
Схема 76.
CF3
Et
O
O
H
F3C
N
HN
N
H
O
OMe
N
R2
O
Cl
R1
S
C74 (10 мол%)
N
N
R2
4
O
R
R4
O
S
N
Na2CO3 (1.0 экв.)
N
R1
R3
CH3CN, -10oC, 16 ч
R3
113
126
127
биоконьюгации пептидов и белков. В заключение
читателей принять участие в развитии этого, несо-
стоит сказать, что при написании данного обзора
мненно, интересного и перспективного направле-
авторы преследовали цель не только рассказать о
ния органической химии.
последних достижениях в использовании сквара-
В заключение мы хотели бы упомянуть пионе-
мидов в асимметрическом катализе, но и побудить
ров асимметричесмкого органокатализа, внесших
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
389
Схема 77.
F3C
O
O
N
N
N
H
H
F3C
MeO
Ts
O
R2
O
Br
R3
R3
R2
N
C75
N
1
N
R
R1
N
K2CO3, CHCl3, H2O, 20oC
O
N
OH
R4
R4
103
128
129
Схема 78.
K2CO3
KTs+KBr+KHCO3
вода
органический слой
Ph
O
Ph
C75
[C75-H]+Ts-
N
N
O
Me
OMe
[C75-H]+Br-
(S,S)
Ts
N
N
Me
O
O
O
O
Br
Ph
N
Ar
OMe
Ar
OH
N
MeO
N
N
O
N
N
OMe
Ph
H
H
H
H N
N
OMe
H
O
O
O
OMe
H
O
O
Ph
O
Br
N
N
Ph
ArN
Br
N
N
N
Re
H
H
N
o-QM
Ph
Me
MeO
PhMe
сопряженное присоединение
нуклеофильное замещение
N
C75
большой вклад в его развитие и становление, как
А. Кордова. В 2021 г. Д. Макмиллан и Б. Лист ста-
важного направления органической химии: К. Бар-
ли лауреатами Нобелевской премии по химии за
бас III, Б. Лист, Д. Макмиллан, К.А. Йоргенсен и
развитие асимметрического органокатализа.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
390
ПОПОВА и др.
Схема 79.
O
O
CF3
N
MeO
R2
N
N
H
H
CF3
NC
O
R3
Me
N
R1
CN
N
H2N
R2
C76 (2.5 мол%)
O
N
R4
R1
CN
40oC, CH2Cl2, 16 ч
N N
R4
R3
130
131
132
Схема 80.
СПИСОК ЛИТЕРАТУРЫ
N
1.
Marchetti L.A., Kumawat L.K., Mao N., Stephens J.C.,
O
O
Elmes R.B. // Chem. 2019. Vol. 5. P. 1398. doi 10.1016/j.
F3C
chempr.2019.02.027
H
2.
Rotger M.C., Pin M.N., Frontera A., Martorell G.,
OMe
N
N
Ballester P., Deya P.M., Costa A. // J. Org. Chem. 2004.
H
H
Vol. 69. P. 2302. doi 10.1021/jo035546t
N
F3C
3.
Prohens R., Portell A., Font-Bardia M., Bauza A.,
H
N
N
Frontera A. // Cryst. Growth Des. 2014. Vol. 14.
O
Ph
P. 2578. doi 10.1021/cg500264k
N
4.
Talens V.S., Englebienne P., Trinh T.T., Noteborn W.E.M.,
Re
N
Voets I.K., Kieltyka R.E. // Angew. Chem. Int. Ed. 2015.
Ph
H Ph
Vol. 54. P. 10502. doi 10.1002/anie.201503905
Ph
5.
Li Z., Li X., Cheng J.-P. // Synlett. 2019. Vol. 30.
P. 1940. doi 10.1055/s-0037-1611890
6.
Cohen S., Cohen S.G. // J. Am. Chem. Soc. 1966.
Vol. 88. P. 1533. doi 10.1021/ja00959a040
ИНФОРМАЦИЯ ОБ АВТОРАХ
7.
Malerich J.P., Hagihara K., Rawal V.H. // J. Am. Chem.
Soc. 2008. Vol. 130. P. 14416. doi 10.1021/ja805693p
8.
Held F.E., Tsogoeva S.F. // Catal. Sci. Technol. 2016.
org/0000-0001-8666-282Х
Vol. 6. P. 645. doi 10.1039/c5cy01894c
Бойцов Виталий Михайлович, ORCID: https://
9.
Zhao B.-L., Li J.-H., Du D.-M. // Chem. Rec. 2017.
Vol. 17. P. 994. doi 10.1002/tcr.201600140
orcid.org/0000-0002-4857-2046
10.
Grayson M.N. // J. Org. Chem. 2017. Vol. 82. P. 4396.
Степаков Александр Владимирович, ORCID:
doi 10.1021/acs.joc.7b00521
11.
Hasılcıogulları D., Tanyeli C. // Tetrahedron Lett. 2018.
Vol. 59. P. 1414. doi 10.1016/j.tetlet.2018.02.068
БЛАГОДАРНОСТЬ
12.
White J. D., Shaw S. // Chem. Sci. 2014. Vol. 5. P. 2200.
doi 10.1002/chin.201443072
Работа выполнена при финансовой поддерж-
13.
Kostenko A.A., Kucherenko A.S., Komogortsev A.N.,
ке Российского научного фонда (проект № 20-15-
Lichitsky B.V., Zlotin S.G. // Org. Biomol. Chem. 2018.
00332).
Vol. 16. P. 9314. doi 10.1039/c8ob02523a
КОНФЛИКТ ИНТЕРЕСОВ
14.
Kucherenko A.S., Kostenko A.A., Komogortsev A.N.,
Lichitsky B.V., Fedotov M.Yu., Zlotin S.G. // J. Org.
Авторы заявляют об отсутствии конфликта
Chem. 2019. Vol. 84. P. 4304. doi 10.1021/acs.
интересов.
joc.9b00252
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
КАТАЛИЗАТОРЫ НА ОСНОВЕ СКВАРАМИДОВ
391
15.
Tukhvatshin R.S., Kucherenko A.S., Nelyubina Y.V.,
34.
Bai S., Zhu Y., Wu Q. // Heterocycl. Commun. 2019.
Zlotin, S.G. // Eur. J. Org. Chem. 2018. Vol. 48. P. 7000.
Vol. 25. P. 47. doi 10.1515/hc-2019-0005
doi 10.1002/ejoc.201801423
35.
Zhu Y.,Li Y., Meng Q., Li X. // Org. Chem. Front. 2016.
16.
Gormen M., Plażuk D., Pigeon P., Hillard E.A., Pla-
Vol. 3. P. 709. doi10.1039/C6QO00038J
mont M.A., Top S., Vessières A., Jaouen G. //
36.
Luo Y., Xie K.-X., Yue D.-F., Zhang X.-M., Xu X.-Y.,
Tetrahedron Lett. 2010. Vol. 51. P. 118. doi 10.1016/j.
Yuan W.-C. // Org. Biomol. Chem. 2018. Vol. 16.
tetlet.2009.10.102
P. 3372. doi 10.1039/c8ob00707a
17.
Zhang Y.-P., You Y., Zhao J.-Q., Zhang X.-M., Xu X.-Y.,
37.
Zhou Y., You Y., Wang Z.-H., Zhang X.-M., Xu X.-Y.,
Yuan W.-C. // J. Org. Chem. 2019. Vol. 84. P. 7984. doi
Yuan W.-C. // Eur. J. Org. Chem. 2019. Vol. 20. P. 3112.
10.1021/acs.joc.9b00837
doi 10.1002/ejoc.201900346
18.
Zhao M.-X., Zhu G.-Y., Zhao X.-L., Shi M. // Tetrahedron.
38.
Qi L., Hou H., Ling F., Zhong W. // Org. Biomol. Chem.
2019. Vol. 75. P. 1171. doi 10.1016/j.tet.2019.01.024
2018. Vol. 16. P. 566. doi 10.1039/c7ob02606d
19.
Kaya U., Chauhan P., Hack D., Deckers K., Put-
39.
Zhao Y-L., Lou Q-X., Wang L-S., Hu W-H., Zhao J-L. //
treddy R., Rissanen K., Endersa D. // Chem. Commun.
Angew. Chem. Int. Ed. 2017. Vol. 129. P. 344. doi
2015. Vol. 52. P. 1669. doi 10.1039/C5CC09592A
10.1002/anie.201609390
20.
Yang S.-M., Karanam P., Wang M., Jang Y.-J., Yeh Y.-S.,
40.
Montesinos-Magraner M., Vila C., Rendon-Patino A.,
Tseng P.-Y., Ganapuram M.R., Liou Y.-C., Lin W. //
Blay G., Fernandez I., Munoz M.C., Pedro J.R. //
Chem. Commun. 2019. Vol. 55. P. 1398. doi 10.1039/
ACS Catal. 2016. Vol. 6. P. 2689. doi 10.1021/
c8cc09219b
acscatal.6b00260
21.
Zhang X.-L., Tang C.-K., Xia A.-B., Feng K.-H.,
41.
Kumari P., Barik S., Khan N.H., Ganguly B., Ku-
Du X.-H., Xu D.-Q. // Eur. J. Org. Chem. 2017. Vol. 22.
reshy R.I., Abdi S.H.R., Bajaj H.C. // RSC Adv. 2015.
P. 3152. doi 10.1002/ejoc.201700474
Vol. 5. P. 69493. doi 10.1039/C5RA12795E
22.
Yang Z.-T., Zhao J., Yang W.-L., Deng W.-P. // Org. Lett.
42.
Zhou D., Huang Z., Yu X., Wang Y., Li J., Wang W.,
2019. Vol. 21. P. 1015. doi 10.1021/acs.orglett.8b04039
Xie H. // Org. Lett. 2015. Vol. 17. P. 5554. doi 10.1021/
23.
Tang Q.-G., Cai S.-L., Wang C.-C., Lin G.-Q., Sun X.-W. //
acs.orglett.5b02668
Org. Lett. 2020. Vol. 22. P. 3351. doi 10.1021/acs.
43.
Wang P., Gao Y., Zhao Y., Liu W., Wang Y.J. // Org.
orglett.0c00779
Chem. 2017. Vol. 82. P. 13109. doi 10.1021/acs.
24.
Ullah M.S., Itsuno S. // ACS Omega. 2018. Vol. 3.
joc.7b02168
P. 4573. doi 10.1021/acsomega.8b00398
44.
Kaya U., Chauhan P., Mahajan S., Deckers K., Valko-
25.
Ullah M.S., Itsuno S. // Chem. Lett. 2018. Vol. 47.
nen A., Rissanen K., Enders D. // Angew. Chem. Int. Ed.
P. 1220. doi 10.1246/cl.180554
2017. Vol. 56. P. 15358. doi 10.1002/anie.201709224
26.
Chhanda S.A., Itsuno S. // J. Catal. 2019. Vol. 377.
45.
Li Y., He C. Q., Gao F.-X., Li Z., Xue X-S., Li X.,
P. 543. doi 10.1016/j.jcat.2019.07.060
Houk K.N., Cheng J-P. // Org. Lett. 2017. Vol. 19. P.
27.
Li X., Wang Z., Sun J., Gao J., Zhao Y., Cheng P.,
1926. doi 10.1021/acs.orglett.7b00727
Aguila B., Ma S., Chen Y., Zhang Z. // Chem. Commun.
46.
Wang Y., Zhang C., Wang H., Jiang Y., Du X., Xu D. //
2019. Vol. 55. P. 5423. doi 10.1039/C9CC01317B
Adv. Synth. Cat. 2017. Vol. 359. P. 791. doi 10.1002/
28.
Valle M., Martín L., Maestro A., Andres J.M., Pedrosa R. //
adsc.201600814
Polymers. 2018. Vol. 11. P. 13. doi 10.3390/
47.
Guo W., Wu B., Zhou X., Chen P., Wang X., Zhou Y.G.,
polym11010013
Liu Y., Li. C. // Angew. Chem. Int. Ed. 2015. Vol. 54.
29.
Kisszekelyi P., Alammar A., Kupai J., Huszthy P.,
P. 4522. doi 10.1002/ange.201409894
Barabas J., Holtzl T., Szente L., Bawn C., Adams R.,
48.
Chennapuram M., Reddy U.V.S., Seki C., Okuyama Y.,
Szekely G. // J. Catal. 2019. Vol. 371. P. 255. doi
Kwon E., Uwai K., Tokiwa M., Takeshita M., Nakano H. //
10.1016/j.jcat.2019.01.041
Eur. J. Org. Chem. 2017. P. 1638. doi 10.1002/
30.
Yang K., Ma Z., Tong H.-X., Sun X.-Q., Hu X.-Y.,
ejoc.201700138
Li Z.-Y. // Chinese Chem. Lett. 2020. Vol. 31. P. 3259.
49.
Izquierdo J., Demurget N., Landa A., Brinck T.,
doi 10.1016/j.cclet.2020.02.057
Mercero J.M., Diner P., Oiarbide M., Palomo C. //
31.
Echave H., Bastida I., Lopez R., Palomo C. // Chem. Eur.
Chem. Eur. J. 2019. Vol. 25. P. 12431. doi 10.1002/
J. 2018. Vol. 24. P. 11554. doi 10.1002/chem.201802550
chem.201902817
32.
Bae H. Y., Kim M. J., Sim J. H., Song C. E. // Angew.
50.
Banik S. M., Levina A., Hyde A.M., Jacobsen E.N. //
Chem. Int. Ed. 2016. Vol. 55. P. 10825. doi 10.1002/
Science. 2017. Vol. 358. P. 761. doi 10.1126/science.
anie.201605167
aao5894
33.
Isibol D., Karahan S., Tanyeli C. // Tetrahedron Lett.
51.
Song Y.-X., Du D.-M. // Adv. Synth. Catal. 2019. Vol. 361.
2018. Vol. 59. P. 541. doi 10.1016/j.tetlet.2017.12.081
P. 5042. doi 10.1002/adsc.201900901
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
392
ПОПОВА и др.
52. Alegre-Requena J.V., Marques-Lopez E., Herrera R.P. //
57. Liu M., Zhao P., Gu Y., Ping R., Gao J., Liu F. // J.
Adv. Synth. Catal. 2016. Vol. 358. P. 1801. doi 10.1002/
CO2 Utilization. 2020. Vol. 37. P. 39. doi 10.1016/j.
adsc.201600046
jcou.2019.11.028
53. Susam D., Tanyeli C. // New J. Chem. 2017. Vol. 41.
P. 3555. doi 10.1039/C6NJ04078K
58. Song Y.-X., Du D.-M. // Org. Biomol. Chem. 2019.
54. Ren X.-R., Lin J.-B., Hu X.-Q., Xu P.-F. // Org. Chem.
Vol. 17. P. 5375. doi 10.1039/c9ob00998a
Front. 2019. Vol. 6. P. 2280. doi 10.1039/c9qo00357f
59. Chu M., Qi S., Wang Y., Wang B., Jiang Z., Xu D.,
55. Ni Q., Wang X., Xu F., Chen X. Y., Song X. //
Chem. Commun. 2020. Vol. 56. P. 3155. doi 10.1039/
Xu Z.Y. // Org. Chem. Front. 2019. Vol. 6. P. 1977. doi
D0CC00736F
10.1039/C9QO00332K
56. Su J., Ma Z., Li X., Lin L., Shen Z., Yang P., Li Y.,
60. Wang X., Sun B., Zhang J., Chen J., Fan W., Yu J., Hu J. //
Wang H., Yan W., Wang K., Wanga R. // Adv.
Org. Chem. Front. 2019. Vol. 6. P. 1842. doi 10.1039/
Synth. Catal. 2016. Vol. 358. P. 3777. doi 10.1002/
adsc.201600688
C8QO01391H
Squaramide-Based Catalysts in Organic Synthesis (A Review)
E. A. Popovaa-c, Yu. A. Proninaa, A. V. Davtiana, G. D. Nepochatyia, M. L. Petrova,
V. M. Boitsovd,e, and A. V. Stepakova,f,*
a St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
b St. Petersburg State Chemical and Pharmaceutical University, St. Petersburg, 197376 Russia
c Institute of Macromolecular Compounds of the Russian Academy of Sciences, St. Petersburg, 199004 Russia
d Alferov St. Petersburg National Research Academic University of the Russian Academy of Sciences,
St. Petersburg, 194021 Russia
e Pavlov First St. Petersburg State Medical University, St. Petersburg, 197022 Russia
f St. Petersburg State University, St. Petersburg, 198504 Russia
*e-mail: alstep@yandex.ru
Received February 3, 2021; revised February 16, 2022; accepted February 18, 2022
The review considers works published over the past 5 years on the synthesis, modifications, and application of
chiral catalysts based on squaramides in organic synthesis. The review material is presented by types of reactions
catalyzed by squaramide organocatalysts: Michael, Mannich, Pictet-Spengler, Friedel-Crafts, Henry reactions,
aldol condensation, cycloaddition. For each reaction, a mechanism is considered that demonstrates the catalytic
effect of squaramide organocatalysts.
Keywords: organic synthesis, chiral squaramides, enantioselective organocatalysis, Mannich reaction, Friedel-
Crafts reaction, Henry reaction, Pictet-Spengler reaction, cycloaddition reactions
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022