ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 3, с. 443-469
УДК 546.271
МОЛЕКУЛЫ РАСТВОРИТЕЛЕЙ - ЛИГАНДЫ В
КООРДИНАЦИОННЫХ СОЕДИНЕНИЯХ МЕТАЛЛОВ
С КЛАСТЕРНЫМИ АНИОНАМИ БОРА И ИХ
ПРОИЗВОДНЫМИ (ОБЗОР)
© 2022 г. В. В. Авдеева*, С. Е. Короленко, Е. А. Малинина, Н. Т. Кузнецов
Институт общей и неорганической химии имени Н. С. Курнакова Российской академии наук, Ленинский пр. 31,
Москва, 119991 Россия
*e-mail: avdeeva.varvara@mail.ru
Поступило в Редакцию 31 октября 2021 г.
После доработки 24 января 2022 г.
Принято к печати 28 января 2022 г.
В настоящей работе обобщены литературные данные по синтезу и строению координационных сое-
динений щелочных, щелочно-земельных металлов, ряда переходных металлов M(I), M(II) и редкозе-
мельных элементов с молекулами растворителей и кластерными анионами бора и их производными
в качестве лигандов. Проведена классификация обсуждаемой группы соединений в учетом природы
координирующихся молекул растворителей, положения кластерных анионов бора и их производных
во внутренней координационной сфере металла или их внешнесферном положении. Показано, что в
присутствии металлов мягких кислот по Пирсону [медь(I), серебро(II), свинец(II)] кластерные анионы
бора и их производные наряду с молекулами растворителей координируются атомами металлов за счет
трехцентровых двухэлектронных связей, формируя координационные полиэдры. Для неклассических
металлов-комплексообразователей в ходе термической обработки аквакомплексов или комплексов с
молекулами спиртов в качестве лигандов L [ML6][BnHn] (M = Ca, Mg, Co, Ni) обнаружена возможность
формирования смешанно-лигандных комплексов за счет достраивания координационного полиэдра
металла ВН-группами борного кластера.
Ключевые слова: координационные соединения, щелочные, щелочно-земельные металлы, металлы
M(II), металлы d10, редкоземельные элементы, молекулы растворителей, кластерные анионы бора и их
производные
DOI: 10.31857/S0044460X22030076
1. Введение
444
2. Комплексные соединения металлов общей формулы [M(Solv)m][ВnНn]
444
3. Смешанно-лигандные комплексы металлов с молекулами
458
растворителей и кластерными анионами бора и их производными в качестве лигандов
4. Заключение
465
443
444
АВДЕЕВА и др.
1. ВВЕДЕНИЕ
стью, равной числу атомов бора в полиэдре. Кроме
того, в комплексах на основе кластерных анионов
Кластерные анионы бора [BnHn]2- (n = 6-12)
бора и их производных может реализовываться
составляют самостоятельный раздел в химии бора
специфическая позиционная изомерия, обуслов-
и представляют новый и необычный тип анио-
ленная различным положением атомов металла
нов-лигандов в координационных соединениях
вокруг объемного борного кластера [22-27].
переходных и непереходных металлов [1-5]. Дол-
Новый класс полидентатных лигандов форми-
гое время химия соединений на основе кластер-
руют замещенные производные кластерных ани-
ных анионов бора [BnHn]2- была направлена на
онов бора; для них также свойственно образова-
получение различных органических производных,
ние многоцентровых взаимодействий M-[BnHn]2-,
образующихся в ходе реакции замещения экзо-
вторичных взаимодействий В-Н···H-Х (Х = N, O,
полиэдрических связей B-H с сохранением борно-
С) или В-Cl···Х с атомами С, N, O органических
го остова. Необычность кластерных анионов бора
молекул (лигандов, растворителей) или органиче-
как лигандов заключается в том, что они содержат
ских катионов [28-34].
трехцентровые двухэлектронные связи и обладают
Несмотря на достаточно большое число опу-
трехмерной ароматичностью [6, 7], в то время как
бликованных обзоров, посвященных кластерным
классические лиганды имеют в своем составе ато-
анионам бора, исследователями практически не
мы, способные к донированию электронной пары
рассматриваются комплексные соединения, в ко-
для связи с центральным атомом. Наличие дело-
торых в качестве лигандов выступают молекулы
кализованной электронной плотности отличает
растворителей. Между тем, эта группа соедине-
этот класс лигандов и от лигандов, содержащих
ний является достаточно обширной и сведения о
π-электронные системы (бензол, циклопентадие-
методах получения таких комплексов, их термоди-
нил и др.). Высокая кинетическая и термическая
намической устойчивости могут быть востребо-
устойчивость кластерных анионов бора в рас-
ваны при проведения реакций взаимозамещения
творах и твердом состоянии, а также уникальная
лигандов в растворах и твердой фазе, а также при
возможность варьирования размера, заряда анио-
установлении механизмов процессов комплексо-
нов, геометрических параметров, недоступная для
образования.
других анионов-лигандов обусловливает широкие
перспективы их использования в дизайне коорди-
В ходе анализа литературных данных нами про-
национных соединений, в том числе за счет функ-
ведена классификация этой группы соединений в
ционализации кластерных анионов бора различ-
учетом природы координирующихся молекул рас-
ными функциональными группами [8-16].
творителей, положения кластерных анионов бора
и их производных во внутренней или внешней ко-
Природа металла-комплексообразователя, как
ординационной сфере металла.
и природа кластерных анионов бора существенно
влияют не только на процессы комплексообразо-
2. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
вания, но и на характер связывания (M-[BnHn]2-)
МЕТАЛЛОВ ОБЩЕЙ ФОРМУЛЫ
и строение образующихся комплексов [17-21].
[M(Solv)m][ВnНn]
Кластерные анионы бора представляют собой объ-
емные многогранники, каркас которых состоит из
Кластерные анионы бора и их производные в
атомов бора, в котором каждый атом бора связан
силу своего строения легко стабилизируют форми-
с экзо-полиэдрическим атомом водорода. Во взаи-
рующиеся в реакциях комплексообразования ком-
модействие с металлом могут быть вовлечены вер-
плексные катионы, выступая в качестве объемных
шины, ребра или грани борного полиэдра, а также
противоионов. Долгое время соединения состава
могут реализовываться комбинированные спосо-
(Cat)2[ВnНn] (n = 6, 10, 12), где Cat - катионы ме-
бы координации; следовательно, с точки зрения
таллов или ониевые катионы, были первыми при-
координационной емкости кластерные анионы
мерами стабильных соединений с кластерными
бора можно рассматривать как полидентатные ли-
анионами бора. В работах, датированных первой
ганды с потенциальной максимальной дентатно-
половиной XX века, при отсутствии прецессион-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
445
ных методов физико-химического анализа многие
ют о ступенчатой дегидратации последних, что
соединения (Cat)2[ВnНn] трактовались как простые
обусловлено существованием двух типов моле-
соли, в которых присутствуют только кулоновские
кул воды, а именно, координированных атомами
взаимодействия. Анализ литературных данных,
металлов и внешнесферных (сольватированных),
проведенный в данном обзоре, а также результаты
при этом анион [B10H10]2- во всех случаях явля-
исследований в области координационной химии,
ется противоионом. Таким образом, обсуждае-
полученные в последние годы, позволяют взгля-
мым соединениям больше соответствует формула
нуть на строение многих соединений с других по-
[M(H2O)m]2[B10H10]∙nH2O.
зиций, в первую очередь, это касается неклассиче-
Синтез и физико-химические свойства аква-
ских металлов-комплексообразователей, таких как
комплекса уранила описаны в работе [38]. При-
щелочные и щелочноземельные металлы.
писывая соединению формулу UO2[B10H10]∙7H2O,
авторы предполагают, что внутреннюю коорди-
2.1. Молекулы воды в качестве лигандов
национную сферу уранила заполняют молекулы
воды, при этом анионы [B10H10]2- не взаимодей-
2.1.1. Аквакомплексы металлов с кластерными
ствуют с уранилом и находятся во внешней сфе-
анионами бора в качестве противоионов
ре. Очевидно, что речь идет о соединении состава
[UO2(H2O)m][B10H10]∙nH2O.
Данные по аквакомплексам, в состав которых в
качестве противоиона входит низший в ряду поли-
В литературе широко представлены аква-
эдрических анионов бора и наиболее реакционно-
комплексы с классическими металлами-ком-
способный гексагидро-клозо-гексаборатный ани-
плексообразователями и кластерными аниона-
он [В6Н6]2- немногочисленны. Так, в работах [35,
ми бора. Авторами [39] получены и структурно
36] рассмотрены синтез и термическая стабиль-
охарактеризованы гексааквакомплексы метал-
ность солей щелочных металлов общей формулы
лов М(II) (Fe, Co, Ni, Zn, Mn) общей формулы
M2[В6Н6]∙nH2O (M = Li, Na; n = 7, 2). На основании
[M(H2O)6][B10H10]·2H2O. Стоит отметить, что ме-
данных ИК спектроскопии авторы заключают, что
тодики получения данных соединений различны
при нагревании Li2[В6Н6]∙7H2O удаление послед-
и зависят от природы металла-комплексообразо-
них молекул воды происходит с одновременным
вателя. Комплексы железа(II), кобальта(II) и ни-
разложением соединения. При термолизе натри-
келя(II) получены при взаимодействии водного
евой соли Na2[В6Н6]∙2H2O соединение теряет ко-
раствора (H3O)2[B10H10] с металлом М(II), в слу-
ординированные молекулы воды и образует без-
чае цинка(II) - при взаимодействии (H3O)2[B10H10]
водную соль Na2[В6Н6], отличающуюся высокой
с основным карбонатом
[Zn(CO3)]2·[Zn(OH)2]3.
термической устойчивостью. В работе [36] при-
Комплекс марганца(II) получен при взаимодей-
ведены данные рентгеноструктурных исследова-
ствии клозо-декабората бария с сульфатом Mn.
ний, выполненные для безводных гексагидро-кло-
Согласно данным рентгеноструктурного
зо-гексаборатов калия и цезия M2[В6Н6] (M = K,
анализа, полученные соединения изоструктур-
Cs). Анализируя результаты термического анализа
ны. Кристаллическая структура комплексов
соединений очевидно, что в случае лития(I) обра-
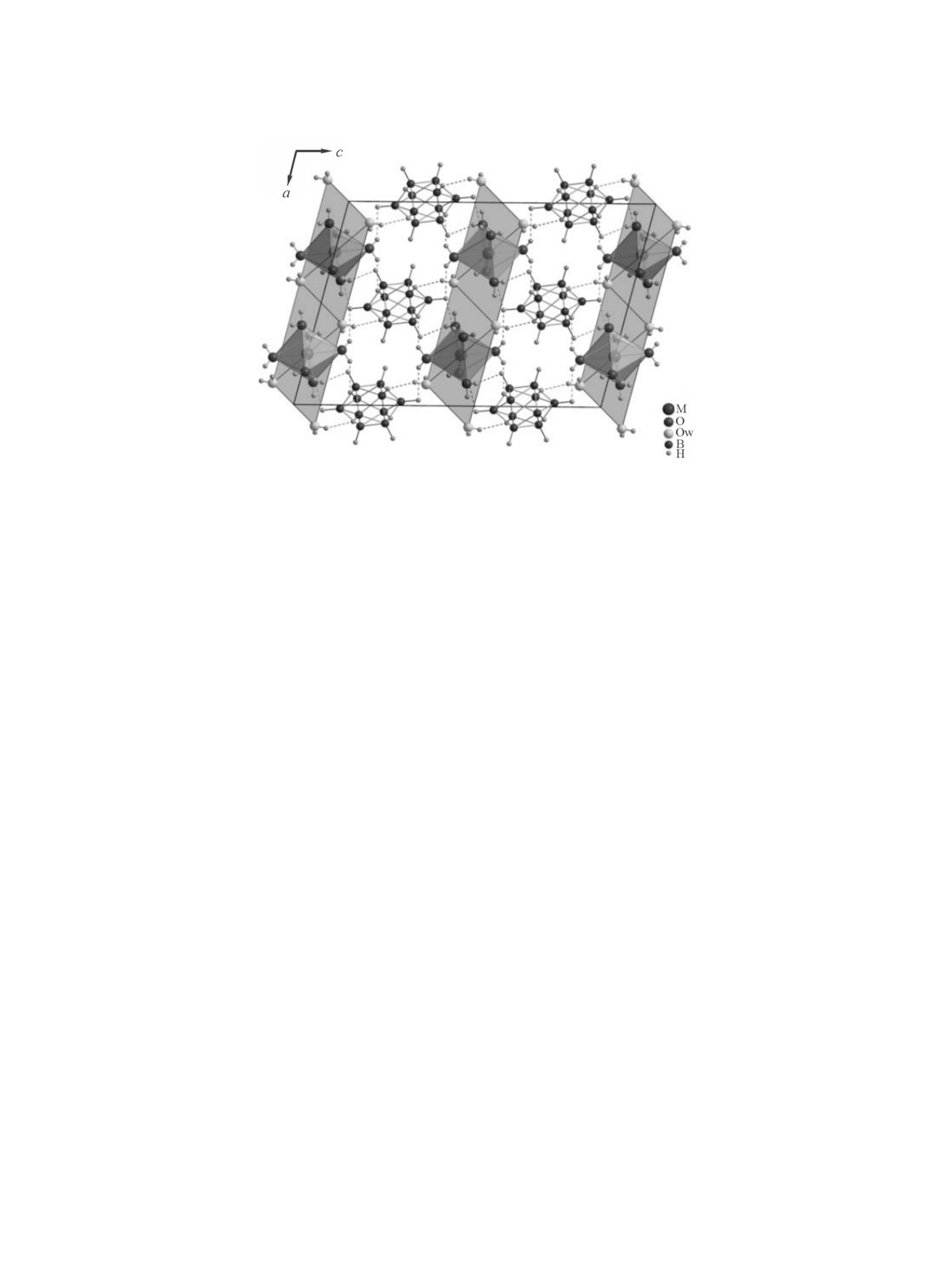
[M(H2O)6][B10H10]·2H2O (M = Fe, Co, Ni, Zn, Mn)
зуется аквакомплекс состава [Li(H2O)7]2[В6Н6], в
содержит катионы металла(II), которые коорди-
то время как для натрия(I) соединение представля-
нируют шесть молекул воды атомами кислорода,
ет собой кристаллогидрат Na2[В6Н6]∙2H2O.
образуя искаженные октаэдры, которые в свою
Аналогичная картина складывается и при ана-
очередь связаны друг с другом общими ребрами и
лизе многочисленных данных по солям щелочных
образуют слой, содержащий катионы [M(H2O)6]+
и щелочноземельных металлов, редкоземельных
и молекулы воды (рис. 1). клозо-Декаборатные
элементов и урана с декагидро-клозо-декаборат-
анионы [B10H10]2- находятся во внешней коорди-
ным анионом. Так, авторами [37] изучены соеди-
национной сфере и расположены между данными
нения щелочных и щелочноземельных металлов
слоями. Стоит отметить, что в структуре данных
общей формулы M2[B10H10]∙nH2O. Исследования
соединений присутствуют межмолекулярные вза-
термических свойств соединений свидетельству-
имодействия В-Н···Н-О между атомами водорода
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
446
АВДЕЕВА и др.
Рис. 1. Фрагмент ячейки изоструктурных комплексов [M(H2O)6][B10H10]·2H2O (M = Mn, Fe, Co, Ni, Zn).
кластерных анионов бора и атомами водорода мо-
цепи и не входит во внутреннюю координацион-
лекул воды.
ную сферу металла.
Наибольшее количество аквакомплексов, в ко-
Аналогичный комплекс стронция(II) с кло-
торых клозо-бороводородный анион выступает
зо-додекаборатным анионом
[Sr(H2O)7][B12H12]
в качестве внешнесферного лиганда, получено и
описан авторами [45]. Методом рентгенострук-
изучено для додекагидро-клозо-додекаборатного
турного анализа установлено, что шесть молекул
аниона [B12H12]2- и его производных. В работах
воды комплексного катиона образуют искаженный
[40-44] описан синтез, физико-химические свой-
октаэдр вокруг металла-комплексообразователя,
ства и строение аквакомплексов щелочных и ще-
а седьмая молекула воды располагается в центре
лочноземельных металлов с анионом [B12H12]2-.
треугольной грани октаэдра (рис. 2б). Авторы от-
Установлено, что катионы металлов гидратируют-
мечают, что треугольная грань борного остова,
ся большим количеством молекул воды, образуя
расположенная вблизи седьмой молекулы воды
аквакомплексы.
комплексного катиона, имеет самые короткие рас-
Кристаллическая
решетка
тетрагидрата
стояния B-B, а противоположная ей грань - самые
додекагидро-клозо-додекабората
натрия
со-
длинные.
стоит из тетраэдров
[Na(H2O)4]+ и октаэдров
Гексааквакомплексы алюминия(III) и ба-
[Na(H2O)4[B12H12]2]3-, причем два кластерных
рия(II) описаны в работах [46, 47]. Комплекс
аниона входят в октаэдр в цис-положении [42]. В
[Al(H2O)6]2[B12H12]3·12H2O [46] состоит из катио-
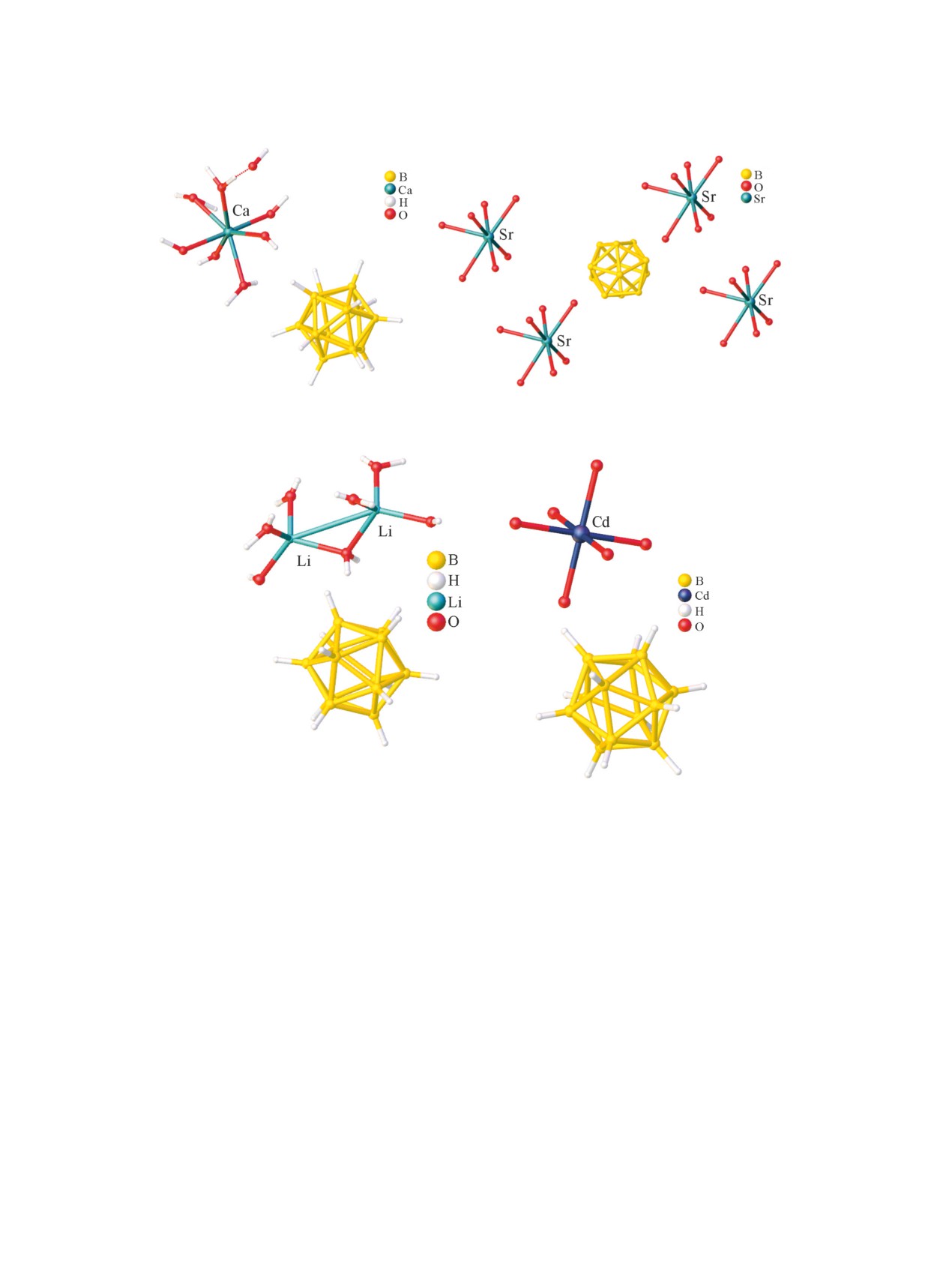
работе [43] получен и охарактеризован пентааква-
нов [Al(H2O)6]3+, имеющих октаэдрическое строе-
комплекс лития [Li2(H2O)5][B12H12].
ние, и клозо-додекаборатных анионов, выполняю-
Авторами [44] установлено, что катионы геп-
щих роль противоинов. Авторы [47] полагают, что
тааквакомплекса [Ca(H2O)7][В12Н12]∙H2O состоят
в комплексе [Ba(H2O)6][B12H12] кластерный анион
из семи молекул воды, координированных атомом
бора занимает промежуточное положение между
кальция(II), и представляют собой искаженную
противоионом и координированным лигандом,
пентагональную пирамиду (рис. 2а). Восьмая мо-
при этом геометрия аниона [B12H12]2- искажена.
лекула воды водородными связями связывает кати-
Авторы отмечают, что шесть молекул воды, коор-
оны [Ca(H2O)7]2+ в бесконечные зигзагообразные
динированные атомом металла, образуют гидрат-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
447
(а)
(б)
Рис. 2. Кристаллическая структура [Ca(H2O)7][В12Н12]∙H2O (а) и [Sr(H2O)7][B12H12] (б) (атомы водорода не показаны).
(а)
(б)
Рис. 3. Строение соединений [Li2(H2O)7][B12H12] (а) и [Cd(H2O)6][B12H12]∙6H2O (б) (атомы водорода молекул воды не
показаны).
ную оболочку, закрывающую только часть иона
ской решетки осуществляется за счет специфиче-
бария, а с другой стороны металл приближен к
ских взаимодействий В-Н···Н-О.
клозо-бороводородному аниону. Однако говорить
Методом РСА установлено, что комплекс ли-
о координации аниона [B12H12]2- нецелесообразно,
тия [Li2(H2O)7][B12H12] [48] образован катионами
так как расстояние между атомом бария и борово-
[Li2(H2O)7]2+, которые состоят из двух изолиро-
дородным остовом слишком велико (3.5 Å).
ванных тетраэдров [Li(H2O)4]+, связанных в димер
В более поздних работах проведено детальное
общей молекулой воды, и кластерных анионов
исследование строения аквакомплексов лития, маг-
бора (рис. 3а). В гексааквакомплексах кадмия(II)
ния(II) и кадмия(II) с клозо-додекаборатным анио-
(рис. 3б) [49] и магния(II) [50] координационное
ном состава [Li2(H2O)7][B12H12] [48], [Cd(H2O)6]·
окружение атомов металлов образовано шестью
[B12H12] [49] и [Mg(H2O)6][B12H12]∙6H2O [50]. Во
атомами воды, а клозо-додекаборатные анионы на-
всех трех соединениях стабилизация кристалличе-
ходятся во внешней координационной сфере.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
448
АВДЕЕВА и др.
(а)
(б)
Рис. 4. Строение [Ni(H2O)6][B12H12]∙6H2O: вид ячейки кристалла (а) и система вторичных взаимодействий В-Н···Н-О
вокруг катиона [Ni(H2O)6]2+ (б).
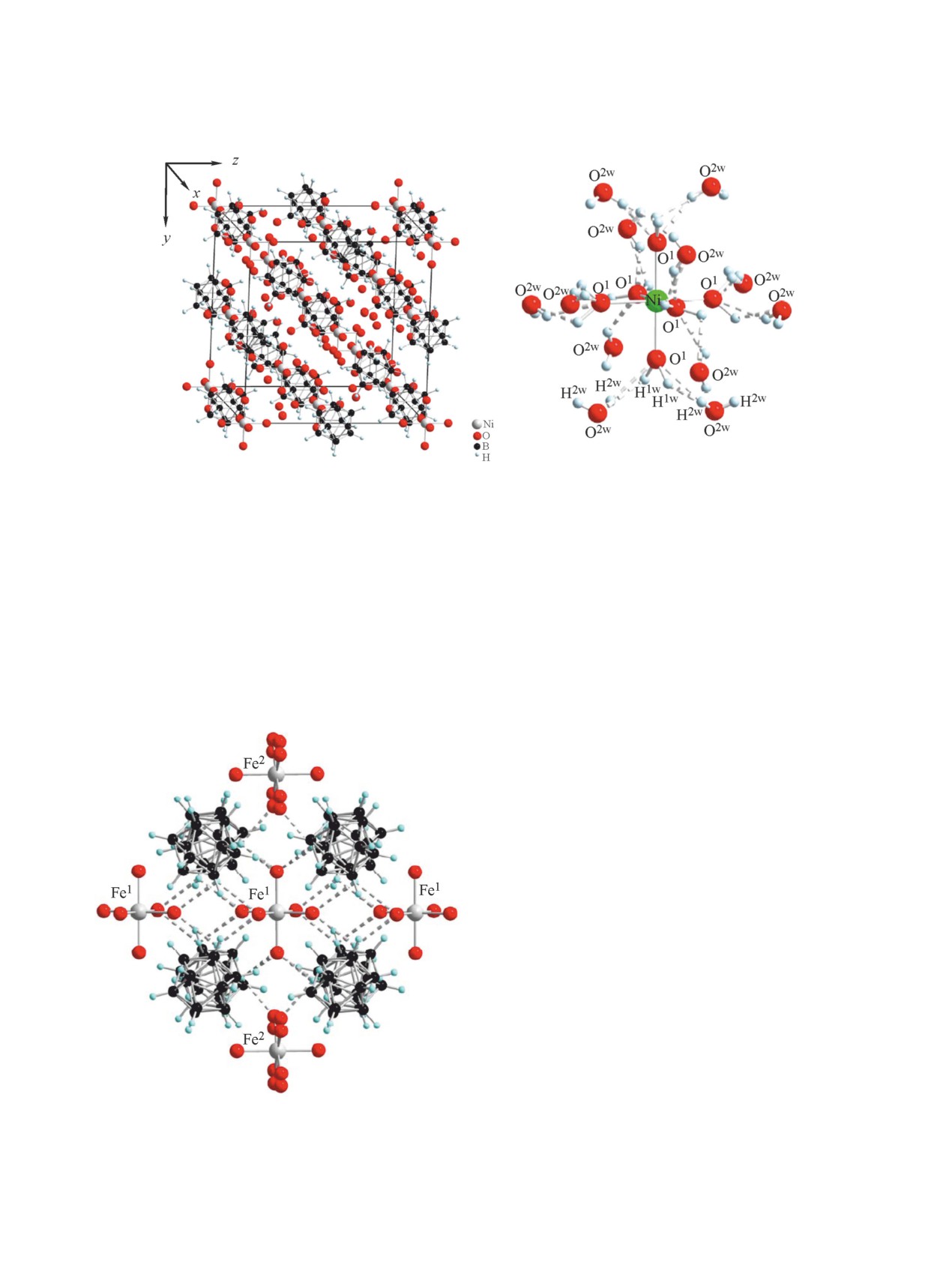
Аналогичное строение имеет гексаакваком-
действия В-Н···Н-О между атомами водорода
плекс никеля (II) [Ni(H2O)6][B12H12]∙6H2O [51]
ВН-групп клозо-додекаборатного аниона и ато-
(рис. 4а), который получен нейтрализацией кис-
мами водорода ОН-групп координированных и
лоты (H3O)2[B12H12] гидроксидом никеля(II). В
сольватных молекул воды (рис. 4б).
данном соединении также наблюдаются взаимо-
В гексааквакомплексе железа(II) [Fe(H2O)6]·
[B12H12] [52] присутствуют два кристаллографи-
чески неэквивалентных атома железа(II), коор-
динационное окружение которых построено ше-
стью атомами кислорода молекул воды. При этом
каждый гидратированный атом железа находится
в кубическом окружении, образованном восемью
анионами
[B12H12]2-. Стабилизация структуры
происходит за счет образования специфических
взаимодействий В-Н···Н-О между молекулами
воды аквакатиона и ВН-группами клозо-додекабо-
ратного аниона (рис. 5).
Учитывая тот факт, что получение акваком-
плексов наблюдается как правило в кислых сре-
дах, в присутствии ионов гидроксония, среди ак-
вакомплексов встречаются смешаннокатионные
соединения. Смешаннокатионные клозо-додека-
бораты с катионом оксония и гексааквакомплекса-
ми металлов [M(H2O)6](H3O)2[B12H12]2∙6H2O (M =
Mn, Fe, Co, Ni, Cu, Zn, Cd) описаны в работе [52].
Комплексы получены при нейтрализации кисло-
ты (H3O)2[B12H12] карбонатами или гидроксидами
Рис. 5. Взаимодействия В-Н···Н-О в структуре
металлов M(II). Согласно данным рентгенострук-
[Fe(H2O)6][B12H12].
турного анализа, соединения изоструктурны и по-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
449
(а)
(б)
Рис. 6. Строение [M(H2O)6](H3O)2[B12H12]2∙6H2O (M = Mn, Fe, Co, Ni, Cu, Zn, Cd): (а) вид ячейки кристалла; (б) система
В-Н···Н-О связей в структурах.
строены из октаэдрических катионов металлов(II)
соответственно, формула соединения должна быть
[M(H2O)6]2+ и кластерных анионов бора, которые
записана как [UO2(H2O)5][B12H12]·6H2O. Предпо-
образуют внешнюю координационную сферу
лагается, что большой разброс в значениях длин
(рис. 6). В данных структурах наблюдаются водо-
связей и валентных углов как в координационном
родные связи О-Н···Н между атомами водорода
полиэдре урана, так и в икосаэдре [B12H12]2- сви-
координированных и сольватных молекул воды, а
детельствует о разветвленной системе водородных
также специфические взаимодействия В-Н…Н-О
связей, присутствующих в данном соединении.
между атомами водорода ВН-групп клозо-додека-
В работе [55] описан синтез и строение ряда
боратного аниона, атомами водорода оксониевых
аквакомплексов редкоземельных металлов общей
катионов Н3О+ и некоординированными молекула-
формулы M2[B12H12]3·nH2O, где М = Er, Tm, Yb,
ми воды.
Lu (n = 15); Sc, Y, Nd, Sm, Eu, Gd, Tb, Dy, Ho (n =
Авторы
[53,
54] синтезировали комплексы
18); La, Ce (n = 20); Pr (n = 21). Авторы предполага-
урана(IV) и уранила UO2 с анионами [В10Н10]2- и
ют, что непосредственное взаимодействие редко-
[B12H12]2-. Установлено, что аквакомплексы ура-
земельный металл-анион [B12H12]2- отсутствует, и
нила содержат по одиннадцать молекул воды. Ис-
связь носит преимущественно ионный характер.
следование их физико-химических свойств ука-
Кроме того, описан синтез и строение еще
зывает на ионный характер связи комплексного
целого ряда аквакомплексов
[Bi(H2O)2(OH)·
аквакатиона и бороводородного аниона, что под-
[B12H12], [M(H2O)6]2[B12H12]3∙15H2O (M = Cr3+,
тверждается данными РСА [53]. В структуре со-
In3+),
[Cr(H2O)6](H5O2)[B12H12]2∙6H2O,
единения с брутто-формулой UO2[B12H12]·11H2O
[La(H2O)9]2[B12H12]3∙7H2O, и [M(H2O)9]2[B12H12]3∙
уранил окружен пятью атомами кислорода моле-
15H2O (M = Pr3+, Ho3+) [52], а также акваком-
кул воды. Основными структурными единицами
плексов меди(II)
[Cu(H2O)5.5][B12H12]∙2.5H2O
соединения являются катион [UO2(H2O)5]2+, анион
и цинка(II) [Zn(H2O)6][B12H12]∙6H2O [56], в ко-
[B12H12]2- и некоординированные молекулы воды,
торых окружение металлов образовано моле-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
450
АВДЕЕВА и др.
(а)
(б)
(в)
(г)
Рис. 7. Строение аквакомплексов кальция: [Ca(H2O)6][B10H10] (а), молекулярный комплекс {[Ca(H2O)5][B10H10]} (б), цепо-
чечный полимер {[Ca(H2O)4][B10H10]}n (в) и трехмерный полимер {[Ca(H2O)][B10H10]}n (г). Атомы водорода молекул воды
не показаны.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
451
Рис. 8. Общий вид структуры [Pb(H2O)3][B12H12]∙3H2O вдоль оси [001].
кулами воды, при этом клозо-додекаборатные
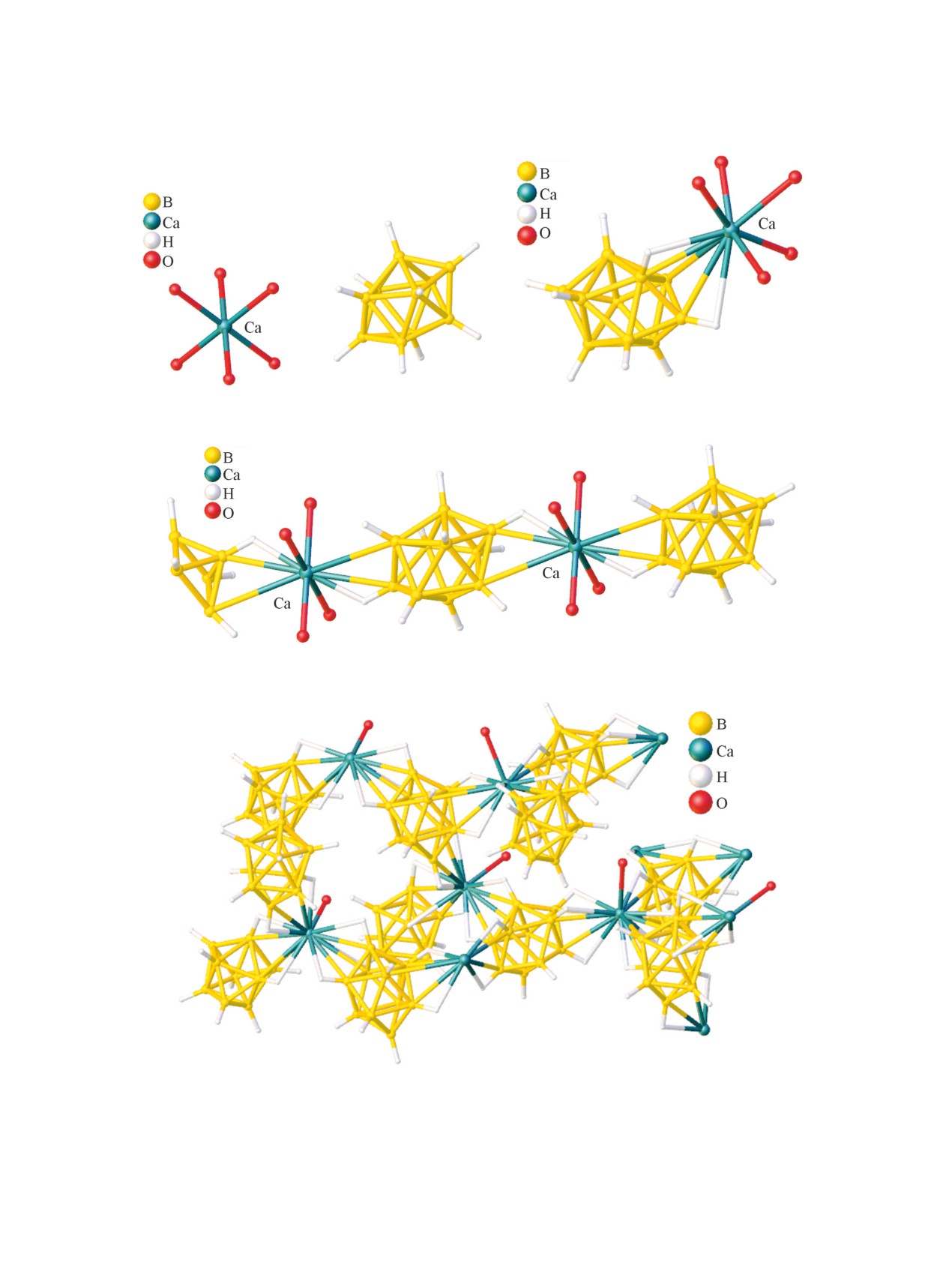
[B10H10]}n (рис. 7) (Ca-B 2.827-2.935 Å, Ca-H
анионы участвуют в специфических взаимодей-
2.331-2.695 Å) (трехмерный каркас). Данный вид
ствиях В-Н···Н-О. Интересно, что соединение
комплексных соединений, содержащих кластер-
[Cu(H2O)5.5][B12H12]∙2.5H2O построено из биядер-
ные анионы бора во внутренней координационной
ных аквакомплексов меди [Cu2(H2O)11]4+ и кла-
сфере, нехарактерен для соединений кальция(II).
стерных анионов бора [56], а между элементами
В комплексе свинца(II) {[Pb(H2O)3][B12H12]}∙
структуры обнаружены классические водородные
3H2O [52, 58] (рис. 8) атомы свинца(II) координи-
связи и специфические связи между ВН-группами
руют три молекулы воды и три клозо-додекаборат-
борного кластера и ОН-группами молекул воды.
ных аниона, при этом расстояния Pb-H составля-
Формулу соединения следует записывать как
ют 2.50-2.68 Å.
[Cu2(H2O)11][B12H12]2∙5H2O.
В работе [59] методом твердофазного син-
теза при взаимодействии Na2[B12H12] и хлори-
2.1.2. Аквакомплексы металлов с кластерными
дов металлов MCl2 (M = Ti, Cr, Mn, Fe, Co, Cu,
анионами бора в качестве лигандов
Zn, Mg) или CuCl получены аквакомплексы пе-
В работе [57] синтезированы и охарактеризова-
реходных
3d-металлов и магния(II). Методом
ны методом РСА пять стехиометрических гидра-
РСА определена структура ряда аквакомплексов
тов Ca[B10H10]·xH2O, где x = 1, 4, 5, 6 и 7. В струк-
[M(H2O)6][B12H12]. Установлено, что строение со-
турах аквакомплексов с числом молекул воды 6 и
единений коррелирует с вышеописанными дан-
7 наблюдается образование катионного комплекса
ными. Нагревание октаэдрических аквакомплек-
[Ca(H2O)]2+ с анионом [B10H10]2- во внешней сфе-
сов в вакууме привело к получению комплексов
ре ([Ca(H2O)6][B10H10] и [Ca(H2O)6][B10H10]·H2O
{[M(H2O)4][B12H12]}, ряд соединений охаракте-
соответственно). Снижение содержания воды до
ризован методом РСА (M = Mn, Fe, Co). Интерес-
5 молекул приводит к образованию молекуляр-
но, что в полученных соединениях наблюдается
ных комплексов {[Ca(H2O)5][B10H10]}, в которых
координация икосаэдрического борного кластера
координационная сфера кальция достраивается
атомом металла, аналогично обнаруженной в ак-
ВН-группой борного кластера. Расстояния Ca-B
вакомплексах кальция с клозо-декаборатным ани-
составляют 2.911-3.062 Å, а связи Ca-H - 2.492-
оном. Данный факт объясняется снижением ко-
2.783 Å. Дальнейшее снижение содержания мо-
ординационного числа металла до КЧ 4 за счет
лекул воды приводит к образованию полимерных
удаления молекул воды и достраиванием коорди-
комплексов
{[Ca(H2O)4][B10H10]}n (Ca-B
2.709,
национной сферы металла до КЧ 6 ВН-группами
3.242 Å, Ca-H 1.982 Å) (1D-полимер) и {[Ca(H2O)]·
присутствующего в соединении икосаэдра (рис. 9).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
452
АВДЕЕВА и др.
(а)
(б)
Рис. 9. Фрагмент структуры аквакомплексов [Co(H2O)4][B12H12] (а), [Mn(H2O)4][B12H12] (б).
Получение комплексов с координированными кла-
химического анализа, включающих ИК спектро-
стерными анионами для катионов кальция(II), ко-
скопию, элементный анализ и термогравиметрию.
бальта(II) и магния(II) нехарактерно.
Авторами показана возможность использования
в качестве пре-
комплекса [Eu(H2O)9]2[B10Cl10]3
2.1.3. Аквакомплексы металлов
курсора в твердофазных реакциях, сопровожда-
с пергалогенированными производными
ющихся гидролизом и приводящих к получению
кластерных анионов бора
солей общей формулы (НL)2[B10Cl10] с прото-
нированными органическими лигандами L [L =
Ряд изученных и представленных в литературе
7-амино-4-метилкумарин или 1-этил-2-(4-меток-
аквакомплексов металлов с пергалогенированны-
сифенил)азобензимидазол] в качестве катионов.
ми производными кластерных анионов бора не
Для пергалогенированных производных кло-
столь разнообразен.
зо-додекаборатного аниона методом РСА опреде-
В работах [60-63] получены и идентифициро-
лено строение аквакомплекса никеля(II) с перхло-
ваны аквакомплексы меди(II), европия(III) и ура-
рированным производным состава
[Ni(H2O)6]·
нила с декахлор-клозо-декаборатным анионом со-
[B12Cl12]·6H2O, который был получен при нейтра-
става [Cu(H2O)4][B10Cl10]·5H2O [60], [Cu(H2O)6]·
лизации кислоты (H3O)2[B10Cl10] карбонатом ни-
[B10Cl10]·4H2O
[61],
[UO2(H2O)6][B10Cl10]
[62]
келя [64]. Авторами установлено, что нагревание
[Eu(H2O)9]2[B10Cl10]3
[63]. Комплексы образу-
соединения выше 30°С приводит к потере кри-
ются в ходе реакций нейтрализации при взаимо-
сталлизационных молекул воды и образованию
действии соответствующих карбонатов или окси-
комплекса [Ni(H2O)6][B12Cl12] (рис. 10).
дов с кислотой [(H3O)2][B10Cl10]. Методом РСА
Строение аквакомплексов щелочноземель-
установлено строение комплексов. Так, комплекс
ных металлов [M(H2O)7][B12F12] (M = Ca, Sr),
[Cu(H2O)6][B10Cl10]·4H2O [61] построен из октаэ-
[Ba(H2O)4][B12F12], [Ba(H2O)5][B12F12], [Ba(H2O)6]·
дров [Cu(H2O)6]2+, которые связаны сольватными
[B12F12], [Mg(H2O)6][B12F12], а также кобальта(II),
молекулами воды в бесконечные цепи. Между
никеля(II) и цинка(II) [M(H2O)6][B12F12] (M = Co,
цепями расположены кластерные анионы бора. В
Ni, Zn) с додекафтор-клозо-додекаборатным ани-
комплексе [UO2(H2O)6][B10Cl10] [62] внутреннюю
оном описано в работе [65]. Соединения исследо-
координационную сферу уранила формируют мо-
ваны методом РСА и ИК спектроскопии, изучены
лекулы воды, при этом перхлорированные анионы
слабые O-H···F водородные связи между катион-
[В10Cl10]2- выступают в качестве противоионов и
ными комплексами металлов и кластерным анио-
не взаимодействуют с уранильной группой.
ном бора. Комплексы с 6 и 7 молекулами воды по-
Строение аквакомплекса европия(III) состава
строены из катионных аквакомплексов металлов
[Eu(H2O)9]2[B10Cl10]3 установлено в работе [63] и
и кластерных анионов бора; в комплексах бария
базируется на данных косвенных методов физико-
с низким содержанием воды {[Ba(H2O)5][B12F12]n
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
453
(а)
(б)
Рис. 10. Структура комплексов [Ni(H2O)6][B12Cl12]·6H2O (а) и [Ni(H2O)6][B12Cl12] (б).
(а)
(б)
Рис. 11. Фрагмент структур [Ba(H2O)5][B12F12] (а) и [Ba(H2O)4][B12F12] (б).
и {[Ba(H2O)4][B12F12]}n наблюдается координация
В работе [66] изучены процессы механоактива-
кластерного аниона бора атомом металла. Строе-
ции солей Na2[B12H12] и MCl2 (M = Mn, Fe, Co, Ni,
ние аквакомплексов бария с координированными
Mg), в ходе которой при последующем выделение
борными кластерами представлено на рис. 11.
целевых соединений путем добавлением этанола
или метанола и сушкой в динамическом вакууме
2.2. Молекулы спиртов в качестве лигандов
был получен ряд комплексных соединений с моле-
Молекулы органических растворителей в реак-
кулами спиртов в качестве лигандов. Кристалли-
циях комплексообразования в отсутствии конку-
ческие структуры клозо-боратов с комплексными
рентоспособных органических и неорганических
катионами, содержащими координированные мо-
лигандов способны участвовать в формирова-
лекулы растворителей-спиртов, охарактеризованы
нии внутренней координационной сферы атома
совокупностью физикохимических методов ана-
металла. Кроме того, природа растворителей и
лиза, включающих термогравиметрический ана-
возможность образования комплексов состава
лиз, инфракрасную спектроскопию, порошковую
[M(Solv)m][ВnНn] в значительной степени оказыва-
дифракцию на синхротроне и теоретические рас-
ют влияние на механизм реакций комплексообра-
четы ab initio. Комплексы с различным содержа-
зования и строение конечных продуктов реакций.
нием молекул растворителя были получены в ходе
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
454
АВДЕЕВА и др.
(а)
(б)
Рис. 12. Фрагмент кристаллической структуры комплексов [Co(Et3OH)6][B12H12] (а), [Co(Et3OH)3][B12H12] (б).
(а)
(б)
Рис. 13. Фрагмент кристаллической структуры комплексов [Fe(Et3OH)][B12H12] (а), [Mn(Et3OH)2][B12H12] (б).
термического высушивания соединений, которое
2.3. Молекулы диметилформамида
приводит к снижению числа координированных
и диметилсульфоксида в качестве лигандов
молекул спиртов (до четырех, трех), а также к по-
Комплексы кобальта(II) и никеля(II) состава
лучению нейтральных смешанно-лигандных ком-
[M(Solv)6][BnHn] (M = Co, Ni; Solv = DMF, DMSO,
плексов с координированными молекулами спир-
n = 10, 12) образуются при взаимодействии оние-
тов и клозо-додекаборатным анионом (рис. 12б).
вых солей (Cat)2[BnHn] с соответствующими хло-
Снижение молекул растворителя приво-
ридами или нитратами металлов в ДМФА или
ДМСО [67-69]. Соединения охарактеризованы
дит к образованию полимерных комплексов
совокупностью физико-химических методов ана-
{M(Solv)n[B12H12]} (Solv = CH3CN, C2H5OH, n =
лиза, включающих ИК спектроскопию и РСА.
1,
2,
3) (рис.
13). Согласно данным рент-
Авторы отмечают, что в ИК спектрах комплексов
геноструктурного анализа, комплексы, со-
[M(Solv)6][B10H10] (Solv = DMF или DMSO) при-
держащие
шесть
молекул
растворите-
сутствует мультиплетно расщепленная полоса
ля,
построены из катионов
[M(Solv)6]2+
валентных колебаний ВН-связей ν(ВН) в области
(Solv
= MeOH, EtOH) и анионов
[B12H12]2-
2550-2400 см-1, характеризующая наличие спец-
(рис. 12а).
ифических межмолекулярных взаимодействий
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
455
(а)
(б)
Рис. 14. Фрагмент кристаллической структуры [Co(Solv)6][B10H10], Solv = DMF (а), DMSO (б).
(а)
(б)
Рис. 15. Фрагмент кристаллической структуры комплексов [Ni(DMF)6][B10H10] (а) и [Ni(DMSO)6][B10H10] (б).
между BH-группами кластерного аниона бора и
комплексный катион расположен на поворотной
СН-группами координированных молекул раство-
оси второго порядка, в структуре [Ni(DMSO)6]·
рителя.
[B10H10] - в центре симметрии.
Согласно данным РСА
[67], кристаллы
В комплексах [M(Solv)6][An] (M = Co, Ni;
[Co(Solv)6][B10H10] построены из центросимме-
Solv = DMF, DMSO) [67, 68] наблюдаются ме-
тричных комплексных катионов [CoL6]2+ (L =
жмолекулярные взаимодействия BH···HC между
DMF или DMSO) и клозо-декаборатных анионов
атомами водорода клозо-декаборатного аниона и
[В10Н10]2-, которые расположены во внешней ко-
атомами водорода CH-групп координированных
ординационной сфере комплексов (рис. 14).
молекул растворителей, что хорошо согласуется
с данными ИК спектроскопии. В комплексах ко-
По данным РСА, монокристаллы комплексов
бальта(II) реализуется наименьшая длина межмо-
[Ni(Solv)6][B10H10] [68], выделенные из описан-
лекулярных взаимодействий, которая составляет
ных выше реакционных растворов, состоят из
2.27 Å (для [Co(DMF)6][B10H10]) и 2.17, 2.21 Å (для
комплексных катионов [Ni(Solv)6]2+ (L = DMF или
DMSO). Длины связей Ni-O составляют 2.042(1)-
[Co(DMSO)6][B10H10]).
2.070(2) Å в комплексе с диметилформамидом и
Авторами [70, 71] получены и идентифици-
2.048(1)-2.083(1) в комплексе с диметилсульфок-
рованы аналогичные комплексы цинка(II) и кад-
сидом (рис. 15). В структуре [Ni(DMF)6][B10H10]
мия(II) [М(Solv)6][BnHn], где (Solv = DMF, DMSO;
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
456
АВДЕЕВА и др.
(а)
(б)
Рис. 16. Строение комплексов (а) [Cd(DMF)6][B10H10] и (б) [Zn(DMSO)6][B10H10].
(а)
(б)
Рис. 17. Строение комплексов кобальта [Co(DMF)6][B10Cl10] (а) и [Co(DMSO)6][B10Cl10] (б).
n = 10, 12). Комплексы с клозо-декаборатным анио-
структурах [М(Solv)6][B10H10] кластерные анионы
ном получены при взаимодействии алкиламмони-
бора образуют специфические контакты BH···HC
евых солей аниона [B10H10]2- с нитратами соответ-
с атомами водорода метильных групп молекул
ствующих металлов в ДМФА или ДМСО. В случае
ДМФА или ДМСО, длины контактов находятся в
клозо-додекаборатного аниона, по данной мето-
диапазоне 2.23-2.70 Å.
дике получены только комплекс [Cd(DMSO)6]·
В работе [72] описаны синтез и строение ком-
[B12H12]. Комплексы с диметилформамидом
плексов кобальта(II) и никеля(II)
[М(Solv)6]·
[М(DMF)6][B12H12] (M = Zn(II), Cd(II)) образуются
[B10Cl10] (Solv = DMF, DMSO). Авторы отмечают,
при перекристаллизации предварительно синтези-
что в ИК спектрах данных соединений присутству-
рованных гексааквакомплексов [M(H2O)6][B12H12]
ют полосы валентных колебаний, соответствую-
в ДМФА.
щие координированным молекулам растворителя:
Согласно данным РСА, соединения [М(Solv)6]·
для молекул ДМФА ν(СО) 1640 см-1; для молекул
[B10H10] (M = Zn(II), Cd(II); Solv = DMF, DMSO)
ДМСО ν(SO) 1004 см-1. Кристаллы [Co(Solv)6]·
[70,
71] построены из комплексных катионов
[B10Cl10] построены из катионов [Co(Solv)6]2+ и
[M(Solv)6]2+ и анионов [B10H10]2- (рис. 16). В
анионов [B10Cl10]2- (рис. 17). Молекулы диметил-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
457
Рис. 18. Строение комплекса [Ni(DMSO)6][B10Cl10].
(а)
(б)
Рис. 19. Строение комплексов [Co(CH3CN)6][В10Cl10] (а) и [Fe(CH3CN)6][B12Cl12] (б).
формамида в катионном комплексе кобальта(II)
ет использовать комплексы цинка(II) и кадмия(II)
[Co(DMF)6][B10Cl10] разупорядочены, на рисунке
в качестве исходных реагентов для получения но-
представлено одно из их положений. Строение
вых соединений с органическими лигандами, об-
комплекса
[Ni(DMSO)6][B10Cl10] приведено на
ладающих люминесцентными свойствами [74-77].
рис. 18.
2.4. Молекулы ацетонитрила
В комплексе UO2[B10Cl10]·6DMSO авторами
в качестве лигандов
установлено, что координационную сферу ура-
нила заполняют нейтральные молекулы диметил-
Первым комплексом с молекулами ацетонитри-
сульфоксида, а перхлорированное замещенное
ла в качестве внутрисферных лигандов и клозо-
производное располагается во внешней сфере [73].
декаборатным анионом является комплекс нике-
ля(II) [Ni(CH3CN)6][В10Н10] [78], строение которо-
Стоит отметит, что вышеописанные комплексы
го предположено авторами на основании ИК-спек-
металлов общей формулы [M(Solv)m][ВnНn], где
Solv = H2O, DMF, DMSO показали свою эффек-
троскопии и элементного анализа.
тивность в качестве стартовых реагентов в твердо-
Для декахлор-клозо-декаборатного анио-
фазных реакциях взаимозамещения лигандов. Так,
на в работе [72] описан комплекс кобальта(II)
возможность легкой замены молекул растворите-
[Co(CH3CN)6][В10Cl10], полученный при взаимо-
лей на молекулы органических лигандов позволя-
действии триэтиламмониевой соли кластерного
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
458
АВДЕЕВА и др.
(а)
(б)
Рис. 20. Строение биядерных комплексов серебра [Ag2(CH3CN)4][B12F12] (а), [Ag2(CH3CN)5][B12F12] (б).
аниона бора с хлоридом кобальта(II) в ацетонитри-
ди(I) молекулы ацетонитрила могут участвовать в
ле. Методом рентгеноструктурного анализа авто-
качестве лигандов при формировании внутренней
рами установлена структура данного соединения
координационной сфере металла наряду с молеку-
(рис. 19а).
лами неорганических лигандов (анионов [BnHn]2-),
а также дополнять координационное окружение
Аналогичныйкомплексжелеза(II)[Fe(CH3CN)6]·
[B12Cl12] (рис. 19б) [79] получен в качестве по-
металлов в присутствии органических лигандов.
бочного продукта при взаимодействии комплекса
3.1. Биядерные комплексы меди(I)
железа(II)
(2,2,6,6-тетраметилпиперидил)сила[1]
с координированными молекулами
ферроценофана с [CHPh3]2[B12Cl12].
ацетонитрила и кластерными анионами бора
Авторы [80] изучили реакции комплексообра-
зования серебра в ацетонитриле в присутствии
В работе [82] при взаимодействии {Cu2[B10H10]}
додекафтор-клозо-додекаборатного аниона и по-
c ацетонитрилом в присутствии трифторуксусной
лучили целый ряд комплексов серебра(I) с мо-
кислоты получен биядерный комплекс меди(I)
лекулами ацетонитрила в качестве лигандов:
[Cu2(CH3CN)4][B10H10]. В данном соединении
[Ag(CH3CN)4]2[B12F12],
[Ag2(CH3CN)5][B12F12],
клозо-декаборатный анион координирован ато-
[Ag2(CH3CN)4][B12F12]. Строение комплексов с
мом металла апикальным ребром B1-B2 и ребром,
биядерными катионами серебра представлены на
соединяющим два экваториальных пояса B3-B6
рис. 20.
за счет трехцентровых двухэлектронных связей
CuHB [расстояния Cu-B(H) 2.25(2)-2.29(2), рас-
Аналогичный катионный комплекс тетра-
стояния Cu-H(B) 1.82-1.95 Å, угол CuHB 109°]
кис(ацетонитрил)серебра(I)
[Ag(CH3CN)4]·
(рис. 21).
[B12Cl11(NH3)] получен при использовании в каче-
стве исходного реагента амино-ундекахлор-кло-
В комплексе геометрия борного остова суще-
зо-додекаборатного аниона [81].
ственно искажена со стороны вершин, которые не
участвуют в координации к атому меди(I). Апи-
3. СМЕШАННО-ЛИГАНДНЫЕ
кальные ребра противоположной вершины поли-
КОМПЛЕКСЫ МЕТАЛЛОВ С МОЛЕКУЛАМИ
эдра сильно укорочены [1.50(2) и 1.55(2) Å], связь
РАСТВОРИТЕЛЕЙ И КЛАСТЕРНЫМИ
B4-B5 фактически разорвана [2.10(3) Å], а фраг-
АНИОНАМИ БОРА И ИХ ПРОИЗВОДНЫМИ В
мент B1-B4-B5-B8 уплощен (перегиб по линии
КАЧЕСТВЕ ЛИГАНДОВ
B4-B5 составляет 13.6°).
Анализ литературных данных позволил уста-
Авторами [83] в ходе изучения процесса сту-
новить, что в реакциях комплексообразования ме-
пенчатого замещения лигандов в комплексе
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
459
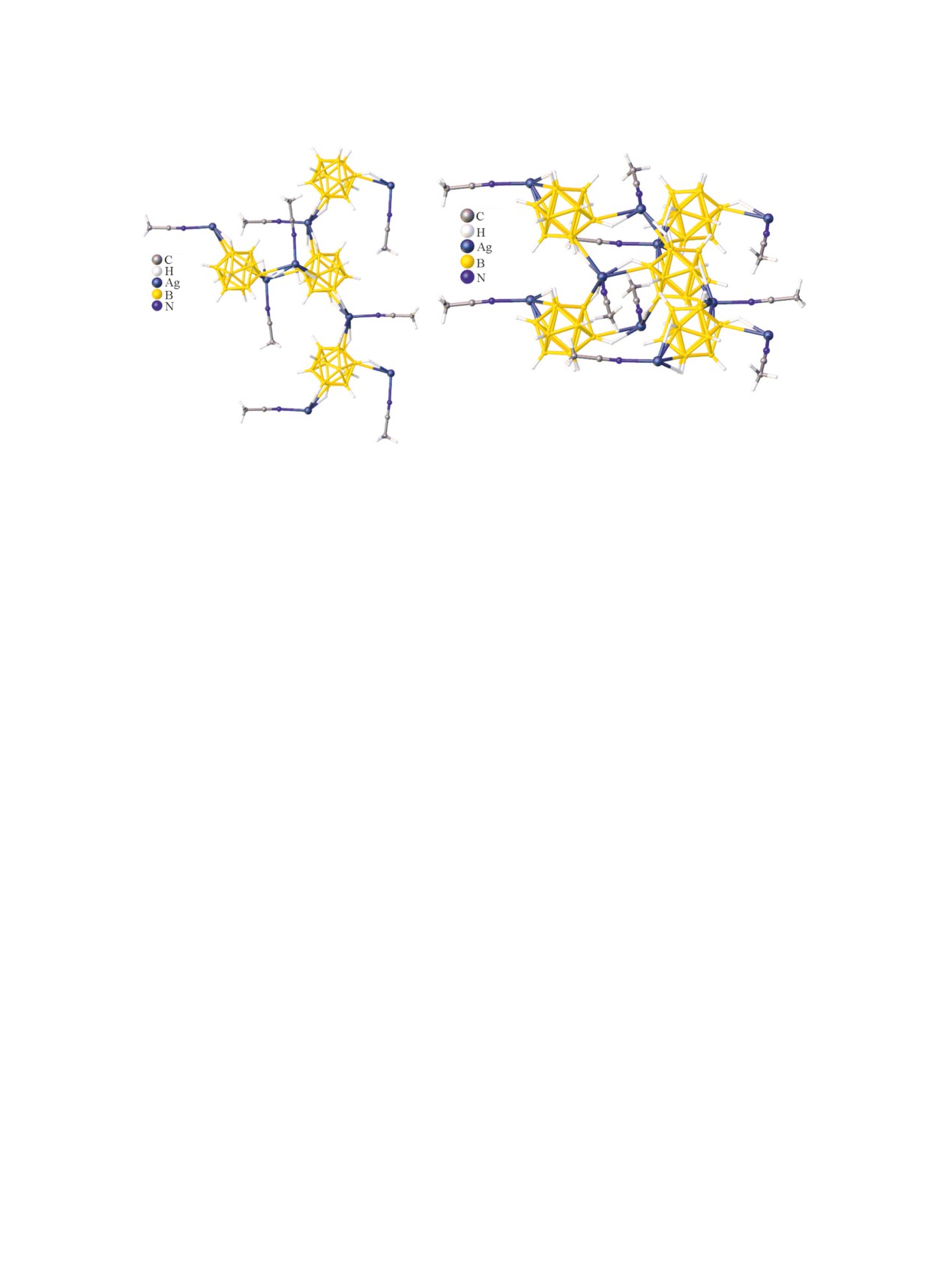
Рис. 22. Строение комплекса 1-2, 7-10 {Cu2(CH3CN)·
Рис. 21. Строение комплекса {Cu2(CH3CN)4[B10H10]}.
(5Nphen)3[B10H10]}.
меди(I) {Cu2(CH3CN)4[B10H10]} на молекулыфенан-
плексе
{Cu2(CH3CN)4[B10H10]} на молеку-
тридина (5Nphen) выделены комплекс 1-2, 7(8)-10
лы трифенилфосфина получен комплекс
{Cu2(CH3CN)(5Nphen)3[B10H10]} и cокристалл 1-2,
{Cu2(CH3CN)2(Ph3P)2[B10H10]}. Авторы отмечают,
7(8)-10
{Cu2(CH3CN)(5Nphen)3[B10H10]}·5Nphen.
что при проведении гомогенной реакции комплек-
Данные соединения получены в результате гете-
сообразования образуется сольват {Cu2(CH3CN)2·
рофазной реакции в ацетонитриле при различном
(Ph3P)2[B10H10]}·CH3CN, в то время как при прове-
соотношении металл-лиганд.
дении гетерофазной реакции - такой же комплекс,
но не содержащий молекулы растворителя.
{Cu
[B
H
]}
+2Ph
P
2
10
10
n
3
CH3CN
2
3
10
2
3
2
10
3
Cu
→
{
(CH
CN)
(Ph
P)
[B
H
]}⋅CH
CN
Для полученного биядерного комплекса ме-
ди(I) {Cu2(CH3CN)(5NPhen)3[B10H10]} выполнено
рентгеноструктурное исследование, в ходе кото-
Строение обоих комплексов приведено на
рого установлено, что кластерный анион коорди-
рис.
23. Координационное окружение атомов
нирован атомом меди по апикальным ребрам при
меди(I) образуют атом азота молекулы ацетони-
разных вершинах, при этом в кристаллах наблю-
трила, атом фосфора молекулы трифенилфос-
дается сокристаллизация энантиомеров 1-2, 7-10 и
фина и апикальное ребро борного кластера. В
1-2, 8-10 (рис. 22). Самая короткая связь Cu2-N4
обоих комплексах бороводородный кластер ко-
с молекулой CH3CN составляет 1.970(6) Å; связь
ординирован атомом металла по ребрам 1-2 и
Cu2-N3 с молекулой 5Nphen [1.993(5) Å] короче
6(9)-10 (наблюдается сокристаллизация соот-
аналогичных связей, образованных атомом Cu1
ветствующих энантиомеров). Расстояния Cu-B
[2.030 и 2.046(5) Å соответственно]. Связи между
в комплексах
{Cu2(CH3CN)2(Ph3P)2[B10H10]} и
атомом Cu1 и анионом [B10H10]2- (Cu-B) 2.030 и
{Cu2(CH3CN)2(Ph3P)2[B10H10]}·CH3CN составля-
2.046(5) Å, напротив, короче аналогичных связей,
ют 2.2455(18), 2.2890(18) и 2.264(2)-2.297(2) Å со-
образованных атомом Cu2 [2.294 и 2.305(8) Å].
ответственно [83].
В ходе
исследования
аналогично-
В работе
[84] нейтрализацией кислоты
го процесса замещения лигандов в ком-
(H3O)2[B12H12]-- оксидом меди(I) с последующей
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
460
АВДЕЕВА и др.
(а)
(б)
Рис. 23. Строение комплексов 1-2, 6-10 {Cu2(CH3CN)2(Ph3P)2[B10H10]} (а) и 1-2, 6-10 {Cu2(CH3CN)2(Ph3P)2[B10H10]}·CH3CN (б).
Рис. 24. Строение центросимметричного комплекса {Cu2(CH3CN)4[B12H12]}.
перекристаллизацией в ацетонитриле получен
3.2. Полимерные комплексы серебра(I)
биядерный комплекс меди(I) с молекулами аце-
с координированными молекулами
тонитрила в качестве лигандов и клозо-додекабо-
растворителей и кластерными анионами бора
ратным анионом во внутренней сфере комплекса
Большое сродство серебра(I) к кластерным
{Cu2(CH3CN)4[B12H12]} (рис. 24). Согласно дан-
анионам бора приводит к формированию коорди-
ным РСА, кластерный анион бора в полученном
национных 1D, 2D или 3D полимеров с анионами
центросимметричном молекулярном комплексе
[BnHn]2- и молекулами растворителей в качестве
координирован двумя атомами металла по двум
лигандов.
противоположным ребрам борного полиэдра с об-
разованием трехцентровой двухэлектронной связи
В работе
[82] синтезирован и охарактери-
МНВ. Расстояния Cu-B составляют 2.228 и 2.351 Å.
зован полимерный комплекс
{[Cu(CH3CN)3]·
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
461
[Ag[B10H10]]}n, который образуется при взаимо-
действии {Cu2[B10H10]} и {Ag2[B10H10]} в ацето-
нитриле с добавлением трифторуксусной кислоты.
{Cu [B H
]
+[Ag [B H1
]}
2
10
10
2
10
0
CH3CN
3
3
10
10
{Cu
(CH
CN)
]Ag[B
H
]]} .
n
→
Методом РСА определено строение комплекса
{[Cu(CH3CN)3][Ag[B10H10]]}n. Установлено, что
кристаллы сформированы комплексными кати-
онами меди(I) [Cu(CH3CN)3]+, которые распола-
гаются в пустотах бесконечных цепей анионного
комплекса серебра(I) {Ag[B10H10]}-n (рис. 25). В по-
лученном соединении геометрия борного класте-
ра существенно искажена. Длины связей Ag-B2,
Ag-B1 и Ag-B5 равны 2.547(7), 2.656(8) и 2.758(9)
Å соответственно. Плоское тригональное окруже-
ние атомов меди образуют атомы азота молекул
ацетонитрила. Два удлиненных контакта с груп-
пами B4-H4 дополняют координацию атома ме-
талла до тригонально-бипирамидальной [Cu-B(H)
3.319(7), Cu-H(B) 2.40(7) Å, угол CuHB 141°],
Рис.
25. Строение комплекса {[Cu(CH3CN)3]·
формируя слои.
[Ag[B10H10]]}n.
(а)
(б)
Рис. 26. Строение трехмерного каркаса в полимере {Ag2(DMF)[В10Н10]}n в направлении [110] (а) и [100] (б).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
462
АВДЕЕВА и др.
(а)
(б)
Рис. 27. Строение трехмерного каркаса в полимере {(AgCH3CN)2[B12H12]}n в направлении [100] (а) и [101] (б).
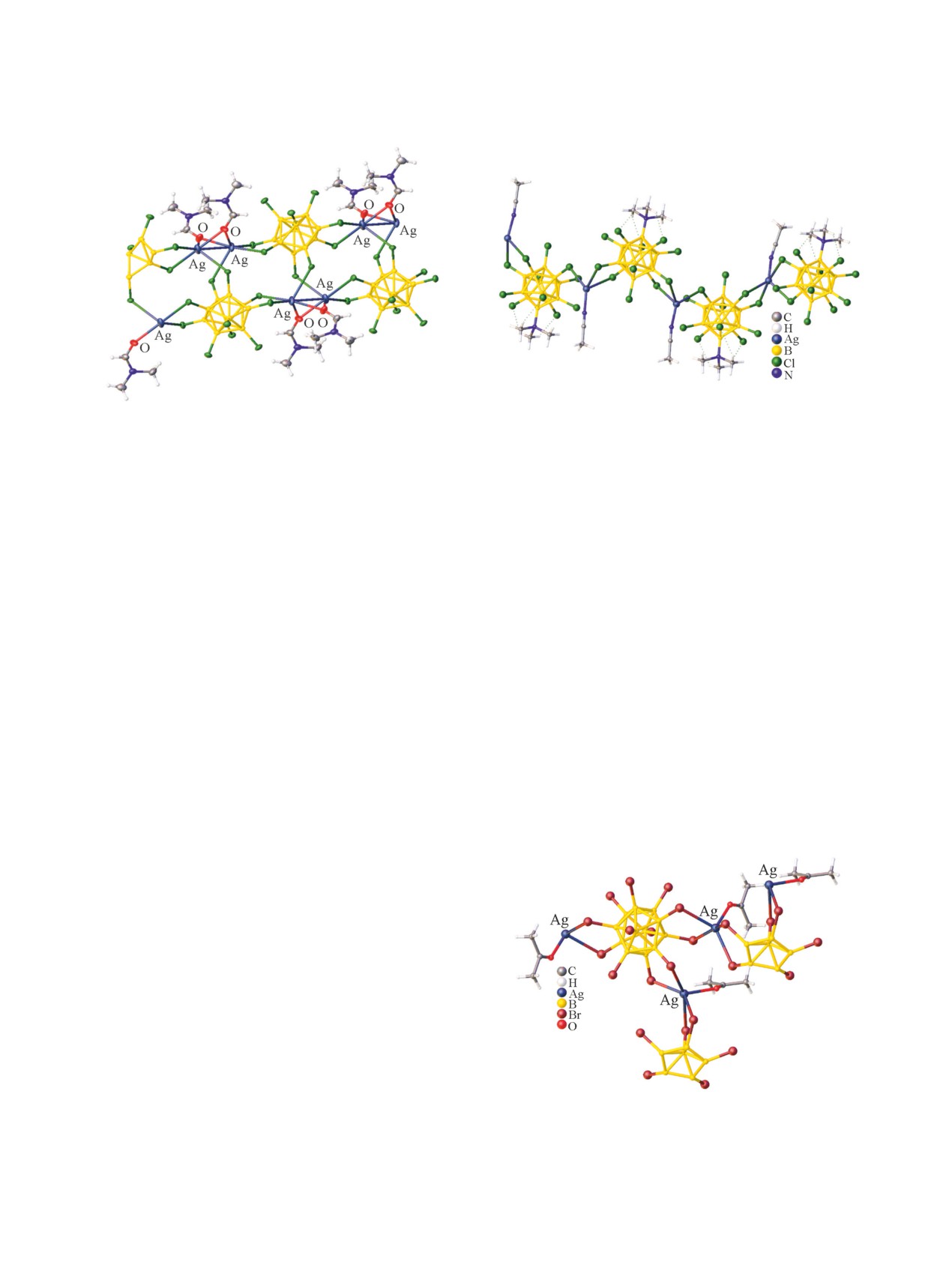
Известен комплекс серебра(I) с молекулами
в качестве основания пирамиды, и лигандом L в
ДМФА в качестве лигандов - {Ag2(DMF)[В10Н10]}n
вершине. Катион Ag2 координирует три клозо-до-
[85] (рис. 26).
декаборатных аниона трехцентровыми связями
AgHB. При этом три атома водорода и лиганд L
В комплексе восемь из десяти ВН-групп ико-
саэдрического аниона участвуют в координации
образуют вокруг атома серебра Ag2 тетраэдр. Ка-
тионы Ag2 и анионы формируют зигзагообразные
к атомам серебра с образованием трехцентровых
двухэлектронных связей AgHB. Авторы отмечают,
цепи в направлении а, в котором атомы серебра ко-
что участие такого количества атомов бора в ко-
ординируют три борных остова через связи AgHB.
ординации приводит к существенному уширению
Катионы Ag2 и анионы формируют другую цепь.
полосы валентных колебаний ВН связей, ν(BH)МНВ
Эти цепи и цепи катионов Ag2 связаны друг с дру-
в ИК спектре соединения. В структуре соедине-
гом так, что реализуется пространственное трех-
ния присутствуют четыре типа атомов серебра,
мерное связывание.
окружение которых образуют клозо-декаборатные
3.3. Полимерные комплексы серебра(I)
анионы и молекулы диметилформамида, КЧ всех
с координированными молекулами
атомов серебра равно 4+2.
растворителей и замещенными производными
В работе [86] при взаимодействии тетрабу-
кластерных анионов бора
тиламмониевой соли аниона [B12H12]2- с нитра-
том серебра в ацетонитриле получен комплекс
Авторами [87] методом рентгеноструктурного
серебра с координированными молекулами аце-
анализа определено строение комплекса серебра
тонитрила и клозо-додекаборатным анионом
[Ag(CH3CN)3]2{Ag2[2-B10H9F]2} с монофторзаме-
{Ag(CH3CN)2[B12H12]}. Методом РСА установ-
щенным производным клозо-декаборатного ани-
лено (рис. 27), что катионы серебра в соедине-
она. Соединение получено при взаимодействии
нии кристаллографически различны. Катион Ag1
(Ph4P)2[2-B10H9F] c трифторацетатом серебра.
координируют два клозо-додекаборатных аниона
Установлено, что структура комплекса состоит
трехцентровыми связями AgHB, при этом коор-
из димерных фрагментов {Ag2[2-B10H9F]2}2-, ко-
динационная сфера вокруг атома серебра является
торые связаны с двумя катионными комплексами
незначительно искаженной квадратной пирами-
серебра [Ag(CH3CN)3]+ (рис. 28). Центросимме-
дой, которая построена из четырех атомов водоро-
тричные димеры связаны длинными контактами
да двух кластерных анионов бора, выступающих
Ag···H 2.36 Å, формируя двойные цепи. Четыре
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
463
Рис. 28. Фрагмент кристаллической структуры [Ag(CH3CN)3]2{Ag2[2-B10H9F]2}n (атом фтора разупорядочен по двум
позициям).
Рис. 29. Строение комплекса {Ag2(H2O)4[B12F12]}n.
атома водорода трех различных кластерных ани-
рированным производным клозо-додекаборатным
онов формируют искаженный тетраэдр вокруг
аниона. Комплекс образуется при кристаллизации
атома Ag1. Расстояния Ag1-H составляют 2.02(5)-
в водном растворе образца, полученного в ходе
термического удаления легко уходящих молекул
2.25(5) Å. Три атома азота и два атома водорода
ацетонитрила из координационной сферы ком-
формируют незначительно искаженную триго-
плекса
[Ag2(CH3CN)4][B12F12]n. Согласно дан-
нальную бипирамиду вокруг атома Ag2. Струк-
ным рентгеноструктурного анализа, структура
турные единицы AgN3 образуют практически пло-
{Ag2(H2O)4[B12F12]}n (рис. 29) построена из бес-
ский треугольник. Расстояния Ag2-N 2.2-2.3 Å,
конечных цепей, образованных атомами серебра,
расстояния Ag2-H 2.16(4)-2.36(5) Å.
связанными между собой молекулами воды, вы-
В работе [88] описан синтез и строение поли-
ступающими в роли мостиковых лигандов. Коор-
мерного комплекса {Ag2(H2O)4[B12F12]}n с перфто-
динационная сфера атомов серебра дополняется
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
464
АВДЕЕВА и др.
(а)
(б)
Рис. 30. Кристаллическая структура {Ag2(CH2Cl2)2[B12F12]}n: фрагмент структуры (а), фрагмент упаковки (б).
атомами фтора бороводородного кластера до 4+2.
чен смешанно-лигандный комплекс серебра(I)
Расстояния Ag-O составляют 2.371(4)-2.524(4) Å;
{Ag2(CH3CN)2[B10Cl10]}n
[89], который образу-
расстояния Ag-F - 2.734(4)-2.751(4) Å.
ется при взаимодействии K2[B10Cl10] с двумя мо-
В ходе изучения реакции комплексообразова-
лями AgNO3 в ацетонитриле. Авторы отмечают,
ния серебра с анионом [B12F12]2- в дихлорметане
что образующийся в ходе реакции нитрат калия
был выделен комплекс {(Ag2(CH2Cl2)2[B12F12]}n
практически количественно выводится из реак-
[81]. Согласно данным РСА, комплекс имеет
ционного раствора, при этом в маточном раство-
структуру трехмерного каркаса (рис. 30). Коорди-
ре остаются только катионы серебра, кластер-
национное окружение атома серебра образовано
ные анионы бора и молекулы растворителя, что
четырьмя атомами хлора двух молекул дихлорме-
приводит к образованию полимерного комплекса
тана и тремя атомами фтора от двух перфториро-
{Ag2(CH3CN)2[B10Cl10]n}. Согласно данным РСА,
ванных замещенных производных икосаэдриче-
атом серебра(I) координирует две молекулы рас-
ского аниона.
творителя и два аниона [B10Cl10]2- с образованием
Для перхлорированного производного клозо-
координационного полиэдра AgN2Cl4. Структура
декаборатного аниона - аниона [B10Cl10]2- полу-
соединения представляет собой трехмерный кар-
кас, анион [B10Cl10]2- координирован четырьмя
атомами металла (рис. 31).
При взаимодействии (Et3NH)2[B10Cl10] с дву-
мя молями AgNO3 в диметилформамиде обра-
зуется полимерное соединение
[Ag2[B10Cl10]·
(DMF)2]n [89]. Согласно данным РСА, комплекс
{Ag2[B10Cl10](DMF)2}n представляет собой коор-
динационный полимер, построенный из анионов
[B10Cl10]2-, атомов серебра(I) и координированных
молекул ДМФА (рис. 32). Два атома серебра(I) ко-
ординируют мостиковые молекулы ДМФА, рас-
стояние Ag-Ag в кристалле составляет 3.202 Å,
длины связей Ag-B 2.636-2.828 Å. Авторы пред-
полагают наличие в комплексе связи Ag-Ag на
основании данных, полученных методом КР спек-
Рис. 31. Строение комплекса {Ag2(CH3CN)2[B10Cl10]}n.
троскопии.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
465
Рис. 33. Строение координационного полимера
Рис. 32. Строение комплекса {Ag2[B10Cl10](DMF)2}n.
{Ag(CH3CN)[B12Cl11(Me3N)]}n.
Авторы
[90] синтезировали и идентифици-
дов и кластерными анионами бора или их заме-
ровали комплекс серебра(I) с ундекахлор-(три-
щенными производными. Анализ литературных
метиламмонио)-клозо-додекаборатным анионом
данных показал, что природа металла оказывает
[B12Cl11(Me3N)]-, который образуется при взаи-
существенное влияние на формирование его ко-
модействии (H3O)[B12Cl11(Me3N)] с нитратом се-
ординационного окружения. Так, в присутствии
ребра в системе ацетонитрил-вода. Полученные
металлов-мягких кислот по Пирсону (медь(I), се-
кристаллы {Ag(CH3CN)[B12Cl11(Me3N)]}n иссле-
ребро(II), свинец(II)) кластерные анионы бора и их
дованы методом РСА. Соединение представля-
производные наряду с молекулами растворителей
ет собой координационный полиэдр и состоит из
координируются атомами металлов за счет трех-
бесконечных цепей (рис. 33). Атом серебра нахо-
центровых двухэлектронных связей. Комплексные
дится в искаженном тригонально-бипирамидаль-
соединения, содержащие кластерные анионы бора
ном окружении, образованном четырьмя атомами
во внутренней координационной сфере, могут
хлора двух соседних кластеров бора и атомом азо-
быть получены и для неклассических металлов-
та молекулы ацетонитрила. Расстояния Ag-Cl со-
комплексообразователей, например, кальция, ба-
ставляют 2.6522(9)-2.8919(9) Å.
рия. Так, в ходе термической обработки акваком-
плексов или комплексов с молекулами спиртов в
В работе [86] описан комплекс серебра с ацето-
ном и пербромированным производным клозо-до-
декаборатного аниона {Ag2[(CH3)2CO]2[B12Br12]}n,
образующийся при взаимодействии Ag[CF3SO3] и
(NBzlEt3)2[B12Br12] в ацетоне в токе азота. Целевое
соединение кристаллизовали в отсутствии света.
Обнаружено, что квадратно-пирамидальное ко-
ординационное окружение атома серебра форми-
руют два атома брома двух анионов [B12Br12]2- и
атом кислорода координированной молекулы аце-
тона (рис. 34).
4. ЗАКЛЮЧЕНИЕ
Таким образом, в настоящем обзоре обобщены
и структурированы сведения о координационных
соединениях металлов с молекулами воды или
Рис. 34. Структура комплекса {Ag2[(CH3)2CO]2·
[B12Br12]}n.
органических растворителей в качестве лиган-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
466
АВДЕЕВА и др.
качестве лигандов состава [ML6][BnXn] (M = Ca,
4.
Boron-Based Compounds: Potential and Emerging
Ba, Co, Ni, Fe, Mn; n = 10, 12; X = H, Hlg) наблю-
Applications in Medicine / Eds E. Hey-Hawkins, C.
Viñas Teixidor. Glasgow, UK: John Wiley & Sons Ltd.,
дается ступенчатое снижение содержания лиганда
2018. P. 470. doi 10.1002/9781119275602
L и формирование смешанно-лигандных комплек-
5.
Sivaev I.B., Bregadze V.I. Polyhedral Boron Hydrides in
сов за счет достраивания координационного поли-
Use: Current Status and Perspectives. Hauppauge: Nova
эдра В-Н или B-Hlg группами борного кластера.
Science Publishers, 2009. P. 85.
Координационные соединения металлов с лег-
6.
King R.B. // Chem. Rev. 2001. Vol. 101. N 5. P. 1119.
ко уходящими молекулами растворителей в ка-
doi 10.1021/cr000442t
честве лигандов показали свою эффективность в
7.
Chen Z. and King R.B. // Chem. Rev. 2005. Vol. 105.
качестве прекурсоров в реакциях комплексообра-
N 10. P. 3613. doi 10.1021/cr0300892
зования, проводимых в растворах и твердой фазе,
8.
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J.
с органическими лигандами, обладающими задан-
Inorg. Chem. 2010. Vol. 55. N 14. P. 2089. doi 10.1134/
S0036023610140019
ными свойствами, например, люминесценцией.
9.
Sivaev I.B., Prikaznov A.V., Naoufal D. // Coll. Czech.
Кроме того, знания о возможности существования
Chem. Commun. 2010. Vol. 75. N 11. P. 1149. doi
комплексов такого рода и их устойчивости в ре-
10.1135/cccc2010054
акционных растворах позволяют детально обсуж-
10.
Сиваев И.Б. // ЖНХ. 2019. Т. 64. № 8. С. 789;
дать возможные механизмы реакций комплексо-
Sivaev I.B. // Russ. J. Inorg. Chem. 2019. Vol. 64. N 8.
образования.
P. 955. doi 10.1134/S003602361908014X
11.
Клюкин И.Н., Селиванов Н.А., Быков А.Ю.,
ИНФОРМАЦИЯ ОБ АВТОРАХ
Жданов А.П., Жижин К.Ю., Кузнецов Н.Т. // ЖНХ.
Авдеева Варвара Владимировна, ORCID:
2020. Т. 65. № 10. С. 1345; Klyukin I.N., Seliva-
nov N.A., Bykov A.Y., Zhdanov A.P., Zhizhin K.Yu.,
Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. Vol. 65.
Короленко Светлана Евгеньевна, ORCID:
N 10. P. 1547. doi 10.1134/S0036023620100113
12.
Нелюбин А.В., Селиванов Н.А., Быков А.Ю.,
Малинина Елена Анатольевна, ORCID: https://
Клюкин И.Н., Новиков А.С., Жданов А.П.,
orcid.org/0000-0002-9620-6956
Жижин К.Ю., Кузнецов Н.Т. // ЖНХ. 2020. Т. 65. №
6. С. 719; Nelyubin A.V., Selivanov N.A., Bykov A.Y.,
Кузнецов Николай Тимофеевич, ORCID: https://
Klyukin I.N., Novikov A.S., Zhdanov A.P., Zhizhin K.Yu.,
orcid.org/0000-0002-0131-6387
Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. Vol. 65.
ФОНДОВАЯ ПОДДЕРЖКА
N 6. P. 795. doi 10.1134/S0036023620060133
13.
Nelyubin A.V., Klyukin I.N., Zhdanov A.P.,
Работа выполнена в рамках государственно-
Zhizhin K.Yu., Kuznetsov N.T. // Russ. J. Inorg.
го задания Института общей и неорганической
Chem. 2019. Vol. 64. N 14. P. 1750. doi 10.1134/
химии им. Н.С. Курнакова РАН в области фунда-
S0036023619140043
ментальных научных исследований.
14.
Нелюбин А.В., Клюкин И.Н., Жданов А.П., Григорь-
ев М.С., Жижин К.Ю., Кузнецов Н.Т. // ЖНХ. 2019.
КОНФЛИКТ ИНТЕРЕСОВ
Т. 64. № 12. С. 1263; Nelyubin A.V., Klyukin I.N.,
Zhdanov A.P., Grigor’ev M.S., Zhizhin K.Yu., Kuzne-
Авторы заявляют об отсутствии конфликта
tsov N.T. // Russ. J. Inorg. Chem. 2019. Vol. 64. N 12.
интересов.
P. 1499. doi 10.1134/S003602361912012X
15.
Shmal’ko A.V. and Sivaev I.B. // Russ. J. Inorg.
СПИСОК ЛИТЕРАТУРЫ
Chem. 2019. Vol. 64. N 14. P. 1726. doi 10.1134/
1. Greenwood N.N.. Earnshaw A. Chemistry of the
S0036023619140067
Elements. Oxford: Butterworth-Heinemann, 1997.
16.
Нелюбин А.В., Клюкин И.Н., Жданов А.П., Григорь-
2. Grimes R.N. Carboranes. London: Academic Press,
ев М.С., Жижин К.Ю., Кузнецов Н.Т. // ЖНХ. 2021.
2016. P. 1058. doi 10.1016/B978-0-12-801894-1.09989-3
Т. 66. № 2. С. 134; Nelyubin A.V., Klyukin I.N., Zhda-
3. Boron Science: New Technologies and Applications /
nov A.P., Grigor’ev M.S., Zhizhin K.Yu., Kuznetsov N.T. //
Ed. N.S. Hosmane. Boca Raton, Florida: CRC Press,
Russ. J. Inorg. Chem. 2021. Vol. 66. N 2. P. 139. doi
2012.
10.1134/S0036023621020133
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
467
17.
Авдеева В.В., Малинина Е.А., Жижин К.Ю., Кузне-
tsov N.T. // Polyhedron 2016. Vol. 117. P. 561. doi
цов Н.Т. // ЖНХ. 2021. Т. 47. № 8. С. 457; Avdee-
10.1016/j.poly.2016.06.016
va V.V., Malinina E.A., Zhizhin K.Y., Kuznetsov N.T. //
31.
Авдеева В.В., Малинина Е.А., Жижин К.Ю., Кузне-
Russ. J. Coord. Chem. 2021. Vol. 47. N 8. P. 519. doi
цов Н.Т. // ЖНХ. 2020. Т. 65. № 4. С. 495; Avdee-
10.1134/S1070328421080017
va V.V., Malinina E.A., Zhizhin K.Y., Kuznetsov N.T. //
18.
Malinina E.A., Avdeeva V.V., Goeva L.V., Kuznetsov N.T. //
Russ. J. Inorg. Chem. 2020. Vol. 65. N 4. P. 514. doi
Russ. J. Inorg. Chem. 2010. V. 55. N 14. P. 2148. doi
10.1134/S0036023620040026
10.1134/S0036023610140032
32.
Гоева Л.В., Авдеева В.В., Малинина Е.А., Кузне-
19.
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J.
цов Н.Т. // ЖНХ. 2018. Т. 63. № 8. С. 1015;
Inorg. Chem. 2017. V. 62. N 13. P. 1673. doi 10.1134/
Goeva L.V., Avdeeva V.V., Malinina E.A., Kuznetsov N.T. //
S0036023617130022
Russ. J. Inorg. Chem. 2018. Vol. 63. N 8. P. 1050. doi
20.
Короленко С.Е., Авдеева В.В., Малинина Е.А., Кузне-
10.1134/S0036023618080089
цов Н.Т. // ЖНХ. 2021. Т. 66. № 9. С. 1255; Korolen-
33.
Матвеев Е.Ю., Новиков И.В., Кубасов А.С.,
ko S.E., Avdeeva V.V., Malinina E.A., Kuznetsov N.T. //
Ретивов В.М., Жижин К.Ю., Кузнецов Н.Т. // ЖНХ.
Russ. J. Inorg. Chem. 2021. Vol. 66. N 9. P. 1350. doi
2021. Т. 66. № 2. С. 187; Matveev E.Y., Novikov I.V.,
10.1134/S0036023621090047
Kubasov A.S., Retivov V.M., Zhizhin K.Yu., Kuzne-
21.
Сиваев И.Б. // ЖНХ. 2021. Т. 66. № 9. С. 1192;
tsov N.T. // Russ. J. Inorg. Chem. 2021. Vol. 66. N 2.
Sivaev I.B. // Russ. J. Inorg. Chem. 2021. Vol. 66. N 9.
P. 187. doi 10.1134/S0036023621020121
P. 1289. doi 10.1134/S0036023621090151
34.
Malinina E.A., Korolenko S.E., Zhdanov A.P., Avdee-
22.
Авдеева В.В., Малинина Е.А., Кузнецов Н.Т. // ЖНХ.
va V.V., Privalov V.I., Kuznetsov N.T. // J. Cluster Sci.
2020. Т. 65. № 3. С. 334; Avdeeva V.V., Malinina E.A.,
2021. Vol. 32. P. 755. doi 10.1007/s10876-020-01840-5
Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. Vol. 65.
35.
Агафонов А.В., Винницкий Д.М., Солнцев К.А., Куз-
N 3. P. 335. doi 10.1134/S003602362003002X
нецов Н.Т., Микоян З.Н., Рюриков В.Ф. // ЖНХ. 1985.
23.
Avdeeva V.V., Polyakova I.N., Vologzhanina A.V.,
Т. 30. № 2. С. 355.
Malinina E.A., Zhizhin K.Yu., Kuznetsov N.T. //
36.
Винницкий Д.М., Кузнецов И.Ю., Солнцев К.А., Куз-
Polyhedron 2017. Vol. 123. P. 396. doi 10.1016/j.
нецов Н.Т. // ЖНХ. 1987. Т. 32. № 12. С. 3268.
poly.2016.12.009
37.
Климчук Г.С, Мустяца В.Н. // Тезисы докл. IV Все-
24.
Avdeeva V.V., Vologzhanina A.V., Malinina E.A.,
союзного совещания по химии гидридов. Душанбе.
Kuznetsov N.T. // Crystals. 2019. Vol. 9. N 7. P. 330.
1987. С. 44.
doi10.3390/cryst9070330
38.
Кузнецов Н.Т., Земскова Л.А., Гоева Л.В. // Коорд.
25.
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. //
хим. 1981. Т. 7. № 2. С. 232.
Polyhedron. 2016. Vol. 105. P. 205. doi 10.1016/j.
39.
Zimmermann L.W., Schleid Th. // Z. Kristallogr. 2013.
poly.2015.11.049
Vol. 228. N 10. P. 558. doi 10.1524/zkri.2013.1634.
26.
Avdeeva V.V., Buzin M.I., Malinina E.A., Kuznetsov N.T.,
40.
Кузнецов Н.Т., Солнцев К.А., Климчук Г.С. // Изв. АН
Vologzhanina A.V. // CrystEngComm. 2015. Vol. 17.
СССР. Неорг. матер. 1978. Т. 14. № 11. С. 2013.
N 46. P. 8870. doi 10.1039/c5ce00859j
41.
Успенская С.М., Солнцев К.А., Кузнецов Н.Т. // ЖСХ.
27.
Avdeeva V.V., Buzin M.I., Dmitrienko A.O.,
1975. Т. 16. № 3. С. 482.
Dorovatovskii P.V., Malinina E.A., Kuznetsov N.T.,
42.
Солнцев К.А., Кузнецов Н.Т., Пономарев В.И. // Докл.
Voronova E.D., Zubavichus Y.V., Vologzhanina A.V.
АН СССР. 1976. Т. 228. № 4. С. 853.
// Chem. Eur. J. 2017. Vol. 23. N 66. P. 16819. doi
43.
Кузнецов Н.Т., Климчук Г.С. // ЖНХ. 1971. Т. 16.
10.1002/chem.201703285
№ 5. С. 1218.
28.
Малинина Е.А., Авдеева В.В., Короленко С.Е.,
44.
Солнцев К.Α., Кузнецов Н.Т., Пономарев В.И. // Изв.
Нефедов С.Е., Гоева Л.В., Кузнецов Н.Т. // ЖНХ.
АН СССР. Неорг. матер. 1976. Т. 12. № 6. С. 1044.
2020. Т. 65. № 9. С. 1208; Malinina E.A., Avdeeva
45.
Солнцев Κ.Α., Кузнецов Н.Т., Раннев Η.В., Заводник
V.V., Korolenko S.E., Nefedov S.E., Goeva L.V., Kuzne-
В.Е. // Докл. АН СССР. 1977. Т. 232. № 6. С. 1366.
tsov N.T. // Russ. J. Inorg. Chem. 2020. Vol. 65. N 9.
46.
Muetterties E.L., Baltnis J.H., Chia Y.T., Knoth W.N.,
P. 1343. doi 10.1134/S0036023620090119
Miller H.C. // Inorg. Chem. 1964. Vol. 3. N 3. P. 444.
29.
Kravchenko E.A., Gippius A.A., Kuznetsov N.T. // Russ.
doi 10.1021/ic50013a030
J. Inorg. Chem. 2020. Vol. 65. N 4. P. 546. doi 10.1134/
47.
Солнцев К.А., Кузнецов Н.Т., Раннев Н.В. // Докл. АН
S0036023620040105
СССР. 1973. Т. 221. № 6. С. 1378
30.
Kravchenko E.A., Gippius A.A., Vologzhanina A.V.,
48.
Tiritiris I. and Schleid T. // Z. anorg. allg.
Avdeeva V.V., Malinina E.A., Ulitin E.O., Kuzne-
Chem.
2002. Vol.
628. P.
1411. doi
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
468
АВДЕЕВА и др.
10.1002/1521-3749(200206)628:6<1411::AID-
Goeva L.V., Buzanov G.A., Generalova N.B., Malini-
ZAAC1411>3.0.CO;2-X
na E.A., Zhizhin K.Y., Kuznetsov N.T., Vologzhanina A.V. //
49.
Tiritiris I. and Schleid T. // Z. anorg. allg. Chem. 2005.
Russ. J. Inorg. Chem. 2016. Vol. 61. N 9. P. 1125. doi
Vol. 631. P. 1593. doi 10.1002/zaac.200500093
10.1134/S0036023616090023
50.
Tiritiris I. and Schleid T. // Z. anorg. allg. Chem. 2004.
68.
Avdeeva V.V., Polyakova I.N., Goeva L.V., Buzanov G.A.,
Vol. 630. P. 541. doi 10.1002/zaac.200300416
Malinina E.A., Kuznetsov N.T. // Inorg. Chim. Acta.
51.
Tiritiris I., Van Ng.-D., Schleid T. // Z. anorg. allg. Chem.
2016. Vol. 451. P. 129. doi 10.1016/j.ica.2016.07.016
2004. Vol. 630. P. 1763. doi 10.1002/zaac.200470138.
69.
Малинина Е.А., Гоева Л.В., Бузанов Г.А., Ретивов В.М.,
52.
Van Ng.-D. PhD Thesis: New salt-like dodecahydro-
Авдеева В.В., Кузнецов Н.Т. // ЖНХ. 2020. Т. 65. № 1.
closo-dodecaborates and efforts for the partial
С. 124; Malinina E.A., Goeva L.V., Buzanov G.A.,
hydroxylation of [B12H12]2- anions. Stuttgart, 2009.
Avdeeva V.V., Kuznetsov N.T., Retivov V.M. // Russ. J.
53.
Кузнецов H.T., Земскова Л.Α., Алиханова 3.Μ.,
Inorg. Chem. 2020. Т. 65. N 1. P. 126. doi 10.1134/
Ипполитов Ε.Г. // ЖНХ. 1981. Т. 26. № 5. С. 1331.
S0036023620010118
54.
Михайлов Ю.Н., Канищева А.С, Земскова Л.А.,
70.
Малинина Е.А., Короленко С.Е., Гоева Л.В.,
Мистрюков В.Э., Кузнецов Н.Т., Солнцев К.А. //
Бузанов Г.А., Авдеева В.В., Кузнецов Н.Т. // ЖНХ.
ЖНХ. 1982. Т. 27. № 9. С. 2343.
2018. Т. 63. № 12. С. 1543; Malinina E.A., Korolen-
55.
Канаева О.А., Кузнецов Н.Т. // Труды MИTXT. 1972.
ko S.E., Goeva L.V., Buzanov G.A., Avdeeva V.V.,
Т. 2. № 2. С. 21.
Kuznetsov N.T. // Russ. J. Inorg. Chem. 2018. Vol. 63.
56.
Tiritiris I. and Schleid T. // Z. anorg. allg. Chem. 2007.
N 12. P. 1552. doi 10.1134/S0036023618120148
Vol. 634. P. 317. doi 10.1002/zaac.200700399
71.
Короленко С.Е., Гоева Л.В., Кубасов А.С., Авдее-
57.
Jørgensen M., Zhou W., Wu H., Udovic T.J., Paskev-
ва В.В., Малинина Е.А., Кузнецов Н.Т. // ЖНХ.
icius M., Černý R., Jensen T.R. // Inorg. Chem.
2020. Т. 65. № 6. С. 778; Korolenko S.E., Goeva L.V.,
2021. Vol. 60. N 15. P. 10943. doi 10.1021/acs.
Kubasov A.S., Avdeeva V.V., Malinina E.A., Kuzne-
inorgchem.1c00594
tsov N.T. // Russ. J. Inorg. Chem. 2020. Т. 65. N 6.
58.
Tiritiris I., Van Ng.-D., Schleid T. // Z. anorg. allg. Chem.
P. 846. doi 10.1134/S0036023620060091
2011. Vol. 637. P. 682. doi 10.1002/zaac.201000457
72.
Avdeeva V.V., Vologzhanina A.V., Ugolkova E.A.,
59.
Didelot E., Sadikin Y., Łodzian Zb., Černý R. //
Minin V.V., Malinina E.A., Kuznetsov N.T. // J. Solid
Solid State Sci. 2019. Vol. 90. P. 86. doi 10.1016/j.
State Chem. 2021. Vol. 296. P. 121989. doi 10.1016/j.
solidstatesciences.2019.02.005
jssc.2021.121989
60.
Kleeberg F.M. and Schleid T. // Z. Kristallogr. 2017.
73.
Кузнецов Н.Т., Земскова Л.А. // ЖНХ. 1982. Т. 27.
Suppl. 37. P. 107.
№ 5. С. 1320
61.
Bareiß K. and Schleid T. // Z. Kristallogr. 2019. Suppl.
74.
Korolenko S.E., Zhuravlev K.P., Tsaryuk V.I., Kuba-
39. P. 87.
sov A.S., Avdeeva V.V., Malinina E.A., Burlov A.S.,
62.
Кузнецов H.T., Земскова Л.Α., Ипполитов Ε.Г. //
Divaeva L.N, Zhizhin K.Yu., Kuznetsov N.T. // J.
ЖНХ. 1981. Т. 26. № 7. С. 1862.
Lumin. 2021. Vol. 237. P. 118156. doi 10.1016/j.
63.
Malinina E.A., Korolenko S.E., Kubasov A.S., Buza-
jlumin.2021.118156
nov G.A., Golubev A.V., Goeva L.V., Simonenko N.P.,
75.
Korolenko S.E., Kubasov A.S., Goeva L.V., Avdee-
Avdeeva V.V., Kuznetsov N.T. // J. Solid State
va V.V., Malinina E.A., Kuznetsov N.T. // Inorg. Chim.
Chem. 2021. Vol. 302. P. 122413. doi 10.1016/j.
Acta. 2021. Vol. 520. P. 120315. doi 10.1016/j.
jssc.2021.122413
ica.2021.120315
64.
Kleeberg F.M., Dinnebier R.E., Schleid T. // Inorg.
76.
Korolenko S.E., Kubasov A.S., Goeva L.V., Avdee-
Chim. Acta. 2017. Vol. 467. P. 147. doi 10.1016/j.
va V.V., Malinina E.A., Kuznetsov N.T. // Inorg. Chim.
ica.2017.07.066
Acta. 2021. Vol. 527. P. 120587. doi 10.1016/j.
65.
Lacroix M.R., Bukovsky E.V., Lozinšek M., Fol-
ica.2021.120587
som T.C., Newell B.S., Liu Y., Peryshkov D.V.,
77.
Милутка М.С., Бурлов А.С., Власенко В.Г., Кощиен-
Strauss S.H. // Inorg. Chem. 2018. Vol. 57. N 23.
ко Ю.В., Макарова Н.И., Метелица А.В., Коршуно-
P. 14983. doi 10.1021/acs.inorgchem.8b02786
ва Е.В., Тригуб А.Л., Зубенко А.А., Клименко А.И. //
66.
Didelot E., Łodziana Z., Murgia F., Černý R. // Crystals.
ЖОХ. 2021. Т. 91. № 9. С. 1426; Milutka M.S.,
2019. Vol. 9. N 7. P. 372. doi 10.3390/cryst9070372
Burlov A.S., Vlasenko V.G., Koschienko Yu.V.,
67.
Авдеева В.В., Полякова И.Н., Вологжанина А.В.,
Makarovs N.I., Metelitsa A.V., Korshuniva E.V.,
Гоева Л.В., Бузанов Г.А., Генералова Н.Б., Малини-
Trigub A.L., Zubenko A.A., Klimenko A.I. // Russ.
на Е.А., Жижин К.Ю., Кузнецов Н.Т. // ЖНХ. 2016.
J. Gen. Chem. 2021. Vol. 91. P. 1706. doi 10.1134/
Т. 61, № 9. С. 1182; Avdeeva V.V., Polyakova I.N.,
S1070363221090140
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022
МОЛЕКУ
ЛЫ РАСТВОРИТЕЛЕЙ
469
78. Zakharova I.A., Kuznetsov N.Т., Gaft Yu.L. // Inorg.
Goeva L.V., Polyakova I.N., Votinova N.A.,
Chim. Acta. 1978. Vol. 28. Р. 271. doi 10.1016/S0020-
Zhizhin K.Yu., Kuznetsov N.T. // Russ. J. Inorg.
1693(00)87446-0
Chem. 2006. Vol. 51. N 11. P. 1723. doi 10.1134/
79. Musgrave R.A., Hailes R.L.N., Schäfer A., Russell A.D.,
S0036023606110076
Gates P.J., Manners I. // Dalton Trans. 2018. Vol. 47.
85. Полякова И.Н., Малинина Е.А., Дроздова В.В., Куз-
P. 2759. doi 10.1039/C7DT04593J
нецов Н.Т. // Кристаллография. 2008. Т. 53. № 2.
80. Peryshkov D.V. and Strauss S.H. // Inorg. Chem.
С. 279; Polyakova I.N., Malinina E.A., Drozdova V.V.,
2017. Vol. 56. N 7. P. 4072. doi 10.1021/acs.
Kuznetsov N.T. // Crystallography Reports. 2008.
inorgchem.7b00051
Vol. 53. N 2. P. 253. doi 10.1007/s11445-008-2013-3
81. Zhang Y., Liu J., Duttwyler S. // Eur. J. Inorg. Chem.
86. Volkov O., Hu Ch., Paetzold P. // Z. anorg. allg. Chem.
2015. P. 5158. doi 10.1002/ejic.201501009
2005. Vol. 631. P. 1107. doi 10.1002/zaac.200400518
82. Малинина Е.А., Жижин К.Ю., Мустяца В.Н.,
87. Ivanov S.V., Ivanova S.I., Miller S.M., Anderson O.P.,
Гоева Л.В., Полякова И.Н., Кузнецов Н.Т. // ЖНХ.
Solntsev K.A., Strauss S.H. // Inorg. Chem. 1996.
2003. Т. 48. № 7. С. 1102; Malinina E.A., Zhizhin K.Yu.,
Vol. 35. N 24. P. 6914. doi 10.1021/ic961043c
Mustyatsa V.N., Goeva L.V., Polyakova I.N., Kuzne-
88. Malischewski M., Peryshkov D.V., Bukovsky E.V.,
tsov N.T. // Russ. J. Inorg. Chem. 2003. Vol. 48. N 7.
Seppelt K., Strauss S.H. // Inorg. Chem. 2016. Vol. 55.
P. 993.
N 23. P. 12254. doi 10.1021/acs.inorgchem.6b01980
83. Avdeeva V.V., Malinina E.A., Churakov A.V., Polyako-
89. Avdeeva V.V., Buzanov G.A., Malinina E.A., Kuzne-
va I.N., Kuznetsov N.T. // Polyhedron. 2019. Vol. 169.
P. 144. doi 10.1016/j.poly.2019.05.018
tsov N.T., Vologzhanina A.V. // Crystals. 2020. Vol. 10.
84. Малинина Е.А., Мустяца В.Н., Гоева Л.В., Поляко-
P. 389. doi 10.3390/cryst10050389
ва И.Н., Вотинова Н.А., Жижин К.Ю., Кузне-
90. Saleh M., Powell D.R., Wehmschulte R.J. // Inorg.
цов Н.Т., Дроздова В.В. // ЖНХ. 2006. T. 51. № 11.
Chem. 2016. Vol. 55. N 20. P. 10617. doi 10.1021/acs.
С. 1832; Malinina E.A., Drozdova V.V., Mustyatsa V.N.,
inorgchem.6b01867
Solvent Molecules As Ligands in Coordination Compounds
of Metals with Boron Cluster Anions and Their Derivatives
(A Review)
V. V. Avdeeva*, S. E. Korolenko, E. A. Malinina, and N. T. Kuznetsov
Kurnakov Institute of General and Inorganic Chemistry, Russian Academy of Sciences, Moscow, 119991 Russia
*e-mail: avdeeva.varvara@mail.ru
Received October 31, 2021; revised January 24, 2022; accepted January 28, 2022
This work summarizes the literature data on the synthesis and structure of coordination compounds of alkali,
alkaline earth metals, a series of transition metals M(I), M(II), and rare earth elements with solvent molecules
and boron cluster anions and their derivatives as ligands. A classification of the discussed group of compounds
is carried out taking into account the nature of the coordinating solvent molecules, the position of boron cluster
anions and their derivatives in the inner coordination sphere of the metal or outer sphere. It is shown that, in
the presence of mild acid metals according to Pearson [copper(I), silver(II), lead(II)] boron cluster anions and
their derivatives along with Solvent molecules are coordinated by metal atoms due to three-center two-electron
bonds, forming coordination polyhedra. For nonclassical complexing metals during the thermal treatment of
aqua complexes or complexes with alcohol molecules as ligands [ML6][BnHn] ((M = Ca, Mg, Co, Ni)), the
possibility of the formation of mixed ligand complexes due to completion of the metal coordination polyhedron
with BH groups of the boron cluster was found.
Keywords: coordination compounds, alkali, alkaline earth metals, M(II) metals, d10 metals, rare earth elements,
solvent molecules, boron cluster anions and their derivatives
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 3 2022