ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 4, с. 621-629
УДК 54-14/-16:661.185
К 90-летию со дня рождения А. И. Русанова
ОБРАТНЫЕ МИЦЕЛЛЫ И ПРОТОМИЦЕЛЛЫ
МОНОДОДЕЦИЛОВОГО ЭФИРА
ТЕТРАЭТИЛЕНГЛИКОЛЯ В СИСТЕМАХ С
ГЕПТАНОМ И НИЛЬСКИМ КРАСНЫМ
© 2022 г. Т. Г. Мовчанa,*, А. И. Русановa,b, Е. В. Плотниковаa
aИнститут физической химии и электрохимии имени А. Н. Фрумкина Российской академии наук,
Ленинский пр. 31, Москва, 119071 Россия
b Менделеевский центр, Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: movchan_tamara@mail.ru
Поступило в редакцию 16 февраля 2022 г.
После доработки 26 февраля 2022 г.
Принято к печати 28 февраля 2022 г.
Методом электронной спектроскопии поглощения исследованы процессы мицеллообразования в систе-
мах монододециловый эфир тетраэтиленгликоля (C12E4)-гептан (1) и C12E4-нильский красный-гептан
(2). В системе 1 возникают обратные мицеллы небольшой величины, что затрудняет нахождение кри-
тической концентрации мицеллообразования (ККМ). В связи с этим апробирован метод определения
ККМ на основе спектроскопических данных. То же сделано и для системы 2, где появление нильского
красного в качестве нано-адсорбента C12E4 приводит к образованию протомицелл ниже ККМ. Сама ККМ
в системе 2 оказывается ниже ККМ в системе 1, что соответствует предсказаниям теории. Использова-
нием коммерческого аналога C12E4 препарата Brij 30 (с содержанием воды 1%) исследована роль воды в
образовании обратных мицелл. Полученные результаты согласуются с теоретическими предсказаниями.
Ключевые слова: монододециловый эфир тетраэтиленгликоля, Brij 30, нильский красный, н-гептан,
спектр поглощения, обратные мицеллы, протомицеллы
DOI: 10.31857/S0044460X22040060, EDN: YHIHWT
Изучение агрегации неионных ПАВ типа СnЕm
утверждения, что образование обратных мицелл в
(C - углеводородные звенья, E - оксиэтиленовая
отсутствие воды невозможно вообще, т. е. «сухих»
группа) в неполярных и слабо полярных средах
мицелл не существует [7-10, 15]. Однако такие
представляет научный интерес в силу недостаточ-
мнения были опровергнуты работами [4, 12, 14, 16].
ной изученности механизма формирования обрат-
Нужно отметить, что, ввиду трудности избавиться
ных мицелл в отсутствие воды, а практически -
от воды на практике, особое значение приобрели
потребностью использования результатов иссле-
методы компьютерного моделирования. Недавно
дования в различных технологических процессах
расчеты образования «сухих» мицелл были прове-
[1-5]. Уже долгое время влияние воды на образо-
дены для C12E4 [18, 19], что повлияло и на выбор
вание обратных мицелл является предметом дис-
реактивов в данной работе. Речь идет о монодо-
куссии [6-19]. Несомненно, присутствие воды об-
дециловом эфире тетраэтиленгликоля, который в
легчает образование обратных мицелл и приводит
данном исследовании использовался в двух при-
к понижению критической концентрации мицел-
обретенных модификациях: C12E4 с чистотой 99%
лообразования (ККМ) [6, 13, 17]. Встречались и
и его известный коммерческий аналог Brij-30 с чи-
621
622
МОВЧАН и др.
стотой 98%. Последний содержит больше воды (до
сителя мы столкнулись при исследовании фтало-
1%), так что сравнительное изучение обоих препа-
цианинов [25-28]. Большая молекула красителя
ратов имело и принципиальное значение.
в растворе действует как нано-адсорбент [28] в
отношении ПАВ и способствует формированию
Для обратных мицелл немаловажным и до сих
мицеллоподобных частиц (мы назвали их «про-
пор еще дискуссионным [4] остается вопрос о су-
томицеллами») на основе солюбилизационного
ществовании ККМ. Само это понятие связано с
резкостью возникновения мицелл (то мицелл не
ядра. Сформировавшиеся протомицеллы ничем не
отличаются от обычных мицелл с солюбилизатом,
было совсем, а то вдруг их сразу много), а рез-
но образуются постепенно и при концентрациях
кость, в свою очередь, сильно зависит от числа
значительно ниже ККМ. Поэтому в наших иссле-
агрегации [17]. Для прямых мицелл характерны
дованиях нильского красного будет использовать-
числа агрегации порядка нескольких десятков, а
для обратных они могут быть в пределах одно-
ся как зонд и как возможный нано-адсорбент для
образования протомицелл.
го десятка или даже считанными единицами, что
делает мицеллообразование постепенным про-
Целью данной работы является изучение
цессом и ставит существование ККМ под вопрос.
агрегации C12E4 и Brij 30 в н-гептане методом
Например, в циклогексане число агрегации n для
электронной спектроскопии поглощения в при-
обратных мицелл Аэрозоля ОТ около 23, и мицел-
сутствии нильского красного. В работах [29, 30]
лообразование происходит так же резко, как и для
приведены спектры поглощения нильского крас-
прямых мицелл, а в случае C12E5 n ≈ 5 и переход
ного в гептане, а в [30] методом спектроскопии
свободных мономеров в мицеллы происходит по-
поглощения изучен переход свободных молекул
степенно [4].
нильского красного из гептана в обратные мицел-
В таких условиях ККМ в обычном понимании
лы анионного ПАВ. В данном исследовании мы
также неизбежно столкнемся с влиянием воды и
не существует, и в качестве ККМ используют кон-
другими проблемами, затронутыми во введении.
центрацию ПАВ, при которой мицеллы впервые
обнаруживаются. Очевидно, этот метод зависит от
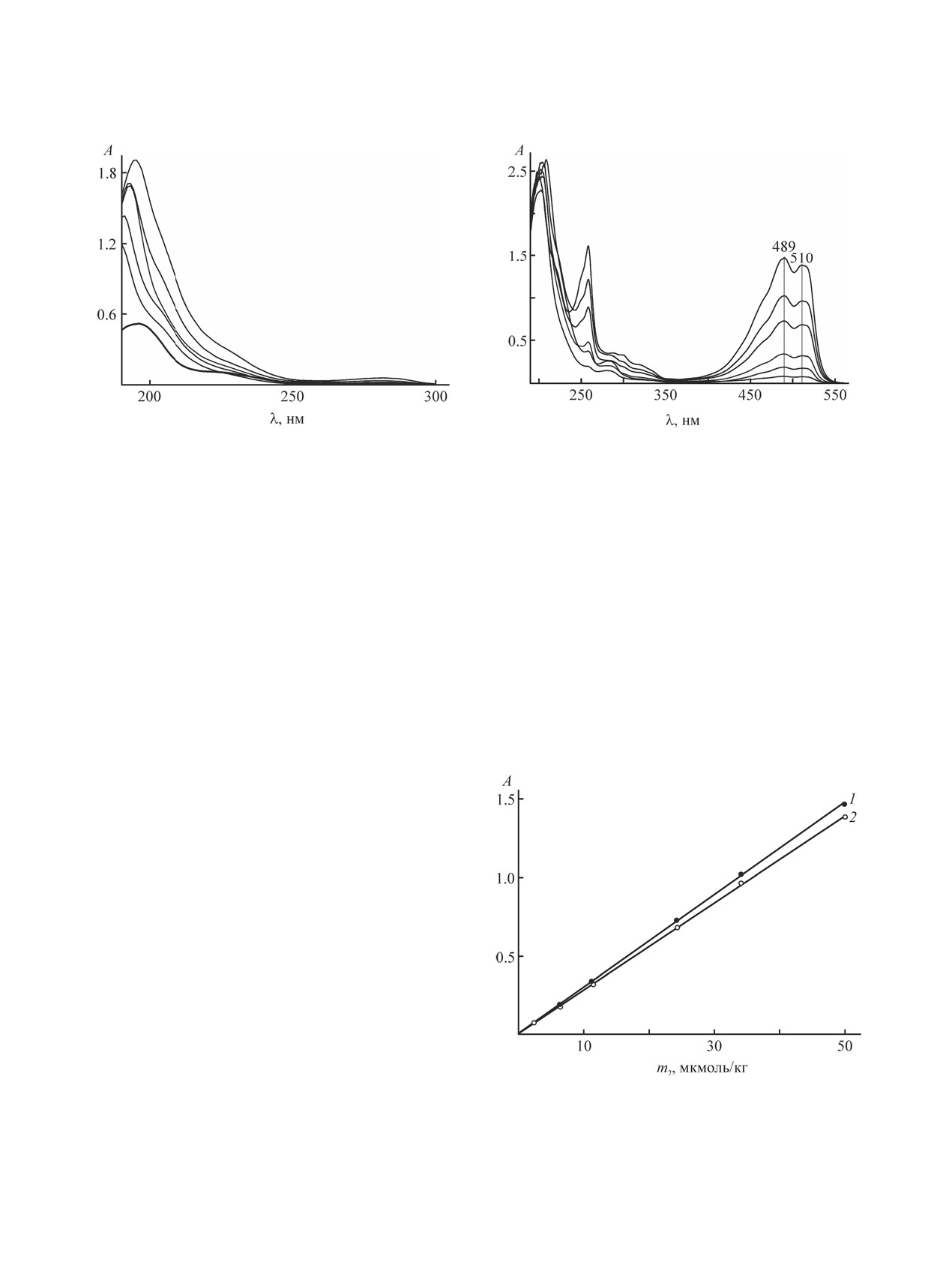
На рис. 1 показаны электронные спектры по-
чувствительности метода исследования мицеллоо-
глощения раствора С12Е4 в гептане в интервале
бразования. Ведь, согласно закону действия масс,
моляльности m1 0-300 ммоль/кг. Спектр чисто-
мицеллы существуют при любых концентрациях
го гептана (кривая 1) занимает сравнительно не-
ПАВ, только их концентрация может быть слиш-
большую область УФ диапазона с длиной волны
ком мала для обнаружения [20-22]. Для системы
λ 190-230 нм и имеет широкую полосу поглоще-
C12E4-гептан метод светорассеяния [1] дает при
ния, характерную для насыщенных углеводородов
25°C величины n = 9 и ККМ 2.3 г/100 мл. При
(алканов и циклоалканов) [31]. С увеличением кон-
переводе в моляльность ККМ составляет около
центрации С12Е4 в спектрах наблюдается усиление
0.0956
моль/кг (при плотности гептана
поглощения раствора, а при m1 ≥ 30 ммоль/кг -
0.6795 г/см3, а C12E4 - 0.946 г/мл и молекулярной
еще и незначительное смещение максимума поло-
массе 362.54). Для той же системы при 20°C ме-
сы (λmах) в сторону больших длин волн.
тод малоуглового рассеяния нейтронов [2] дает n =
Поговорим теперь об использовании нильского
10 и ККМ 4 мас% (моляльность m 0.115 моль/кг).
красного для исследования агрегации С12Е4 в орга-
Данные работ [1, 2] довольно близки, хотя в них
нической среде. Известно, что нильский красный
использовались разные реактивы. Будем иметь их
растворяется как в гептане (до 62 мкг/мл) [32], так
в виду при оценке наших результатов, полученных
и непосредственно в С12Е5 [23], близком по струк-
методом спектроскопии поглощения.
туре к С12Е4. Ввиду отклика нильского красного,
Наш метод также предполагает использова-
фиксируемого в спектрах поглощения в этих рас-
ние гидрофобного красителя нильского красного.
творителях, на изменение среды микроокружения,
Обычно красители используются в качестве зон-
было заманчивым использовать его в качестве
да для исследования внутримицеллярной среды.
зонда и в системе гептан-С12Е4 для исследования
В этой роли многократно выступал и нильский
агрегации неионного ПАВ методом спектроско-
красный [23, 24]. С совсем другой функцией кра-
пии поглощения.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 4 2022
ОБР
АТНЫЕ МИЦЕЛЛЫ И ПРОТОМИЦЕЛЛЫ МОНОДОДЕЦИЛОВОГО ЭФИРА
623
Рис. 1. Спектры поглощения С12Е4 в гептане при кон-
Рис. 2. Спектры поглощения в диапазоне длин волн
центрациях ПАВ (снизу вверх) m1, ммоль/кг: 0, 30.13,
400-550 нм растворов нильского красного в гептане
65.3, 131.4, 209.9 и 303.6. Длина оптического пути -
при концентрациях (снизу вверх) m2, мкмоль/кг: 2.4,
0.1 см.
6.4, 11.3, 24.2, 34.2 и 50.1. Длина оптического пути - 1 см.
Предварительно были получены электронные
максимума в видимом диапазоне, кроме присут-
спектры поглощения растворов нильского крас-
ствующих вблизи 489 и 510 нм. Концентраци-
ного в гептане (рис. 2) в интервале концентраций
онная зависимость оптической плотности (при
(m2) 2-50 мкмоль/кг. Видно, что спектры в УФ
489 нм) в растворителе от содержания нильского
диапазоне содержат узкую высокоинтенсивную
красного также соответствовала закону Ламберта-
полосу с максимумом около 200 нм и менее ин-
Бера. Согласно работе [33], нильского красного в
тенсивную - при 257 нм. В видимом диапазоне
гексане растворяется до мономеров, а положение
(400-550 нм), прозрачном для гептана, наблюда-
максимумов в его спектре поглощения находит-
ется широкая полоса с двумя максимумами (при
489 и 510 нм) и незначительным поглощением
выше 540 нм. Положение максимумов сохраняет-
ся во всем исследуемом интервале концентраций
нильского красного. На рис. 3 показана зависи-
мость оптической плотности А при λmax 489 (1) и
510 нм (2) от моляльности нильского красного (m2)
в интервале 2-50.1 мкмоль/кг. Линейный характер
обеих кривых указывает на отсутствие каких-ли-
бо агрегированных видов нильского красного [29,
30]. Угол их наклона является коэффициентом экс-
тинкции нильского красного в гептане и составля-
ет 2.96×104 и 2.79×104 кг/(моль·см) при λmax 489 и
510 нм соответственно.
Полученные данные о характере спектров и их
зависимости от концентрации нильского красно-
го хорошо согласуются с известными [29, 30, 33].
В работе [30], как и в нашем исследовании, с уве-
Рис. 3. Зависимость оптической плотности (А) раство-
личением содержания нильского красного не на-
ров нильского красного в гептане от его содержания
(m2) при длинах волн 489 (1) и 510 нм (2).
блюдали ни деформации, ни какого-либо нового
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 4 2022
624
МОВЧАН и др.
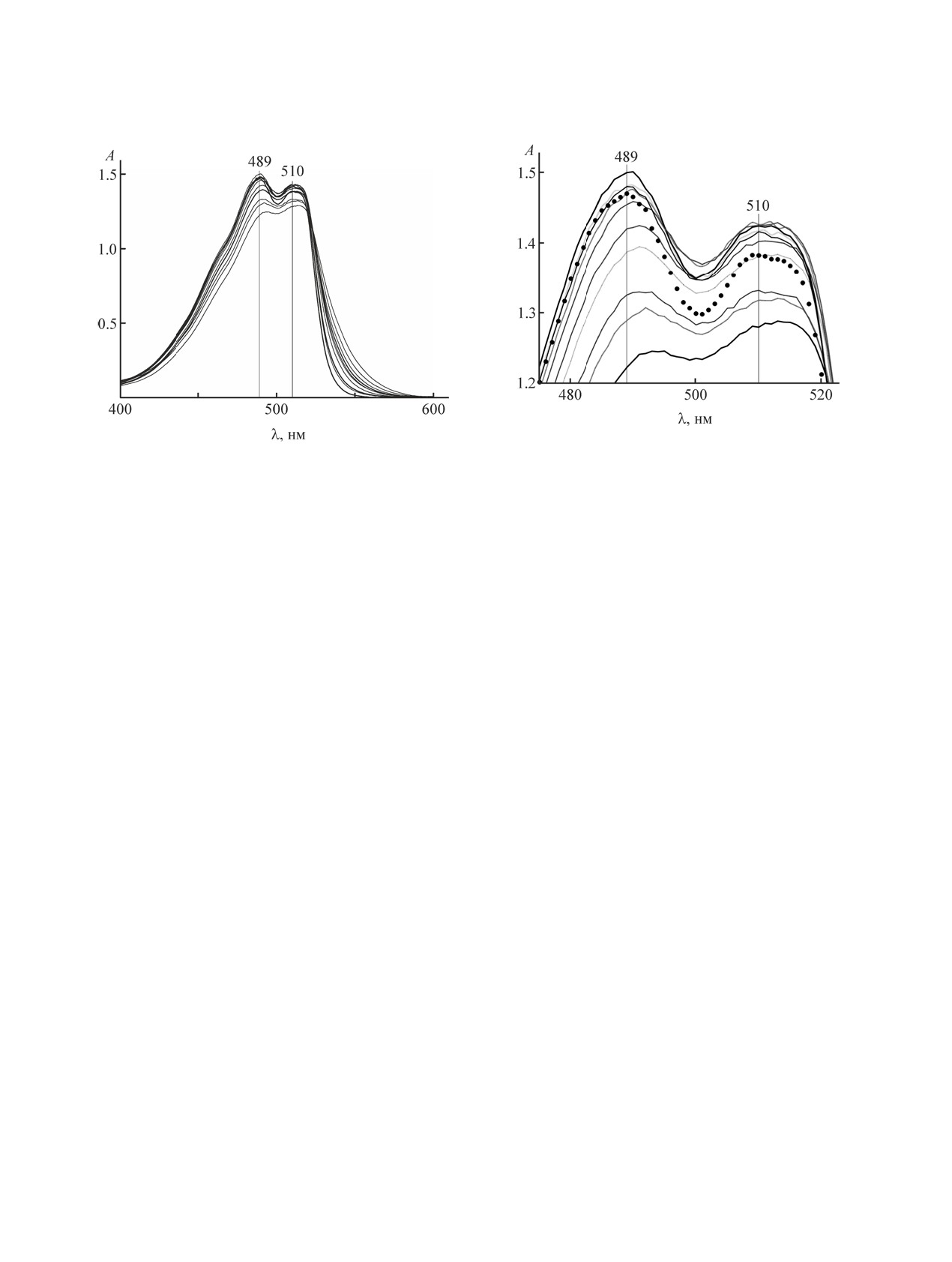
Рис. 5. Фрагмент спектров поглощения в диапазоне
Рис. 4. Спектры поглощения в диапазоне длин
длин волн 460-530 нм растворов нильского красного
волн 400-600 нм растворов нильского красного
(50.1 мкмоль/кг) в гептане в присутствии С12Е4 при
(50.1 мкмоль/кг) в гептане в присутствии С12Е4 при
концентрациях (сверху вниз), ммоль/кг: 28.9, 57.3,
концентрациях (сверху вниз), ммоль/кг: 28.9, 57.3,
44.2, 0 (●), 106.7, 127.1, 140, 156.2, 185.5, 202.1 и 243.7.
106.7, 0, 127.1, 140, 156.2, 185.5, 202.1 и 243.7.
Длина оптического пути - 1 см.
ся при 488 и 508 нм. В работе [34], наличие этих
Как следует из рис. 4 и 5, при добавлении С12Е4
максимумов объясняют присутствием мономер-
к гептану поглощение нильского красного при λ >
ных молекул красителя с различной ориентацией
520 нм увеличивается. В области 489 и 510 нм при
диэтиламиногруппы относительно плоской части
небольших количествах (примерно до 30 ммоль/кг)
молекулы. Они полагают, что первый (коротковол-
поглощение нильского красного немного усилива-
новый) максимум формируют молекулы с планар-
ется. Но с дальнейшим ростом содержания ПАВ
ной ориентацией диэтиламиногруппы, а второй - с
наблюдается снижение оптической плотности (А)
перпендикулярной.
в обоих (489 и 510 нм) максимумах, наиболее за-
метное после m1 127 ммоль/кг и небольшое сме-
Используя полученную информацию о спек-
щение их положения в более длинноволновую
трах поглощения нильского красного в гептане
область спектра. Поскольку снижение А в макси-
перейдем к системе С12Е4-гептан-нильский крас-
муме 489 нм происходит интенсивнее, чем при
ный с заданным (m2 50.1 мкмоль/кг) содержанием
510 нм, то при некоторой концентрации ПАВ соот-
нильского красного и переменной концентрацией
ношение значений оптической плотности в макси-
(m1) С12Е4. На рис. 4 и 5 приведены спектры по-
глощения этой системы в диапазоне длин волн
мумах изменяется на противоположное по сравне-
нию с исходным состоянием без ПАВ.
400-550 нм и интервале m1 0-250 ммоль/кг. Выбор
спектрального диапазона обусловлен прозрачно-
Более ярко эти изменения проявляются на раз-
стью в нем С12Е4 и гептана, а также возможностью
ностных спектрах поглощения нильского крас-
экспериментального наблюдения за изменения-
ного (в присутствии С12Е4 и без него). В частно-
ми (под влиянием ПАВ) поглощения нильского
сти, уже заметно появление небольшого пика при
красного в характерных для него максимумах. В
528 нм (рис. 6). При m1 > 127 ммоль/кг он становит-
исследованиях агрегации ПАВ с помощью спек-
ся более интенсивным, а его положение находится
троскопии поглощения красителя часто ориентиру-
вблизи 530 нм. В областях максимумов исходных
ются на максимумы в видимом диапазоне спектра
спектров (489 и 510 нм) в разностных спектрах на-
[35, 36].
блюдаются впадины, усиливающиеся по величи-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 4 2022
ОБР
АТНЫЕ МИЦЕЛЛЫ И ПРОТОМИЦЕЛЛЫ МОНОДОДЕЦИЛОВОГО ЭФИРА
625
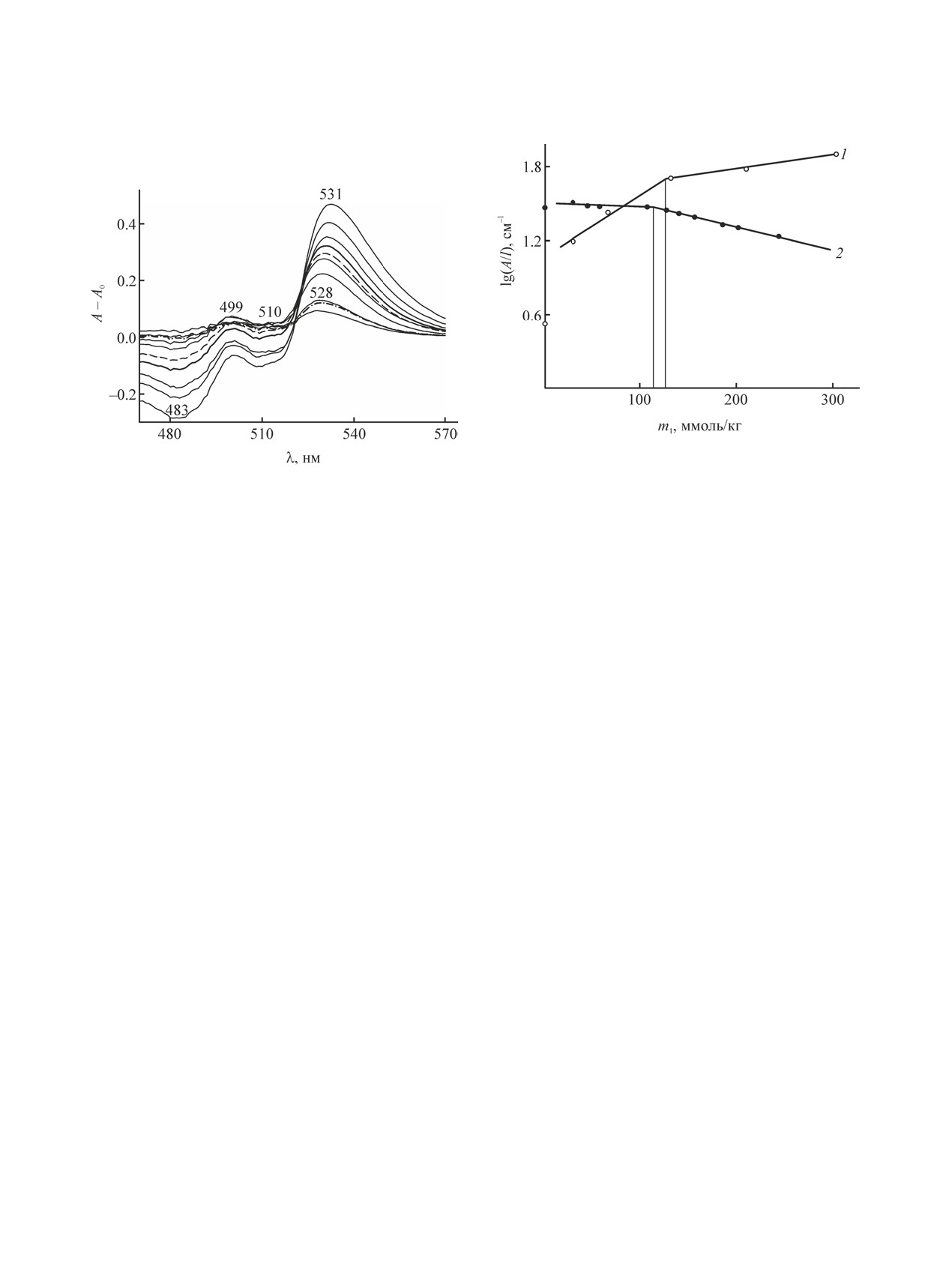
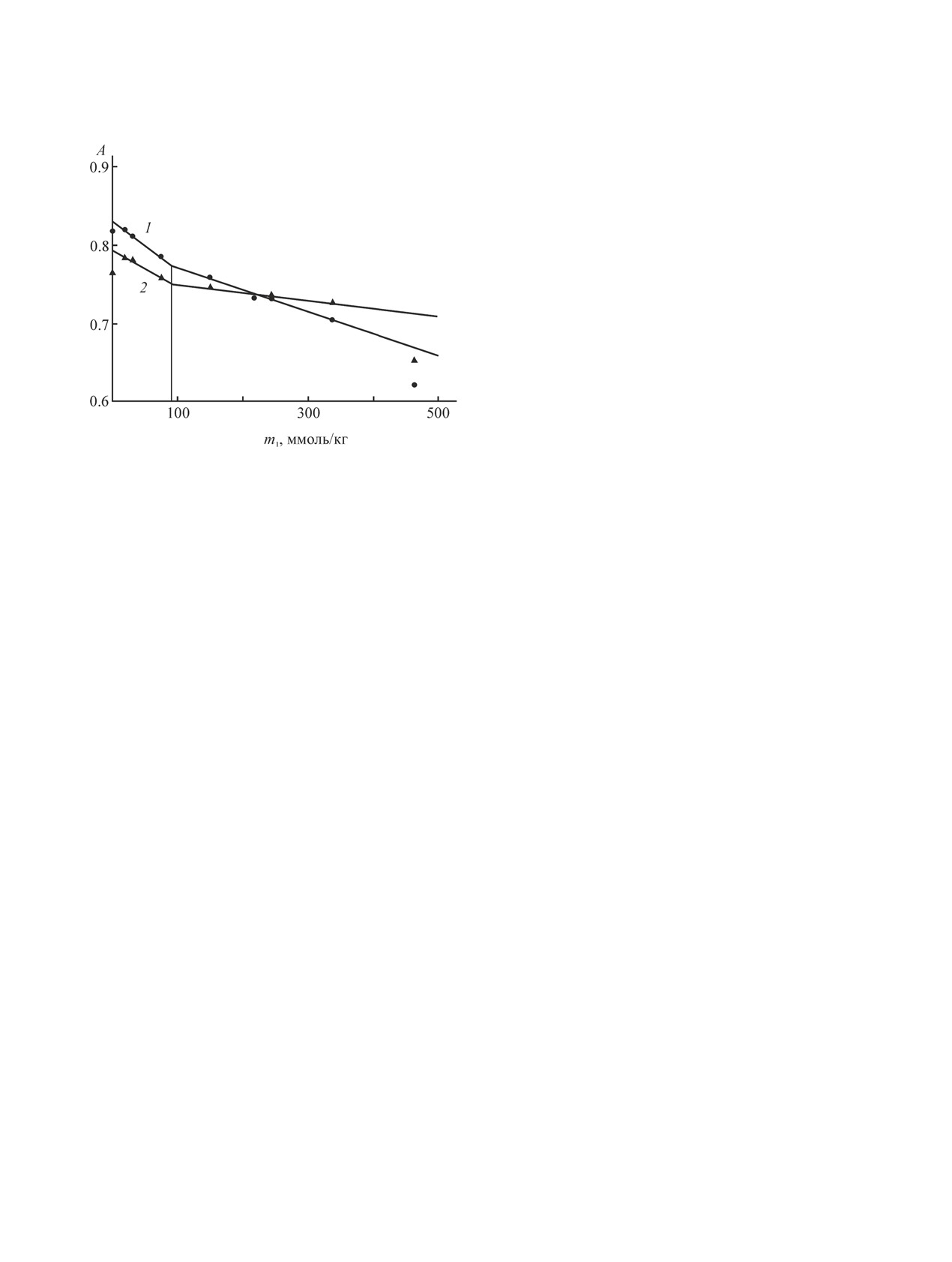
Рис. 7. Зависимость приведенной оптической плот-
ности lg(А/l) от содержания ПАВ (m1) в максимумах
Рис. 6. Разностные спектры поглощения нильского
поглощения С12Е4 в гептане (1) и нильского красного
красного (50.1 мкмоль/кг) в гептане, содержащем С12Е4
(50.1 мкмоль/кг) в растворе С12Е5 в гептане (2), полу-
при концентрациях, ммоль/кг (снизу вверх): 28.9, 44.2,
ченные на основе спектров поглощения рис. 1 и 5 (в
57.3, 106.7, 127.1, 140, 156.2, 185.5, 202.1 и 243.7.
области 489 нм).
не с ростом концентрации С12Е4. Подобные пики
тре нильского красного, находящегося в среде по-
и впадины в разностных спектрах поглощения
лиметилметакрилата при 535 нм.
нильского красного в гептане наблюдали авторы
На основе приведенных спектров и значений
[30] в присутствии анионного ПАВ. При содер-
оптической плотности А в точках максимумов
жании 90 мМ. бис(2-этилгексил)сульфосукцината
(при λmах) рассмотрим теперь зависимости lg(А/l),
натрия пик зонда находился при 533 нм. Его
где l - длина оптического пути, от концентрации
наличие объясняли положением молекул кра-
(m1) С12Е4 в гептане в отсутствие и в присутствии
сителя внутри обратных мицелл, а форми-
нильского красного (рис. 7). Кривая 1 построена
рование впадины в области
490-500 нм
-
по данным рис. 1 в отсутствие нильского красного.
уменьшением концентрации нильского красного в
Она не линейна и не проявляет резкого изменения
гептане вследствие миграции молекул красителя
А с ростом содержания ПАВ, что характерно для
из объема гептана внутрь обратных мицелл.
систем с небольшими числами агрегации (5-8 при
Исходя из этого, приходим к выводу, что наблю-
20°С [2] и 9 при 25°С). Нелинейный характер функ-
даемые под влиянием С12Е4 изменения в спектрах
ции lg(А/l) от m1 с отсутствием излома затрудняет
поглощения нильского красного в гептане объяс-
нахождение ККМ этого ПАВ по абсорбционным
няются с одной стороны уменьшением концентра-
спектрам. Заметим, что в случае бромидов цетил-
ции красителя в объеме растворителя, а с другой -
триметиламмония [37] и цетилпиридиния [38] зна-
небольшим увеличением полярности в микро-
чение ККМ в их водных растворах определялось
окружении зонда за счет его взаимодействия с
по излому на концентрационной кривой оптиче-
молекулами ПАВ или сформированными мицел-
ской плотности. Для С12Е4 в гептане мы попыта-
лами. Согласно [23], максимумы флуоресценции
емся лишь провести его оценку, для чего предста-
нильского красного при переходе от органическо-
вим экспериментальную зависимость lg(А/l) от m1
го растворителя (тетрадекана) к С12Е5 смещаются
в виде ломаной линии с двумя прямолинейными
в сторону больших длин волн. В работе [33] сооб-
отрезками (рис. 7, кривая 1). Эти отрезки хорошо
щается о наличии максимума поглощения в спек-
аппроксимируются уравнениями:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 4 2022
626
МОВЧАН и др.
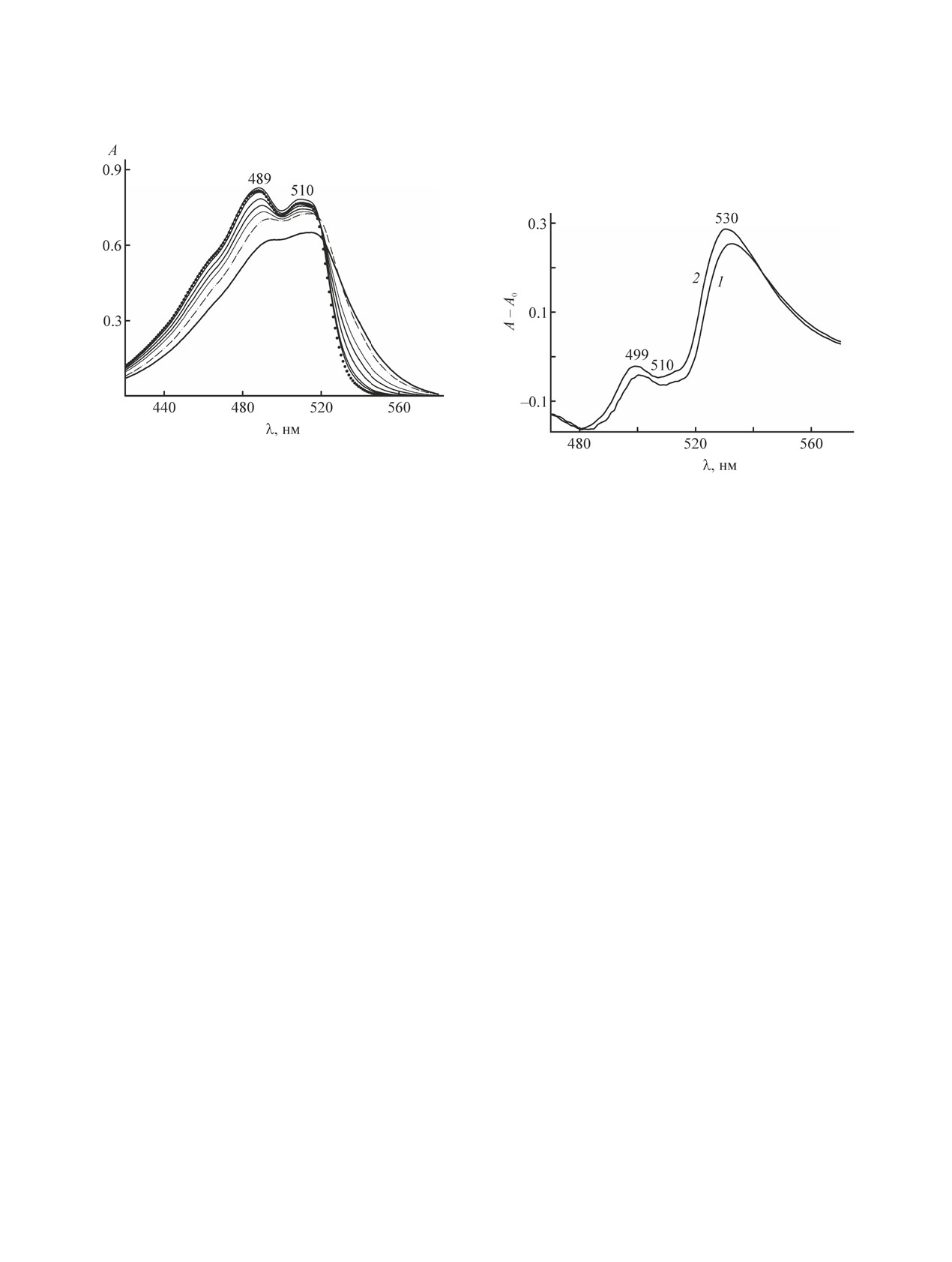
Рис. 8. Спектры поглощения растворов нильского крас-
ного (26.5 мкмоль/кг) в гептане в присутствии Brij 30
в диапазоне длин волн 420-580 нм при концентрациях
Рис. 9. Разностные спектры поглощения растворов
ПАВ (сверху вниз), ммоль/кг: 20, 0 (●), 30, 75, 148.6,
С12Е4 (1) и Brij 30 (2) в гептане в присутствии нильско-
217, 337.5 (штрих-пунктирная линия), 463.9. Длина
го красного (26.5 мкмоль/кг) при концентрации С12Е4 и
оптического пути - 1 см.
Brij 30 220 ммоль/кг.
lg(А/l) = 0.0015 m1 + 1.0428, R2 = 0.9628,
(1)
стью сформировавшаяся протомицелла ничем не
отличается от обычной мицеллы с солюбилизатом,
lg(А/l) = 0.0003 m1 + 1.1951, R2 = 0.9888.
(2)
а наличие последнего всегда понижает величину
ККМ [20-22]. Мы видим, что полученные резуль-
Решение системы уравнений (1) и (2) дает
таты подтверждают эту закономерность.
значение m1 126.6 ммоль/кг. Оно представляется
разумной величиной для ККМ, поскольку близ-
До сих пор мы обсуждали данные для наиболее
чистого препарата С12Е4. Теперь обратимся к дан-
ко к известным данным [1, 2]. Заметим, что ККМ
ным для Brij 30, влажному аналогу С12Е4, чтобы
С12Е4 в гептане намного больше ККМ в воде
оценить влияние воды. На рис. 8 показаны спек-
(0.075 ммоль/л), полученной методом флуоресцен-
тры поглощения гептановых растворов Brij 30 в
ции Пирена [39].
присутствии нильского красного (при концентра-
На основе спектров, приведенных на рис. 4 и
ции 26.5 мкмоль/кг). Прежде всего, следует отме-
5, построили зависимость оптической плотности
тить, что по форме и положению максимумов они
lg(А/l) от концентрации С12Е4, отвечающей макси-
похожи на спектры С12Е4 в гептане (в присутствии
муму поглощения нильского красного при 489 нм
нильского красного). Поскольку концентрация
(рис. 7, кривая 2). Эту зависимость можно пред-
красителя примерно в два раза меньше, то и зна-
ставить в виде линии с изломом при концентрации
чения оптической плотности в соответствующих
m1 110.6 ммоль/кг, что также можно трактовать как
максимумах - ниже. Но в УФ области поглощение
ККМ. На рис. 7 эта концентрация обозначена как
достаточно сильное, что затрудняет анализировать
ККМs, где индекс s отражает присутствие солюби-
влияние Brij 30 на поглощение нильского красно-
лизата в мицелле. Заметим, что если часть кривой
го. В видимом диапазоне спектра можно отметить
1 левее ККМ соответствует мономерам С12Е4, то
ту же тенденцию смещения максимумов в сторо-
такая же часть кривой 2 отвечает протомицеллам,
ну больших длин волн (493 и 516 нм) и снижения
образующимся на молекулах нильского красного
оптической плотности по мере увеличения содер-
в роли нано-адсорбента [28]. Величина ККМ на
жания Brij 30 в системе. На разностных спектрах
обеих кривых имеет один и тот же смысл и от-
(при одинаковой концентрации ПАВ и нильского
носится к мицеллообразованию С12Е4. Но полно-
красного) пик в области 530 нм в случае Brij 30
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 4 2022
ОБР
АТНЫЕ МИЦЕЛЛЫ И ПРОТОМИЦЕЛЛЫ МОНОДОДЕЦИЛОВОГО ЭФИРА
627
тральном поведении нильского красного в гептане
в присутствии С12Е4 и Brij 30 может быть связано
с влиянием воды, присутствующей в препаратах в
незначительном, но разном количестве, на процес-
сы агрегации молекул ПАВ в гептане.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования ассоциации в гептане неионных
ПАВ типа СnЕm проводили на примере монододе-
цилового эфира тетраэтиленгликоля С12Е4 (99%,
Sigma Aldrich). Кроме того, исследовали и его ком-
мерческий аналог - Brij 30 (Acros Organics) с со-
держанием основного вещества 98% и воды менее
1%. В качестве растворителя ПАВ использовали
н-гептан (99.8%, Sigma Aldrich, d 0.6795 г/см3),
Рис. 10. Определение ККМ в гептановых растворах
который использовали без дальнейшей очистки.
Brij 30 с помощью нильского красного при концентра-
В качестве зонда, чувствительного к изменениям
ции 26.5 мкмоль/кг на основе спектров поглощения в
в микроокружении при локализации в обратных
области максимумов 489 (1) и 510 нм (2).
мицеллах ПАВ, использовали сольватохромный
краситель: 9-диэтиламино-5H-бензо[α]феноксази-
немного выше, чем у С12Е4 (рис. 9).
нон-5 (нильский красный, 99%, Acros Organics).
На основе данных, полученных из спектров
Главной методикой в исследованиях являлась
рис. 8, на рис. 10 построена зависимость опти-
спектрофотометрия - измерение оптической плот-
ческой плотности А растворов Brij 30 в гептане
ности A раствора в зависимости от длины свето-
с присутствием нильского красного при длинах
вой волны λ и наблюдение за характерными дли-
волн, отвечающих максимуму поглощения ниль-
нами волн при изменении концентрации С12Е4 в
ского красного в области 489 (кривая 1) и 510 (кри-
отсутствие или в присутствии нильского красного.
вая 2) от концентрации (m1). Пересечение отрезков
Для выявления характерной длины волны и коэф-
на линиях 1 и 2, принятое за ККМ, дает значения
фициента экстинкции мономеров нильского крас-
m1 ≈ 90 ммоль/кг. Оно заметно меньше, чем у
ного в н-гептане предварительно были зарегистри-
С12Е4. Известно, что добавление воды к обратным
рованы спектры поглощения растворов красителя
мицеллам всегда приводит к понижению ККМ
в интервале концентраций m2 6-50.1 мкмоль/кг.
[6, 17]. Таким образом, наши эксперименталь-
Поскольку плотность гептана отличается от еди-
ные данные подтверждают и эту закономерность.
ницы, то приготовленные растворы весовым спо-
Тут может возникнуть вопрос, правомерно ли де-
собом удобнее было выражать в моль/кг, как это
лать такой вывод, если концентрация нильского
представлено в работе [2], а не в моль/л, где в рас-
красного в этом сравнении не одна и та же (50.1
четах концентрации нужно было учитывать значе-
и 26.5 мкмоль/кг). Как уже было отмечено выше,
ние плотности растворителя.
солюбилизация нильского красного приводит к
Измерения спектров поглощения растворов
снижению ККМ ПАВ, а потому, если бы эффекта
С12Е4 в н-гептане проводили в интервале кон-
воды не было, ККМ для Brij 30 была бы, наоборот,
центраций ПАВ m1 30-305 ммоль/кг. В системах
выше, чем для С12Е4. Таким образом, именно вли-
С12Е4-нильский красный-гептан и Brij 30-ниль-
яние воды приводит к наблюдаемому результату.
ский красный-гептан концентрации нильского
красного были постоянными и составляли 50.1 и
Таким образом, исследование системы н-геп-
тан-С12Е4-нильский красный методом спек-
26.5 мкмоль/кг соответственно, а содержание ПАВ
троскопии поглощения показало возможность
изменялось в диапазоне 20-500 ммоль/кг.
формирования обратных мицелл без заметного
Растворы С12Е4 в гептане в присутствии ниль-
добавления воды. Наблюдаемое различие в спек-
ского красного (m2 = const) с изменяющимися кон-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 4 2022
628
МОВЧАН и др.
центрациями ПАВ (m1) готовили путем разбавле-
СПИСОК ЛИТЕРАТУРЫ
ния исходного раствора (m1 243.7 ммоль/кг и m2
1.
Смирнова А.В., Корецкий А.Ф., Соколовская Н.А. //
50.1 мкмоль/кг) раствором нильского красного (с2
Коллоид. ж. 1976. Т. 38. № 4. С. 726.
50.1 мкмоль/кг) в гептане без ПАВ, что обеспечи-
2.
Ravey J.C., Buzier M., Picot J.C. // J. Colloid Interface
вало постоянство в содержании нильского красно-
Sci. 1984. Vol. 97. N 1. P. 9. doi 10.1016/0021-
9797(84)90269-8
го в системах с ПАВ переменной концентрации. В
3.
Correa N.M., Silber J.J., Riter R.E., Levinger N.E. //
случае Brij 30 исходный раствор содержал ПАВ в
Chem. Rev. 2012. Vol. 112. P. 4569. doi 10.1021/
количестве m1 337.5 ммоль/кг, нильского красного -
cr200254q
m2 26.5 мкмоль/кг. Разбавление же осуществля-
4.
Smith G.N., Brown P., Rogers S.E., Eastoe J. //
лось раствором нильского красного в гептане при
Langmuir. 2013. Vol. 29. P. 3252. doi 10.1021/
la400117s
m2 26.5 мкмоль/кг.
5.
Kurtanidze M., Butkhuzi T., Rukhadze M., Kokiashvili N.,
В процессе приготовления и подготовки раство-
Bezarashvili G., Marcus J., Werner K., Sigua K. //
ров к измерениям следили за минимальным време-
Colloids Surf. (A). 2017. Vol. 519. P. 98. doi 10.1016/j.
colsurfa.2016.05.024
нем их контакта с воздухом (использовали сосуды
6.
Eicke H.-F., Christen H. // Helv. Chim. Acta. 1978.
и кюветы с плотно закрывающимися крышками,
Vol. 61. P. 2258. doi 10.1002/hlca.19780610631
периодически измеряли их массу), чтобы миними-
7.
Ruckenstein E., Nagarajan R. // J. Phys. Chem. 1980.
зировать погрешности в расчетах значений НПАВ
Vol. 84. P. 1349. doi 10.1021/j100448a013
8.
Nagarajan R., Ruckenstein E. // Langmuir. 1991.
из-за летучести растворителя.
Vol. 7. P. 2934. doi 10.1021/la00060a012
Спектры поглощения систем регистрирова-
9.
Chowdhary J., Ladanyi B.M. // J. Phys. Chem. (B).
ли при комнатной температуре (25°C), используя
2009. Vol. 113. P. 15029. doi 10.1021/jp906915q
спектрофотометр Unico UV-2800 и кварцевые
10.
Fathi H., Kelly J.P., Vasquez V.R., Graeve O.A. //
Langmuir. 2012. Vol. 28. P. 9267. doi 10.1021/la300586f
кюветы с длиной оптического пути l 0.1 и 1 см (в
11.
Lemyre J.-L., Lamarre S., Beauprế A., and Ritcey A.M. //
зависимости от концентрации раствора) и плотно
Langmuir. 2010. Vol. 26. N 13. P. 10524. doi 10.1021/
закрывающимися крышками по методике, описан-
la100541m
ной в работе [40].
12.
Bradley-Shaw J.L., Camp P.J., Dowding P.J.,
Lewtas K. // J. Phys. Chem. (B). 2015. Vol. 119. N 11.
ИНФОРМАЦИЯ ОБ АВТОРАХ
P. 4321. doi 10.1021/acs.jpcb.5b00213
13.
Khoshnood A., Firoozabadi A. // Langmuir. 2015. Vol.
Мовчан Тамара Григорьевна, ORCID: https://
31. N 22. P. 5982. doi 10.1021/la504658u
orcid.org/0000-0001-6249-6732
14.
Smith G.N., Brown P., James C., Rogers S.E.,
Eastoe J. // Colloids Surf. (A). 2016. Vol. 494. P. 194.
Русанов Анатолий Иванович, ORCID: https://
doi 10.1016/j.colsurfa.2016.01.020
orcid.org/0000-0002-8972-1220
15.
Eskici G., Axelsen P.H. // J. Phys. Chem. (B). 2016. Vol.
Плотникова Елена Валерьевна, ORCID: https://
120. P. 11337. doi 10.1021/acs.jpcb.6b06420
orcid.org/0000-0002-3265-3917
16.
Urano R., Pantelopulos G.A., Straub J.E. // J. Phys.
Chem. (B). 2019. Vol. 123. N 11. P. 2546. doi 10.1021/
ФОНДОВАЯ ПОДДЕРЖКА
acs.jpcb.8b07847
17.
Русанов А.И. // Коллоид. ж. 2020. Т. 82. № 5. С. 604;
Работа выполнена в рамках государственного
Rusanov A.I. // Colloid J. 2020. Vol. 82. N 5. P. 560. doi
задания Министерства науки и высшего образо-
10.1134/S1061933X20050130
18.
Волков Н.А., Щёкин А.К., Посысоев М.В., Ерош-
вания РФ по теме Физико-химические пробле-
кин Ю.А., Аджемян Л.Ц. // Тезисы докл. межд. науч.
мы создания эффективных нано- и супрамоле-
конф. «Современная химическая физика на стыке
кулярных систем (регистрационный номер темы
физики, химии и биологии». Черноголовка: ИПХФ
122011300052-1) при частичной финансовой под-
РАН, 2021. С. 418.
держке Российского фонда фундаментальных ис-
19.
Щёкин А.К., Аджемян Л.Ц., Ерошкин Ю.А.,
следований (проект № 20-03-00641).
Волков Н.А. // Коллоид. ж. 2022. Т. 84. № 1. С. 114.
doi 10.31857/S0023291222010128
КОНФЛИКТ ИНТЕРЕСОВ
20.
Русанов А.И. Мицеллообразование в растворах по-
верхностно-активных веществ. СПб: Химия, 1992.
А.И. Русанов является главным редактором
21.
Rusanov A.I. Micellization in Surfactant Solutions.
Журнала общей химии. Остальные авторы заявля-
Chemistry Reviews. Reading: Harwood Academic
ют об отсутствии конфликта интересов.
Publ., 1996. Vol. 22. Pt 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 4 2022
ОБР
АТНЫЕ МИЦЕЛЛЫ И ПРОТОМИЦЕЛЛЫ МОНОДОДЕЦИЛОВОГО ЭФИРА
629
22.
Русанов А.И., Щёкин А.К. Мицеллообразование в
33. Dutta A.K., Kamada K., Ohta K. // J. Photochem.
растворах поверхностно-активных веществ. СПб:
Photobiol. (A). 1996. Vol. 93. P. 57. doi 10.1016/1010-
Лань, 2016.
6030(95)04140-0
23.
Hungerford G., Castanheira E.M.S., Real Olivei-
34. Алексеева В.И. Закирина А.М., Ибраев Н.Х., Ма-
ra E.C.D., da Graҫua Miguel М., Burrows H.D. // J.
ринина Л.Е., Савина Л.П. // ЖФХ. 2005. Т. 79. С.
Phys. Chem. (B). 2002. Vol. 106. N 16. P. 4061. doi
497; Alekseeva V.I., Marinina L.E., Savvina L.P., Zikiri-
10.1021/jp013047v
na A.M., Ibraev N.Kh. // Russ. J. Phys. Chem. (A). 2005.
24.
Stuart M.C.A., van de Pas J.C., Engberts J.B.F.N. // J.
Vol. 79. N 3. P. 415.
Phys. Org. Chem. 2005. Vol. 18. P. 929. doi 10.1002/
35. Гайнанова Г.А., Валеева Ф.Г., Кушназарова Р.А.,
poc.919
Бекмухаметова А.М., Захаров С.В., Миргородская
25.
Русанов А.И., Мовчан Т.Г., Плотникова Е.В. // До-
А.Б., Захарова Л.Я. // ЖФХ. 2018. Т. 92. № 7. С. 1159;
кл. РАН. Химия, науки о материалах. 2020. Т. 425.
Gaynanova G.A., Valeeva F.G., Kushnazarova R.A.,
С. 60; Rusanov A.I., Movchan T.G., Plotnikova E.V. //
Bekmukhametova A.M., Zakharov S.V., Mirgorodskaya
Doklady. Phys. Chem. 2020. Vol. 495. P. 181. doi
A.B., Zakharova L.Ya. // Russ J. Phys. Chem. (A). 2018.
10.1134/S0012501620120027
Vol. 92. N 7 P. 1400. doi 10.1134/S0036024418070129
26.
Мовчан Т.Г., Русанов А.И. Плотникова Е.В. //
36. Rehman A., Usman M., Bokhari T.H., Abd Ur
Коллоид. ж. 2021. Т. 83. № 3. С. 335; Movchan T.G.,
Rahman H.M., Mansha A., Siddiq M., Rasheed A.,
Rusanov A.I., Plotnikova E.V. // Colloid. J. 2021.
Un Nisa M. // Colloids Surf. (A). 2020. Vol. 586.
Vol. 83. P. 356. doi 10.1134/S1061933X21030121
P. 124241. doi 10.1016/j.colsurfa.2019.124241
27.
Мовчан Т.Г., Русанов А.И. Плотникова Е.В. //
37. Мовчан Т.Г., Плотникова Е.В., Усьяров О.Г. //
Коллоид. ж. 2021. Т. 83. № 4. С. 443; Movchan T.G.,
Коллоид. ж. 2013. Т. 75. № 3. С. 351; Movchan T.G.,
Rusanov A.I., Plotnikova E.V. // Colloid. J. 2021.
Plotnikova E.V., Us’yarov, O.G. // Colloid. J. 2013.
Vol. 83. P. 468. doi 10.1134/S1061933X21040062
Vol. 75. P. 319. doi 10.1134/S1061933X13030137
28.
Rusanov A.I. // Colloids Surf. (A). 2021. Vol. 629.
38. Greksáková O., Oremusová J., Vojteková M.,
P. 127453. doi 10.1016/j.colsurfa.2021.127453
Kopecký F. // Chem. Pap. 1994. Vol. 48. N 5. P. 300.
29.
Ray A., Das S., Chattopadhyay N. // ACS Omega. 2019.
Vol. 4. P. 15. doi 10.1021/acsomega.8b02503
39. Mohr A., Talbiersky P., Korth H.-G., Sustmann R., Boese R.,
30.
Datta A., Mandal D., Pal S. K., Bhattacharyya K. // J.
Blaser D., Rehage H. // J. Phys. Chem. (B). 2007. Vol.
Phys. Chem. (B). 1997. Vol. 101. P. 10221. doi 10.1021/
111. N 45. P. 12985. doi 10.1021/jp0731497
jp971576m
40. Мовчан Т.Г., Плотникова Е.В., Соболева И.В.,
31.
Свердлова О.В. Электронные спектры в органиче-
Русанов А.И. // Коллоид. ж. 2017. Т. 79. № 3.
ской химии. Л.: Химия: 1973. 248 с.
С. 313; Movchan T.G., Plotnikova E.V., Soboleva I.V.,
32.
Greenspan P., Fowler S.D. // J. Lipid Res. 1985. Vol. 26.
Rusanov A.I. // Colloid. J. 2017. Vol. 79. P. 368. doi
P. 781.
10.1134/S1061933X17030115
Reverse Micelles and Protomicelles of Tetraethylene Glycol
Monododecyl Ether in Systems with Heptane and Nile Red
T. G. Movchana,*, A. I. Rusanova,b, and E. V. Plotnikovaa
a A. N. Frumkin Institute of Physical Chemistry and Electrochemistry, Russian Academy of Sciences, Moscow, 119071 Russia
b Mendeleev Center, St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: movchan_tamara@mail.ru
Received February 16, 2022; revised February 26, 2022; accepted February 28, 2022
The processes of micellization in the systems tetraethylene glycol monododecyl ether (C12E4)-heptane (1) and
C12E4-nile red-heptane (2) have been studied by electron absorption spectroscopy. In system 1, reverse micelles
of small size appear, which makes it difficult to find the critical micelle concentration (CMC). In this regard,
a method for determining CMC based on spectroscopic data was tested. The same was done for system 2,
where the appearance of nile red as a C12E4 nano-adsorbent leads to the formation of protomicelles below the
CMC. The CMC itself in system 2 turns out to be lower than the CMC in system 1, which corresponds to the
predictions of the theory. The role of water in the formation of reverse micelles was studied using a commercial
analogue of C12E4 preparation Brij 30 (with a water content of 1%). The results obtained are consistent with
theoretical predictions.
Keywords: tetraethylene glycol monododecyl ether, Brij 30, nile red, n-heptane, absorption spectra, reverse
micelles, protomicelles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 4 2022