ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 5, с. 818-832
УДК 621.039.85;546.185;546.681
СРАВНИТЕЛЬНАЯ ОЦЕНКА СВОЙСТВ
АМИНОПОЛИФОСФОНАТОВ КАК ХИМИЧЕСКИХ
ПРЕДШЕСТВЕННИКОВ РАДИОФАРМПРЕПАРАТОВ С
САМАРИЕМ-153
© 2022 г. Г. Е. Кодинаa, А. Я. Марукb, О. Е. Клементьеваa, Ю. А. Митрофановa,*,
А. О. Малышеваa, А. С. Лунёвa, К. А. Лунёваa, Г. С. Цебриковаb,
В. Е. Баулинc, В. В. Рагулинc
a Государственный научный центр Российской Федерации «Федеральный медицинский биофизический центр
имени А. И. Бурназяна», Живописная ул. 46, Москва, 123098 Россия
b Институт физической химии и электрохимии имени А. Н. Фрумкина Российской академии наук, Москва, 119991 Россия
c Институт физиологически активных веществ Российской академии наук, Черноголовка, 142432 Россия
*e-mail: mitrofanoff.yura@yandex.ru
Поступило в редакцию 3 декабря 2021 г.
После доработки 20 марта 2022 г.
Принято к печати 24 марта 2022 г.
Проведено сравнительное исследование условий комплексообразования группы лигандов, содержащих
фосфоновые группировки (ациклических и цикленсодержащих), с самарием-153, предложены методы
контроля радиохимической чистоты образующихся комплексов и установлен характер их биологического
поведения. Отмечено, что основным критерием в выборе соединения радионуклида в качестве активной
фармацевтической субстанции для создания радиофармацевтического лекарственного препарата является
его биологическое поведение.
Ключевые слова: радиофармацевтический препарат, радионуклидная терапия, самарий-153, полифос-
фонаты, биораспределение
DOI: 10.31857/S0044460X22050183, EDN: CLAEZN
Системная радионуклидная терапия болевого
0.81 МэВ) в схеме распада радионуклида имеют-
синдрома при метастатическом поражении скелета
ся γ-кванты (Еγ 103 кэВ), что позволяет проводить
с использованием радиофармацевтических препа-
визуализацию распределения радиофармпрепара-
ратов стронция-89 и самария-153 хорошо известна
та в период лечения [1]. Самарий-153 получают
и успешно применяется уже почти тридцать лет.
облучением в ядерном реакторе обогащенного (до
Стронций-82 используют в виде изотонического
99%) самария-152.
раствора стронция [89Sr] хлорида (Metastron®), а
Препарат Quadramet®, основой которого яв-
радиофармацевтические препараты самария-153,
ляется комплекс самария-153 с этилендиаминте-
способного гидролизоваться в области физиологи-
траметиленфосфонатом (1, ЭДТФ) (схема 1), был
чески приемлемых значений рН раствора, получа-
одобрен Управлением по санитарному надзору за
ют в виде комплексных соединений с лигандами,
качеством пищевых продуктов и медикаментов
содержащими аминометилфосфоновые фрагменты.
(FDA, США) к медицинскому применению в конце
Период полураспада радионуклида сама-
1990 годов [2] и до настоящего времени успешно
рий-153 Т1/2 46.3 ч. Наряду с β--излучением (Emax
применяется в онкологической клинике во многих
818
СР
АВНИТЕЛЬНАЯ ОЦЕНКА СВОЙСТВ АМИНОПОЛИФОСФОНАТОВ
819
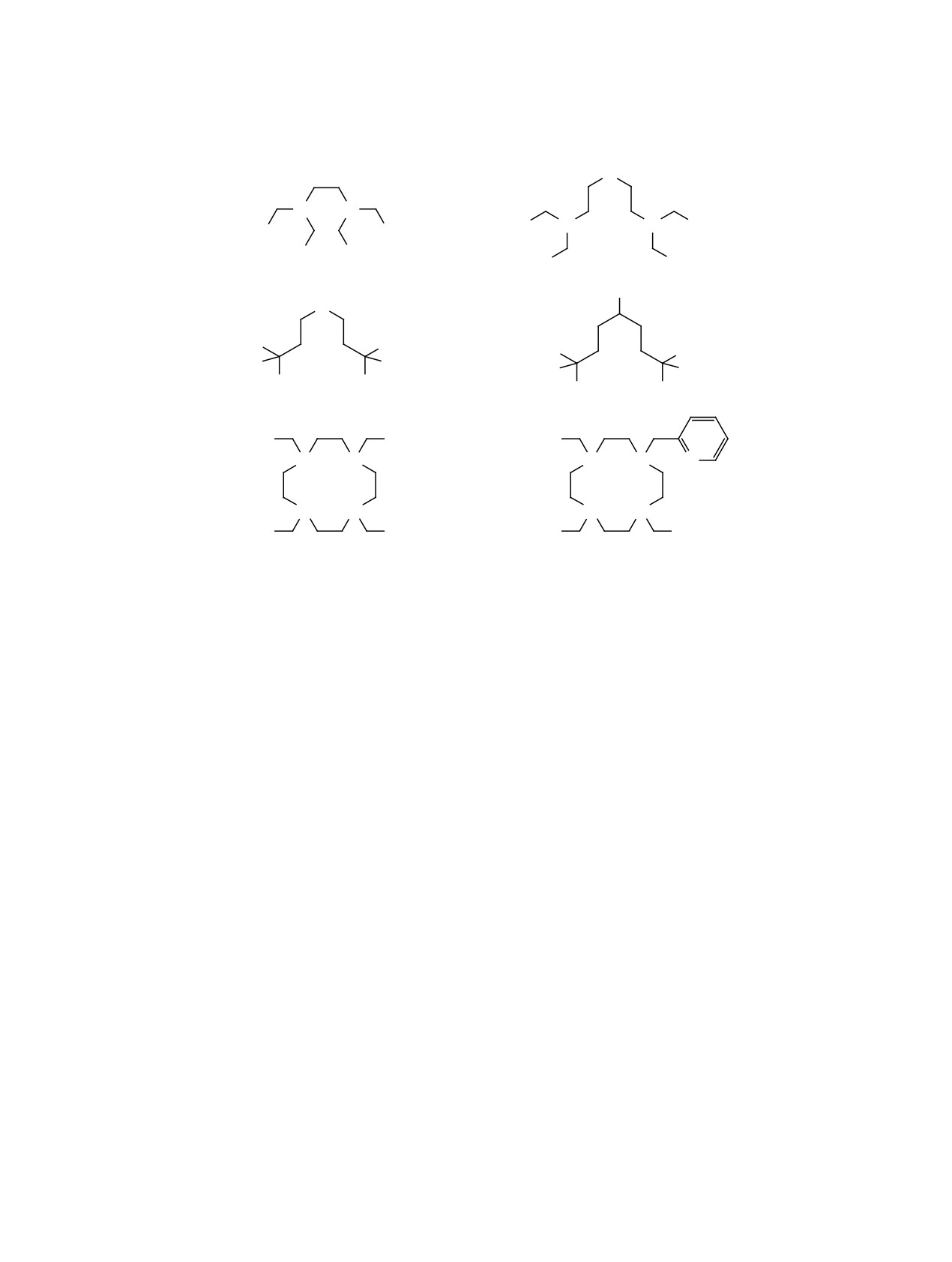
Схема 1.
O
N N
(HO)2OP
N
N
PO(OH)2
(HO)2OP
PO(OH)2
(HO)2OP
PO(OH)2
1
(HO)
2
PO(OH)2
2OP
COOH
O
(HO)2OP
PO(OH)2
(HO)2OP
PO(OH)2
(HO)2OP
PO(OH)2
(HO)2OP
PO(OH)2
NH2
NH2
NH2
NH2
3
4
(HO)2OP
PO(OH)2
(HO)2OP
N
N
N
N
N
N N
N N
(HO)2OP
PO(OH)2
(HO)2OP
PO(OH)2
5
6
странах мира при лечении рака легких, предста-
плексов самария-153, в том числе как основы осте-
тельной железы, молочной железы, остеосарко-
отропных радиофармацевтические препараты.
мы и некоторых других [3-6]. В России с 2001 г.
Хорошие результаты были получены [13-18] для
выпускаются радиофармацевтические препараты
соединений, содержащих циклический хелатор
«Самарий,
153Sm оксабифор», на основе ок-
ДОТА
[1,4,7,10-тетраазациклододекан-1,4,7,10-
са-бис(этиленнитрило)тетраметиленфосфоновой
тетракис(метиленфосфоновая кислота)], в кото-
кислоты 2 (схема 1), который также до настояще-
ром карбоксильные группы заменены фосфоно-
го времени успешно применяется в медицинских
выми (5, схема 1). Однако получение комплексов
организациях нашей страны и некоторых государ-
радионуклидов с ДОТА-содержащими лигандами
ствах СНГ [7-10].
связано, по данным некоторых исследований, с
необходимостью нагревания реакционной смеси
Известно, что в последние годы наблюдается
в течение определенного времени (20-30 мин при
рост онкологической заболеваемости [11] и, соот-
75-95°C [17, 18]), в то время как ациклические по-
ветственно, увеличение частоты случаев метаста-
лифосфонаты способны к образованию комплек-
зирования в скелет. Это, по данным маркетинго-
сов при комнатной температуре.
вых исследований [12], стимулирует некоторый
рост применения технологий радионуклидной
При исследовании взаимодействия стабиль-
терапии для обезболивания при метастазах в ске-
ного самария с ациклическими лигандами 2 и 3
лет в целом, и на основе радиофармацевтические
(схема 1) методом ЯМР на ядрах 1H, 13C и 31P [19]
препараты самария-153 в частности, где к 2024 г.
было сделано предположение о перспективно-
прогнозируется увеличение спроса примерно на
сти применения нового лиганда 3 для получения
10% по сравнению с 2019 г. При этом, несмотря
остеотропных радиофармацевтических препара-
на повсеместное применение этого радионуклида
тов самария-153. Поскольку комплексы галлия-68
практически в виде единственного препарата, в
с цикленсодержащими лигандами 5 и 6 облада-
оригинальной литературе постоянно появляются
ют остеотропными свойствами [20], то изучение
сведения о результатах исследования других ком-
комплексов этих лигандов с самарием-153 также
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
820
КОДИНА и др.
Таблица 1. Хроматографические системы, использованные для анализа препаратов самария-153
Rf
Неподвижная
№
Подвижная фаза
фаза
1
Whatman № 2
H2O-EtOH-Py,
0
0.95±0.05
0.4±0.4
0.4±0.4
-
-
4:2:1
2
Целлюлозаа
2.4% HCl-ацетон-Hacac,
0.0±0.1
0.0±0.1
0.0±0.1
0.0±0.1
-
-
0.8:7:0.5
3
Whatman № 2
0.1 об% TFA в смеси
0.7±0.2
0.1±0.1
0.0±0.1
0.0±0.1
-
-
H2O-MeCN, 1:1
4
iTLC-SGб
H2O-EtOH-Py, 4:1:2
0.1±0.1
0.95±0.05
0.7±0.3
0.95±0.05
0.95±0.05
0.95±0.05
5
iTLC-SGб
10% AcONH4aq-MeOH, 1:1
0.9±0.1
0.25±0.15
0.2±0.2
0.2±0.2
0.5±0.2
0.5±0.2
а Целлюлоза на алюминиевой подложке (105574, Merck KGaA, Германия).
б Полоски стекловолокна, импрегнированного силикагелем (Agilent Technologies, Inc., США).
представляет интерес. В настоящей работе прове-
153Sm (как в ионной форме, так и комплексов)
дено сравнительное исследование условий ком-
было аналогично: самарий-153, связанный с фос-
плексообразования группы лигандов, содержащих
фонатами (включая [153Sm]Sm-2), воспроизводимо
фосфоновые группировки, с самарием-153 и био-
остается на старте хроматограммы, а хлорид сама-
логического поведения полученных комплексов.
рия-153 продвигается с фронтом растворителя в
виде достаточно узкого пика. Однако в сравнении
Оценка радиохимической чистоты и ста-
с хроматограммами препаратов 68Ga наблюдаемые
бильности препаратов с ациклическими лиган-
пики были асимметричны и уширены. Помимо
дами. Система № 1 (табл. 1) в течение многих лет
этого, анализ в данной системе занимает боль-
применяется для определения радиохимической
шее время в сравнении с анализами в системах с
чистоты препарата «Самарий, 153Sm оксабифор»
использованием полосок стекловолокна, импрег-
[7] и препаратов самария-153 с ЭДТФ [21-26], од-
нако анализ в данной системе занимает продолжи-
нированного силикагелем (iTLC-SG): 30-40 мин
против 5-10 мин соответственно. Поэтому в на-
тельное время (до 120 мин) и для его выполнения
стоящей работе для анализа радиохимической чи-
требуется наличие свежеперегнанного пиридина.
стоты препаратов 153Sm как с ациклическими, так
Система № 2 была использована ранее [27] для
и с циклическими лигандами были использованы
оценки радиохимической чистоты [68Ga]Ga-3: сво-
бодный 68Ga (в ионной форме) в данной системе
системы № 4 и 5. Отмечено, что при получении
комплексов самария-153 с ациклическими лиган-
движется с фронтом, в то время как комплекс с 3
дами нагревание реакционной смеси не требуется.
остается на старте. В отношении комплексов из-
учаемых соединений с 153Sm данная система ока-
Система № 4 аналогична системе № 1, упо-
залась неприменима, так как активность 153Sm
мянутой ранее. Основное отличие заключается в
остается на старте хроматограммы независимо от
использовании iTLC-SG вместо хроматографиче-
его химической формы. Система № 3 также была
ской бумаги и некотором изменении объемного со-
выбрана исходя из результатов экспериментов с
отношения используемых растворителей. Данные
[68Ga]Ga-4
[27]: Rf свободного 68Ga составляет
модификации позволили сократить время анализа
0.85±0.05, а комплекса c лигандом 4 - 0.0±0.1. В
с 2.5 ч до 15-20 мин с сохранением характерных
данной системе хроматографическое поведение
черт получаемых хроматограмм: несвязанный са-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
СР
АВНИТЕЛЬНАЯ ОЦЕНКА СВОЙСТВ АМИНОПОЛИФОСФОНАТОВ
821
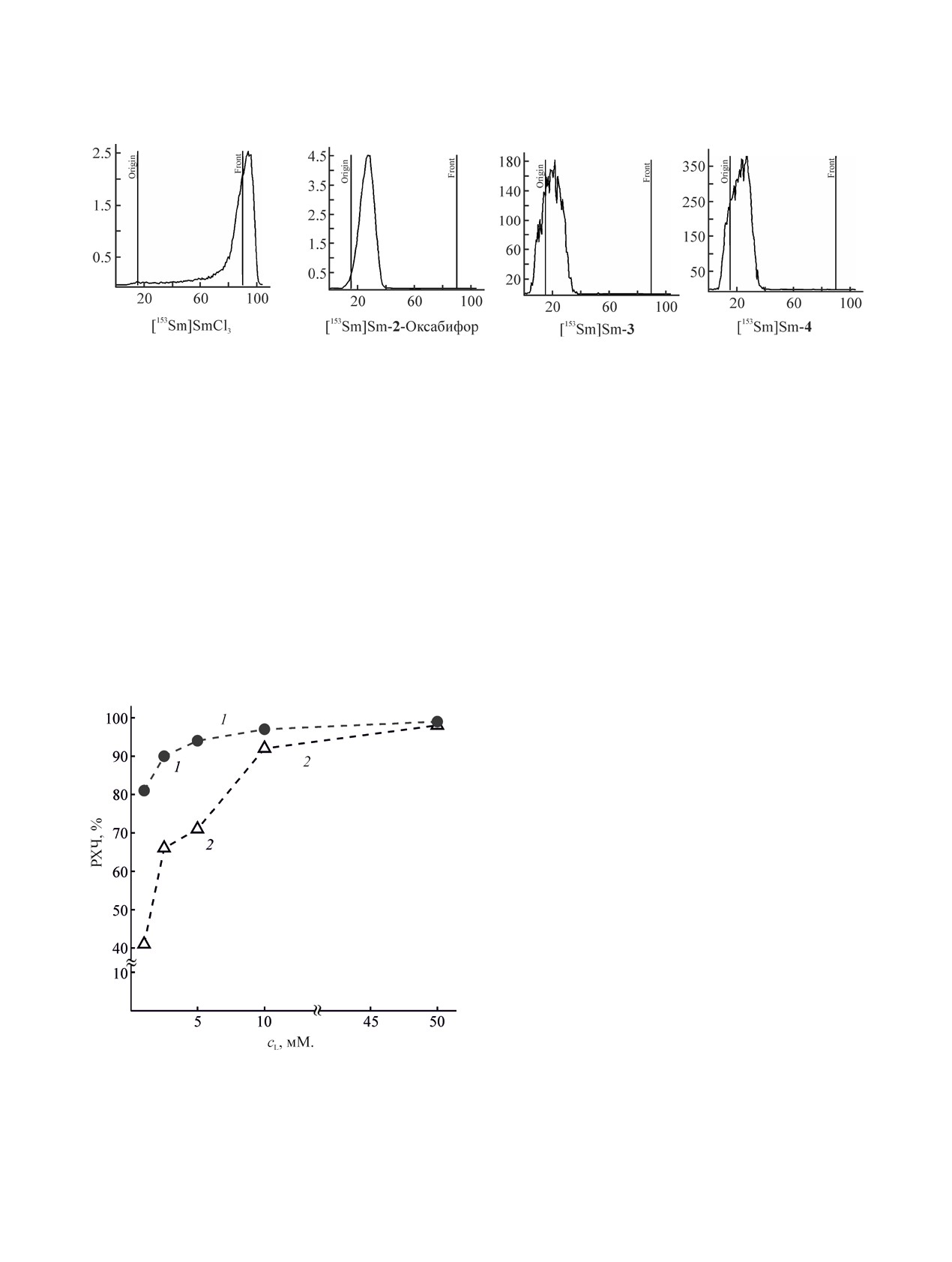
Рис. 1. Вид хроматограмм в системе № 5: iTLC-SG/10% AcONH4-метанол, 1:1. [153Sm]Sm-2-Оксабифор.
марий-153 остается на старте хроматограммы, в то
комплекс 68Ga, который в условиях анализа под-
время как комплексы с изучаемыми лигандами в
вергается гидролизу и остается на старте хрома-
основном движутся с фронтом растворителя.
тограммы [29]. Логично ожидать гидролиза сама-
рия в присутствии ацетата аммония (для системы
Система № 5 была выбрана на основе литера-
№ 5 pH элюента ~7), однако в наших эксперимен-
турных данных об аналогичных системах. Так,
тах этого не наблюдалось (рис. 1).
например, в работах [21-26, 28] при использова-
нии системы iTLC-SG (или Whatman № 2) 10%
Радиохимическая чистота полученных препа-
AcONH4:метанол = 1:1 для контроля качества
ратов самария-153 с лигандами 3 и 4 (с с3/4 50 мМ.)
исходного раствора самария-153 хлорида пока-
оставалась на уровне не ниже 95% в течение 7 сут
зано, что вся активность остается на старте хро-
после получения. Анализ смесей препаратов с сы-
матограммы. Также данная система используется
вороткой крови в соотношении 1:1 не выявил зна-
для оценки количества несвязанного в целевой
чимых изменений в величине радиохимической
чистоты.
Интересно, что при проведении «ДТПА-чел-
ленджа» [30] вид хроматограмм препаратов, со-
держащих
[153Sm]Sm-3 и
[153Sm]Sm-4, после
добавления диэтилентриаминпентауксусной кис-
лоты (ДТПА), количество которой при этом рав-
но количеству лиганда в препарате, не меняется в
течение 4 ч, а [153Sm]Sm-2 подвергается полному
перелигандированию с образованием комплексов
[153Sm]Sm-ДТПА практически мгновенно.
Исследования препаратов с более низкими кон-
центрациями лигандов (с добавлением 200 мМ.
ацетата натрия в качестве буферного агента, рис. 2)
показали, что радиохимическая чистота выше 90%
достигается в препарате [153Sm]Sm-4 при кон-
центрации лиганда ≥ 5 мМ., в то время как для
[153Sm]Sm-3 концентрация лиганда должна состав-
лять ≥ 10 мМ. Но при этом [153Sm]Sm-4 сохраняет-
ся в неизменном виде в смеси с сывороткой только
Рис. 2. Зависимости радиохимической чистоты (РХЧ,
при конечной концентрации 4 10 мМ. в смеси.
%) комплексов [153Sm]Sm-4 (1) и [153Sm]Sm-3 (2) от
концентрации лиганда (рН 5.5±0.5, концентрация аце-
Исследование комплексообразования са-
тата - 0.2 М.).
мария с цикленсодержащими лигандами при
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
822
КОДИНА и др.
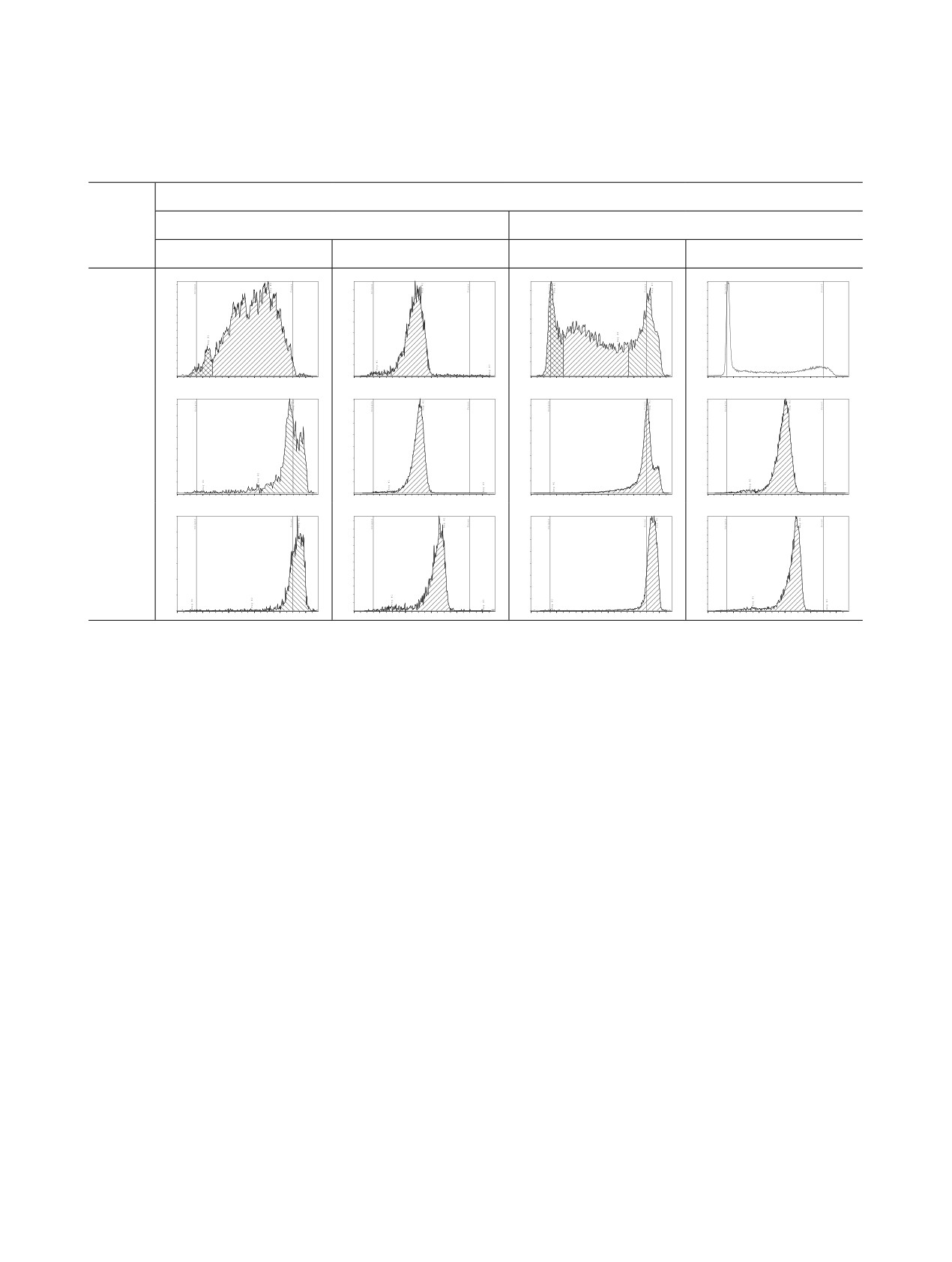
Таблица 2. Влияние температуры на комплексообразование самария-153 с лигандом 5
Инкубирование при 25°C
Инкубирование при 95°C
с5, мМ.
система № 4
система № 5
система № 4
система № 5
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-RT-sys1-1.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-RT-sys2-1.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-95-sys1-1.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-95-sys2-1.rta
180 C/mm
TLC
180
C/mm
TLC
C/mm
TLC
160
C/mm
TLC
160
300
160
140
140
250
140
120
120
120
200
100
100
100
0.1
80
80
80
150
60
60
100
60
40
40
40
20
20
50
20
0
0
2020
40
60
80
100
mm
0
0
20
40
60
80
100
mm
0
0
20
40
60
80
100
mm
0
0
20
40
60
80
100
mm
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-RT-sys1-6.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-RT-sys2-6.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-95-sys1-6.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-95-sys2-6.rta
C/mm
TLC
120 C/mm
TLC
300 C/mm
TLC
220
C/mm
TLC
220
110
200
100
250
200
180
90
180
160
80
200
160
140
70
140
120
60
150
120
10
100
50
100
80
40
100
80
60
30
60
40
20
50
40
20
10
20
0
0
0
0
0
20
40
60
80
100
mm
0
20
40
60
80
100
mm
0
2020
40
60
80
100
mm
0
20
40
60
80
100
mm
различных условиях. При исследовании связыва-
При низких концентрациях лиганда
5
ния 153Sm с лигандом 5 в системе № 5 наблюдали
(≤ 0.5 мМ.) в системе № 4 наблюдается уширение
появление второго пика на хроматограммах, что,
тыльной стороны пика с Rf ≈ 1 и применимость
вероятно, связано с образованием двух форм ком-
данного метода для оценки радиохимической чи-
плекса: первая, основная, характеризуется фак-
стоты становится сомнительной. Совокупность
тором удерживания Rf ≈ 0.5, а вторая - Rf ≈ 0.2.
результатов ТСХ-анализа в системах № 4 и 5 го-
ворит о высокой хелатирующей способности
Согласно результатам анализа в этой системе, при
лиганда 5 по отношению к 153Sm, и для связыва-
25°C и концентрации лиганда 5 0.1 мМ. более 90%
ния более 90% радионуклида достаточно с5 ≥ 2 и
самария-153 связывается с лигандом. При этом в
≥ 0.5 мМ. при 25 и 95°C соответственно. Наличие
системе № 4 практически вся активность наблю-
двух пиков на хроматограммах комплекса 153Sm с
дается на фронте хроматограммы, что говорит в
пользу предположения об образовании двух форм
комплекса.
Таблица 3. Хроматограммы образцов [153Sm]Sm-5 с с5
При увеличении температуры до 95°C содер-
0.1 и 10 мМ. в сравнении с 153SmCl3 через 2 сут выдер-
жание формы комплекса с Rf ≈ 0.2 становится
живания при комнатной температуре
незначительным и на хроматограммах в системе
с5, мМ.
Система № 4
Система № 5
№ 5 наблюдается единственный пик с Rf ≈ 0.5. Од-
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-RT-sys1-x.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-RT-sys2-x.rta
C/mm
TLC
450 C/mm
TLC
250
400
нако при дальнейшем выдерживании реакцион-
350
200
300
150
250
ной смеси при комнатной температуре в образце
153SmCl3
200
100
150
50
100
с концентрацией лиганда 10 мМ. наблюдается по-
50
0
0
2020
4040
6060
80
100
100
mm
00
20
40
60
80
100
mm
степенный обратный переход комплекса из одной
Integration C:\GINA_Star_TLC\ITLC-100-15\01072021-306-sys1-1.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\01072021-306-sys2-1.rta
80
C/mm
TLC
C/mm
TLC
формы в другую, и тем интенсивнее, чем выше
70
120
60
100
50
80
концентрация лиганда и ниже pH (см. ниже) (25°C,
0.1
40
60
30
20
40
система № 5, табл. 2). Аналогично в образце с с5
10
20
0
0
2020
40
6060
8080
100
mmmm
00
20
40
60
80
100
mm
1 мМ. спустя 2 сут образуется вторая форма, но
Integration C:\GINA_Star_TLC\ITLC-100-15\01072021-306-sys1-6.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\01072021-306-sys2-6.rta
C/mm
TLC
C/mm
TLC
180
180
в количестве лишь около 8%. При этом согласно
160
160
140
140
120
120
100
100
результатам анализа в системе № 4, более 95% са-
10
80
80
60
60
мария-153 находится в связанном с лигандом 5 со-
40
40
20
20
0
0
2020
4040
60
8080
100100
mm
0
0
20
40
60
80
100
mm
стоянии (табл. 3).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
СР
АВНИТЕЛЬНАЯ ОЦЕНКА СВОЙСТВ АМИНОПОЛИФОСФОНАТОВ
823
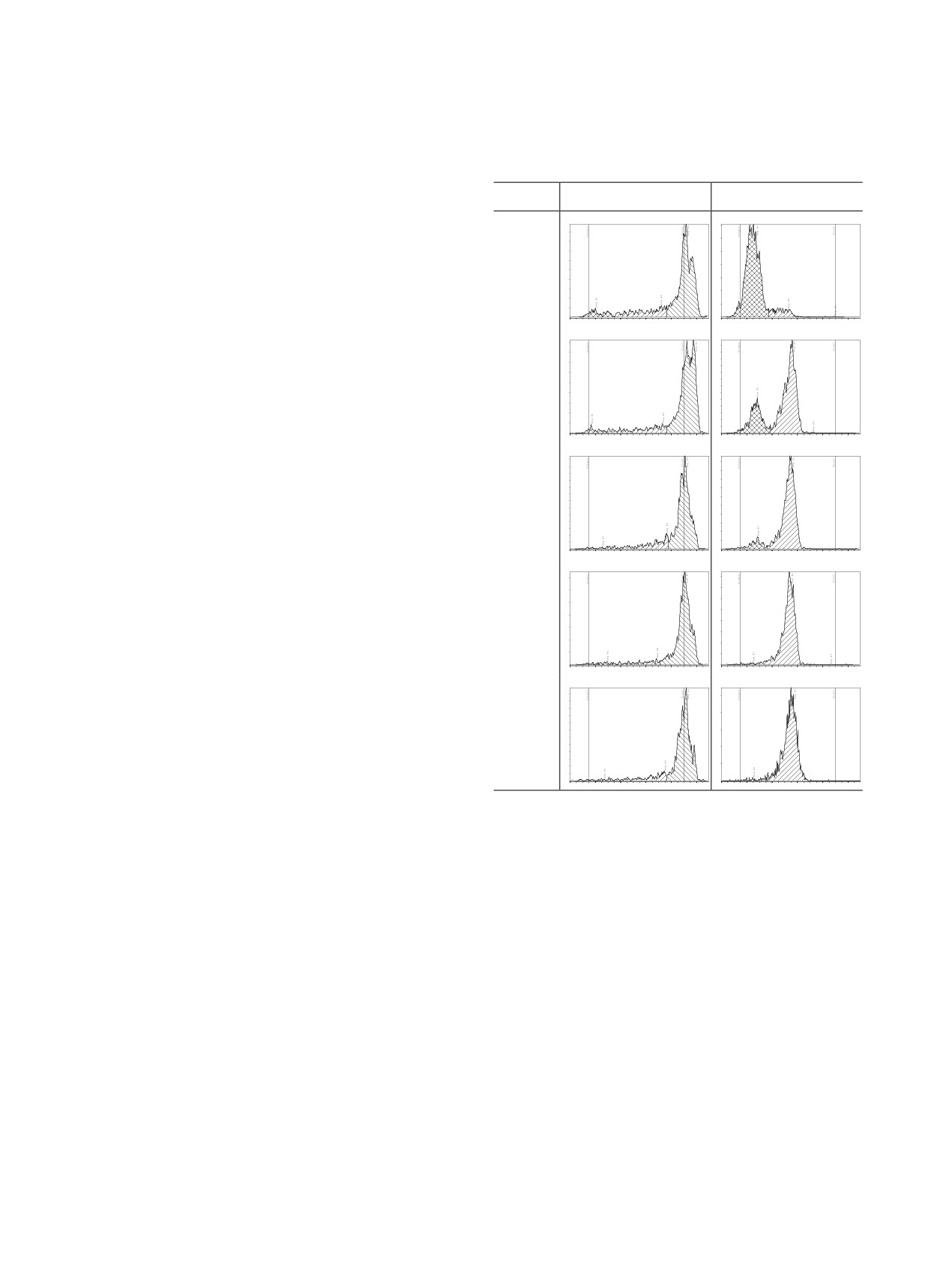
Таблица 4. Влияние содержания изотопного носителя на эффективность связывания 153Sm с лигандом 5 при его
различной концентрации
Расчетная концентрация носителя, сSm, мМ.
с5, мМ.
0.1
1
система № 4
система № 5
система № 4
система № 5
Integration C:\GINA_Star_TLC\ITLC-100-15\010720241-153SmDOTP-sys1-1.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\010720241-153SmDOTP-sys2-1.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\010720241-153SmDOTP-sys1-5.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\010720241-153SmDOTP-sys2-5.rta
120
C/mm
TLC
C/mm
TLC
C/mm
TLC
5.50 C/mm *1000
TLC
110
400
300
5.00
100
350
4.50
90
250
4.00
300
80
200
3.50
70
250
3.00
0.01
60
200
150
2.50
50
40
150
2.00
100
1.50
30
100
20
50
1.00
10
50
0.50
0
0
0
0.00
0
20
40
60
80
100
mm
0
2020
40
60
80
100
mm
0
20
40
60
80
100
mm
0
20
40
60
80
100
mm
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-95-sys1-4.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-95-sys2-4.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\010720241-153SmDOTP-sys1-2.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\010720241-153SmDOTP-sys2-2.rta
C/mm
TLC
1.60 C/mm *1000
TLC
C/mm *1000
TLC
1.10
C/mm *1000
TLC
160
3.50
1.40
1.00
140
3.00
0.90
120
1.20
0.80
1.00
2.50
0.70
100
2.00
0.60
1.0
80
0.80
0.50
60
0.60
1.50
0.40
40
0.40
1.00
0.30
0.20
20
0.20
0.50
0.10
0
0
20
40
60
80
100
mm
0.000
20
40
60
80
100
mm
0.000
20
40
60
80
100
mm
0.000
20
40
60
80
100
mm
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-95-sys1-6.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\30-06-2021-153SmDOTP-95-sys2-6.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\010720241-153SmDOTP-sys1-4.rta
Integration C:\GINA_Star_TLC\ITLC-100-15\010720241-153SmDOTP-sys2-4.rta
300 C/mm
TLC
220
C/mm
TLC
C/mm *1000
TLC
1.30
C/mm *1000
TLC
200
1.40
1.20
250
1.10
180
1.20
160
1.00
200
1.00
0.90
140
0.80
10.0
150
120
0.80
0.70
100
0.60
80
0.60
0.50
100
0.40
60
0.40
40
0.30
50
0.20
0.20
20
0.10
0
0
20
40
60
80
100
mm
0
0
20
40
60
80
100
mm
0.000
20
20
40
60
80
100
mm
0.000
20
40
60
80
100
mm
лигандом 5 в системе № 5 при 25°C может быть
Известно, что соединение 5 в комплексах с ланта-
связано с образованием так называемых in-cage
ноидами преимущественно образует TSA-изомер
и out-of-cage форм комплекса, т. е. катион сама-
[40, 42], который не координирует дополнитель-
рия может быть связан с одной или несколькими
ные молекулы воды, однако равновесие между
фосфоновыми группами лиганда без внедрения в
изомерами в растворе зависит от многих факторов
полость макроцикла, а может быть связан и с ато-
[43], в том числе от температуры, рН и природы
мами азота макроцикла, и с фосфоновыми груп-
растворителя. Вероятно, нам удалось подобрать
пами. Подобное явление (образование комплексов
условия, позволяющие косвенно наблюдать в рас-
in-cage/out-of-cage) описано для комплексов тре-
творе два изомера [153Sm]Sm-5.
хвалентных элементов с ДОТА-производными
Предполагая наличие второй формы комплек-
[31-35]. Поскольку для лиганда 6 на хромато-
са в случае [153Sm]Sm-5, следует особо отметить,
граммах присутствует лишь один пик, то вероятно
что судить о радиохимической чистоте образца не
также и образование двух форм комплекса, разли-
вполне корректно ввиду изменения соотношения
чающихся только взаимным расположением боко-
форм комплекса в зависимости от времени, темпе-
вых заместителей и конформацией макроцикла:
ратуры и pH реакционной смеси. Более правиль-
квадратная антипризма и (square antiprism, SA) и
ным является указание на отсутствие несвязанно-
скрученная квадратная антипризма (twisted square
го с лигандом самария в определенных условиях.
antiprism, TSA). Для комплексов лантаноидов и ит-
Количественное
(≥95%) связывание
153Sm
трия с ДОТА и ее производными, в том числе фос-
с лигандом 6 (95°C, 15 мин, pH 5-6, 0.2 М. аце-
форилированными, образование подобных изо-
тат) происходит уже при концентрации хелатора
меров обнаружено методом ЯМР и подтверждено
0.01 мМ. Стоит, однако, отметить, что концентра-
данными рентгеноструктурного анализа [36-39].
ция носителя самария в препаратах в 25 раз ниже
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
824
КОДИНА и др.
по сравнению с таковой в исходном растворе хло-
Таблица 5. Результаты анализа образцов [153Sm]Sm-5
рида самария-153. Радиохимическая чистота сме-
при различном pH (с5 0.5 мМ.)
сей [153Sm]Sm-6 при с6 ≥ 0.1 мМ. и pH 5-6 в тече-
pH
Система № 4
Система № 5
ние 2 сут сохраняется на уровне ≥96%.
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys1-1.rta
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys2-1.rta
C/mm
TLC
140 C/mm
TLC
180
160
120
Таким образом, комплексы самария с исследуе-
140
100
мыми цикленсодержащими лигандами проявляют
120
80
2.4
100
80
60
схожее хроматографическое поведение в исполь-
60
40
40
зованных системах, однако химические формы
20
20
0
0
20
20
40
60
80
100
mm
0
0
20
40
60
80
100
mm
[153Sm]Sm-6 (если таковые образуются) не разде-
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys1-2.rta
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys2-2.rta
180
C/mm
TLC
130
C/mm
TLC
ляются на хроматограмме, в отличие от [153Sm]
160
120
140
110
Sm-5.
100
120
90
100
80
3.7
70
Содержание носителя. Существенная раз-
80
60
60
50
40
ница наблюдается только для образцов с с5
40
30
20
20
10
0.01 мМ.: при увеличении объемной активности
0
0
20
20
40
60
80
100
mm
0
0
20
40
60
80
100
mm
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys1-3.rta
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys2-3.rta
в 10 раз (до 93 МБк/мл, а концентрации носителя
130
C/mm
TLC
C/mm
TLC
200
120
180
110
до 1 мМ. соответственно) наблюдается снижение
100
160
90
140
80
120
радиохимической чистоты. В системе № 4 появля-
70
5.0
60
100
50
80
ется узкий пик на старте и уширенный пик с Rf ≈
40
60
30
40
20
0.1 (в сумме ≥ 70%), что характерно для свободно-
10
20
0
0
0
20
20
40
60
80
100
mm
0
20
40
60
80
100
mm
го самария. Более того, в системе № 5 отсутствует
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys1-4.rta
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys2-4.rta
140
C/mm
TLC
160
C/mm
TLC
пик с Rf ≈ 0.5, соответствующий содержанию ком-
140
120
120
плекса (табл. 4). Схожая картина наблюдается при
100
100
80
5.9
80
анализе таких же образцов с лигандом 6: радиохи-
60
60
40
40
мическая чистота образца с с6 0.01 мМ. составляет
20
20
около 25%.
0
0
2020
40
60
80
100
mm
0
0
20
40
60
80
100
mm
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys1-5.rta
Integration
C:\GINA_Star_TLC\ITLC-100-15\01072021-27-sys2-5.rta
C/mm
TLC
C/mm
TLC
Кислотность среды. Для оценки влияния кис-
120
250
110
100
лотности среды на эффективность связывания
90
200
80
70
150
153Sm с лигандами изменяли соотношение объе-
12.3
60
50
100
40
мов растворов 0.1 М. NaOH, 0.1 М. HCl и деио-
30
20
50
низованной воды, сохраняя при этом постоянными
10
0
0
2020
40
60
80
100
mm
0
0
20
40
60
80
100
mm
концентрации ацетата, лиганда и объемную актив-
ность радионуклида. Результаты анализа образцов
[153Sm]Sm-5 с помощью системы № 4 показывают,
этом эффективность связывания при высоких зна-
что даже при pH ~2 с лигандом связывается около
чениях pH позволяет снизить минимальную кон-
93% самария-153 (табл. 5). С увеличением уровня
центрацию лиганда 5, увеличивая молярную ак-
pH реакционной смеси радиохимическая чистота
тивность препарата, с последующим доведением
растет монотонно и при pH 12 достигает макси-
pH до физиологически приемлемого уровня (5-9).
мальных значений (99-100%). При этом, согласно
Однако стоит учитывать, что при меньшем соотно-
анализу с помощью системы № 5, меняется соот-
шении с5/сSm (т. е. при увеличении концентрации
ношение форм комплекса [153Sm]Sm-5: в области
низких значений pH преобладает содержание фор-
носителя) возможно снижение радиохимической
мы с Rf ≈ 0.1, а при pH ≥ 5, наоборот, более 90%
чистоты при pH < 5.5±0.5.
комплекса представлено в форме с Rf ≈ 0.5.
В отличие от соединения 5 хелатор 6 образует
Таким образом, при с5 0.5 мМ. и содержании
комплексы с самарием в более узком диапазоне
носителя 0.1 мМ., наблюдается практически ко-
pH. Получение препарата с радиохимическая чи-
личественное (> 90%) связывание самария-153 с
стота > 98% возможно при pH ≥ 4. Однако спустя
лигандом 5 в широком диапазоне pH (2-12). При
сутки после получения наблюдается снижение
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
СР
АВНИТЕЛЬНАЯ ОЦЕНКА СВОЙСТВ АМИНОПОЛИФОСФОНАТОВ
825
Таблица 6. Зависимость радиохимической чистоты 153Sm-6 от pH
Система № 4
Система № 5
pH
сразу после приготовления
спустя сутки
сразу после приготовления
спустя сутки
1.9
34
30
33
30
3.6
89
61
95
75
5.0
96
86
99
92
Таблица 7. Содержание (%) радиохимических примесей с Rf 1 (система № 5) в смесях [153Sm]Sm-5 с ДТПА и
сывороткой
Отношение 5/ДТПА, с5/сДТПА, мМ.
Разбавление в сыворотке,
Время
(nэкв5/nэквДТПА)
Vпрепарата/Vсыворотки
с5 в препарате,
инкубирования
мМ.
0.5/0.5
0.1/0.9
0.02/0.98
0.01/0.99
смеси
1/1
1/9
1/49
1/99
(1/1)
(1/9)
(1/49)
(1/99)
1 ч
18
22
26
28
0
1
15
30
1
1 сут
59
67
10
16
Время
с5 в препарате,
5.0/0.5
1/0.9
0.2/0.98
0.1/0.99
инкубирования
мМ.
(10/1)
(1.1/1)
(0.2/1)
(0.1/1)
смеси
1 ч
32
37
40
45
0
0
1
2
10
1 сут
76
77
1
1
радиохимической чистоты в образцах с pH ≤ 5
В присутствии ДТПА наблюдается значитель-
(табл. 6), поэтому оптимальным является диапазон
ное перелигандирование. В табл. 7 приведено со-
pH 5-9.
держание радиохимических примесей, получен-
ное при анализе смесей в системе № 5. При этом
Стабильность [153Sm]Sm-5 в различных сре-
радиохимические примеси в данных смесях дви-
дах. Спустя сутки в NaCl сохраняется не менее
жутся с фронтом, а на старте хроматограммы на-
92% [153Sm]Sm-5 даже при разбавлении в 100 раз
блюдается не более 1% активности.
(с 1 до 0.01 мМ.). Для смесей образцов с с5 10 мМ.
спустя 1 ч после смешивания наблюдается увели-
Стабильность [153Sm]Sm-6 в различных сре-
чение содержания формы с Rf ≈ 0.1 (система № 5):
дах. При разбавлении изотоническим раствором
до ~21% при разбавлении в 50 и более раз (спустя
натрия хлорида спустя 2 сут сохраняется не менее
1 сут - до 31-33% при тех же условиях). Но при
98% [153Sm]Sm-6 даже при разбавлении в 100 раз
этом более 95% самария-153 сохраняется в виде
(минимальная концентрация лиганда 6 составляет
[153Sm]Sm-5.
0.01 мМ.). При тех же условиях в случае сыворот-
ки крови сохраняется более 96% [153Sm]Sm-6.
При разбавлении сывороткой крови в слу-
чае смесей с конечной концентрацией 5, равной
В присутствии ДТПА так же, как и в случае
0.1 мМ., изменения на хроматограммах не наблю-
[153Sm]Sm-5, наблюдается перелигандирование.
даются. При дальнейшем разбавлении (до кон-
В табл. 8 приведено содержание радиохимических
центраций лиганда ≤ 0.02 мМ.) наблюдается уве-
примесей, полученное при анализе смесей в систе-
личение активности на участках хроматограмм,
ме № 5. При этом радиохимические примеси в дан-
соответствующих примесям самария-153 (т. е.
ных смесях движутся с фронтом, а на старте хрома-
старт в системе № 4 и фронт в системе № 5).
тограммы наблюдается менее 1% активности.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
826
КОДИНА и др.
Таблица 8. Содержание (%) радиохимических примесей (система № 5) в смесях [153Sm]Sm-6 с ДТПА и сывороткой
Отношение 6/ДТПА, с6/сДТПА, мМ.
Разбавление в сыворотке,
Время
(nэкв6/nэквДТПА)
Vпрепарата/Vсыворотки
с6 в препарате,
инкубирования
мМ.
0.1/0.9
0.02/0.98
0.01/0.99
смеси
1/9
1/49
1/99
(1/9)
(1/49)
(1/99)
1 ч
≤5
≤5
6
≤1
≤1
≤5
1
1 сут
18
17
≤5
≤5
2 сут
30
30
≤5
≤5
Время
с6 в препарате,
1/0.9
0.2/0.98
0.1/0.99
инкубирования
мМ.
(1.1/1)
(0.2/1)
(0.1/1)
смеси
1 ч
≤5
≤5
≤5
≤1
≤1
≤1
10
1 сут
16
16
≤5
≤5
2 сут
30
30
≤5
≤5
Таким образом комплексы
[153Sm]Sm-6 яв-
зависимости от концентрации лиганда и времени
ляются более стабильными по сравнению с
после введения), т. е. по биологическому поведе-
[153Sm]Sm-5. При этом оба соединения проявляют
нию комплексы [153Sm]Sm-3 и [153Sm]Sm-4 прояв-
высокую устойчивость к разбавлению в сыворотке
ляют свойства, близкие к [153Sm]SmCl3, который
крови.
в значительной степени подвергается гидролизу
в физиологических средах, что является причи-
Исследование биораспределения препаратов
ной накопления 153Sm в печени. Однако известно
самария-153 на основе исследуемых ацикличе-
ских и цикленсодержащих лигандов. Результа-
[40], что кроме этого [153Sm]SmCl3 обладает соб-
ственной остеотропностью и может накопиться в
ты по исследованию биологического поведения
скелете в количестве 10-20% от введенной дозы,
комплексов самария [153Sm] с лигандами 1-5 в
что и наблюдалось в наших экспериментах. Отме-
сравнении с [153Sm]SmCl3, полученные на кры-
чено, что накопление [153Sm]Sm-3 и [153Sm]Sm-4
сах с переломом бедра, приведены в табл. 9. Для
в скелете экспериментальных животных достовер-
[153Sm]Sm-1 приведены наши результаты и лите-
но ниже, чем хлорида 153Sm. Биораспределение
ратурные данные [40]. Несмотря на существенное
[153Sm]Sm-5 (полученного при нагревании реак-
различие в концентрации лиганда 1, принципиаль-
ционной смеси) практически аналогично таково-
ной разницы результатов биораспределения мы не
му для [153Sm]Sm-1 и [153Sm]Sm-2, и на основании
отмечали. В экспериментах с [153Sm]Sm-2 были
полученных результатов нельзя заключить, что ли-
получены практически аналогичные результаты:
ганд 5 обладает какими-либо преимуществами по
уже в течение 2 ч после внутривенного введения
сравнению с лигандами 1 или 2.
порядка 50% радионуклида в составе комплекса
с лигандом 2 накапливается в скелете, при незна-
Поиск новых эффективных средств радиону-
чительном (≤ 5% суммарно) накоплении в других
клидной терапии и, в частности, препаратов для
органах и тканях, остальная часть выводится из
купирования болевого синдрома при метастати-
организма. При этом в модельном патологическом
ческом поражении скелета, в течение многих лет
очаге накопление превышает накопление в интакт-
остается актуальным направлением в области
ной кости. Для препаратов, содержащих лиганды
создания новых средств онкологического профи-
3 и 4, отмечено накопление значительного количе-
ля. Одним из подходов к решению проблемы се-
ства радионуклида в печени (около 30% и выше в
лективного накопления радионуклида в костных
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
СР
АВНИТЕЛЬНАЯ ОЦЕНКА СВОЙСТВ АМИНОПОЛИФОСФОНАТОВ
827
Таблица 9. Сравнение биораспределения [153Sm]SmCl3 и комплексов самария-153 с лигандами 1-5
Голень
Костная
Кровь
Легкие
Печень
Почки
Скелет
Время после
норма
мозоль
L
сL, мМ
введения, ч
%ID/мл
%ID
%ID
%ID
%ID/г
%ID/г
%ID
2
0.46±0.32
0.52±0.30
38±10
0.79±0.22
0.87±0.18
0.45±0.19
16.3±6.8
Хлорид
0
4
0.04±0.02
0.28±0.04
51±5
2.02±0.37
0.81±0.08
0.82±0.46
18.0±2.9
24
≤ 0.01
0.10±0.03
22±3
1.03±0.35
1.43±0.34
1.00±1.25
21.5±10.9
a
80 [41]
2
≤ 0.01
0.02±0.01
0.25±0.04
0.25±0.04
3.72±0.26
44.2±3.9
1
a
10
1
≤ 0.01
-
2.8±0.4
3.0±0.45
2.58±0.31
43.0±4.5
1
0.8±0.1
1.0±0.6
0.4±0.3
-
2.4±0.4 (бедро, норма)
48.0±7.2
10
24
0.4±0.4
0.8±0.3
0.3±0.2
-
2.6±0.1 (бедро, норма)
51±2
2
2
≤ 0.01
0.05±0.01
1.46±0.25
0.37±0.09
1.62±0.60
2.53±0.69
51.8±7.8
50
4
≤ 0.01
0.03±0.01
0.96±0.27
0.33±0.08
2.44±0.83
3.10±0.06
54.2±2.1
24
≤ 0.01
0.03±0.01
1.06±0.45
0.30±0.10
3.61±1.31
3.84±0.21
64.8±7.9
5
1
0.06
1.00
41
0.8
0.1
0.14
3.7
2
0.15±0.02
2.42±1.10
33.3±8.8
0.39±0.37
0.30±0.14
0.24±0.06
6.7±2.0
3
50
4
0.10±0.01
1.85±0.43
29.5±2.8
0.42±0.16
0.36±0.07
0.26±0.03
8.4±1.2
24
≤ 0.01
0.76±0.31
27.0±0.8
0.22±0.08
0.51±0.11
0.39±0.05
11.7±1.3
2
0.14±0.05
0.65±0.28
59±13
0.11±0.03
0.11±0.00
0.14±0.04
4.10±0.03
50
4
0.07±0.02
0.70±0.42
55±14
0.07±0.03
0.09±0.02
0.12±0.02
3.30±0.02
4
24
0.04±0.02
0.54±0.25
58±16
0.10±0.05
0.12±0.02
0.27±0.09
4.40±0.03
a
10
2
0.1±0.1
0.6±0.3
27±12
0.1±0.1
0.7±0.0
14.0±0.1
2
≤ 0.01
0.03±0.01
0.60±0.20
0.59±0.09
1.69±0.31
1.75±0.18
33.8±2.7
5
10
4
≤ 0.01
0.02±0.01
0.65±0.28
0.47±0.05
1.74±0.16
1.12±0.26
34.8±1.3
24
≤ 0.01
≤ 0.01
0.59±0.35
0.38±0.09
2.21±0.79
1.82±0.51
44.2±3.6
а Использовали нормальных животных (без модели патологии).
тканях является использование координацион-
состава реакционных смесей и препаратов, что в
ных соединений радионуклидов с фосфонатами
настоящее время находит все более широкое при-
различного строения. Опубликованы данные о
менение в практике экспресс-контроля качества
биологическом поведении нескольких десятков
радиофармацевтических препаратов, изготовлен-
комплексов фосфонатов с различными радиону-
ных непосредственно в медицинской организации.
клидами, и поиски продолжаются.
Интересно, что в анализе удалось обнаружить по-
следовательное, в зависимости от условий получе-
Подводя итоги проведенных исследований,
можно заключить, что лиганды 3-6 образуют
ния препарата, образование связи радионуклида с
фосфоновыми группами лиганда и/или циклено-
при взаимодействии с растворами, содержащими
153Sm, комплексы, стабильность которых по дан-
вым фрагментом. Хотя нужно отметить, что пока
это предположительный результат, который ну-
ным метода ТСХ сохраняется в течение нескольких
ждается в самостоятельном исследовании и под-
суток, в том числе при взаимодействии с ДТПА и
тверждении.
в физиологических средах. При этом полученные
результаты сопоставимы и подтверждены при ис-
Вместе с тем необходимо отметить и негатив-
пользовании различных хроматографических си-
ный результат, полученный при исследовании био-
стем для определения радиохимической чистоты
рапределения препаратов. Как видно из табл. 9, в
препаратов. Очевидно, позитивное значение име-
экспериментах с комплексами изучаемых ацикли-
ет показанная в работе возможность применения
ческих аминофосфоновых кислот 3 и 4 накопле-
высокоэффективной (быстрой) тонкослойной хро-
ние радионуклида наблюдается в основном в пече-
матографии (iTLC) для анализа радиохимического
ни, т. е. эти соединения по своим биологическим
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
828
КОДИНА и др.
свойствам не пригодны для создания остеотропно-
Спектры ЯМР 1Н и 31Р регистрировали на спек-
го радиофармацевтического препарата. Посколь-
трометре Bruker DPX-200, стандарты - ТМС (вну-
ку данные препараты показали высокую стабиль-
тренний) и 85%-ная H3PO4 (внешний).
ность в сыворотке крови в экспериментах in vitro,
1,7-Диамино-4-оксагептан-1,1,7,7-тетрафос-
одним из возможных объяснений может быть ли-
фоновая кислота (3) синтезирована по методике,
пофильность получаемых комплексов.
описанной в работе [19]. Спектр ЯМР 1H (D2О), δ,
Поскольку препарат на основе циклического
м. д.: 2.19-2.35 м (4Н, СН2СN), 3.85 т (4Н, СН2О,
лиганда 5 показал накопление в скелете, и в це-
3JРН 7.5 Гц). Спектр ЯМР 31Р{H} (D2О): δP 12.91 м.
лом биораспределение практически аналогично
д. Найдено, %: C 14.68, 14.74; H 4.21, 4.11; N 5.80,
таковому для используемых в клинической прак-
5.72. C6H20N2O13P4·2H2O. Вычислено, %: C 14.75;
тике препаратов [153Sm]Sm-1 и [153Sm]Sm-2, то
H 4.92; N 5.74.
дальнейшие поиски оптимальных структур мо-
Аналогично, путем присоединения двух моле-
лекулы лиганда для остеотропных препаратов
кул фосфористой кислоты к нитрильной группе,
самария-153 логично продолжить в ряду именно
а именно к бис(2-цианоэтил)малоновому эфиру,
цикленсодержащих соединений, обладающих ши-
с последующим кислотным гидролизом продукта
рокими возможностями для направленной моди-
присоединения получена 1,7-диамино-4-гидрок-
фикации.
сикарбонилгептан-1,1,7,7-тетрафосфоновая
Специфика поиска потенциальных кандидатов
кислота (4). Спектр ЯМР 1H (D2О), δ, м. д.: 1.62-
для создания радиофармацевтических препара-
1.95 м (4Н, СН2), 2.05-2.39 м (5Н, СН + 2СH2).
тов заключается в том, что сведения, о структуре
Спектр ЯМР 31Р{H} (D2О, рН~1): δР 16.32 м. д.
и свойствах комплексных соединений, синтези-
(АВ-система, 2JPP 13.6 Гц). Найдено, %: C 18.48,
рованных при стехиометрических соотношениях
18.08; H 5.18, 5.17; N 5.86, 5.58. C8H22N2O14P4·H2O.
металла и лиганда, не позволяют сделать одно-
Вычислено, %: C 18.74; H 4.69; N 5.46.
значный вывод о возможности применения ана-
1,4,7,10-Тетраазациклододекан-1,4,7,10-те-
логичного комплекса радионуклида (который по-
тракис(метиленфосфоновая кислота) (5) полу-
лучен в условиях разницы мольных соотношений
чена по методике [20, 44]. Спектр ЯМР 1H (D2O +
металл-лиганд в несколько порядков) в качестве
NH4OH), δ, м. д.: 2.91 д (8Н, РСН2, 2JPH 10.4 Гц),
основы радиофармацевтические препараты. Нако-
3.23 с (16Н, CH2N). Спектр ЯМР 31Р{H} (D2O +
нец, не всегда понятно, каким образом реализуется
NH4OH): δР 11.79 м. д. Найдено, %: C 26.37, 26.61;
путь комплексного соединения в живом организ-
H 6.14, 6.17; N 9.99, 9.91. C12H32N4O12P4. Вычисле-
ме, т. е. какие химические превращения происхо-
но, %: C 26.29; H 5.88; N 10.22.
дят с исходным соединением после внутривенно-
1,4,7,10-Тетраазациклододекан-1-(2-пири-
го введения. Необходимо признать, что основным
дилметилен)-4,7,10-трис(метиленфосфоновая
критерием в выборе соединения радионуклида в
кислота) (6, DO3PPy) была синтезирована из мо-
качестве активной фармацевтической субстанции
нопиридилпроизводного с последующим введени-
радиофармацевтических препаратов является его
ем фосфоновых фрагментов посредством реакции
биологическое поведение.
с параформом и фосфористой кислотой аналогич-
но синтезу лиганда 5 [44]. Спектр ЯМР 1H (D2O),
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
δ, м. д.: 2.66-3.88 м (16Н, CH2N), 2.88 д (2Н, РСН2,
Этилендиаминтетраметиленфосфоновая кис-
2JPH 10.8 Гц), 3.24 д (4Н, РСН2, 2JPH 12.7 Гц), 4.16 с
лота 1 (Chemical Point UG, Германия) поставлена
(2Н, СН2Рy), 7.54-7.66 м (1НPy), 7.95-8.09 м (1НPy),
ООО ТД «ХИММЕД». Препарат «Самарий, 153Sm
8.49-8.58 м (1НPy), 8.78-8.80 м (1НPy). Спектр
оксабифор» 2 и раствор 153SmCl3 в 0.1 M. HCl по-
ЯМР 31Р{H} (D2O), δР, м. д.: 8.11 (2Р), 20.76 (1Р).
лучены от АО «НИФХИ им. Л.Я. Карпова». Со-
Найдено, %: C 35.83, 35.18; H 6.76, 6.93; N 11.37,
гласно документации производителя, препараты
11.38. C17H34N5O9P3·2H2O. Вычислено, %: C 35.11;
содержат носитель в количестве 25-100 мкг/мл.
H 6.54; N 12.05.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
СР
АВНИТЕЛЬНАЯ ОЦЕНКА СВОЙСТВ АМИНОПОЛИФОСФОНАТОВ
829
Синтез и анализ радиохимической чистоты
основе изученных фосфоновых кислот (табл. 9)
препаратов. Для приготовления препаратов 153Sm
проводили в сравнении с препаратом «Самарий,
с концентрацией лигандов до 50 мМ. (АО «НИФХИ
153Sm оксабифор» на животных с моделью кост-
им. Л.Я. Карпова) в каждом и pH 6.5±0.5 сна-
ной патологии. В качестве образца сравнения ис-
чала готовили 0.1 М. растворы лигандов в 0.4-
пользовали также исходный раствор 153SmCl3 (pH
0.5 М. NaOH с последующим разбавлением до
6, буфер Трис, 50 мМ.). Все введенные животным
необходимого значения концентрации лиганда. К
препараты были предварительно проанализирова-
этим растворам добавляли деионизованную воду
ны методом радио-ТСХ и их радиохимическая чи-
и 153SmCl3 в 0.1 М. растворе HCl. При этом рас-
стота составила не менее 98% во всех случаях, где
твор самария-153 хлористого добавляли в таком
это применимо.
объеме, чтобы количество изотопного носителя в
Эксперименты проведены на крысах линии
образцах, рассчитанное согласно документации
Wistar с модельными патологиями костных мета-
производителя, было одинаковым во всех образ-
стазов. В качестве модели патологии определен
цах и составляло 0.1 мМ., если не указано иное. В
закрытый перелом бедра в стадии активного фор-
случае необходимости получения раствора с кон-
мирования костной мозоли. Такой выбор сделан
центрацией лиганда ниже 10 мМ. для поддержа-
исходя из физиолого-биохимического сходства
ния значения рН в раствор добавляли 2 М. раствор
механизма формирования костной мозоли и остео-
натрия ацетата (конечная концентрация AcONa в
лиза, спровоцированного экспрессией опухолевых
этом случае составляла 0.2 М.). Полученные смеси
паракринных факторов, вызывающих процесс ре-
инкубировали при 25-95°C в течение 15-30 мин
конструкции кости с избыточным синтезом колла-
при перемешивании.
гена, являющегося первичной мишенью для свя-
Определение радиохимической чистоты синте-
зывания фосфонатов [45].
зированных комплексов проводили методом ТСХ
Для создания очагов патологии животных нар-
с радиометрическим детектированием. Описание
котизировали путем внутрибрюшинного введения
использованных хроматографических систем и
раствора хлоралгидрата в физиологическом рас-
факторов удерживания (Rf) изученных меченых
творе из расчета 400 мг на 1 кг массы тела. После
соединений в них представлены в табл. 1.
наркотизации животных, без разреза мягких тка-
Оценка стабильности комплексов сама-
ней производили внешнее воздействие на прок-
рия-153. Препараты самария-153 с ациклическими
симальный отдел бедренной кости крысы (между
лигандами 2-4 смешивали с 0.9%-ным раствором
большим и третьим вертелами бедренной кости)
NaCl и эмбриональной сывороткой бычьей крови
или на голень мыши. Нагрузка осуществлялась
в объемном соотношении 1:1. Параллельно прово-
перпендикулярно оси кости до появления в ней пе-
дили «ДТПА-челлендж», для чего к аликвоте пре-
релома. Формирование костной мозоли происхо-
парата добавляли эквимолярное (по отношению
дило без фиксации отломков. В течение последу-
к лиганду) количество ДТПА в виде раствора в
ющих 10 сут после создания закрытого перелома
0.9%-ном растворе NaCl (pH 7.0±0.5). Для оценки
формировалась костная мозоль, которая и служи-
стабильности препаратов самария с цикленсодер-
ла моделью метаболического поражения костной
жащими лигандами 5 и 6 аликвоты свежеприго-
ткани.
товленных препаратов с концентрациями лиган-
Радиометрия проб проведена с использовани-
дов 1 и 10 мМ. смешивали с 0.9%-ным раствором
ем автоматического гамма-счетчика Wizard 2480
NaCl, эмбриональной сывороткой бычьей крови и
(PerkinElmer, USA). По результатам радиометрии
1 мМ. раствором ДТПА·3NaOH в изотоническом
биологических проб проведен расчет доли акку-
растворе NaCl в объемных соотношениях 1:9, 1:49
мулированного радиоактивного соединения Aк
и 1:99. Полученные смеси анализировали методом
(%ID - % of Injected Dose) по формуле (1):
ТСХ спустя 1 ч инкубирования при 37°C, 1 и 2 сут
инкубирования при 25°C.
Биораспределение препаратов 153Sm. Оцен-
(1)
ку биораспределения препаратов самария-153 на
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
830
КОДИНА и др.
где Апробы - скорость счета образца, имп/мин;
Рагулин Валерий Владимирович, ORCID:
Аэталон - скорость счета эталона (или пересчет на
100% эталон счета его аликвоты), имп/мин; ско-
ФИНАНСОВАЯ ПОДДЕРЖКА
рость счета эталона корректируют для каждого
животного индивидуально, вычитая значение сче-
Работа выполнена при финансовой поддержке
та пробы «место введения»; Амв - скорость счета
Российского научного фонда (проект № 19-13-
от места введения, имп/мин.
00294, радиохимические и биологические иссле-
Далее выполняли пересчет содержания радио-
дования, и проект № 21-43-00020, синтез лиган-
активного соединения на 1 г ткани по формуле (2):
дов).
КОНФЛИКТ ИНТЕРЕСОВ
(2)
Авторы заявляют об отсутствии конфликта
интересов.
где Аг - приведенная к массе пробы, доля радиоак-
тивного соединения, аккумулированного в пробе,
СПИСОК ЛИТЕРАТУРЫ
%ID/г; m - масса пробы, г.
1.
Małkowski B., Maruszak M., Dudek A., Wędrowski M.,
Массы проб измеряли при помощи лаборатор-
Szefer J. // Contemp. Oncol. 2016. Vol. 20. N 5. P. 385
ных весов VIBRA АJН-220CE (SHINKO DENSHI
doi 10.5114/WO.2016.64598
Co., Ltd., Япония).
2.
Iagaru A.H., Mittra E., Colletti P.M., Jadvar H. // J.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
Nucl. Med. Soc. Nucl. Med. 2016. Vol. 57. Suppl. 3.
P. 19S. doi 10.2967/JNUMED.115.170746
Все процедуры, выполненные в исследованиях
3.
Ratsimanohatra H., Barlesi F., Doddoli C., Robitail S.,
с участием животных, соответствовали этическим
Gimenez C., Kleisbauer J.-P., Astoul P. // Rev. Mal.
стандартам учреждения, в котором проводились
Respir. 2005. Vol. 22. N 2. P. 317. doi 10.1016/S0761-
исследования, и утвержденным правовым актам
8425(05)85484-1
РФ и международных организаций [46, 47].
4.
Baczyk M., Milecki P., Pisarek M., Gut P., Antczak A.,
Hrab M. // Neoplasma. 2013. Vol. 60. N 3. P. 328. doi
ИНФОРМАЦИЯ ОБ АВТОРАХ
10.4149/NEO_2013_044
5.
Ricci S., Boni G., Pastina I., Genovesi D., Cianci C.,
Кодина Галина Евгеньевна, ORCID: https://
Chiacchio S., Orlandini C., Grosso M., Al Sharif A.,
orcid.org/0000-0002-3415-4329
Chioni A., Di Donato S., Francesca F., Selli C.,
Rubello D., Mariani G. // Eur. J. Nucl. Med. Mol.
org/0000-0003-2576-2338
Imaging. 2007. 2007. Vol. 34. N 7. P. 1023. doi 10.1007/
Клементьева Ольга Евгеньевна, ORCID: https://
S00259-006-0343-8
orcid.org/0000-0002-6604-0860
6.
Pacilio M., Ventroni G., Basile C., Ialongo P., Becci
D., Mango L. // Eur. J. Nucl. Med. Mol. Imaging. 2013.
Митрофанов Юрий Алексеевич, ORCID: https://
Vol. 41. N 2. P. 238. doi 10.1007/S00259-013-2552-2
orcid.org/0000-0001-5249-8507
7.
Кодина Г.Е., Громова Н.П., Тронова И.Н.,
Инкин А.А., Дроздовский Б.Я., Крылов В.В. Пат.
orcid.org/0000-0002-9508-2840
2162714. (2006). РФ
Лунёв Александр Сергеевич, ORCID: https://
8.
Krylov V., Drozdovsky B., Tsyb A., Kodina G. // Eur. J.
orcid.org/0000-0002-8392-8343
Nucl. Med. 2000. Vol. 27. N 8. P. 1127. doi 10.1007/
BF02800976
Лунёва Кристина Андреевна, ORCID: https://
9.
Tsyb A.F., Drozdovsky B.Y., Krylov V.V., Kodina G.E. //
orcid.org/0000-0002-1256-9873
Med. Radiol. Radiat. Saf. 2002. Vol. 47. N 5. P. 61.
Цебрикова Галина Сергеевна, ORCID: https://
10.
Цыб А.Ф., Крылов В.В., Дроздовский Б.Я., Каря-
orcid.org/0000-0002-1215-4256
кин О.Б., Бирюков В.А., Медведев В.Н., Смирно-
Баулин Владимир Евгеньевич, ORCID: https://
ва И.А., Воробьева С.Л. // Сибирск. онкол. ж. 2006. Т. 3.
orcid.org/0000-0002-5956-2601
№ 19. С. 8.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
СР
АВНИТЕЛЬНАЯ ОЦЕНКА СВОЙСТВ АМИНОПОЛИФОСФОНАТОВ
831
11.
Информационный бюллетень ВОЗ от 05.10.2021.
Biol. 1996. Vol. 23. N 8. P. 935. doi 10.1016/S0969-
8051(96)00117-5.
cancer
24.
Turner J.H., Martindale A.A., Sorby P., Hethering-
12.
Nuclear Medicine Market - Global Forecast to
ton E.L., Fleay R.F., Hoffman R.F., Claringbold P.G.
2026. MarketsandMarkets 05.10.2021. https://
// Eur. J. Nucl. Med. 1989. Vol. 15. N 12. P. 784. doi
10.1007/BF00255498
radiopharmaceuticals-market-417.html
25.
Alberts A.S., Smit B.J., Louw W.K.A., van Rens-
13.
Chakraborty S., Das T., Banerjee S., Chaudhari P.R.,
burg A.J., van Beek A., Kritzinger V., Nel J.S. //
Sarma H.D., Venkatesh M., Pillai M.R.A. // Nucl.
Radiother. Oncol. 1997. Vol. 43. N 2. P. 175. doi
Med. Commun. 2004. Vol. 25. N 12. P. 1169. doi
10.1016/S0167-8140(97)01912-9
10.1097/00006231-200412000-00003
26.
Majali M.A., Mathakar A.R., Shimpi H.H. // J.
14.
Simón J., Frank R.K., Crump D.K., Erwin W.D.,
Radioanal. Nucl. Chem. 1999. Vol. 240. N 3. P. 845.
Ueno N.T., Wendt R.E. // Nucl. Med. Biol. 2012. Vol. 39.
doi 10.1007/BF02349861
N 6. P. 770. doi 10.1016/J.NUCMEDBIO.2011.12.015
27.
Митрофанов Ю.А., Марук А.Я., Ларенков А.А.,
15.
Das T., Chakraborty S., Sarma H.D., Banerjee S. //
Кодина Г.Е., Лунев А.С., Лунева К.А., Клементье-
Radiochim. Acta. 2015. Vol. 103. N 8. P. 595. doi
ва О.Е., Цебрикова Г.С., Баулин В.Е., Рагулин В.В.,
10.1515/ract-2014-2353
Цивадзе А.Ю. // ЖОХ. 2020. Т. 90. № 3. С. 409;
16.
Rabie A., Enayati R., Yousefnia H., Jalilian A.R.,
Mitrofanov Iu.A., Maruk A.Ya., Larenkov A.A.,
Shamsaei M., Zolghadri S., Bahrami-Samani A.,
Kodina G.E., Lunev A.S., Luneva K.A., Klementye-
Hosntalab M. // Ann. Nucl. Med. 2015. Vol. 29. N 10.
va O.E., Tsebrikova G.S., Baulin V.E., Ragulin V.V.,
P. 870. doi 10.1007/S12149-015-1014-2
Tsivadze A.Y. // Russ. J. Gen. Chem. 2020. Vol. 90. N 3.
17.
Yousefnia H., Zolghadri S. // Phys. Medica. 2015.
P. 390. doi 10.1134/S107036322003010X
Vol. 31. N 7. P. 714. doi 10.1016/j.ejmp.2015.05.015
28.
Aghanejad A., Jalilian A.R., Bahrami-Samani A., Beiki D.,
18.
Yousefnia H., Enayati R., Hosntalab M., Zolghadri
Maus S., Khalaj A. // Iran. J. Nucl. Med. 2015. Vol. 23.
S., Bahrami-Samani A. // J. Cancer Res. Ther. 2016.
N 1. P. 36.
Vol. 12. N 3. P. 1117. doi 10.4103/0973-1482.197534
29.
Toegel S., Wadsak W., Mien L.K., Viernstein H.,
19.
Цебрикова Г.С., Баулин В.Е., Калашникова И.П.,
Kluger R., Eidherr H., Haeusler D., Kletter K., Dudczak R.,
Рагулин В.В., Завельский В.О., Кодина Г.Е.,
Mitterhauser M. // Eur. J. Pharm. Biopharm. 2008. Vol.
Цивадзе А.Ю. // ЖОХ. 2016. Т. 86. № 3. С. 499;
68. N 2. P. 406. doi 10.1016/j.ejpb.2007.05.015
Tsebrikova G.S., Baulin V.E., Kalashnikova I.P., Ragu-
30.
Behe M., Becker W., Gotthardt M., Angerstein C.,
lin V.V., Zavel’skii V.O., Kodina G.E., Tsivadze A.Y. //
Behr T.M. // Eur. J. Nucl. Med. Mol. Imaging. 2003.
Russ. J. Gen. Chem. 2016. Vol. 86. N 3. P. 639. doi
Vol. 30. N 8. P. 1140. doi 10.1007/s00259-003-1178-1
10.1134/s107036321603021x
31.
Holub J., Meckel M., Kubíček V., Rösch F., Hermann P. //
20.
Цебрикова Г.С., Баулин В.Е., Калашникова И.П.,
Contrast Media Mol. Imaging. 2015. Vol. 10. N 2.
Рагулин В.В., Завельский В.О., Марук А.Я.,
P. 122. doi 10.1002/cmmi.1606
Лунев А.С., Клементьева О.Е., Кодина Г.Е.,
32.
Kerdjoudj R., Pniok M., Alliot C., Kubíček V., Havlíčko-
Цивадзе А.Ю. // ЖОХ. 2015. Т. 85. № 9. С. 1490;
vá J., Rösch F., Hermann P., Huclier-Markai S. //
Tsebrikova G.S., Baulin V.E., Kalashnikova I.P.,
Dalton Trans. 2016. Vol. 45. N 4. P. 1398. doi 10.1039/
Ragulin V.V., Zavel’skii V.O., Maruk A.Ya., Lunev A.S.,
Klement’eva O.E., Kodina G.E., Tsivadze A.Yu. // Russ.
c5dt04084a
33.
Kubíček V., Rudovsky J., Kotek J., Hermann P., Elst L.
J. Gen. Chem. 2015. Vol. 85. N 9. P. 2017. doi 10.1134/
S1070363215090091
Vander, Muller R.N., Kolar Z.I., Wolterbeek H.T.,
21.
Luo S.Z., Pu M.F., Quao J., Liu Z.L., Zhang C.Y.,
Peters J.A., Lukeš I. // J. Am. Chem. Soc. 2005. Vol.
Zhao P.J., Fu Y.B., Deng H.F. // J. Radioanal. Nucl.
127. N 47. P. 16477. doi 10.1021/ja054905u
Chem. Artic. 1992. Vol. 160. N 2. P. 443. doi 10.1007/
34.
Vitha T., Kubíček V., Hermann P., Elst L. Vander,
BF02037119
Muller R.N., Kolar Z.I., Wolterbeek H.T.,
22.
Sohaib M., Ahmad M., Jehangir M., Perveen A. //
Breeman W.A.P., Lukeš I., Peters J.A. // J. Med. Chem.
Cancer Biother. Radiopharm. 2011. Vol. 26. N 2.
2008. Vol. 51. N 3. P. 677. doi 10.1021/jm7012776
P. 159. doi 10.1089/cbr.2010.0846
35.
Toth E., Brucher E., Lazar I., Toth I. // Inorg. Chem.
23.
Louw W.K.A., Dormehl I.C., Van Rensburg A.J., Hugo N.,
1994. Vol. 33. N 18. P. 4070. doi 10.1021/ic00096a036.
Alberts A.S., Forsyth O.E., Beverley G., Sweetlove M.A.,
36.
Aime S., Botta M., Ermondi G. // Inorg. Chem. 1992.
Marais J., Lötter M.G., Van Aswegen A. // Nucl. Med.
Vol. 31. N 21. P. 4291. doi 10.1021/ic00047a016
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
832
КОДИНА и др.
37. Vojtíšek P., Cígler P., Kotek J., Rudovský J., Her-
Chem. 1997. Vol. 36. N 10. P. 2059. doi 10.1021/
mann P., Lukeš I. // Inorg. Chem. 2005. Vol. 44. N 16.
ic961364o
P. 5591. doi 10.1021/ic048190s
44. Lazar I., Hmcir D.C., Kim W., Kiefer G.E.,
38. Kotek J., Rudovský J., Hermann P., Lukeš I. // Inorg.
Sherry A.D. // Inorg. Chem. 1992. Vol. 31. N 17.
Chem. 2006. Vol. 45. N 7. P. 3097. doi 10.1021/
P. 4422. doi 10.1021/ic00047a034.
ic060006a
45. Любимова Н.В., Кушлинский Н.Е. // Усп. мол.
39. Peters J.A., Djanashvili K., Geraldes C.F.G.C., Platas-
биол. 2015. Т. 2. № 1. С. 61. doi 10.17650/2313-
Iglesias C. // Coord. Chem. Rev. 2020. Vol. 406.
805X.2015.2.1.061-075
P. 213146. doi 10.1016/j.ccr.2019.213146
40. Geraldes C.F.G.C., Sherry A.D., Kiefer G.E. // J. Magn.
46. Руководство по лабораторным животным и альтер-
Reson. 1992. Vol. 97. N 2. P. 290. doi 10.1016/0022-
нативным моделям в биомедицинских исследова-
2364(92)90314-W
ниях / Под ред. Н.Н. Каркищенко, С.В. Грачева. М:
41. Goeckeler W.F., Edwards B., Volkert W.A., Holmes R.A.,
Профиль-2С, 2010. 358 с.
Simon J., Wilson D. // J. Nucl. Med. 1987. Vol. 28.
47. Решение Совета Евразийской экономической комис-
N 4. P. 495.
сии от 03.11.2016 № 81 «Об утверждении Правил
42. Janicki R., Kȩdziorski A., Mondry A. // Phys. Chem.
надлежащей лабораторной практики Евразийского
Chem. Phys. 2016. Vol. 18. N 40. P. 27808. doi 10.1039/
экономического союза в сфере обращения лекар-
c6cp05284c
43. Aime S., Botta M., Fasano M., Marques M.P.M.,
Geraldes C.F.G.C., Pubanz D., Merbach A.E. // Inorg.
ru/01411927/cncd_21112016_81
Comparative Evaluation of Aminopolyphosphonates Properties
as Chemical Precursors of Samarium-153 Radiopharmaceuticals
G. E. Kodinaa, A. Ya. Marukb, O. E. Klementyevaa, Yu. A. Mitrofanova,*, A. O. Malyshevaa,
A. S. Luneva, K. A. Lunevaa, G. S. Tsebrikovab, V. E. Baulinc, and V. V. Ragulinc
a State Research Center — Burnasyan Federal Medical Biophysical Center of Federal Medical Biological Agency,
Moscow, 123098 Russia
b Frumkin Institute of Physical Chemistry and Electrochemistry, Russian Academy of Sciences, Moscow, 119991 Russia
c Institute of Physiologically Active Compounds, Russian Academy of Sciences, Chernogolovka, 142432 Russia
*e-mail: mitrofanoff.yura@yandex.ru
Received December 3, 2021; revised March 20, 2022; accepted March 24, 2022
A comparative study of samarium-153 complexation with several phosphonate-bearing ligands (acyclic and
cyclen-based) was carried out. Resulting complex quality control methods were proposed and their biological
behavior was determined. It is noted that the radionuclide compound biological behavior is a principal bench-
mark in choosing of it as an active pharmaceutical substance for a radiopharmaceutical drug development.
Keywords: radiopharmaceutical, radionuclide therapy, samarium-153, polyphosphonates, bio-distribution
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022