ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 7, с. 1028-1037
Памяти В. И. Галкина
УДК 547.481:546
СИНТЕЗ, СТРУКТУРА ЧЕТВЕРТИЧНЫХ СОЛЕЙ
ФОСФОНИЯ НА ОСНОВЕ ФОСФОРИЛИРОВАННЫХ
СТЕРИЧЕСКИ ЗАТРУДНЕННЫХ ФЕНОЛОВ
© 2022 г. И. В. Галкинаа,*, В. В. Андрияшина, С. Р. Романова, Р. Р. Давлетшина,
О. К. Поздеевb, М. П. Шулаеваb, И. А. Литвиновc, Ю. В. Бахтияроваа
a Казанский (Приволжский) федеральный университет, Химический институт имени А. М. Бутлерова,
ул. Кремлевская 18, Казань, 420008 Россия
b Казанская государственная медицинская академия, Казань, 420012 Россия
c Институт органической и физической химии имени А. Е. Арбузова Федерального исследовательского центра
«Казанский научный центр Российской академии наук», Казань, 420088 Россия
*e-mail: vig54@mail.ru
Поступило в редакцию 29 марта 2022 г.
После доработки 13 апреля 2022 г.
Принято к печати 14 апреля 2022 г.
Разработана методика синтеза четвертичных фосфониевых солей с двумя атомами фосфора [Р(III) и
P(V)] на основе фосфорилированных пространственно затрудненных фенолов. Получены стабильные
соли фосфония, состав и строение которых, установлены комплексом химических, физических и физи-
ко-химических методов (ЯМР 1Н и 31Р, ИК спектроскопия, элементный и рентгеноструктурный анализ).
Полученные фосфониевые соли обладают высокой антимикробной активностью по отношению к пато-
генной и условно-патогенной микрофлоре человека и животных.
Ключевые слова: четвертичные соли фосфония, фосфорилированные стерически затрудненные фенолы,
антиоксидантная активность
DOI: 10.31857/S0044460X22070046, EDN: CPUQYB
Первая фосфониевая соль - иодид фосфония,
биологической активности по отношению к ос-
по мнению Ван Везера, была получена Х. Бий-
новным видам патогенной микрофлоры человека,
ярдьером в 1817 году из PH3 и HI [1]. Через 135 лет
направленность к очагу инфекции. Наиболее эф-
появились первые сообщения о биологической
фективный путь решения этой задачи - функцио-
активности солей фосфония с органическими
нализация биоактивного соединения различными
радикалами (антибактериальной, фунгицидной,
фармакофорными группами.
противоопухолевой и др.) [2-12]. Направленный
В качестве модифицируемых соединений нами
синтез биологически активных соединений - одна
выбраны пространственно затрудненные фенолы -
из фундаментальных задач современной фарма-
малотоксичные, легкодоступные соединения,
цевтической, медицинской, органической и эле-
обладающие выраженной биологической актив-
ментоорганической химии. Синтезируемые пре-
ностью и широко использующиеся в медицине.
параты нового поколения должны сочетать в себе
Например,
2,6-ди-трет-бутилметилфенол (Ди-
высокую эффективность, низкую токсичность,
бунол), обладающий антимикробной и антиокси-
отсутствие побочных эффектов, широкий спектр
дантной активностью [13], успешно применяется
1028
СИНТЕЗ, СТРУКТУР
А ЧЕТВЕРТИЧНЫХ СОЛЕЙ ФОСФОНИЯ
1029
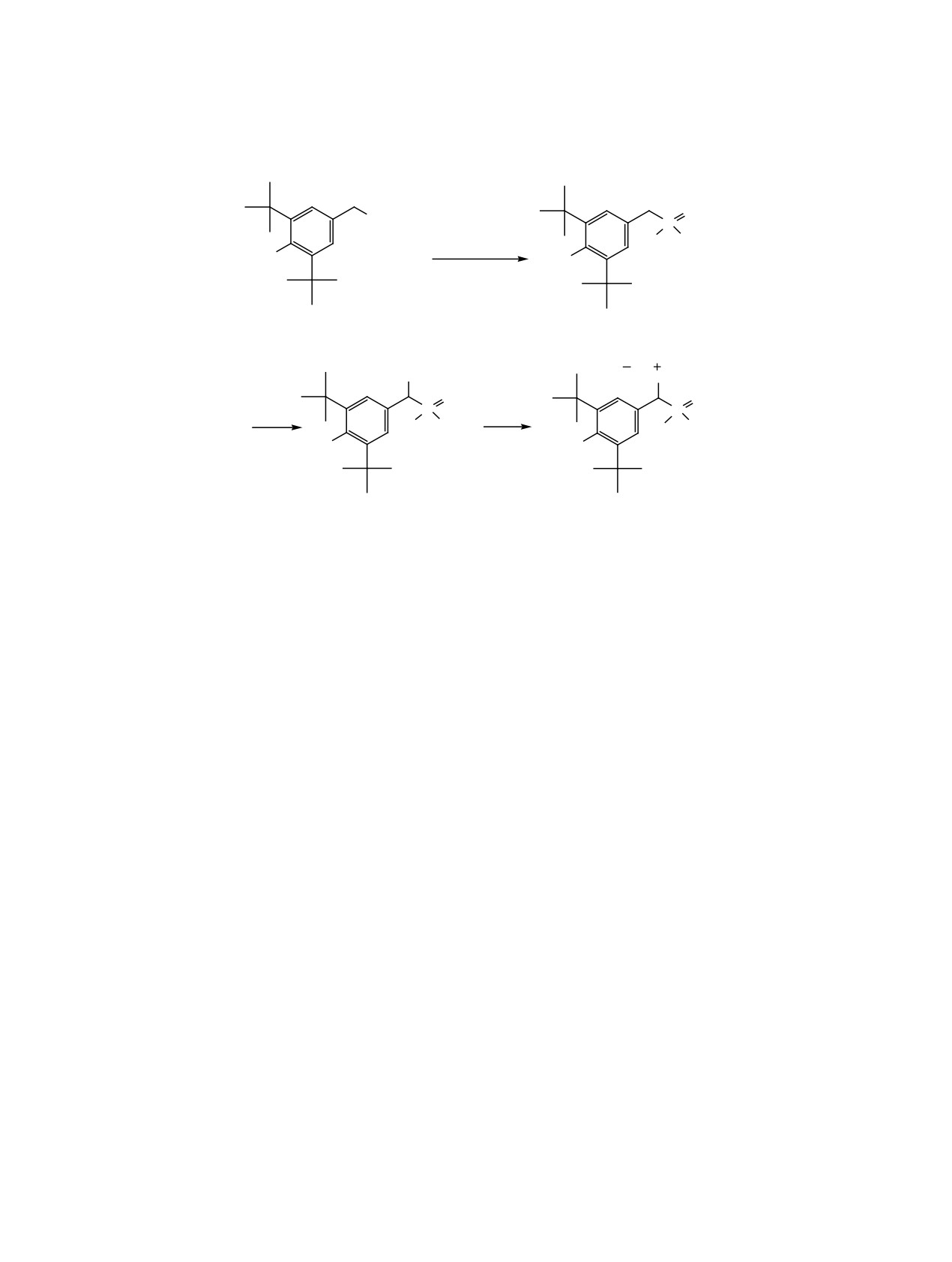
Схема 1.
O
N(CH3)2
P
R1
R1
(R1)2P(OH)
HO
HO
-(CH
3)2NH
1
2-4
Br
Br
PR23
O
O
P
P
Br2
R23P
R1
R1
R1
R1
-HBr HO
HO
5-7
8
R1 = OPh (2, 5, 8), C10H21 (3, 6), OMe (4, 7); R2 = C4H9 (8).
для лечения некоторых видов рака [14], лучевых
эфира проведено нуклеофильное замещение атома
и трофических поражений кожи и слизистых обо-
брома в дифенил[бром(3,5-ди-трет-бутил-4-гид-
лочек [15], а многофункциональные антиоксидан-
роксифенил)метил]фосфонате
5
на
три-
ты на основе 3,5-ди-трет-бутилфенола Тиофан
бутилфосфин и получено соединение 8 (схема 1).
и Тиофан-М нашли применение при лечении до-
Бромирование фосфоната 2 бромом в диэтиловом
брокачественных и злокачественных опухолей,
эфире имеет ряд существенных недостатков и
заболеваний печени, легких, сердечно сосудистой
ограничений, в частности, образующиеся побоч-
системы, разрушениях костной ткани и в уроло-
ные продукты реакции отрицательно влияют на
гической практике [16]. На основе фосфорилиро-
выход соединения 5. Этот способ бромирования
ванных пространственно затрудненных фенолов
оказался малопригодным для получения других
получены биологически активные антиоксидан-
бромпроизводных фосфиноксидов (R1 = OCH3,
ты - четвертичные фосфониевые соли с двумя
C10H21), которые невозможно получить с хорошим
различными атомами фосфора Р(III) и P(V). Про-
выходом, поскольку, выделяющийся бромоводо-
ведено фосфорилирование 2,6-ди-трет-бутил-4-
род может связываться с фосфорильной группой,
[(диметиламино)метил]фенола 1 с образованием
образует достаточно стабильные фосфиноксоние-
диметил, дифенил фосфонатов и окиси дидецил-
вые соединения и не позволяет получить продукты
фосфина, бромирование полученных соединений
присоединения с третичными фосфинами (схема 2).
по метиленовой группе бензильного фрагмента и
Нами предложен способ получения солей фос-
получены четвертичные фосфониевые соли с ато-
фония с двумя различными атомами фосфора,
мами фосфора в различной степени окисления при
в котором на стадии бромирования фосфонатов
взаимодействии образовавшихся бромидов с три-
в качестве бромирующего агента используется
бутил- и трифенилфосфином (схема 1).
N-бромсукцинимид (NBS). Реакцию проводили
Первоначальные стадии синтеза фосфонатов 2 и
в CCl4 при облучении реакционной смеси лам-
5 выполняли по известным методикам [17, 18]. За-
пой накаливания мощностью 300 Вт в течение
тем при комнатной температуре в среде диэтилового
3 ч. Таким способом были получены дифенил
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1030
ГАЛКИНА и др.
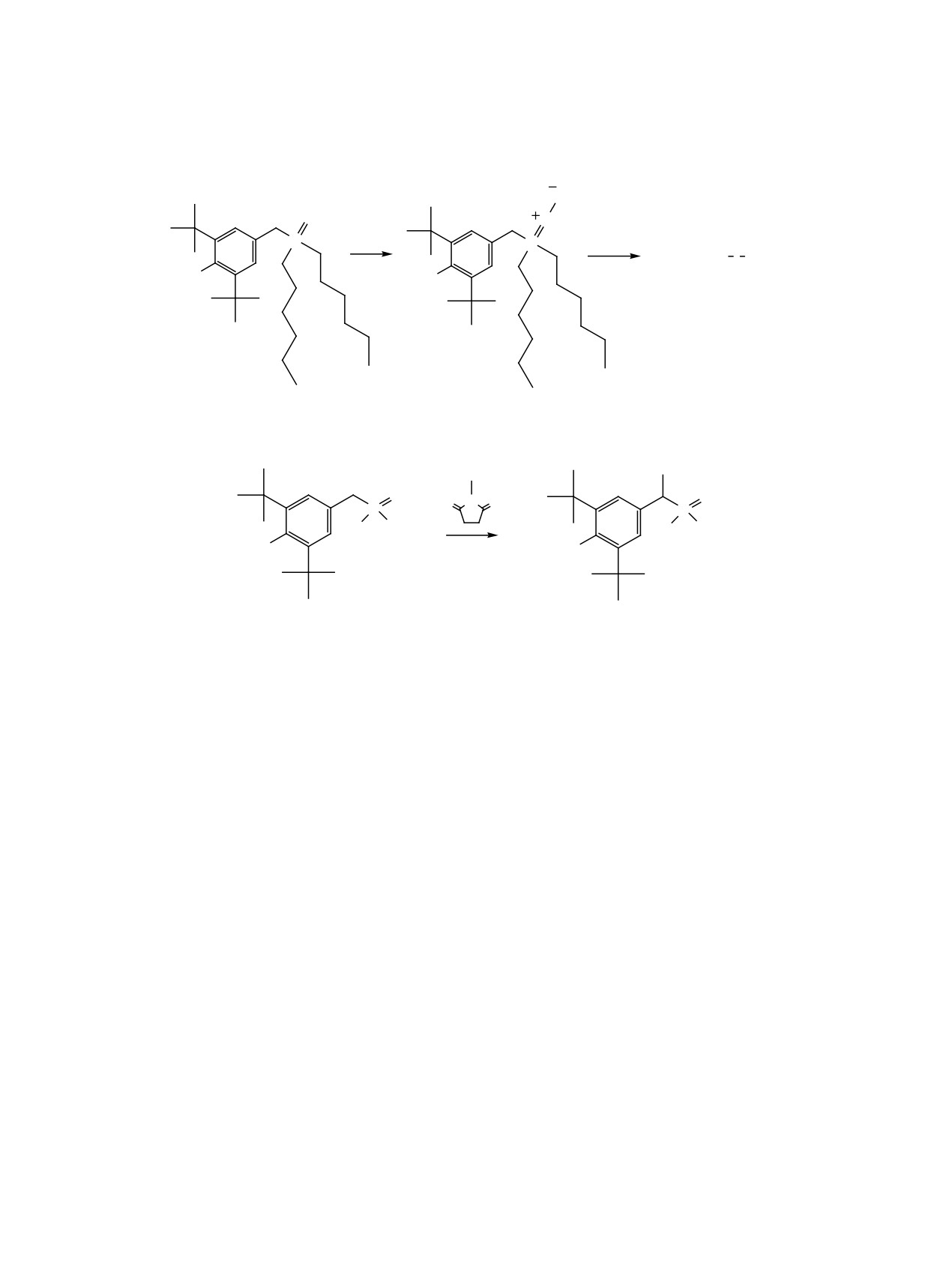
Схема 2.
BrH
O
O
P
Br2
P
Ph3P, [O]
Ph3P O+
-BrH
-HBr
HO
HO
Схема 3.
Br
Br
O
O
O N O
P
P
R R
R R
HO
HO
2-4
5-7
R = OC6H5 (2, 5), C10H21 (3, 6), OCH3 (4, 7).
[бром(3,5-ди-трет-бутил-4-гидроксифенил)ме-
ЯМР 31Р сигнал ядра фосфора, δР 21.0 м. д., пред-
тил]фосфонат
5,
4-[бром(дидецилфосфорил)-
ставляет собой октет, поскольку 2JPOH = 2JPCH.
метил]-2,6-ди-трет-бутилфенол
6, и диметил-
Бромирование соответствующих фосфонатов
[бром(3,5-ди-трет-бутил-4-гидроксифенил)ме-
2, 3 при получении соединений 5 и 6 проводили
тил]фосфонат 7 (схемa 3).
аналогично. При получении фосфоната 5 (с фе-
Cинтез диметил
[бром(3,5-ди-трет-бутил-
ноксигруппами у атома фосфора) трехчасово-
4-гидроксифенил)метил]фосфоната
7 протекает
го облучения лампой накаливания мощностью
при облучении эквимолярных количеств исходного
300 Вт оказалось недостаточно. После выдержива-
диметил[(3,5-ди-трет-бутил-4-гидроксифенил)-
ния реакционной массы под лампой еще в течение
метил]фосфоната 4 (R = OMe) и N-бромсукцини-
1 ч реакция прошла до конца. Для получения чет-
мида в CCl4 лампой накаливания c вольфрамовой
вертичной фосфониевой соли с двумя различными
нитью мощностью 300 Вт в течение 3 ч. Оставше-
атомами фосфора проводили реакцию 4-[бром(ди-
еся после удаления выпавшего в осадок сукцини-
децилфосфорил)метил]-2,6-ди-трет-бутилфено-
мида и отгонки растворителя густое желтое масло
ла 6 с трибутилфосфином в среде ССl4 (схема 4) и
многократно отмывали от примеси исходных сое-
получили соединение 9.
динений и затем растирали стеклянной палочкой в
Кристаллы соединения
9 при растирании
небольшом количестве гептана до полной кристал-
маслообразного остатка в диэтиловом эфире. B
лизации. Полученный таким образом фосфонат 7
спектре ЯМР 31Р соединения 9 наблюдаются два
представляет собой бесцветный кристаллический
дублета с одинаковыми константами спин-спино-
порошок, т. пл. 115-116°С (гептан). В спектре
вого взаимодействия около 4 Гц в области 53.69 и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
СИНТЕЗ, СТРУКТУР
А ЧЕТВЕРТИЧНЫХ СОЛЕЙ ФОСФОНИЯ
1031
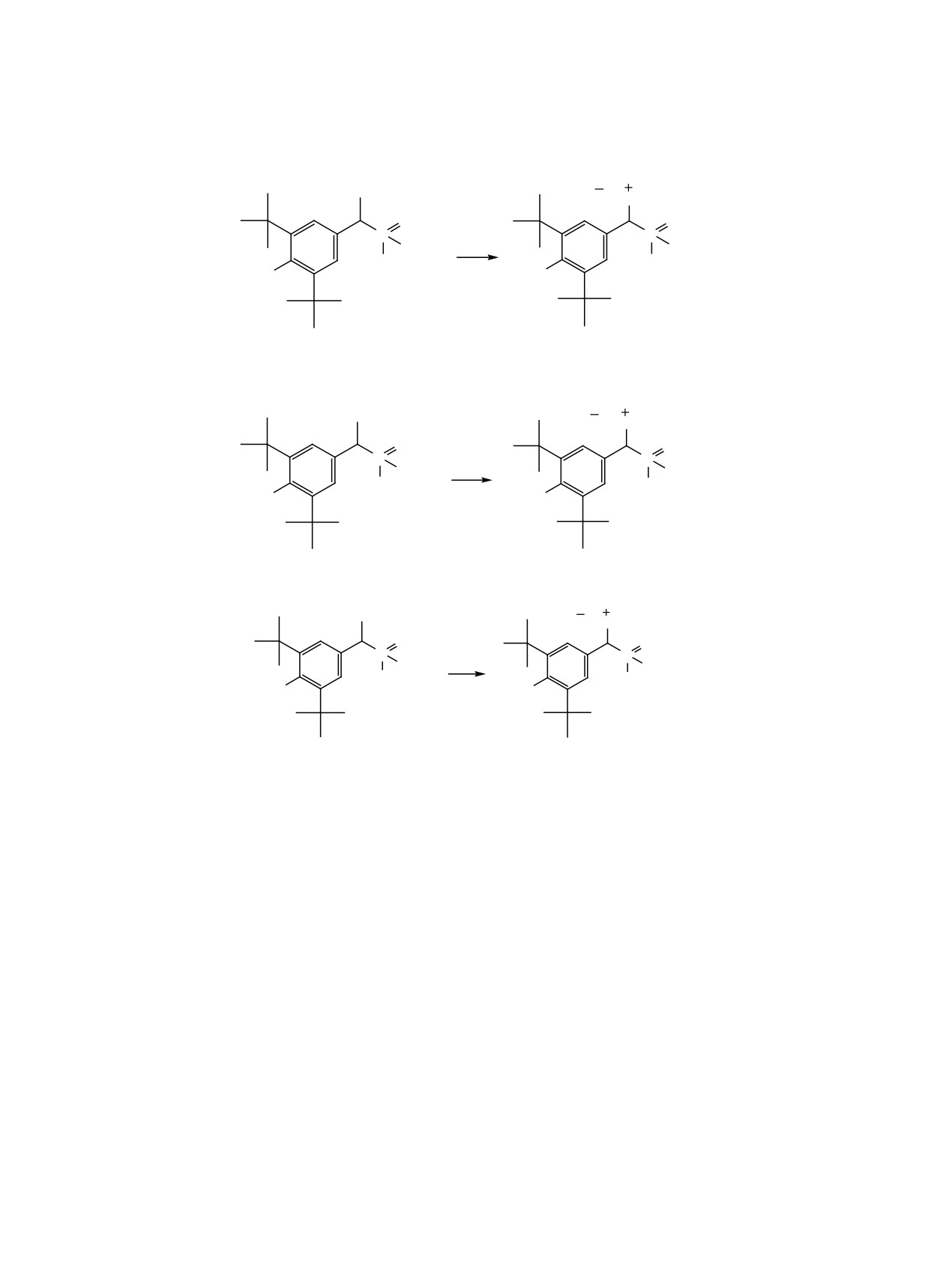
Схема 4.
Br
Br
P(C4H9)3
O
O
P
P
C10H21
Bu3P
C10H21
C10H21
C10H21
HO
HO
6
9
Схема 5.
Br
Br
PR3
O
O
P
P
OC6H5
R3P
OC6H5
OC6H5
OC6H5
HO
HO
5
8, 10
Br
Br
PR3
O
O
P
P
OCH3
R3P
OCH3
OCH3
OCH3
HO
HO
7
11, 12
R = Bu (8), Ph (10), Ph (11), Bu (12).
38.50 м. д., принадлежащие фосфиноксидному и
При исследовании методом рентгеноструктур-
фосфониевому атомам фосфора соответственно
ного анализа кристаллов, полученных при кристал-
(табл. 1). Таким образом, для пары окись фосфи-
лизации фосфониевой соли 8, достоверно установ-
лено, что в молекуле фосфониевой соли находится
на-фосфониевая соль величина 2JPP меньше, чем
хлорид-анион вместо ожидаемого бромид-аниона.
для пары фосфонат-фосфониевая соль.
Так как исходный фосфонат 5 получали в виде
Продукты бромирования 5 и 7 были введены в
масла в среде CCl4, последний, по-видимому, в не-
реакции с трифенил- и трибутилфосфином в сре-
больших количествах вступил во взаимодействие
де диэтилового эфира. Реакции протекают при
с образующейся четвертичной солью фосфония
комнатной температуре с высокой скоростью, с
8 [19]. Вполне возможно, что благодаря неболь-
хорошими выходами образуются белые порошко-
шой примеси аниона хлора (по данным спектров
образные соединения 8, 10-12, имеющие высокие
ЯМР 31Р) и его небольшому размеру по сравнению
температуры плавления (схема 5).
с бромом нам удалось вырастить кристаллы три-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1032
ГАЛКИНА и др.
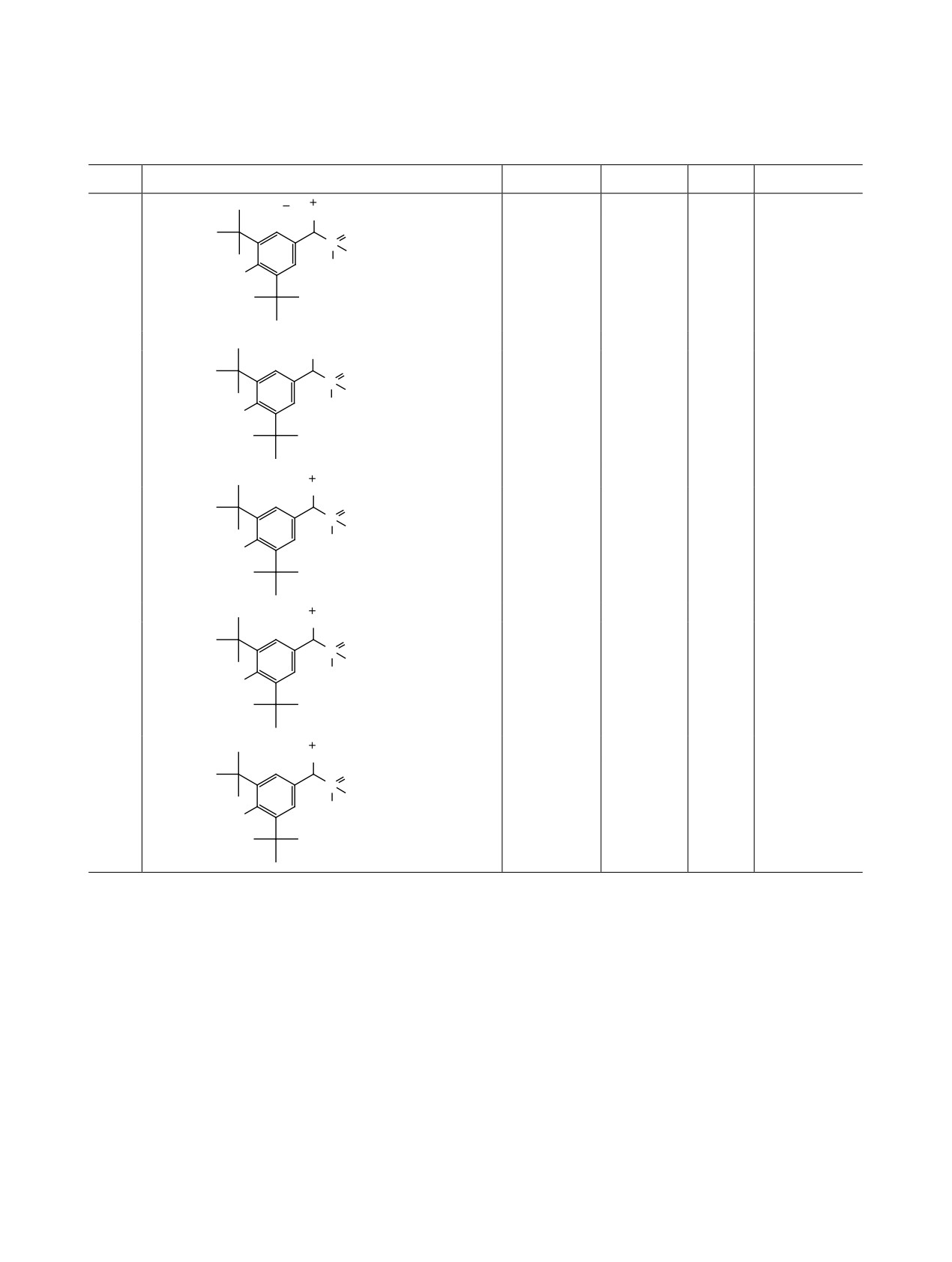
Таблица 1. Выход, температура плавления, спектральные данные 31 Р ЯМР солей 8-12
№
Соединение
т. пл., °C
δP, м. д.
JPP, Гц
Выход, %
229а (разл.)
9.8, 36.5а
7.86а
60а
Br
P(C4H9)3
O
P
OC6H5
8
OC6H5
HO
230б (разл.)
8.53, 34.4б
7.87б
87б
+
147 (разл.)
53.69
3.8
70
Br-
P(C4H9)3
O
P
C10H21
9
C10H21
38.50
HO
145 (разл.)
17.98
10.35
80
Br-
P(C6H5)3
O
P
OC6H5
10
OC6H5
23.47
HO
238 (разл.)
8.17
13.67
78
Br-
P(C6H5)3
O
P
OCH3
11
OCH3
HO
23.42
229 (разл.)
9.77
7.80
88
P(C4H9)3
Br-
O
P
OCH3
12
OCH3
HO
34.35
а Стадия бромирования бромом, реакция SN 5 мин.
б Бромирование NBS, реакция SN 15 мин.
бутил[(3,5-ди-трет-бутил-4-гидроксифенил)(ди-
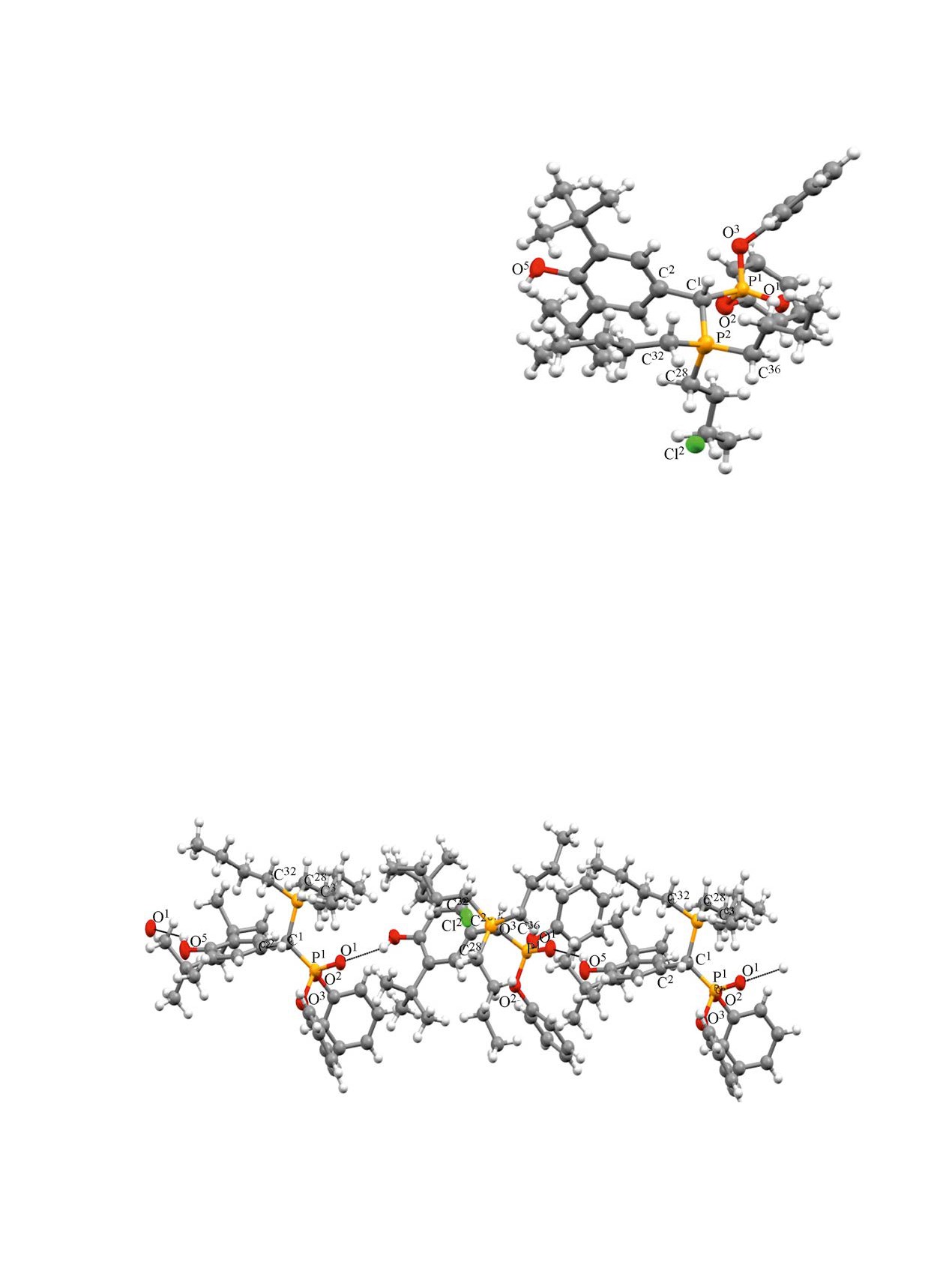
водородно-связанных катионов (pис. 2). Хлорид-
феноксифосфорил)метил]фосфонийхлорида
13
анионы в образовании водородных связей уча-
(рис. 1).
стия не принимают. Водородные связи образуются
между гидроксильной группой пространственно
Важно отметить, что кристалл трибу-
затрудненного фенола и фосфорильной группой
тил[(3,5-ди-трет-бутил-4-гидроксифенил)-(ди-
при атоме Р′.
феноксифосфорил)метил]фосфоний хлорида
13
стабилизирован водородными связями О-Н∙∙∙О,
Быстрое протекание реакций обусловле-
за счет которых образуются бесконечные цепи
но большим положительным зарядом на ато-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
СИНТЕЗ, СТРУКТУР
А ЧЕТВЕРТИЧНЫХ СОЛЕЙ ФОСФОНИЯ
1033
ме углерода, возникающим из-за влияния
электроноакцепторных феноксигрупп в дифенил-
[бром(3,5-ди-трет-бутил-4-гидроксифенил)-
метил]фосфонате 5 и метоксигрупп в диметил-
[бром(3,5-ди-трет-бутил-4-гидроксифенил)ме-
тил]фосфонатe 7, способствующим нуклеофиль-
ному замещению.
Строение полученных солей подтверждено
методами ЯМР и ИК спектроскопии. В спектрах
ЯМР 31Р фиксируются сигналы фосфонатного и
фосфониевого атомов фосфора, а в ИК спектрах
зафиксированы полосы поглощения гидроксиль-
ной и фосфорильной групп. Сигналы исходных
фосфинов и бромпроизводных в спектрах отсут-
ствуют, как и сигналы других побочных соедине-
ний. В табл. 1 представлены основные характери-
стики соединений 8-12.
Рис. 1. Общий вид молекулы хлорида фосфониевой
соли 13 в кристалле. Атомы С и Н показаны в сферах
Фунгицидную и бактерицидную активность со-
произвольного радиуса, гетероатомы представлены в
лей 8-12 исследовали на тест культурах патоген-
форме эллипсоидов анизотропных смещений с веро-
ятностью 30%.
ной и условно-патогенной микрофлоры человека
и животных. В работе использовали музейные
штаммы кафедры микробиологии Казанской госу-
дарственной медицинской академии: Escherichia
coli (ATCC 10536), Bacillus cereus (ATCC 10876),
культуры музейных штаммов стандартизовали до
Pseudomonas aeruginosa, Staphylococcus aureus
оптической плотности 0.5 по МакФарланду (1.5×
(ATCC 6538) и Candida albicans (ATCC 885-653)
108 КОЕ/мл). Чашки Петри с питательной средой
[20]. Для оценки активности непосредственно
Сабуро (для Candida albicans) и Мюллера-Хин-
перед исследованием готовили 0.01%-ные рас-
тона для всех остальных микроорганизмов засе-
творы солей фосфония 8-12 в спирте. Суточные
вали стандартизованными взвесями тест-культур,
Рис. 2. Система водородных связей в кристалле соли 13. Водородные связи показаны пунктиром.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1034
ГАЛКИНА и др.
Таблица 2. Антимикробная активность солей фосфония 8-12
Величина зоны задержки роста, мм
Соединение
E. coli
B. cereus
Ps. аeruginosa
S. aureus
C. albicans
8
18+0.2
17+0.3
22+0.3
30+0.2
27+0.1
9
21+0.2
19+0.3
15+0.1
35+0.5
35+0.4
10
15+0.2
13+0.1
8+0.1
25+0.3
24+0.4
11
17+0.2
15+0.3
15+0.2
33+0.3
26+0.3
12
15+0.2
13+0.3
11+0.2
35+0.4
28+0.5
Хлоргексидин
15+0.3
11+0.2
13+0.4
9+0.2
16+0.3
Мирамистин
0
13+0.3
0
0
13+0.1
Клотримазол
0
0
0
0
16+0.1
используя тампон. Через 5 мин на поверхность
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
агара бактериологической петлей наносили каплю
Спектры ЯМР 31Р регистрировали на приборе
исследуемого вещества. В одну чашку помещали
AVANCE-400 Bruker, а также на спектрофотометре
5 химических соединений, в центр чашки наноси-
Varian Unity-300 с рабочей частотой 121.64 МГц.
ли растворитель (для контроля возможного анти-
Рентгеноструктурное исследование кристалла
бактериального эффекта) или стандартное лекар-
хлорида 13 проведено на дифрактометре Bruker
ственное вещество для сравнения. Через 24-48 ч
AXS Smart APEX II CCD на рентгеновском излуче-
инкубации при 37°С оценивали величину зоны за-
нии MoKα (λ 0.71073 Å) при 293(2) K. ИК спектры
держки роста микроорганизмов (табл. 2).
записывали на приборах Specord М-80, Specord
Как видно из табл. 2, соли фосфония с двумя
75IR в диапазоне 500-3700 см-1 в таблетках KBr,
различными атомами фосфора 8-12 обладают од-
в виде суспензии в вазелиновом масле и в жидкой
новременно высокой бактерицидной и высокой
пленке между пластинами КBr.
фунгицидной активностью, данный эффект прояв-
Все фосфины, фосфиты, фосфиниты, 4-ме-
ляется при низких концентрациях на фоне низкой
тил-2,6-ди-трет-бутилфенол,
N,N-диме-
токсичности (LD50 160 мг/кг, III класс токсичности
тил-(3,5-ди-трет-бутил-4-гидроксибензил)амин
в соответствии с ГОСТ 121.007-76). Почти все со-
и N-бромсукцинимид - коммерческие реагенты,
единения обладают высокой селективной активно-
дополнительно очищенные перекристаллизацией
стью в отношении культур Staphylococcus aureus и
или перегонкой. Свежеперегнанные исходные ре-
Candida albicans соответственно. Практические
агенты идентифицировали сравнением констант с
все полученные фосфониевые соли целесообразно
литературными данными. Растворители очищали
рекомендовать для дальнейшего изучения в каче-
и обезвоживали обычными методами [20-22].
стве микробиологических препаратов.
Дифенил(3,5-ди-трет-бутил-4-гидрокси-
Таким образом, предложенный метод синтеза
бензил)фосфонат (2). Смесь 5.26 г (0.02 моль)
четвертичных фосфониевых солей с двумя раз-
2,6-ди-трет-бутил-4-(диметиламинометил)фено-
личными атомами фосфора на основе реакций
ла и 4.68 г (0.02 моль) дифенилфосфита выдер-
третичных фосфинов с бромпроизводными про-
живали 3 ч в атмосфере аргона при 130°С. Реак-
странственно затрудненных фенолов прост, удо-
ционную массу охлаждали до 60°С и добавляли
бен и эффективен, а главное, позволяет получать
небольшое количество (не более 1 мл) ацетони-
соответствующие соли фосфония с высокой анти-
трила при тщательном перемешивании. Смесь
микробной активностью, что открывает широкие
полностью закристаллизовалась. Кристаллы от-
возможности для синтеза новых отечественных
фильтровывали и промывали небольшим количе-
лекарственных препаратов и антисептиков.
ством гексана. Выход 8.9 г (89%), светло-коричне-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
СИНТЕЗ, СТРУКТУР
А ЧЕТВЕРТИЧНЫХ СОЛЕЙ ФОСФОНИЯ
1035
вые кристаллы, т. пл. 135°С (октан). Найдено, %:
бромид (8). а. К раствору 0.265 г (0.0005 моль)
C 71.75; H 7.18; P 6.91. C27H33O4P. Вычислено, %:
маслообразного соединения 5 в 10 мл эфира при-
C 71.66; H 7.35; P 6.84.
бавляли 0.101 г (0.0005 моль) трибутилфосфина.
Смесь выдерживали 5 мин при 20°С, выпавший
Дифенил[бром(3,5-ди-трет-бутил-4-гид-
кристаллический осадок промывали эфиром и су-
роксифенил)метил]фосфонат (5). а. К кипяще-
шили. Выход 0.202 г (60%), т. пл. 229°С (разл.).
му раствору 2.25 г (0.005 моль) соединения 2 в
Спектр ЯМР 31P (CH3OD), δР, м. д.: 36.5 д (1Р,
25 мл CCl4 добавляли по каплям раствор 0.8 г
Bu3P+, JPP 7.8 Гц), 9.8 д [1Р, (PhО)2P(О), JPP 7.8 Гц].
(0.005 моль) брома в 25 мл CCl4 при облуче-
Найдено, %: C 64.15; H 8.14; P 8.44. C39H59BrO4P2.
нии лампой с вольфрамовой нитью мощностью
Вычислено, %: C 63.84; H 8.10; P 8.44.
300 Вт в течение 3 ч, после чего смесь кипятили
1 ч. Растворитель удаляли в вакууме. Выход 2.5 г
б. Реакцию эквимольных количеств соответ-
(94%), оранжевое вязкое масло. Спектр ЯМР 1Н
ствующего фосфоната и соответствующего фос-
(CH3OD), δ, м. д.: 2.75 с [18H, C(CH3)3], 4.88 д (1H,
фина проводили в 10 мл диэтилового эфира. Смесь
CHBr, JPH 21.0 Гц), 7.02 c (1H, OH), 8.13-8.83 м
выдерживали при 20оС в течение 15 мин, выпав-
(10H, C6H5), 8.87 д (2H, C6H2, JPH 1.6 Гц). Спектр
ший кристаллический осадок промывали эфиром
ЯМР 31P (CH3OD): δР 11.8 м. д. Найдено, %: C
и сушили. Поучили соединение 8 с примесью
61.15; H 6.14; P 5.84. C27H32BrO4P. Вычислено, %:
хлорида. Выход 0.322 г (87%), т. пл. 230°С (разл.).
C 61.02; H 6.07; P 5.83.
Спектр ЯМР 31P (CH3OD), δР, м. д.: 34.4 д (1Р,
Bu3P+, JPP 7.8 Гц), 9.8 д [1Р, (PhО)2P(О), JPP 7.8 Гц].
б. Реакцию эквимольных количеств фосфоната
Найдено, %: C 64.01; H 8.21; P 8.53. C39H59BrO4P2.
2 и бромсукцинимида проводили в 20 мл CCl4 при
Вычислено, %: 63.84; H 8.10; P 8.44.
облучении реакционной смеси лампой накалива-
ния с вольфрамовой нитью мощностью 300 Вт в
Соединения 9-12 получены аналогично по ме-
течение 3 ч, после чего сукцинимид отфильтро-
тодике б.
вывали, растворитель удаляли в вакууме, образо-
Трибутил[(3,5-ди-трет-бутил-4-гидроксифе-
вавшееся масло многократно промывали гексаном
нил)(дидецилфосфорил)метил]фосфонийбро-
и сушили диэтиловым эфиром. Выход 2 г (76%).
мид (9). Выход 0.581 г (70%), т. пл. 147°С. Спектр
Найдено, %: C 61.27; H 6.21; P 6.07. C27H32BrO4P.
ЯМР 31P (CH3OD), δР, м. д.: 38.5 (Bu3P+), 53.69
Вычислено, %: C 61.02; H 6.07; P 5.83.
[(Dec)2P(О)]. Найдено, %: C 67.77; H 11.21; P 7.55.
Соединения 6, 7 получены по методике б.
C47H91BrO2P2.Вычислено,%: 68.01; H 11.05; P 7.46.
4-[Бром(дидецилфосфорил)метил]-2,6-
[(3,5-Ди-трет-бутил-4-гидроксифенил)(ди-
ди-трет-бутилфенол (6). Выход 1.47 г (50%).
феноксифосфорил)метил]трифенилфосфоний-
Спектр ЯМР 31P (CH3OD), δP, м. д.: 68.9 м [1Р,
бромид (10). Выход 0.367 г (78%), т. пл. 238°С
Dec2P(O)·HBr], 53.2 м [1Р, Dec2P(O)СH2], 46.1 м
(разл.). Спектр ЯМР 31P (CH3OD), δР, м. д.: 23.4
[1Р, Dec2P(O)CHBr]. Найдено, %: C 66.85; H 18.44;
д (1P, Ph3P+, JPP 13.7), 8.2 д [1P, (PhO)2P(O)CH,
P 4.84. C35H64BrO2P. Вычислено, %: C 66.96; H
J
13.7]. Найдено, %: C 68.34; H 6.04; P 7.82.
PP
10.28; P 4.93.
C45H47BrO4P2. Вычислено, %: C 68.10; H 5.97; P
7.80.
Диметил[бром(3,5-ди-трет-бутил-4-гидрок-
сифенил)метил]фосфонат (7). Выход 2.4 г (71%),
[(3,5-Ди-трет-бутил-4-гидроксифенил)(ди-
т. пл. 105°С (гептан). Спектр ЯМР 1Н (CH3OD), δ,
метоксифосфорил)метил])трифенилфосфоний-
м. д.: 2.79 с [18H, C(CH3)3], 5.12 д (1H, CHBr, JPH
бромид (11). Выход 0.268 г (80%), т. пл. 145°С
11.3 Гц), 5.18 д (6H, CH3O, JPH 10.5), 7.12 c (1H,
(разл.). Спектр ЯМР 31P (CH3OD), δР, м. д.: 23.5
OH), 8.82 д (2H, C6H2, JPH 1.5 Гц). Спектр ЯМР 31P
д (1P, Ph3P+, JPP 10.4), 17.9 д [1P, (MeO)2P(O)CH,
(CH3OD), δP, м. д.: 21.0 октет [1P, (MeO)2P(O)CH].
JPP 10.4]. Найдено, %: C 63.01; H 6.67; P 9.31.
Найдено, %: C 50.45; H 7.02; P 7.75. C17H28BrO4P.
C35H43BrO4P2. Вычислено, %: C 62.78; H 6.47; P
Вычислено, %: C 50.13; H 6.93; P 7.61.
9.25.
Трибутил[(3,5-ди-трет-бутил-4-гидрокси-
Трибутил(3,5-ди-трет-бутил-4-гидроксифе-
фенил)(дифеноксифосфорил)метил]фосфоний-
нил)(диметоксифосфорил)метил)фосфонийбро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1036
ГАЛКИНА и др.
мид (12). Выход 0.264 г (87%), т. пл. 240°С (разл).
Давлетшин Рустам Рифхатович, ORCID: https://
Спектр ЯМР 31P (CH3OD), δР, м. д.: 34.1 д (1P,
orcid.org/0000-0002-1708-6985
Bu3P+, JPP 4.9), 19.9 д [1P, (MeO)2P(O)CH, JPP 4.9].
ФИНАНСОВАЯ ПОДДЕРЖКА
Найдено, %: C 57.43; H 9.67; P 10.23. C29H55BrO4P2.
Вычислено, %: C 57.14; H 9.09; P 10.16.
Работа выполнена за счет средств Программы
Рентгеноструктурное исследование кристал-
стратегического академического лидерства Казан-
ла хлорида 13 проведено на дифрактометре Bruker
ского (Приволжского) федерального университе-
AXS Smart APEX II CCD. Параметры ячейки и
та. Рентгеноструктурное исследование выполнено
экспериментальные данные получены при 296 K,
в рамках государственного задания Федерального
λ(MoKα) 0.71073 Å, ω- и φ-сканирование). Крис-
исследовательского центра «Казанский научный
таллы соединения 13 (C39H59O4P2Cl, M 689.25)
центр РАН» в отделении рентгеноструктурно-
бесцветные призматические моноклинные, т. пл.
го анализа Федерального центра коллективного
229°C (разл.); a
16.778(2), b
14.2708(19), c
пользования на базе лаборатории дифракционных
методов исследования Института органической и
17.387(2), β 103.861(2)°, V 4041.8(9) Å3, Z 4, про-
физической химии им. А.Е. Арбузова Казанского
странственная группа P21/n, dвыч 1.133 г/см3, μ
научного центра РАН.
0.209 мм-1, F(000) 1488, 2θmax < 57.4°. Было из-
мерено 33783 отражений (Rint 0.083), из них 9677
КОНФЛИКТ ИНТЕРЕСОВ
независимых, число наблюдаемых отражений с
I > 2σ(I) 3721. Учет поглощения проводили по про-
Авторы заявляют об отсутствии конфликта ин-
грамме SADABS [23]. Структура расшифрована
тересов.
прямым методом по программе SHELXT-2018/2
СПИСОК ЛИТЕРАТУРЫ
[24] и уточнена полноматричным МНК по F2 по
программе SHELXL-2018/3 [25]. Все расчеты вы-
1. Ван Везер Фосфор и его применение. М.: ИЛ, 1962.
полнены с использованием программного пакета
2. Лохматиков А.В., Воскобойникова Н.Е., Черепа-
нов Д.А., Сумбатян Н.В., Коршунова Г.А., Скула-
WinGX-2014.1 [26]. Не водородные атомы уточня-
чев М.В., Штейнхофф Ю., Мулкиджанян А.Я. //
ли в анизотропном приближении. Атомы водорода
Биохимия. 2014. Т. 79. № 10. С. 1332.
помещены в вычисленные положения и уточнены
3. Rokitskaya T.I., Murphy M.P., Skulachev V.P. //
по модели наездника. Рисунки молекул выполне-
Bioelectrochem. 2016. Vol. 111. P. 23.
ны в программе MERCURY [27], анализ межмо-
4. Андрияшин В.В., Бахтиярова Ю.В., Черкасов Р.А.,
лекулярных контактов выполнен по программе
Галкин В.И., Галкина И.В. ЖОрХ. 2012. Т. 48. Вып. 5.
PLATON [28]. Окончательные значения факторов
С. 1605; Andriyashin V.V., Bakhtiyarova Yu.V.,
расходимости: R 0.2148, wR2 0.3566 по всем от-
Cherkasov R.A., Galkin V.I., Galkina I.V. // Russ. J.
Org. Chem. 2012. Vol. 48. N 12. P. 1576. doi 10.1134/
ражениям, R 0.0970, wR2 0.2697 по наблюдаемым
S1070428012120160
отражениям, GOOF 0.971, число уточняемых па-
5. Андрияшин В.В., Бахтиярова Ю.В., Черкасов Р.А.,
раметров 425.
Галкин В.И. Галкина И.В. // ЖОрХ. 2012. Т.48.
Кристаллографические данные структуры де-
Вып. 5. С. 1603; Andriyashin V.V., Bakhtiyarova Yu.V.,
понированы в Кембриджском банке кристалло-
Cherkasov R.A., Galkin V.I., Galkina I.V. // Russ. J.
структурных данных (CCDC 2050285).
Org. Chem. 2012. Vol. 48. N 12. P. 1574. doi 10.1134/
S1070428012120159
ИНФОРМАЦИЯ ОБ АВТОРАХ
6. Пат. 2736054 (2020) РФ // Б. И. № 32. С. 11.
7. Пат. 2738609 (2020) РФ // Б. И. № 35. С. 13.
Галкина Ирина Васильевна, ORCID: https://
8. Пат. 2757490 (2021) РФ // Б. И. № 29. С. 10.
orcid.org/0000-0002-7899-555X
9. Пат. 2758054 (2021) РФ // Б. И. № 30. С. 14.
10. Овчинникова Л.П., Роцкая У.Н., Васюнина Е.А., Си-
Романов Семён Романович, ORCID: https://
ницина О.И., Кандалинцева Н.В., Просенко А.Е.,
orcid.org/0000-0002-9270-8932
Невинский Г.А. // Биоорг. хим. 2009. Т. 35 № 3.
Бахтиярова Юлия Валерьевна, ORCID: https://
С. 417; Ovchinnikova L.P., Rotskaya U.N., Vasyuni-
orcid.org/0000-0002-1865-274X
na E.A., Sinitsina O.I., Kandalintseva N.V., Prosen-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
СИНТЕЗ, СТРУКТУР
А ЧЕТВЕРТИЧНЫХ СОЛЕЙ ФОСФОНИЯ
1037
ko A.E., Nevinsrii G.A. // Bioorg. Chem. 2009. Vol. 35.
17. Мукменева Н.А., Кадырова П.А., Жаркова В.М. //
P. 379. doi 10.1134/S1068162009030145
ЖОХ. 1992. Т. 62. №. 7. С. 1372.
11. Орлова Т.Н., Толстикова Т.Г., Сорокина И.В.,
18. Gross H., Keitel I., Costisella B. // Phosphorus,
Долгих М.П., Воевога Т.В. // Хим.-фарм. ж. 2000.
Sulfur, Silicon, Relat. Elem. 1991. Vol. 62. P. 35. doi
Т. 34. № 2. С. 9; Orlova T.N., Tolstikova T.G., Soroki-
10.1080/10426509108034456
na I.V., Dolgikh M.P., Voevoga T.V. // Pharm. Chem J.
19. Alkorta1 J., Elguero J. // Struct. Chem.
2021.
2000. Vol. 34. N 9. P. 9. doi 10.1023/A:1005282022980
Vol. 32. P. 1755. doi 10.1007/s11224-021-01805-y
12. Бахтиярова Ю.В., Морозов М.В., Романов С.Р., Мин-
20. Першин Г.Н. Методы экспериментальной химиоте-
нуллин Р.Р., Шулаева М.П., Поздеев О.К., Галки-
рапии. М.: Медицина, 1971. 245с.
на И.В., Галкин В.И. // Изв. Акад. наук. Сер. хим.
21. Вайсбергер А., Проскауэр Э., Риддик Д., Тупс Э.
2020. № 8. С. 1569; Bakhtiyarova Y.V., Morozov M.V.,
Органические растворители. М.: ИЛ. 1958. 518 с.
Romanov S.R., Minnullin R.R., Shulaeva M.P., Pozde-
22. Общий практикум по органической химии / Под ред.
ev O.K., Galkina I.V., Galkin V.I. // Russ. Chem. Bull.
А.Н. Коста. М.: Мир, 1965. 678 с.
2020. Vol. 69. P. 1569. doi 10.1007/s11172-020-2936-y
23. Sheldrick G.M. SADABS. Bruker AXS Inc., Madison,
13. Ершов В.В., Никифоров Г.А., Володькин А.А.
USA, 1997.
Пространственно-затрудненные фенолы. М.: Химия,
24. Sheldrick G.M. // Acta Crystallogr. (A). 2015. Vol. 71.
1972. 352 с.
P. 3. doi 10.1107/S2053273314026370
14. Барсель В.А., Дулькин А.М., Демидов А.Е. // Вопр.
25. Sheldrick G.M. Acta Crystallogr. (C). 2015. Vol. 71.
онкол. 1977. № 11. С. 50.
P. 3. doi 10.1107/S2053229614024218
15. Ежова М.Н., Вербенко Е.В., Барсель В.А. // Вестн.
26. Farrugia L.J. // J. Appl. Crystallogr. 2012. Vol. 45.
дерматологии. 1986. № 9. С. 58.
16. Овчинникова Л.П., Роцкая У.Н., Васюнина Е.А.,
P. 849. doi 10.1107/S0021889812029111
Синицина О.И., Кандалинцева Н.В., Просенко А.Е.,
27. Macrae C.F., Edgington P.R., McCabe P., Pidcock E.,
Невинский Г.А. // Биоорг. хим. 2009. Т. 35 № 3.
Shields G.P., Taylor R., Towler M., van de Streek J. // J.
С. 417; Ovchinnikova L.P., Rotskaya U.N., Vasyuni-
Appl. Crystallogr. 2006. 39. N 3. P. 453. doi 10.1107/
na E.A., Sinitsina O.I., Kandalintseva N.V., Prosen-
S002188980600731X
ko A.E., Nevinsrii G.A. // Bioorg. Chem. 2009. Vol. 35.
28. Spek A.L. Acta Crystallogr. (D). 2009. Vol. 65. P. 148.
P. 379. doi 10.1134/S1068162009030145
doi 10.1107/S090744490804362X
Synthesis and Structure of Quaternary Phosphonium Salts
Based on Phosphorylated Sterically Hindered Phenols
I. V. Galkinaa,*, V. V. Andriyashina, S. R. Romanova, R. R. Davletshina, O. K. Pozdeevb,
M. P. Shulaevab, I. A. Litvinovc, and Yu. V. Bakhtiyarovaa
a A.M. Butlerov Institute of Chemistry, Kazan (Volga Region) Federal University, Kazan, 420008 Russia
b Kazan State Medical Academy, Kazan, 420012 Russia
c A.E. Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center “Kazan Scientific Center
of the Russian Academy of Sciences”, Kazan, 420088 Russia
*e-mail: vig54@mail.ru
Received March 29, 2022; revised April 13, 2022; accepted April 14, 2022
A procedure was developed for the synthesis of quaternary phosphonium salts with two phosphorus atoms [P(III)
and P(V)] based on phosphorylated hindered phenols. Stable phosphonium salts were obtained, the composition
and structure of which were established by a complex of chemical, physical and physicochemical methods (1Н
and 31Р NMR, IR spectroscopy, elemental and X-ray diffraction analysis). The resulting phosphonium salts have
high antimicrobial activity against pathogenic and opportunistic microflora of humans and animals.
Keywords: quaternary phosphonium salts, phosphorylated hindered phenols, antioxidant activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022