ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 7, с. 1109-1118
Памяти В. И. Галкина
УДК 544.032;544.72
САМОСБОРКА ОЛИГОПЕПТИДОВ ДИ- И ТРИГЛИЦИНА
В ТОНКИХ ПЛЕНКАХ НА ПОВЕРХНОСТИ
ГИДРОФИЛЬНОГО И ГИДРОФОБНОГО КРЕМНИЯ ПОД
ДЕЙСТВИЕМ ПАРОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
© 2022 г. А. С. Морозоваа,*, С. А. Зиганшинаа, М. А. Зиганшинb, А. А Бухараева
a Казанский физико-технический институт имени Е. К. Завойского, Федеральный исследовательский центр
«Казанский научный центр Российской академии наук», ул. Сибирский тракт 10/7, Казань, 420029 Россия
b Химический институт имени А. М. Бутлерова, Казанский (Приволжский) федеральный университет,
Казань, 420008 Россия
*e-mail: morozova_anna_s@mail.ru
Поступило в редакцию 31 марта 2022 г.
После доработки 16 мая 2022 г.
Принято к печати 19 мая 2022 г.
Изучено влияние степени гидрофобности подложки и количества аминокислотных остатков в молекуле
олигопептида на самосборку глицилглицина и глицилглицилглицина под действием паров органических
соединений. Методом атомно-силовой микроскопии исследовано влияние паров протонодонора и про-
тоноакцептора на морфологию тонких пленок олигопептидов. Управление самосборкой олигопептидов
возможно за счет тонкого подбора подложки и паров органических соединений, используемых для
насыщения тонких пленок. Предложена методика контроля состояния поверхности тонких пленок оли-
гопептидов с помощью метода атомно-силовой спектроскопии.
Ключевые слова: олигопептиды, самосборка, тонкие пленки, микроструктуры, наноструктуры, атом-
но-силовая микроскопия
DOI: 10.31857/S0044460X22070150, EDN: CRPGGL
Олигопептиды с небольшим числом аминокис-
препаратов [10], для стабилизации мембранных
лотных остатков - популярные объекты исследова-
белков при разработке наноразмерных и молеку-
ния благодаря своей способности к самоорганиза-
лярных устройств [11].
ции и самосборке [1]. На основе этих соединений
Вид наноструктур, образующихся при само-
могут быть получены наноразмерные материалы
организации олигопептидов, зависит от строе-
[2-4]. Такие материалы биосовместимы и находят
ния олигопептида, включая природу, количество
применение для биомедицинских, экологических
и порядок соединения аминокислотных остатков
и технологических приложений [5], используют-
[12-14], от методов формирования наноструктур
ся при изготовлении чувствительных сенсоров
[15-20], от внешних условий: температуры [21] и
[6], гибридных материалов [7], новых сорбентов,
магнитного поля [22].
способных селективно связывать газы и биологи-
чески активные вещества [8]. Олигопептиды ис-
Первичная структура олигопептида (природа,
пользуются в регенеративной медицине [9], при
количество и порядок соединения аминокислот-
изготовлении нового поколения лекарственных
ных остатков) в значительной степени определяет
1109
1110
МОРОЗОВА и др.
форму и вид наноструктур, формирующихся при
органических пленок [35].
его самоорганизации на поверхности подложек
В качестве подложек при изучении олигопепти-
[23]. Например, дифенилаланин при самосборке
дов методами атомно-силовой микроскопии (АСМ)
из раствора формирует нанотрубки, в то время
используются слюда или высокоориентированный
как дифенилаланин, отличающийся от дифени-
пиролитический графит, обладающие разными по-
лаланина двумя группами СН2, образует сферы
верхностными свойствами. Поверхность графита
[24, 25]. При исследовании влияния последова-
гидрофобна, в то время как поверхность слюды ги-
тельности аминокислотных остатков в тетрапепти-
дрофильна и заряжена отрицательно. Поверхность
дах с защитными группами Boc-Gly-Phe-Aib-Leu-
этих материалов атомарно-гладкая и используется
OMe и Boc-Gly-Leu-Aib-Phe-OMe обнаружено,
для исследования многих объектов, включая белки
что в первом случае формируются нескрученные
[36].
нити, а во втором зафиксированы лентовидные
На графите и слюде самопроизвольно фор-
структуры.
мируется аморфная пленка диглицина [32] или
Наноструктуры на основе олигопептидов по-
триглицина [33], в то время как на поверхности
лучают из растворов олигопептидов в различных
кремния происходит самосборка с образованием
растворителях [18, 26, 27] и в тонких пленках
кристаллических структур. К настоящему време-
[16, 17]. К достоинствам первого метода относят-
ни влияние степени гидрофобности подложки на
ся возможность совместной самоорганизации не-
вид наноструктуры практически не изучено.
скольких олигопептидов из раствора. Например,
Для исследования влияния поверхности под-
описано получение сложных структур из дифе-
ложек на морфологию олигопептидных пленок
нилаланина и его трет-бутилоксикарбонильно-
нами выбран монокристаллический кремний,
го (Вос) производного. По отдельности каждый
пластины которого после специальной обработки
из этих олигопептидов образует специфические
имели различную степень гидрофобности. Изуче-
структуры: дифенилаланин - трубчатые структу-
но влияние количества аминокислотных остатков
ры, а его Вос-производное - сферы. При совмест-
на самосборку ди- и трипептида на основе гли-
ной самоорганизации эти олигопептиды форми-
цина под действием паров органических соеди-
руют ожерелья, состоящие из сфер, соединенных
нений, проведен анализ влияния паров сильного
удлиненными элементами [18]. К недостаткам
протонодонора (этанола), сильного протоноак-
получения наноструктур из растворов относится
цептора (пиридина) и слабого протоноакцептора
большой расход растворителей, необходимость
(ацетонитрила) на морфологию тонких пленок
приготовления растворов с точной концентраци-
глицилглицина (GlyGly) и глицилглицилглицина
ей веществ [27, 28] и чувствительность системы к
(GlyGlyGly). Установлены условия формирования
температуре раствора [29], к примесям [30].
наноструктур заданной формы на их основе. Раз-
Для получения наноструктур в тонких плен-
работана методика контроля состояния поверхно-
ках используют осаждение из паровой фазы на
сти образцов с помощью атомно-силовой спектро-
различные подложки [16], технологию Ленгмюр-
скопии (АСС).
Блоджетт [17], обработку тонких аморфных пле-
Были получены АСМ изображения пленок ди-
нок парами органических соединений или воды
и трипептида на основе глицина на поверхностях
[21, 31]. В последнем случае вид образующихся
пластин монокристаллического кремния с различ-
наноструктур можно изменять, варьируя раство-
ной гидрофобностью. Ранее было установлено,
ритель и/или парообразный компонент [32, 33], а
что при самопроизвольном высыхании растворов
также время насыщения пленки парами [34]. При
GlyGly и GlyGlyGly на поверхности кремния фор-
получении аморфных тонких пленок к подложкам
мируются кристаллические структуры [32, 33].
предъявляются следующие требования: атомар-
Аморфные пленки GlyGly и GlyGlyGly на поверх-
но-гладкая поверхность без дефектов, отсутствие
ностях гидрофильного и гидрофобного кремния
сильного ван-дер-ваальсового взаимодействия с
получали по разработанной нами методике [33].
молекулами олигопептидов. В противном случае
происходит формирование структурированных
На поверхности гидрофильного кремния
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
САМОСБОРКА ОЛИГОПЕПТИДОВ ДИ- И ТРИГЛИЦИНА
1111
(а)
(б)
2.5 мкм
2.5 мкм
(в)
(г)
2.5 мкм
2.5 мкм
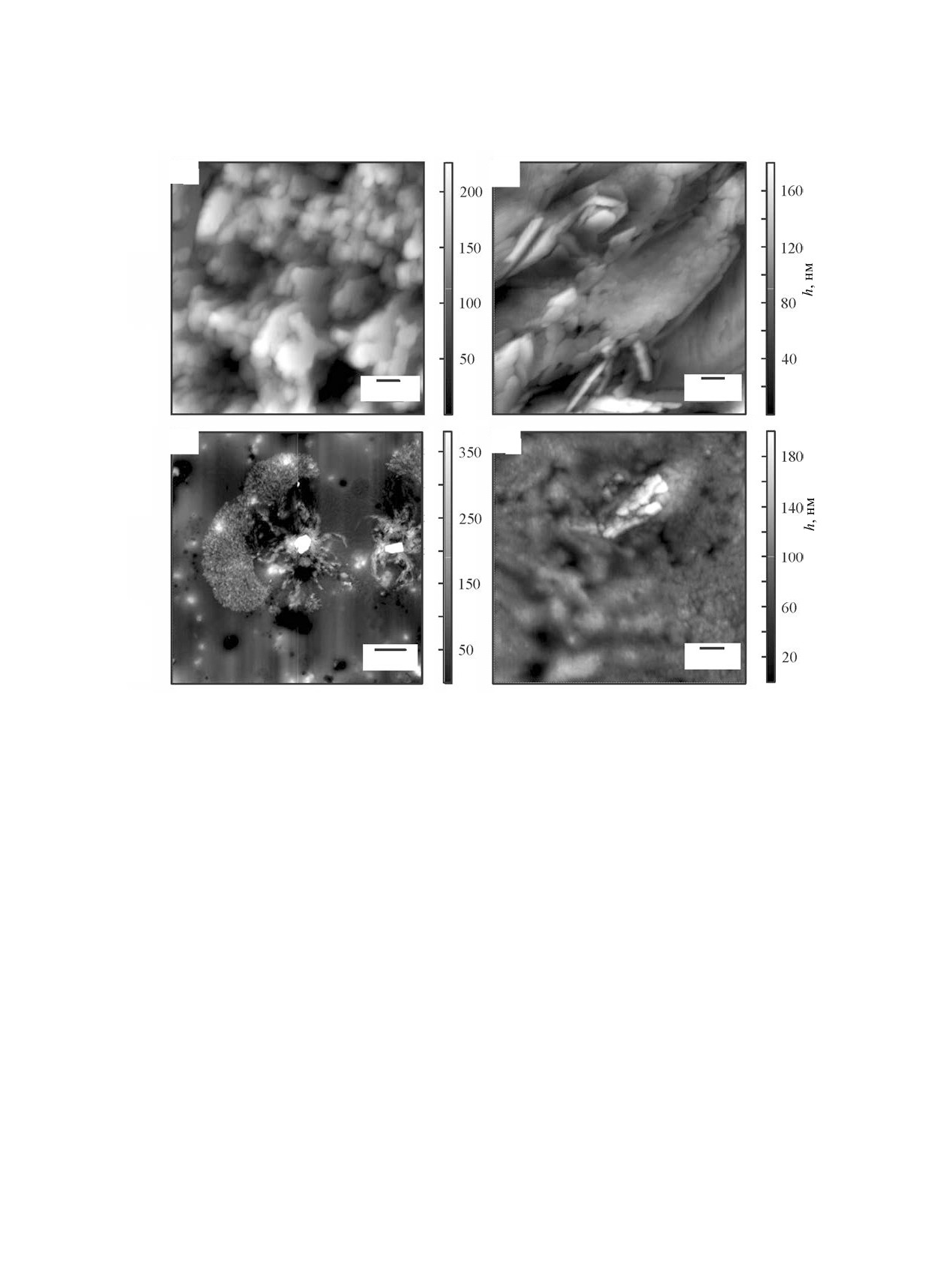
Рис. 1. АСМ-Изображения пленок GlyGly (а, б) и GlyGlyGly (в, г) на гидрофильном (а, в) и гидрофобном (б, г) кремнии
после принудительной сушки.
GlyGly образует более гладкую пленку (рис. 1а),
ний, формируются округлые объекты диаметром
чем GlyGlyGly (рис. 1в). Разброс по высоте плен-
0.3-0.7 мкм (рис. 2а). На поверхности гидрофоб-
ки из дипептида более чем в 10 раз меньше, чем
ного кремния образуются протяженные слоистые
пленки из трипептида. На поверхности пленки
структуры GlyGly (толщина слоя около 0.1 мкм) с
GlyGlyGly видны впадины глубиной до 100 нм,
крупными плоскими кристаллами на поверхности
образовавшиеся в следствие коллапса пузырьков
длиной 0.4-0.7 мкм и шириной 0.2-0.4 мкм (рис. 2б).
при испарении растворителя. На гидрофобной
На гидрофильном кремнии под действием пи-
подложке разброс по высоте пленки из GlyGlyGly
ридина происходит самосборка GlyGlyGly с об-
в 5 раз меньше, чем для GlyGly (рис 1б, г). На
разованием кристаллов двух типов: мелких до
пленках наблюдаются впадины.
0.3 мкм и крупных длиной до 3 мкм (рис. 2в), фаза
Были получены АСМ-изображения пленок
аморфной пленки сохраняется. После насыщения
GlyGly и GlyGlyGly, нанесенных на гидрофиль-
парами пиридина пленки GlyGlyGly на поверх-
ный и гидрофобный кремний после насыщения
ности гидрофобного кремния образуются мелкие
парами протоноакцептора пиридина и протонодо-
структуры размером от 100 до 700 нм (рис. 2г).
нора этанола (рис. 2, 3). На поверхности пленки
дипептида, нанесенной на гидрофильный крем-
При насыщении парами этанола пленок ди- и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1112
МОРОЗОВА и др.
(а)
(б)
0.5 мкм
0.5 мкм
(в)
(г)
5 мкм
1 мкм
Рис. 2. АСМ-Изображения пленок GlyGly (а, б) и GlyGlyGly (в, г) на гидрофильном (а, в) и гидрофобном (б, г) кремнии
после насыщения парами пиридина.
трипептида, нанесенных на гидрофильный или ги-
то время как пары протоноакцептора (пиридина)
дрофобный кремний, происходит их самосборка с
инициируют изменение морфологии поверхности
образованием кристаллических структур (рис. 3).
пленки, но не приводят к образованию упорядо-
На гидрофильном кремнии самосборка GlyGly и
ченных структур, т. е. на форму образующихся
GlyGlyGly начинается с появления зародыша, и
структур оказывает влияние природа органическо-
рост кристаллов происходит в радиальном направ-
го соединения, а не степень гидрофобности под-
лении (рис. 3а, в) с образованием структур треу-
ложки или количество аминокислотных остатков в
гольной формы. На гидрофобном кремнии в обоих
молекуле олигопептида.
случаях формируется двухфазная система из круп-
При насыщении пленки GlyGly, нанесенной на
ных кристаллов длиной до 4.5 мкм и мелких - дли-
разные подложки, парами слабого протоноакцеп-
ной от 0.2 до 0.6 мкм (рис. 3б, г).
тора (ацетонитрил) наблюдается формирование
Таким образом, под действием паров протоно-
совершенно разных по форме структур. На гидро-
донора (этанол) образуются хорошо ограненные
фильном кремнии образуются узкие вытянутые-
кристаллы ди- и трипетида на основе глицина, в
кристаллические структуры, напоминающие ворс,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
САМОСБОРКА ОЛИГОПЕПТИДОВ ДИ- И ТРИГЛИЦИНА
1113
(а)
(б)
1 мкм
5 мкм
(в)
(г)
0.5 мкм
0.5 мкм
Рис. 3. АСМ-Изображения пленок GlyGly (а, б) и GlyGlyGly (в, г) на гидрофильном (а, в) и гидрофобном (б, г) кремнии
после насыщения парами этанола.
длиной 0.4-2 мкм (рис. 4а). На гидрофобном крем-
на гидрофобной поверхности кремния оказывает
нии образуются крупные кристаллические струк-
значительное влияние количество аминокислот-
туры, похожие на ветви с иголками длиной от 0.4
ных остатков в молекуле олигопептида. На гидро-
до 2 мкм (рис. 4б).
фильной подложке пары ацетонитрила не способ-
ны инициировать самосборку трипептида.
Пары ацетонитрила на морфологию пленки
трипептида на гидрофильном кремнии практиче-
Для выяснения возможного влияния паров
ски не оказывают влияния (рис. 4в). Значительный
воды, содержащихся в окружающем воздухе,
эффект ацетонитрила наблюдается после насыще-
аморфные пленки GlyGly и GlyGlyGly, нанесен-
ния его парами пленки GlyGlyGly, нанесенной на
ные на поверхности гидрофильного и гидрофоб-
гидрофобный кремний (рис. 4г). Разброс по вы-
ного кремния, выдерживали в тех же условиях,
соте увеличивается до 0.8 мкм. На поверхности
но в отсутствие органических паров. Морфология
образуются как волокнообразные структуры, так
поверхности пленок не изменялась, образования
и хорошо очерченные кристаллы длиной от 1 до
каких-либо структур не происходило (рис. 5). На
3.5 мкм. Таким образом, на результат самосборки
поверхности пленок сохраняются впадины, при-
олигопептида в парах слабого протоноакцептора
сутствующие на исходных пленках (рис. 1). Таким
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1114
МОРОЗОВА и др.
(а)
(б)
2.5 мкм
2.5 мкм
(в)
(г)
1 мкм
2 мкм
Рис. 4. АСМ-Изображения пленок GlyGly (а, б) и GlyGlyGly (в, г) на гидрофильном (а, в) и гидрофобном (б, г) кремнии
после насыщения парами ацетонитрила.
образом, пары воды, присутствующие в воздухе,
взаимодействии с парами. На гидрофобной под-
не способны инициировать самосборку олиго-
ложке, по данным АСМ, наблюдается формирова-
пептидов, и для формирования наноструктур на
ние кристаллов трипептида (рис. 4г), и величина
поверхности пленок GlyGly и GlyGlyGly необхо-
силы адгезии уменьшается до 50 нН.
димо присутствие паров органических соедине-
Полученные результаты демонстрируют воз-
ний (рис. 2-4).
можность применения метода АСС для опреде-
Методом атомно-силовой спектроскопии
ления степени кристалличности наноструктур на
(АСС) были получены силовые кривые (рис. 6),
основе олигопептидов, нанесенных на различные
на основании которых рассчитана сила адгезии
поверхности.
Fадг полученных микро- и наноструктур к зонду.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для аморфных пленок GlyGly и GlyGlyGly вне за-
висимости от типа подложки она составляет 100-
В качестве объекта исследования использо-
120 нН. После насыщения парами ацетонитри-
вали глицилглицин
(98.0-100.5%, Chem-Impex
ла пленки GlyGlyGly на гидрофильной подложке
International) и глицилглицилглицин (≥99%, Chem-
(рис. 4в) сила адгезии возросла до 160 нН, что,
Impex International), органические растворители
по-видимому, связано с набуханием пленки при
для ГХ с чистотой ≥99.9%. Олигопептиды и орга-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
САМОСБОРКА ОЛИГОПЕПТИДОВ ДИ- И ТРИГЛИЦИНА
1115
(а)
(б)
2.5 мкм
2.5 мкм
(в)
(г)
2.5 мкм
2.5 мкм
Рис. 5. АСМ-Изображения пленок GlyGly (а, б) и GlyGlyGly (в, г) на гидрофильном (а, в) и гидрофобном (б, г) кремнии
после выдерживания на воздухе в отсутствие органических паров.
нические растворители использовали без допол-
нительной очистки. В качестве подложек исполь-
зовали гидрофобные и гидрофильные пластины
монокристаллического кремния. Гидрофильную
поверхность кремния получали путем ее обработ-
ки смесью концентрированной серной кислоты и
пероксида водорода (2:3). Гидрофобную поверх-
ность получали пассивацией очищенной кремни-
евой пластины в растворе плавиковой кислоты.
После обработки пластины кремния промывали
ΔZ, нА
дистиллированной водой и сушили в потоке те-
плого воздуха.
Для получения пленок ди- и трипептидов на ос-
нове глицина по методике [33] использовали рас-
Рис. 6. Кривые атомно-силовой спектроскопии для
твор олигопептидов (с 1 мг/мл), приготовленный
аморфной (1) пленки GlyGlyGly и пленки GlyGlyGly
растворением точной навески в смеси метанол-
после насыщения парами этанола (2) на гидрофильной
вода, 1:1. Четыре порции по 10 мкл свежеприго-
поверхности кремния.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1116
МОРОЗОВА и др.
товленного раствора ди- или трипептида после-
величины изгиба кантилевера ΔL (сила взаимодей-
довательно наносили на поверхность кремниевой
ствия зонда с поверхностью) от величины переме-
подложки и высушивали после нанесения каждой
щения пьезосканера (координата Z) при подводе
порции раствора горячим воздухом (45°С).
или отводе зонда и образца. Характерный вид си-
ловой кривой ΔL = f(z) представлен на рис. 6 [37].
Для насыщения пленок олигопептидов GlyGly
и GlyGlyGly парами органических соединений
Методом атомно-силовой микроскопии в ре-
(пиридин, ацетонитрил, этанол) подложку с на-
жиме силовой спектроскопии была рассчитана
несенной пленкой помещали в чашку Петри с 200
сила адгезии F между поверхностью наконечника
мкл органического растворителя. Чашку Петри
микрозонда и поверхностью образца по уравне-
герметизировали и выдерживали при комнатной
нию (1), отклонение кантилевера σc рассчитывали
по уравнению (2).
температуре 1 сут. Непосредственно перед иссле-
дованиями методом атомно-силовой микроскопии
(1)
пленки сушили в потоке воздуха (45°С).
Изображения АСМ регистрировали с помо-
щью атомно-силового микроскопа Solver P47 Pro
(2)
(НТ-МДТ, Россия). Измерения проводили на воз-
духе в полуконтактном режиме с частотой от 114
до 259 кГц и разрешением 512 точек на линию.
где kc - константа упругости кантилевера, σc - от-
Использовали стандартные кремниевые кантиле-
клонение кантилевера ΔL - величина изгиба кан-
веры NSG-11 (НТ-МДТ, Россия). Для управления
тилевера при отрыве, α - угол наклона силовой
микроскопом использовали программное обеспе-
кривой отвода АСС, характеризующий жесткость
чение Nova (NT-MDT, Россия). Все изображения
образца.
АСМ получены при комнатной температуре. Тем-
пературу контролировали внешним термометром.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Перед визуализацией микроскоп подвергали тер-
мическому уравновешиванию в течение не менее
org/0000-0002-9274-7958
1 ч. Изображения обрабатывали и анализировали
с помощью программы Image Analysis (NT-MDT,
Зиганшина Суфия Асхатовна, ORCID: https://
Россия). Все изображения представлены в виде
orcid.org/0000-0003-2827-2297
необработанных данных, за исключением
1D
Зиганшин Марат Ахмедович, ORCID: http://
и/или 2D коррекции. Погрешность определения
orcid.org/0000-0002-8280-6774
5% по латеральному размеру и менее 1 нм по вы-
Бухараев Анастас Ахметович, ORCID: http://
соте. Измерения начинали через 15-20 мин после
orcid.org/0000-0002-0966-7616
установки образцов в измерительную камеру. Вре-
мя измерения образца варьировали от 1 до 3 ч.
ФИНАНСОВАЯ ПОДДЕРЖКА
Для исследования степени гидрофобности
кремния методом АСС был использован микро-
Работа выполнена при финансовой поддерж-
скоп Solver P47 (НТ-МДТ, Россия). Применялись
ке Российского фонда фундаментальных иссле-
кремниевые кантилеверы CSG-11 с константой
дований (проект № 20-32-90101, приготовление
жесткости 0.03 Н/м. Для уменьшения ошибок, свя-
образцов, АСМ, АСС измерения и их обработка,
занных с юстировкой и неточностью в определе-
А.С. Морозова) в рамках государственного за-
нии постоянной упругости кантилевера, серии экс-
дания Федерального исследовательского центра
периментов проводились одним и тем же зондом.
«Казанский научный центр РАН» (С.А. Зиганшина,
С помощью атомно-силового микроскопа из-
А.А. Бухараев), а также за счет средств Програм-
учали особенности локального силового взаимо-
мы стратегического академического лидерства Ка-
действия зонда с поверхностью. Получены сило-
занского (Приволжского) федерального универси-
вые кривые, представляющие собой зависимость
тета (М.А. Зиганшин).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
САМОСБОРКА ОЛИГОПЕПТИДОВ ДИ- И ТРИГЛИЦИНА
1117
КОНФЛИКТ ИНТЕРЕСОВ
18.
Yuran, S., Razvag Y., Reches M. // Acs Nano. 201. Vol.6.
P. 9559. doi 10.1021/nn302983e
Авторы заявляют об отсутствии конфликта
19.
Joshi K.B., Verma S. // J. Pept. Sci. 2008. Vol. 14. P. 118.
интересов.
doi 10.1002/psc.955
20.
Yan X., Cui Y., He Q., Wang K., Li J. // Chem. Mater.
СПИСОК ЛИТЕРАТУРЫ
2008. Vol. 20. P. 1522. doi 10.1021/cm702931b
21.
Ryu J., Park Ch.B. // Adv. Mater. 2008. Vol. 20. P. 3754.
1.
Kim S., Kim J.H., Lee J.S., Park C.B. // Small. 2015.
doi 10.1002/adma.200800364
Vol. 11. P. 3623. doi 10.1002/smll.201500169
22.
Зиганшин М.А., Ефимова И.Г., Бикмухаметова
2.
Wang T., Zhang Y.-R., Liu X.-H., Ge S., Zhu Y.-S. //
А.А., Горбачук В.В., Зиганшина С.А., Чукланов А.П.,
Biomolecules. 2019. Vol. 9. P. 733. doi 10.3390/
Бухараев А.А. // Физикохимия поверхности и за-
biom9110733
щита материалов. 2013. Т. 49. C. 1. doi 10.7868/
3.
Zelzer, M., Ulijn, R. V. // Chem. Soc. Rev. 2010. Vol. 39.
S0044185614010173
P.3351. doi 10.1039/C0CS00035C
23.
Ziganshin M. Gubina N.S., Gerasimov A.V., Gorbat-
4.
Marchesan S., Vargiu A.V., Styan K.E.
/ /
chuk V.V., Ziganshina S.A., Chuklanov A.P., Bukhara-
Molecules. 2015. Vol. 20. P. 19775. doi 10.3390/
ev A.A. // Phys. Chem. Chem. Phys. 2015. Vol. 7.
molecules201119658
P. 20168. doi 10.1039/C5CP03309H.
5.
Sheehan F., Sementa D., Jain A., Kumar M., Tayarani-
24.
Reches M., Gazit E. // Nano Lett. 2004. Vol. 4. P. 581.
Najjaran M., Kroiss D., Ulijn R.V. // Chem. Rev. 2021.
doi 10.1021/nl035159z
Vol. 121. P. 13869. doi 10.1021/acs.chemrev.1c00089
25.
Gazit E. // Chem. Soc. Rev. 2007. Vol. 36. P. 1263. doi
6.
Slabov V., Kopyl S., P. Soares dos Santos M.,
Kholkin A. Piezoelectricity in Self-Assembled
10.1039/b605536m
Peptides: A New Way towards Electricity Generation at
26.
Görbitz C.H. // Chem. Eur. J. 2001. Vol. 7. P. 5153.
Nanoscale: IntechOpen, 2020. P. 1.
doi 10.1002/1521-3765(20011203)7:23<5153:aid-
7.
Vandermeulen, G.W.M., Klok, H.-A. // Macromolecular
chem5153>3.0.co;2-n
Biosci. 2004. Vol. 4. P. 383. doi 10.1002/
27.
Rissanou A.N., Georgilis E., Kasotakis E., Mitraki A.,
mabi.200300079
Harmandaris V. // J. Phys. Chem. (B). 2013. Vol. 117.
8.
Ziganshin M.A., Ziganshina S.A., Gubina N.S.,
P. 3962. doi 10.1021/jp311795b
Gerasimov A.V., Gorbatchuk V.V., Bukharaev A.A.// J.
28.
Acuña S.M., Veloso M.C., Toledo P.G. // J. Nanomater.
Chem. 2015. Vol. 31. P. 1977. doi 10.13005/ojc/310415
2018. Vol. P. 1. doi 10.1155/2018/8140954
9.
Mata A., Geng Y., Henrikson K.J., Aparicio C.,
29.
Huang R., Qi W., Su R., Zhao J., He Z. // Soft Matter.
Stock S.R., Satcher R.L., Stupp S.I. // Biomaterials. 2010.
2011. Vol. 7. P. 6418. doi 10.1039/c1sm05752a
Vol. 31. P. 6004. doi 10.1016/j.biomaterials.2010.04.013
30.
Evans P.G., Spalenka J.W. Handbook of crystal growth.
10.
Tomono T., Yagi H., Kanemoto S., Ukawa M., Miyata K.,
2015. P. 509.
Shigeno K., Sakuma S. // Int J Pharm. 2022. Vol. 616.
31.
Lee J.S., Ryu J., Park C.B. // Soft Matter. 2009. Vol. 5.
doi 121519 10.1016/j.ijpharm.2022.121519.
P. 2717. doi 10.1039/b906783c
11.
Yang Y., Ulung K., Wang X., Horii A., Yokoi H.,
32.
Ziganshin M.A., Morozova A.S., Ziganshina S.A.,
Zhang Sh. // Nano Today. 2009. Vol. 4. P. 193. doi
Vorobev V.V., Suwińska K., Bukharaev A.A., Gorbat-
10.1016/j.nantod.2009.02.009
chuk V.V. // Molecular Crystals Liquid Crystals. 2019.
12.
Adler-Abramovich L., Kol N., Yanai I., Barlam D.,
Vol. 690. P.67. doi 10.1080/15421406.2019.1683311
Shneck R. Z., Gazit E. // Angew. Chem. Int. Ed. 2010.
33.
Морозова А.С., Зиганшина С.А., Бухараев А.А.,
Vol. 49. P. 9939. doi 10.1002/anie.201002037
Зиганшин М.А., Герасимов А.В. // Поверхность.
13.
Tamamis P., Adler-Abramovich L., Reches M., Mar-
2020. Вып.5. С.73; Morozova A.S., Ziganshina S.A.,
shall K., Sikorski P., Serpell L., Gazit E., Archontis G. //
Bukharaev A.A., Ziganshin M.A., Gerasimov A.V. //J.
Biophys. J. 2009. Vol. 96. P. 5020. doi 10.1016/j.
Surface Invest.: X-ray, Synchrotron Neutron Tech. 2020.
bpj.2009.03.026
Vol. 14. P. 499. doi 10.1134/S102745102003009X
14.
Dutta A., Dutt A., Drew M.G.B., Pramanik A. //
34.
Romanyuk K., Slabov V., Alikin D., Zelenovskiy P.,
Supramolecular Chem. 2008. Vol. 20. P. 625. doi
Correia M. R. P., Keller K., Ferreira R. A.S., Vasilev S.,
10.1080/10610270701565194
Kopyl S., Kholkin A. // Appl. Mater. Today 2022.
15.
Li H., Zhang F., Zhang Y., Hel J., Hu J. // Acta Bioch.
Biophys. Sin. 2007. Vol. 39. P. 285. doi 10.1111/j.1745-
Vol. 26. doi 10.1016/j.apmt.2021.101261
7270.2007.00278.x
35.
Brooks J.S. // Chem. Soc. Rev. 2010. Vol. 39. P. 2667.
16.
Tao K., Makam P., Aizen R., Gazit E. // Science. 2017.
doi 10.1039/B913417B
Vol. 358. P. 1. doi 10.1126/science.aam9756
36.
Sidney P.S., Marchant R.E. // Surface Sci. 2001.
17.
Zasadzinski J., Viswanathan R., Madsen L., Garnaes J.,
Vol. 491. P. 421. doi 10.1016/S0039-6028(01)01308-5
Schwartz D. // Science. 1994. Vol. 263. P.1726. doi
37.
Миронов В.Л. Основы сканирующей зондовой
10.1126/science.8134836
микроскопии. М.: Техносфера, 2009. С. 144.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022
1118
МОРОЗОВА и др.
Self-Organization of Di- and Triglycine Oligopeptides
in Thin Films on the Surface of Hydrophilic and Hydrophobic
Silicon Under the Action of Organic Compounds Vapors
A. S. Morozovaa,*, S. A. Ziganshinaa, M. A. Ziganshinb, and A. A. Bukharaeva
a Zavoisky Physical-Technical Institute, Federal Research Center “Kazan Scientific Center of the Russian Academy
of Sciences”, Kazan, 420029 Russia
b A.M. Butlerov Chemical Institute, Kazan (Volga region) Federal University, Kazan, 420008 Russia
*e-mail: morozova_anna_s@mail.ru
Received March 31, 2022; revised May 16, 2022; accepted May 19, 2022
In this work the effect of the substrate hydrophobicity degree and the number of amino acid residues in the oli-
gopeptide molecule on the self-assembly of glycyl-glycine and glycyl-glycyl-glycine under the action of vapors
of organic compounds was studied. The effect of strong and weak protonodonor and protonoacceptor vapors
on the morphology of thin films of oligopeptides based on glycine was studied by atomic-force microscopy.
The possibility of the control of the oligopeptides self-assembly by precise selection of the substrate type and
vapors of organic compounds used for thin films saturation has been demonstrated. A technique for surface state
monitoring of the oligopeptides thin film using atomic force spectroscopy is proposed.
Keywords: oligopeptides, self-assembly, thin film, microstructure, nanostructure, atomic-force microscopy
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 7 2022