ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 8, с. 1263-1274
УДК 547.564.4’371’576:541.49:546.824’131:547.313:541.128
ДИЗАЙН ПОСТМЕТАЛЛОЦЕНОВЫХ
КАТАЛИТИЧЕСКИХ СИСТЕМ АРИЛИМИННОГО
ТИПА ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ:
XIX.1 СИНТЕЗ N-(4-АЛЛИЛОКСИ-2,3,5,6-
ТЕТРАФТОРФЕНИЛ)САЛИЦИЛАЛЬДИМИНОВ И ИХ
КОМПЛЕКСОВ С ДИХЛОРИДОМ ТИТАНА(IV)
© 2022 г. И. В. Олейникa, И. И. Олейникa,*
a Новосибирский институт органической химии имени Н. Н. Ворожцова Сибирского отделения
Российской академии наук, пр. Академика Лаврентьева 9, Новосибирск, 630090 Россия
*е-mail: oleynik@nioch.nsc.ru
Поступило в редакцию 5 мая 2022 г.
После доработки 9 июня 2022 г.
Принято к печати 13 июня 2022 г.
При взаимодействии 3- и 3,5-замещенных салициловых альдегидов, содержащих в положении 3 трет-
бутильную или 2-фенилпропан-2-ильную группы, с 4-аллилокси-2,3,5,6-тетрафторанилином в толуоле
в присутствии пара-толуолсульфокислоты получен ряд соответствующих (N-арил)салицилальдиминов,
образующих при взаимодействии с TiCl2(OPr-i)2 комплексы дихлорида титана(IV) L2TiCl2.
Ключевые слова: салициловые альдегиды, 4-аллилокси-2,3,5,6-тетрафторанилин, салицилальдарили-
мины, комплексы дихлорида титана(IV)
DOI: 10.31857/S0044460X22080133, EDN: IPUKVG
Промышленное производство сверхвысокомо-
лальдарилиминных комплексов дихлорида тита-
лекулярного полиэтилена (линейный полиэтилен
на(IV), содержащих пентафторфенилиминогруппу
с молекулярной массой выше 106 Да) осущест-
(структура А, схема 1), образуется сверхвысоко-
вляется полимеризацией этилена на гетерогенных
молекулярный полиэтилен с неспутанными ма-
мультицентровых катализаторах Циглера-Натта
кромолекулами, если полимеризация проводится
или на титан-магниевых катализаторах, оптимум
при низкой температуре. Однако образующийся
производительности которых находится при повы-
полимер сильно налипает на внутренние стенки,
шенной температуре [2-4]. Промышленый сверх-
мешалку и терморегулирующее оборудование ре-
высокомолекулярный полиэтилен характеризуется
актора. Налипание полимера нарушает отвод теп-
высокой степенью взаимного переплетения макро-
ла и делает невозможным управление процессом
молекул.
полимеризации [5-8].
При полимеризации этилена в присутствии
В серии работ показано, что салицилальда-
гомогенных катализаторов на основе салици-
рилиминные комплексы дихлорида титана(IV),
содержащие аллилокси- и диаллиламинофенил-
1 Сообщение XVIII см. [1].
иминогруппу (структуры Б и В), в процессе полиме-
1263
1264
И.В. ОЛЕЙНИК, И.И. ОЛЕЙНИК
Схема 1.
R2
R2
R1
F
R1
O N
F
O N
F
O
F
F
TiCl2
F
F
TiCl2
n
n
F
O
F
N
O
N
O
F
R1
R1
R2
Б
R2
А
R2
R2
R1
R1
F4
O N
O N
N
O
TiCl2
TiCl2
O
N
N
O
N
O
F
4
R1
R1
В
R2
Г
R2
ризации самоиммобилизируются (закрепляются)
иминогруппу, не способны продуцировать сверх-
на полиэтилене и продуцируют сверхвысокомоле-
высокомолекулярный полиэтилен. Возможность
кулярный полиэтилен с низкой степенью перепле-
получения сверхвысокомолекулярного полиэтиле-
тения макромолекул в форме порошка с мелкими
на с низкой степенью переплетения макромолекул
частицами и низкой насыпной плотностью [9]. Это
в форме порошка с мелкими частицами и низкой
обусловлено тем, что в процессе полимеризации
насыпной плотностью в условиях промышленного
гомогенный катализатор самопроизвольно пре-
производства открывает перспективу разработки
вращается в гетерогенный, а в качестве носителя
технологически более совершенного, экономич-
выступает растущая макромолекула полиэтилена.
ного и экологически чистого способа производ-
Удивительно, что аналоги таких комплексов, не
ства высокомодульных высокопрочных волокон
содержащие аллилокси- или диаллиламинофенил-
из сверхвысокомолекулярного полиэтилена, ос-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
ДИЗАЙН ПОСТМЕТАЛЛОЦЕНОВЫХ КАТАЛИТИЧЕСКИХ СИСТЕМ
1265
нованного на твердотельной (без растворителя)
ветствующих иминов 3а-п после очистки от по-
деформационной обработке таких реакторных
бочных продуктов осмоления составляют 70-75%.
порошков, при которой происходит монолитиза-
Строение салицилальдарилиминов 3а-п уста-
ция реакторного порошка в ленту с последующей
новлено на основании совокупности аналитиче-
многократной вытяжкой, получившего название
ских и спектральных данных. Данные ЯМР 1Н
«метод холодного формования» [9, 10].
спектроскопии позволяют предположить, что
Дальнейшее совершенствование каталитиче-
полученные основания Шиффа являются инди-
ской системы видится в использовании ещё неиз-
видуальными Е-изомерами. В спектрах ЯМР 1Н
вестных гибридных комплексов, получающихся
соединений 3а-п наряду с сигналами заместите-
лей салицилиденового фрагмента присутствуют
введением атомов фтора в аллилоксифенилими-
синглеты групп N=CH в области 8.68-8.83 м. д.
ногруппу салицилальдарилиминных комплек-
и синглеты групп ОH в области 12.22-13.16 м. д.
сов дихлорида титана(IV) (структура Г). Следует
Аллилоксигруппа арилиминного фрагмента ос-
ожидать проявления у таких комплексов синер-
нований Шиффа 3а-п дает характерный набор
гического эффекта - способности продуцировать
сигналов, аналогичный наблюдаемому для исход-
сверхвысокомолекулярный полиэтилен с низкой
ного 4-аллилокси-2,3,5,6-тетрафторанилина 2. В
степенью переплетения макромолекул с большей
спектрах ЯМР 19F присутствуют симметричные
молекулярной массой и большей производитель-
сигналы равной интенсивности в области 4.72-
ностью при повышенных температурах, посколь-
5.16 и 8.15-8.88 м. д. В спектрах ЯМР 13С сигна-
ку в таких комплексах объединены структуры обо-
лы атомов углерода CH2, CH= и =СН2 O-аллиль-
их комплексов А и Б.
ной группы проявляются в областях 75.41-75.51,
В рамках систематического исследования вли-
132.00-132.18 и 120.00-120.14 м. д. соответствен-
яния структурной модификации салицилальдари-
но, а сигналы атомов углерода иминной группы - в
лиминных комплексов дихлорида титана(IV) на
области 168.26–170.63 м. д.
их активность при полимеризации этилена и свой-
В ИК спектрах салицилальдарилиминов 3а-п
ства получающегося полиэтилена в настоящей
имеется интенсивная полоса поглощения в обла-
работе описан синтез салицилальдарилиминных
сти 1593-1614 см-1, отвечающая валентным ко-
лигандов и комплексов дихлорида титана(IV), со-
лебаниям связи C=N иминной группировки. В
держащих 4-аллилокси-2,3,5,6-тетрафторфенили-
масс-спектрах феноксииминов 3а-п присутствует
миногруппу.
интенсивный пик молекулярного иона.
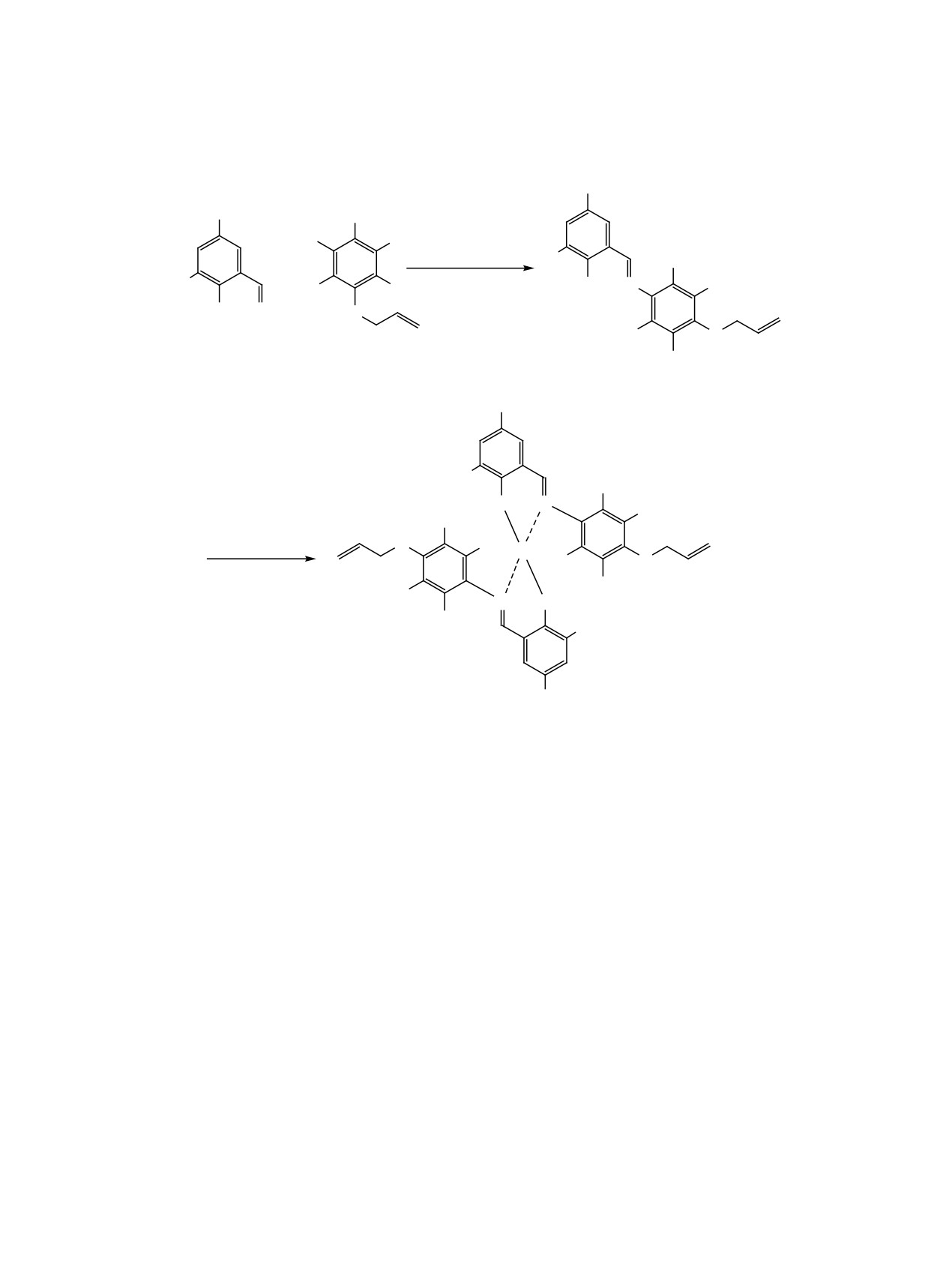
В литературе отсутствуют сведения о синтезе
Для синтеза комплексов 4а-п был применен
оснований Шиффа из 4-аллилокси-2,3,5,6-тетра-
одностадийный метод, заключающийся во вза-
фторанилина. Поэтому синтез рассматриваемых
имодействии лиганда с диизопропоксититан-
(N-арил)салицилальдиминов осуществляли по
дихлоридом TiCl2(OPr-i)2, разработанный для
аналогии с работами [1, 11] взаимодействием 3- и
получения комплексов с феноксииминными ли-
3,5-замещенных салициловых альдегидов 1а-п с
гандами, содержащими объемные заместители
4-аллилокси-2,3,5,6-тетрафторанилином 2 (схема 2).
[1, 11]. При действии эквимольных количеств рас-
В отличие от нефторированных изомерных
твора TiCl2(OPr-i)2 в толуоле на имины 3а-п при
аллилоксианилинов [1, 11], реагирующих с заме-
комнатной температуре с высокими выходами об-
щенными салициловыми альдегидами в мягких
разуются комплексы дихлорида титана(IV) 4а-п
условиях (кипячение в метаноле), 4-аллилокси-
(схема 2).
2,3,5,6-тетрафторанилин проявляет низкую ре-
Состав комплексов 4а-п подтверждается со-
акционную способность при конденсации с за-
вокупностью аналитических и спектральных дан-
мещенными салициловыми альдегидами
1а-п.
ных. В ИК спектрах комплексов присутствуют
Высокой степени конверсии удается достичь при
полосы поглощения в области 430-490 см-1, со-
их длительном кипячении в толуоле в присутствии
ответствующие колебаниям связей Ti-N, а также
п-толуолсульфокислоты и СаSO4. Выходы соот-
в области 527-592 (Ti-O) и 1595-1603 см-1 (C=N).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
1266
И.В. ОЛЕЙНИК, И.И. ОЛЕЙНИК
Схема 2.
R2
R2
NH2
F
F
p-TSA, CaSO4
R1
F
+
R1
C6H5CH3
OH
N
F
F
F
OH
O
O
F
O
F
3а-п
1а-п
2
R2
R1
F
O N
F
F
TiCl2(OPr-i)2
O
F
TiCl2
F
O
F
F
N
O
F
R1
R2
4а-п
R1 = t-Bu, R2 = H (а); R1 = t-Bu, R2 = Br (б); R1 = t-Bu, R2 = Cl (в); R1 = t-Bu, R2 = Ме (г); R1 = t-Bu, R2 = ОМе (д);
R1 = R2 = t-Bu (е); R1 = t-Bu, R2 = CMe2(Ph) (ж); R1 = CMe2(Ph), R2 = H (з); R1 = CMe2(Ph), R2 = Br (и); R1 = CMe2(Ph),
R2 = Cl (к); R1 = CMe2(Ph), R2 = Ме (л); R1 = CMe2(Ph), R2 = ОМе (м); R1 = CMe2(Ph), R2 = t-Bu (н); R1 = R2 = CMe2(Ph)
(о); R1 = циклогексил, R2 = Сl (п).
В спектрах ЯМР 1Н комплексов 4а-п присут-
тетрафторфенилиминогруппу, и соответствую-
ствуют близкорасположенные сигналы протонов
щие им (N-арил)салицилальдиминные комплексы
НС=N-групп в области 8.02-8.43 м. д., что указы-
дихлорида титана(IV). Рассматриваемые комплек-
вает на присутствие нескольких стереоизомерных
сы могут использоваться в каталитических систе-
форм [1] комплексов 4а-п. Остальные протоны
мах полимеризации этилена.
проявляются в виде мультиплетов из-за взаимного
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
перекрывания соответствующих сигналов стерео-
форм комплексов. Сигналы OH-групп, наблюдае-
Аналитические и спектральные измерения
мые в спектрах исходных иминов 3а-п, отсутствуют.
были выполнены в Химическом исследователь-
Таким образом, впервые синтезированы осно-
ском центре коллективного пользования Сибир-
вания Шиффа, содержащие 4-аллилокси-2,3,5,6-
ского отделения РАН.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
ДИЗАЙН ПОСТМЕТАЛЛОЦЕНОВЫХ КАТАЛИТИЧЕСКИХ СИСТЕМ
1267
Спектры ЯМР 1Н, 13С и 19F растворов соедине-
1.3 Гц), 5.94-6.07 м (1H, ОСН2СН=СН2). Спектр
ний в CDCl3 регистрировали на приборах Bruker
ЯМР 13С, δC, м. д.: 75.79 т (OСН2СН=СН2, J
AV-300 (300.1, 75.5 и 282.4 МГц для 1Н, 13С и 19F,
2.5 Гц), 119.52 (ОСН2СН=СН2), 121.49 т. т (СF, J
соответственно) и Bruker AV-400 (400.1 и 100.6
14.5, 2.6 Гц), 120.14 (ОСН2СН=СН2 ), 127.01 т. т
МГц для 1H и 13С, соответственно). Химические
(СF, J 13.5, 2.3 Гц), 132.64 (ОСН2СН=СН2), 136.87
сдвиги 1Н и 13С определяли относительно оста-
д (2СFAr, J 238.7 Гц), 142.32 д (2СFAr, J 244.0 Гц).
точного сигнала хлороформа. В качестве внешне-
Спектр ЯМР 19F, δF, м. д.: -1.1 м (2F), 3.33 м (2F).
го стандарта для ядра 19F использовали C6F6. ИК
Масс-спектр, m/z: 221.0457 [M]+ (вычислено для
спектры записаны на спектрометре Vector 22 в та-
C9H7F4NO: 221.0458).
блетках KBr. Контроль за протеканием реакций и
Общая методика синтеза салицилальдари-
чистотой синтезированных соединений проводили
лиминов 3а-п. Смесь 1.5 ммоль альдегида 1а-п,
методом ТСХ на пластинах Silufol UV-254, в каче-
0.348 г (1.575 ммоль) 4-аллилокси-2,3,5,6-тетра-
стве элюента использовали хлороформ. Элемент-
фторанилина, 0.613 г CaSO4, 0.02 г п-толуолсуль-
ный анализ выполнен на CHNS-анализаторе Euro
фокислоты и 20 мл безводного толуола кипяти-
EA 3000. Брутто-формулы полученных соедине-
ли 12-30 ч до исчезновения исходных веществ
ний вычисляли из масс-спектров высокого разре-
по ТСХ. Осадок отфильтровывали, промывали
шения, записанных на спектрометре DFS Thermo
дихлорметаном (2×5 мл). Фильтрат упаривали,
Electron Corporation. Температуры плавления
остаток хроматографировали, используя силика-
определяли на приборе Mettler Toledo FP90 в ка-
гель 2-25μ, элюент - CHCl3-гексан (1:2), соби-
пилляре при нагревании со скоростью 1 град/мин.
рали первую ярко-желтую фракцию. Растворите-
Салициловые альдегиды 1а-п получали фор-
ли отгоняли, для получения кристаллов остаток
милированием соответствующих фенолов по ме-
растирали с 5 мл метанола, осадок отфильтровы-
тодике [11]. 4-Аллилокси-2,3,5,6-тетрафторанилин
вали, промывали 3 мл метанола и выдерживали в
получали из 4-аллилокси-2,3,5,6-тетрафторнитро-
вакуум-эксикаторе.
бензола [12] по модифицированной методике [11].
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
4-Аллилокси-2,3,5,6-тетрафторанилин
(2).
имино)метил]-6-трет-бутилфенол (3а). Выход
К кипящему раствору
22.57 г
(100 ммоль)
75%, т. пл. 53-54°С. ИК спектр, ν, см-1: 1602
SnCl2·2H2O в 30 мл этанола в атмосфере арго-
(С=N). Спектр ЯМР 1Н, δ, м. д.: 1.45 с [9Н,
на при перемешивании добавляли раствор 5.02 г
С(СН3)3], 4.72 д (2H, ОСН2СН=СН2, J 6.1 Гц),
(20 ммоль) 4-аллилокси-2,3,5,6-тетрафторнитро-
5.31 д. к (1H, ОСН2СН=СН2, J 10.3, 1.0 Гц), 5.39
бензола в 20 мл этанола. Смсеь кипятили 2 ч, затем
д. к (1H, ОСН2СН=СН2, J 17.1, 1.2 Гц), 5.96-6.11 м
охлаждали до комнатной температуры и выливали
(1H, ОСН2СН=СН2), 6.88 т (1НAr, J 7.6 Гц), 7.22 д.
в 100 мл воды. После добавления 150 мл насыщен-
д (1НAr, J 7.6, 1.4 Гц), 7.44 д. д (1НAr, J 7.6, 1.2 Гц),
ного раствора карбоната натрия экстрагировали
8.83 с (1H, СH=N), 13.09 с (1H, OH). Спектр ЯМР
метил-трет-бутиловым эфиром (4×50 мл), экс-
13С, δC, м. д.: 29.17 [С(СН3)3], 34.85 [С(СН3)3],
тракт сушили сульфатом магния. После отгонки
75.51 т (OСН2СН=СН2, J 3.2 Гц), 118.60 (СНAr),
растворителя остаток растворяли в 10 мл СНCl3,
118.66 (СAr), 120.14 (ОСН2СН=СН2 ), 122.01 т (СF,
подвергали флеш-хроматографии, используя сили-
J 11.8 Гц), 131.34 (СНAr), 131.66 (СНAr), 132.09
кагель 2-25μ, элюент - CHCl3-гексан (1:2), соби-
(ОСН2СН=СН2), 134.10 т. т (СF, J 12.7, 2.8 Гц),
рали первую бесцветную фракцию. Выход 3.54 г
137.97 (СAr), 141.07 д (2СFAr, J 249.7 Гц), 141.71 д
(80%), бесцветные кристаллы, т.пл. 43-44°С. ИК
(2СFAr, J 247.7 Гц),), 160.82 (СAr), 170.10 т (СН=N,
спектр, ν, см-1: 3403 (NH2), 3321 (NH2), 3213, 2950
J 5.1 Гц). Спектр ЯМР 19F, δF, м. д.: 4.86 м (2F), 8.36
(CH), 1668, 1512, 1421, 1362, 1192, 1153, 1032,
м (2F). Масс-спектр, m/z: 381.1340 [M]+ (вычисле-
991, 951, 737, 669, 596. Спектр ЯМР 1Н, δ, м. д.:
но для C20H19F4NO2: 381.1346).
3.73 уш. с (2Н, NH2), 4.54 д (2H, ОСН2СН=СН2,
J 6.2 Гц), 5.25 д. к (1H, ОСН2СН=СН2, J 10.4,
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
0.9 Гц), 5.31 д. к (1H, ОСН2СН=СН2, J 17.2,
имино)метил]-4-бром-6-трет-бутилфенол (3б).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
1268
И.В. ОЛЕЙНИК, И.И. ОЛЕЙНИК
Выход 72%, т. пл. 83-84°С. ИК спектр, ν, см-1:
120.08 (ОСН2СН=СН2), 122.11 т (СF, J 11.8 Гц),
1595 (С=N). Спектр ЯМР 1Н, δ, м. д.: 1.42 с [9Н,
127.39 (СAr), 130.92 (СНAr), 132.08 (ОСН2СН=СН2),
С(СН3)3], 4.73 д (2H, ОСН2СН=СН2, J 6.1 Гц),
132.92 (СНAr), 134.00 т. т (СF, J 12.8, 2.8 Гц), 137.70
5.30 д. к (1H, ОСН2СН=СН2, J 10.3, 1.3 Гц), 5.37
(СAr), 141.04 д (2СFAr, J 249.6 Гц), 141.69 д (2СFAr,
д. к (1H, ОСН2СН=СН2, J 17.1, 1.4 Гц), 5.94-6.07
J 247.1 Гц), 158.67 (СAr), 170.03 т (СН=N, J 5.2 Гц).
м (1H, ОСН2СН=СН2), 7.34 д (1НAr, J 2.4 Гц), 7.47
Спектр ЯМР 19F, δF, м. д.: 4.78 м (2F), 8.28 м (2F).
д (1НAr, J 2.4 Гц), 8.77 с (1H, СH=N), 13.16 с (1H,
Масс-спектр, m/z: 395.1508 [M]+ (вычислено для
OH). Спектр ЯМР 13С, δC, м. д.: 29.02 [С(СН3)3],
C21H21F4NO2: 395.1503).
35.14 [С(СН3)3], 75.49 т (OСН2 СН=СН2, J 3.3 Гц),
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
110.50 (СAr), 119.97 (СAr), 120.13 (ОСН2СН=СН2),
имино)метил]-6-трет-бутил-4-метоксифенол
121.31 т (СF, J 11.8 Гц), 132.06 (ОСН2СН=СН2),
(3д). Выход 73%, т. пл. 103-104°С. ИК спектр, ν,
132.85 (СНAr), 134.41 (СНAr), 134.71 т. т (СF, J 12.2,
см-1:
1610 (С=N). Спектр ЯМР 1Н, δ, м. д.:
3.0 Гц), 140.76 (СAr), 141.20 д (2СFAr, J 250.2 Гц),
1.43 с [9Н, С(СН3)3], 3.79 с (3Н, OСН3), 4.72
141.71 д (2СFAr, J 247.8 Гц), 159.86 (СAr), 168.49 т
д (2H, ОСН2СН=СН2, J 6.1 Гц), 5.31 д. к (1H,
(СН=N, J 5.6 Гц). Спектр ЯМР 19F, δF, м. д.: 5.16 м
ОСН2СН=СН2, J 10.3, 0.9 Гц), 5.39 д. к (1H,
(2F), 8.88 м (2F). Масс-спектр, m/z: 459.0450 [M]+
ОСН2СН=СН2, J 17.1, 1.3 Гц), 5.99-6.10 м (1H,
(вычислено для C20H18BrF4NO2: 459.0452).
ОСН2СН=СН2), 6.66 д (1НAr, J 3.0 Гц), 7.08 д (1НAr,
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
J 3.0 Гц), 8.80 с (1H, СH=N), 12.78 с (1H, OH).
имино)метил]-6-трет-бутил-4-хлорфенол (3в).
Спектр ЯМР 13С, δ, м. д.: 29.03 [С(СН3)3], 34.94
Выход 75%, т. пл. 92-93°С. ИК спектр, ν, см -1:
[С(СН3)3], 55.49 (OСН3), 75.46 т (OСН2СН=СН2,
1601 (С=N). Спектр ЯМР 1Н, δ, м. д.: 1.43 с [9Н,
J 3.2 Гц), 111.71 (СHAr), 117.83 (СAr),
120.06
С(СН3)3], 4.73 д (2H, ОСН2СН=СН2, J 6.2 Гц),
(ОСН2СН=СН2), 121.03 (СНAr), 121.88 т (СF, J
5.31 д. к (1H, ОСН2СН=СН2, J 10.2, 1.1 Гц), 5.39
11.8 Гц), 132.06 (ОСН2СН=СН2), 134.10 т. т (СF,
д. к (1H, ОСН2СН=СН2, J 17.1, 1.4 Гц), 5.96-6.10
J 8.5, 1.9 Гц), 139.69 (СAr), 141.07 д (2СFAr, J
м (1H, ОСН2СН=СН2), 7.20 д (1НAr, J 2.5 Гц), 7.35
249.6 Гц), 141.65 д (2СFAr, J 246.6 Гц), 151.51 (СAr),
д (1НAr, J 2.5 Гц), 8.78 с (1H, СH=N), 13.13 с (1H,
155.59 (СAr), 169.60 т (СН=N, J 5.3 Гц). Спектр ЯМР
OH). Спектр ЯМР 13С, δC, м. д.: 29.00 [С(СН3)3],
19F, δF, м. д.: 4.84 м (2F), 8.43 м (2F). Масс-спектр,
35.13 [С(СН3)3], 75.49 т (OСН2 СН=СН2, J 3.3 Гц),
m/z: 411.1448[M]+ (вычислено для C21H21F4NO3:
119.33 (СAr), 120.12 (ОСН2СН=СН2), 121.36 т (СF, J
411.1452).
11.6 Гц), 123.39 (СAr), 129.73 (СНAr), 131.71 (СНAr),
132.07 (ОСН2СН=СН2), 134.69 т. т (СF, J 12.8,
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
2.9 Гц), 140.42 (СAr), 141.20 д (2СFAr, J 250.3 Гц),
имино)метил]-4,6-ди-трет-бутилфенол
(3е).
141.72 д (2СFAr, J 247.8 Гц), 159.42 (СAr), 168.62 т
Выход 70%, т. пл. 72-73°С. ИК спектр, ν, см-1:
(СН=N, J 5.6 Гц). Спектр ЯМР 19F, δF, м. д.: 5.14 м
1608 (С=N). Спектр ЯМР 1Н, δ, м. д.: 1.31 с [9Н,
(2F), 8.83 м (2F). Масс-спектр, m/z: 415.0959 [M]+
С(СН3)3], 1.45 с [9Н, С(СН3)3], 4.71 д (2H, ОСН2С-
(вычислено для C20H18ClF4NO2: 415.0957).
Н=СН2, J 6.1 Гц), 5.31 д. к (1H, ОСН2СН=СН2, J
10.3, 1.0 Гц), 5.39 д. к (1H, ОСН2СН=СН2, J 17.2,
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
1.2 Гц), 5.96-6.11 м (1H, ОСН2СН=СН2), 7.17 д
имино)метил]-6-трет-бутил-4-метилфенол (3г).
Выход 71%, т. пл. 99-100°С. ИК спектр, ν, см -1:
(1НAr, J 2.4 Гц), 7.50 д (1НAr, J 2.4 Гц), 8.82 с (1H,
1612 (С=N). Спектр ЯМР 1Н, δ, м. д.: 1.44 с [9Н,
СH=N), 12.90 с (1H, OH). Спектр ЯМР 13С, δC, м. д.:
С(СН3)3], 2.30 с (3Н, СН3), 4.72 д (2H, ОСН2С-
29.32 [С(СН3)3], 31.29 [С(СН3)3], 34.10 [С(СН3)3],
Н=СН2, J 6.1 Гц), 5.31 д. к (1H, ОСН2СН=СН2, J
35.07 [С(СН3)3], 75.51 т (OСН2 СН=СН2, J 3.2 Гц),
10.3, 0.8 Гц), 5.39 д. к (1H, ОСН2СН=СН2, J 17.2,
117.98 (СAr), 120.02 (ОСН2СН=СН2), 122.45 т
1.1 Гц), 5.97-6.10 м (1H, ОСН2СН=СН2), 7.01 д
(СF, J 12.0 Гц), 127.36 (СНAr), 129.50 (СНAr),
(1НAr, J 1.8 Гц), 7.25 д (1НAr, J 1.8 Гц), 8.78 с (1H,
132.18 (ОСН2СН=СН2), 134.02 т. т (СF, J 12.6, 3.0
СH=N), 12.88 с (1H, OH). Спектр ЯМР 13С, δC,
Гц), 137.44 (СAr), 140.93 (СAr), 141.04 д (2СFAr, J
м. д.: 20.44 (СН3), 29.18 [С(СН3)3], 34.71 [С(СН3)3],
249.1 Гц), 141.77 д (2СFAr, J 247.5, 158.68 (СAr),
75.50 т (OСН2 СН=СН2, J 3.2 Гц), 118.33 (СAr),
170.63 т (СН=N, J 4.8 Гц). Спектр ЯМР 19F, δF, м. д.:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
ДИЗАЙН ПОСТМЕТАЛЛОЦЕНОВЫХ КАТАЛИТИЧЕСКИХ СИСТЕМ
1269
4.76 м (2F), 8.19 м (2F). Масс-спектр, m/z: 437.1973
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
[M]+ (вычислено для C24H27F4NO2: 437.1972).
имино)метил]-4-бром-6-(2-фенилпропан-2-ил)-
фенол (3и). Выход 72%, т. пл. 67-68°С. ИК спектр,
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
ν, см-1: 1593 (С=N). Спектр ЯМР 1Н, δ, м. д.: 1.73
имино)метил]-6-трет-бутил-4-(2-фенилпро-
с (6Н, СН3), 4.70 д (2H, ОСН2СН=СН2, J 6.2 Гц),
пан-2-ил)фенол (3ж). Выход 71%, т. пл. 62-63°С.
5.29 д. к (1H, ОСН2СН=СН2, J 10.3, 1.2 Гц), 5.37
ИК спектр, ν, см-1: 1606 (С=N). Спектр ЯМР 1Н,
д. к (1H, ОСН2СН=СН2, J 17.2, 1.4 Гц), 5.93-6.07
δ, м. д.: 1.38 с [9Н, С(СН3)3], 1.67 с (6Н, СН3),
м (1H, ОСН2СН=СН2), 7.11-7.28 м (5HAr), 7.40 д
4.71 д (2H, ОСН2СН=СН2, J 6.1 Гц), 5.31 д. к
(1НAr, J 2.4 Гц), 7.68 д (1НAr, J 2.4 Гц), 8.68 с (1H,
(1H, ОСН2СН=СН2, J 10.3, 1.2 Гц), 5.38 д. к (1H,
СH=N), 12.64 с (1H, OH). Спектр ЯМР 13С, δC,
ОСН2СН=СН2, J 17.2, 1.4 Гц), 5.96-6.10 м (1H,
м. д.: 29.09 [С(СН3)2Ph], 42.17 [С(СН3)2Ph], 75.43
ОСН2СН=СН2), 7.06 д (1НAr, J 2.4 Гц), 7.13-7.27 м
т (OСН2 СН=СН2, J 3.0 Гц), 110.33 (СAr), 120.09
(5НAr), 7.29 д (1НAr, J 2.4 Гц), 8.75 с (1H, СH=N),
(ОСН2СН=СН2), 120.16 (СAr), 121.36 т (СF, J
12.95 с (1H, OH). Спектр ЯМР 13С, δC, м. д.: 29.26
11.8 Гц), 125.34 (СНAr), 125.47 (2СНAr), 127.83
[С(СН3)3],
29.60
[С(СН3)2Ph],
34.99
[С(СН3)3],
(2СНAr), 132.00 (ОСН2СН=СН2), 133.31 (СНAr),
42.37
[С(СН3)2Ph], 75.49 т (OСН2 СН=СН2, J
134.58 (СНAr), 140.15 (СAr), 140.97 д (2СFAr, J
2.8 Гц),
117.94 (СAr),
120.03 (ОСН2СН=СН2),
250.7 Гц), 141.61 д (2СFAr, J 247.8 Гц), 149.17
122.36 т (СF, J 11.9 Гц), 125.63 (СНAr), 126.60
(СAr), 159.13 (СAr), 168.26 т (СН=N, J 5.1 Гц).
(2СНAr),
127.96
(2СНAr), 128.84 (СНAr),
131.06
Спектр ЯМР 19F, δF, м. д.: 5.12 м (2F), 8.85 м (2F).
(СНAr), 132.16 (ОСН2СН=СН2), 134.05 т. т (СF, J
Масс-спектр, m/z: 521.0603 [M]+ (вычислено для
13.5, 2.6 Гц), 137.49 (СAr), 140.59 (СAr), 141.01 д
C25H20BrF4NO2: 521.0608).
(2СFAr, J 249.8 Гц), 141.75 д (2СFAr, J 247.8 Гц),
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
150.23 (СAr), 158.85 (СAr), 170.56 т (СН=N, J
имино)метил]-6-(2-фенилпропан-2-ил)-4-
4.7 Гц). Спектр ЯМР 19F, δF, м. д.: 4.80 м (2F), 8.22
хлорфенол (3к). Выход 75%, т. пл. 62-63°С. ИК
м (2F). Масс-спектр, m/z: 499.2132 [M]+ (вычисле-
спектр, ν, см-1: 1606 (С=N). Спектр ЯМР 1Н, δ,
но для C29H29F4NO2: 499.2129).
м. д.: 1.74 с (6Н, СН3), 4.70 д (2H, ОСН2СН=СН2,
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
J 6.2 Гц), 5.29 д. к (1H, ОСН2СН=СН2, J 10.3,
имино)метил]-6-(2-фенилпропан-2-ил)фенол
1.1 Гц), 5.37 д. к (1H, ОСН2СН=СН2, J 17.2,
(3з). Выход 70%, т. пл. 74-75°С. ИК спектр, ν, см -1:
1.3 Гц), 5.94-6.07 м (1H, ОСН2СН=СН2), 7.12-
1605 (С=N). Спектр ЯМР 1Н, δ, м. д.: 1.76 с (6Н,
7.25 м (5HAr), 7.26 д (1НAr, J 2.6 Гц), 7.55 д (1НAr,
СН3), 4.70 д (2H, ОСН2СН=СН2, J 6.1 Гц), 5.30 д.
J 2.6 Гц), 8.69 с (1H, СH=N), 12.61 с (1H, OH).
к (1H, ОСН2СН=СН2, J 10.3, 0.9 Гц), 5.37 д. к (1H,
Спектр ЯМР 13С, δC, м. д.: 29.08 [С(СН3)2Ph],
ОСН2СН=СН2, J 17.2, 1.2 Гц), 5.95-6.09 м (1H,
42.18
[С(СН3)2Ph], 75.44 т (OСН2 СН=СН2, J
ОСН2СН=СН2), 6.97 т (1НAr, J 7.7 Гц), 7.11-7.28
3.3 Гц),
119.51 (СAr),
120.10 (ОСН2СН=СН2),
м (5HAr), 7.29 д (1НAr, J 1.3 Гц), 7.61 д. д (1НAr, J
121.42 т (СF, J 11.6 Гц), 123.29 (СAr), 125.35 (СНAr),
7.7, 1.3 Гц), 8.75 с (1H, СH=N), 12.59 с (1H, OH).
125.48
(2СНAr),
127.84
(2СНAr), 130.20 (СНAr),
Спектр ЯМР 13С, δC, м. д.: 29.21 [С(СН3)2Ph],
131.93 (СНAr), 132.02 (ОСН2СН=СН2), 134.59 т. т
41.94
[С(СН3)2Ph], 75.43 т (OСН2 СН=СН2, J
(СF, J 12.5, 2.5 Гц), 139.81 (СAr), 140.96 д (2СFAr,
3.2 Гц),
118.40 (СHAr),
118.78 (СAr),
120.14
J 250.6 Гц), 141.63 д (2СFAr, J 247.3 Гц), 149.18
(ОСН2СН=СН2), 122.08 т (СF, J 12.0 Гц), 125.10
(СAr), 158.70 (СAr), 168.40 т (СН=N, J 5.2 Гц).
(СНAr),
125.49
(2СНAr),
127.71
(2СНAr),
131.70
Спектр ЯМР 19F, δF, м. д.: 5.10 м (2F), 8.81 м (2F).
(СНAr),
131.93 (СНAr),
132.01 (ОСН2СН=СН2),
Масс-спектр, m/z: 477.1108 [M]+ (вычислено для
133.97 т. т (СF, J 13.1, 1.8 Гц), 137.36 (СAr), 140.76
C25H20ClF4NO2: 477.1113).
д (2СFAr, J 249.6 Гц), 141.60 д (2СFAr, J 247.3 Гц),
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
150.01 (СAr), 160.04 (СAr), 169.88 т (СН=N, J
имино)метил]-4-метил-6-(2-фенилпропан-2-
4.8 Гц). Спектр ЯМР 19F, δF, м. д.: 4.83 м (2F), 8.35
ил)фенол (3л). Выход 71%, т. пл. 100-101°С. ИК
м (2F). Масс-спектр, m/z: 443.1505 [M]+ (вычисле-
спектр, ν, см-1: 1613 (С=N). Спектр ЯМР 1Н, δ,
но для C25H21F4NO2: 443.1503).
м. д.: 1.74 с (6Н, СН3), 2.36 с (3Н, СН3), 4.68 д (2H,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
1270
И.В. ОЛЕЙНИК, И.И. ОЛЕЙНИК
ОСН2СН=СН2, J 6.1 Гц), 5.29 д. к (1H,ОСН2СН=СН2,
J 2.1 Гц), 8.74 с (1H, СH=N), 12.40 с (1H, OH).
J 10.3, 0.8 Гц), 5.36 д. к (1H, ОСН2СН=СН2, J
Спектр ЯМР 13С, δC, м. д.: 29.28 [С(СН3)2Ph], 31.31
17.2, 1.2 Гц), 5.94-6.08 м (1H, ОСН2СН=СН2),
[С(СН3)3],
34.12
[С(СН3)3],
42.26
[С(СН3)2Ph],
7.06 д (1НAr, J 1.8 Гц), 7.09-7.25 м (5HAr), 7.41 д
75.46 т (OСН2 СН=СН2, J 2.9 Гц), 118.10 (СAr),
(1НAr, J 1.8 Гц), 8.69 с (1H, СH=N), 12.35 с (1H,
120.00 (ОСН2СН=СН2), 122.50 т (СF, J 12.1 Гц),
OH). Спектр ЯМР 13С, δC, м. д.: 20.54 (СН3),
125.11 (СНAr),
125.61
(2СНAr),
127.72
(3СНAr),
29.18
[С(СН3)2Ph],
41.93
[С(СН3)2Ph], 75.45 т
129.88 (СНAr),
132.13 (ОСН2СН=СН2),
133.93
(OСН2 СН=СН2, J 3.2 Гц), 118.56 (СAr), 120.00
т. т (СF, J 13.5, 2.5 Гц), 136.87 (СAr), 140.80 д
(ОСН2СН=СН2), 122.34 т (СF, J 12.1 Гц), 125.08
(2СFAr, J 249.7 Гц), 140.82 (СAr), 141.68 д (2СFAr, J
(СНAr),
125.55
(2СНAr),
127.27 (СAr),
127.72
247.3 Гц), 150.19 (СAr), 158.00 (СAr), 170.42 т
(2СНAr), 131.36 (СНAr), 132.11 (ОСН2СН=СН2),
(СН=N, J 4.3 Гц). Спектр ЯМР 19F, δF, м. д.: 4.72 м
133.22 (СНAr), 133.97 т. т (СF, J 12.8, 2.9 Гц), 137.22
(2F), 8.15 м (2F). Масс-спектр, m/z: 499.2130 [M]+
(СAr), 140.86 д (2СFAr, J 249.7 Гц), 141.66 д (2СFAr,
(вычислено для C29H29F4NO2: 499.2129).
J 247.8 Гц), 150.14 (СAr), 158.01 (СAr), 169.90 т
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
(СН=N, J 4.8 Гц). Спектр ЯМР 19F, δF, м. д.: 4.73 м
имино)метил]-4,6-ди(2-фенилпропан-2-ил)
(2F), 8.24 м (2F). Масс-спектр, m/z: 457.1658 [M]+
фенол (3о). Выход 74%, т. пл. 107-108°С. ИК
(вычислено для C26H23F4NO2: 457.1659).
спектр, ν, см-1: 1614 (С=N). Спектр ЯМР 1Н, δ,
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
м. д.: 1.67 с (6Н, СН3), 1.71 с (6Н, 2СН3), 4.68 д (2H,
имино)метил]-4-метокси-6-(2-фенилпропан-2-
ОСН2СН=СН2, J
6.2 Гц),
5.29 д. к
(1H,
ил)фенол (3м). Выход 73%, т. пл. 102-103°С. ИК
ОСН2СН=СН2, J 10.3, 1.3 Гц), 5.36 д. к (1H,
спектр, ν, см-1: 1610 (С=N). Спектр ЯМР 1Н, δ,
ОСН2СН=СН2, J 17.2, 1.4 Гц), 5.94-6.07 м (1H,
м. д.: 1.75 с (6Н, СН3), 3.83 с (3Н, OСН3), 4.69
ОСН2СН=СН2), 7.13 д (1НAr, J 2.4 Гц), 7.15-7.33 м
д (2H, ОСН2СН=СН2, J 6.2 Гц), 5.29 д. к (1H,
(10НAr), 7.44 д (1НAr, J 2.4 Гц), 8.68 с (1H, СH=N),
ОСН2СН=СН2, J 10.3, 1.0 Гц), 5.37 д. к (1H,
12.45 с (1H, OH). Спектр ЯМР 13С, δC, м. д.: 29.19
ОСН2СН=СН2, J 17.2, 1.3 Гц), 5.95-6.08 м (1H,
[С(СН3)2Ph], 30.73 [С(СН3)2Ph], 42.14 [С(СН3)2Ph],
ОСН2СН=СН2), 6.72 д (1НAr, J 3.0 Гц), 7.11-7.27
42.39
[С(СН3)2Ph], 75.44 т (OСН2 СН=СН2, J
м (6HAr), 8.72 с (1H, СH=N), 12.22 с (1H, OH).
3.2 Гц),
118.04 (СAr),
120.05 (ОСН2СН=СН2),
Спектр ЯМР 13С, δC, м. д.: 29.13 [С(СН3)2Ph],
122.39 т (СF, J 12.3 Гц), 125.09 (СНAr), 125.55
42.01
[С(СН3)2Ph],
55.58 (OСН3),
75.41 т
(2СНAr), 125.69 (СНAr),
126.58
(2СНAr),
127.71
(OСН2 СН=СН2, J 3.1 Гц), 112.15 (СНAr), 118.01
(2СНAr),
128.00
(2СНAr), 129.09 (СНAr),
131.52
(СAr),
120.10 (ОСН2СН=СН2),
121.39 (СНAr),
(СНAr), 132.11 (ОСН2СН=СН2), 133.95 т. т (СF, J
122.04 т (СF, J 11.8 Гц), 125.15 (СНAr), 125.45
12.6, 2.8 Гц), 136.91 (СAr), 140.49 (СAr), 140.78 д
(2СНAr), 127.72 (2СНAr), 132.00 (ОСН2СН=СН2),
(2СFAr, J 249.3 Гц), 141.66 д (2СFAr, J 247.3 Гц),
133.95 т. т (СF, J 12.6, 2.3 Гц), 139.01 (СAr), 140.79
150.02 (СAr), 150.22 (СAr), 158.17 (СAr), 170.31 т
д (2СFAr, J 250.1 Гц), 141.58 д (2СFAr, J 246.8 Гц),
(СН=N, J 4.6 Гц). Спектр ЯМР 19F, δF, м. д.: 4.77 м
149.69 (СAr), 151.42 (СAr), 154.82 (СAr), 169.50 т
(2F), 8.20 м (2F). Масс-спектр, m/z: 561.2289 [M]+
(СН=N, J 4.9 Гц). Спектр ЯМР 19F, δF, м. д.: 4.77 м
(вычислено для C34H31F4NO2: 561.2285).
(2F), 8.39 м (2F). Масс-спектр, m/z: 473.1603 [M]+
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
(вычислено для C26H23F4NO3: 473.1609).
имино)метил]-4-хлор-6-циклогексилфенол (3п).
2-[(4-Аллилокси-2,3,5,6-тетрафторфенил-
Выход 72%, т. пл. 112-113°С. ИК спектр, ν, см-1:
имино)метил]-4-трет-бутил-6-(2-фенилпро-
1599 (С=N). Спектр ЯМР 1Н, δ, м. д.: 1.21-1.40 м
пан-2-ил)фенол (3н). Выход 71%, т. пл. 76-77°С.
и 1.70-1.94 м (10Н, СН2-циклогексил), 2.99-3.10 м
ИК спектр, ν, см-1: 1613 (С=N). Спектр ЯМР 1Н,
(1Н, СН-циклогексил), 4.73 д (2H, ОСН2СН=СН2,
δ, м. д.: 1.36 с [9Н, С(СН3)3], 1.78 с (6Н, 2СН3),
J 6.2 Гц), 5.32 д. к (1H, ОСН2СН=СН2, J 10.3,
4.69 д (2H, ОСН2СН=СН2, J 6.2 Гц), 5.30 д. к
1.1 Гц), 5.39 д. к (1H, ОСН2СН=СН2, J 17.2,
(1H, ОСН2СН=СН2, J 10.3, 1.2 Гц), 5.38 д. к (1H,
1.3 Гц), 5.96-6.10 м (1H, ОСН2СН=СН2), 7.18 д
ОСН2СН=СН2, J 17.2, 1.1 Гц), 5.95-6.09 м (1H,
(1НAr, J 2.5 Гц), 7.27 д (1НAr, J 2.5 Гц), 8.78 с (1H,
ОСН2СН=СН2), 7.11-7.29 м (6НAr), 7.65 д (1НAr,
СH=N), 12.81 с (1H, OH). Спектр ЯМР 13С, δC,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
ДИЗАЙН ПОСТМЕТАЛЛОЦЕНОВЫХ КАТАЛИТИЧЕСКИХ СИСТЕМ
1271
м. д.: 26.18 (СН2-циклогексил), 26.75 (2СН2-ци-
4-хлорфенокси}титана(IV) (4в). Выход 95%. ИК
клогексил), 32.67 (2СН2-циклогексил), 36.48 (СН-
спектр, ν, см-1: 1600 (C=N), 579 (Ti-O), 455 (Ti-N).
циклогексил), 75.47 т (OСН2 СН=СН2, J 3.3 Гц),
Спектр ЯМР 1Н, δ, м. д.: 1.20-1.57 м [18Н, С(СН3)3],
118.93 (СAr), 120.05 (ОСН2СН=СН2), 121.36 т (СF, J
4.49-4.75 м (4H, ОСН2СН=СН2), 5.26-5.44 м (4H,
11.6 Гц), 123.85 (СAr), 129.03 (СНAr), 131.52 (СНAr),
ОСН2СН=СН2), 5.87-6.10 м (2H, ОСН2СН=СН2),
132.06 (ОСН2СН=СН2), 134.73 т. т (СF, J 12.8,
7.11-7.69 м
(4HAr),
8.03-8.15 м
(2H, СH=N).
2.8 Гц), 138.46 (СAr), 141.21 д (2СFAr, J 250.2 Гц),
Найдено, %: С 50.71; H 3.57; Cl 14.88; F 16.04; N
141.69 д (2СFAr, J 247.3 Гц), 157.47 (СAr), 168.31 т
2.87. C40H34Cl4F8N2O4Ti. Вычислено, %: С 50.65; H
(СН=N, J 5.6 Гц). Спектр ЯМР 19F, δF, м. д.: 5.13 м
3.61; Cl 14.95; F 16.03; N 2.95.
(2F), 8.84 м (2F). Масс-спектр, m/z: 441.1109 [M]+
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
(вычислено для C22H20ClF4NO2: 441.1101).
фторфенилимино)метил]-6-трет-бутил-4-ме-
Общая методиа синтеза комплексов 4а-п.
тил-фенокси}титана(IV) (4г). Выход 96%. ИК
Смесь 1 ммоль лиганда 3а-п, 10 мл абсолютного
спектр, ν, см-1: 1593 (C=N), 579 (Ti-O), 430 (Ti-
хлористого метилена, 4.25 г толуольного раство-
N). Спектр ЯМР 1Н, δ, м. д.: 1.21-1.43 м [18Н,
ра, содержащего 0.118 г (0.5 ммоль) TiCl2(OPr-i)2
С(СН3)3], 2.25-2.32 м (6Н, СН3), 4.47-4.60 м (4H,
перемешивали при комнатной температуре в ат-
ОСН2СН=СН2), 5.28-5.42 м (4H, ОСН2СН=СН2),
мосфере аргона 24 ч. Растворитель из образовав-
5.88-6.06 м (2H, ОСН2СН=СН2), 7.01-7.39 м (4HAr),
шегося темно-красного раствора отгоняли в ва-
8.02-8.13 м (2H, СH=N). Найдено, %: С 55.41; H
кууме, остаток промывали на фильтре гексаном
4.39; Cl 7.70; F 16.62; N 3.07. C42H40Cl2F8N2O4Ti.
(2×2 мл), выдерживали 1 ч в вакууме масляного
Вычислено, %: С 55.58; H 4.44; Cl 7.81; F 16.75;
насоса при 95°С. Получали соответствующие ком-
N 3.09.
плексы в виде красно-коричневых порошкообраз-
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
ных веществ.
фторфенилимино)метил]-6-трет-бутил-4-ме-
Дихлорид
бис{2-[(4-аллилокси-2,3,5,6-те-
токсифенокси}титана(IV) (4д). Выход 93%. ИК
трафторфенилимино)метил]-6-трет-бутилфе-
спектр, ν, см-1: 1595 (C=N), 584 (Ti-O), 473 (Ti-N).
нокси}титана(IV) (4а). Выход 95%. ИК спектр, ν,
Спектр ЯМР 1Н, δ, м. д.: 1.31-1.45 м [18Н,
см-1: 1595 (C=N), 592 (Ti-O), 449 (Ti-N). Спектр
С(СН3)3], 3.73-3.78 м (6Н, OСН3), 4.46-4.55 м (4H,
ЯМР 1Н, δ, м. д.: 1.24-1.61 м [18Н, С(СН3)3],
ОСН2СН=СН2), 5.28-5.40 м (4H, ОСН2СН=СН2),
4.46-4.64 м (4H, ОСН2СН=СН2), 5.27-5.42 м (4H,
5.88-6.03 м
(2H, ОСН2СН=СН2),
6.54-6.66 м
ОСН2СН=СН2), 5.85-6.04 м (2H, ОСН2СН=СН2),
(2HAr), 7.08-7.17 м (2HAr), 8.08-8.17 м (2H, СH=N).
6.78-7.54 м (6НAr), 8.08-8.21 м (2H, СH=N). Най-
Найдено, %: С 53.80; H 4.36; Cl 7.50; F 16.09; N
дено, %: С 54.45; H 4.15; Cl 8.10; F 17.21; N 3.09.
2.93. C42H40Cl2F8N2O6Ti. Вычислено, %: С 53.69;
C40H36Cl2F8N2O4Ti. Вычислено, %: С 54.62; H 4.13;
H 4.29; Cl 7.55; F 16.18; N 2.98.
Cl 8.06; F 17.28; N 3.18.
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
фторфенилимино)метил]-4,6-ди-трет-бутил-
фторфенилимино)метил]-4-бром-6-трет-бу-
фенокси}титана(IV) (4е). Выход 96%. ИК спектр,
тилфенокси}титана(IV) (4б). Выход 97%. ИК
ν, см-1: 1595 (C=N), 565 (Ti-O), 467 (Ti-N). Спектр
спектр, ν, см-1: 1601 (C=N), 577 (Ti-O), 451 (Ti-N).
ЯМР 1Н, δ, м. д.: 1.28-1.46 м [36Н, С(СН3)3],
Спектр ЯМР 1Н, δ, м. д.: 1.24-1.57 м [18Н, С(СН3)3],
4.46-4.55 м (4H, ОСН2СН=СН2), 5.23-5.42 м (4H,
4.49-4.73 м (4H, ОСН2СН=СН2), 5.22-5.44 м (4H,
ОСН2СН=СН2), 5.87-6.04 м (2H, ОСН2СН=СН2),
ОСН2СН=СН2), 5.88-6.10 м (2H, ОСН2СН=СН2),
7.08-7.22 м (2HAr), 7.49-7.61 м (2HAr), 8.09-8.21 м
7.25-7.81 м (4HAr), 8.04-8.14 м (2H, СH=N). Най-
(2H, СH=N). Найдено, %: С 58.25; H 5.37; Cl 7.10;
дено, %: С 46.22; H 3.35; Br 15.29; Cl 6.90; F 14.55;
F 15.26; N 2.89. C48H52Cl2F8N2O4Ti. Вычислено, %:
N 2.62. C40H34Br2Cl2F8N2O4Ti. Вычислено, %: С
С 58.13; H 5.29; Cl 7.15; F 15.33; N 2.82.
46.31; H 3.30; Br 15.41; Cl 6.84; F 14.65; N 2.70.
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
фторфенилимино)метил]-6-трет-бутил-4-(2-
фторфенилимино)метил]-6-трет-бутил-
фенилпропан-2-ил)фенокси}титана(IV)
(4ж).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
1272
И.В. ОЛЕЙНИК, И.И. ОЛЕЙНИК
Выход 92%. ИК спектр, ν, см-1: 1595 (C=N), 586
451 (Ti-N). Спектр ЯМР 1Н, δ, м. д.: 1.59-1.85 м
(Ti-O), 467 (Ti-N). Спектр ЯМР 1Н, δ, м. д.: 1.18-
(12Н, СН3), 2.18-2.44 м (6Н, СН3), 4.52-4.71 м (4H,
1.37 м [18Н, С(СН3)3], 1.65-1.68 м (12Н, СН3),
ОСН2СН=СН2), 5.21-5.43 м (4H, ОСН2СН=СН2),
4.49-4.68 м (4H, ОСН2СН=СН2), 5.26-5.42 м (4H,
5.88-6.09 м
(2H, ОСН2СН=СН2),
6.45-6.60 м
ОСН2СН=СН2), 5.87-6.08 м (2H, ОСН2СН=СН2),
(2НAr), 6.89-7.70 м (12НAr), 8.08-8.34 м (2H,
7.07-7.50 м (14НAr), 8.08-8.15 м (2H, СH=N). Най-
СH=N). Найдено, %: С 60.59; H 4.36; Cl 6.76; F
дено, %: С 62.52; H 5.11; Cl 6.25; F 13.47; N 2.51.
14.70; N 2.60. C52H44Cl2F8N2O4Ti. Вычислено, %:
C58H56Cl2F8N2O4Ti. Вычислено, %: С 62.43; H 5.06;
С 60.53; H 4.30; Cl 6.87; F 14.73; N 2.72.
Cl 6.36; F 13.62; N 2.51.
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
фторфенилимино)метил]-4-метокси-6-(2-фе-
фторфенилимино)метил]-6-(2-фенилпропан-
нилпропан-2-ил)фенокси}титана(IV)
(4м).
2-ил)фенокси}титана(IV) (4з). Выход 95%. ИК
Выход 94%. ИК спектр, ν, см-1: 1597 (C=N),
спектр, ν, см-1: 1601 (C=N), 527 (Ti-O), 478 (Ti-N).
582 (Ti-O), 474 (Ti-N). Спектр ЯМР 1Н, δ, м. д.:
Спектр ЯМР 1Н, δ, м. д.: 1.69-1.87 м (12Н, СН3),
1.65-1.98 м (12Н, СН3), 3.81-3.89 м (6Н, OСН3),
4.50-4.72 м (4H, ОСН2СН=СН2), 5.21-5.43 м (4H,
4.52-4.71 м (4H, ОСН2СН=СН2), 5.21-5.43 м (4H,
ОСН2СН=СН2), 5.89-6.09 м (2H, ОСН2СН=СН2),
ОСН2СН=СН2), 5.87-6.09 м (2H, ОСН2СН=СН2),
6.43-6.56 м (2НAr), 6.97-7.88 м (14НAr), 8.15-8.42
6.48-6.85 м (6НAr), 7.29-7.54 м (8НAr), 8.12-8.37 м
м (2H, СH=N). Найдено, %: С 59.96; H 4.05; Cl
(2H, СH=N). Найдено, %: С 58.90; H 4.24; Cl 6.55;
7.12; F 15.02; N 2.80. C50H40Cl2F8N2O4Ti. Вычис-
F 14.23; N 2.58. C52H44Cl2F8N2O6Ti. Вычислено, %:
лено, %: С 59.83; H 4.02; Cl 7.07; F 15.14; N 2.79.
С 58.71; H 4.17; Cl 6.67; F 14.29; N 2.63.
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
фторфенилимино)метил]-4-бром-6-(2-фенил-
фторфенилимино)метил]-4-трет-бутил-6-(2-
пропан-2-ил)фенокси}титана(IV)
(4и). Выход
фенилпропан-2-ил)фенокси}титана(IV)
(4н).
91%. ИК спектр, ν, см-1: 1601 (C=N), 534 (Ti-O),
Выход 95%. ИК спектр, ν, см-1: 1595 (C=N), 563
447 (Ti-N). Спектр ЯМР 1Н, δ, м. д.: 1.70-1.95
(Ti-O), 471 (Ti-N). Спектр ЯМР 1Н, δ, м. д.: 1.39-
м (12Н, СН3), 4.51-4.72 м (4H, ОСН2СН=СН2),
1.46 м [18Н, С(СН3)3], 1.61-1.83 м (12Н, СН3),
5.22-5.41 м (4H, ОСН2СН=СН2), 5.88-6.09 м (2H,
4.54-4.69 м (4H, ОСН2СН=СН2), 5.23-5.40 м (4H,
ОСН2СН=СН2), 6.44-7.68 м (14 НAr), 8.00-8.34 м
ОСН2СН=СН2), 5.90-6.08 м (2H, ОСН2СН=СН2),
(2H, СH=N). Найдено, %: С 51.80; H 3.35; Br 13.50;
6.39-6.51 м (2НAr), 7.13-7.79 м (12НAr), 8.16-8.43
Cl 6.03; F 12.98; N 2.35. C50H38Br2Cl2F8N2O4Ti. Вы-
м (2H, СH=N). Найдено, %: С 62.33; H 5.19; Cl
числено, %: С 51.70; H 3.30; Br 13.76; Cl 6.11; F
6.29; F 13.50; N 2.45. C58H56Cl2F8N2O4Ti. Вычис-
13.09; N 2.41.
лено, %: С 62.43; H 5.06; Cl 6.36; F 13.62; N 2.51.
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
фторфенилимино)метил]-6-(2-фенилпропан-
фторфенилимино)метил]-4,6-ди(2-фенил-
2-ил)-4-хлорфенокси}титана(IV)
(4к). Выход
пропан-2-ил)фенокси}титана(IV)
(4о). Выход
93%. ИК спектр, ν, см-1: 1603 (C=N), 542 (Ti-O),
96%. ИК спектр, ν, см-1: 1597 (C=N), 542 (Ti-O), 472
453 (Ti-N). Спектр ЯМР 1Н, δ, м. д.: 1.59-1.96
(Ti-N). Спектр ЯМР 1Н, δ, м. д.: 1.64-1.76 м (24Н,
м (12Н, СН3), 4.52-4.72 м (4H, ОСН2СН=СН2),
СН3), 4.52-4.70 м (4H, ОСН2СН=СН2), 5.22-5.41
5.22-5.44 м (4H, ОСН2СН=СН2), 5.88-6.09 м (2H,
м (4H, ОСН2СН=СН2), 5.88-6.09 м (2H, ОСН2С-
ОСН2СН=СН2), 6.43-7.57 м (14 НAr), 8.04-8.35 м
Н=СН2), 6.32-6.47 м (4НAr), 7.09-7.54 м (10НAr),
(2H, СH=N). Найдено, %: С 56.04; H 3.61; Cl 13.17;
8.08-8.36 м (2H, СH=N). Найдено, %: С 65.92; H
F 14.20; N 2.53. C50H38Cl4F8N2O4Ti. Вычислено, %:
4.97; Cl 5.65; F 12.17; N 2.25. C68H60Cl2F8N2O4Ti.
С 55.99; H 3.57; Cl 13.22; F 14.17; N 2.61.
Вычислено, %: С 65.86; H 4.88; Cl 5.72; F 12.26;
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
N 2.26.
фторфенилимино)метил]-4-метил-6-(2-фенил-
Дихлорид бис{2-[(4-аллилокси-2,3,5,6-тетра-
пропан-2-ил)фенокси}титана(IV)
(4л). Выход
фторфенилимино)метил]-4-хлор-6-цикло-
97%. ИК спектр, ν, см-1: 1597 (C=N), 581 (Ti-O),
гексилфенокси}титана(IV) (4п). Выход 92%. ИК
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
ДИЗАЙН ПОСТМЕТАЛЛОЦЕНОВЫХ КАТАЛИТИЧЕСКИХ СИСТЕМ
1273
спектр, ν, см-1: 1603 (C=N), 546 (Ti-O), 490 (Ti-N).
СПИСОК ЛИТЕРАТУРЫ
Спектр ЯМР 1Н, δ, м. д.: 1.20-2.17 м (20Н, СН2-
1.
Олейник И.И., Олейник И.В., Иванчёв С.С.,
циклогексил), 2.97-3.21 м (2Н, СН-циклогексил),
Толстиков Г.А. // ЖОрХ. 2014. Т. 50. С. 1581;
4.51-4.76 м (4H, ОСН2СН=СН2), 5.23-5.44 м (4H,
Oleinik I.I., Oleinik I.V., Ivanchev S.S., Tolstikov G.A. //
Russ. J. Org. Chem. 2014. Vol. 50. P. 1565. doi 10.1134/
ОСН2СН=СН2), 5.89-6.10 м (2H, ОСН2СН=СН2),
S1070428014110050
7.10-7.40 м (4НAr), 8.04-8.19 м (2H, СH=N). Най-
2.
Stürzel M., Mihan S., Mülhaupt R. // Chem. Rev. 2016.
дено, %: С 52.94; H 3.92; Cl 14.08; F 15.27; N 2.87.
Vol. 116. P. 1398. doi 10.1021/acs.chemrev.5b00310
3.
Kurtz S.M. The UHMWPE Handbook: Ultra-
C44H38Cl4F8N2O4Ti. Вычислено, %: С 52.82; H 3.83;
High Molecular Weight Polyethylene in Total Joint
Cl 14.18; F 15.19; N 2.80.
Replacement. London: Elsevier Academic Press, 2004.
4.
Encyclopedia of Polymer Science and Engineering / Eds
ИНФОРМАЦИЯ ОБ АВТОРАХ
H.F. Mark, N.M. Bikales, C.G. Overberger, G. Menges,
J.I. Kroschwitz. New York: Wiley Interscience, 1985.
Олейник Ирина Владимировна, ORCID: https://
Vol. 6. P. 490.
orcid.org/0000-0002-2686-3889
5.
Makio H., Terao H., Iwashita A., Fujita T. // Chem. Rev.
2011. Vol. 111. P. 2363. doi 10.1021/cr100294r
6.
Rastogi S., Yao Y., Ronca S., Bos J., van der Eem J. //
org/0000-0001-7232-6200
Macromolecules. 2011. Vol. 44. P. 5558. doi 10.1021/
ma200667m
БЛАГОДАРНОСТЬ
7.
Forte G., Ronca S. // Int. J. Polym. Sci. 2017. Article ID
7431419. doi 10.1155/2017/7431419
Авторы выражают благодарность Химическо-
8.
Smith P., Lemstra P.J. // J. Mater. Sci. 1980. Vol. 15.
му исследовательскому центру коллективного
P. 505. doi 10.1007/BF02396802
9.
Oleynik I.V., Shundrina I.K., Oleyinik I.I. // Polym. Adv.
пользования Сибирского отделения РАН за прове-
Technol. 2020. Vol. 31. P. 1921. doi 10.1002/pat.4917
дение спектральных и аналитических измерений.
10.
Озерин А.Н., Иванчев С.С., Чвалун С.Н., Аулов В.А.,
Иванчева Н.И., Бакеев Н. Ф. // Высокомолек. соед.
ФИНАНСОВАЯ ПОДДЕРЖКА
(А). 2012. Т. 54. С. 1731; Ozerin A.N., Ivanchev S.S.,
Chvalun S.N., Aulov V.A., Ivancheva N.I., Bakeev N.F. //
Работа выполнена при поддержке Министер-
Polym. Sci. (A). 2012. Vol. 54. P. 950. doi 10.1134/
ства науки и высшего образования Российской
S0965545X12100033
Федерации в рамках государственного задания
11.
Олейник И.И., Олейник И.В., Зайцев Д.Е.,
Иванчёв С.С., Толстиков Г.А. // ЖОрХ. 2014. Т. 50.
Новосибирского института органической химии
С. 201;Oleinik I.I., Oleinik I.V., Zaitsev D.E., Ivan-
им. Н.Н. Ворожцова Сибирского отделения РАН.
chev S.S., Tolstikov G.A. // Russ. J. Org. Chem. 2014.
Vol. 50. P. 191. doi 10.1134/S1070428014020092
КОНФЛИКТ ИНТЕРЕСОВ
12.
Barber A.M., Hardcastle I.R., Rowlands M.G.,
Nutley B.P., Marriott J.H., Jarman M. // Bioorg. Med.
Авторы заявляют об отсутствии конфликта
Chem. Lett. 1999. Vol 9. P. 623. doi 10.1016/S0960-
интересов.
894X(99)00043-8
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
1274
И.В. ОЛЕЙНИК, И.И. ОЛЕЙНИК
Design of Postmetallocene Catalytic Systems of Arylimine Type
for Olefin Polymerization XIX. Synthesis
of N-(4-Allyloxy-2,3,5,6-tetrafluorophenyl)salicylaldimines
and Their Complexes with Titanium(IV) Dichloride
I. V. Oleynika and I. I. Oleynika,*
a N.N. Vorozhtsov Novosibirsk Institute of Organic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
*e-mail: oleynik@nioch.nsc.ru
Received May 5, 2022; revised June 9, 2022; accepted June 13, 2022
The reaction of 3- and 3,5-substituted salicylic aldehydes containing tert-butyl or 2-phenylpropan-2-yl groups
in position 3 with 4-allyloxy-2,3,5,6-tetrafluoroaniline in toluene in the presence of para-toluenesulfonic acid
was used to obtain a series of corresponding (N-aryl)salicylaldimines, which form complexes of titanium(IV)
dichloride L2TiCl2 upon interaction with TiCl2(OPr-i)2.
Keywords: salicylic aldehydes, 4-allyloxy-2,3,5,6-tetrafluoroaniline, salicylaldarylimines, titanium(IV)
dichloride complexes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022