ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 1, с. 31-42
УДК 547.461.3:547.565.2:547.814
СИНТЕЗ И СВОЙСТВА 2-АМИНО-4-АРИЛ-6-ГЕКСИЛ-
7-ГИДРОКСИ-4H-ХРОМЕН-3-КАРБОНИТРИЛОВ
© 2023 г. В. В. Доценко1,2*, К. В. Халатян1, А. А. Русских1, Е. А. Варзиева1,
Д. А. Крамарева1, В. К. Василин3, Н. А. Аксенов2, И. В. Аксенова2
1 Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
2 Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
3 Кубанский государственный технологический университет, Краснодар, 350072 Россия
*e-mail: victor_dotsenko_@mail.ru
Поступило в редакцию 3 сентября 2022 г.
После доработки 3 октября 2022 г.
Принято к печати 6 октября 2022 г.
Трехкомпонентная конденсация ароматических альдегидов с малононитрилом и 4-гексилрезорцином в
толуоле в присутствии основания приводит к образованию 2-амино-4-арил-6-гексил-7-гидрокси-4H-хро-
мен-3-карбонитрилов с хорошими выходами (79-90%). Строение соединений изучено с привлечением
методов двумерной ЯМР-спектроскопии. Проведено предсказание параметров биодоступности in silico,
методом протеин-лигандного докинга спрогнозированы возможные белковые мишени.
Ключевые слова: 4-гексилрезорцин, малононитрил, 2-амино-4Н-хромен-3-карбонитрилы, 2-ами-
но-4Н-пираны, расчетная биологическая активность
DOI: 10.31857/S0044460X23010043, EDN: OYOACU
2-Амино-4Н-пиран-3-карбонитрилы
1 и их
сированных аналогов найдены противомикробные
бензопроизводные,
2-амино-4Н-хромен-3-карбо-
препараты, фунгистатики, антипротозойные аген-
нитрилы 2 (схема 1), были впервые получены еще
ты, гербициды, соединения с антираковой актив-
в середине 50-х годов ХХ века, однако интенсивно
ностью и др. [2, 4, 12, 14, 15, 18]. Из числа наи-
химия этих соединений начала развиваться толь-
более известных соединений следует упомянуть
ко за последние два десятилетия. Начало нового
кролибулин 3 - низкомолекулярный ингибитор
века ознаменовалось экспоненциальным ростом
полимеризации тубулина с антинеопластическим
числа публикаций по химии и свойствам 2-ами-
эффектом, и ряд других соединений ряда 2-ами-
но-4Н-пиран- и
2-амино-4Н-хромен-3-карбони-
но-4Н-хромена (SP-6-27, MX 58151) с доказанным
трилов. Такое обилие фактологического материала
противоопухолевым действием (схема 1).
нашло отражение в ряде литературных обзоров
Второй фактор - исключительная синтетиче-
[1-21], раскрывающих различные аспекты химии
ская доступность, простота получения и очистки
соединений 1 и 2. Причина такого многообразия
соединений такого типа. В основе большинства
и популярности этой химии определяется, по на-
методов получения 2-амино-4Н-пиран-3-карбони-
шему мнению, двумя факторами. Первый - это
трила 1 или родственных хроменов 2 лежит трех-
биологическая активность производных 2-ами-
компонентное взаимодействие енолизируемого
но-4Н-пиран-3-карбонитрила или родственных
карбонильного соединения (либо замещенного
2-амино-4Н-хромен-3-карбонитрилов.
Спектр
фенола) с карбонильным соединением и мало-
биологической активности весьма обширен - сре-
нонитрилом (либо продуктом их конденсации по
ди 2-амино-4Н-пиран-3-карбонитрилов и конден-
Кнёвенагелю, схема 1). В частности, в литературе
31
32
ДОЦЕНКО и др.
Схема 1.
R1
R2
CN
+
+
R1
R2
R1
R2
O
CN
R4
CN
OH
CN
или
X
R2
R3
O NH2
O NH2
+
CN
R1
1
2
OH
CN
OCH3
NMe2
OMe
Br
OCH3
MeO
Br
CN
CN
CN
H2N
O
NH2
Me2N
O
NH2
Me2N
O NH2
NH2
3
SP-6-27
MX 58151
кробулин (EPC2407)
представлено заметное число примеров взаимодей-
4-гексилрезорцина, получение 6-гексил-7-гидрок-
ствия резорцина (либо замещенного резорцина) с
сихроменов 7 на его основе описано всего в трех
альдегидами и малононитрилом в различных усло-
работах [42-44]. Синтез соединений 7 в работах
виях с образованием производных 2-амино-7-ги-
[42-44] осуществлялся по общей схеме - через
дрокси-4Н-хромен-3-карбонитрила
4
[22-35]
взаимодействие арилметиленмалононитрилов 8 с
(схема 2). Некоторые из производных обнаружива-
гексилрезорционом 6 в кипящем этаноле в присут-
ют биологическую активность: например, соеди-
ствии морфолина [42, 43] либо пиперидина [44]
нения 5 [26] обнаруживают антипролиферативное
(схема 2).
действие.
Наличие н-гексильного остатка увеличива-
4-Гексилрезорцин 6 - нетоксичное соединение,
ет липофильность хроменов 7 и растворимость в
известное своим антисептическим, местноане-
малополярных растворителях, что может заметно
стезирующим и антигельминтным действием, ис-
сказаться на биодоступности этих соединений и, в
пользуется как пищевая добавка, препятствующая
частности, на возможности проникновения через
потемнению морепродуктов [36]. Недавно было
гематоэнцефалический барьер. Настоящая работа
показано, что 4-гексилрезорцин перспективен как
продолжает цикл наших исследований в области
адьювант антибиотиков [37], а также обнаружи-
химии производных 2-амино-4Н-пиран-3-карбо-
вает свойства ингибитора деацетилаз гистонов
нитрила [45-48]. Задачами текущего исследования
[38, 39] и способствует ангиогенезу [40, 41]. В
являлись оптимизация синтетического протокола
то же время, аспектам синтетического использо-
для получения 2-амино-6-гексил-7-гидроксихро-
вания 4-гексилрезорцина уделяется значительно
менов 7, а также изучение in silico возможных
меньшее внимание. Так, несмотря на доступность
белковых мишеней, параметров ADMET и соот-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
СИНТЕЗ И СВОЙСТВА 2-АМИНО-4-АРИЛ-6-ГЕКСИЛ-...
33
Схема 2.
R1
R2
OH
R4
R4
R1
R2
N
R3
O
R3
CN
CN
+
+
Ar
N
HO
O NH2
HO
OH
CN
NC
4
N
CH3
CH
3
Ar
H2N
O
O N CH3
EtOH
CN
Ar
5
B, t°
+
HO
O NH2
HO
OH
NC CN
6
8
7
В = морфолин или пиперидин.
Схема 3.
CH3
H Ar
CH
3
Ar
морфолин
O
толуол, кипячение
CN
+
+
CN
HO
O NH2
HO
OH
CN
6
7a-e
Ar = 4-ClC6H4 (a), 4-BrC6H4 (б), 3,4-(MeO)2C6H3 (в), 4-FC6H4 (г), 2,4-Cl2C6H3 (д), 3-NO2C6H4 (e).
ветствия полученных соединений критериям био-
ются внутримолекулярной 6-экзо-диг-циклизации
доступности.
с замыканием пиранового цикла, и далее, через
каскад прототропных переходов, превращаются в
Установлено, что трехкомпонентная конденса-
ция 4-гексилрезорцина 6, малононитрила и аро-
целевые 4Н-хромены 7 (схема 4).
матических альдегидов в присутствии морфолина
Толуол оказался предпочтительным раствори-
в кипящем толуоле приводит к образованию хро-
телем, поскольку при использовании EtOH или
менов 7 с выходами 79-90% (схема 3). Вероят-
н-BuOH выходы существенно ниже, очевидно, в
ный механизм реакции включает первоначальную
силу большей растворимости целевых продуктов.
конденсацию Кнёвенагеля альдегидов с малоно-
Соединения 7 хорошо кристаллизуются из толуо-
нитрилом с образованием in situ непредельных
ла, при этом исходные соединения легко раство-
нитрилов 8. Последние реагируют с анионом со-
римы. В целом, преимуществом выполнения син-
единения 6 по пространственно наиболее доступ-
теза в толуоле являются более высокие выходы и,
ному положению С6 резорцина, превращаясь в
как правило, отсутствие необходимости дополни-
аддукты Михаэля А. Последние легко подверга-
тельной очистки. Хромены 7 легко растворяются
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
34
ДОЦЕНКО и др.
Схема 4.
морфолин (Mf)
Ar
CN
толуол
H Ar
+
-H2O
CN
CN
O
Ar
NC
Ar
морфолин
R
толуол
R
R
CN R
CN
NC
MfH+
CN
HO
OH
HO
O
HO
O
HO
O
R = C6H13
6
~H+
Ar
Ar
Ar
R
CN
R
CN
R
CN
~H+
δ+
HO
O NH
HO
O N
HO
O N
MfH+
-Mf
A
Ar
Ar
R
CN
R
CN
+
~H
H
HO
O NH
HO
O NH2
7
в спиртах и хлороформе при нагревании, EtOAc,
ного фрагмента наблюдаются в диапазоне 13.8-
ацетоне, ДМСО. Строение полученных хроменов
31.5 м. д. В спектрах ЯМР 13С соединений также
7 подтверждается комплексом спектральных дан-
обнаруживается ряд характерных сигналов атомов
ных. В ИК спектрах соединений 7 обнаружива-
С2 (159.8-160.6 м. д.), С3 (54.5-59.3 м. д.), С≡N
ется набор полос поглощения, соответствующих
(119.8-120.8 м. д.), С4 (36.9-40.3 м. д.), С4a (111.3-
валентным колебаниям ОН- и NH2-групп (3470-
113.3 м. д.), С5 (129.0-130.0 м. д.), С6 (125.4-
3190 см-1), серия полос поглощения, соответству-
127.0 м. д.), С7 (154.0-154.7 м. д.), С8 (101.7-
ющих валентным колебаниям С-Н н-гексильного
103.0 м. д.), С8a (146.6-146.9 м. д.). Строение сое-
фрагмента (3005-2835 см-1), а также интенсивная
динений 7в, д, е дополнительно исследовано с при-
полоса поглощения сопряженной цианогруппы
влечением методов двумерной спектроскопии ЯМР
при 2197-2179 см-1. В спектрах ЯМР 1Н соедине-
(1H-13C HSQC, 1H-13C HMBC). Карта отнесения
ний 7 наблюдается картина из 4 сигналов прото-
сигналов приведена на схеме 5. Копии спектров и
нов н-гексильного фрагмента: триплета при 0.78-
таблицы наблюдаемых гетероядерных корреляций
0.80 м. д. (СН3) и мультиплетов при 1.11-1.27
(табл. S1-S3) приведены в Дополнительных
[(СН2)3], 1.31-1.44 (СН2), 2.31-2.49 м. д. (СН2-Ar).
материалах.
Из числа характерных сигналов следует отметить
В контексте известной [2, 4, 14, 15] биологи-
синглеты протонов С4Н (4.52-5.10 м. д.) и два син-
глета ароматических протонов С5Н (6.53-6.65 м. д.)
ческой активности производных 2-амино-4Н-хро-
и С8Н (6.44-6.46 м. д.). В растворе ДМСО-d6 сиг-
мен-3-карбонитрилов представлялось целесоо-
налы протонов NH2 и ОН обнаруживаются как
бразным провести предварительное исследование
уширенные пики при 6.71-6.89 и 9.49-9.63 м. д. со-
in silico возможных мишеней, параметров ADMET
ответственно. Сигналы атомов углерода н-гексиль-
и соответствия критериям биодоступности для
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
СИНТЕЗ И СВОЙСТВА 2-АМИНО-4-АРИЛ-6-ГЕКСИЛ-...
35
Схема 5.
55.4
3.70
OCH
3
OCH3
3.69
55.4
147.5
OCH
OCH3
3
2.31-
6.84
111.9
2.39
148.6
119.4
111.3
1.13-
6.64
6.76
39.6
1.17
138.9
6.65
N
22.0
28.3
29.0
N
4.52
129.5
0.79
13.8
29.1
56.5
120.8
31.3
113.3
9.49
6.71
1.34-1.40
125.4
HO
O
NH2
HO
O
NH
2
6.44
101.7
154.4
7в
146.6
160.2
Cl
Cl
132.1
7.36
7.53
132.0
128.0
128.8
132.7
36.9
1.11-
7.17
Cl
Cl
1.16
111.3
142.0
2.33
6.53
N
22.1
28.1
28.8
N
5.10
129.0
0.78
13.8
31.0
28.9
54.5
120.2
9.63
6.89
1.31-1.38
125.7
HO
O
NH2
HO
O
NH
2
6.46
101.9
7д
155.0
146.8
160.6
8.08
122.3
7.46-
NO2
NO2
129.7
7.49
148.5
7.55
134.1
122.7
1.19-
8.01
1.27
2.34-
112.5
147.2
N
40.3
N
2.49
6.57
4.76
22.5
28.9
29.4
130.0
0.80
14.0
31.5
29.5
29.3
119.8
1.41-1.44
5.00
4.80
127.0
HO
O
NH
2
7е
HO
O
NH
2
6.46
103.0
154.0
146.9
159.8
полученных производных 4Н-хромена 7. Анализ
параметр сходства с известными лекарственными
структур на соответствие «правилу пяти» К. Ли-
препаратами (drug-likeness), а также общая оценка
пински (MW ≤ 500, сLogP ≤ 5.0, TPSA ≤ 140 Å2,
фармакологического потенциала соединения (drug
число акцепторов водородных связей ≤ 10, до-
score). Полученные расчетные данные представле-
норов ≤ 5) [49-51] проведен с использованием
ны в табл. 1.
программного сервиса OSIRIS Property Explorer
Как следует из приведенных в табл. 1 данных,
[52]. Рассчитаны следующие параметры: сLogP
значение сLogP либо не превышает 5.0, либо пре-
(логарифм коэффициента распределения между
вышает незначительно. Это указывает на ожи-
н-октанолом и водой lоg(coctanol/cwater), раствори-
даемую хорошую абсорбцию и проницаемость
мость (logS), площадь топологической полярной
[49-51]. В то же время, для всех соединений рас-
поверхности (TPSA), ряд токсикологических ха-
четное значение logS < -4.0 указывает на невы-
рактеристик - рисков побочных эффектов (мута-
сокую растворимость (менее 1×10-4 моль/л). Мо-
генные, онкогенные, репродуктивные эффекты),
лекулярные массы всех соединений и показатели
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
36
ДОЦЕНКО и др.
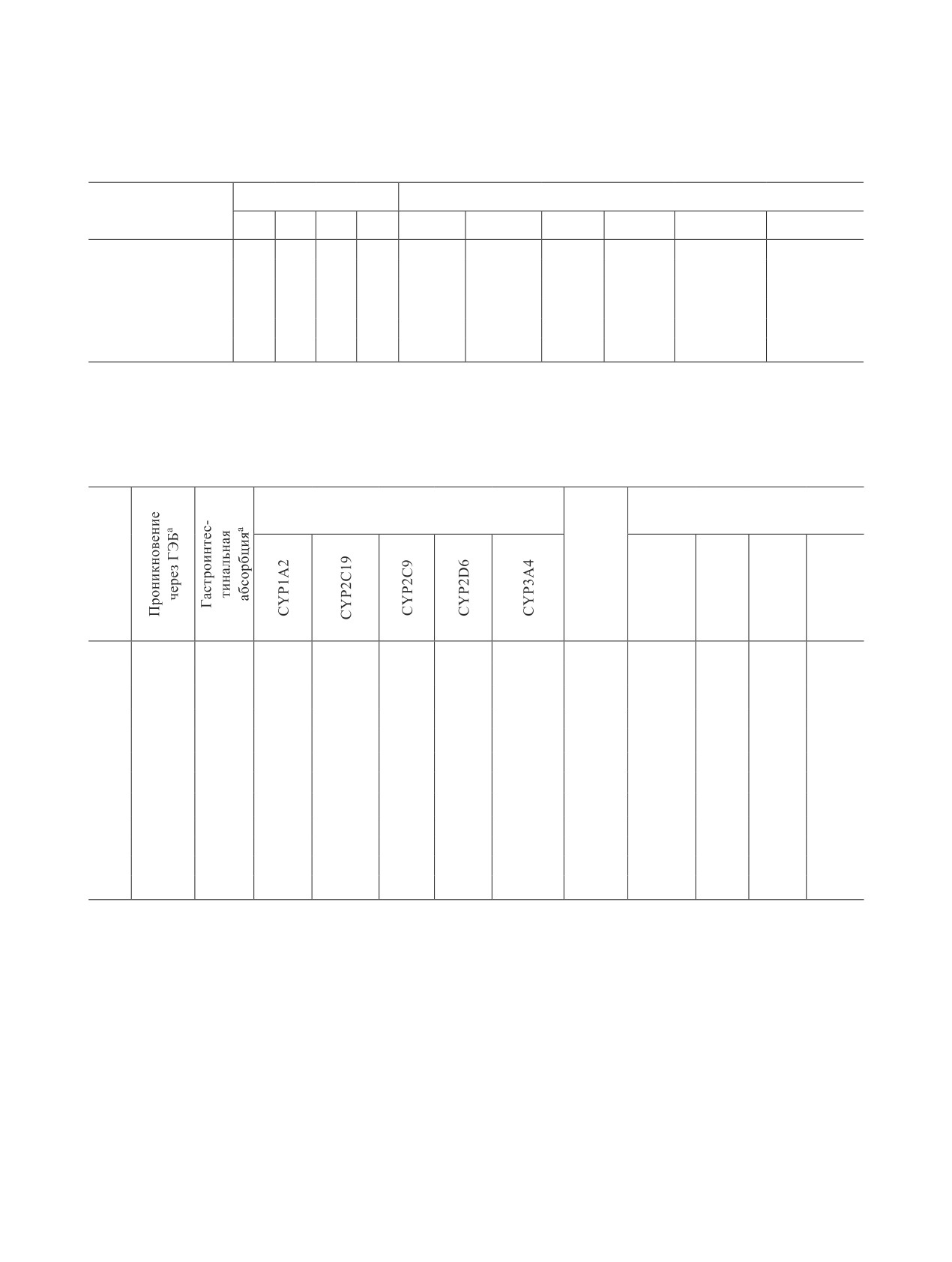
Таблица 1. Риски токсичности и физико-химические параметры соединений 7а-е, спрогнозированные с помощью
сервиса OSIRIS Property Explorer
Риск токсичностиа
Физико-химические параметры
Соединение
А
В
С
D
сLogP
logS
MW
TPSA
drug likeness
drug-score
7а
-
-
-
-
5.22
-6.99
382
79.27
-18.89
0.18
7б
-
-
-
-
5.34
-7.09
426
79.27
-22.12
0.17
7в
-
-
-
-
4.47
-6.29
408
97.73
-18.12
0.22
7г
-
-
-
-
4.71
-6.57
366
79.27
-20.7
0.21
7д
-
-
-
-
5.83
-7.72
416
79.27
-19.14
0.15
7е
-
-
-
-
1.96
-6.71
393
125.0
-26.14
0.25
a Знаком «+» показан высокий риск токсичности, «±» - умеренный риск, «-» - отсутствие токсичности. A - Мутагенность,
B - канцерогенность, С - раздражающее действие, D - репродуктивные эффекты.
Таблица 2. Расчетные параметры ADMET для соединений 7а-е
Острая токсичность (крысы),
Ингибирование цитохромов Р450а
LD50, log10 (ммоль/кг) мг/кг
Тест
№
Эймсаа
IPб
IVб
Oralб
SCб
+
+
+
+
+
-
+
-
0.246
-0.883
-0.162
0.087
7а
0.5757
0.9970
0.6465
0.6096
0.6153
0.8436
0.8249
0.5850
674.3
50.16
263.8
467.5
+
+
+
+
+
-
+
-
0.308
-0.710
-0.183
0.198
7б
0.5405
0.9957
0.6111
0.5722
0.6164
0.8476
0.8616
0.5925
869.3
83.350
280.7
674.3
-
+
-
+
+
-
+
-
0.355
-0.839
-0.139
-0.167
7в
0.7916
0.9530
0.6715
0.6119
0.6358
0.8742
0.8503
0.5911
925.9
59.25
296.9
278.3
+
+
+
+
+
-
+
-
0.165
-0.761
-0.169
-0.047
7г
0.6352
0.9970
0.5776
0.5822
0.5907
0.8571
0.7077
0.5828
535.7
63.58
248.3
328.9
+
+
+
+
+
-
+
-
0.064
-0.875
0.268
-0.062
7д
0.5757
0.9970
0.6465
0.6096
0.6153
0.8436
0.8249
0.5850
483.9
55.62
773.3
361.9
-
+
-
-
+
-
+
+
-0.134
-0.835
-0.366
-0.532
7е
0.6888
0.9968
0.5507
0.5853
0.5105
0.8519
0.9405
0.5693
289.0
57.52
169.5
115.6
а Знаком «+» или «-» показано наличие или отсутствие эффекта.
б IP - внутрибрюшинный способ введения, IV - внутривенный путь введения, Oral - пероральный путь введения, SC - подкожный
путь введения.
параметра TPSA соответствуют критериям перо-
гнозирования параметров ADMET и вероятных
ральной биодоступности. Соединения демонстри-
мишеней также использовались программные па-
руют отсутствие рисков токсического воздействия.
кеты SwissADME [53], admetSAR [54], GUSAR
Итоговые предсказанные значения показателя
[55, 56]. Результаты приведены в табл. 2.
фармакологического потенциала соединения (drug
Для всех соединений постулируется ингиби-
score) достаточно высоки (0.15-0.25). Для про-
рующее действие в отношении широкого круга
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
СИНТЕЗ И СВОЙСТВА 2-АМИНО-4-АРИЛ-6-ГЕКСИЛ-...
37
изоформ цитохрома Р450. Для всех соединений
для результатов докинга отдельных протеин-ли-
прогнозируется высокая гастроинтестинальная аб-
гандных комплексов визуализирована средствами
сорбция, а также возможность проникновения че-
программного комплекса UCSF Chimera [62,63] и
рез гематоэнцефалический барьер (кроме 4Н-хро-
представлена на рис. 1.
мена 7е). Для всех соединений, кроме 4Н-хромена
Таким образом, нами предложен новый трех-
7е, предсказывается отсутствие мутагенного по-
компонентный подход к синтезу
2-амино-4-а-
тенциала в тесте Эймса. В целом, оценка острой
рил-6-гексил-7-гидрокси-4H-хромен-3-карбо-
токсичности позволяет отнести все соединения
нитрилов, основанный на циклоконденсации
к III и IV классам опасности согласно критериям
4-гексилрезорцина, ароматических альдегидов и
OECD [57].
малононитрила в толуоле в присутствии морфоли-
Возможные протеиновые мишени для полу-
на. Результаты экспериментов in silico по оценке
ченных соединений были спрогнозированы с
вероятных протеиновых мишеней, токсичности и
использованием нового протокола протеин-ли-
параметров биодоступности позволяют рассма-
тривать полученные соединения как перспектив-
гандного докинга GalaxySagittarius [58] на базе
ные объекты для разработки новых препаратов с
веб-сервера GalaxyWeb [59, 60]. 3D-структуры
антидиабетическим и антиатеросклеротическим
соединений были предварительно оптимизиро-
действием.
ваны средствами молекулярной механики в си-
ловом поле ММ2 для оптимизации геометрии и
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
минимизации энергии. Докинг с использованием
протокола GalaxySagittarius проводился в режимах
ИК спектры получали на спектрофотометре
Binding compatability prediction и Re-ranking using
Bruker Vertex 70 с приставкой НПВО методом
docking. В табл. S4 (см. Дополнительные материа-
нарушенного полного внутреннего отражения на
лы) представлены результаты докинга по каждому
кристалле алмаза, погрешность ±4 см-1. Спектры
из соединений 7а-е для 20 комплексов мишень-
ЯМР регистрировали на приборе Bruker Avance
лиганд с минимальным значением свободной
III HD 400MHz [400.17 (1Н), 100.63 МГц (13С)] и
энергии связывания ΔGbind и наилучшей оценкой
Agilent 400/MR в растворе CDCl3 (для соединения
протеин-лигандного взаимодействия. Прогнози-
7е) или ДМСО-d6, в качестве стандарта использо-
руемые протеиновые мишени указаны с помощью
вали остаточные сигналы растворителя. Элемент-
идентификаторов в Protein Data Bank (PDB) и в
ный анализ проводили на приборе Elementar vario
базе данных UniProt. Как можно заметить из табл.
Micro cube. Индивидуальность полученных образ-
S4, общей протеиновой мишенью для всех соеди-
цов контролировали методом ТСХ на пластинах
Сорбфил-А (ООО «Имид», Краснодар), элюент -
нений 7а-е является переносчик жирных кислот
ацетон-гексан (1:1) или этилацетат, проявитель -
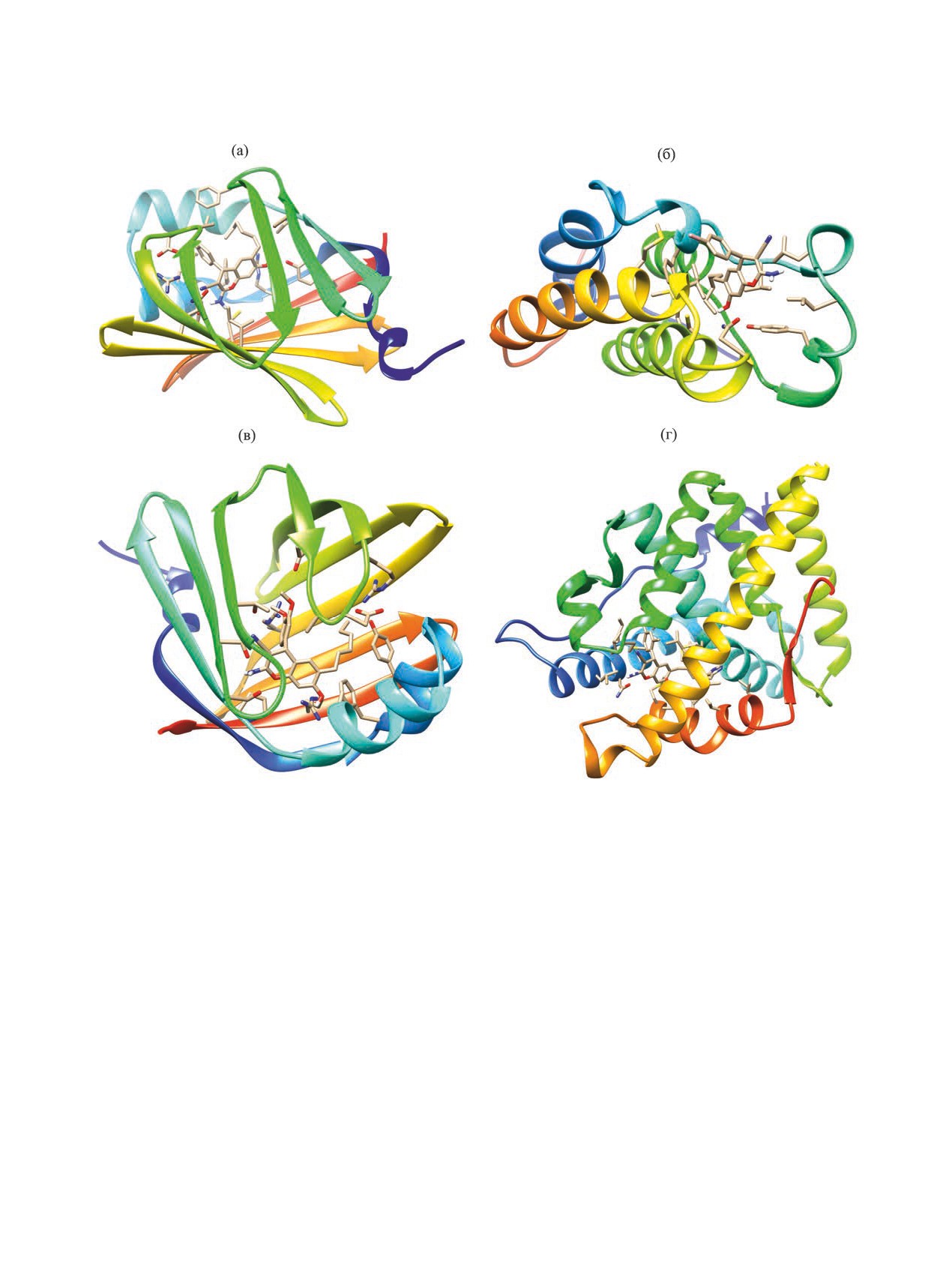
FABP4 (fatty acid binding protein 4, PDB ID 5d47_A,
пары иода, УФ детектор.
ΔGbind
-22.09÷-23.76 ккал/моль). Ингибиторы
FABP4 представляют интерес как средства для
4-Гексилрезорцин является коммерчески до-
терапии атеросклероза и диабета [61]. Также об-
ступным реагентом.
щими мишенями являются регулятор транскрип-
2-Амино-4-арил-6-гексил-7-гидрокси-4H-
ции, бромодоменсодержащий белок BRD2 (PDB
хромен-3-карбонитрилы (7а-е). Смесь 0.30 г
ID 5s9o_A), андрогеновый рецептор NR3C4 (PDB
(4.54 ммоль) малононитрила, 4.54 ммоль соответ-
ID 4okx_A), индуцированный белок дифференци-
ствующего ароматического альдегида, 10 мл толу-
ровки клеток миелоидного лейкоза Mcl-1 (PDB ID
ола и 3 капли морфолина перемешивали до полно-
6u65), цепь А бромдоменсодержащего белка BRDT
го растворения. К полученному желтому раствору
(PDB ID 4kcx_A). Таким образом, хромены 7а-е
добавляли 0.88 г (4.54 ммоль) 4-гексилрезорцина
могут рассматриваться как перспективные объек-
6. Реакционную массу кипятили до завершения
ты для скрининга с целью поиска новых агентов
реакции (контроль методом ТСХ), затем смесь
для лечения/терапии атеросклероза и диабета, а
выливали в химический стакан объемом 100 мл,
также онкозаболеваний. Молекулярная графика
охлаждали до комнатной температуры и выдер-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
38
ДОЦЕНКО и др.
Рис. 1. Прогнозируемые структуры протеин-лигандных комплексов для соединения 7а и протеина FABP4 (PDB ID 5d47_A)
(а), хромена 7б и бромдоменсодержащего белка BRD2 (PDB ID 5s9o_A) (б), хромена 7в и протеина FABP4 (PDB ID 5d47_A)
(в), хромена 7д и андрогенового рецептора NR3C4 (PDB ID 4okx_A) (г).
живали до завершения кристаллизации. Осадок
упаривали в вакууме, остаток растворяли в этила-
отфильтровывали, промывали толуолом (7 мл) и
цетате и очищают флеш-хроматографией на сили-
петролейным эфиром (3 мл), сушили при 60°С.
кагеле (элюент - EtOAc). Соединение 7е выделено
Дополнительное количество продукта осаждается
в виде масла.
из маточного раствора при упаривании толуольно-
2-Амино-6-гексил-7-гидрокси-4-(4-хлорфе-
го фильтрата при комнатной температуре (25°С).
нил)-4H-хромен-3-карбонитрил
(7а). Выход
Получают кристаллические 2-амино-4-арил-6-гек-
90%, бледно-оранжевый мелкокристаллический
сил-7-гидрокси-4H-хромен-3-карбонитрилы 7а-д
порошок. ИК спектр, ν, см-1: 3468 сл, 3331 с, 3209
в аналитически чистом виде (ТСХ). В случае хро-
сл, 3190 сл (O-H, N-H); 2955 сл, 2922 с, 2870 сл,
мена 7е (Ar = 3-NO2C6H4) толуольный раствор
2854 ср (С-Н), 2197 с (C≡N). Спектр ЯМР 1H (ДМ-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
СИНТЕЗ И СВОЙСТВА 2-АМИНО-4-АРИЛ-6-ГЕКСИЛ-...
39
СО-d6), δ, м. д.: 0.78 т (3H, CH3, 3J 6.0 Гц), 1.13-1.17
2-Амино-6-гексил-7-гидрокси-4-(2,4-дихлор-
м (6Н, СН2), 1.34-1.37 м (2Н, СН2), 2.33 т (2H, CH2,
фенил)-4H-хромен-3-карбонитрил (7д). Выход
3J 7.1 Гц), 4.62 с (1Н, Н4), 6.44 уш. с (1Н, Н8), 6.60
79%, бледно-оранжевый мелкокристаллический
уш. с (1Н, Н5), 6.88 уш. с (2Н, NH2), 7.16 д (2H, Ar,
порошок. ИК спектр, ν, см-1: 3423 с, ш, 3344 с, ш,
3J 8.0 Гц), 7.34 д (2H, Ar, 3J 8.0 Гц), 9.62 уш. с (1H,
3246 ср, 3221 ср (O-H, N-H); 2957 ср, 2930 с, 2872
OH). Спектр ЯМР 13C DEPTQ (ДМСО-d6), δC, м. д.:
ср, 2856 с (С-Н), 2179 с (C≡N). Спектр ЯМР 1H
13.9* (CH3), 22.1 (CH2), 28.3 (CH2), 29.0 (CH2),
(ДМСО-d6), δ, м. д.: 0.78 т (3H, CH3, 3J 6.6 Гц), 1.11-
29.1 (CH2), 31.1 (CH2), 39.4* (C4H), 55.8 (C3),
1.16 м (6Н, СН2), 1.31-1.38 м (2Н, СН2), 2.33 т (2H,
101.8* (C8H), 112.6 (C4a), 120.7 (C≡N), 125.6 (C6),
CH2, 3J 7.5 Гц), 5.10 с (1Н, Н4), 6.46 с (1Н, Н8), 6.53
128.5* (2CH, Ar), 129.3* (2CH, Ar), 129.6* (C5H),
с (1Н, Н5), 6.89 уш. с (2Н, NH2), 7.17 д (1H, H6-2,4-
131.2 (C4Cl, Ar), 145.5 (C1, Ar), 146.7 (C8a), 154.7
Cl2C6H3, 3J 8.5 Гц), 7.36 д. д (1H, H5-2,4-Cl2C6H3,
3J 8.5, 4J 2.1 Гц), 7.53 д (1H, H3-2,4-Cl2C6H3, 4J
(C7), 160.4 (C2). Звездочкой отмечены сигналы в
2.1 Гц), 9.63 уш. с (1H, OH). Спектр ЯМР 13C
противофазе. Найдено, %: C 68.95; H 6.13; N 7.30.
(ДМСО-d6), δC, м. д.: 13.8 (CH3), 22.1 (CH2), 28.1
C22H23ClN2O2. Вычислено, %: C 69.01; H 6.05; N
(CH2), 28.8 (CH2), 28.9 (CH2), 31.0 (CH2),
36.9
7.32. М 382.88.
(C4H), 54.5 (C3), 101.9 (C8H), 111.3 (C4a), 120.2
2-Амино-4-(4-бромфенил)-6-гексил-7-ги-
(C≡N), 125.7 (C6), 128.0 (C5, Ar), 128.8 (C3, Ar),
дрокси-4H-хромен-3-карбонитрил (7б). Выход
129.0 (C5), 132.0 (C6, Ar), 132.1 (С4-Cl, Ar), 132.7
89%, бледно-оранжевый мелкокристаллический
(С2-Cl, Ar), 142.0 (C1, Ar), 146.8 (C8a), 155.0 (C7),
порошок. Спектральные данные идентичны тако-
160.6 (C2). Найдено, %: C 63.25; H 5.44; N 6.61.
вым, приведенным в работе [42].
C22H22Cl2N2O2. Вычислено, %: C 63.32; H 5.31; N
2-Амино-6-гексил-4-(3,4-диметоксифенил)-
6.71. М 417.33.
7-гидрокси-4H-хромен-3-карбонитрил
(7в).
2-Амино-6-гексил-7-гидрокси-4-(3-нитро-
Выход
82%, бледно-оранжевый мелкокристал-
фенил)-4H-хромен-3-карбонитрил (7е). Выход
лический порошок. ИК спектр, ν, см-1: 3470 сл,
80%, желтое масло. ИК спектр, ν, см-1: 3460 с, ш,
3435 с, 3323 с, 3194 сл (O-H, N-H); 3005 сл, 2953
3342 с, ш, 3201 ср (O-H, N-H); 2955 ср, 2926 с,
с, 2932 с, 2866 ср, 2835 ср (С-Н), 2197 с (C≡N).
2856 с (С-Н), 2189 с (C≡N), 1526 с, 1348 с (NO2).
Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 0.79 т (3H,
Спектр ЯМР 1H (CDCl3), δ, м. д.: 0.80 т (3H, CH3,
CH3, 3J 6.3 Гц), 1.13-1.17 м (6Н, СН2), 1.34-1.40 м
3J 6.5 Гц), 1.19-1.27 м (6Н, СН2), 1.41-1.44 м (2Н,
(2Н, СН2), 2.31-2.39 м (2H, CH2), 3.69 с (3Н, MeO),
СН2), 2.34-2.49 м (2H, CH2), 4.76 с (1Н, Н4), 4.80
3.70 с (3Н, MeO), 4.52 с (1Н, Н4), 6.44 уш. с (1Н,
уш. с (2Н, NH2), 5.00 уш. с (1Н, ОН), 6.46 уш. с
Н8), 6.64 д. д (1Н, Ar, 4J 2.0, 3J 8.3 Гц), 6.65 уш. с
(1Н, Н8), 6.57 уш. с (1Н, Н5), 7.46-7.49 м (1Н,
(1Н, Н5), 6.71 уш. с (2Н, NH2), 6.74 д (1Н, Ar, 4J
H5-3-NO2C6H4), 7.55 д
(1Н, H6-3-NO2C6H4, 3J
2.0 Гц), 6.84 д (1Н, Ar, 3J 8.3 Гц), 9.49 уш. с (1H, OH).
7.6 Гц), 8.01 уш. с (1Н, H2-3-NO2C6H4), 8.08 д (1Н,
Спектр ЯМР 13C (ДМСО-d6), δC, м. д.: 13.8 (CH3),
H4-3-NO2C6H4, 3J 8.2 Гц). Спектр ЯМР 13C (CDCl3),
22.0 (CH2), 28.3 (CH2), 29.0 (CH2), 29.1 (CH2), 31.1
δC, м. д.: 14.0 (CH3), 22.5 (CH2), 28.9 (CH2), 29.4
(CH2), 39.6 (C4H), 55.42 (MeO), 55.44 (MeO), 56.5
(CH2), 29.5 (CH2), 31.5 (CH2), 40.3 (C4H), 59.3 (C3),
(C3), 101.7 (C8H), 111.3 (С2, Ar), 111.9 (С5, Ar), 113.3
103.0 (C8H), 112.5 (C4a), 119.8 (C≡N), 122.3 (C4H,
(C4a), 119.4 (С6, Ar), 120.8 (C≡N), 125.4 (C6), 129.5
3-NO2C6H4), 122.7 (C2H, 3-NO2C6H4), 127.0 (C6),
(C5), 138.9 (C1, Ar), 146.6 (C8a), 147.5 (C-OMe),
129.7 (C5H, 3-NO2C6H4), 130.0 (C5H), 134.1 (C6H,
148.6 (C-OMe), 154.4 (C7), 160.2 (C2). Найдено, %:
3-NO2C6H4), 146.9 (C8a), 147.2 (C1, Ar), 148.5 (С3-
C 70.70; H 7.11; N 6.67. C24H28N2O4. Вычислено,
NO2, Ar), 154.0 (C7-OH), 159.8 (C2). Найдено, %: C
%: C 70.57; H 6.91; N 6.86. М 408.49.
67.25; H 6.03; N 10.52. C22H23N3O4. Вычислено, %:
C 67.16; H 5.89; N 10.68. М 393.44.
2-Амино-6-гексил-7-гидрокси-4-(4-фтор-
фенил)-4H-хромен-3-карбонитрил (7г). Выход
ИНФОРМАЦИЯ ОБ АВТОРАХ
80%, оранжевые кристаллы. Спектральные дан-
ные идентичны таковым, приведенным в работе
Доценко Виктор Викторович, ORCID: https://
[43].
orcid.org/0000-0001-7163-0497
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
40
ДОЦЕНКО и др.
Варзиева Екатерина Анатольевна, ORCID:
5.
Myrboh B., Mecadon H., Rohman M.R., Rajbangshi M.,
Kharkongor I., Laloo B.M., Kharbangar I., Kshiar B. //
Org. Prep. Proced. Int. 2013. Vol. 45. N 4. P. 253. doi
Аксенов Николай Александрович, ORCID:
10.1080/00304948.2013.798566
6.
El-Agrody A.M., Afifi T.H. // Heterocycles. 2014. Vol. 89.
Аксенова Инна Валерьевна, ORCID: https://
N 7. P. 1557. doi 10.3987/REV-14-793
orcid.org/0000-0002-8083-1407
7.
Sonsona I.G., Marqués-López E., Herrera R.P. //
Symmetry. 2015. Vol. 7. N 3. P. 1519. doi 10.3390/
БЛАГОДАРНОСТЬ
sym7031519
8.
Elnagdi M.H., Moustafa M.S., Al-Mousawi S.M.,
Исследования проведены с использованием
Mekheimer R.A., Sadek K.U. // Mol. Divers. 2015.
оборудования научно-образовательного центра
Vol. 19. N 3. P. 625. doi 10.1007/s11030-015-9594-2
«Диагностика структуры и свойств наноматериа-
9.
Patil S.A., Patil S.A., Patil R. // Future Med. Chem.
лов» и Эколого-аналитического центра Кубанского
2015. Vol. 7. N 7. P. 893. doi 10.4155/fmc.15.38
государственного университета.
10.
Maleki B. // Org. Prep. Proced. Int. 2016. Vol. 48. N 1.
P. 81. doi 10.1080/00304948.2016.1127104
ФИНАНСОВАЯ ПОДДЕРЖКА
11.
Sadek K.U., Mekheimer R.A.H., Abd-Elmonem M.,
Abdel-Hameed A., Elnagdi M.H. // Tetrahedron
Работа выполнена при финансовой поддерж-
Asym. 2017. Vol. 28. N 11. P. 1462. doi 10.1016/j.
ке Кубанского научного фонда в рамках научного
tetasy.2017.10.020
проекта Н-21.1/15 «Высокофункционализирован-
12.
Aslam N., White J.M., Zafar A.M., Jabeen M., Ghafoor A.,
ные 4Н-пираны: синтез, свойства и биологическая
Sajid N., Noreen S., Khan M.A. // Arkivoc. 2018. part vi.
активность».
P. 139. doi 10.24820/ark.5550190.p010.622
13.
Mamaghani M., Nia R.H., Tavakoli F., Jahanshahi P. //
КОНФЛИКТ ИНТЕРЕСОВ
Curr. Org. Chem. 2018. Vol. 22. N 17. P. 1704. doi 10.
Авторы заявляют об отсутствии конфликта
2174/1385272822666180530104302
интересов.
14.
Tashrifi Z., Mohammadi-Khanaposhtani M.,
Hamedifar H., Larijani B., Ansari S., Mahdavi M. //
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Mol. Divers. 2020. Vol. 24. P. 1385. doi 10.1007/
s11030-019-09994-9
Дополнительные материалы для этой статьи
15.
Raj V., Lee J. // Front. Chem. 2020. Vol. 8. P. 623. doi
доступны по doi
10.31857/S0044460X23010043
10.3389/fchem.2020.00623
для авторизованных пользователей.
16.
Mamaghani M., Hossein Nia R. // Polycycl. Arom.
Comp.
2021. Vol.
41. N
2. P.
223. doi
СПИСОК ЛИТЕРАТУРЫ
10.1080/10406638.2019.1584576.
1. Шаранин Ю.А., Гончаренко М.П., Литвинов В.П. //
17.
Ganta R.K., Kerru N., Maddila S., Jonnalagadda S.B.
// Molecules. 2021. Vol. 26. N 11. Article N 3270. doi
Усп. хим. 1998. Т. 67. № 5. С. 442; Sharanin Yu.A.,
Goncharenko M.P., Litvinov V.P. // Russ. Chem.
10.3390/molecules26113270
Rev. 1998. Vol. 67. N 5. P. 393. doi 10.1070/
18.
Borah B., Dwivedi K.D., Chowhan L.R. // Arkivoc.
RC1998v067n05ABEH000371.
2021. Vol. 2021. Pt I. P. 273. doi 10.24820/ark.5550190.
2. Шестопалов А.М., Емельяновa Ю.М. В кн.: Избран-
p011.481
ные методы синтеза и модификации гетероциклов /
19.
Chatterjee R., Bhukta S., Dandela R. // J. Heterocycl.
Под ред. В.Г. Карцева. М.: IBS PRESS, 2003. Т. 2.
Chem. 2022. Vol. 59. N 4. P. 633. doi 10.1002/jhet.4417
С. 534.
20.
Кривенько А.П., Василькова Н.О., Никулин А.В.,
3. Shestopalov A.M., Shestopalov A.A., Rodinovskaya L.A. //
Сорокин В.В. // Изв. вузов. Сер. хим. и хим.
Synthesis. 2008. Vol. 2008. N 1. P. 1. doi 10.1055/s-
технол. 2022. Т. 65. № 9. С. 13. doi 10.6060/
2007-990942
ivkkt.20226509.6526
4. Litvinov Yu.M., Shestopalov A.M. // Adv. Heterocycl.
21.
Nawaz A., Aslam S., Ahmad M., Zahoor A.F.,
Chem. 2011. Vol. 103. P. 175. doi 10.1016/B978-0-12-
Naqvi S.A.R. // J. Iran. Chem. Soc. 2022. Vol. 19. P.
386011-8.00003-4
3721. doi 10.1007/s13738-022-02581-0
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
СИНТЕЗ И СВОЙСТВА 2-АМИНО-4-АРИЛ-6-ГЕКСИЛ-...
41
22.
Elagamey A.G.A., Sawllim S.Z., El-Taweel F.,
38.
Kim J.-Y., Kweon H.-Y., Kim D.-W., Choi J.-Y.,
Elnagdi M.H. // Coll. Czech. Chem. Commun. 1988.
Kim S.-G. // Appl. Sci. 2021. Vol. 11. N 8. Paper
Vol. 53. N 7. P. 1534. doi 10.1135/cccc19881534
N 3486. doi 10.3390/app11083486
23.
Kolla S.R., Lee Y.R. // Tetrahedron. 2011. Vol. 67. N 43.
39.
Lee I.-S., Kim D.-W., Oh J.-H., Lee S.K., Choi J.-Y.,
P. 8271. doi 10.1016/j.tet.2011.08.086
Kim S.-G., Kim T.-W. // Int. J. Mol. Sci. 2021. Vol. 22.
24.
Aminkhani A., Talati M., Sharifi R., Chalabian F.,
N. 16. Paper N 8935. doi 10.3390/ijms22168935
Katouzian F. // J. Heterocycl. Chem. 2019. Vol. 56.
40.
Kim M.K., Kim S.G., Lee S.K. // Maxillofac. Plast.
N 6. P. 1812. doi 10.1002/jhet.3555
Reconstr. Surg. 2020. Vol. 42. Article no. 23. doi
25.
Bardasov I.N., Alekseeva A.U., Ershov O.V., Grisha-
10.1186/s40902-020-00267-2
nov D.A. // Heterocycl. Commun. 2015. Vol. 21. N 3.
41.
Kim S.G. // Maxillofac. Plast. Reconstr. Surg. 2022.
P. 175. doi 10.1515/hc-2015-0077
Vol. 44. Article no. 5. doi 10.1186/s40902-022-00334-w
26.
Parveen I., Ahmed N., Idrees D., Khan P., Hassan M.I. //
42.
Шаранин Ю.А., Клокол Г.В. // ЖОрХ. 1983. Т. 19.
Bioorg. Med. Chem. Lett. 2017. Vol. 27. N 18. P. 4493.
№ 8. С. 1782; Sharanin Yu.A., Klokol G.V. // J. Org.
doi 10.1016/j.bmcl.2017.07.077
Chem. USSR. 1983. Vol. 19. N 8. P. 1582.
27.
Maleki B., Sheikh S. // Org. Prep. Proced. Int. 2015.
43.
Клокол Г.В., Шаранина Л.Г., Нестеров В.Н.,
Vol.
47.
N
5.
P.
368.
doi
Шкловер В.Е., Шаранин Ю.А., Стручков Ю.Т. //
10.1080/00304948.2015.1066647
ЖОрХ. 1987. Т. 23. № 2. С. 412; Klokol G.V.,
28.
Masesane I.B., Mihigo S.O. // Synth. Commun.
Sharanina L.G., Nesterov V.N., Shklover V.E.,
2015. Vol.
45. N
13. P.
1546. doi
Sharanin Yu.A., Struchkov Yu.T. // J. Org. Chem. USSR.
10.1080/00397911.2015.1031249
29.
Thanh N.D., Hai D.S., Bich V.T.N., Hien P.T.T.,
1987. Vol. 23. N 2. P. 369.
Duyen N.T.K., Mai N.T., Dung T.T., Van H.T.K.,
44.
Abd-El-Aziz A.S., El-Agrody A.M., Bedair A.H.,
Toan V.N., Toan D.N., Dang L.H. // Curr. Org. Synth.
Corkery T.C., Ata A. // Heterocycles. 2004. Vol. 63.
2019. Vol. 16. N 3. P. 423. doi 10.2174/157017941666
N 8. P. 1793. doi 10.3987/COM-04-10089
6190104124652
45.
Доценко В.В., Душенко В.А., Аксенов Н.А.,
30.
Makarem S., Mohammadi A.A., Fakhari A.R. //
Аксенова И.В., Нетреба Е.Е. // ЖОХ. 2019. Т. 89.
Tetrahedron Lett. 2008. Vol. 49. N 50. P. 7194. doi
№ 9. С. 1337; Dotsenko V.V., Dushenko V.A., Aksenov N.A.,
10.1016/j.tetlet.2008.10.006
Aksenova I.V., Netreba E.E. // Russ. J. Gen. Chem. 2019.
31.
Kundu S.K., Mondal J., Bhaumik A. // Dalton
Vol. 89. N 9. P. 1752. doi 10.1134/S1070363219090044
Transactions. 2013. Vol. 42. N 29. P. 10515. doi
46.
Доценко В.В., Гузь Д.Д., Тебиев Д.Т., Киндоп В.К.,
10.1039/C3DT50947H
Аксенов Н.А., Аксенова И.В., Нетреба Е.Е. // ЖОХ.
32.
Choudhare S.S., Bhosale V.N., Chopade M. // Russ. J.
2021. Т. 91. № 9. С. 1340; Dotsenko V.V., Guz D.D.,
Org. Chem. 2022. Vol. 58. N 6. P. 913. doi 10.1134/
Tebiev D.T., Kindop V.K., Aksenov N.A., Aksenova I.V.,
S1070428022060227
Netreba E.E. // Russ. J. Gen. Chem. 2021. Vol. 91. N 9.
33.
Шестопалов А.М., Емельянова Ю.М., Нестеров В.Н. //
P. 1629. doi 10.1134/S107036322109005X
Изв. АН. Сер. хим.
2002.
№ 12. С. 2079;
47.
Исмиев А.И., Доценко В.В., Аксенов Н.А., Аксе-
Shestopalov A.M., Emelianova Y.M., Nesterov V.N. //
нова И.В., Магеррамов А.М. // ЖОХ. 2021. Т. 91.
Russ. Chem. Bull. 2002. Vol. 51. N 12. P. 2238. doi
№ 5. С. 665; Ismiyev A.I., Dotsenko V.V., Aksenov N.A.,
10.1023/A:1022135402451
Aksenova I.V., Magarramov A.M. // Russ. J. Gen.
34.
Safari J., Heydarian M., Zarnegar Z. // Arab. J. Chem.
Chem. 2021. Vol. 91. N 5. P. 758. doi 10.1134/
2017. Vol. 10. Suppl. 2. P. S2994. doi 10.1016/j.
S1070363221050029
arabjc.2013.11.038
48.
Palchykov V.A., Chabanenko R.M., Konshin V.V.,
35.
Pourmohammad M., Mokhtary M. // C. R. Chimie. 2015.
Dotsenko V.V., Krivokolysko S.G., Chigorina E.A.,
Vol. 18. N 5. P. 554. doi 10.1016/j.crci.2014.09.008
Horak Y.I., Lytvyn R.Z., Vakhula A.A., Obushak M.D.,
36.
Montero P., Martínez-Álvarez O., Gómez-Guillén M.C. //
Mazepa A.V. // New J. Chem. 2018. Vol. 42. N 2.
J. Food Sci. 2004. Vol. 69. N 8. P. C643. doi 10.1111/
P. 1403. doi 10.1039/c7nj03846a
j.1365-2621.2004.tb09913.x
37.
Nikolaev Y.A., Tutel’yan A.V., Loiko N.G., Buck J.,
49.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
Sidorenko S.V., Lazareva I., Gostev V., Manzen’yuk O.Y.,
Adv. Drug. Delivery Rev. 1997. Vol. 23. N 1-3. P. 4. doi
Shemyakin I.G., Abramovich R.A., Huwyler J., El’-
10.1016/S0169-409X(96)00423-1
Registan G.I. // PloS one. 2020. Vol. 15. N 9. Paper
50.
Lipinski C.A. // Drug Discov. Today: Technologies. 2004.
e0239147. doi 10.1371/journal.pone.0239147
Vol. 1. N 4. P. 337. doi 10.1016/j.ddtec.2004.11.007
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
42
ДОЦЕНКО и др.
51. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
58. Yang J., Kwon S., Bae S.H., Park K.M., Yoon C.,
Adv. Drug. Delivery Rev. 2012. Vol. 64. Supplement. P.
Lee J.H., Seok C. // J. Chem. Inf. Model. 2020. Vol. 60.
4. doi 10.1016/j.addr.2012.09.019.
N 6. P. 3246. doi 10.1021/acs.jcim.0c00104
52. Sander T. OSIRIS Property Explorer, Idorsia
59. GalaxyWEB. A web server for protein structure
prediction, refinement, and related methods.
chemistry.org/prog/peo/
Computational Biology Lab, Department of Chemistry,
53. Daina A., Michielin O., Zoete V. // Sci. Rep. 2017.
Vol. 7. Article no. 42717. doi 10.1038/srep42717
seoklab.org/index.html
54. Cheng F., Li W., Zhou Y., Shen J., Wu Z., Liu G.,
60. Ko J., Park H., Heo L., Seok C. // Nucl. Acids Res.
Lee P.W., Tang Y. // J. Chem. Inf. Model. 2012. Vol. 52.
2012. Vol. 40. N W1. P. W294. doi 10.1093/nar/gks493
N 11. P. 3099. doi 10.1021/ci300367a
61. Floresta G., Pistarà V., Amata E., Dichiara M.,
55. Lagunin A., Zakharov A., Filimonov D., Poroikov V. //
Marrazzo A., Prezzavento O., Rescifina A. // Eur. J.
Mol. Informatics. 2011. Vol. 30. N 2-3. P. 241. doi
Med. Chem. 2017. Vol. 138. P. 854. doi 10.1016/j.
10.1002/minf.201000151
ejmech.2017.07.022
56. GUSAR Online. Laboratory for Structure-Function
62. Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S.,
Based Drug Design, Institute of Biomedical Chemistry
Greenblatt D.M., Meng E.C., Ferrin T.E. // J. Сomput.
Chem. 2004. Vol. 25. N 13. P. 1605. doi 10.1002/
gusar/references.html
jcc.20084
57. OECD Environment, Health and Safety Publications
63. UCSF Chimera. Visualization system for exploratory
Series on Testing and Assessment No 24. Guidance
Document on Acute oral Toxicity Testing. ENV/JM/
research and analysis developed by the Resource for
Biocomputing, Visualization, and Informatics at the
officialdocuments/publicdisplaydocumentpdf/?cote=e
University of California, San Francisco, US. https://
nv/jm/mono(2001)4&doclanguage=en
Synthesis and Some Properties of 2-Amino-4-aryl-6-hexyl-
7-hydroxy-4H-chromene-3-carbonitriles
V. V. Dotsenkoa,b,*, K. V. Khalatyana, A. A. Russkikha, E. A. Varzievaa, D. A. Kramarevaa,
V. K. Vasilinc, N. A. Aksenovb, and I. V. Aksenovab
a Kuban State University, Krasnodar, 350040 Russia
b North Caucasus Federal University, Stavropol, 355009 Russia
c Kuban State Technological University, Krasnodar, 350072 Russia
*e-mail: victor_dotsenko_@mail.ru
Received September 3, 2022; revised October 3, 2022; accepted October 6, 2022
Three-component condensation of aromatic aldehydes with malononitrile and 4-hexylresorcinol in toluene in
the presence of a base leads to the formation of 2-amino-4-aryl-6-hexyl-7-hydroxy-4H-chromene-3-carbonitriles
in good yields (79-90%). Structure of the compounds was studied using the methods of two-dimensional NMR
spectroscopy. Bioavailability parameters were predicted in silico, and possible protein targets were predicted
by protein-ligand docking.
Keywords: 4-hexylresorcinol, malononitrile, 2-amino-4H-chromene-3-carbonitriles, 2-amino-4H-pyrans,
calculated biological activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023