ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 1, с. 43-49
УДК 547.854
РЕАКЦИЯ БИДЖИНЕЛЛИ В СИНТЕЗЕ
ЭТИЛ-4-(6-АРИЛ-5-БЕНЗОИЛ-4-ГИДРОКСИ-
2-ТИОКСОГЕКСАГИДРОПИРИМИДИН-4-
КАРБОКСАМИДО)БЕНЗОАТОВ
© 2023 г. В. Л. Гейн1*, Т. М. Замараева1, Е. В. Горгопина1, М. В. Дмитриев2
1 Пермская государственная фармацевтическая академия, ул. Полевая 2, Пермь, 614990 Россия
2 Пермский государственный национальный исследовательский университет, Пермь, 614990 Россия
*e-mail: geinvl48@mail.ru
Поступило в редакцию 30 августа 2022 г.
После доработки 30 августа 2022 г.
Принято к печати 29 сентября 2022 г.
Трехкомпонентная реакция Биджинелли этил-4-(2,4-диоксо-4-фенилбутанамидо)бензоата, ароматическо-
го альдегида и тиомочевины в уксусной кислоте в присутствии ацетата натрия приводит к образованию
этил-4-(6-арил-5-бензоил-4-гидрокси-2-тиоксогексагидропиримидин-4-карбоксамидо)бензоатов. Стро-
ение полученных соединений установлено методами ИК, ЯМР 1Н, 13С спектроскопии.
Ключевые слова: реакция Биджинелли, этил-4-(2,4-диоксо-4-фенилбутанамидо)бензоат, арилальдегиды,
тиомочевина, ацетат натрия
DOI: 10.31857/S0044460X23010055, EDN: OYQSIM
Основной синтетической стратегией создания
пользуемых 1,2,4-трикарбонильных соединений в
потенциально биологически активных произво-
конденсации Биджинелли, нами в реакцию с аро-
дных пиримидина является модификация реакции
матическим альдегидом и тиомочевиной был вов-
Биджинелли, основанная на использовании новых
лечен этил 4-(2,4-диоксо-4-фенилбутанамидо)бен-
исходных реагентов, позволяющих функционали-
зоат. Кипячение указанных реагентов в уксусной
зировать пиримидиновый цикл [1-6].
кислоте не привело к образованию пиримидино-
вого цикла и в качестве продуктов реакции были
Известно, что участие в реакции Биджинелли
выделены исходные соединения.
субстратов, содержащих оксалильную группу, та-
ких как метил- [7, 8], этилароилпируваты [9-12],
Установлено, что реакция протекает в уксусной
диэтилоксалоацетата [13] и его натриевой соли
кислоте в присутствии в качестве катализатора
[14] приводит к образованию метил(этил)-5-ароил-
ацетата натрия в течение 7-30 мин и останавлива-
тетрагидропиримидин-4-карбоксилатов,
реже
ется на стадии образования недегидратированных
4-гидроксигексагидропиримидин-4-карбоксилатов,
продуктов
- этил-4-(6-арил-5-бензоил-4-гидрок-
и 4,5-диэтоксикарбонилпроизводных 1,2,3,6-тетра-
си-2-тиоксогексагидропиримидин-4-карбоксами-
гидропиримидин-2-онов соответственно. Следует
до)бензоатов 1-7.
отметить, что поведение амидов ароилпировино-
Полученные соединения 1-7 - бесцветные кри-
градных кислот в реакции Биджинелли не изучалось.
сталлические вещества растворимые в ДМФА,
С целью получения ранее неизвестных про-
ДМСО, нерастворимые в уксусной кислоте, этило-
изводных пиримидина и расширения круга ис-
вом спирте, воде. В ИК спектрах соединений 1-7
43
44
ГЕЙН и др.
Схема 1.
O
H
O
N
O
O
CH3COONa,
OH
O
S
O
CH3COOH
O
NH
+
Ar
+
N
H
H2N NH2
O
H
O O
Ar
N
S
H
1-7
Ar = 3-O2NC6H4 (1), 3-BrC6H4 (2), 3,4-(CH3O)2C6H3 (3), 4-HO-3-C2H5OC6H3 (4), 4-ClC6H4 (5), 4-(CH3)2NC6H4 (6),
4-FC6H4 (7).
Схема 2.
F
O
O
O
O
O
O
O
O
F
N
N
H
H
H
O O
O
A
O
F
O
O
N
-PhCOOH
H
O
8
наблюдаются полосы, обусловленные валентны-
3-енамидо]бензоата 8 в результате взаимодействия
ми колебаниями групп NH, OH (2976-3440 см-1),
этил-4-(2,4-диоксо-4-фенилбутанамидо)бензоата
C2H5OCO (1710-1720 см-1), CON (1670-1698 см-1),
и 4-фторбензальдегида c последующим отщепле-
CO (1628-1660 см-1), связи С=С (1610-1630 см-1).
нием бензоильного фрагмента от интермедиата А
В спектрах ЯМР 1Н соединений 1-7, кроме сигна-
(схема 2).
лов ароматических протонов и связанных с ними
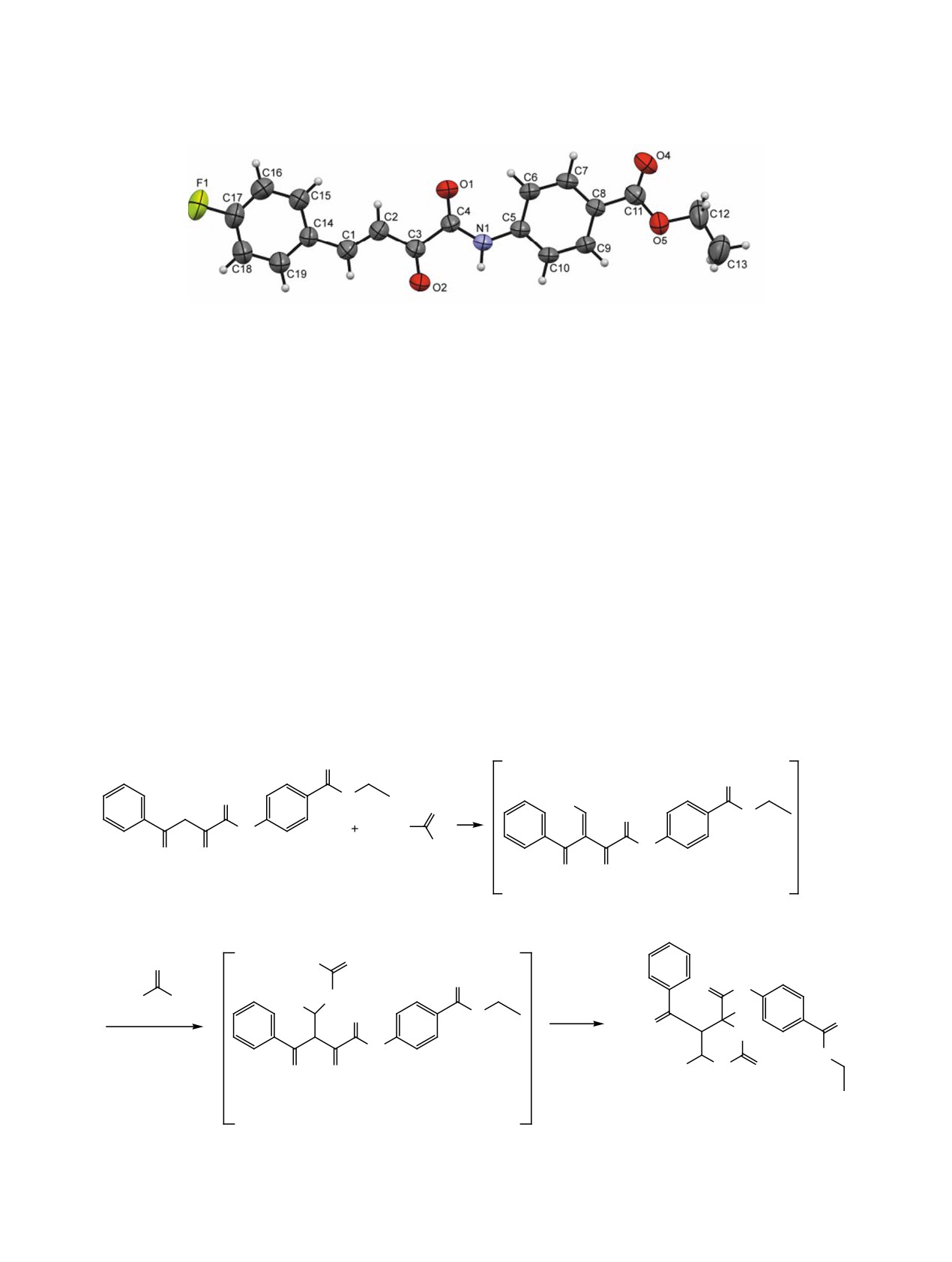
Строение этил-(Е)-4-[4-(4-фторфенил)-2-оксо-
групп, присутствуют дублеты протонов в положе-
бут-3-енамидо]бензоата 8 было установлено рент-
ниях 5 и 6 гетероцикла (4.63-4.79 и 4.94-5.26 м. д.,
геноструктурным анализом (рис. 1). Соединение
J 12 Гц), два уширенных синглета протонов H1
8 кристаллизуется в центросимметричной про-
и H3 (8.54-8.93 и 9.16-9.34 м. д.), синглеты про-
странственной группе триклинной сингонии. Зна-
тонов NH амидной группы (9.98-10.03 м. д.) и
чения длин связей и валентных углов близки к
OH-группы (6.92-7.05 м. д.).
стандартным. Молекула в целом приблизительно
В ходе исследования было зафиксировано об-
плоская, диэдральный угол между двумя арома-
разование этил-(Е)-4-[4-(4-фторфенил)-2-оксобут-
тическими циклами равен 4.8°. Этоксикарбониль-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
РЕАКЦИЯ БИДЖИНЕЛЛИ
45
Рис. 1. Общий вид молекулы соединения 8 по данным РСА. Тепловые эллипсоиды представлены с 50%-ной вероятностью.
ный заместитель развернут на небольшой угол,
циклизуется в целевой продукт 1-7 или распада-
торсионный угол C9C8C11O5 11.8(3)°. В кристалле
ется до этил-(Е)-4-(4-арил-2-оксобут-3-енамидо)-
молекулы образуют центросимметричные диме-
бензоатов. Вероятно, реакция протекает по схеме 3.
ры за счет слабой межмолекулярной водородной
Таким образом, на примере этил-4-(2,4-диок-
связи N1-H1A∙∙∙O2 [1-x, 1-y, -z] с параметрами:
со-4-фенилбутанамидо)бензоата показана воз-
N1-H1A 0.89(2), H1A∙∙∙O2 2.52(2), N1∙∙∙O2 3.340(3) Å,
можность использования N-ариламидов ароилпи-
угол N1H1AO2 153(2)°.
ровиноградных кислот в каталитической реакции
Образование этил-(Е)-4-[4-(4-фторфенил)-2-ок-
Биджинелли, что позволит существенно расши-
собут-3-енамидо]бензоата косвенно подтверждает
рить границы применимости данной реакции для
синтеза биологически активных веществ.
активирующее действие ацетата натрия на мети-
леновую группу в этил-4-(2,4-диоксо-4-фенилбу-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
танамидо)бензоате и формирование бензилидено-
вого производного Б в качестве промежуточного
ИК спектры соединений записывали на спек-
продукта, который реагирует с тиомочевиной и
трофотометре Specord М-80 в таблетках KBr.
Схема 3.
O
O
O
O
R
O
O
O
R
N
H
H
N
O O
H
O O
Б
S
H2N S
H
O
O
N
H2N
NH2
R NH
OH
O
O
O
O
NH
N
O
H
R
N
S
O O
H
1-7
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
46
ГЕЙН и др.
Спектры ЯМР 1Н и 13С регистрировали на прибо-
(2H, ArH, J 8.0 Гц), 8.84 с (1H, H1), 9.28 с (1H, H3),
ре Bruker AVANCE 400SX с рабочей частотой 400
10.02 с (1H, NH). Спектр ЯМР 13С, δC, м. д.: 14.07,
и 100 МГц в ДМСО-d6, внутренний стандарт -
50.95, 54.00, 60.34, 80.81, 119.69, 121.25, 124.89,
ТМС. Элементный анализ выполняли на приборе
127.36, 127.69, 128.09, 129.35, 130.30, 130.81,
PerkinElmer 2400. Температуры плавления опреде-
130.98, 132.93, 137.03, 141.39, 141.77, 165.17,
ляли на приборе Melting Point M-565.
166.99, 176.55, 195.71. Найдено, %: С 55.55, 55.80;
Этил-4-[5-бензоил-4-гидрокси-6-(3-нитро-
Н 4.04, 4.24; N 7.07, 7.33. С27H24BrN3O5S. Вычис-
фенил)-2-тиоксогексагидропиримидин-4-кар-
лено, %: С 55.68; Н 4.15; N 7.21.
боксамидо]бензоат (1). Смесь 3.40 г (0.01 моль)
Этил-4-[5-бензоил-6-(3,4-диметоксифенил)-
этил-4-(2,4-диоксо-4-фенилбутанамидо)бензоата,
4-гидрокси-2-тиоксогексагидропиримидин-
1.51 г (0.01 моль) 3-нитробензальдегида, 0.78 г
4-карбоксамидо]бензоат (3). В реакции исполь-
(0.01 моль) тиомочевины и 0.82 г (0.01 моль)
зовали 3,4-диметоксибензальдегид, смесь кипя-
ацетата натрия в 15 мл уксусной кислоты кипя-
тили в течение 10 мин. Выход 3.32 г (59%), т. пл.
тили в течение 15 мин. Выпавшие кристаллы от-
221-223°C. ИК спектр (KBr), ν, cм-1: 1608, 1656,
фильтровывали, промывали этанолом и сушили.
1696, 1710, 2976, 3216, 3280, 3336. Спектр ЯМР
Выход 4.16 г (76%), т. пл. 231-233°C. ИК спектр
1H, δ, м. д.: 1.30 т (3H, COOCH2CH3, J 8.0 Гц), 4.28
(KBr), ν, cм-1: 1612, 1656, 1692, 1718, 3192, 3288,
к (2H, COOCH2CH3, J 8.0 Гц), 3.66 с (3H, CH3O),
3312, 3344. Спектр ЯМР 1H, δ, м. д.: 1.30 т (3H,
3.73 с (3H, CH3O), 4.73 д (1H, H5, J 12.0 Гц), 5.03 д
COOCH2CH3, J 8.0 Гц), 4.28 к (2H, COOCH2CH3,
(1H, H6, J 12.0 Гц), 6.83 д (1H, ArH, J 8.0 Гц), 6.91
J 8.0 Гц), 4.79 д (1H, H5, J 12.0 Гц), 5.26 д (1H,
д (1H, ArH, J 8.0 Гц), 6.95 с (1H, OH), 7.02 с (1H,
H6, J 12.0 Гц), 7.04 с (1H, OH), 7.15 т (2H, ArH, J
ArH), 7.20 т (2H, ArH, J 8.0 Гц), 7.32 т (1H, ArH,
8.0 Гц), 7.28 т (1H, ArH, J 8.0 Гц), 7.43 д (2H, ArH, J
J 8.0 Гц), 7.43 д (2H, ArH, J 8.0 Гц), 7.65 д (2H,
8.0 Гц), 7.57 т (1H, ArH, J 8.0 Гц), 7.63 д (2H, ArH, J
ArH, J 8.0 Гц), 7.74 д (2H, ArH, J 8.0 Гц), 8.58 с
8.0 Гц), 7.78 д (2H, ArH, J 8.0 Гц), 7.90 д (1H, ArH,
(1H, H1), 9.19 с (1H, H3), 9.99 с (1H, NH). Спектр
J 8.0 Гц), 8.08 д (1H, ArH, J 8.0 Гц), 8.30 с (1H,
ЯМР 13С, δC, м. д.: 14.01, 50.77, 54.25, 55.34, 55.50,
ArH), 8.93 с (1H, H1), 9.34 с (1H, H3), 10.03 с (1H,
60.30, 80.90, 111.39, 111.81, 119.73, 120.89, 124.86,
NH). Спектр ЯМР 13С, δC, м. д.: 14.06, 51.06, 53.91,
127.79, 128.06, 129.33, 130.57, 132.82, 137.09,
60.32, 80.86, 119.69, 122.91, 123.01, 124.95, 127.72,
141.78, 148.42, 148.55, 165.17, 167.13, 176.36,
128.07, 129.36, 129.73, 132.94, 135.19, 137.00,
195.99. Найдено, %: С 61.70, 61.94; Н 5.11, 5.30; N
140.95, 141.75, 147.54, 165.17, 166.89, 176.76,
7.34, 7.59. С29H29N3O7S. Вычислено, %: С 61.80; Н
195.80. Найдено, %: С 59.00, 59.31; Н 4.33, 4.50; N
5.19; N 7.46.
10.09, 10.32. С27H24N4O7S. Вычислено, %: С 59.12;
Этил-4-[5-бензоил-6-(3-этокси-4-гидрокси-
Н 4.41; N 10.21.
фенил)-4-гидрокси-2-тиоксогексагидропири-
Соединения 2-7 получали аналогично.
мидин-4-карбоксамидо]бензоат (4). В реакции
Этил-4-[5-бензоил-6-(3-бромфенил)-4-гид-
использовали
4-гидрокси-3-этоксибензальдегид,
рокси-2-тиоксогексагидропиримидин-4-кар-
смесь кипятили в течение 30 мин. Выход 3.49 г
боксамидо]бензоат (2). В реакции использовали
(62%), т. пл. 184-186°C. ИК спектр (KBr), ν, cм-1:
3-бромбензальдегид, смесь кипятили в течение
1604, 1644, 1698, 1718, 2992, 3198, 3364, 3382, 3410.
7 мин. Выход 4.60 г (79%), т. пл. 225-227°C. ИК
Спектр ЯМР 1H, δ, м. д.: 1.26 м (6H, COOCH2CH3,
спектр (KBr), ν, cм-1: 1600, 1632, 1696, 1710, 2984,
OCH2CH3,), 3.97 к (2H, OCH2CH3, J 8.0 Гц), 4.28 к
3192, 3312, 3410. Спектр ЯМР 1H, δ, м. д.: 1.32 т (3H,
(2H, COOCH2CH3, J 8.0 Гц), 4.66 д (1H, H5, J
COOCH2CH3, J 8.0 Гц), 4.26 к (2H, COOCH2CH3, J
12.0 Гц), 4.96 д (1H, H6, J 12.0 Гц), 6.63 д (1H, ArH),
8.0 Гц), 4.70 д (1H, H5, J 12.0 Гц), 5.08 д (1H, H6, J
6.75 д (1H, ArH), 6.92 с (1H, OH), 6.93 с (1H, ArH),
12.0 Гц), 6.98 с (1H, OH), 7.18 т (2H, ArH, J 8.0 Гц),
7.01 с (1H, OH), 7.20 т (2H, ArH, J 7.2 Гц), 7.31 т
7.23 т (1H, ArH, J 8.4 Гц), 7.30 т (1H, ArH, J 8.0 Гц),
(1H, ArH, J 7.2 Гц), 7.42 д (2H, ArH, J 8.7 Гц), 7.65
7.38 д (2H, ArH, J 8.0 Гц), 7.42 д (2H, ArH, J 8.0 Гц),
д (2H, ArH, J 7.5 Гц), 7.75 д (2H, ArH, J 8.7 Гц), 8.52
7.61 с (1H, ArH), 7.63 д (2H, ArH, J 8.4 Гц), 7.77 д
с (1H, H1), 9.16 с (1H, H3), 9.99 с (1H, NH). Спектр
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
РЕАКЦИЯ БИДЖИНЕЛЛИ
47
ЯМР 13С, δC, м. д.: 14.13, 14.63, 50.72, 54.34, 60.40,
Этил-4-[5-бензоил-6-(4-фторфенил)-4-гид-
64.01, 81.15, 113.88, 115.20, 119.81, 121.19, 124.67,
рокси-2-тиоксогексагидропиримидин-4-кар-
127.80, 128.12, 129.01, 129.36, 132.89, 137.20,
боксамидо]бензоат (7). В реакции использова-
141.76, 146.14, 146.85, 165.24, 167.26, 176.41,
ли 4-фторбензальдегид, смесь кипятили в тече-
196.19. Найдено, %: С 61.67, 61.92; Н 5.07, 5.29; N
ние 7 мин. Выход 3.70 г (71%), т. пл. 236-238°C.
7.35, 7.59. С29H29N3O7S. Вычислено, %: С 61.80; Н
ИК спектр (KBr), ν, cм-1: 1608, 1628, 1696, 1712,
5.19; N 7.46.
2984, 3184, 3264, 3338. Спектр ЯМР 1H, δ, м. д.:
1.30 т (3H, COOCH2CH3, J 8.0 Гц), 4.28 к (2H,
Этил-4-[5-бензоил-6-(4-хлорфенил)-4-гид-
COOCH2CH3, J 8.0 Гц), 4.66 д (1H, H5, J 12.0 Гц),
рокси-2-тиоксогексагидропиримидин-4-кар-
5.10 д (1H, H6, J 8.0 Гц), 7.00 с (1H, OH), 7.08 т
боксамидо]бензоат (5). В реакции использовали
(2H, ArH, J 8.0 Гц), 7.18 т (1H, ArH, J 8.0 Гц), 7.42
4-хлорбензальдегид, смесь кипятили в течение
д (2H, ArH, J 8.0 Гц), 7.30-7.48 м (4H, ArH), 7.60 д
15 мин. Выход 3.97 г (74%), т. пл. 226-228°C.
(2H, ArH, J 8.0 Гц), 7.76 д (2H, ArH, J 8.0 Гц), 8.71
ИК спектр (KBr), ν, cм-1: 1612, 1650, 1670, 1720,
с (1H, H1), 9.21 с (1H, H3), 9.98 с (1H, NH). Спектр
2990, 3215, 3284, 3440. Спектр ЯМР 1H, δ, м. д.:
ЯМР 13С, δC, м. д.: 14.01, 51.14, 53.82, 60.24, 81.36,
1.30 т (3H, COOCH2CH3, J 8.0 Гц), 4.26 к (2H,
114.81 (д, J 15.75 Гц), 119.72, 124.94, 127.85 (д, J
COOCH2CH3, J 8.0 Гц), 4.65 д (1H, H5, J 12.0 Гц),
15.75 Гц), 129.32, 130.32, 132.99, 134.79, 137.18,
5.10 д (1H, H6, J 12.0 Гц), 7.05 с (1H, OH), 7.17 т
141.84, 160.31, 162.79 (д, J 186 Гц), 165.46, 167.22,
(2H, ArH, J 8.4 Гц), 7.28 т (1H, ArH, J 8.4 Гц), 7.31
176.55, 195.95. Найдено, %: С 61.96, 62.29; Н 4.52,
д (2H, ArH), 7.38-7.45 м (4H, ArH), 7.60 д (2H, ArH,
4.74; N 7.92, 8.18. С27H24FN3O5S. Вычислено, %: С
J 8.4 Гц), 7.75 д (2H, ArH, J 8.4 Гц), 8.77 с (1H, H1),
62.18; Н 4.64; N 8.06.
9.25 с (1H, H3), 9.99 с (1H, NH). Спектр ЯМР 13С,
Рентгеноструктурный анализ (Е)-этил-
δC, м. д.: 14.14, 51.16, 53.86, 60.40, 80.92, 119.79,
4-[4-(4-фторфенил)-2-оксобут-3-енамидо]бен-
124.96, 127.76, 128.16, 128.21, 129.38, 130.18,
зоата 8 выполнен на дифрактометре Xcalibur
132.53,
132.97,
137.11,
137.75,
141.82,
165.24,
Ruby с ССD-детектором по стандартной методике
167.14, 176.57, 196.77. Найдено, %: С 60.15, 60.38;
[MoKα-излучение, 295(2) K, ω-сканирование, шаг
Н 4.43, 5.59; N 7.70, 7.95. С27H24ClN3O5S. Вычис-
сканирования 1°) [15]. Поглощение учтено эмпи-
лено, %: С 60.28; Н 4.50; N 7.81.
рически с использованием алгоритма SCALE3
Этил-4-{5-бензоил-6-[4-(диметиламино)-
ABSPACK [15]. Сингония кристалла (C19H16FNO4,
фенил]-4-гидрокси-2-тиоксогексагидропири-
M 341.33) триклинная, пространственная группа
мидин-4-карбоксамидо}бензоат (6). В реакции
P-1, a 5.4869(12), b 10.095(2), c 15.568(3) Å, α
использовали N,N-диметиламинобензальдегид,
79.593(18), β 82.878(18), γ 80.402(17)°, V 832.3(3) Å3,
смесь кипятили в течение 30 мин. Выход 2.57 г
Z 2, dвыч 1.362 г/см3, μ 0.103 мм-1. Структура рас-
(47%), т. пл. 212-214°C. ИК спектр (KBr), ν, cм-1:
шифрована с помощью программы SHELXS [16]
1630, 1660, 1699, 1720, 2980, 3215, 3348, 3420.
и уточнена полноматричным МНК по F2 в ани-
Спектр ЯМР 1H, δ, м. д.: 1.29 т (3H, COOCH2CH3,
зотропном приближении для всех неводородных
J 8.0 Гц), 4.27 к (2H, COOCH2CH3, J 8.0 Гц), 4.63
атомов с использованием программы SHELXL
д (1H, H5, J 12.0 Гц), 4.94 д (1H, H6, J 12.0 Гц),
[17] с графическим интерфейсом OLEX2 [18].
6.61 д (2H, ArH), 7.01 с (1H, OH), 7.15-7.32 м (5H,
Атом водорода группы NH уточнен независи-
ArH), 7.40 д (2H, ArH, J 8.4 Гц), 7.61 д (2H, ArH, J
мо в изотропном приближении. При уточнении
8.4 Гц), 7.75 д (2H, ArH, J 8.4 Гц), 8.54 с (1H, H1),
остальных атомов водорода использована модель
9.22 с (1H, H3), 10.05 с (1H, NH). Спектр ЯМР 13С,
наездника. Окончательные параметры уточне-
δC, м. д.: 14.14, 39.59, 39.93, 51.03, 53.97, 60.40,
ния: R1 0.0611, wR2 0.1396 [для 1881 отражений с
81.00, 111.92, 119.79, 124.92, 125.69, 127.76, 128.12,
I > 2σ(I)], R1 0.1242, wR2 0.1906 (для всех 3845 не-
128.76, 129.37, 132.80, 137.23, 141.86, 150.06,
зависимых отражений), S 1.016.
165.25, 167.39, 176.33, 196.85. Найдено, %: С 63.51,
Результаты
РСА зарегистрированы в
63.84; Н 5.42, 5.61; N 10.11, 10.38. С29H30N4O5S.
Кембриджском центре кристаллографических
Вычислено, %: С 63.72; Н, 5.53; N, 10.25.
данных (CCDC 2192419).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
48
ГЕЙН и др.
ИНФОРМАЦИЯ ОБ АВТОРАХ
8.
Гейн В.Л., Замараева Т.М., Горгопина Е.В.,
Дмитриев М.В. // ХГС. 2020. Т. 56. № 3. С. 339;
Гейн Владимир Леонидович, ORCID: https://
Gein V.L., Zamaraeva T.M., Gorgopina E.V., Dmitriev
orcid.org/0000-0002-8512-0399
M.V. // Chem. Heterocycl. Compd. 2020. Vol. 56. N 3.
Дмитриев Максим Викторович, ORCID: https://
P. 339. doi 10.1007/s10593-020-02665-w
orcid.org/0000-0002-8817-0543
9.
Zohdi H.F., Rateb N.M., Elnagdy S.M. // Eur. J.
Med. Chem. 2011. 46. N 11. P. 5636. doi 10.1016/j.
ФИНАНСОВАЯ ПОДДЕРЖКА
ejmech.2011.09.036
10.
Ryabukhin S.V., Plaskon A.S., Bondarenko S.S.,
Исследование выполнено при финансовой под-
Ostapchuk E.N., Grygorenko O.O., Shishkin O.V.,
держке Пермского научно-образовательного цен-
Tolmachev A.A. // Tetrahedron Lett. 2010. 51. N 32.
тра «Рациональное недропользование», 2022 г.
P. 4229. doi 10.1016/j.tetlet.2010.06.032
11.
El-Malah A., Mahmoud Z., Hamed Salem H.,
КОНФЛИКТ ИНТЕРЕСОВ
Abdou A.M., Soliman Mona M.H., Hassan R.A. //
Авторы заявляют об отсутствии конфликта
Green Chem. Lett. Rev. 2021. Vol. 14. N 2. P. 2. doi
10.1080/17518253.2021.1896789
интересов.
12.
Lauro G., Strocchia M., Terracciano S., Bruno I.,
СПИСОК ЛИТЕРАТУРЫ
Fischer K., Pergola C., Werz O., Riccio R., Bifulco G. //
Eur. J. Med. Chem. 2014. Vol. 80. P. 407. doi 10.1016/j.
1. Kappe C.O. // Multicomponent Reactions. 2005. P. 95.
ejmech.2014.04.061
doi 10.1002/3527605118.ch4
13.
Колосов М.А., Ал-Огаили М.Д.К., Пархоменко В.С.,
2. Kappe C.O. // Tetrahedron 1993. Vol. 49. N 32. P. 6937.
Орлов В.Д. // ХГС. 2013. № 10. С. 1599; Kolo-
doi 10.1016/S0040-4020(01)87971-0
sov M.A., Al-Ogaili M.J.K., Parkhomenko V.S.,
3. Kappe C.O. // Eur. J. Med. Chem. 2000. Vol. 35. N 12.
Orlov V.D. // Chem. Heterocycl. Compd. 2014. Vol. 49.
P. 1043. doi 10.1016/s0223-5234(00)01189-2
N 10. P. 1484. doi 10.1007/s10593-014-1399-1
4. Wan J.-P., Liu Y. // Synthesis 2010. N 23. P. 3943. doi
14.
Гейн В.Л., Замараева Т.М., Волкова Е.С., Дмит-
10.1055/s-0030-1258290
риев М.В. // ЖОрХ. 2016. Т. 52. N 5. С. 740;
5. Nagarajaiah H., Mukhopadhyay A., Moorthy J.N. //
Gein V.L., Zamaraeva T.M., Volkova E.S.,
Tetrahedron Lett. 2016. 57. N 47. P. 5135. doi 10.1016/j.
Dmitriev M.V. // Russ. J. Org. Chem. 2016. Vol. 52.
tetlet.2016.09.047
P. 730. doi 10.1134/S1070428016050195
6. Вдовина С.В., Мамедов В.А. // Усп. хим. 2008. Т. 77.
15.
CrysAlisPro, Agilent Technologies, Version 1.171.37.33
№ 12. С. 1091; Vdovina S.V., Mamedov V.A. // Russ.
(release 27-03-2014 CrysAlis171.NET)
Chem. Rev. 2008. Vol. 77. P. 1017. doi 10.1070/
16.
Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
RC2008v077n12ABEH003894
7. Гейн В.Л., Крылова И.В., Цыплякова Е.П., Гайфулли-
P. 112. doi 10.1107/S0108767307043930
на А.Р., Варкентин Л.И., Вахрин М.И. // ХГС. 2009.
17.
Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
№ 7. С. 1046; Gein V.L., Krylova I.V., Tsypliakova E.P.,
N 1. P. 3. doi 10.1107/S2053229614024218
Gaifullina A.R., Varkentin L.I., Vakhrin M.I. // Chem.
18.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Heterocycl. Compd. 2009. Vol. 45. N 7. P. 829. doi
ward J.A.K., Puschmann H. // J. Appl. Crystallogr. 2009.
10.1007/S10593-009-0353-0
Vol. 42. N 2. P. 339. doi 10.1107/S0021889808042726
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
РЕАКЦИЯ БИДЖИНЕЛЛИ
49
Biginelli Reaction in the Synthesis
of Ethyl 4-(6-Aryl-5-benzoyl-4-hydroxy-
2-thioxohexahydropyrimidine-4-carboxamido)benzoates
V. L. Geina,*, T. M. Zamaraevaa, E. V. Gorgopinaa, and M. V. Dmitrievb
a Perm State Pharmaceutical Academy, Perm, 614990 Russia
b Perm State National Research University, Perm, 614990 Russia
*e-mail: geinvl48@mail.ru
Received August 30, 2022; revised August 30, 2022; accepted September 29, 2022
Three-component Biginelli reaction of ethyl 4-(2,4-dioxo-4-phenylbutanamido)benzoate, aromatic aldehyde
and thiourea in acetic acid in the presence of sodium acetate led to the formation of ethyl 4-(6-aryl-5-benzoyl-
4-hydroxy-2-thioxohexahydropyrimidine-4-carboxamido)benzoates. Structure of the obtained compounds was
established by IR, 1H NMR, 13C spectroscopy methods.
Keywords: Biginelli reaction, ethyl 4-(2,4-dioxo-4-phenylbutanamido)benzoate, arylaldehydes, thiourea,
sodium acetate
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023