ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 1, с. 113-125
К 300-летию со дня основания Санкт-Петербургского государственного университета
УДК 546.922;547-304.7;54.03
БИСИЗОЦИАНИДНЫЕ ЦИКЛОМЕТАЛЛИРОВАННЫЕ
КОМПЛЕКСЫ ПЛАТИНЫ(II): СИНТЕЗ, СТРУКТУРА,
ФОТОФИЗИЧЕСКИЕ СВОЙСТВА И МЕХАНОХРОМНОЕ
ПОВЕДЕНИЕ
© 2023 г. С. А. Каткова1*, Э. В. Соколова1, М. А. Кинжалов1
1 Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: s.katkova@spbu.ru
Поступило в редакцию 1 октября 2022 г.
После доработки 24 октября 2022 г.
Принято к печати 26 октября 2022 г.
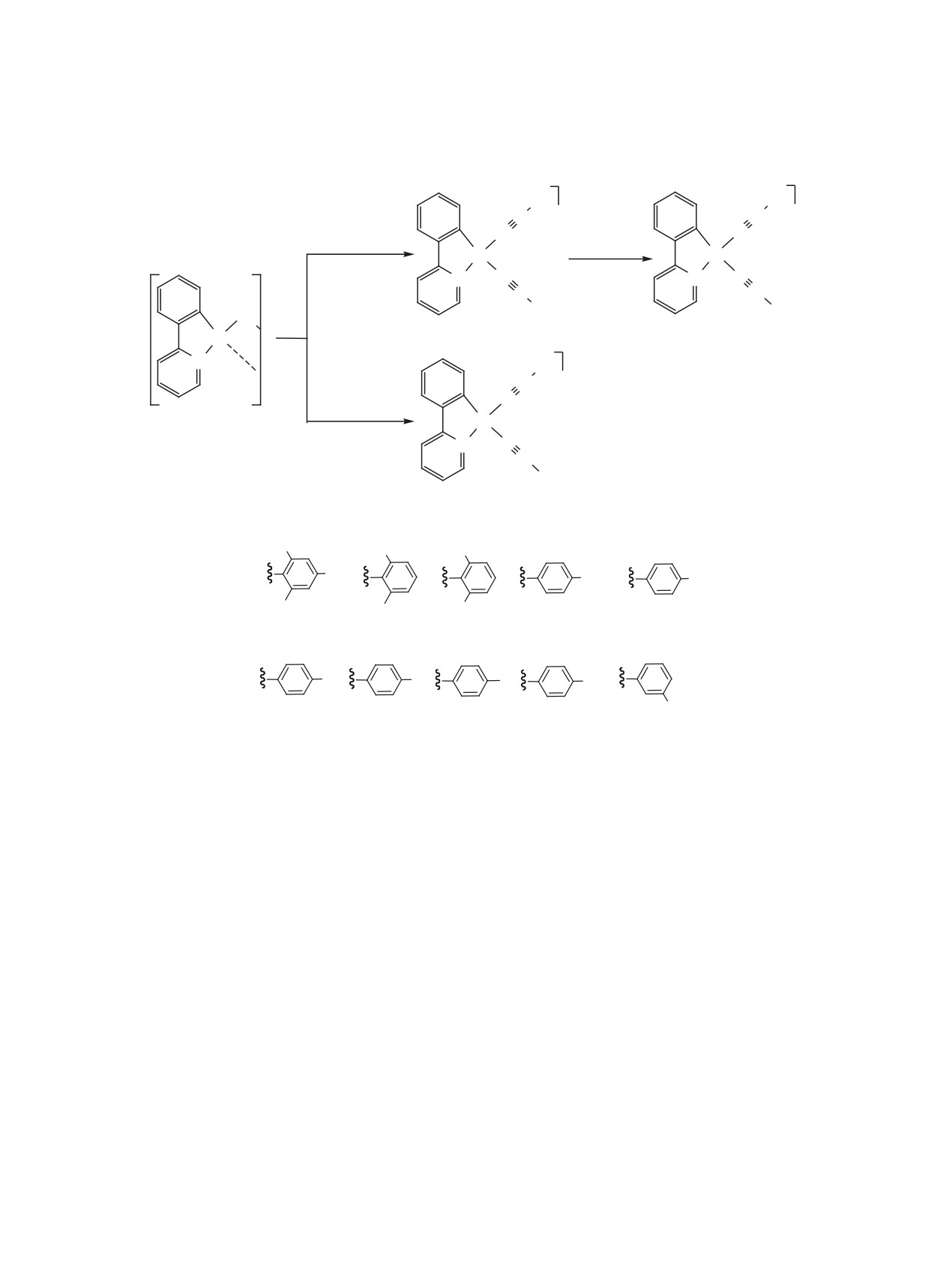
Серия циклометаллированых комплексов платины(II) [Pt(ppy){CNAr}2]X с двумя изоцианидными ли-
гандами (Hppy = 2-фенилпиридин, Ar = С6H2-2,4,6-Me3, С6H3-2-Cl-6-Me, С6H3-2,6-Cl2, C6H4-4-NMe2,
C6H4-4-Me, C6H4-4-Cl, C6H4-4-Br, C6H4-4-I, C6H4-4-CF3, C6H4-3-CF3; X = BF4, OTf) синтезирована взаи-
модействием димера [{Pt(ppy)Cl}2] c изоцианидами (выход 52-70%). Структура полученных комплексов
установлена с помощью масс-спектрометрии, спектроскопии ЯМР 1H, 13C{1H}, 195Pt{1H}, 1H-1H COSY,
1H-1H NOESY, 1H-13C HSQC и 1H-13C HMBC в растворе и твердотельной спектроскопии ЯМР CP/MAS
13C и 195Pt, ИК спектроскопии и рентгеноструктурного анализа в твердой фазе. Изучены фотофизиче-
ские свойства полученных комплексов в твердой фазе и механохромное люминесцентное поведение. В
твердой фазе все синтезированные соединения фосфоресцируют в зеленом или оранжевом диапазоне
видимого света, квантовые выходы фотолюминесценции достигают 26%. Зеленые люминофоры демон-
стрируют обратимое механохромное изменение люминесценции, достигаемое механическим измельче-
нием (зеленый в оранжевый) и адсорбцией растворителя (оранжевый в зеленый).
Ключевые слова: комплексы платины, изоцианиды, люминесценция, механолюминесценция
DOI: 10.31857/S0044460X23010134, EDN: OZPAUN
Люминесцентные материалы на основе ком-
ного класса люминофоров являются гетеролепти-
плексных соединений металлов платиновой груп-
ческие C^N-циклометаллированные комплексы
пы, такие как эмиссионные слои в светоизлучаю-
платины(II) [Pt(C^N)(L1,L2)]Z. Настройка фотофи-
щих устройствах, люминесцентные хемосенсоры
зических свойств таких люминофоров достигает-
и агенты для биомиджинга, обладают рядом пре-
ся варьированием структуры циклометаллирован-
имуществ по сравнению с органическими люми-
ного (C^N) и вспомогательных лигандов (L1, L2).
нофорами [1-5]. В таких комплексах излучения
Основную роль в формировании люминесцент-
имеет триплетный характер (фосфоресценция),
ных свойств играет хелатный лиганд, поскольку
проявляющийся за счет сильного спин-орбиталь-
эмиссия в основном определяется лиганд-цен-
ного взаимодействия, вызванного эффектом тяже-
трированными переходами (3LC) и переходами с
лого атома - металлоцентра - и способствующего
переносом заряда с металла на лиганд (3MLCT).
формально запрещенному переходу между син-
Вспомогательные лиганды, как правило, способ-
глетным и триплетным возбужденными уровнями
ствуют увеличению энергетического зазора между
[1, 6]. Одними из перспективных соединений дан-
самым низколежащим возбужденным состоянием
113
114
КАТКОВА и др.
(IL/MLCT) и более высоким d*-уровнем, что при-
растворе CH2Cl2 (поглощение и эмиссия) и твер-
водит к снижению вероятности нерадиационного
дой фазе (эмиссия, время жизни возбужденного
распада и увеличению квантового выхода люми-
состояния и квантовый выход фотолюминесцен-
несценции [7-11]. Использование в качестве вспо-
ции), а также влияние механического воздействия
могательных лигандов L сильных σ-донорных ли-
на люминесцентные свойства в твердой фазе.
гандов, таких как изоцианиды, позволяет получить
Синтез соединений 3а-л проводили взаимодей-
люминофоры, обладающие высокими квантовыми
ствием хлормостикового димера 1 со стехиометри-
выходами фотолюминесценции [12-14]. К тому
ческим количеством соответствующего изоциани-
же, линейная геометрия изоцианидных лигандов
да CNAr [Ar = С6H2-2,4,6-Me3 (a), С6H3-2-Cl-6-Me
гарантирует отсутствие стерических затрудне-
(б), С6H3-2,6-Cl2 (в), C6H4-4-NMe2 (г), C6H4-4-Me
ний для образования межмолекулярных некова-
(д), C6H4-4-Cl (е), C6H4-4-Br (ж), C6H4-4-I (з),
лентных взаимодействий различных типов (ме-
C6H4-4-CF3 (и), C6H4-3-CF3 (к)] двумя способами
таллофильные Pt···Pt, π···π-стекинг), что, в свою
(схема 1). Первый способ заключался в предвари-
очередь, может повысить структурную жесткость
тельном удалении хлоридного лиганда и получе-
молекул в кристалле и снизить безызлучательное
нии ацетонитрильного комплекса 2, который далее
рассеивание энергии [9, 13, 15-20]. К настоящему
вводили в реакцию с изоцианидом. Этот метод
времени циклометаллированные комплексы пла-
оказался наиболее удобным для получения сое-
тины(II) с изоцианидными лигандами зарекомен-
динений 3а-в (выход 66-72%). Согласно второму
довали себя в качестве высокоэффективных лю-
способу, комплексы 3г-к получены при кипячении
минофоров [10, 12-14, 21-26], фотокатализаторов
в 1,2-дихлорэтане димера 1, изоцианида и избытка
[27], а также потенциальных противоопухолевых
NaBF4 (выход 52-70%). Синтез соединений 3а-в с
препаратов [28, 29].
помощью второго способа протекает с меньшими
В ряде работ показано, что циклометаллиро-
препаративными выходами, поскольку комплексы
ванные комплексы платины(II) также могут прояв-
растворимы в 1,2-дихлорэтане в отличие от соеди-
лять механолюминесцентные свойства (см. обзор-
нений 3г-л. Соединения 3а-к устойчивы на возду-
ные статьи [30-33], последние работы [14, 34-37]).
хе при 20-150°С (т. разл. >165°С); комплексы 3а-в
В литературе описаны способные к механолюми-
растворимы в широко используемых апротонных
несценции гетеролептические C^N-циклометал-
растворителях (CH2Cl2, CHCl3 и MeCN), в свою
лированные комплексы платины(II), такие как
очередь, соединения 3г-к имеют ограниченную
[Pt(ppy)(O^N)] (O^N = хинолин [38], 5-[2-(4-R-фе-
растворимость в этих растворителях.
нил)этинил]-8-хинолин {R = H, Me, Et, t-Bu} [39]);
Строение комплексов 3а-к установлено с по-
[Pt(С^N)Cl{СNR] и
[Pt(С^N)(C≡СTol){CNR}]
мощью с помощью масс-спектрометрии высокого
(С^N = ppy, дифторфенилпиридин, фенилхинолин;
разрешения с электрораспылительной ионизаци-
R = С6H3-2,6-Me2) [20]. Тем не менее, исследова-
ей, ИК спектроскопии, ЯМР 1H, 13C{1H}, 19F{1H},
нию механолюминесцентных свойств C^N-цикло-
195Pt{1H}, 1H-1H COSY, NOESY и 1H-13C HSQC,
металлированных комплексов платины(II) с изо-
HMBC, а также методом РСА (3а-в, 3к). Из-за пло-
цианидными лигандами представлено всего в двух
хой растворимости соединений 3д-и в широкодо-
работах [14, 20].
ступных органических растворителях их строение
Учитывая наш научный интерес к разработке
изучено в растворе только методом масс-спектро-
метрии и в твердом состоянии методами ИК спек-
светоизлучающих и фотоактивных систем на ос-
троскопии и твердотельной спектроскопии ЯМР
нове изоцианидных комплексов платины(II) [13,
14, 26, 40-42], в представленной работе получена
13С и 195Pt.
серия бисизоцианидных циклометаллированных
В масс-спектрах растворов комплексов 3а-к
комплексов платины(II) [Pt(ppy){CNAr}2]X (Ar =
в MeOH пик максимальной интенсивности соот-
С6H2-2,4,6-Me3, С6H3-2-Cl-6-Me, С6H3-2,6-Cl2,
ветствует иону [M - OTf/BF4]+ и имеет изотопное
C6H4-4-NMe2, C6H4-4-Me, C6H4-4-Cl, C6H4-4-Br,
распределение, соответствующее предполагаемой
C6H4-4-I, C6H4-4-CF3, C6H4-3-CF3; X = BF4, OTf)
брутто-формуле. В ИК спектрах соединений 3а-к
(схема 1), изучены фотофизические свойства в
присутствуют две частично перекрывающиеся ин-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
БИСИЗОЦИАНИДНЫЕ ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
115
Схема 1.
OTf
OTf
Me
Ar
C
N
N
C
AgOTf
CNAr
Pt
Pt
MeCN
CH2Cl2
N
N
N C
C
N
Me
Ar
Cl
2
Pt
3а-в (56-67%)
1/2
N
BF4
Ar
N
CNAr
C
2
NaBF4
1
Pt
C2H4Cl
2
N C
N
Ar
3г-к (56-70%)
Me
Cl
Cl
Me
NMe2
Me
Me
Me
Cl
а
б
в
г
д
Cl
Br
I
CF3
CF3
е
ж
з
и
к
тенсивные полосы валентных колебаний тройной
нилпиридинового фрагмента (рру), мультиплет-
связи C≡N в области 2166-2226 см-1, что свиде-
ный характер этого сигнала обусловлен спин-спи-
тельствует о присутствии двух изоцианидных ли-
новым взаимодействием с магнитно-активным
гандов в структуре комплекса [20, 21, 23, 28, 43,
ядром 195Pt [50]. Сравнивания данные для сое-
динений 3а-в, к с описанными ранее для моно-
44]. Положение полос поглощения ν(C≡N) в ком-
изоцианидных комплексов
[Pt(ppy)Cl{CNR}],
плексах 3а-к смещено в сторону более высоких
для которых δ атома водорода H11 около 9.5 м. д.
частот по сравнению ν(C≡N) соответствующих не-
[40, 41], можно отметить, что введение в струк-
координированных изоцианидов (табл. 1), что под-
туру второго изоцианидного лиганда приводит к
тверждает координацию изоцианида и указывает
низкочастотному смещению сигнала атома водо-
на проявление изоцианидным лигандом сильных
рода H11 в комплексах 3а-в, к. В спектрах твер-
σ-донорных свойств [40, 45-47].
дотельного ЯМР 13С CP/MAS соединений 3г-и
В спектрах ЯМР 1H соединений 3а-в, к отли-
наблюдается набор сигналов, соответствующий
чительным сигналом является высокочастотный
фрагментам ppy и CNR, как и в растворе для со-
пик 8.4-9.1 м. д., соответствующий протону H11
единений 3а-в, к. Сигналы в спектре ЯМР 195Pt
(нумерация приведена согласно данным РСА фе-
расположены в диапазоне δPt -4195-4074 м. д.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
116
КАТКОВА и др.
Таблица 1. Положение полос колебаний ν(C≡N) в ИК
имеет плоскоквадратную геометрию, сформиро-
спектрах изоцинидов и комплексов 3а-к
ванную одним циклометаллированным и двумя
изоцианидными лигандами. Длины связей Pt-Cppy
ν(CN), см-1
Ar
и Pt-Nppy и угол CppyPtNppy находятся в стандарт-
CNAr
комплекс
ном диапазоне для связей этого типа и согласу-
C6H2-1,3,5-Me3
2116[48]
2166, 2186
ются со значениями в других соединениях типа
C6H3
-2-Cl-6-Me
2124
2184, 2207
[Pt(ppy)L2] [20, 21, 23]. Длины связей Pt-CCNR со-
C6H3-2,6-Cl2
2120 [49]
2176, 2201
поставимы с теми, которые наблюдаются в других
C6H4-4-NMe2
2115
2183, 2204
изоцианидных комплексах [Pt(C^N){CNR}2]Х и
C6H4
-4-Me
2128 [49]
2196, 2226
[Pt(C^N)Cl{CNR}]. Во всех случаях тройная связь
C6H4-4-Cl
2126
2196, 2221
C≡N в изоцианидном фрагментах имеет длину,
C6H4-4-Br
2125
2192, 2220
сходную с длинами аналогичных связей в других
C6H4-4-I
2128
2191, 2217
комплексах платины(II) [21, 40, 41]. Все прочие
C6H4-4-CF3
2128
2195, 2218
длины связей хорошо согласуются со значениями
C6H4-3-CF3
2123
2231, 2203
межатомных расстояний в других циклометалли-
рованных изоцианидных комплексах платины(II).
Расстояния Pt-CNC≡N в транс-положении по от-
ношению к атому Nppy, короче на 0.067-0.117 Å,
что согласуется с литературными данными для
чем расстояние Pt-CC≡N в транс-положении по
описанных ранее бисизоцианидных цикломе-
отношению к атому Сppy; данное наблюдение со-
таллированных комплексов
([Pt(bzq){CNR}2]+
гласуется с меньшим транс-влиянием атома N
[bzq = бензохинолин, R = t-Bu (δPt -4246 м. д.),
относительно атома С фрагмента рру [26]. Изоци-
C6H3-2,6-Me2 (δPt -4168 м. д. [21])].
анидные лиганды CNR координированы линейно.
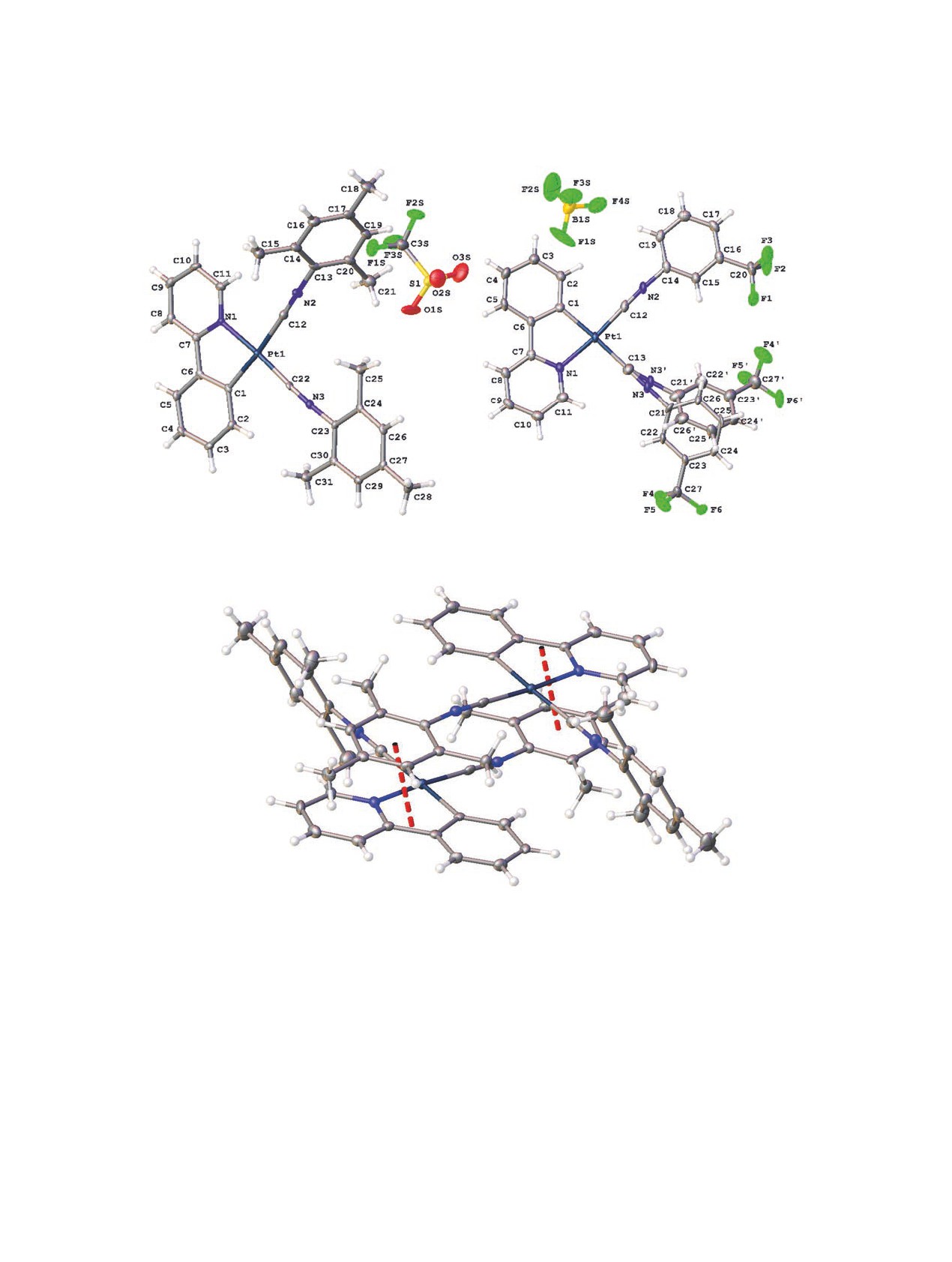
Для доказательства структуры соединений
Можно отметить, что во всех случаях арильный
3а-в, к в твердой фазе использован метод рентге-
фрагмент изоцианидного лиганда, находящего-
ноструктурного анализа (РСА) (рис. 1). Значения
ся в транс-положении к Сppy некомпланарен с
некоторых длин связей и валентных углов приве-
координационной плоскостью [двугранный угол
дены в табл. 2.
между арильным фрагментом изоцианидного ли-
По данным РСА, соединения 3а-в, к имеют
ганда и плоскостью Pt-C-N-C-C 60.88(8)° для
ионный характер в твердой фазе; во всех струк-
3а; 52.61(19)° для 3б; 43.93(7)° для 3в; 20.40(2)°
турах кристаллографически независимая часть
и 34.2(5)° для 3к]. В кристалле комплексы 3а-в, к
представлена одним металлорганическим катио-
образуют димеры с конфигурацией голова к хвосту
ном [Pt(ppy){CNR}2]+ и анионом (OTf- для 3a-в
за счет слабых межмолекулярных π-π-взаимодей-
или BF– для 3к). Координационная сфера металла
ствий между циклометаллированным и изоци-
Таблица 2. Значения некоторых длин связей (Å) и углов (град) в комплексах 3а-в, к
Связь, угол
3а
3б
3в
3к
Pt-Nppy
2.049(2)
2.0486(19)
2.0486(19)
2.049(3)
Pt-Cppy
2.026(3)
2.020(2)
2.020(2)
2.036(4)
Pt-CCC≡N
2.015(3)
1.985(3)
1.985(2)
2.027(5)
Pt-CNC≡N
1.919(3)
1.918(2)
1.919(2)
1.910(4)
C≡NС
1.157(4)
1.153(3)
1.153(3)
1.162(16)
C≡NN
1.146(4)
1.149(3)
1.149(3)
1.152(6)
CppyPtNppy
80.79(11)
80.71(9)
80.71(9)
81.50(15)
NppyPtCCCNR
94.86(11)
94.18(9)
94.18(9)
95.49(16)
NppyPtCNCNR
175.08(10)
175.24(11)
174.73(8)
174.22(16)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
БИСИЗОЦИАНИДНЫЕ ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
117
(а)
(б)
Рис. 1. Общий вид молекул комплексов 3a (а) и 3к (б) в кристалле.
Рис. 2. Ориентация голова-хвост в комплексе 3а в твердой фазе.
нанидным лигандами (рис. 2, расстояние между
Для комплексов 3а-к в твердой фазе зареги-
плоскостями фенилпиридинового и изоцианидных
стрированы спектры эмиссии и измерены кванто-
лигандов 3.55 Å для 3а, 3.979 Å - 3б, 3.818 Å - 3в и
вые выходы люминесценции и время жизни воз-
3.897 Å - 3к, что соответствует 104-117% от удво-
бужденного состояния (табл. 3, рис. 4). Вследствие
енного ван-дер-ваальсова радиуса атома углерода,
плохой растворимости соединений 3в-к получить
предложенного Бонди [[51]).
фотофизические характеристики в растворе уда-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
118
КАТКОВА и др.
Таблица 3. Фотофизические характеристики комплексов 3a-к в растворе и твердой фазе
№
Образец
λems, нм (λexc, нм)
Φ, %
τ, мксб
Растворв
482, 515, 558 пл (310)
-
-
3аб
Твердая фаза
484, 520, 550 пл (410)
1.9
1.2
После измельчения
484, 520, 550, 609 пл (410)
4.5
1.2
Растворв
482, 517, 567 пл (310)
-
-
3бб
Твердая фаза
600(410)
5.9
1.0
После измельчения
600(410)
6.3
0.9
Твердая фаза
497, 530, 554 пл (370)
4.3
1.2
3в
После измельчения
497, 530, 554 пл (370)
5.7
1.2
Твердая фаза
600 (430)
6.3
0.6
3г
После измельчения
603 (430)
5.4
0.5
Твердая фаза
493, 516, 558 пл (430)
19.3
3.2
3д
После измельчения
664 (410)
11.3
1.3
Твердая фаза
503, 537, 563 пл (395)
13.7
2.4
3е
После измельчения
624 (410)
12.7
1.0
Твердая фаза
544 (395)
5.1
0.8
3ж
После измельчения
629 (410)
6.3
1.2
Твердая фаза
537, 571 пл (395)
12.3
2.0
3з
После измельчения
618 (410)
10.9
1.1
Твердая фаза
594 (430)
26.1
1.6
3и
После измельчения
611 (410)
6.2
0.7
Твердая фаза
487, 500, 523, 550 пл (360)
1.5
1.8
3к
После измельчения
662 (410)
0.6
1.2
а Время жизни комплексов определено в максимуме эмиссионных полос. б Среднее время жизни эмиссии для двух экспоненциаль-
ных распадов, определяемое уравнением tav = (A1t2 + A2t2)/(A1t1 + A2t2), Ai = вес i-ой экспоненты.
б λabs, нм (ε×10-3, см-1·М-1): 3а, 224 (29.5), 278 (3.1), 324 (1.4); 3б, 224 (30.1), 275 (2.9), 321 (1.3).
в 293 K, раствор СH2Cl2 (1×10-4 М.).
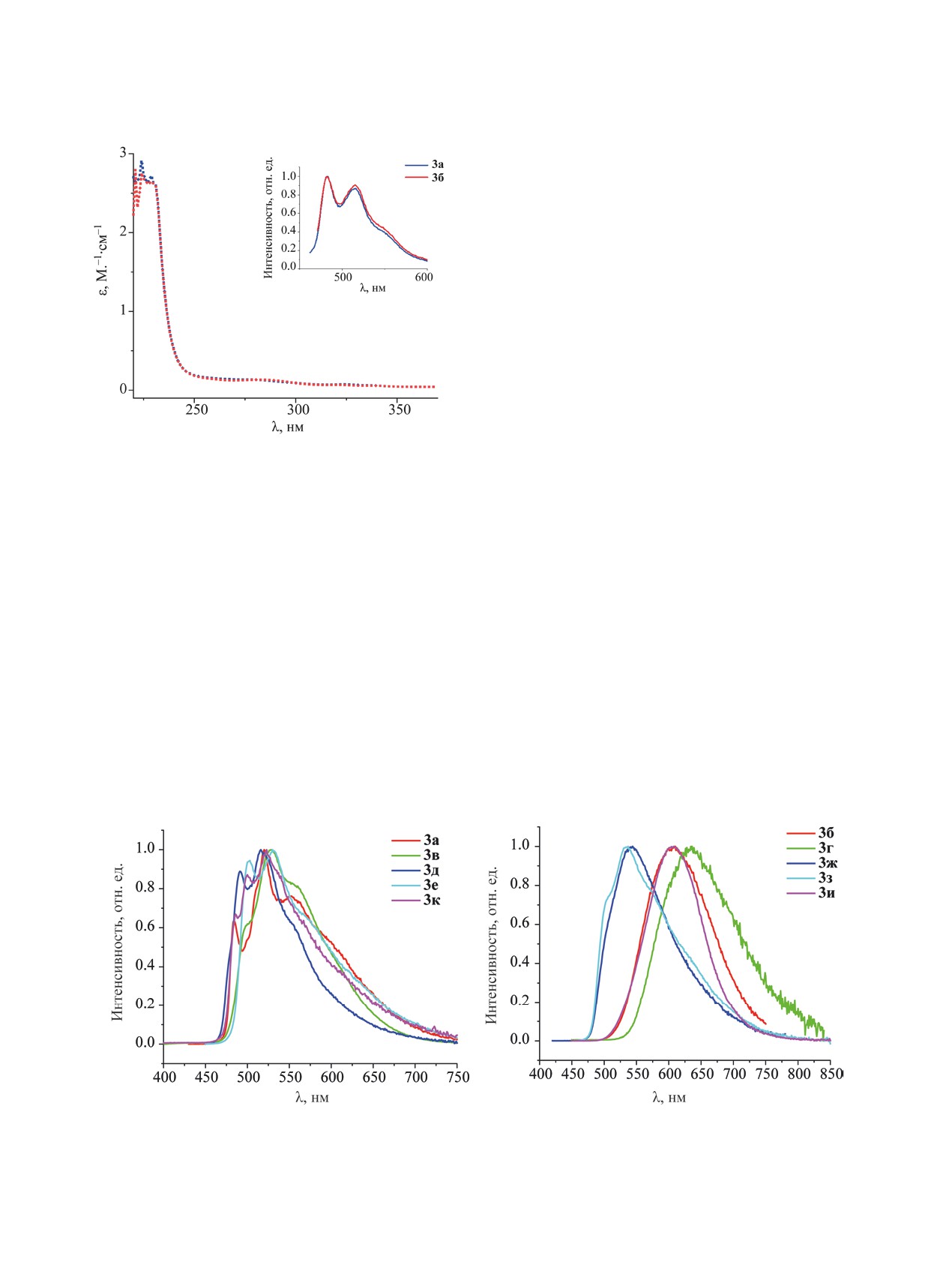
лось только для комплексов 3а и 3б - для них за-
и с металла на лиганд [1MLCT, dπ(Pt)→π*(ppy)].
регистрированы спектры поглощения и эмиссии в
В спектре люминесценции комплексов 3а и 3б в
растворе СH2Cl2 (табл. 3, рис. 3).
растворе CH2Cl2 (1×10-4 М) излучение имеет оди-
Электронные спектры поглощения соедине-
наковый колебательно-структурированный про-
филь (рис. 3), аналогичный для ранее описанных
ний 3а и 3б в растворе CH2Cl2 (1×10-4 М.), имеют
несколько типов оптических переходов (табл. 3,
моноизоцианидных комплексов [Pt(ppy)Cl{CNR}]
[13, 20, 40, 42], что свидетельствует о схожей при-
рис. 3), которые соответствуют литературным дан-
роде излучательных переходов, обусловленной
ным, полученным ранее для других циклометал-
внутрилигандными 3LC(ppy) переходам с неболь-
лированных комплексов платины(II) с изоцианид-
шой примесью 3MLCT-переходов.
ными лигандами [Pt(C^N)X{CNR}] [13, 15, 19, 20,
23, 40, 41] и [Pt(C^N){CNR}2]X [21, 28, 52]. Так,
Спектр люминесценции комплекса 3а в твердой
интенсивные полосы поглощения в области λ 200-
фазе аналогичен спектру, зарегистрированному
300 нм можно отнести к внутрилигандным
в растворе. Схожую с комплексом 3а вибронную
π-π*-переходам циклометаллированного лиганда
структуру и положения максимумов излучения де-
1LC (ppy), менее интенсивные низкоэнергетические
монстрируют также соединения 3в, д, е, и. Ком-
полосы поглощения при λ 320-380 нм - спин-раз-
плексы 3б, г, ж-к в твердой фазе демонстрирует
решенным переходам переноса заряда с лиганда
эмиссию в виде уширенной бесструктурной по-
на лиганд (1L1L2CT, L1 = ppy, L2 = CNR, π→π*)
лосы (табл. 3, рис. 4). Значение времени жизни
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
БИСИЗОЦИАНИДНЫЕ ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
119
люминесценции (табл. 3, рис. 5). При измельчении
желто-зеленых кристаллов комплексов 3д-ж, и
наблюдается постепенное изменение окраски по-
лучающегося порошка на желто-оранжевую, что
также сопровождается изменением цвета фото-
люминесценции с зеленой на оранжевую. Прои-
зошедшее изменение цвета остается неизменным
при хранении в течение нескольких недель, однако
при добавлении нескольких капель растворителя,
такого как н-гексан или CH2Cl2, происходит из-
менение окраски и цвета фотолюминесценции на
наблюдаемые для неизмельченных образцов. При
измельчении оранжевых кристаллов комплексов
3б, г, к не наблюдалось видимого изменения окра-
ски образца и цвета фотолюминесценции.
Риc. 3. Спектры поглощения соединений 3а и 3б в
Анализ спектров люминесценции подтвердил,
(1×10-4 М.). На вставка приведены
растворе CH2Cl2
что изученные комплексы по-разному реагируют
спектры люминесценции.
на механическое воздействие. При измельчении
комплексов 3д, е, и происходит изменение спек-
трального профиля на уширенный куполообраз-
ный и смещение максимума излучения в красную
возбужденного состояния (табл. 3) находится в
область (табл. 2, рис. 5). В случае соединений 3ж, з
микросекундном интервале (0.2-2.4 мкс), что ука-
измельчение сопровождается значительным
зывает на триплетное происхождение люминес-
(более 100 нм) сдвигом максима излучения в
ценции, т. е. фосфоресценцию [9, 53].
красную область, в то время как для комплексов
Для изучения механолюминесцентных свойств
3б, г, к смещение полосы излучения незначи-
соединений 3а-к исследованы фотофизические ха-
тельно (0-15 нм); в обоих случаях сохраняется
рактеристики после механического измельчения в
куполообразный спектральный профиль. Важно
ступке (спектр люминесценции, время жизни воз-
отметить, что при механическом воздействии на
бужденного состояния и квантовый выход фото-
комплексы 3а, в сохраняются фотофизические
(а)
(б)
Риc. 4. Спектры эмиссии в твердой фазе комплексов 3а-к.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
120
КАТКОВА и др.
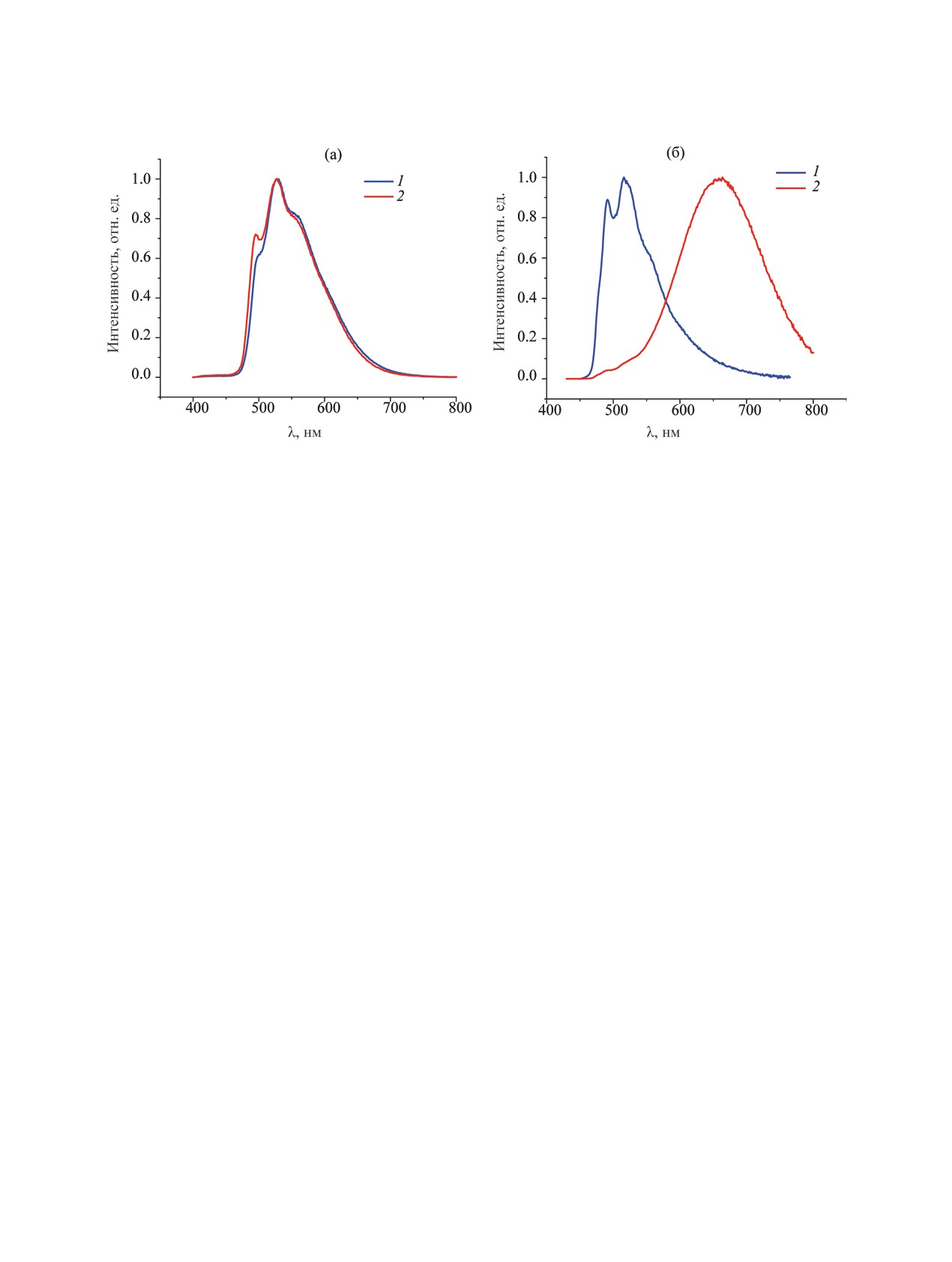
Рис. 5. Спектры эмиссии комплексов 3б (а) и 3д (б) до (1) и после измельчения (2).
свойства, в том числе спектральный профиль с
хромное изменение люминесценции, достигаемое
разрешенной вибронной структурой (рис. 5).
механическим измельчением (зеленый в оранже-
Согласно литературным данным [30-33, 54],
вый) и адсорбцией растворителя (оранжевый в
зеленый). В тоже время, зеленые люминофоры, та-
при механическом воздействии на плоскоквадрат-
кие как [Pt(ppy){CNAr}2]OTf (Ar = С6H2-2,4,6-Me3,
ные комплексы платины(II) происходит смещение
молекул относительно друг друга таким образом,
С6H3-2,6-Cl2), не изменяют фотофизические свой-
ства при механическом измельчении.
что происходит образование новых агрегатов за
счет возникающих межмолекулярных Pt···Pt и/или
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
π-π-взаимодействий. Наблюдаемое изменение фо-
тофизических свойств, в частности батохромное
Использовались коммерческие реактивы и
смещение максимума эмиссии [13, 14], вызвано
растворители (Aldrich, Вектон) без дополни-
изменением природы возбужденных состояний с
тельной очистки, кроме 1,2-дихлорэтана, CH2Cl2
3LC/3MLCT на состояния с переносом заряда ме-
и Et2O.
1,2-Дихлорэтан и CH2Cl2 перегоняли
талл-металл-лиганд (3MMLCT) или эксимерных
над P2O5, Et2O - над металлическим натрием
(3ππ*) возбужденных состояний. Подобное явле-
в присутствии бензофенонa. Хлормостиковый
ние является обратимым и при нагревании или до-
комплекс 1 синтезировали из K2[PtCl4] по ра-
бавлении органического растворителя спектраль-
нее опубликованной методике [49]. Масс-спек-
ные параметры восстанавливаются.
трометрический анализ проводили на спектро-
Таким образом, в работе изучена серия ра-
метре Bruker micrOTOF (Bruker Daltonics) с
нее не описанных циклометаллированных ком-
ионизацией электрораспылением. Растворитель -
плексов платины(II) с двумя арилизоцианидны-
метанол. Значения m/z приведены для сигналов
ми лигандами [Pt(ppy)(CNR)2]X (10 примеров).
изотопологов c наибольшим содержанием. Инфра-
В твердой фазе все синтезированные соедине-
красные спектры записаны на спектрофотометре
ния фосфоресцируют в зеленом или оранжевом
Shimadzu FTIR-спектр 8400S (4000-400 см-1, об-
диапазоне видимого света, квантовые выходы
разцы таблетированы с KBr). Спектры ЯМР 1H,
фотолюминесценции достигают
26%. Зеленые
13С{1H} и 195Pt{1H} регистрировали в растворе на
люминофоры, такие как
[Pt(ppy){CNAr}2]BF4
спектрометре Bruker Avance II+ [рабочая часто-
(Ar = C6H4-4-Me, C6H4-4-Cl, C6H4-4-Br, C6H4-4-I,
та 400.13 (1Н), 100.61 (13C), 86 МГц (195Pt)] при
C6H4-3-CF3), демонстрируют обратимое механо-
комнатной температуре, растворитель - СDCl3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
БИСИЗОЦИАНИДНЫЕ ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
121
Спектры поглощения зарегистрированы на спек-
ИК спектр, ν, см-1: 2166 с, 2186 (N≡C). Спектр
трофотометре UV-1800 (Shimadzu). Твердотель-
ЯМР 1H (СDCl3), δ, м. д.: 2.35 с (3H, Me), 2.37 с
ные спектры ЯМР зарегистрированы на приборе
(3H, Me, Mes), 2.49 с (6H, Me, Mes), 2.50 с (6H, Me,
Bruker 400 MHz WB Avance III (Bruker Daltonics),
Mes), 7.03 д (4H, CH, Mes, JHH 7.3 Гц), 7.28-7.38 м
оснащенном датчиком вращения под магическим
(2H, H3, H4), 7.66 д. д. д (1H, H10, JHH 7.3, 5.7,
углом (MAS). Спектры ЯМР на ядрах 13C получе-
1.4 Гц), 7.69-7.75 м (2H, H2, H5), 7.96 д (1H, H8, JHH
ны методом кросс-поляризации (СР) при скорости
7.2 Гц), 8.18 т. д (1H, H9, JHH 7.8, 1.5 Гц), 9.04 д с
вращения 12.5 кГц, время контакта для всех экс-
сателлитами 195Pt (1H, H11 JHH 4.3, 3JHPt 36.0 Гц).
периментов составило 2000 мкс. Релаксационная
Спектр ЯМР 13С{1H} (СDCl3), δС, м. д.: 18.72 (Me,
задержка - 2 с для комплексов 3д и 3к, 5 с - 3е-з.
Mes), 18.79 (Me, Mes), 21.42 (Me, Mes), 21.46 (Me,
Спектры ЯМР на ядрах 195Pt были получены мето-
Mes), 120.44 (C8), 125.1 (C2), 126.06 (C9), 127.69
дом прямого возбуждения (DE) при двух скоростях
(C3) , 129.39 (CArH,Mes), 129.41 (CArH, Mes), 131.68
вращения для определения положения изотропной
(C4), 135.5(CAr, Mes), 135.90 (CAr, Mes), 137.34
линии (12.5 и 13.3 кГц для комплексов 3д и 3к,
(C5), 141.16 (C17), 141.83 (C27), 142.43 (C9), 147.25
12.5 и 11.7 кГц - 3е-з). Релаксационная задержка -
(C7), 148.01 (C6), 153.68 (C11), 166.60 (C1); сигнал
10 с для комплекса 3д, 5 с - 3к, 1 с - 3е-з. Во всех
Cизоцианид не обнаружен. Спектр ЯМР 195Pt{1H}
экспериментах длительность импульса составила
(СDCl3): δPt -4103 м. д. Масс-спектр, m/z: 639.2108
3.5 мкс. Спектры возбуждения, эмиссии и расчет-
[M - OTf]+ (вычислено для C31H30N3Pt+: 639.2087).
ное время жизни возбужденного состояния полу-
Данные РСА: C34H33F3N4O3PtS, M 829.79, синго-
чены с помощью спектрофлуориметра Fluorolog-3
ния триклинная, пространственная группа P-1,
(Horiba Jobin Yvon). Рентгеноструктурныи ана-
a 8.5823(3) A, b 12.1692(5) A, c 15.6374(6) A, β
лиз 3а (CCDC 2208906), 3б (CCDC 2208907), 3в
86.339(3)°, V 1610.19(11) A3, Z 2, dвыч 1.711 г/см3, μ
(CCDC 2208908) и 3к (CCDC 2208903) выполняли
4.481 мм-1, размер кристалла 0.2 × 0.16 × 0.08 мм3,
на дифрактометре Xcalibur, Eos. Измерения про-
всего отражений 30934, независимых отражений c
водили при 100 K с использованием монохрома-
I > 2σ(I) 7388 (Rint 0.0486), R1(|Fo| ≥ 4σF)/R1 (все
тического MoKα- (λ 0.71073 нм) и CuKα-излучения
данные) 0.0248/0.0306, wR2(|Fo| ≥ 4σF)/wR2 (все
(λ 1.54184 нм). Структура решена прямыми ме-
данные) 0.0502/0.0528, ρmin/ρmax = 0.92/-0.97 e/A3.
тодами и уточнена с использованием программы
Комплекс 3б. Выход 69 мг (72%), т. разл. 193°С.
SHELX [55] встроенной в комплекс OLEX2 [56].
ИК спектр, ν, см-1: 2184 c, 2207 (N≡C). Спектр
Поправка на поглощение введена в программном
ЯМР 1H (СDCl3), δ, м. д.: 2.61 с (3H, Me), 2.65 с
комплексе CrysAlisPro эмпирически с помощью
(3H, Me), 7.26-7.49 м (8H, H3, H4, HAr), 7.63 д. д. д
сферических гармоник, реализованных в алгорит-
(1H, H10, JHH 7.3, 5.8, 1.4 Гц), 7.72 д. д (1H, H5, JHH
ме шкалирования SCALE3 ABSPACK [57].
7.6, 1.8 Гц), 7.77 д. д (1H, H2, JHH 7.2, 1.7 Гц), 7.95
Общая методика синтеза комплексов 3а-в.
д (1H, H8, JHH 7.5 Гц), 8.18 т. д (1H, H9, JHH 7.8,
Суспензию [{Pt(ppy)(μ-Cl)}2] (100 мг, 0.13 ммоль)
1.5 Гц), 9.09 д с сателлитами 195Pt (1H, H11, JHH
и AgOTf (40 мг, 0.32 ммоль) в 20 мл ацетонитрила
5.9 Гц, 3JHPt 31.0 Гц). Спектр ЯМР 13С{1H} (СDCl3),
перемешивали 2 ч. Образовавшийся нераствори-
δС, м. д.: 19.21 (Me), 19.32 (Me), 120.45 (C8), 125.04
мый AgCl отделяли фильтрованием, фильтрат упа-
(C2), 126.01 (C9), 127.59 (C3), 127.93 (Ar), 128.18
ривали досуха при пониженном давлении. Обра-
(Ar), 129.74 (CArH, Ar), 129.84 (CArH, Ar), 131.61
зовавшийся твердый остаток растворяли в CH2Cl2
(C4), 131.94 (CAr, Ar), 132.20 (CAr, Ar), 137.75 (C5),
(2 мл) и добавляли 0.52 ммоль соответствующего
138.06, 138.85, 142.53 (C9), 146.90 (C7), 149.77 (C6),
твердого изоцианида CNAr (Ar = C6H2-2,4,6-Me3,
153.94 (C11), 166.69 (C1); сигнал Cизоцианид не обна-
C6H3-2-Cl-6-Me, C6H3-2,6-Cl2). Смесь перемеши-
ружен. Спектр ЯМР 195Pt{1H} (СDCl3): δPt -4103
вали в течение 12 ч при комнатной температуре.
м. д. Масс-спектр, m/z: 639.2108 [M - OTf]+ (вы-
Образовавшийся осадок отфильтровывали, про-
числено для C31H30N3Pt+: 639.2087). Данные РСА:
мывали Et2O (3×3 мл) и сушили на воздухе при
C28N3O3F3SCl2PtH0.5, M 781.86, сингония триклин-
комнатной температуре.
ная, пространственная группа P-1, a 8.8202(2) A,
Комплекс 3a. Выход 61 мг (64%), т. разл. 165°С.
b 11.6797(4) A, c 15.6346(5) A, β 88.761(2)°, V
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
122
КАТКОВА и др.
1527.41(8) A3, Z 2, dвыч 1.700 г/см3, μ 4.887 мм-1,
спектр, ν, см-1: 2183 с, 2204 (N≡C). Спектр ЯМР
размер кристалла 0.1×0.15×0.1 мм3, всего отра-
1H (СDCl3), δ, м. д.: 3.00 с (6H, Me, NMe2), 3.03 с
жений 17725, независимых отражений c I > 2σ(I)
(6H, Me, NMe2), 6.57 т (4H, Ar, JHH 9.3 Гц), 6.83 т.
9665 (Rint 0.0314), R1(|Fo| ≥ 4σF)/R1 (все данные)
д (1H, H3, JHH 7.5, 0.9 Гц), 6.93 т. д (1H, H4, JHH 7.3,
0.0298/0.0377, wR2(|Fo| ≥ 4σF)/wR2 (все данные)
1.1 Гц), 7.10 д (2H, Ar, JHH 9.0 Гц), 7.17-7.26 м (7H,
0.0562/0.0602, ρmin/ρmax = 1.32/-0.94 e/A3.
H10, H5, H2, Ar), 7.42-7.44 м (1H, H8), 7.59 т. д (1H,
Комплекс 3в. Выход 67 мг (66%), т. разл.
H9, JHH 7.9, 1.3 Гц), 8.32 д (1H, H11, JHH 5.6 Гц).
180°С. ИК спектр, ν, см-1: 2176 с, 2201 (N≡C).
Спектр ЯМР 13С{1H} (СDCl3), δС, м. д.: 40.04 (Me),
Спектр ЯМР 1H (СDCl3), δ, м. д.: 7.29-7.34 м (2H,
119.87 (C8, C10), 124.60 (C5), 125.27 (C4), 125.40,
H3, H4), 7.44 д. д. д (1H, H10, JHH 7.4, 5.7, 1.5 Гц),
126.50, 127.73, 128.36 (C from Ar), 131.34 (C3),
7.57-7.69 м (5H, HAr, H5), 7.78-7.80 м (1H, H2),
136.72 (C2), 141.02 (C1, C9), 146.29 (C6), 151.19 (C
7.94-7.96 м (2H, HAr), 8.03 д (1H, H8, JHH 8.2 Гц),
from Ar), 151.33 (C11), 166.06 (C7); сигнал Cизоцианид
8.17 т. д (1H, H9, JHH 7.9, 1.6 Гц), 8.98 д с сателли-
не обнаружен. Спектр ЯМР 195Pt{1H} (СDCl3): δPt
тами 195Pt (1H, H11, JHH 5.7, 3JHPt 36.0 Гц). Спектр
-4074 м. д. Масс-спектр, m/z: 641.1976 [M - BF4]+
ЯМР 13С{1H} (СDCl3), δС, м. д.: 120.85 (C8), 125.19
(вычислено для C29H28N5Pt+: 641.1989).
(C2), 125.26 (C9), 127.66 (C3), 129.19 (CArH, Ar),
Общая методика синтеза комплексов 3д-к. К
129.23 (CArH, Ar), 131.82 (C4), 132.75 (CArH, Ar),
суспензии [{Pt(ppy)(μ-Cl)}2] (100 мг, 0.13 ммоль) и
132.87 (CAr, Ar), 132.92 (CArH, Ar), 133.26 (CAr,
NaBF4 (35 мг, 0.32 ммоль) в 20 мл 1,2-дихлорэтана
Ar), 138.40 (C5), 142.75 (C9), 147.06 (C7), 148.13
при перемешивании и нагревании до 50 °С прибав-
(CAr, Ar), 149.70 (CAr, Ar), 149.84 (C6),
153.79
ляли раствор 0.52 ммоль соответствующего изоци-
(C11), 166.72 (C1); сигнал Cизоцианид не обнаружен.
анида CNAr (Ar = C6H4-4-Cl, C6H4-4-Br, C6H4-4-I,
Спектр ЯМР 195Pt{1H} (СDCl3): δPt -4093 м. д.
C6H4-3-CF3, C6H4-3-CF3) в 10 мл 1,2-дихлорэта-
Масс-спектр, m/z: 690.9517 [M - OTf]+ (вычисле-
на в течение 1 ч. Смесь перемешивали при 80°С
но для C25H30Cl4N3Pt+: 690.9584). Данные РСА:
3 ч. В течение этого периода реакционная смесь
C26N3O3F3SCl4PtH0.5, M 828.74, сингония триклин-
постепенно превращалась из желтой суспензии в
ная, пространственная группа P-1, a 8.0304(2) A,
светло-зеленый раствор, после чего образовался
b 13.7011(4) A, c 14.3091(4) A, β 83.126(2)°, V
желтый или оранжевый осадок. Твердый продукт
1472.63(7) A3, Z 2, dвыч 1.869 г/см3, μ 5.250 мм-1,
отфильтровывали, промывали водой (2 мл), ацето-
размер кристалла 0.15×0.11×0.1 мм3, всего отра-
ном (5 мл), СH2Cl2 (2 мл) и сушили на воздухе при
жений 36299, независимых отражений c I > 2σ(I)
комнатной температуре.
9812 (Rint 0.0357), R1(|Fo| ≥ 4σF)/R1 (все данные)
Комплекс 3д. Выход 98 мг (56%), т. разл.
0.0228/0.0262, wR2(|Fo| ≥ 4σF)/wR2 (все данные)
231°С. ИК спектр, ν, см-1: 2196 с, 2226 (N≡C).
0.0515/0.0528, ρmin/ρmax = 1.48/-0.93 e/A3.
Спектр ЯМР 13C CP/MAS, δС, м. д.: 21.41, 123.19,
Синтез комплекса
3г.
К суспензии
124.23, 125.88, 129.81, 139.83, 141.59, 147.02,
[{Pt(ppy)(μ-Cl)}2] (100 мг, 0.13 ммоль) и NaBF4
148.12, 150.45, 151.64, 152.75, 166.21. Спектр ЯМР
(40 мг, 0.32 ммоль) в 20 мл 1,2-дихлорэтана при
195Pt: δPt -4156 м. д. Масс-спектр, m/z: 583.1420
перемешивании и нагревании до 50°С прибав-
[M - BF4]+ (вычислено для C27H22N3Pt+: 583.1458).
ляли по каплям раствор CNC6H4NMe2 (76 мг,
Комплекс 3е. Выход 126 мг (68%), т. разл.
0.52 ммоль) в 10 мл 1,2-дихлорэтана в течение
180°С. ИК спектр, ν, см-1: 2196 с, 2221 (N≡C).
1 ч. Полученную смесь перемешивали при 80°С
Спектр ЯМР 13C CP/MAS, δС, м. д.: 121.49, 124.70,
3 ч. В течение этого периода реакционная смесь
129.53, 136.08, 138.50, 141.02, 143.06, 147.43,
постепенно превращалась из желтой суспензии в
149.34, 154.55, 167.27. Спектр ЯМР 195Pt δPt, м. д.:
темно-коричневый раствор, из которого затем при
-4156. Масс-спектр, m/z: 624.0405 [M - BF4]+ (вы-
медленном выпаривании растворителя образовал-
числено для C25H16Cl2N3Pt+: 624.0352).
ся красный остаток, который отфильтровывали,
промывали водой (2 мл), ацетоном (2 мл), MeCN
Комплекс 3ж. Выход 146 мг (70%), т. разл.
(2 мл) и сушили на воздухе при комнатной тем-
185°С. ИК спектр, ν, см-1: 2192 с, 2220 (N≡C).
пературе. Выход 110 мг (58%), т. разл. 183°С. ИК
Спектр ЯМР 13C CP/MAS, δС, м. д.: 123.09, 123.91,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
БИСИЗОЦИАНИДНЫЕ ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
123
129.47, 133.49, 134.63, 135.22, 142.53, 146.93,
Соколова Элина Вадимовна, ORCID: https://
151.43, 152.78,
165.12. Спектр ЯМР 195Pt: δPt
orcid.org/0000-0001-8857-9536
–4168 м. д. Масс-спектр, m/z: 713.9352 [M - BF4]+
Кинжалов Михаил Андреевич, ORCID: https://
(вычислено для C25H16Br2N3Pt+: 713.9332).
orcid.org/0000-0001-5055-1212
Комплекс 3з. Выход 156 мг (68%), т. разл.
ФИНАНСОВАЯ ПОДДЕРЖКА
165°С. ИК спектр, ν, см-1: 2191 с, 2217 (N≡C).
Спектр ЯМР 13C CP/MAS, δС, м. д.: 100.03, 119.42,
Работа выполнена при финансовой поддержке
120.48,
124.76,
128.88,129.58,
139.36,
146.75,
Российского научного фонда (проект 22-23-00621)
150.07, 153.47, 165.49, 167.21. Спектр ЯМР 195Pt:
с использованием оборудования ресурсных цен-
δPt -4168 м. д. Масс-спектр, m/z: 806.9079 [M -
тров Санкт-Петербургского государственного
BF4]+ (вычислено для C25H16I2N3Pt+: 806.9084).
оборудования
«Магнитно-резонансные методы
Комплекс 3и. Выход 136 мг (67%), т. разл.
исследований», «Рентгенодифракционные методы
160°С. ИК спектр, ν, см-1: 2195 с, 2218 (N≡C).
исследования», «Методы анализа состава веще-
Спектр ЯМР 13C CP/MAS, δС, м. д.: 125.04, 127.63,
ства» и «Образовательный центр по направлению
131.67, 132.06, 132.76, 139.25, 142.95, 146.28,
химия», «Оптические и лазерные методы исследо-
152.08, 155.42, 165.48, 165.87, 168.14. Спектр ЯМР
вания вещества».
195Pt δPt: -4195 м. д. Масс-спектр, m/z: 691.0971
[M - BF4]+ (вычислено для C27H16F6N3Pt+: 691.0896).
КОНФЛИКТ ИНТЕРЕСОВ
Комплекс 3к. Выход 136 мг (52%), т. разл.
Авторы заявляют об отсутствии конфликта
230°С. ИК, ν, см-1: 3081 (C-H), 2231, 2203 (C≡N),
интересов.
1612 (C=C, C=N). Спектр ЯМР 1H (CD3CN), δ, м. д.:
7.30-7.32 м (2H, H3, H4), 7.43 т (1H, JHH, H10), 7.75-
СПИСОК ЛИТЕРАТУРЫ
7.77 м (2H, HAr), 7.80-7.84 м 2H, HAr), 7.95-8.06
1. Kinzhalov M.A., Grachova E.V., Luzyanin K.V. // Inorg.
м (5H, H5, H2, HAr), 8.12-8.16 м (3H, H4, H8, H9),
Chem. Front. 2022. Vol. 9. N 3. P. 417. doi 10.1039/
8.88 д (1H, H11, JHH 5.6, 3JHPt 37.0 Гц). Спектр ЯМР
d1qi01288f
13С{1H} (CD3CN), δС, м. д.: 121.69, 122.92, 125.48
2. Adachi C., Baldo M.A., Thompson M.E., Forrest S.R. //
д (JC,F 2.3 Hz), 125.62, 125.84 д (JCF 3.9 Гц), 126.12,
J. Appl. Phys. 2001. Vol. 90. N 10. P. 5048. doi
126.26, 128.45, 129.22 д (JCF 3.9 Гц), 129.47 д (м-
10.1063/1.1409582
CF3, JCF 3.9 Гц), 132.13, 132.31, 132.86, 138.99,
3. Baldo M.A., Lamansky S., Burrows P.E., Thompson M.E.,
143.56 (C1), 148.13 (C6), 150.66 (C11), 155.17, 167.75
Forrest S.R. // Appl. Phys. Lett. 1999. Vol. 75. N 1.
(C7); сигнал Cизоцианид не обнаружен. Спектр ЯМР
P. 4-6. doi 10.1063/1.124258
4. McGhie B.S., Aldrich-Wright J.R. // Biomedicines. 2022.
19F (CD3CN), δF, м. д.: -63.51 м (3F), -151.86 м
Vol. 10. N 3. P. 578. doi 10.3390/biomedicines10030578
(3F). Спектр ЯМР 195Pt{1H} (CD3CN): δPt -4137 м.
5. Lee L.C.-C., Lo K.K.-W. // J. Am. Chem. Soc. 2022.
д. Масс-спектр, m/z: 691.0990 [M - BF4]+ (вычис-
Vol. 144. N 32. P. 14420. doi 10.1021/jacs.2c03437
лено для C27H16F6N3Pt+: 691.0896). Данные РСА:
6. Na H., Maity A., Morshed R., Teets T.S. / /
C27H16BF10N3Pt, M
778.33, сингония триклин-
Organometallics. 2017. Vol. 36. N 15. P. 2965. doi
ная, пространственная группа P-1, a 7.0835(3) A,
10.1021/acs.organomet.7b00428
b 13.3599(4) A, c 14.8864(4) A, β 100.713(3)°, V
7. Fornies J., Sicilia V., Larraz C., Camerano J.A., Martin A.,
1284.55(8) A3, Z 2, dвыч 2.012 г/см3, μ 11.113 мм-1,
Casas J.M., Tsipis A.C. // Organometallics. 2010.
размер кристалла 0.2×0.2×0.15 мм3, всего отра-
Vol. 29. N 6. P. 1396. doi 10.1021/om901032v
жений 23008, независимых отражений c I > 2σ(I)
8. Sanning J., Stegemann L., Ewen P.R., Schwermann C.,
4885 (Rint 0.0554), R1(|Fo| ≥ 4σF)/R1 (все данные)
Daniliuc C.G., Zhang D., Lin N., Duan L., Wegner D.,
Doltsinis N.L., Strassert C.A. // J. Mater. Chem. (C).
0.0283/0.0307, wR2(|Fo| ≥ 4σF)/wR2 (все данные)
2016. Vol. 4. N 13. P. 2560. doi 10.1039/C6TC00093B
0.0692/0.0710, ρmin/ρmax = 1.70/-1.16 e/A3.
9. Solomatina A.I., Aleksandrova I.O., Karttunen A.J.,
ИНФОРМАЦИЯ ОБ АВТОРАХ
Tunik S.P., Koshevoy I.O. // Dalton Trans. 2017. Vol. 46.
N 12. P. 3895. doi 10.1039/C7DT00349H
Каткова Светлана Александровна, ORCID:
10. Chen Y., Lu W., Che C.-M. // Organometallics. 2013.
Vol. 32. N 1. P. 350. doi 10.1021/om300965b
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
124
КАТКОВА и др.
11.
Paziresh S., Babadi Aghakhanpour R., Fuertes S.,
26.
Dobrynin M.V., Sokolova E.V., Kinzhalov M.A.,
Sicilia V., Niroomand Hosseini F., Nabavizadeh S.M. //
Smirnov A.S., Starova G.L., Kukushkin V.Y.,
Dalton Trans. 2019. Vol. 48. N 17. P. 5713. doi 10.1039/
Islamova R.M. // ACS Appl. Polymer Mater. 2021.
c9dt00807a
Vol. 3. N 2. P. 857. doi 10.1021/acsapm.0c01190
12.
Sutton G.D., Olumba M.E., Nguyen Y.H., Teets T.S. //
27.
Anderson C., Crespo M., Morris J., Tanski J.M. // J.
Dalton Trans. 2021. Vol. 50. N 48. P. 17851. doi
Organomet. Chem. 2006. Vol. 691. N 26. P. 5635. doi
10.1039/D1DT03312C
10.1016/j.jorganchem.2006.09.012
13.
Katkova S.A., Luzyanin K.V., Novikov A.S., Kinzha-
28.
Liu J., Leung C.H., Chow A.L.F., Sun R.W.Y., Yan S.C.,
lov M.A. // New J. Chem. 2021. Vol. 45. N 6. P. 2948.
Che C.M. // Chem. Commun. 2011. Vol. 47. N 2. P. 719.
doi 10.1039/D0NJ05457G
doi 10.1039/c0cc03641b
14.
Sokolova E.V., Kinzhalov M.A., Smirnov A.S.,
29.
Sun R.W.Y., Chow A.L.F., Li X.H., Yan J.J.,
Cheranyova A.M., Ivanov D.M., Kukushkin V.Y.,
Chui S.S.Y., Che C.M. // Chem. Sci. 2011. Vol. 2. N 4.
Bokach N.A. // ACS Omega. 2022. Vol. 7. N 38.
P. 728. doi 10.1039/c0sc00593b
P. 34454. doi 10.1021/acsomega.2c04110
30.
Sagara Y., Kato T. // Nat. Chem. 2009. Vol. 1. N 8.
15.
Solomatina A.I., Krupenya D.V., Gurzhiy V.V., Zlatkin I.,
P. 605. doi 10.1038/nchem.411
Pushkarev A.P., Bochkarev M.N., Besley N.A.,
31.
Chi Z., Zhang X., Xu B., Zhou X., Ma C., Zhang Y.,
Bichoutskaia E., Tunik S.P. // Dalton Trans. 2015.
Liu S., Xu J. // Chem. Soc. Rev. 2012. Vol. 41. N 10.
Vol. 44. N 16. P. 7152. doi 10.1039/c4dt03106g
P. 3878. doi 10.1039/C2CS35016E
16.
Yam V.W.W., Law A.S.Y. // Coord. Chem. Rev. 2020.
32.
Sagara Y., Yamane S., Mitani M., Weder C., Kato T. //
Vol. 414. P. 213298. doi 10.1016/j.ccr.2020.213298
Adv. Mater. 2016. Vol. 28. N 6. P. 1073. doi 10.1002/
17.
Wang P.P., Miao X.R., Meng Y., Wang Q., Wang J.,
adma.201502589
Duan H.H., Li Y.W., Li C.Y., Liu J., Cao L.P. // ACS
33.
Huang Q., Li W., Yang Z., Zhao J., Li Y., Mao Z.,
Appl. Mater. Interfaces. 2020. Vol. 12. N 20. P. 22630.
Yang Z., Liu S., Zhang Y., Chi Z. // CCS Chem.
doi 10.1021/acsami.0c04917
2022. Vol. 4. N 5. P. 1643. doi doi10.31635/
18.
Koshevoy I.O., Krause M., Klein A. // Coord. Chem.
ccschem.021.202100968
Rev. 2020. Vol. 405. P. 213094. doi 10.1016/j.
34.
Su M., Liu S., Zhang J., Meng C., Ni J. // Dyes
ccr.2019.213094
Pigm. 2022. Vol. 200. P. 110139. doi 10.1016/j.
19.
Diez A., Fornies J., Larraz C., Lalinde E., Lopez J.A.,
dyepig.2022.110139
Martin A., Moreno M.T., Sicilia V. // Inorg. Chem. 2010.
35.
Ito S. // CrystEngComm. 2022. Vol. 24. N 6. P. 1112. doi
Vol. 49. N 7. P. 3239. doi 10.1021/ic902094c
10.1039/D1CE01614H
20.
Martinez-Junquera M., Lara R., Lalinde E.,
36.
Riesebeck T., Bertrams M.-S., Stipurin S., Konowski K.,
Moreno M.T. // J. Mater. Chem. (C). 2020. Vol. 8. N 21.
Kerzig C., Strassner T. // Inorg. Chem. 2022. Vol. 56.
P. 7221. doi 10.1039/d0tc01163k
N16. P. 9391. doi 10.1021/acs.inorgchem.2c02141
21.
Diez A., Fornies J., Fuertes S., Lalinde E., Larraz C.,
37.
Zhang H.-H., Wu S.-X., Wang Y.-Q., Xie T.-G.,
Lopez J.A., Martin A., Moreno M.T., Sicilia V. //
Sun S.-S., Liu Y.-L., Han L.-Z., Zhang X.-P., Shi Z.-F. //
Organometallics. 2009. Vol. 28. N 6. P. 1705. doi
Dyes Pigm. 2022. Vol. 197. P. 109857. doi 10.1016/j.
10.1021/om800845c
dyepig.2021.109857
22.
Fornies J., Sicilia V., Borja P., Casas J.M., Diez A.,
38.
Yang C.-J., Yi C., Xu M., Wang J.-H., Liu Y.-Z.,
Lalinde E., Larraz C., Martin A., Moreno M.T. // Chem.
Gao X.-C., Fu J.-W. // Appl. Phys. Lett. 2006. Vol. 89.
Asian J. 2012. Vol. 7. N 12. P. 2813. doi 10.1002/
N 23. P. 233506. doi 10.1063/1.2400395
asia.201200585
23.
Shahsavari H.R., Babadi Aghakhanpour R.,
39.
Ni J., Liu G., Su M., Zheng W., Zhang J. // Dyes
Hossein-Abadi M., Golbon Haghighi M., Notash B.,
Pigm. 2020. Vol. 180. P. 108451. doi 10.1016/j.
Fereidoonnezhad M. // New J. Chem. 2017. Vol. 41.
dyepig.2020.108451
N 24. P. 15347. doi 10.1039/C7NJ03110F
40.
Каткова С.А., Лещев А.А., Михердов А.С.,
24.
Sivchik V.V., Grachova E.V., Melnikov A.S.,
Кинжалов М.А. // ЖОХ. 2020. Т. 90. № 4. С.
Smirnov S.N., Ivanov A.Y., Hirva P., Tunik S.P.,
591; Katkova S.A., Leshchev A.A., Mikherdov A.S.,
Koshevoy I.O. // Inorg. Chem. 2016. Vol. 55. N 7.
Kinzhalov M.A. // Russ. J. Gen. Chem. 2020. Vol. 90.
P. 3351. doi 10.1021/acs.inorgchem.5b02713
N 4. P. 648. doi 10.1134/s1070363220040143
25.
Dobrynin M.V., Kasatkina S.O., Baykov S.V., Savko P.Y.,
41.
Каткова С.А., Михердов А.С., Новиков А.С.,
Antonov N.S., Mikherdov A.S., Boyarskiy V.P.,
Старова Г.Л., Кинжалов М.А. // ЖОХ. 2021. Т. 91.
Islamova R.M. // Dalton Trans. 2021. Vol. 50. N 42.
№ 3. С. 430; Katkova S.A., Eliseev I.I., Mikherdov A.S.,
P. 14994. doi 10.1039/D1DT02823E
Sokolova E.V., Starova G.L., Kinzhalov M.A. // Russ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023
БИСИЗОЦИАНИДНЫЕ ЦИКЛОМЕТАЛЛИРОВАННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ(II)
125
J. Gen. Chem. 2021. Vol. 91. N 3. P. 393. doi 10.1134/
49. Guirado A., Zapata A., Gómez J.L., Trabalón L.,
s1070363221030099
Gálvez J. // Tetrahedron. 1999. Vol. 55. N 31. P. 9631.
42.
Katkova S.A., Mikherdov A.S., Sokolova E.V.,
doi 10.1016/S0040-4020(99)00509-8
50. Pazderski L., Pawlak T., Sitkowski J., Kozerski L.,
Novikov A.S., Starova G.L., Kinzhalov M.A. // J. Mol.
Szłyk E. // Magn. Reson. Chem. . 2009. Vol. 47. N 11.
Struct. 2022. Vol. 1253. P. 132230. doi 10.1016/j.
P. 932. doi 10.1002/mrc.2491
molstruc.2021.132230
51. Bondi A. // J. Phys. Chem. 1964. Vol. 68. N 3. P. 441.
43.
Diez-Gonzalez S., Nolan S.P. // Coord. Chem. Rev. 2007.
doi 10.1021/j100785a001
Vol. 251. N 5-6. P. 874. doi 10.1016/j.ccr.2006.10.004
52. Fuertes S., Chueca A.J., Peralvarez M., Borja P.,
44.
Sicilia V., Fuertes S., Martin A., Palacios A. //
Torrell M., Carreras J., Sicilia V. // ACS Appl. Mater.
Organometallics. 2013. Vol. 32. N 15. P. 4092. doi
Interfaces. 2016. Vol. 8. N 25. P. 16160. doi 10.1021/
10.1021/om400159g
acsami.6b03288
45.
Popov R.A., Mikherdov A.S., Boyarskiy V.P. // Eur. J.
53. Kinzhalov M.A., Katkova S.A., Doronina E.P.,
Inorg. Chem. 2022. Vol. 2022. N 26. P. e202200217. doi
Novikov A.S., Eliseev I., Ilichev V.A., Kukinov A.A.,
10.1002/ejic.202200217.
Starova G.L., Bokach N.A. // Zeit. Kristallogr. Cryst.
46.
Кинжалов М.А., Кашина М.В., Михердов А.С.,
Mater. 2018. Vol. 233. N 11. P. 795. doi 10.1515/
Каткова С.А, Суслонов В.В. // ЖOX, 2018. T. 88. № 6.
zkri-2018-2075
54. Shimizu M. In: Aggregation-Induced Emission. Elsevier,
С. 1000; Kinzhalov M.A., Kashina M.V., Mikherdov A.S.,
2022. Ch. 8. Р. 253.
Katkova S.A., Suslonov V.V. // Russ. J. Gen. Chem. 2018.
55. Hubschle C.B., Sheldrick G.M., Dittrich B. // J. Appl.
Vol. 88. N 6. P. 1180. doi 10.1134/S107036321806021X
Crystallogr. 2011. Vol. 44. N 6. P. 1281. doi 10.1107/
47.
Кинжалов М.А., Боярский В.П. // ЖОХ. 2015. Т. 85.
S0021889811043202
№ 10. С. 1681; Kinzhalov M.A., Boyarskii V.P. // Russ.
56. Dolomanov O.V., Bourhis L.J., Gildea R.J.,
J. Gen. Chem. 2015. Vol. 85. N 10. P. 2313. doi 10.1134/
Howard J.A., Puschmann H. // J. Appl. Crystallogr.
S1070363215100175
2009. Vol.
42. N
2. P.
339. doi
10.1107/
48.
Beer H., Bresien J., Michalik D., Rölke A.-K., Schulz A.,
S0021889808042726
Villinger A., Wustrack R. // J. Org. Chem. 2020. Vol. 85.
57. CrysAlisPro A.T., Version 1.171.36.20 (release 27-06-
N 22. P. 14435. doi 10.1021/acs.joc.0c00460.
2012).
Bisisocyanide Cyclometallated Platinum(II) Complexes:
Synthesis, Structure, Photophysical Properties,
and Mechanochromic Behavior
S. A. Katkovaa,*, E. V. Sokolovaa, and M. A. Kinzhalova
a St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: s.katkova@spbu.ru
Received October 1, 2022; revised October 24, 2022; accepted October 26, 2022
A series of cyclometallated platinum(II) complexes [Pt(ppy){CNAr}2]X with two isocyanide ligands (Hppy =
2-phenylpyridine, Ar = С6H2-2,4,6-Me3, С6H3-2-Cl-6-Me , С6H3-2,6-Cl2, C6H4-4-NMe2, C6H4-4-Me, C6H4-
4-Cl, C6H4-4-Br, C6H4-4-I, C6H4-4-CF3, C6H4-3-CF3; X = BF4, OTf) was synthesized by the reaction of the
[{Pt(ppy)Cl}2] dimer with isocyanides (yield 52-70%). The structure of the resulting complexes was determined
using mass spectrometry, 1H, 13C{1H}, 195Pt{1H}, 1H-1H COSY, 1H-1H NOESY, 1H-13C HSQC, and 1H-13C
HMBC NMR spectroscopy in solution and solid-state CP/MAS 13C and 195Pt NMR spectroscopy, IR spectros-
copy and X-ray diffraction analysis in the solid phase. The photophysical properties of the obtained complexes
in the solid phase and the mechanochromic luminescence behavior were studied. In the solid phase, all synthe-
sized compounds phosphoresce in the green or orange range of visible light, while photoluminescence quantum
yields reach 26%. Green phosphors exhibit a reversible mechanochromic luminescence change achieved by
mechanical grinding (green to orange) and solvent adsorption (orange to green).
Keywords: platinum complexes, isocyanides, luminescence, mechanoluminescence
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 1 2023