ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 12, с. 1867-1874
УДК 547.057
4,7-БИС(ОКТИЛОКСИ)-3-(ХИНОЛИН-2-ИЛМЕТИЛЕН)-
ИЗОИНДОЛИН-1-ОН И ЕГО БОРФТОРИДНЫЙ
КОМПЛЕКС.
СИНТЕЗ И СПЕКТРАЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ
СВОЙСТВА
© 2023 г. А. А. Набасов1,*, Т. А. Румянцева1, В. В. Александрийский1, Н. Е. Галанин1
1 Ивановский государственный химико-технологический университет, пр. Шереметевский 7, Иваново, 153000 Россия
*е-mail: kolosaner@mail.ru
Поступило в редакцию 27 октября 2023 г.
После доработки 8 ноября 2023 г.
Принято к печати 12 ноября 2023 г.
Взаимодействием 3,6-бис(октилокси)фталонитрила с бутилатом лития в бутаноле с последующей
обработкой соляной кислотой получен 4,7-бис(октилокси)изоиндолин-1,3-дион. Его конденсация с
хинальдином в присутствии оксида цинка приводит к образованию (E,Z)-4,7-бис(октилокси)-3-(хи-
нолин-2-илметилен)изоиндолин-1-она, обработкой которого BF3·Et2O в присутствии триэтиламина в
толуоле получен новый несимметричный аналог BODIPY - (Z)-2-(дифторборил)-4,7-бис(октилокси)-3-
(хинолин-2-илметилен)изоиндолин-1-он. Комплекс имеет стоксов сдвиг 25 нм и высокий относительный
квантовый выход флуоресценции (0.68). Для подтверждения экспериментальных данных выполнены
квантово-химические расчеты.
Ключевые слова: аналоги BODIPY, комплексы бора, хинальдин, замещенный фталимид, спектраль-
но-люминесцентные свойства
DOI: 10.31857/S0044460X23120065, EDN: OBDCTW
В последние годы красители BODIPY стали
Не меньший интерес представляют несимме-
ценной категорией люминофоров для применения
тричные аналоги BODIPY. Понижение симметрии
в различных технологиях благодаря их уникаль-
ядра флуорофора приводит к значительным изме-
нениям свойств красителей, в том числе к умень-
ным физико-химическим свойствам, таким как
шению π-π-взаимодействий в твердом состоянии.
высокий квантовый выход флуоресценции, интен-
Это обусловливает наличие интенсивной флуо-
сивное поглощение с высоким молярным коэффи-
ресценции несимметричных комплексов бора как
циентом экстинкции, отличная фотохимическая
в растворах, так и в твердой фазе, а также приво-
и термическая стабильность, легкая структурная
дит, в некоторых случаях, к увеличению стоксо-
модификация и хорошая растворимость в орга-
вых сдвигов [10-12] и увеличению времени жизни
нических средах [1-5]. Эти свойства красителей
флуоресценции [13]. Свойства этих соединений
BODIPY делают их важным классом хромофоров
позволяют использовать их в качестве сенсоров на
для применения в нелинейной оптике [6], сенсиби-
цистеин [14] и фосген [15], фотосенсибилизаторов
лизированных красителями солнечных элементах
[16], флуорофоров для исследования биологиче-
[7], хемосенсорах [8], фотодинамической терапии
ских систем [17], в оптических технологиях [18] и
[9] и других областях.
в других областях.
1867
1868
НАБАСОВ и др.
Схема 1.
OC8H17
OC8H17
LiN
O
OC8H17
H2O,
CN
BuOLi,
HCl
BuOH
HN
HN
BuO
CN
BuO
O
OC8H17
OC8H17
OC
8H17
3 (95%)
Схема 2.
OC8H17
OC8H17
OC8H17
O
1)
, ZnO
N
N
BF3⋅Et2O,
N
NEt3
HN
NH
N
B
F
2) HCl
F
O
O
O
OC8H17
OC8H17
1 (75%)
OC8H17
2 (65%)
3
К числу несимметричных аналогов BODIPY
Выход имида 3 составил 95%, он представляет
относятся комплексы бора на основе продуктов
собой вещество светло-желтого цвета, раствори-
конденсации фталимидов с хинальдином, напри-
мое в широком ряду органических растворителей.
мер, 2-дифторборил-3-(хинолин-2-илметилен)изо-
В его масс-спектре отмечен сигнал молекулярного
индолин-1-он [19, 20] и его феноксизамещенные
иона при 403.58 Да. В спектре ЯМР 1Н, измерен-
[21], которые обладают интенсивной флуоресцен-
ном в CDCl3, присутствуют семь сигналов, харак-
цией и высокой фоточувствительностью в тонких
теризующих резонанс протона имидной группы,
пленках, что делает их перспективными материа-
протонов бензольного кольца и алифатических
лами для устройств тонкопленочной электроники.
заместителей. Спектр ЯМР 13С содержит сигналы
Очевидно, что изменение характера заместите-
атомов углерода как фталимидного цикла в обла-
лей и их положения приведет к изменению физи-
сти 166-119 м. д., так и октильных групп (70-14 м. д.).
ко-химических свойств красителей, исследование
Нагревание смеси имида 3 и оксида цинка в
которых представляется актуальной задачей. В
избытке хинальдина при кипении в течение 2 ч с
этой связи, в настоящей работе осуществлен синтез
последующей обработкой соляной кислотой при-
(E,Z)-4,7-бис(октилокси)-3-(хинолин-2-илметилен)-
водит к образованию соединения 1, которое при
изоиндолин-1-она
1, комплекса бора на его
кипячении с BF3·Et2O в присутствии триэтилами-
основе - (Z)-2-(дифторборил)-4,7-бис(октилокси)-
на в толуоле образует комплекс 2 (схема 2).
3-(хинолин-2-илметилен)изоиндолин-1-она 2 - и
исследованы их физико-химические свойства.
Выход соединения 1 после выделения и хрома-
В качестве исходного соединения для синтеза
тографической очистки составил 75%. Оно пред-
ставляет собой вещество желтого цвета, хорошо
соединения 1 использовали 4,7-бис(октилокси)-
изоиндолин-1,3-дион 3. Он получен взаимодей-
растворимое в неполярных органических раство-
ствием синтезированного по известной методике
рителях. Комплекс 2 также очищали хроматогра-
[22] 3,6-бис(октилокси)фталонитрила с бутилатом
фированием, его выход достигает 65%. Он явля-
лития в бутаноле с последующим гидролизом в
ется веществом желто-оранжевого цвета, также
кислой среде в соответствии со схемой 1.
растворимыми в различных органических раство-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
4,7-БИС(ОКТИЛОКСИ)-3-(ХИНОЛИН-2-ИЛМЕТИЛЕН)-ИЗОИНДОЛИН-1-ОН
1869
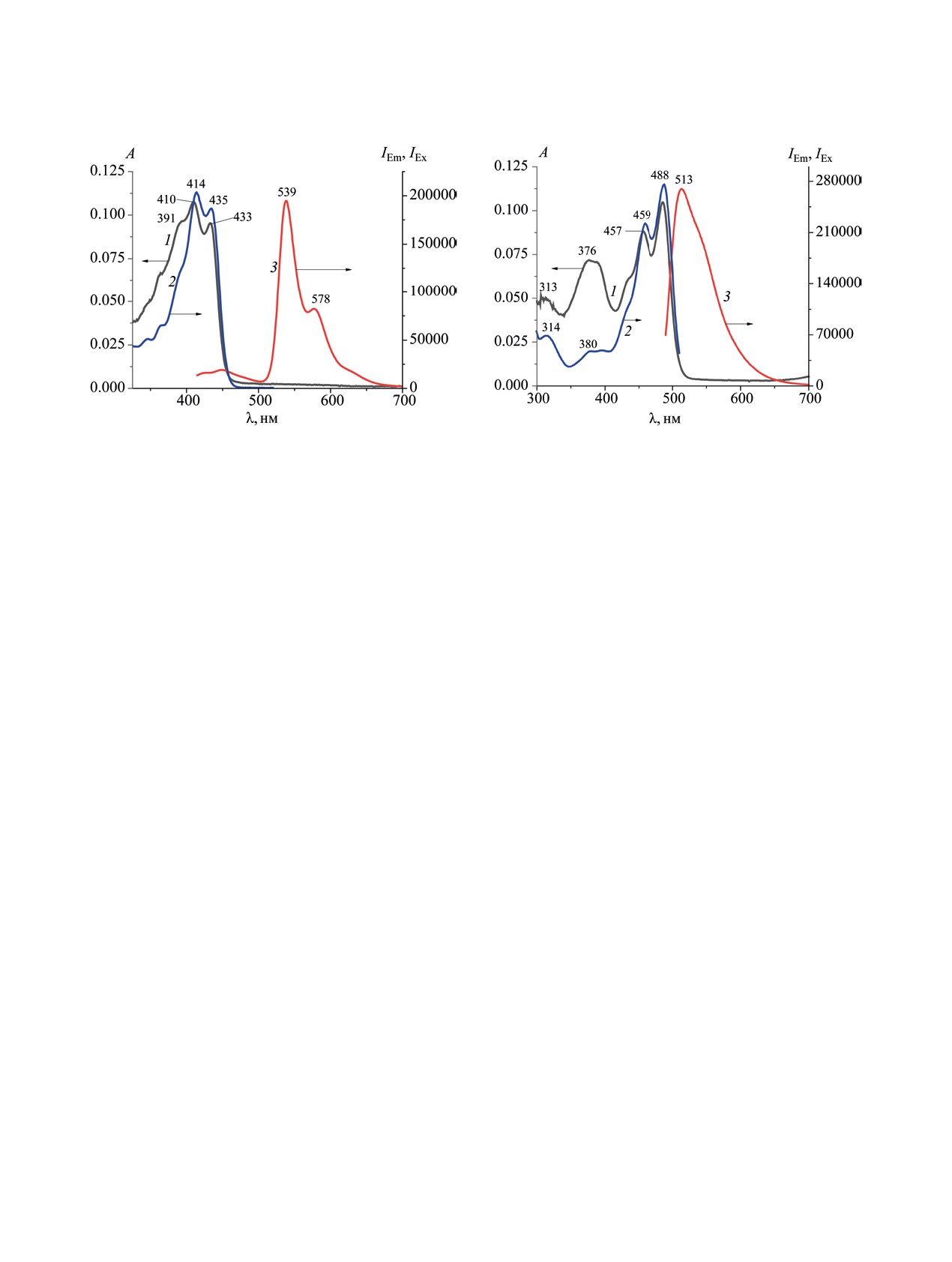
Рис. 1. Электронные спектры поглощения (1), возбуж-
Рис. 2. Электронные спектры поглощения (1), возбуж-
дения (2) и флуоресценции (λex 415 нм) (3) соединения
дения (2) и флуоресценции (λex 490 нм) (3) соединения
1 в хлороформе.
2 в хлороформе.
рителях, обладающим сильной флуоресценцией в
соединения 2 представляет собой слабо разрешен-
растворах.
ный триплет при 2.71 м. д. с КССВ 20 Гц. Спектры
Состав и строение соединений 1 и 2 подтвер-
ЯМР 13С также подтверждают строение соедине-
ждали данными элементного анализа, масс-спек-
ний 1 и 2.
трометрии MALDI-TOF и спектроскопии ЯМР. В
Нормализованные электронные спектры погло-
масс-спектре лиганда 1 основным является сигнал
щения, спектры возбуждения и спектры флуорес-
иона [M + Н]+, m/z 529.74, кроме него присутству-
ценции соединений 1 и 2 в хлороформе представ-
ет сигнал при 567.69, соответствующий аддукту
лены на рис. 1 и 2.
[M + K]+. В масс-спектре комплекса 2 обнаружены
Спектр поглощения соединения 1 (рис. 1, 1) ха-
сигналы ионов [M - F]+ и [M + Na]+ с m/z 559.37
рактеризуется полосами с максимумами при 433,
и 601.55 соответственно. В спектре ЯМР 1Н сое-
414 и 391 нм. Его спектр возбуждения (рис. 1, 2)
динения 1 в наиболее слабом поле обнаружива-
по характеру и положению полос близок к спектру
ется сигнал протона группы NH в виде синглета
поглощения. По сравнению со спектром погло-
при 11.53 м. д., сигналы протона в мезо-положе-
щения незамещенного 3-(хинолин-2-илметилен)-
нии в виде двух синглетов находятся при 6.93 и
изоиндолин-1-она [20] введение двух алкоксиль-
6.91 м. д. В более сильном поле присутствует ряд
ных заместителей приводит к батохромному сме-
мультиплетов, соответствующих резонансу прото-
щению максимумов полос поглощения в среднем
нов заместителей. В спектре ЯМР 1Н комплекса 2
на 32 нм. В спектре флуоресценции (λEx 415 нм)
сигнал протона группы NH отсутствует, а сигнал
(рис. 1, 3) наблюдается весьма значительный сток-
протона в мезо-положении сдвигается в сильное
сов сдвиг (129 нм), что связано с большим числом
поле до 6.55 м. д. и имеет вид синглета. Расщепле-
степеней свободы молекулы и значительными по-
ние сигнала протона в мезо-положении в спектре
терями энергии при внутренней конверсии.
соединения 1, как и расщепление на два дубле-
та сигнала протона в положении 4 хинолинового
Комплексообразование соединения 1 с бором
цикла, может свидетельствовать о существовании
приводит к существенному изменению его элек-
1 в виде E- и Z-изомеров, причем такая изомерия
тронно-оптических свойств, заключающемуся в
невозможна для комплекса 2. В целом, положение
батохромном сдвиге полос в электронном спектре
сигналов в спектрах ЯМР при комплексообразова-
поглощения (рис. 2, 1) и в спектре возбуждения
нии изменяется незначительно. Спектр ЯМР 11В
(рис. 2, 2) комплекса 2 на 45 - 53 нм. Спектр флу-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
1870
НАБАСОВ и др.
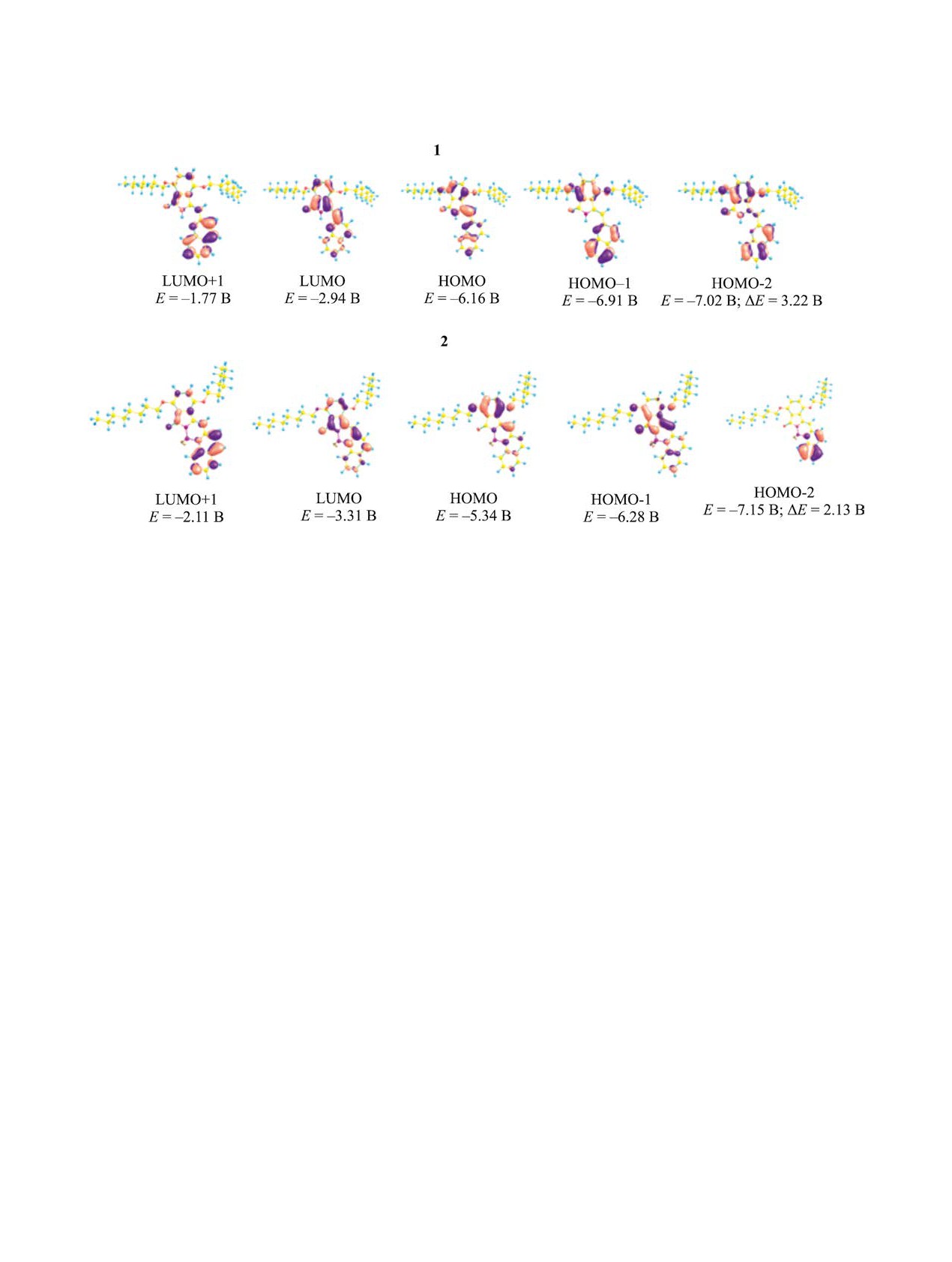
Рис. 3. Формы и энергии граничных орбиталей (эВ) соединений 1 и 2. ΔE = EВЗМО - EНВМО
оресценции комплекса (рис. 2, 3) характеризует-
(B3LYP/def2-TZVP) с учетом влияния растворите-
ся полосой с максимумом при 513 нм. Поскольку
ля (хлороформа) в модели поляризованного конти-
при комплексообразовании число степеней свобо-
нуума (PCM).
ды молекулы сокращается из-за невозможности
Оптимизированные геометрии соединений 1 и
E-Z-таутомерии, то стоксов сдвиг уменьшается и
2 характеризуются плоским строением хромофо-
составляет 25 нм. Относительные квантовые вы-
ров. Вид их граничных молекулярных орбиталей и
ходы флуоресценции в растворе хлороформа, рас-
их энергии представлены на рис. 3.
считанные по известному методу [23], с использо-
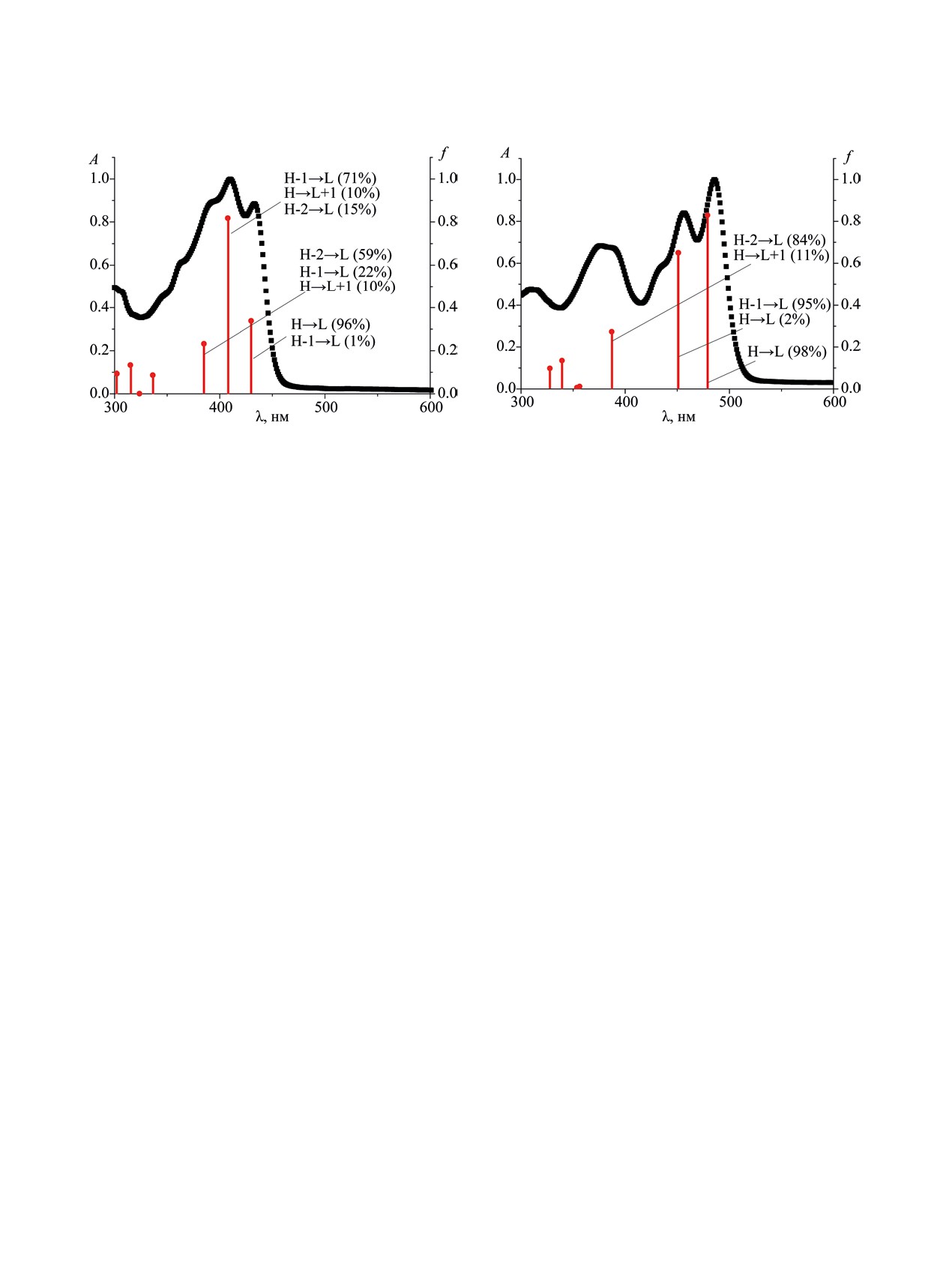
В рассчитанных электронных спектрах погло-
ванием сульфата хинина в качестве стандарта (ФF
щения соединений 1 и 2 (рис. 4, 5) присутствуют
0.60 в 0.05 М. H2SO4) [24], для соединений 1 и 2
несколько основных полос, обусловленных S0→Sn
составили 0.18 и 0.68 соответственно.
электронными переходами. Наиболее длинновол-
Для исследования влияния структурной моди-
новые полосы (переходы S0→S1) в обоих случа-
фикаций на спектральные свойства соединений
ях относятся, в основном, к электронным пере-
1 и 2 выполнена оптимизация геометрии их ос-
ходам HOMO→LUMO, полосы S0→S2 и S0→S3
новных состояний методом DFT с использовани-
обусловлены переходами HOMO-1→LUMO,
ем функционала B3LYP [25] и базисного набора
HOMO-2→LUMO и HOMO→ LUMO+1.
def2-TZVP [26] с полной оптимизацией геометри-
ческих параметров. Расчеты проводили при по-
Полученные результаты согласуются с экспе-
мощи программного комплекса Firefly 8.2.0 [27].
риментальными данными. Так, энергетический
Построение начальных геометрий, обработка и
зазор между HOMO и LUMO в соединении 1 со-
представление результатов выполнены с исполь-
ставляет 3.22 эВ, что на 1.09 эВ больше, чем в ком-
зованием программного комплекса Chemcraft [28].
плексе 2 (2.13 эВ). Это и определяет значительный
Значения энергий электронных переходов из ос-
батохромный сдвиг полос поглощения в спектре
новного в ближайшие возбужденные состояния и
комплекса 2 по сравнению с соединением 1. Как
силы осцилляторов вычислены методом TD-DFT
показано ранее, энергетическая щель HOMO-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
4,7-БИС(ОКТИЛОКСИ)-3-(ХИНОЛИН-2-ИЛМЕТИЛЕН)-ИЗОИНДОЛИН-1-ОН
1871
Рис. 4. Электронный спектр поглощения соединения
Рис. 5. Электронный спектр поглощения соединения
1 в хлороформе в сравнении с теоретическим. f - сила
2 в хлороформе в сравнении с теоретическим. f - сила
осциллятора, H - HOMO, L - LUMO.
осциллятора, H - HOMO, L - LUMO.
LUMO в незамещенном 2-дифторборил-3-(хино-
AXIMA Confidence (Shimadzu Corporation, Япо-
лин-2-илметилен)изоиндолин-1-оне составляет
ния). ИК спектры сняты на спектрофотометре
2.50 эВ [19]. Это объясняет значительное (32 нм)
Avatar 360 FT-IR (Thermo Fisher Scientific, США)
гипсохромное смещение максимумов полос в его
в области 400-4000 см-1 в тонких пленках на сте-
спектре поглощения по сравнению со спектром
кле KRS-5. Спектры ЯМР 1Н (500.17 МГц), 11С
комплекса 2.
(125.77 МГц) и 11В (160.47 МГц) записаны на при-
Таким образом, синтезирован новый лиганд -
боре Bruker Avance-500 (Bruker AXS Inc., США) в
(E,Z)-4,7-бис(октилокси)-3-(хинолин-2-илмети-
CDCl3. Для спектров ЯМР 11В применяли BF3∙Et2O
лен)изоиндолин-1-он, на его основе получен не-
как внешний стандарт. Электронные спектры по-
симметричный аналог BODIPY - (Z)-2-(дифторбо-
глощения измерены на спектрофотометре Helios
рил)-4,7-бис(октилокси)-3-(хинолин-2-илметилен)-
Zeta (Thermo Fisher Scientific, США). Спектры
изоиндолин-1-он. Лиганд обладает низким кванто-
флуоресценции записаны на спектрофлуориметре
вым выходом флуоресценции (0.18) и значитель-
Shimadzu RF-6000 (Shimadzu Corporation, Япония)
ным стоксовым сдвигом (129 нм). Комплекс не
в кварцевых прямоугольных кюветах с толщиной
способен к таутомерным превращениям, поэтому
поглощающего слоя 10 мм при 23°С. Для спек-
демонстрирует умеренный Стоксов сдвиг (25 нм)
тральных измерений использовали хлороформ
и высокий относительный квантовый выход флу-
квалификации ХЧ (Экос-1, Россия).
оресценции (0.68), что может быть востребовано
4,7-Бис(октилокси)изоиндолин-1,3-дион
при создании сенсоров для исследования биологи-
(3). К раствору 0.1 г (14 ммоль) лития в 30 мл бу-
ческих систем и устройств тонкопленочной элек-
тан-1-ола добавляли 1.0 г (2.6 ммоль) 3,6-бис(ок-
троники.
тилокси)фталонитрила. Смесь перемешивали 3 ч
при 90°С, после вносили в 100 мл 10%-ного рас-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
твора соляной кислоты, кипятили 1 ч и охлаждали.
Элементный анализ выполнен на приборе
Осадок отфильтровывали, промывали 250 мл воды
FlashEA 1112 CHNS-O Analyzer (Thermo Fisher
и сушили. Выход 1.0 г (95%), светло-желтый по-
Scientific, США). Масс-спектры (MALDI-TOF,
рошок, растворим в хлороформе, бензоле, ДМФА,
матрица - 2,5-дигидроксибензойная кислота) за-
ДМСО. Спектр ЯМР 1Н, δ, м. д.: 7.85 с (1Н), 7.18
регистрированы на приборе Shimadzu Biotech
с (2Н), 4.13 т (4Н, 3JНН 7.2 Гц), 1.88-1.82 м (4Н),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
1872
НАБАСОВ и др.
1.50-1.47 м (4Н), 1.33-1.27 м (16Н), 0.89 т (6Н,
Собирали основную (вторую) желто-оранжевую,
3JНН 7.0 Гц). Спектр ЯМР 13С, δС, м. д.: 166.30,
сильно флуоресцирующую зону. Вещество суши-
150.40, 121.73, 119.24, 69.99, 31.80, 29.71, 29.20,
ли на воздухе при 80°С в течение 6 ч. Выход 0.43
28.83, 25.80, 22.66, 14.11. Масс-спектр, m/z (Iотн,
г (65%), желто-оранжевый порошок, растворим в
%): 403.58 (100) [M]+. Найдено, %: C 71.65; H 9.31;
хлороформе, бензоле, ДМСО, ДМФА. Электрон-
N 3.35. C24H37NO4. Вычислено, %: C 71.43; H 9.24;
ный спектр поглощения, λmax, нм (lgε): 487 (4.85),
N 3.47. М 403.27.
457 (4.82), 376 (4.68). Спектр ЯМР 1Н, δ, м. д.:
(E,Z)-4,7-Бис(октилокси)-3-(хинолин-2-ил-
8.00-7.96 м (2Н), 7.78-7.63 м (2Н), 7.49 т (1Н, 3JНН
метилен)изоиндолин-1-он
(1).
Смесь
0.8 г
7.4 Гц), 7.16 с (2Н), 6.95 т (1Н, 3JНН 6.8 Гц), 6.55
(2.0 ммоль) имида 3, 5.0 мл (5.29 г, 37.0 ммоль)
с (1Н), 4.10 т (4Н, 3JНН 7.2 Гц), 1.87-1.81 м (4Н),
хинальдина и 0.25 г (3.1 ммоль) оксида цинка пе-
1.49-1.46 м (4Н), 1.33-1.28 м (16Н), 0.88 т (6Н,
ремешивали при кипении 2 ч, охлаждали, вылива-
3JНН 7.2 Гц). Спектр ЯМР 13С, δC, м. д.: 169.34,
ли в 150 мл 10%-ного раствора соляной кислоты
166.35, 153.12, 151.06, 150.36, 149.70, 147.41,
и выдерживали при перемешивании 1 ч. Осадок
141.17, 140.61, 136.50, 132.31, 128.49, 126.69,
отфильтровывали и промывали водой до рН 7.
122.81, 121.71, 119.20, 117.17, 106.18, 97.69, 69.95,
Остаток растворяли в хлороформе и хроматогра-
68.77, 31.80, 29.20, 28.81, 26.40, 25.79, 22.66, 14.12.
фировали на колонке, заполненной силикагелем 60
Спектр ЯМР 11В, δB, м. д.: 2.71 т (J 20.0 Гц). Масс-
(Merck), элюируя хлороформом. Собирали основ-
спектр, m/z (Iотн, %): 601.55 (15) [M + Na]+, 559.37
ную желтую зону. Вещество сушили на воздухе
(100) [M - F]+. Найдено, %: C 70.95; H 7.55; N 4.77.
при 80°С в течение 6 ч. Выход 0.79 г (75%), жел-
C34H43BF2N2O3. Вычислено, %: C 70.83; H 7.52; N
тый порошок, растворим в хлороформе, бензоле,
4.86. М 576.33.
ДМСО, ДМФА. Электронный спектр поглощения,
λmax, нм (lgε): 433 (4.41), 410 (4.52). Спектр ЯМР
ИНФОРМАЦИЯ ОБ АВТОРАХ
1Н, δ, м. д.: 11.53 с (1Н), 8.14 д (0.5Н, 3JНН 6.2 Гц),
8.07 д (0.5Н, 3JНН 6.0 Гц), 7.77-7.70 м (2Н), 7.50-
Набасов Артем Алексеевич, ORCID: https://
7.47 м (1Н), 7.32-7.30 м (1Н), 7.16 с (2Н), 7.03-6.98
orcid.org/0009-0006-2775-9289
м (1Н), 6.92 д (1Н, 3JНН 6.0 Гц), 4.13 т (4Н, 3JНН
Александрийский Виктор Вениаминович,
7.2 Гц), 1.95-1.84 м (4Н), 1.49-1.47 м (4Н), 1.33-
1.29 м (16Н), 0.90 т (6Н, 3JНН 7.2 Гц). Спектр ЯМР
Галанин Николай Евгеньевич, ORCID: https://
13С, δC, м. д.: 167.36, 166.22, 156.72, 150.96, 150.38,
orcid.org/0000-0001-6117-167X
149.36, 147.82, 138.63, 136.23, 129.92, 128.89,
127.43,
126.05,
123.36,
121.69,
119.23,
116.61,
Румянцева Таисия Андреевна, ORCID: https://
115.57, 106.15, 69.97, 68.74, 31.81, 29.21, 28.84,
orcid.org/0000-0002-4110-0572
26.38, 25.81, 22.67, 14.13. Масс-спектр, m/z (Iотн,
ФИНАНСОВАЯ ПОДДЕРЖКА
%): 567.69 (23) [M + K]+, 529.74 (100) [M + H]+.
Найдено, %: C 77.66; H 8.44; N 5.21. C34H44N2O3.
Работа выполнена в рамках государственного
Вычислено, %: C 77.24; H 8.39; N 5.30. М 528.34.
задания на выполнение научно-исследователь-
(Z)-2-(Дифторборил)-4,7-бис(октилокси)-3-
ской работы (тема № FZZW-2020-0010) с исполь-
(хинолин-2-илметилен)изоиндолин-1-он
(2).
зованием оборудования Центра коллективного
Раствор 0.6 г (1.1 ммоль) соединения 1, 1.0 мл
пользования Ивановского государственного хими-
(1.12 г, 8.0 ммоль) BF3∙Et2O и 3.0 мл (30.0 ммоль)
ко-технологического университета при финансо-
триэтиламина в 50 мл толуола кипятили 2 ч, за-
вой поддержке Министерства образования и науки
тем охлаждали, добавляли 50 мл хлороформа и
России (соглашение № 075-15-2021-671).
вносили в 250 мл воды. Органический слой отде-
ляли, многократно промывали водой, раствори-
КОНФЛИКТ ИНТЕРЕСОВ
тель отгоняли. Остаток растворяли в хлороформе
и хроматографировали на колонке, заполненной
Авторы заявляют об отсутствии конфликта
силикагелем 60 (Merck), элюируя хлороформом.
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
4,7-БИС(ОКТИЛОКСИ)-3-(ХИНОЛИН-2-ИЛМЕТИЛЕН)-ИЗОИНДОЛИН-1-ОН
1873
СПИСОК ЛИТЕРАТУРЫ
15.
Cao T., Gong D., Zheng L., Wang J., Qian J., Liu W.,
Cao Y., Iqbal K., Qin W., Iqbal A. // Anal. Chim. Acta.
1.
Ziessel R., Ulrich G., Harriman A. // New J. Chem.
2019. Vol. 1078. P. 168. doi 10.1016/j.aca.2019.06.033
2007. Vol. 31. N 4. P. 496. doi 10.1039/B617972J
16.
He H., Lo P.-C., Yeung S.-L., Fong W.-P., Ng D.K.P. //
2.
Loudet A., Burgess K. // Chem. Rev. 2007. Vol. 107.
Chem. Commun. 2011. Vol. 47. N 16. P. 4748. doi
N 11. P. 4891-4932. doi 10.1021/cr078381n
10.1039/C1CC10727E
3.
Schmitt A., Hinkeldey B., Wild M., Jung G. // J. Fluoresc.
17.
Gut A., Ciejka J., Makuszewski J., Majewska I., Brela M.,
2009. Vol. 19. N 4. P. 755-758. doi 10.1007/s10895-
Łapok Ł. // Spectrochim. Acta (A). 2022. Vol. 271.
008-0446-7
Article no. 120898. doi 10.1016/j.saa.2022.120898
4.
Молчанов Е.Е., Марфин Ю.С., Ксенофонтов А.А.,
18.
Duran-Sampedro G., Agarrabeitia A.R., Garcia-Moreno
Румянцев Е.В. // Изв. вузов. Сер. хим. и хим.
I., Gartzia-Rivero L., de la Moya S., Bañuelos J., López-
технол. 2019. Т. 62. № 12. С. 13. doi 10.6060/
Arbeloa Í., Ortiz M.J. // Chem. Commun. 2015, Vol. 51.
ivkkt.20196212.6017.
N 57. P. 11382. doi 10.1039/C5CC03408F
5.
Parhi A.K., Kung M.-P., Ploessl K., Kung H.F. //
Tetrahedron Lett. 2008. Vol. 49. N 21. P. 3395. doi
19.
Zhou Y., Xiao Y., Li D., Fu M., Qian X. // J. Org. Chem.
10.1016/j.tetlet.2008.03.130
2008. Vol. 73. N 4. P. 1571. doi 10.1021/jo702265x
6.
Wang H.-Q., Ye J.-T., Zhang Y., Zhao Y.-Y., Qiu Y.-Q. //
20.
Nabasov A.A., Koptyaev A.I., Usoltsev S.D.,
J. Mater. Chem. (C). 2019. Vol. 7. N 25. P. 7531. doi
Rumyantseva T.A., Galanin N.E. // Macroheterocycles.
10.1039/C9TC01750J
2022. Vol. 15. N 2. P. 128. doi 10.6060/mhc224262g
7.
Squeo B.M., Ganzer L., Virgili T., Pasini M. //
21.
Nabasov A.A., Rumyantseva T.A., Koptyaev A.I.,
Molecules. 2021. Vol. 26. N 1. Article no. 153. doi
Galanin N.E. // Dyes Pigm. 2023. Vol. 219. Article
10.3390/molecules26010153
no. 111523. doi 10.1016/j.dyepig.2023.111523
8.
Raveendran A.V., Sankeerthana P.A., Jayaraj A., Chinna
22.
Галанин Н.Е., Шапошников Г.П. // ЖОХ. 2012.
Ayya Swamy P. // Res. Chem. 2022. Vol. 4. Article no.
Т. 82. № 10. С. 1736; Galanin N.E., Shaposhnikov G.P. //
100297. doi 10.1016/j.rechem.2022.100297
Russ. J. Gen. Chem. 2012. Vol. 82. N 10. P. 1734. doi
9.
Malacarne M.C., Gariboldi M.B., Caruso E. // Int. J.
10.1134/S1070363212100179
Mol. Sci. 2022. Vol. 23. N 17. Article no. 10198. doi
23.
Brouwer A.M. // Pure Appl. Chem. 2011. Vol. 83. N 12.
10.3390/ijms231710198
P. 2213. doi 10.1351/PAC-REP-10-09-31
10.
Liu H., Lu H., Zhou Z., Shimizu S., Li Z., Kobayashi N.,
24.
Suzuki K., Kobayashi A., Kaneko S., Takehira K.,
Shen Z. // Chem. Commun. 2015. Vol. 51. N 9. P. 1713.
Yoshihara T., Ishida H., Shiina Y., Oishi S., Tobita S. //
doi 10.1039/C4CC06704E
Phys. Chem. Chem. Phys. 2009. Vol. 11. N 42. P. 9850.
11.
Wu Y., Lu H., Wang S., Li Z., Shen Z. // J. Mater.
doi 10.1039/B912178A
Chem. (C). 2015. Vol. 3. N 47. P. 12281. doi 10.1039/
25.
Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7. P. 5648.
c5tc03084f
doi 10.1063/1.464913
12.
Yu C., Fang X., Wu Q., Jiao L., Sun L., Li Z., So P.-K.,
26.
Rappoport D., Furche F. // J. Chem. Phys. 2010.
Wong W.-Y., Hao E. // Org. Lett. 2020. Vol. 22. N 12.
Vol.
133. N
13. Article no.
134105. doi
P. 4588. doi 10.1021/acs.orglett.0c00940
13.
Zhang X.F., Zhang G.Q., Zhu J. // J. Fluoresc. 2019.
10.1063/1.3484283
Vol. 29. N 1. P. 407. doi 10.1007/s10895-019-02349-5
27.
14.
Yue J., Wang N., Wang J., Tao Y., Wang H., Liu J.,
msu.su/gran/gamess/index.html
Zhang J., Jiao J., Zhao W. // Anal. Meth. 2021. Vol. 13.
28.
N 26. P. 2908. doi 10.1039/D1AY00740H
chemcraftprog.com
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
1874
НАБАСОВ и др.
4,7-(Bis(octyloxy)-3-(quinoline-2-ylmethylene)isoindoline-1-one
and Its Boronflouride Complex. Synthesis
and Spectral-Luminescent Properties
A. A. Nabasova,*, T. A. Rumyantsevaa, V. V. Aleksandriiskiia, and N. E. Galanina
a Ivanovo State University of Chemistry and Technology, Ivanovo, 153000 Russia
*e-mail: kolosaner@mail.ru
Received October 27, 2023; revised November 8, 2023; accepted November 12, 2023
4,7-Bis(octyloxy)isoindoline-1,3-dione was obtained by reacting 3,6-bis(octyloxy)phthalonitrile with sodium
butoxide in butanol, followed by treatment with hydrochloric acid. Its condensation with quinaldine in the pres-
ence of zinc oxide leads to the formation of (E,Z)-4,7-bis(octyloxy)-3-(quinolin-2-ylmethylene)isoindolin-1-one,
which was treated with BF3۰Et2O in the presence of triethylamine in toluene to give a new unsymmetrical
analogue of BODIPY - (Z)-2-(difluoroboryl)-4,7-bis(octyloxy)-3-(quinolin-2-ylmethylene)isoindolin-1-one.
The complex exhibits a Stokes shift of 25 nm and a high relative fluorescence quantum yield (0.68). To support
the experimental data, DFT and TD-DFT calculations were performed.
Keywords: BODIPY analogs, boron complexes, quinaldine, substituted phthalimide, spectral-luminescent
properties
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023