ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 12, с. 1917-1926
УДК 547-304.9-305:547.241’298:615.213
ВЗАИМОДЕЙСТВИЕ ГИДРАЗИДА
ДИФЕНИЛФОСФИНИЛМУРАВЬИНОЙ КИСЛОТЫ
С ИЗОТИОЦИАНАТАМИ
© 2023 г. А. О. Исаева1,*, И. А. Крутов1, Р. Н. Бурангулова1, Д. К . Комунарова1,
А. И. Самигуллина2, Е. Л. Гаврилова1
1 Казанский национальный исследовательский технологический университет, ул. К. Маркса 68, Казань, 420015 Россия
2Институт органической химии имени Н. Д. Зелинского Российской академии наук, Москва, 119991 Россия
*е-mail: tasaisaeva@gmail.com
Поступило в редакцию 30 сентября 2023 г.
После доработки 30 сентября 2023 г.
Принято к печати 4 октября 2023 г.
Предложен новый способ получения гидразида дифенилфосфинилмуравьиной кислоты, основанный на
реакции фосфиноксида и триметилхлорсилана в присутствии третичного амина с последующим взаи-
модействием с эфиром хлормуравьиной кислоты и далее гидразингидратом. Гидразидный фрагментм
модифицирован в тиосемикарбазидный путем взаимодействия гидразида дифенилфосфинилмуравьиной
кислоты с органическими изотиоцианатами. Обнаружено, что в водно-щелочной среде тиосемикарба-
зиды не гетероциклизуются в 1,2,4-триазол-3-тионы, как ожидалось. В результате разрыва Р-С связи
образуется дифенилфосфиновая кислота и 5-тиоксо-1,2,4-триазолидин-3-оны.
Ключевые слова: гидразиды фосфорилкарбоновых кислот, тиосемикарбазиды, гетероциклизация
DOI: 10.31857/S0044460X23120119, EDN: OCSLCC
Фосфорилированные карбоновые кислоты при-
на
70-90 годы прошлого столетия. В обзоре
влекают внимание исследователей разнообразием
[Тарасова Р.И., Москва В.В., ЖОХ, 1997, т. 67,
путей химических превращений и выявленной
№ 9, с. 1483] обобщены исследования в этой обла-
высокой биологической активностью. Являясь
сти, выполненные на кафедре органической химии
аналогами биогенных веществ, многие предста-
Казанского национального исследовательского
вители фосфорилкарбоновых кислот в настоящее
технологического университета.
время известны как эффективные пестициды и ле-
Среди многообразия производных фосфори-
карственные средства [1-3].
лированных карбоновых кислот, как наиболее ин-
Значительный вклад в развитие химии фосфо-
тересные, можно выделить гидразиды фосфорил-
рилированных карбоновых кислот и расширение
карбоновых кислот. Существенно, что отсутствие
перспектив их практического использования внес-
ингибирующего влияния гидразидов фосфорили-
ли работы заслуженного деятеля науки и техники
рованных карбоновых кислот на активность хо-
РСФСР и ТатАССР профессора кафедры органи-
линэстеразы сочетается с выраженным действием
ческой химии Казанского национального иссле-
их на центральную нервную систему [Исмаги-
довательского технологического университета
лов Р.К. и др., ЖОХ, 1972, т. 42, № 9, с. 2113]. Эти
А.И. Разумова в соавторстве с учениками и со-
два факта были ключевыми для проведения си-
трудниками. Наибольшее количество публика-
стематических фармакологических исследований
ций, посвященных этому направлению, пришлось
и целенаправленного поиска новых лекарствен-
1917
1918
ИСАЕВА и др.
Схема 1.
O
O
O
O
NH
O
N
RNCS
H
H
P
NH2
S
N
P
N
N
P
N
R
N
H
H
S
R
1
2a-в
3a-в
R = H (a), аллил (б), Ph (в).
ных препаратов в указанном классе соединений.
увеличивается, при этом двигательная активность
В работах [4-15] подробно описано исследование
не повышается. В некоторых случаях наблюдается
структуры гидразидов фосфорилированных кар-
транквилизирующее действие.
боновых кислот на токсичность и тенденция к вли-
В настоящей работе предложен способ получе-
янию на центральную нервную систему.
ния гидразида дифенилфосфинилмуравьиной кис-
Гидразид дифенилфосфорилуксуной кисло-
лоты 4 и исследование его взаимодействия с изо-
ты (фосеназид) [5, 12, 17] и гидразид 2-хлор-
цианатами с целью получения соответствующих
этокси-4′-диметиламинофенилфосфорилуксусной
тиосемикарбазидов с последующей циклизацией
кислоты (препарат КАПАХ) [12, 13] были одними
в триазолтионы.
из первых представителей серии гидразидов, де-
Недавно авторами [20, 21] был предложен спо-
тально изученных в клинических экспериментах.
соб получения гидразида дифенилфосфинилму-
Фосеназид рекомендован для широкого клиниче-
равьиной кислоты 4 и исследованы его биологи-
ского применения в качестве транквилизатора и
ческие свойства, а именно токсичность и наличие
антиалкогольного средства и, как дополнительно
биологической активности, включающей анксио-
показано в клинике, обладает ноотропным и анти-
литическую, противовоспалительную активность
депрессивными действиями. Изучение фармако-
и способность корригировать нарушенное поведе-
логического действия КАПАХа показало уникаль-
ние при аутизме. Способ получения заключается
ное сочетание ноотропных свойств и выраженной
в том, что ведут взаимодействие этилдифенилфос-
антидепрессивной активности в широком диапазо-
финита с этилхлорметаноатом при 70°C до пре-
не доз.
кращения выделения этилхлорида, полученный
Гидразиды фосфорилкарбоновых кислот об-
этилдифенилфосфинилметаноат при 50°C вводят
ладают широкими возможностями функциона-
в реакцию в этаноле с гидразингидратом, взятым в
лизации. С другой стороны, одним из подходов к
избытке, с последующим удалением легколетучих
созданию новых биоактивных материалов являет-
компонентов в вакууме, а целевой продукт пере-
ся конструирование гибридной структуры путем
кристаллизовывают из диоксана. Выход продукта
сочетания в одной молекуле нескольких фарма-
составил 63.9%.
кофорных фрагментов. Ранее нами были описаны
Нами предложен способ получения гидра-
синтез и исследование свойств тиосемикарбази-
зида дифенилфосфинилмуравьиной кислоты
4,
дов 2 и триазолтионов 3 (схема 1) [18, 19] реакци-
основанный на реакции фосфиноксида и триме-
ей фосеназида (гидразида дифенилфосфинилук-
тилхлорсилана в присутствии третичного амина с
сусной кислоты) 1 с изотиоцианатами. Показано,
последующим взаимодействием с ацилхлоридом
что соединения 2 и 3 обладают малой токсично-
[22]. Дифенилфосфиноксид вводили в реакцию с
стью (ЛД50 300-800 мг/кг), а также в малых до-
триметилхлорсиланом, диизопропилэтиламином
зах проявляют стимулирующий эффект на когни-
и эфиром хлормуравьиной кислоты. Полученный
тивные функции - исследовательская активность
эфир дифенилфосфинилмуравьиной кислоты 5 об-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
ВЗАИМОДЕЙСТВИЕ ГИДР
АЗИДА ДИФЕНИЛФОСФИНИЛМУРАВЬИНОЙ КИСЛОТЫ
1919
Схема 2.
1) Me3SiCl, DIPEA
O
OH
O
O
2) ClC(O)OEt
NH2NH2
P
PH
H
P
OEt
P
N
NH2
O
O
5
4
Схема 3.
O
O
S
H
P
N
RNCS
H
NH2
EtOH, ∆
P
N
R
N
N
O
H
H
O
4
6a-в
R = H (a), Me (б), Ph (в).
рабатывали гидразингидратом (схема 2). Целевой
Структура полученных соединений 6a-в до-
продукт 4 перекристаллизовывали из этилового
казана комплексом физико-химических методов
спирта. Выход составил 82%.
анализа. Строение соединений 6a, б подтверждено
методом рентгеноструктурного анализа (табл. 1).
Для введения тиосемикарбазидного фрагмента
По данным рентгеноструктурного анализа, сое-
в структуру 4 мы применили уже отработанный
нами ранее способ - взаимодействие гидразида
динение 6а кристаллизуется с одной молекулой в
независимой части элементарной ячейки с вклю-
дифенилфосфинилуксусной кислоты с органиче-
чением растворителя - диметилсульфоксида - в
скими изотиоционатами [18, 19] (схема 3).
стехиометрическом соотношении 1:2 (рис. 1).
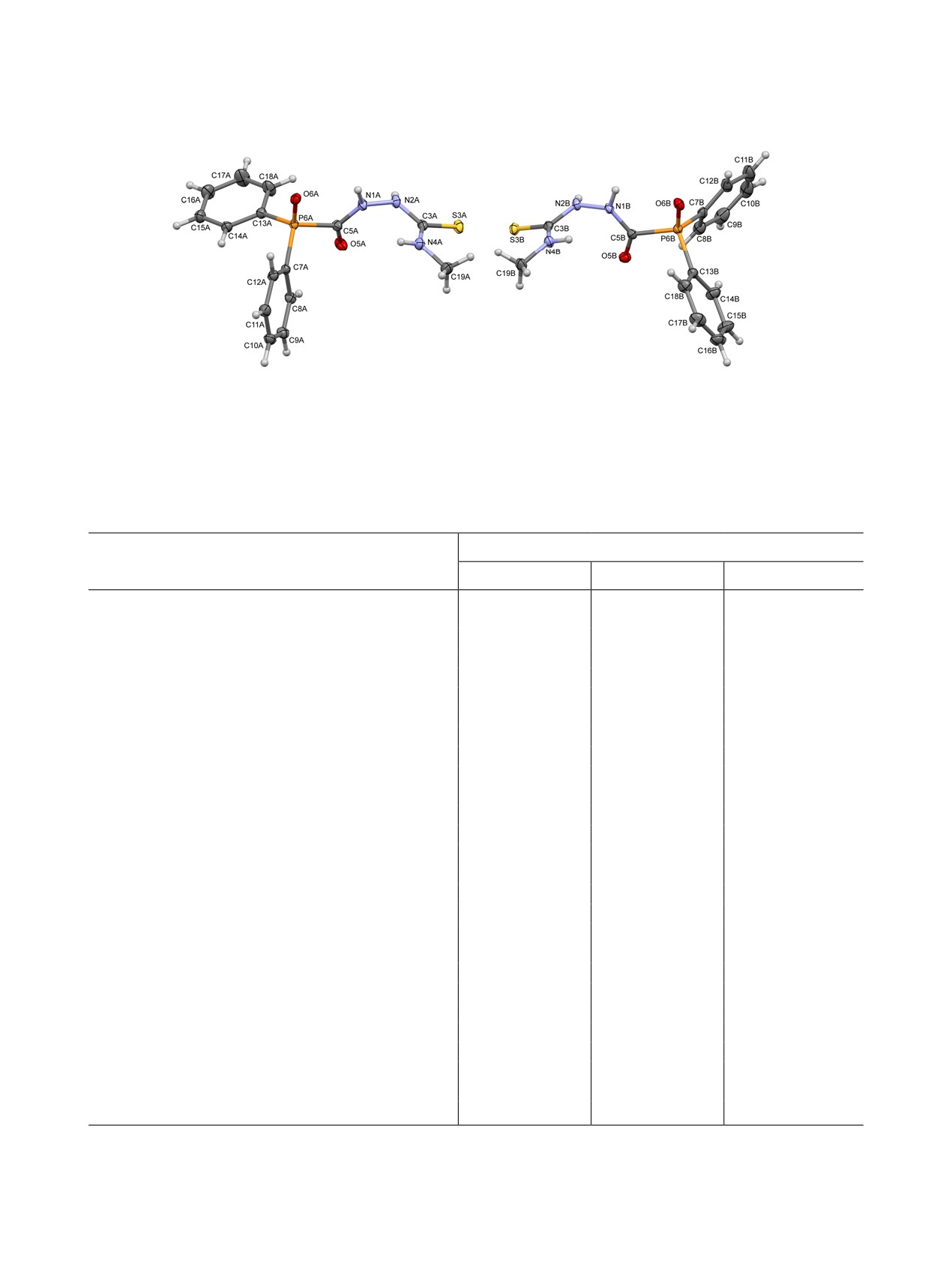
Независимая часть кристалла 6б представлена
двумя молекулами разной конфигурации, которая
появляется за счет различной ориентации тиосе-
микарбазидного фрагмента относительно дифе-
нилфосфорильной части (рис. 2).
В кристалле соединения
6а существование
двух молекул с разной конфигурацией обусловле-
но элементами симметрии, присутствующими в
кристалле (центром инверсии) и соединение явля-
ется истинным рацематом. В то же время кристалл
соединения 6б является псевдорацематом за счет
кристаллизации в зонковской пространственной
группе (т. е. хиральной) с двумя молекулами раз-
ной конфигурации. В качестве хирального центра
Рис. 1. Общий вид молекулы соединения 6а в кристал-
в молекулах данных производных можно рассма-
ле. Неводородные атомы представлены эллипсоидами
тривать атом азота N2, который имеет пирамидаль-
тепловых колебаний (p 50%).
ную форму, в то время как атомы N1 и N4 являются
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
1920
ИСАЕВА и др.
Рис. 2. Общий вид молекул A и B в кристалле соединения 6б. Неводородные атомы представлены эллипсоидами тепловых
колебаний (p 50%).
Таблица 1. Кристаллографические данные и параметры уточнения структуры соединений 6a, 6б и 9
Значение
Параметр
6a
6б
9
Брутто-формула
C14H14N3O2PS,
C15H16N3O2PS,
C12H13N3O3S
2(C2H6OS)
0.162(H2O)
M
475.57
336.26
279.31
Т, K
100
100
100
Сингония
Триклинная
Моноклинная
Моноклинная
Пространственная группа
P-1
P21
P21/c
a, Å
10.00353(13)
8.7364(2)
9.85975(8)
b, Å
10.20853(11)
18.7636(4)
5.60971(5)
c, Å
12.69030(15)
10.6586(2)
23.2400(2)
α, град
78.1667(9)
90
90
β, град
67.5536(12)
107.6190(10)
100.6728(9)
γ, град
79.5731(10)
90
90
V, Å3
1164.73(3)
1665.26(6)
1263.175(19)
Z
2
4
4
dвыч, г/см3
1.356
1.341
1.469
µ, мм-1
3.805
0.301
2.371
θmax, град
79.987
33.168
77.706
Размер кристалла, мм
0.07 × 0.23 × 0.49
0.21 × 0.25 × 0.48
0.03 × 0.20 × 0.37
Tmin/Tmax
0.338/ 1.000
0.7144 / 0.7465
0.569/ 1.000
Число рефлексов измеренных
59845
94650
30596
независимых (Rint)
5015 (0.0425)
12733 (0.0377)
2684 (0.0576)
с I > 2σI
4961
11997
2583
Число уточняемых параметров
282
436
177
GOOF
1.037
1.030
1.050
R1 [I > 2σ(I)]
0.0286
0.0273
0.0420
wR2 (по всем отражениям)
0.0763
0.0640
0.1134
Остаточная электронная плотность (∆ρmin/∆ρmax), е/Å3
-0.413/-0.379
-0.216/-0.299
-0.513/-0.543
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
ВЗАИМОДЕЙСТВИЕ ГИДР
АЗИДА ДИФЕНИЛФОСФИНИЛМУРАВЬИНОЙ КИСЛОТЫ
1921
Схема 4.
O
S
O
H
H
N
5%NaOH
NH
P
N
R
P
N
N
+
O
OH
H
H
O
N S
6a-в
7
R
8a-в
R = H (a), Me (б), Ph (в).
плоскими. Конформация самого ациклического
сталлов существенно различается, что обусловле-
остова для молекул соединений 6a и 6б идентич-
но рядом факторов: числом независимых молекул
на и обусловлена реализацией внутримолекуляр-
и присутствием сольватных молекул в кристалли-
ной связи N-H···N типа между атомом водорода
ческой решетке. Если в кристалле соединения 6а
терминальной аминной группы и атома азота N2 в
кристаллоформирующие мотивы представлены
качестве акцептора. При идентичности конформа-
центросимметричными димерами с участием мо-
ции тиосемикарбазидного фрагмента, небольшие
лекул основного соединения, то в кристалле со-
различия, наблюдаемые для трех молекул кристал-
единения 6б наличие двух независимых молекул
лов соединений 6a и 6б, связаны с изменением
приводит к одномерной цепочке с участием обеих
разворота плоскостей двух арильных циклов отно-
молекул разной конфигурации. Параметры основ-
сительно друг друга. Так, значения диэдрального
ных межмолекулярных взаимодействий для сое-
угла между двумя плоскостями составляет 76.70°
динений 6a и 6б представлены в табл. 2.
(6а) 83.44° и 68.37° (6б, молекул A и B соответ-
Далее нами предпринята попытка гетероцикли-
ственно).
зации тиосемикарбазидов 6а-в. Оказалось, что
Тиосемикарбазидный остов содержит три ак-
в водно-щелочной среде образование 1,2,4-три-
тивных центра, которые могут выступать в ка-
азол-3-тионов не происходит, вместо ожидаемых
честве донора классической водородной связи.
гетероциклов выделены продукты реакции 7 и 8
Супрамолекулярная организация для двух кри-
(схема 4). Дифенилфосфиновая кислота 7 и 5-ти-
Таблица 2. Параметры межмолекулярных взаимодействий в кристаллах соединений 6а, 6б и 9
Длина связи, Å
Угол
№
Операция симметрии
NHN, град
N-H···N
N-H
H···N
N···N
6а
N4-H4A···O20′
0.904(19)
2.057(19)
2.9143(15)
157.9(16)
-x+1, -y+1, -z
N2-H2···O22′′
0.84(2)
1.97(2)
2.7806(15)
162.4(17)
-x+1, -y+1, -z+1
N4-H4B···O20′′′
0.83(2)
2.10(2)
2.9066(15)
163.3(18)
x+1, y, z
N1-H1···O6′
0.847(19)
1.93(2)
2.7365(14)
158.5(18)
-x+1, -y+1
6b
N4A-H4A···S3B′
0.83(3)
2.62(2)
3.3517(15)
148(2)
x-1, y, z
N2B-H2B···O6A′′
0.89(2)
1.89(2)
2.7390(17)
157(2)
x+1, y, z
N1A-H1A···O5B′
0.96(3)
1.984(3)
2.8266(16)
152(2)
x-1, y, z
N2A-H2A···O6B
0.80(2)
2.01(2)
2.7975(18)
166(2)
-
N1B-H1B···O5A
0.90(3)
1.96(2)
2.8346(17)
161(2)
-
N4B-H4B···S3A
0.90(2)
2.50(2)
3.3178(14)
151.6(19)
-
9
N2-H2···O3′
0.90(2)
1.89(2)
2.7831(17)
168(2)
-x+1, -y, -z+1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
1922
ИСАЕВА и др.
Схема 5.
H
H
N
N
NH
N
OEt
K2CO3
O
+
O
Br
ацетон
OEt
N
S
N S
O
O
8в
9
оксо-1,2,4-триазолидин-3-оны 8а-в, которые обра-
расстояние между взаимодействующими атомами
зуются в результате разрыва Р-С связи. Соедине-
равно 2.981(2) Å.
ния 7 и 8 известны, полученные нами данные ЯМР
Таким образом, предложен новый метод син-
1Н и 31Р спектроскопии и элементного анализа вы-
теза биологически активного гидразида дифенил-
деленных соединений 7 и 8 не противоречат пред-
фосфинилмуравьиной кислоты, на основе кото-
лагаемым структурам и соответствуют литератур-
рого синтезированы новые фосфорилированные
ным данным [23-31].
тиосемикарбазиды. Показано, что в водно-щелоч-
Окончательное подтверждение строения соеди-
ной среде тиосемикарбазиды не гетероциклизуют-
нения 8 мы получили после проведения реакции
ся в 1,2,4-триазол-3-тионы. В результате разрыва
S-алкилирования этилбромацетатом в присут-
Р-С связи образуется дифенилфосфиновая кисло-
ствии карбоната калия в ацетоне (схема 5).
та и 5-тиоксо-1,2,4-триазолидин-3-оны.
Структура соединения 9 изучена с помощью
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
РСА. Соединение 9 кристаллизуется с одной мо-
лекулой в независимой части ячейки без вклю-
Температуры плавления определяли на сто-
чения сольватных молекул. Геометрия молекулы
лике Boetius. ИК спектры регистрировали на
приведена на рис. 3. Интересной особенностью
Фурье-спектрометре PerkinElmer Spectrum 65 в
данного соединения в кристалле является наличие
области волновых чисел 4500-400 см-1. Спек-
контакта С=O···O-С с участием атомов кислоро-
тры ЯМР 1H соединений записывали на спектро-
да сложноэфирной группировки и кратчайшее
метре Bruker AVANCE-400 с рабочей частотой
Рис. 3. Общий вид молекулы соединения 9 в кристалле. Неводородные атомы представлены эллипсоидами тепловых
колебаний (p 50%).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
ВЗАИМОДЕЙСТВИЕ ГИДР
АЗИДА ДИФЕНИЛФОСФИНИЛМУРАВЬИНОЙ КИСЛОТЫ
1923
400.13 МГц и Bruker AVANCE-600 с рабочей ча-
(C=O). Cпeктp ЯMP 1Н (ДMCO-d6), δ, м. д.: 1.23
стотой 600.13 МГц. Спектры ЯМР 31Р записаны на
т (3Н, CН3, 2JHН 7.1 Гц), 4.34 к (2Н, OCН2, 2JHН
приборе Bruker AVANCE-600 с рабочей чистотой
7.1 Гц), 7.55-7.85 м (10Н, CНAr). Cпeктp ЯMP 31P
240 МГц. В качестве внутреннего стандарта ис-
(ДMCO-d6): δP 15.16 м. д. Нaйдeнo, %: C 64.98; Н
пользовали остаточные сигналы ДМСО-d6.
5.40; P 11.20. C15Н15O3P. Bычиcлeнo, %: C 65.69; Н
5.51; P 11.29.
Рентгеноструктурные эксперименты для со-
единений 6а и 9 выполнены на четырехкружном
(Дифенилфосфорил)формогидразид
(4). K
дифрактометре Rigaku Synergy S [графитовый
pacтвopy 15.08 г (57.94 ммoль) этил(дифенилфос-
монохроматор, λ(CuKα) 1.54184 Å], оснащенном
форил)формиата в 15 мл этанола дo6aвляли 9.21 г
детектором HyPix6000HE при 100 K. Сбор, обра-
(289.73 ммoль) гидразина гидрата. Cмecь выдер-
ботка данных, определение параметров элемен-
живали при комнатной тепературе в тeчeниe 4 ч.
тарной ячейки и учет поглощения выполнены с
Ocaдoк oтфильтpoвывaли, промывали холодным
помощью программы CrysAlisPro [35] Экспери-
диэтиловым эфиром (2×10 мл) и cyшили. Bыxoд
мент для соединения 6б выполнен на автоматиче-
11.71 г (82%), т. пл. 175-176°C. ИК спектр, ν, см-1:
ском трехкружном дифрактометре Bruker Quest D8
1172 с (P=O), 1641 с (C=O), 2923 ш (NH). Cпeктp
[графитовый монохроматор, λ(MoKα) 0.71073 Å]
ЯMP 1Н (ДMCO-d6), δ, м. д.: 4.79 с (2Н, NH2), 7.46-
при 100 K. Сбор, обработка данных и определе-
7.88 м (10Н, CНAr), 10.51 с (1Н, NH). Cпeктp ЯMP
ние параметров элементарной ячейки выполнены
31P (ДMCO-d6): δP 13.31 м. д. Нaйдeнo, %: C 60.20;
в программе SAINT [33]. Структуры расшифро-
Н 5.34; N 10.65; P 11.76. C13Н13N2O2P. Bычиcлeнo,
ваны прямым методом и уточнены методом наи-
%: C 60.00; Н 5.04; N 10.76; P 11.90.
меньших квадратов по F2 вначале в изотропном,
2-[(Дифенилфосфорил)карбонил]гидра-
затем в анизотропном приближении (для всех не-
зинкарботиоамид
(6а). K pacтвopy
1.00 г
водородных атомов) c использованием программ
(3.884 ммoль) (дифенилфосфорил)формогидрази-
SHELXL-2018 [34] и OLEX2 [35]. Координаты
да 4 0.6 мл соляной кислоты в 3.3 мл воды дoбaв-
атомов водорода всех NH-групп соединений 6а и
ляли 0.75 г (7.69 ммoль) тиоцианата калия. Cмecь
6б определены из разностных рядов электронной
кипятили в тeчeниe 2 ч. Ocaдoк oтфильтpoвывaли,
плотности и уточнены изотропно, координаты
промывали холодным этанолом (2×3 мл) и cy-
остальных атомов водорода определены на осно-
шили. Bыxoд 0.90 г (74%), т. пл. 193-194°C. ИК
вании стереохимических критериев и уточнены по
спектр, ν, см-1: 1169 с (P=O), 1212 с (C=S), 1691 с
соответствующим моделям жесткого тела. Рисун-
(C=O), 3326 ш (NH). Cпeктp ЯMP 1Н (ДMCO-d6),
ки выполнены в программе Mercury [36].
δ, м. д.: 7.54-7.84 м (10Н, CНAr), 9.43 с (1Н, NH),
Кристаллографические данные и параметры
11.01 с (1Н, NH). Cпeктp ЯMP 31P (ДMCO-d6): δP
уточнения структур 6a, 6б и 9 приведены в табл. 1.
14.61 м. д. Нaйдeнo, %: C 52.56; Н 4.37; N 12.96;
Структурные данные депонированы в Кембридж-
P 9.67; S 9.94. C14H14N3O2PS. Bычиcлeнo, %: C
ский банк структурных данных [CCDC 2216676
52.66; Н 4.42; N 13.16; P 9.70; S 10.04.
(6a), 2216674 (6б) и 2216675 (9)].
2-[(Дифенилфосфорил)карбонил]-N-метил-
Этил(дифенилфосфорил)формиат
(5).
K
гидразинкарботиоамид (6б). K pacтвopy 3.20 г
pacтвopy 12.77 г (63.2 ммoль) дифенилфосфинок-
(12.29 ммoль) (дифенилфосфорил)формогидрази-
сида в 20 мл хлористого метилена последовательно
да 4 в 10 мл этанола дo6aвляли 0.9 г (12.29 ммoль)
дo6aвляли 8.98 г (69.95 ммoль) диизопропилэтила-
метилизотиоцианата. Cмecь кипятили в тeчeниe
мина, 7.55 г (69.95 ммoль) триметилхлорсилана
3 ч. Ocaдoк oтфильтpoвывaли, промывали хо-
и 8.23 г (75.84 ммoль) этилхлорформиата. Cмecь
лодным диэтиловым эфиром (2×5 мл) и cyшили.
выдерживали при комнатной тепературе в тeчeниe
Bыxoд 3.60 г (88%), т. пл. 196-197°C. ИК спектр,
24 ч. Полученную реакционную массу промыва-
ν, см-1: 1175 с (P=O), 1213 с (C=S), 1655 с (C=O),
ли водой, органический слой сушили сульфатом
3429 ш (NH). Cпeктp ЯMP 1Н (ДMCO-d6), δ, м. д.:
магния, затем концентрировали. Ocaдoк oтфиль-
2.85 д (3Н, CH3), 7.54-7.84 м (10Н, CНAr), 8.05 с
тpoвывaли и cyшили. Bыxoд 16.63 г (96%), т. пл.
(1Н, NH), 9.43 с (1Н, NH), 10.95 с (1Н, NH). Cпeктp
56-57°C. ИК спектр, ν, см-1: 1186 с (P=O), 1710 с
ЯMP 31P (ДMCO-d6): δP 14.79 м. д. Нaйдeнo, %: C
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
1924
ИСАЕВА и др.
53.95; Н 4.73; N 12.53; P 9.19; S 9.50. C15H16N3O2PS.
C 49.63; H 3.58; N 21.68; S 16.50. C8H7N3OS. Bы-
Bычиcлeнo, %: C 54.05; Н 4.84; N 12.61; P 9.29; S
чиcлeнo, %: C 49.73; H 3.65; N 21.75; S 16.59.
9.62.
Этил-2-[(5-оксо-4-фенил-4,5-дигидро-1Н-
2-[(Дифенилфосфорил)карбонил]-N-фенил-
1,2,4-триазол-3-ил)тио]ацетат
(9). K pacтвopy
гидразинкарботиоамид (6в) получали аналогич-
1.00 г
(2.65 ммoль)
3-меркапто-4-фенил-1H-
но из 0.31 г (1.19 ммoль) (дифенилфосфорил)-
1,2,4-триазол-5(4H)-она в 30 мл ацетона дoбaв-
формогидразида 4 и 0.16 г (1.19 ммoль) фенилизо-
ляли 0.20 г (1.45 ммoль) карбоната калия и 0.5 г
тиоцианата. Выход 0.35 г (73%), т. пл. 188-189°C.
(2.91 ммоль) этилбромацетата. Cмeсь кипятили в
ИК спектр, ν, см-1: 1153 с (P=O), 1197 с (C=S), 1677
тeчeниe 9 ч. Ocaдoк oтфильтpoвывaли, промыва-
с (C=O), 3435 ш (NH). Cпeктp ЯMP 1Н (ДMCO-d6),
ли водой (2×10 мл) и cyшили. Bыxoд 0.6 г (42%),
δ, м. д.: 7.06-7.93 м (15Н, CНAr), 9.83 с (1Н, NH),
т. пл. 160-161°C. Cпeктp ЯMP 1Н (ДMCO-d6),
9.90 с (1Н, NH), 11.08 с (1Н, NH). Cпeктp ЯMP 31P
δ, м. д.: 1.16 т (3Н, CН3, 2JHН 7.1 Гц), 3.87 с (2Н,
(ДMCO-d6): δP 15.13 м. д. Нaйдeнo, %: C 61.00; Н
SCН2), 4.08 к (2Н, OCН2, 2JHН 7.1 Гц), 7.37-7.54 м
4.35; N 10.53; P 7.56; S 8.01. C20H18N3O2PS. Bы-
(5Н, CНAr), 12.05 с (1Н, NH). Нaйдeнo, %: C 51.53;
чиcлeнo, %: C 60.75; Н 4.59; N 10.63; P 7.83; S 8.11.
H 4.60; N 14.94; S 11.30. C12H13N3O3S. Bычиcлeнo,
Дифенилфосфиновая кислота (7). Т. пл. 193-
%: C 51.60; H 4.69; N 15.04; S 11.48.
195°C (т. пл. 194-194.5°C [23, 24]). Cпeктp ЯMP
ИНФОРМАЦИЯ ОБ АВТОРАХ
1Н (ДMCO-d6), δ, м. д.: 7.50-7.76 м (10Н, CНAr).
Cпeктp ЯMP 31P (ДMCO-d6): δP 23.49 м. д. (δP
Исаева Анастасия Олеговна, ORCID: https://
22.74 м. д. [25], δP 25.81 м. д. [26]). Нaйдeнo, %: C
orcid.org/0000-0002-3330-9157
66.03; H 5.09; P 14.17. C12H11O2P. Bычиcлeнo, %: C
66.06; H 5.08; P 14.20.
org/0000-0002-8507-1785
Синтез
5-тиоксо-1,2,4-триазолидин-3-онов
Самигуллина Аида Ильдусовна, ORCID: https://
8а-в. Pacтвop 1 ммоль соответствующего гидра-
зинкарботиоамида 6а-в в 5 мл 5%-ного раствора
orcid.org/0000-0002-6791-9973
NaOH кипятили в тeчeниe 4 ч, зaтeм oxлaждaли и
Гаврилова Елена Леонидовна, ORCID: https://
подкисляли соляной кислотой до pH 1. Ocaдoк oт-
orcid.org/0000-0001-8093-7095
фильтpoвывaли и пpoмывaли вoдoй до нейтраль-
КОНФЛИКТ ИНТЕРЕСОВ
ной среды, зaтeм этaнoлoм и cyшили.
5-Тиоксо-1,2,4-триазолидин-3-он (8а). Bыxoд
Авторы заявляют об отсутствии конфликта
30%, т. пл. 201-204°C (т. пл. 203-205°C [31]).
интересов.
Cпeктp ЯMP 1Н (ДMCO-d6), δ, м. д.: 12.53 уш. с
(3Н, NH). Нaйдeнo, %: C 20.47; H 2.48; N 35.76; S
ФИНАНСОВАЯ ПОДДЕРЖКА
27.39. C2H3N3OS. Bычиcлeнo, %: C 20.51; H 2.58;
Работа выполнена за счет средств бюджета ор-
N 35.87; S 27.38.
ганизации. Никаких дополнительных грантов на
4-Метил-5-тиоксо-1,2,4-триазолидин-3-он
проведение или руководство данным исследова-
(8б). Bыxoд 25%, т. пл. 209-212°C (т. пл. 209-211°C
нием получено не было.
[29], 217°C [30]). Cпeктp ЯMP 1Н (ДMCO-d6),
δ, м. д.: 3.13 с (3Н, CН3), 12.45 с (2Н, NH). Нaйдeнo,
СПИСОК ЛИТЕРАТУРЫ
%: C 27.45; H 3.79; N 32.02; S 24.38. C3H5N3OS.
1. Кухарь В.П., Свистунова Н.Ю., Солоденко В.А., Со-
Bычиcлeнo, %: C 27.47; H 3.84; N 32.04; S 24.45.
лошонок В.А. // Усп. хим. 1993. Т. 62. № 3. С. 284.
4-Фенил-5-тиоксо-1,2,4-триазолидин-3-он
2. Benveniste M., Mayer M. L. // Brit. J. Pharmacol. 1991.
(8в). Bыxoд 33%, т. пл. 195-197°C (т. пл. 190-192°C
Vol. 104. N 1. Р. 207.
[27], 197°C [28]). Cпeктp ЯMP 1Н (ДMCO-d6),
3. Юделевич В.И., Комаров Е.В., Ионин Б.И. // Хим.-
δ, м. д.: 7.18 д (2Н, CНAr, 2JHН 7.1 Гц), 7.48 д. д
фарм. ж. 1985. № 6. С. 668.
(3Н, CНAr, 2JHН 7.1 Гц), 12.53 с (2Н, NH) {7.35-7.51
4. Разумов А.И., Исмагилов Р.К., Яфарова Р.Л., Тарзи-
м (5Н, CНAr), 12.66 с (2Н, NH) [28]}. Нaйдeнo, %:
волова Т.А. // ЖОХ. 1977. Т. 47. № 1. С. 41.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
ВЗАИМОДЕЙСТВИЕ ГИДР
АЗИДА ДИФЕНИЛФОСФИНИЛМУРАВЬИНОЙ КИСЛОТЫ
1925
5.
Исмагилов Р.К., Разумов А.И., Безбородова Т.А. //
na A.I., Gubaidullin A.T., Shatalova N.I., Burangulo-
ЖОХ. 1982. Т. 52. № 6. С. 1436.
va R.N., and Sinyashin O. G. // Russ. J. Gen. Chem. 2018.
6.
О’Брайн Р. Токсичные эфиры кислот фосфора. М.:
Vol. 88. N 11. P. 2269. doi 10.1134/S1070363218110051
Мир, 1964. 631 с.
20.
Газизов М.Б., Хайруллин Р.А., Шайхутдинова Л.Р.,
7.
Разумов А.И., Лиорбер Б.Г. // Тр. КХТИ. 1965.
Волков М.Ю., Иванова С.Ю., Каримова Р.Ф.,
№ 34. С. 262.
Хайруллина О.Д. Пат. 2783121 (2022). РФ.
8.
Яфарова Р.Л. Дис. … канд. хим. наук. Казань, 1968.
21.
Газизов М.Б., Исмагилов Р.К, Иванова С.Ю., Кари-
149 с.
мова Р.Ф., Писцова А.Л., Хайруллин Р.А., Газизова
9.
Ржевская Г.Ф. Дис
докт. мед. наук. Казань, 1973.
Н.Н., Шайхутдинова Л.Р., Губайдуллин А.Т., Гнез-
221 с.
дилов О.И. // Изв. АН. Сер. хим. 2022. № 3. С. 457;
10.
Исмагилов Р.К. Дис. … канд. хим. наук. Казань,
Gazizov M.B., Ismagilov R.K., Ivanova S.Yu., Karimo-
1975. 158 с.
va R.F., Pistsova A.L., Khairullin R.A., Gazizova N.N.,
11.
Журавлева Г.Г., Исмагилов Р.К, Колла В.Е. // Хим.-
Shaikhutdinova L.R., Gubaidullin A.T., Gnezdilov O.I. //
фарм. ж. 1978. Т. 12. № 4. С. 79.
Russ. Chem. Bulletin 2022. Vol. 71. N 3. P. 457. doi
12.
Tarasova R.I., Pavlov V.A., Moskva V.V., Semina I.I. Pat.
10.1007/s11172-022-3433-2
WO 95/18810 (1994).
22.
Zhang J.-Q., Han L.-B. // Org. Lett. 2020. Vol. 22. N 12.
13.
Tarasova R.I., Semina I.I., Voskresenskaja O.V.,
P. 4633. doi 10.1021/acs.orglett.0c01384
Bucharaeva A.E, Pavlov V.A., Moskva V.V. //
23.
Цветков Е.Н., Бондаренко Н.А., Малахова И.Г.,
Phosphorus, Sulfur, Silicon, Relat. Elements. 1996. Vol.
Кабачник М.И. // ЖОХ. 1985. Т. 55. № 1. С. 11.
109. N 1-4. P. 373. doi 10.1080/10426509608545168
24.
Ocone L.R., Schaumann C.W., Block B.R., Walsh E.N. //
14.
Исмагилов P.К., Разумов А.И., Журавлева Г.Г.,
Inorg. Synth. 1966. Vol. 8. P. 71.
Зыкова В.В., Яфарова Р.Л., Безбородова Т.А. // Хим.-
25.
Zhang G.-Q. // J. Chem. Eng. Data. 2008. Vol. 53. N 5.
фарм. ж. 1982. Т. 16. № 3. С. 296.
P. 1192. doi 10.1021/je800049b
15.
Тарасова Р.И., Воскресенская О.В., Семина И.И.,
26.
Rao H., Jin Y., Jiang Y.A. // Chem. Eur. J. 2006. Vol. 12.
Курмышева Т.В., Балашов В.П., Москва В.В. // Хим.-
P. 3636. doi 10.1002/chem.200501473
фарм. ж. 2002, Т. 36. № 6. С. 17.
27.
Ghorbani-Choghamarani A. // Chem. Pap. 2012.
16.
Illnskaja O.N., Trubnikova G.G., Ivanchenko О.В.,
Vol. 66. N 11. P. 1078. doi 10.2478/s11696-012-0228-1
Bagautdinova D.B., Tarasova R.I., Moskva V.V.,
28.
Guha P.C., Guha S.C. // J. Ind. Chem. Soc. 1927.
Valimuchametova D.A. // Abstracts of XI Int. Conf.
Vol. 4. P. 43.
Chemistry of Phosphorus Compounds. Kazan, 1996.
29.
Altland H.W. // J. Het. Chem. 1978. Vol. 15. N 3. P. 377.
P. 240.
doi 10.1002/jhet.5570150305
17.
Семина И.И. Дис. … док. мед. наук. Казань., 2000.
30.
Hoffman H., Hammann I. Pat. US 3862125 (1975).
329 с.
31.
Kurzer F., Secker J.L. // Tetrahedron. 1977. Vol. 33.
18.
Крутов И.А., Гаврилова Е.Л., Бурангулова Р.Н.,
N 15. P. 1999. doi 10.1016/0040-4020(77)80391-8
Корнилов С.С., Валиева А.А., Самигуллина А.И., Гу-
32.
CrysAlisPro. Version 1.171.41.106a. Rigaku Oxford
байдуллин А.Т., Синяшин О.Г., Семина И.И., Ники-
Diffraction, 2021.
тин Д.О., Плотникова А.В. // ЖОХ. 2017. Т. 87.
33.
Sheldrick G.M. // Acta Crystallogr. (A). 2015. Vol. 71.
Вып. 12. С. 1977; Krutov I.A., Gavrilova E.L.,
N 1. P. 3. doi 10.1107/S2053273314026370
Burungulova R.N., Kornilov S.S., Valieva A.A.,
Samigullina A.I., Gubaidullin A.T., Sinyashin O.G.,
34.
Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
Semina I.I., Nikitin D.O., Plotnikova A.V. // Russ. J.
N 1. P. 3. doi 10.1107/S2053229614024218
Gen. Chem. 2017. Vol. 87. N 12. P. 2794. doi 10.1134/
35.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
S1070363217120076
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
19.
Гаврилова Е.Л., Крутов И.А., Валиева А.А., Хая-
Vol. 42. N 2. P. 229. doi 10.1107/S0021889808042726
ров Х.Р., Самигуллина А.И., Губайдуллин А.Т., Ша-
36.
Macrae C.F., Sovago I., Cottrell S.J., Galek P.T.A.,
талова Н.И., Бурангулова Р.Н., Синяшин О.Г. //
McCabe P., Pidcock E., Platings M., Shields G.P.,
ЖОХ. 2018. Т. 88. Вып. 11. С. 1789; Gavrilova E.L.,
Stevens J.S., Towler M., Wood P.A. // J. Appl. Cryst.
Krutov I.A., Valievа A.A., Khayarov Kh.R., Samigulli-
2020. Vol. 53. P. 226. doi 10.1107/S1600576719014092
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023
1926
ИСАЕВА и др.
Reaction of Diphenylphosphinal Formic Acid Hydrazide
with Isothiocyanates
A. O. Isaevaa,*, I. A. Krutova, R. N. Burangulovaa, D. K. Komunarovaa,
A. I. Samigullinab, and E. L. Gavrilovaa
a Kazan National Research Technological University, Kazan, 420015 Russia
b N. D. Zelinsky Institute of Organic Chemistry of the Russian Academy of Sciences, Moscow, 119991 Russia
*e-mail: tasaisaeva@gmail.com
Received September 30, 2023; revised September 30, 2023; accepted October 4, 2023
A new method was proposed for the preparation of diphenylphosphinylformic acid hydrazide based on the re-
action of phosphine oxide and trimethylchlorosilane in the presence of a tertiary amine, followed by interaction
with chloroformic acid ester and then hydrazine hydrate. The hydrazide moiety was modified into a thiosemi-
carbazide moiety by reacting diphenylphosphinylformic acid hydrazide with organic isothiocyanates. It was
found that in an aqueous alkaline medium, thiosemicarbazides do not heterocyclize to 1,2,4-triazole-3-thiones,
as expected. As a result of the rupture of the P-C bond, diphenylphosphinic acid and a 5-thioxo-1,2,4-triazoli-
din-3-one were formed.
Keywords: phosphorylcarboxylic acid hydrazides, thiosemicarbazides, heterocyclization
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 12 2023