ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 3, с. 374-378
УДК 547.743.1
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ
ТЕТРАГИДРОПИРИМИДИНОНОВ
ВЗАИМОДЕЙСТВИЕМ [1-(3,3-ДИЭТОКСИПРОПИЛ)-
УРЕИДО]МЕТАНСУЛЬФОНАТОВ НАТРИЯ
С С-НУКЛЕОФИЛАМИ
© 2023 г. А. В. Смолобочкин1,*, Л. Ж. Яхшиликова2, Т. С. Ризбаева1,
А. С. Газизов1, А. Р. Бурилов1, М. А. Пудовик1
1 Институт органической и физической химии имени А. Е. Арбузова, Федеральный исследовательский центр
«Казанский научный центр Российской академии наук», ул. Академика Арбузова 8, Казань, 420088 Россия
2 Казанский национальный исследовательский технологический университет, Казань, 420015 Россия
*e-mail: smolobochkin@iopc.ru
Поступило в редакцию 17 января 2023 г.
После доработки 1 марта 2023 г.
Принято к печати 2 марта 2023 г.
Реакцией (1-(3,3-диэтоксипропил)уреидо)метансульфонатов натрия с С-нуклеофилами (4-хлоррезорцин,
бензо[d][1,3]диоксол-5-ол, 2,4-дигидроксибензойная кислота, 4-гидрокси-6-метил-2H-пиран-2-он) в
хлороформе в присутствии трифторуксусной кислоты синтезированы новые замещенные тетрагидро-
пиримидиноны.
Ключевые слова: ацетали, тетрагидропиримидинон, 1-(3,3-диэтоксипропил)мочевина, С-нуклеофилы
DOI: 10.31857/S0044460X23030058, EDN: OJWZFU
Циклические мочевины привлекают присталь-
функционализации готовых циклических предше-
ное внимание химиков-синтетиков поскольку
ственников [7-10]. Необходимость предваритель-
представители этого класса гетероциклических
ного синтеза исходной циклической мочевины
соединений проявляют разнообразную биологиче-
увеличивает количество стадий, что неизбежно
скую активность [1]. Особый интерес в последние
приводит к снижению общего выхода целевых со-
годы вызывают производные циклической моче-
единений. Второй подход, напротив, основывается
вины - тетрагидропиримидин-2(1H)-оны, которые
на замыкании ациклических предшественников.
известны своей фармакологической активностью.
При этом циклизации подвергаются производные
Тетрагидропиримидиноны
преимущественно
1,3-диаминопропана [11, 12], либо функционали-
оказывают ингибирующее действие на различ-
зированные мочевины [13-15]. К преимуществам
ные ферменты, такие как ВИЧ-протеаза [2, 3], ди-
этого подхода можно отнести отсутствие трудо-
гидрооротаза [4], топоизомераза I [5], TNF-α-
емкого синтеза исходных циклических соедине-
превращающий фермент [6].
ний. Следует отметить, что упомянутым методам
В литературе предложены два подхода к синте-
присущ общий недостаток - это сложность введе-
зу тетрагидропиримидинонов исходя из структу-
ния заместителей в тетрагидропиримидиноновый
ры исходных соединений. Первый базируется на
фрагмент. С учетом этого неудивительно, что пои-
374
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ ТЕТР
АГИДРОПИРИМИДИНОНОВ
375
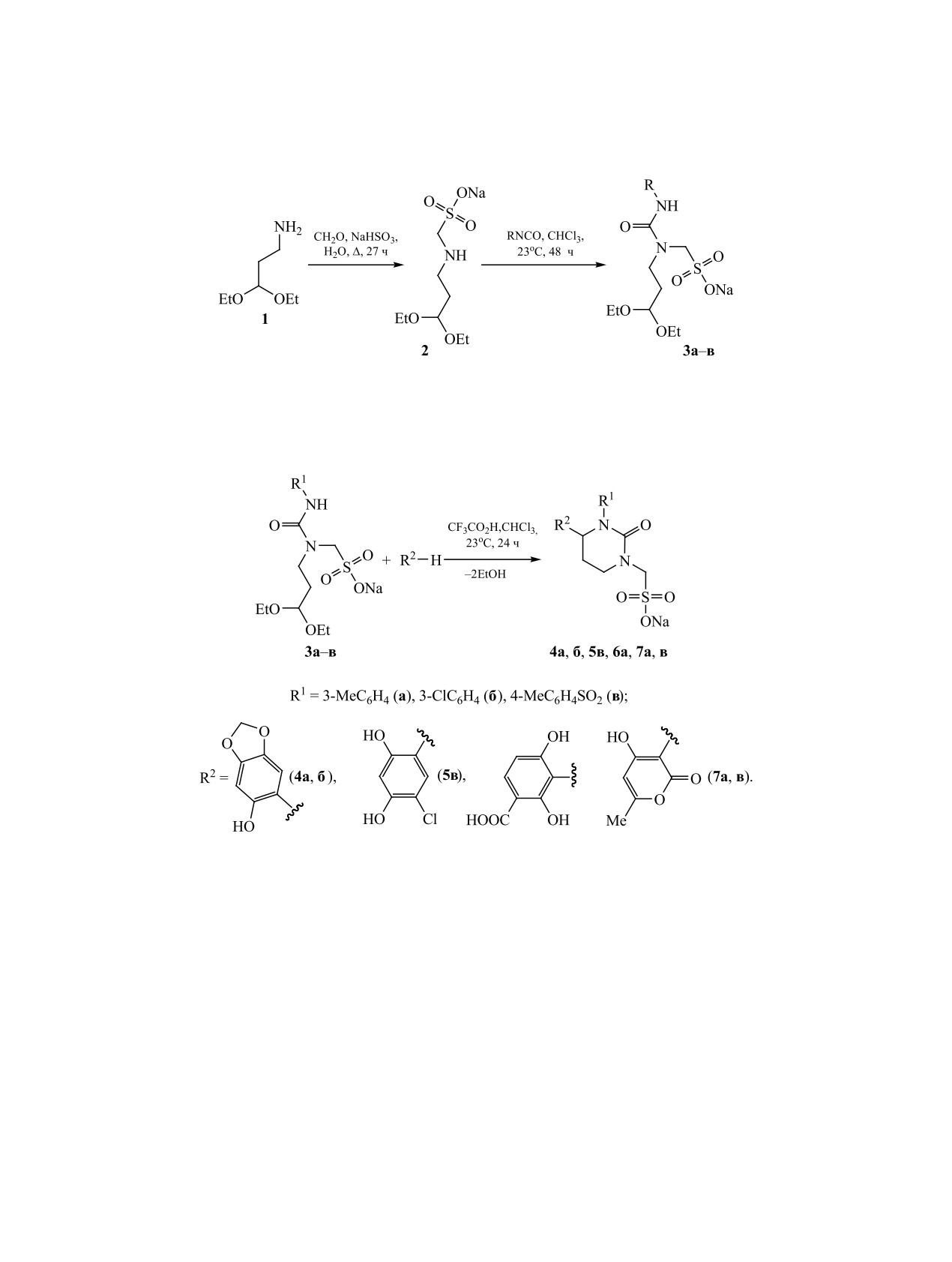
Схема 1.
R = 3-MeC6H4 (а), 3-Cl C6H4 (б), 4-Me C6H4SO2 (в).
Схема 2.
(6а),
ску новых путей синтеза производных тетрагидро-
мальдегидом и гидросульфитом натрия в воде был
пиримидинона уделяется большое внимание.
получен
[(3,3-диэтоксипропил)амино]метансуль-
фонат натрия 2, реакция которого с изоцианатами
Ранее нами был предложен метод синтеза 1,6-ди-
замещенных тетрагидропиримидин-2(1H)-онов
(м-толилизоцианатом, м-хлорфенилизоцианатом,
на основе кислотно-катализируемой реакции раз-
п-толилсульфонилизоцианатом) позволила синте-
личных фенолов с производными 1-(3,3-диэтокси-
зировать
[1-(3,3-диэтоксипропил)уреидо]метан-
пропил)мочевины [16]. Для установления границ
сульфонаты натрия 3а-в (схема 1).
применимости предлагаемого подхода представ-
Взаимодействие синтезированных мочевин 3 с
лялось важным выявить влияние природы заме-
фенолами (бензо[d][1,3]диоксол-5-олом, 4-хлор-
стителя у атома азота и характер нуклеофила на
резорцином, 2,4-дигидроксибензойной кислотой)
синтетический результат реакции.
осуществляли при эквимольном соотношении
С этой целью по известной методике [17] взаи-
реагентов в хлороформе в присутствии трифто-
модействием 3,3-диэтоксипропан-1-амина 1 с фор-
руксусной кислоты при комнатной температуре.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023
376
СМОЛОБОЧКИН и др.
В результате этой реакции были получены новые
CH2), 3.49-3.58 м (2H, CH2), 4.10 с (2H, CH2), 4.43-
производные тетрагидропиримидин-2(1H)-она 4а,
4.58 м (1H, CH), 7.03-7.17 м (4H, ArH). Найдено,
б, 5в, 6а (схема 2). Гетероциклический аналог фе-
%: C 48.73; H 6.59; N 6.89; S 8.25. C16H25N2NaO6S.
нола - 4-гидрокси-6-метил-2H-пиран-2-он, струк-
Вычислено, %: C 48.47; H 6.36; N 7.07; S, 8.09.
турный фрагмент которого является составной ча-
[3-(3-Хлорфенил)-1-(3,3-диэтоксипропил)-
стью антибиотика миксопиронина [18-20], - также
мочевино]метансульфонат натрия (3б). Выход
реагирует с ацеталями 3а, в с образованием ранее
0.39 г (75%), т. пл. >250°C. ИК спектр ν, см-1: 1179,
неизвестных соединений 7а, в.
1640, 2933, 2977. Спектр ЯМР 1Н (ДМСО-d6), δ,
Таким образом, кислотно-катализируемая реак-
м. д.: 1.07-1.16 м (6H, CH3), 1.21-1.29 м (2H, CH2),
ция [1-(3,3-диэтоксипропил)уреидо]метансульфо-
3.33-3.39 м (2H, CH2), 3.40-3.48 м (2H, CH2), 3.50-
натов натрия с ароматическими и гетероцикличе-
3.59 м (2H, CH2), 4.11 с (2H, CH2), 4.48-4.59 м (1H,
ским нуклеофилами позволяет в мягких условиях
CH), 7.18-7.39 м (4H, ArH). Найдено, %: C 43.47; H
получать новые замещенные производные тетра-
5.49; Cl 8.77; N 6.59; S 7.87. C15H22ClN2NaO6S. Вы-
гидропиримидин-2(1H)-она. Преимуществом дан-
числено, %: C 43.22; H 5.32; Cl 8.50; N 6.72; S 7.69.
ного метода являются мягкие условия реакции,
[1-(3,3-Диэтоксипропил)-3-тозилуреидо]-
использование коммерчески доступных реагентов
метансульфонат натрия (3в). Выход 0.47 г (83%),
и катализатора.
т. пл. 158-160°C. ИК спектр ν, см-1: 1188, 1645,
2935, 2975, 3379. Спектр ЯМР 1Н (ДМСО-d6), δ,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
м. д.: 1.13-1.22 м (6H, CH3), 1.83-2.05 м (2H, CH2),
Спектры ЯМР 1Н записаны на спектрометре
2.42 с (3H, CH3), 3.47-3.67 м (4H, CH2), 3.70-3.78
Bruker MSL 400 (400 МГц) относительно сигналов
м (2H, CH2), 4.39 с (2H, CH2), 4.34-4.45 м (1H,
остаточных протонов дейтерированного раствори-
CH), 7.38 д (2H, ArH, 3JHH 7.9 Гц), 7.72 д (2H, ArH,
теля. ИК спектры зарегистрированы на спектроме-
3JHH 8.0 Гц). Найдено, %: C 41.95; H 5.67; N 5.90; S
тре Bruker Tensor 27 в таблетках KBr. Элементный
13.78. C16H25N2NaO8S2. Вычислено, %: C 41.73; H
анализ выполнен на приборе Carlo Erba EA 1108.
5.47; N 6.08; S 13.93.
Температуры плавления определены в стеклянных
Общая методика синтеза тетрагидропири-
капиллярах на приборе Stuart SMP 10.
мидинонов 4а, б, 5в, 6а, 7а, в. К смеси 1.3 ммоль
Общая методика получения ацеталей 3а-в.
ацеталя
3 в
20 мл хлороформа добавляли
К смеси 1.2 мл 37%-ного раствора формальдегида
1.3 ммоль нуклеофила и 2 мл трифторуксусной
добавляли 1.3 г (1.24 ммоль) гидросульфита на-
кислоты. Реакционную смесь перемешивали 24 ч
трия и 20 мл воды. Реакционную смесь кипятили
при комнатной температуре, растворитель удаля-
7 ч, затем добавляли 1.8 мл (1.24 ммоль) 3,3-ди-
ли при пониженном давлении. Остаток промывали
этоксипропан-1-амина 1 и дополнительно кипятили
10 мл ацетона, полученный белый порошок высу-
20 ч, после чего растворитель удаляли при пони-
шивали при пониженном давлении.
женном давлении. Полученный амин 2 вводили в
[4-(6-Гидроксибензо[d][1,3]диоксол-5-ил)-
реакцию с 1.24 ммоль изоцианата в 20 мл хлоро-
2-оксо-3-(м-толил)тетрагидропиримидин-
форма. Реакционную смесь перемешивали при ком-
1(2H)-ил]метансульфонат натрия (4а). Выход
натной температуре 48 ч, после чего растворитель
0.38 г (67%), т. пл. >250°C. ИК спектр ν, см-1:
удаляли при пониженном давлении. Полученные
1153, 1630, 2929, 3014, 3436. Спектр ЯМР 1Н (ДМ-
мочевины 3 промывали 40 мл этилацетата. Про-
СО-d6), δ, м. д.: 2.22 с (3H, CH3), 2.29-2.35 м (2H,
дукты реакции представляли собой белые порошки.
CH2), 3.46-3.55 м (2H, CH2), 3.90 д (1H, СH2, 2JHH
[1-(3,3-Диэтоксипропил)-3-(м-толил)уреидо]-
13.6 Гц), 4.49 д (1H, СH2, 2JHH 13.5 Гц), 5.15-5.23 м
метансульфонат натрия (3а). Выход 0.42 г (86%),
(1H, CH), 5.85-5.90 м (2H, CH2), 6.38 с (1Н, ArH),
т. пл. >250°C. ИК спектр ν, см-1: 1188, 1638, 2935,
6.92 с (1Н, ArH), 7.00-7.14 м (4H, ArH), 8.31 с (1H,
2975, 3475. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
ОH). Найдено, %: C 51.68; H 4.47; N 6.41; S 7.09.
1.06-1.14 м (6H, CH3), 1.19-1.27 м (2H, CH2), 2.25 с
C19H19N2NaO7S. Вычислено, %: C 51.58; H 4.33; N
(3H, CH3), 3.24-3.32 м (2H, CH2), 3.39-3.48 м (2H,
6.33; S 7.25.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ ТЕТР
АГИДРОПИРИМИДИНОНОВ
377
[3-(3-Хлорфенил)-4-(6-гидроксибензо[d]-
СH2, 2JHH 13.3 Гц), 5.06-5.12 м (1H, CH), 5.89 с
[1,3]диоксол-5-ил)-2-оксотетрагидропирими-
(1H, CH), 6.86-6.99 м (2H, ArH), 7.02 с (1H, ArH),
дин-1(2H)-ил]метансульфонат натрия
(4б).
7.05-7.11 м (1H, ArH). Найдено, %: C 50.40; H 4.58;
Выход 0.24 г (40%), т. пл. 247-249°C. ИК спектр
N 6.67; S 7.37. C18H19N2NaO7S. Вычислено, %: C
ν, см-1: 1177, 1629, 2895, 3079, 3422. Спектр ЯМР
50.23; H 4.45; N 6.51; S 7.45.
1Н (ДМСО-d6), δ, м. д.: 1.84-1.95 м (1H, CH2),
[4-(4-Гидрокси-6-метил-2-оксо-2H-пиран-
2.26-2.39 м (1H, CH2), 3.80-3.88 м (2H, CH2), 3.95
3-ил)-2-оксо-3-тозилтетрагидропиримидин-
д (1H, СH2, 2JHH 13.3 Гц), 4.51 д (1H, СH2, 2JHH
1(2H)-ил]метансульфонат натрия (7в). Выход
13.4 Гц), 5.22-5.27 м (1H, CH), 5.84-5.89 м (2H,
0.49 г (76%), т. пл. 70-72°C. ИК спектр ν, см-1:
CH2), 6.39 с (1Н, ArH), 6.86 с (1Н, ArH), 7.10-7.16
1175, 1682, 2533, 2678, 3088, 3436. Спектр ЯМР 1Н
м (3H, ArH), 7.27-7.30 м (1H, ArH), 9.52 с (1H, ОH).
(ДМСО-d6), δ, м. д.: 2.12 с (3H, CH3), 2.36-2.40 м
Найдено, %: C 46.87; H 3.70; Cl 7.78; N 5.95; S 6.99.
(2H, CH2), 2.38 с (3H, CH3), 3.67-3.76 м (2H, CH2),
C18H16ClN2NaO7S. Вычислено, %: C 46.71; H 3.48;
3.82 д (1H, СH2, 2JHH 13.4 Гц), 4.15 д (1H, СH2, 2JHH
Cl 7.66; N 6.05; S 6.93.
13.3 Гц), 5.90-5.96 м (1H, CH), 5.98 с (1H, CH),
[4-(5-Хлор-2,4-дигидроксифенил)-2-оксо-
7.44 д (2H, ArH, 3JHH 8.3 Гц), 7.85 д (2H, ArH, 3JHH
3-тозилтетрагидропиримидин-1(2H)-ил]метан-
8.2 Гц). Найдено, %: C 43.82; H 4.12; N 5.69; S
сульфонат натрия (5в). Выход 0.26 г (39%), т. пл.
12.88. C18H19N2NaO9S2. Вычислено, %: C 43.72; H
165-166°C. ИК спектр ν, см-1: 1179, 1668, 2886,
3.87; N 5.67; S 12.97.
3090, 3396. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
1.89-1.99 м (2H, CH2), 2.08 с (3H, CH3), 3.54-3.60 м
ИНФОРМАЦИЯ ОБ АВТОРАХ
(1H, CH2), 3.64-3.70 м (1H, CH2), 3.81 д (1H, СH2,
Смолобочкин Андрей Владимирович, ORCID:
2JHH 13.5 Гц), 4.15 д (1H, СH2, 2JHH 13.5 Гц), 5.90-
5.96 м (1H, CH), 6.80 с (1Н, ArH), 7.34 д (2H, ArH,
Газизов Альмир Сабирович, ORCID: https://
3JHH 8.1 Гц), 7.39 с (1Н, ArH), 7.84 д (2H, ArH, 3JHH
orcid.org/0000-0001-9899-9606
8.2 Гц). Найдено, %: C 42.34; H 3.47; Cl 7.07; N
5.59; S, 12.72. C18H18ClN2NaO8S2. Вычислено, %:
Бурилов Александр Романович, ORCID: https://
C 42.15; H 3.54; Cl 6.91; N 5.46; S 12.50.
orcid.org/0000-0003-2938-7352
[4-(3-Карбокси-2,6-дигидроксифенил)-2-
Пудовик Михаил Аркадьевич, ORCID: https://
оксо-3-(м-толил)тетрагидропиримидин-1(2H)-
orcid.org/0000-0002-1557-7967
ил]метансульфонат натрия (6а). Выход 0.32 г
Ризбаева Танзиля Салиховна, ORCID: https://
(53%), т. пл. 140-141°C. ИК спектр ν, см-1: 1206,
orcid.org/0000-0003-2326-516X
1684, 2954, 3432. Спектр ЯМР 1Н (ДМСО-d6),
Яхшиликова Лола Журабаевна, ORCID: https://
δ, м. д.: 2.16 с (3H, CH3), 2.30-2.33 м (2H, CH2),
orcid.org/0000-0002-3206-0134
3.62-3.68 м (2H, CH2), 3.79 д
(1H, СH2, 2JHH
13.4 Гц), 4.55 д (1H, СH2, 2JHH 13.4 Гц), 5.41-5.47 м
БЛАГОДАРНОСТЬ
(1H, CH), 6.81 д (1H, ArH, 3JHH 8.7 Гц), 7.03-7.12 м
Авторы выражают благодарность Спектро-ана-
(4Н, ArH), 7.44 д (1H, ArH, 3JHH 8.7 Гц). Найдено,
%: C 49.56; H 4.37; N 6.19; S 7.16. C19H19N2NaO8S.
литическому центру Федерального исследователь-
Вычислено, %: C 49.78; H 4.18; N 6.11; S 6.99.
ского центра «Казанский научный центр РАН» за
техническую поддержку проведенных исследований.
[4-(4-Гидрокси-6-метил-2-оксо-2H-пиран-3-
ил)-2-оксо-3-(м-толил)тетрагидропиримидин-
ФИНАНСОВАЯ ПОДДЕРЖКА
1(2H)-ил]метансульфонат натрия (7а). Выход
0.26 г (47%), т. пл. 146-148°C. ИК спектр ν, см-1:
Работа выполнена при финансовой поддерж-
1164, 1682, 2658, 3038, 3434. Спектр ЯМР 1Н (ДМ-
ке Президента Российской Федерации в рамках
СО-d6), δ, м. д.: 2.05 с (3H, CH3), 2.21 с (3H, CH3),
государственной поддержки молодых россий-
2.08-2.12 м (1H, CH2), 2.25-2.29 м (1H, CH2), 3.43-
ских ученых - кандидатов наук (гранта № МК-
3.53 м (1H, CH2), 4.08-4.15 м (2H, CH2), 3.50 д (1H,
1944.2022.1.3).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023
378
СМОЛОБОЧКИН и др.
КОНФЛИКТ ИНТЕРЕСОВ
10. Смолобочкин А.В., Газизов А.С., Бурилов А.Р.,
Пудовик М.А., Синяшин О.Г. // Усп. хим. 2019. Т. 88.
А.Р. Бурилов является членом редколлегии
С. 1104; Smolobochkin A.V., Gazizov A.S., Burilov A.R.,
Журнала общей химии. Остальные авторы заявля-
Pudovik M.A., Sinyashin O.G. // Russ. Chem. Rev. 2019.
Vol. 88. P. 1104. doi 10.1070/RCR4891
ют об отсутствии конфликта интересов.
11. Primo A., Aguado E., Garcia H. // ChemCatChem.
2013. Vol. 5. P. 1020. doi 10.1002/cctc.201200329
СПИСОК ЛИТЕРАТУРЫ
12. Humphries P.S., Bersot R., Kincaid J., Mabery E.,
1.
Смолобочкин А.В., Газизов А.С., Бурилов А.Р.,
McCluskie K., Park T., Renner T., Riegler E., Steinfeld T.,
Пудовик М.А., Синяшин О.Г. // Усп. хим. 2021.
Turtle E.D., Wei Z.-L., Willis E. // Bioorg. Med.
Т. 90. С. 395; Smolobochkin A.V., Gazizov A.S.,
Chem. Lett. 2018. Vol. 28. P. 293. doi 10.1016/j.
Burilov A.R., Pudovik M.A., Sinyashin O.G. // Russ.
bmcl.2017.12.051
Chem. Rev. 2021. Vol. 90. P. 395. doi 10.1070/RCR4988
13. Taily I.M., Saha D., Banerjee P. // Eur. J. Org. Chem.
2.
De Lucca G.V., Liang J., De Lucca I. // J. Med. Chem.
2019. P. 7804. doi 10.1002/ejoc.201901400
1999. Vol. 42. P. 135. doi 10.1021/jm9803626
14. He Z., Zhou Q., Wu L., Chen Y. // Adv. Synth. Catal.
3.
Katritzky A.R., Oliferenko A., Lomaka A., Karelson M.
2010. Vol. 352. P. 1904. doi 10.1002/adsc.201000291
// Bioorg. Med. Chem. Lett. 2002. Vol. 12. P. 3453. doi
15. Wu T., Cheng J., Chen P., Liu G. // Chem. Commun.
10.1016/S0960-894X(02)00741-2
2013. Vol. 49. P. 8707. doi 10.1039/c3cc44711a
4.
Adams J.L., Meek T.D., Mong S.M., Johnson R.K.,
16. Smolobochkin A. V., Gazizov A.S., Voronina J.K.,
Metcalf B.W. // J. Med. Chem. 1988. Vol. 31. P. 1355.
Strelnik A.G., Rizbayeva T.S., Burilov A.R.,
doi 10.1021/jm00402a018
Pudovik M.A. // ChemistrySelect. 2019. Vol. 4. P. 11038.
5.
Zhu L., Cheng P., Lei N., Yao J., Sheng C., Zhuang C.,
doi 10.1002/slct.201902754
Guo W., Liu W., Zhang Y., Dong G., Wang S., Miao Z.,
17. Taylor H.M., Hauser C.R. // Org. Synth. 1963. Vol. 43.
Zhang W. // Arch. Pharm. 2011. Vol. 344. P. 726. doi
P. 25. doi 10.15227/orgsyn.043.0025
10.1002/ardp.201000402
18. Molodtsov V., Fleming P.R., Eyermann C.J.,
6.
Das Gupta S., Murumkar P.R., Giridhar R., Yadav M.R. //
Ferguson A.D., Foulk M.A., McKinney D.C.,
Bioorg. Med. Chem. 2009. Vol. 17. P. 3604. doi
Masse C.E., Buurman E.T., Murakami K.S. // J.
10.1016/j.bmc.2009.04.003
Med. Chem. 2015. Vol. 58. P. 3156. doi 10.1021/acs.
7.
Yoshimitsu T., Arano Y., Nagaoka H. // J. Am. Chem.
jmedchem.5b00050
Soc. 2005. Vol. 127. P. 11610. doi 10.1021/ja053855q
19. Cook L., Ternai B., Ghosh P. // J. Med. Chem. 1987.
8.
Hori M., Sakakura A., Ishihara K. // J. Am. Chem. Soc.
Vol. 30. P. 1017. doi 10.1021/jm00389a010
2014. Vol. 136. P. 13198. doi 10.1021/ja508441t
20. Fang Z., Liao P.-C., Yang Y.-L., Yang F.-L., Chen Y.-L.,
9.
Guyonnet M., Baudoin O. // Org. Lett. 2012. Vol. 14.
Lam Y., Hua K.-F., Wu S.-H. // J. Med. Chem. 2010.
P. 398. doi 10.1021/ol2031763
Vol. 53. P. 7967. doi 10.1021/jm100619x
Synthesis of Novel Tetrahydropyrimidines via the Reaction
of Sodium [1-(3,3-Diethoxypropyl)ureido]methansulfonates
with C-Nucleophiles
A. V. Smolobochkina,*, L. J. Yakhshilikovab, T. S. Rizbayevaa, A. S. Gazizova,
A. R. Burilova, and M. A. Pudovika
a Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center “Kazan Scientific Center of the Russian
Academy of Sciences”, Kazan, 420088 Russia
b Kazan National Research Technological University, Kazan, 420015 Russia
*e-mail: smolobochkin@iopc.ru
Received January 17, 2023; revised March 1, 2023; accepted March 2, 2023
A series of new substituted tetrahydropyrimidines was obtained by the reaction of sodium [1-(3,3-diethoxypropyl)-
ureido]methansulfonates with various C-nucleophiles (4-chlororesorcinol, sesamol, 2,4-dihydroxybenzoic acid,
4-hydroxy-6-methyl-2H-pyran-2-one) in chloroform in the presence of trifluoroacetic acid.
Keywords: acetals, tetrahydropyrimidin-2(1H)-one, 1-(3,3-diethoxypropyl)urea, C-nucleophiles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023