ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 3, с. 417-424
УДК 547.815:543.422.3:535.37
СИНТЕЗ, СПЕКТРАЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ
И ИОНОХРОМНЫЕ СВОЙСТВА РОДАМИНА
В, СОДЕРЖАЩЕГО ТЕРМИНАЛЬНЫЙ
(4-ГИДРОКСИБЕНЗИЛ)-
ТРИФЕНИЛФОСФОНИЙХЛОРИДНЫЙ
ЗАМЕСТИТЕЛЬ
© 2023 г. Л. Д. Попов1, Е. Н. Шепеленко2, В. А. Подшибякин3, Т. М. Валова4,
О. В. Венидиктова4, А. О. Айт4, А. Д. Дубоносов2,*
1 Южный федеральный университет, Ростов-на-Дону, 344090 Россия
2 Федеральный исследовательский центр Южный научный центр Российской академии наук,
пр. Чехова 41, Ростов-на-Дону, 344006 Россия
3 Научно-исследовательский институт физической и органической химии Южного федерального университета,
Ростов-на-Дону, 344090 Россия
4 Федеральный научно-исследовательский центр «Кристаллография и фотоника» Российской академии наук,
Москва, 119333 Россия
*e-mail: aled@ipoc.sfedu.ru
Поступило в редакцию 3 ноября 2022 г.
После доработки 21 декабря 2022 г.
Принято к печати 30 декабря 2022 г.
Cинтезировано производное родамина B, содержащее терминальный (4-гидроксибензил)трифенилфос-
фонийхлоридный заместитель. Его строение установлено при помощи ИК, ЯМР 1H и 13С спектроскопии.
Изучены спектрально-люминесцентные свойства и комплексообразование полученного соединения в
растворах с катионами Co2+, Cu2+, Ni2+ и Zn2+. Эти ионы вызывают контрастный ионохромный naked-eye
эффект с изменением бесцветной окраски раствора на красно-малиновую, связанной с изомеризацией
спиролактамной формы родамина в открытую форму. Процесс сопровождается появлением флуоресцен-
ции в области 560-600 нм. Особо интенсивной эмиссией характеризуется комплекс с катионом цинка(II),
что придает полученному родамину свойства высокочувствительного и эффективного хемосенсора на
ионы Zn2+.
Ключевые слова: родамин, производные родамина B, ионохромный эффект (naked-eye эффект),
органические хемосенсоры
DOI: 10.31857/S0044460X23030095, EDN: OSQXWJ
Создание органических хемосенсоров для
между рецепторной частью сенсора и аналитом
детектирования неорганических катионов или
и преобразованию этого процесса в соответству-
анионов составляет активно развивающееся на-
ющие оптические или электрохимические сигна-
правление органической, биологической и анали-
лы. Особенно привлекательны оптические методы
тической химии [1-5]. Органический хемосенсор
определения ионов (абсорбция, флуоресценция),
представляет собой молекулярную систему, ко-
поскольку зачастую процесс детектирования
торая способна к селективному взаимодействию
может быть различим невооруженным глазом
417
418
ПОПОВ и др.
Схема 1.
OH
OH
OH
CH2O
P(Ph)3
CHO
CHO
CHO
HCl
MeC6H
5
Cl-
CH2Cl
CH2PPh3
1
2
O
NH2
COOH
NH2
H2N
N
EtOH, ∆, 12 ч
Et2N
O
NEt2
Et2N
O
NEt2
3
Cl-
OH
HO
CHO
O
N
Cl-
N
3
PPh
CH2PPh3
Cl-
i-PrOH
Et2N
O
NEt2
4
[6-11]. Современные хромогенные и флуороген-
ное родамина B, содержащее терминальный (4-гид-
ные сенсоры обладают высокой селективностью
роксибензил)трифенилфосфонийхлоридный за-
и чувствительностью [12-24]. В качестве основы
меститель (схема 1), исследованы его спектраль-
для получения ионохромных и флуоресцентных
но-люминесцентные и ионохромные свойства по
сенсоров такого типа часто используются произ-
отношению к катионам Сo2+, Сu2+, Ni2+ и Zn2+.
водные дибензопирана (родамины B и 6G, флуо-
Строение полученного соединения установле-
ресцеин) [25-28]. Их спиролактамные изомерные
но при помощи данных ИК, ЯМР 1Н и 13C спек-
формы как правило слабо окрашены и не флуорес-
троскопии. В ИК спектре соединения 4 проявля-
цируют. В присутствии катионов металлов может
ются полосы валентных колебаний карбонильной
происходить раскрытие спирокольца, приводящее
группы родамина при 1690 см-1 и группы OH в
к окрашиванию вследствие формирования новых
области 2960 см-1. В спектре ЯМР 1Н соединения
максимумов поглощения, а также к появлению ин-
4 наблюдаются сигналы протонов родаминового
тенсивной длинноволновой эмиссии [29-33].
ядра и синглетные сигналы протонов групп СH и
С целью создания новых флуоресцентных хро-
ОH при 7.89 и 13.00 м. д. соответственно. Сигнал
могенных хемосенсоров было получено производ-
группы CH2, связанной с трифенилфосфониевым
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023
СИНТЕЗ, СПЕКТР
АЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ И ИОНОХРОМНЫЕ СВОЙСТВА
419
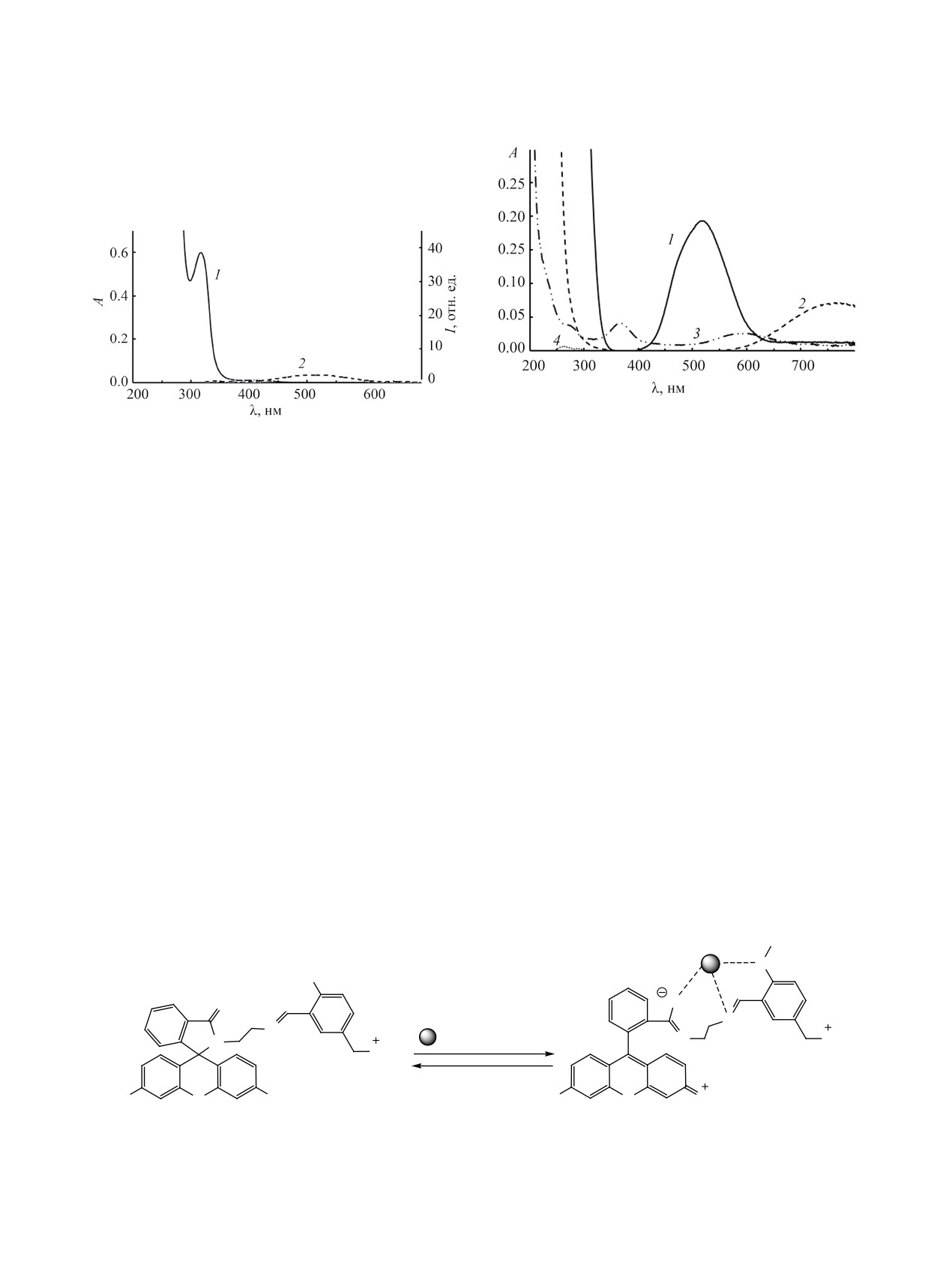
Рис. 2. Спектры поглощения растворов солей
Сo(NO3)2·6H2O (1), Сu(ClO4)2·6H2O (2), Ni(ClO4)2·6H2O
Рис. 1. Спектры поглощения (1) и флуоресценции (2)
(3) и Zn(ClO4)2 (4) в ацетонитриле (c 4×10-3 моль/л, что
(λвозб 315 нм) родамина
4 в ацетонитриле
соответствует мольному соотношению родамин 4/кати-
(с 4.0×10-5 моль/л).
он Me = 1:100).
фрагментом, проявляется в виде двух синглетов
собственной окраски растворов солей d-метал-
при 5.09 и 5.14 м. д., что свидетельствует о затруд-
лов в ацетонитриле. Чтобы избежать возможных
ненном вращении вокруг метиленовой связи.
неточностей, мы исследовали поглощение солей
Родамин 4 обладает полосой поглощения с
Сo(NO3)2·6H2O, Сu(ClO4)2·6H2O, Ni(ClO4)2·6H2O
максимумом при 319 нм (рис. 1). Отсутствие ка-
и Zn(ClO4)2 в заведомо больших концентрациях
кого-либо поглощения в области 400-600 нм со-
(рис. 2).
ответствует спиролактамной изомерной форме
Добавление катионов кобальта(II) к раство-
родамина [27, 28]. Соединение 4 демонстрирует
ру родамина 4 приводит к проявлению naked-eye
чрезвычайно малоинтенсивную флуоресценцию в
хромогенного эффекта [18] с изменением бес-
области 500 нм (рис. 1).
цветной окраски раствора на красно-малиновую
В ранее проводившихся исследованиях сен-
вследствие ион-индуцированного раскрытия спи-
сорных свойств родаминовых производных
ролактамного изомера. В области 520 нм появля-
[34-36], как правило, не проводился учет влияния
ется новая длинноволновая полоса поглощения, а
Схема 2.
H
O
HO
O
O
N
N
Co2+, Cu2+, Ni2+, Zn2+
N
PPh3
N
PPh3
Cl-
Cl-
Et2N
O
NEt2
Et2N
O
NEt2
4
4·M2+
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023
420
ПОПОВ и др.
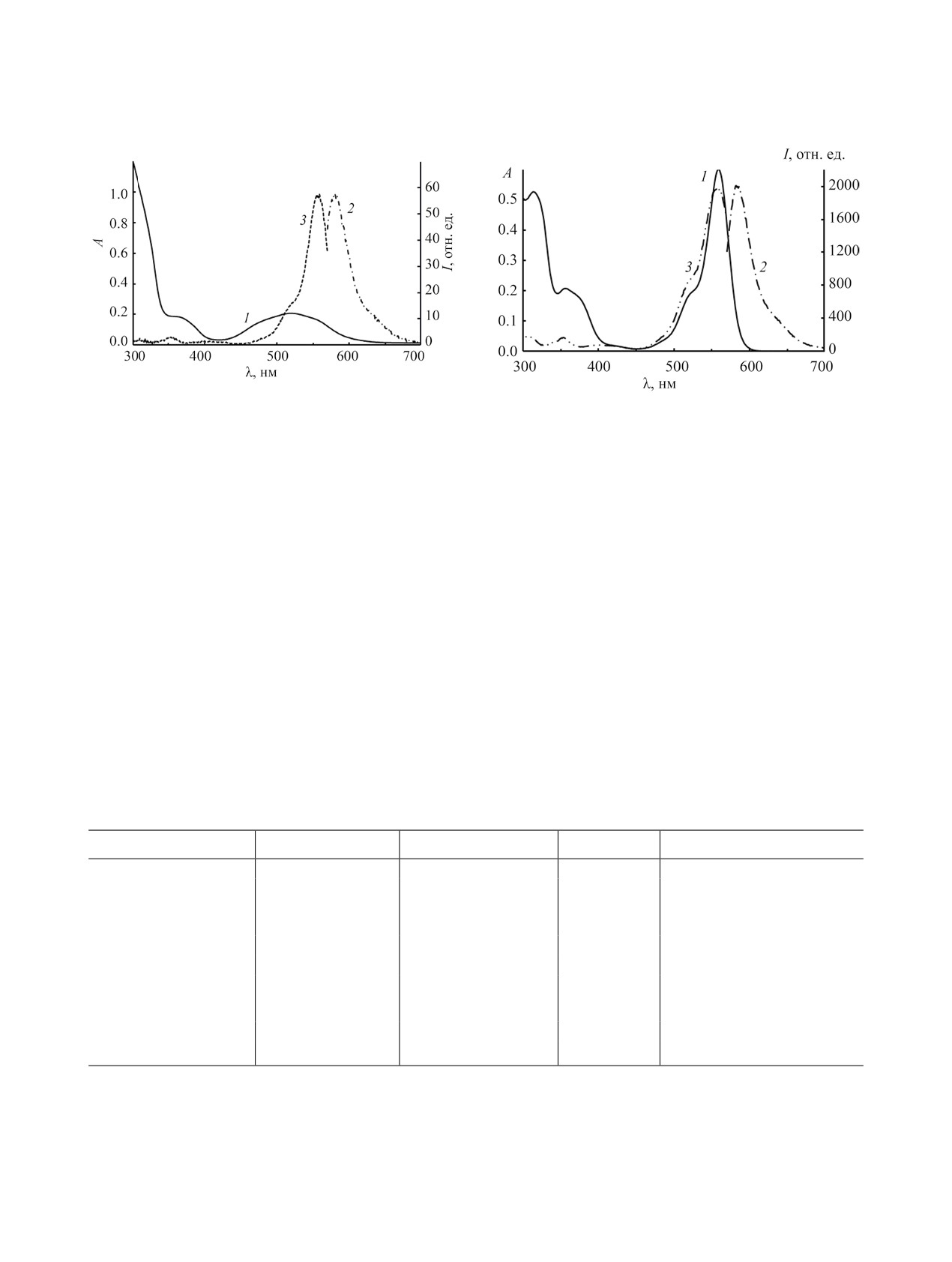
Рис. 3. Спектры поглощения (1), флуоресценции (2)
Рис. 4. Спектры поглощения (1), флуоресценции (2)
(λвозб 560 нм) и возбуждения флуоресценции (3) (λнабл
(λвозб 560 нм) и возбуждения флуоресценции (3) (λнабл
580 нм) родамина 4 в ацетонитриле (с 4.0×10-5 моль/л)
580 нм) родамина 4 в ацетонитриле (с 4.0×10-5 моль/л)
в присутствии ионов Сo2+ (1:100) через 24 ч темнового
в присутствии ионов Zn2+ (1:100) через 24 ч темнового
хранения.
хранения.
новая эмиссия возникает в области 578 нм (рис. 3,
Согласно данным [23, 26-28] совокупность
табл. 1). Практически сходными свойствами об-
вышеописанных спектрально-люминесцентных
ладают и катионы меди(II), тогда как катионы ни-
свойств, индуцированных катионами Сo2+, Сu2+,
келя(II) вызывают чрезвычайно слабый naked-eye
Ni2+ и Zn2+, обусловлена активацией карбониль-
хромогенный эффект (табл. 1).
ной группы и изомеризацией спиролактамной
Катионы цинка(II) вызывают исключительно
формы родамина 4 в открытую форму (предпола-
гаемый механизм взаимодействия представлен на
контрастный эффект naked-eye, а интенсивность
схеме 2).
флуоресценции в области 585 нм многократно воз-
растает (рис. 4, табл. 1), что позволяет считать ро-
Впервые показано, что добавление катионов
дамин 4 высокочувствительным сенсором на ионы
d-металлов в ацетонитрильный раствор спиролак-
Zn2+.
тамных производных родамина 4 с мольным соот-
Таблица 1. Спектральные характеристики солей металлов (c 4×10-3 моль/л), соединения 4 и его комплексов с ионами
металлов (1:100) в ацетонитрилеa
Соединение
λабсmax-соль, нм (Amax)
λабсmax, нм (Amax)
λвозб.max, нм
λфл max, нм (Iфлmax, отн. ед.)
4 (свободный лиганд)
-
315 (0.60), 410 (0.01)
315
510 (~2)
Сo(NO3)2·6H2O
< 350, 520 (0.197)
пл 360 (0.19), пл 475
560
580 (60)
(0.15), 520 (0.21), пл
550 (0.18)
Сu(ClO4)2·6H2O
< 320, 748 (0.07)
350 (0.21), 530 (0.13)
350
460 (45), 545 (25)
530
555 (190)
Ni(ClO4)2·6H2O
< 300, 364 (0.03),
315 (0.61), 375 (0.18),
560
580 (310)
596 (0.04)
560 (0.05)
Zn(ClO4)2
< 300 (< 0.01)
315 (0.53), 350 (0.21),
370
450 (140), 585 (70)
560 (0.60)
560
585 (2000)
a λабсmax-соль - длина волны максимума полосы поглощения соли; λабсmax, λвозбmax, λфлmax - длины волн максимумов полос поглоще-
ния, возбуждения флуоресценции и флуоресценции комплекса соответственно; Amax и Iфлmax - оптическая плотность и интенсив-
ность флуоресценции в максимумах полос поглощения и флуоресценции соответственно.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023
СИНТЕЗ, СПЕКТР
АЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ И ИОНОХРОМНЫЕ СВОЙСТВА
421
ношением лиганд/катион = 1:100, приводит к по-
дующим пересчетом с использованием коэффици-
явлению полос поглощения в области 500-600 нм,
ента 5.2 для соответствия с измерениями осталь-
отличных от полос поглощения солей металлов и
ных комплексов. Для приготовления растворов
лиганда, что свидетельствует об образовании ком-
использовали ацетонитрил спектральной чистоты,
плексов с открытой изомерной формой 4·M2+.
перхлораты или нитраты d-металлов (Aldrich). Для
комплексообразования соли металлов добавляли в
Таким образом, синтезировано производное ро-
мольных соотношениях лиганд/Me = 1:100. Тем-
дамина B, содержащее терминальный (4-гидрок-
пературу плавления измеряли в стеклянных ка-
сибензил)трифенилфосфонийхлоридный заме-
пиллярах на приборе ПТП-М. Элементный анализ
ститель. Изучены спектрально-люминесцентные
выполняли классическим методом [37]. Экспери-
свойства и комплексообразование полученного со-
ментальные данные получены с использованием
единения в растворах с катионами Co2+, Cu2+, Ni2+
оборудования Центра коллективного пользования
и Zn2+. Соединение является бифункциональным
Южного федерального университета «Молекуляр-
хромофлуорогенным хемосенсором на катионы,
ная спектроскопия».
реагирующим на указанные ионы c проявлением
хромогенного naked-eye эффекта с изменением
2-Гидрокси-5-хлорметилбензальдегид
(1)
бесцветной окраски раствора на красно-мали-
получали по модифицированной методике [38].
новую вследствие катион-индуцированного рас-
К смеси 0.14 моль (17.2 г) салицилового альдеги-
крытия спиролактамного цикла. Одновременно
да, 4.74 моль (150 мл) 37%-ной соляной кислоты
наблюдается появление флуоресценции в области
и 0.57 моль (10.8 мл) 37%-ного формальдегида
560-600 нм. Особо интенсивную эмиссию вызы-
добавляли хлорид цинка в качестве катализато-
ра (0.01%) и перемешивали 24 ч при комнатной
вает ион цинка(II), что придает полученному ро-
дамину свойства высокочувствительного и эффек-
температуре. Смесь насыщали газообразным HCl
тивного флуоресцентного хемосенсора на катионы
и оставляли на 24 ч. Продукт отфильтровывали,
промывали смесью диэтиловый эфир-вода (1:1),
Zn2+.
затем этанолом и сушили. Выход 13.80 г (89%), бе-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
лый порошок, т. пл. 86-87°С.
(4-Гидрокси-3-формилбензил)трифенил-
Спектры ЯМР 1Н и 13С получены на спектро-
фосфонийхлорид (2) получали по модифици-
метре Bruker Avance Neo 300 (300 МГц для 1Н
рованной методике [39]. К раствору 11.7 ммоль
и 75 MГц для 13С) в ДМСО-d6. В качестве вну-
(2.0 г) альдегида 1, в 100 мл толуола добавляли
треннего стандарта использовали остаточные
11.8 ммоль (3.1 г) трифенилфосфина. Смесь кипя-
сигналы протонов дейтерорастворителя. Ко-
тили 2 ч, затем охлаждали. Осадок отфильтровы-
лебательные спектры записывали на приборе
вали и сушили. Выход 4.81 г (95%), белый поро-
FT/IR-6800 FTIR (JASCO). Электронные спек-
шок, т. пл. 275-276°С.
тры поглощения снимали на спектрофотометре
Cary 60 bio (Agilent Technologies) в кварцевой кю-
2-(2-Аминоэтил)-3′,6′-бис(диэтиламино)спи-
вете с длиной оптического пути l 1 см. Рабочая
ро[изоиндолин-3,9′-ксантен]-1-он 3 получали по
концентрация раствора родамина составляла
методике [40].
с 4×10-5 моль/л. Флуоресцентные измерения про-
(3-{[(2-{3′,6′-Бис(диэтиламино)-3-оксоспи-
водили на спектрофлуориметре CARY ECLIPSE
ро[изоиндолин-1,9′-ксантен]-2-ил}этил)имино]-
(Varian) в кварцевой кювете с длиной оптического
метил}-4-гидроксибензил)трифенилфосфо-
пути l 1 см. Рабочая концентрация растворов со-
нийхлорид (4). К раствору 1.0 ммоль (0.48 г) ксан-
ставляла с 4×10-5 моль/л. Напряжение на фотоум-
тена 3 в 5 мл изопропилового спирта добавляли
ножителе спектрофлуориметра составляло 600 В.
1 ммоль (0.90 г) фосфонийхлорида 2. Реакцион-
Ширина щелей монохроматоров испускания и
ную смесь кипятили 4 ч, упаривали до объема
возбуждения - 5 нм. Для исследования с ионами
1.5 мл и охлаждали. Выпавший осадок отфиль-
цинка ширина щели уменьшалась до 2.5 нм из-за
тровывали. Выход 0.80 г (89%), желтый порошок,
высокой интенсивности флуоресценции с после-
т. пл. 271-273°С. ИК спектр, ν, см-1: 1614 (C=С),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023
422
ПОПОВ и др.
1633 (C=N), 1690 (C=O), 2960 (OH). Спектр ЯМР
Е.Н. Шепеленко и А.Д. Дубоносов) и государ-
1Н (ДМСО-d6), δ, м. д.: 1.07 т (12Н, 4Me, J 7.2 Гц),
ственного задания Федерального научно-ис-
3.24-3.32 м (12Н, 6CH2), 5.09 с (1Н, CH2), 5.14
следовательского центра
«Кристаллография и
с (1Н, CH2), 6.27 уш. с (4HAr), 6.39 уш. с (2HAr),
фотоника» РАН (тема № 119040590066-7).
6.68-6.71 м (1HAr), 6.87-6.90 м (2HAr), 7.05-7.07
КОНФЛИКТ ИНТЕРЕСОВ
м (1HAr), 7.52-7.56 м (2HAr), 7.62-7.73 м (12HAr),
7.78-7.86 м (4HAr), 7.89 с (1H, CHN), 13.00 с (1H,
Авторы заявляют об отсутствии конфликта
OH). Спектр ЯМР 13С (ДМСО-d6), δC, м. д.: 12.9,
интересов.
44.1, 56.5, 64.5, 97.7, 105.4, 108.6, 117.4, 117.7,
118.9, 119.1, 122.8, 124.2, 128.8, 128.9, 130.4, 130.5,
СПИСОК ЛИТЕРАТУРЫ
130.6, 130.7, 130.8, 133.3, 133.9, 134.4, 134.6, 134.6,
1.
Chemosensors: Principles, Strategies, and Applications /
134.8, 135.4, 135.5, 148.9, 153.2, 153.7, 155.6, 160.9,
Eds E.V. Anslyn, B. Wang. Hoboken: Wiley, 2011.
165.1, 167.6. Найдено, %: C 74.76; H 6.27; N 8.25.
2.
Sensors in Water Pollutants Monitoring: Role of
C56H56N4O3PCl. Вычислено, %: C: 74.78; H: 6.28;
Material / Eds. D. Pooja, P. Kumar, P. Singh, S. Patil.
N: 6.23.
Singapore: Springer, 2020.
3.
Dongare P.R., Gore A.H. // ChemistrySelect. 2021.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Vol. 6. P. 5657. doi 10.1002/slct.202101090
4.
You L., Zha D., Anslyn E.V. // Chem. Rev. 2015.
Попов Леонид Дмитриевич, ORCID: https://
Vol. 115. P. 7840. doi 10.1021/cr5005524
orcid.org/0000-0001-9565-8005
5.
Chhatwal M., Kumar A., Singh V., Gupta R.D.,
Шепеленко Евгений Николаевич, ORCID:
Awasthi S.K. // Coord. Chem. Rev. 2015. Vol. 292. P. 30.
doi 10.1016/j.ccr.2015.02.009
6.
Advances in Spectroscopy: Molecules to Materials / Eds
Подшибякин Виталий Алексеевич, ORCID:
D.K. Singh, S. Das, A. Materny. Singapore: Springer,
2019.
Валова Татьяна Михайловна, ORCID: https://
7.
Lakowicz J.R. Principles of Fluorescence Spectroscopy.
orcid.org/0000-0002-2103-8011
Singapore: Springer, 2006.
Венидиктова Ольга Владимировна, ORCID:
8.
Saleem M., Lee K.H. // RSC Adv. 2015. Vol. 5. P. 72150.
doi 10.1039/ C5RA11388A
9.
Kaur B., Kaur N., Kumar S. // Coord. Chem. Rev. 2018.
Vol. 358. P. 13. doi 10.1016/ j.ccr.2017.12.002
org/0000-0002-1992-3775
10.
Wu D., Sedgwick A.C., Gunnlaugsson T., Akkaya E.U.,
Дубоносов Александр Дмитриевич, ORCID:
Yoon J., James T.D. // Chem. Soc. Rev. 2017. Vol. 46.
P. 7105. doi 10.1039/C7CS00240H
11.
Kaur N., Kumar S. // Tetrahedron. 2011. Vol. 67.
БЛАГОДАРНОСТЬ
P. 9233. doi 10.1016/j.tet.2011.09.003
12.
Khan S., Chen X., Almahri A., Allehyani E.S.,
Авторы выражают благодарность сотрудни-
Alhumaydhi F.A., Ibrahim M.M., Ali S. // J. Environ.
кам Центра коллективного пользования «Нано-
Chem. Eng. 2021. Vol. 9. Article 106381. doi 10.1016/j.
технологии» Южно-Российского государствен-
jece.2021.106381
ного политехнического университета (НПИ) им.
13.
Patil N.S., Dhake R.B., Ahamed M.I., Fegade U. // J.
М.И. Платова за проведение ЯМР-экспериментов.
Fluoresc. 2020. Vol. 30. P. 1295. doi 10.1007/s10895-
020-02554-7
ФИНАНСОВАЯ ПОДДЕРЖКА
14.
Upadhyay S., Singh A., Sinha R., Omer S., Negi K. //
J. Mol. Struct. 2019. Vol. 1193. P. 89. doi 10.1016/j.
Работа выполнена при финансовой поддержке
molstruc.2019.05.007
Министерства науки и высшего образования РФ
15.
Wu D., Sedgwick A.C., Gunnlaugsson T., Akkaya E.U.,
в рамках государственного задания в сфере науч-
Yoon J., James T.D. // Chem. Soc. Rev. 2017. Vol. 46.
ной деятельности (№ FENW-2023-2020), а также в
P. 7105. doi 10.1039/C7CS00240H
рамках реализации государственного задания Юж-
16.
Daly B., Ling J., de Silva P. // Chem. Soc. Rev. 2015.
ного научного центра РАН (№ 122020100282-6,
Vol. 44. P. 4203. doi 10.1039/C4CS00334A
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023
СИНТЕЗ, СПЕКТР
АЛЬНО-ЛЮМИНЕСЦЕНТНЫЕ И ИОНОХРОМНЫЕ СВОЙСТВА
423
17.
Fu Y., Finney N.S. // RSC Adv. 2018. Vol. 8. P. 29051.
Minkin V.I. // Tetrahedron. 2022. V. 109. Article 132710.
doi 10.1039/C8RA02297F
doi 10.1016/j.tet.2022.132710
18.
Yeung M.C., Yam V.W. // Chem. Soc. Rev. 2015. Vol. 44.
30.
Hu J., Long C., Fu Q., Ni P., Yin Z. // J. Photochem.
P. 4192. doi 10.1039/C4CS00391H
Photobiol. (A). 2019. Vol. 379. P. 105. doi 10.1016/j.
19.
Lee M.H., Kim J.S., Sessler J.L. // Chem. Soc. Rev.
jphotochem.2019.04.031
2015. Vol. 44. P. 4185. doi 10.1039/C4CS00280F
31.
Choudhury N., Ruidas B., Mukhopadhyay C.D.,
20.
Carter K.P., Young A.M., Palmer A.E. // Chem. Rev.
De P. // ACS Appl. Polymer Mater. 2020. Vol. 2.
2014. Vol. 114. P. 4564. doi 10.1021/cr400546e
P. 5077. doi 10.1021/acsapm.0c00878
21.
Sun W., Li M., Fan J., Peng X. // Acc. Chem. Res. 2019.
32.
Mondal S., Bandyopadhyay C., Ghosh K. / /
Vol. 52. P. 2818. doi 10.1021/acs.accounts.9b00340
Supramol. Chem. 2019. Vol. 31. P. 1. doi
22.
Wan H., Xu Q., Gu P., Li H., Chen D., Li N., He J.,
10.1080/10610278.2018.1522444
Lu J. // J. Hazard. Mater. 2021. Vol. 403. Article 123656.
33.
Mondal S., Ghosh K. // Supramol. Chem. 2019. Vol. 31.
23.
Popova O.S., Revinskii Yu.V., Tkachev V.V., Uteny-
P. 645. doi 10.1080/10610278.2019.1632456
shev A.N., Karlutova O.Yu., Starikov A.G., Dubono-
34.
Deng F. Dongsheng Sun D., Yang S., Huang W.,
sov A.D., Bren V.A., Aldoshin S.M., Minkin V.I. // J. Mol.
Huang C., Xu Z., Liu L. // Spectrochim. Acta (A). 2022.
Struct. 2020. Vol. 1199. Article 127013. doi 10.1016/j.
Vol. 268. Article 120662. doi 10.1016/j.saa.2021.120662
molstruc.2019.127013
35.
Sun J., Tian-rong Li T., Yang Z. // J. Photochem.
24.
Nikolaeva O.G., Shepelenko E.N., Tikhomirova K.S.,
Photobiol. (A). 2021. Vol. 411. Article 113207. doi
Revinskii Yu.V., Dubonosov A.D., Bren V.A.,
10.1016/j.jphotochem.2021.113207
Minkin V.I. // Mendeleev Commun. 2016. Vol. 26.
36.
Karuk Elmas S.N., Dinckan S., Arslan F.N., Aydin D.,
P. 402. doi 10.1016/j.mencom.2016.09.012
Savran T., Yilmaz I. // J. Photochem. Photobiol.
25.
Chi W., Qi Q., Lee R., Xu Z., Liu X. // J. Phys. Chem. (C).
(A). 2021. Vol. 421. Article 113521. doi 10.1016/j.
2020. Vol. 124. P. 3793. doi 10.1021/acs.jpcc.9b11673
jphotochem.2021.113521
26.
Oliveira E., Bertolo E., Nunez C., Pilla V., Santos H.M.,
37.
Гельман Н.Э., Терентьева Е.А., Шанина Т.М.,
Fernandez-Lodeiro J., Fernandez-Lodeiro A., Djafari J.,
Кипаренко Л.М., Резл В. Методы количественно-
Capelo J.L., Lodeiro C. // ChemistryOpen. 2018. Vol. 7.
го органического элементного микроанализа. М.:
P. 9. doi 10.1002/open.201700135
Химия, 1987.
27.
Chen X., Pradhan T., Wang F., Kim J.S., Yoon J. //
38.
Wei Z., Liu Y.Q., Wang S.Z., Yao L., Nie H.F., Wang Y.A.,
Chem. Rev. 2012. Vol. 112. P. 1910. doi 10.1021/
Liu X.Y., Zheng Z.B., Li S. // Bioorg. Med. Chem. 2017.
cr200201z
Vol. 25. P. 4497. doi 10.1016/j.bmc.2017.06.041
28.
Zheng H., Zhan X.Q., Bian Q.N., Zhang X.J. //
39.
Kureshy R.I., Prathap K.J., Roy T., Maity N.C.,
Chem. Commun. 2013. Vol. 49. P. 429. doi 10.1039/
Khan N.H., Abdi S.H.R., Bajaj H.C. // Adv. Synth. Catal.
C2CC35997A
2010. Vol. 352. P. 3053. doi: 10.1002/adsc.201000428
29.
Podshibyakin V.A., Shepelenko E.N., Karlutova O.Y.,
40.
Shu H., Wu X., Zhou B., Han Y., Jin M., Zhu J.,
Dubonosova I.V., Borodkin G.S., Popova O.S.,
Bao X. // Dyes Pigm. 2017. Vol. 136. P. 535. doi
Zaichenko S.B., Dubonosov A.D., Bren V.A.,
10.1016/j.dyepig.2016.08.063
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023
424
ПОПОВ и др.
Synthesis, Spectral-Luminescent and Ionochromic Properties
of Rhodamine B Containing Terminal
(4-Hydroxybenzyl)triphenylphosphonium Chloride Substituent
L. D. Popova, Е. N. Shepelenkob, V. A. Podshibyakinc, T. M. Valovad,
O. V. Venidiktovad, A. O. Aytd, and A. D. Dubonosovb,*
a Southern Federal University, Rostov-on-Don, 344090 Russia
b Federal Research Centre the Southern Scientific Centre of the Russian Academy of Sciences,
Rostov-on-Don, 344006 Russia
c Institute of Physical and Organic Chemistry, Southern Federal University, Rostov-on-Don, 344090 Russia
d Federal Scientific Research Center “Crystallography and Photonics”of the Russian Academy of Sciences,
Moscow, 119333 Russia
*e-mail: aled@ipoc.sfedu.ru
Received November 3, 2022; revised December 21, 2022; accepted December 30, 2022
A rhodamine B derivative containing a terminal (4-hydroxybenzyl)triphenylphosphonium chloride substituent
was synthesized. Its structure was determined using IR, 1H NMR and 13C spectroscopy. The spectral luminescent
properties and complexation of the compound obtained in solutions with Co2+, Cu2+, Ni2+ and Zn2+ cations were
studied. These ions cause a contrasting ionochromic naked-eye effect with the change of colorless solution to
crimson-red color due to the isomerization of the spirolactam form of rhodamine into an open form. The process
is accompanied by the appearance of fluorescence in the region of 560-600 nm. The complex with zinc(II)
cation exhibits particularly intensive emission, which gives the obtained rhodamine the properties of a highly
sensitive and effective chemosensor for Zn2+ ions.
Keywords: rhodamine, rhodamine B derivatives, ionochromic effect (naked eye effect), organic chemosensors
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 3 2023