ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 4, с. 593-601
УДК 547.821.3:544.623.032.73
ПОЛУЧЕНИЕ, ТЕРМИЧЕСКИЕ СВОЙСТВА
И ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ
ПИРИДИНИЕВЫХ ИОННЫХ ЖИДКОСТЕЙ С
ТЕТРАХЛОРФЕРРАТ-АНИОНОМ
© 2023 г. О. Е. Журавлев1,*, А. Д. Кафтанов1, Г. С. Юлмасов1
1 Тверской государственный университет, Садовый пер. 35, Тверь, 170002 Россия
*e-mail: pifchem@mail.ru
Поступило в редакцию 19 февраля 2023 г.
После доработки 4 апреля 2023 г.
Принято к печати 5 апреля 2023 г.
Изучена термическая стабильность тетрахлорферратов(III) N-алкилпиридиния общей формулы
[C5H5NR]FeCl4, где R = C4H9, (CH2)3CN, CH2C6H5, C8H17, C10H21, на воздухе в интервале 25-600°С, а
также термическая стабильность хлоридов N-алкилпиридиния. Исследована эквивалентная электро-
проводность тетрахлорферратов(III) N-алкилпиридиния в растворе ацетонитрила при 25°С. На основе
кондуктометрических данных методом Ли-Уитона рассчитаны константы ионной ассоциации Ka, пре-
дельная молярная электрическая проводимость (λ0) и стандартная энергия Гиббса ассоциации (ΔG°) в
растворах ацетонитрила.
Ключевые слова: ионные жидкости, термическая стабильность, электропроводность, ассоциация,
ацетонитрил
DOI: 10.31857/S0044460X2304011X, EDN: AUSRWJ
Ионные жидкости представляют собой инте-
катиона или аниона, являются магнитные ионные
ресный класс немолекулярных растворителей,
жидкости [4-6]. Эти соединения обладают мно-
состоящих из органических катионов и органиче-
гими свойствами, характерными для традици-
ских или неорганических анионов [1, 2]. Ионные
онных ионных жидкостей, с дополнительной ха-
жидкости обладают низкими температурами плав-
рактеристикой - откликом на внешнее магнитное
ления и множеством физико-химических свойств,
поле. Магнитная восприимчивость таких ионных
включая варьируемую вязкость, низкое давление
жидкостей часто используется в жидкостной экс-
пара при нормальных условиях, электропрово-
тракции [7-9] и в магнитных датчиках [10]. Маг-
дность и высокую термическую стабильность.
нитные ионные жидкости успешно применяются
Более того, свойства ионных жидкостей могут
для измерения плотности с помощью магнитной
быть изменены путем подбора катиона и аниона
левитации [11], в катализе [12, 13], для получения
в составе ионных жидкостей [3]. Эта особенность
магнитных жидкостей [14], в качестве растворите-
структурной модификации делает ионные жидко-
ля для целлюлозы [15]. Магнитные ионные жид-
сти привлекательными объектами для широкого
кости также привлекли внимание благодаря своей
спектра применения в различных областях науки
низкой летучести и термостабильности, что делает
и техники. Подклассом ионных жидкостей, со-
их экологически безопасными и подходящими для
держащих парамагнитный фрагмент в структуре
применения при высоких температурах, напри-
593
594
ЖУРАВЛЕВ и др.
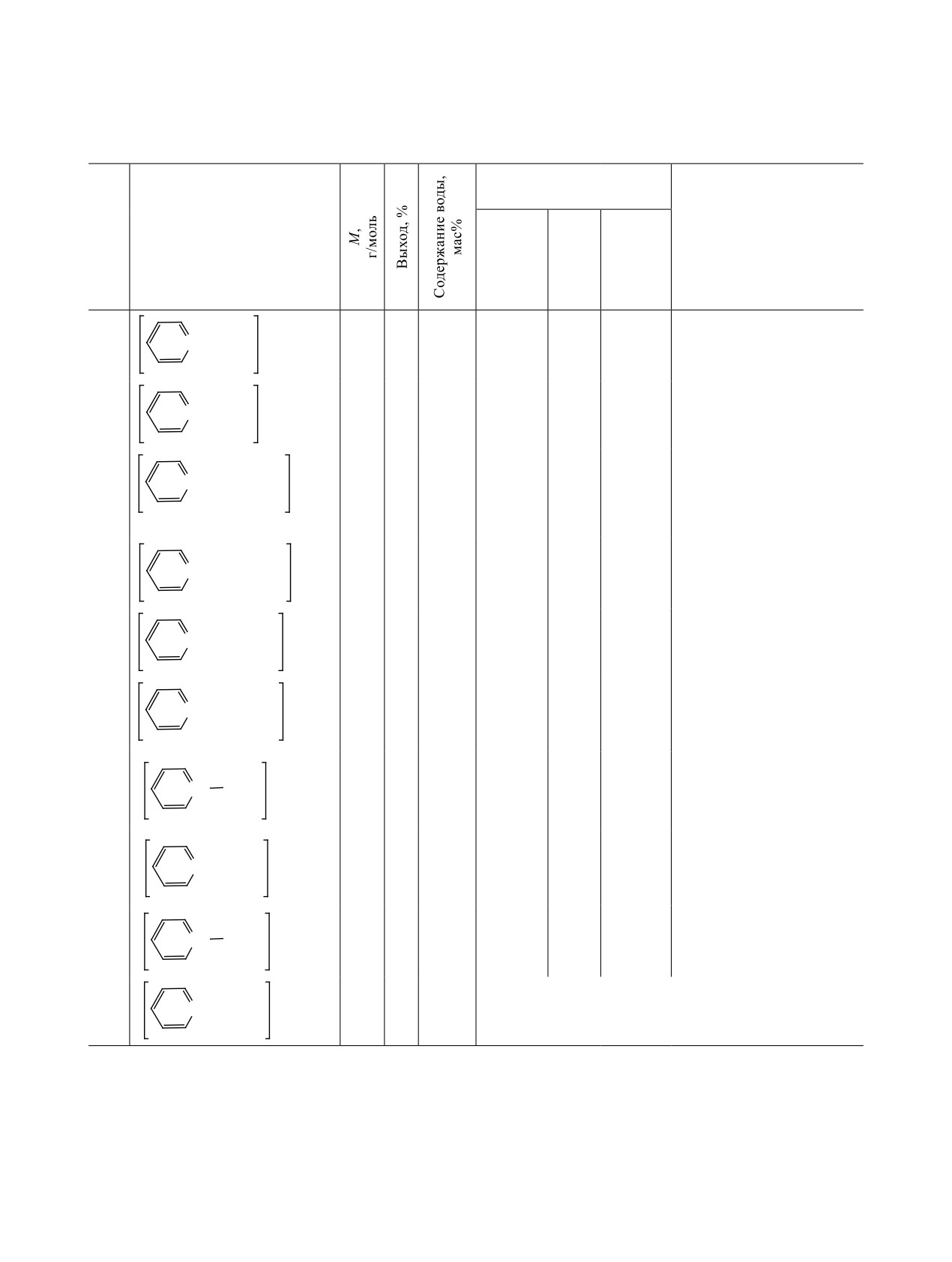
Таблица 1. Выход и физико-химические свойства хлоридов и тетрахлорферратов N-алкилпиридиния 1-10
Элементный анализ,
найдено/вычислено, %
№
Структура
ν, см-1
C
H
N
1
333.7
94
0.19
32.6/32.4
3.1/4.2
4.0/4.2
3241, 3145, 3089 (C-HAr),
-
2956, 2842 (C-HAlk), 1640,
N+ C4H9
FeCl
4
1510, 1491 (C-CAr), 743,
690 [δ(C-HAlk)]
2
171.5
61
0.17
62.9/63.0
8.4/8.2
8.1/8.2
3052 (C-HAr), 2962, 2936
N+ C4H9
Cl-
(C-HAlk), 1633, 1487 (C-CAr),
1442, 1372 [δ(C-HAlk)]
3
344.7
88
0.18
31.6/31.4
3.3/3.2
8.2/8.1
3247, 3133, 3079 (C-HAr),
-
2955, 2848 (C-HAlk), 2252
N+ (CH2)3CN
FeCl
4
(C≡N), 1631, 1512, 1480
(C-CAr), 751, 688
[δ(C-HAlk)]
4
182.5
66
0.16
59.0/59.2
6.2/6.0
15.2/15.3
3057 (C-HAr), 2943
(C-HAlk), 2249 (C≡N), 1629,
N+ (CH2)3CN
Cl-
1489 (C-CAr), 1438
[δ(C-HAlk)]
5
367.8
83
0.15
39.0/39.2
3.4/3.2
3.6/3.8
3059 (C-HAr), 2979
-
(C-HAlk), 1631, 1486
N+ CH2C6H5
FeCl4
(C-CAr), 1444 [δ(C-HAlk)]
6
205.6
77
0.13
70.0/70.1
6.0/5.8
6.7/6.8
3049 (C-HAr), 2968
(C-HAlk), 1631, 1448
N+ CH2C6H5
Cl-
(C-CAr), 1446 [δ(C-HAlk)]
7
389.8
86
0.19
40.0/40.1
5.9/5.6
3.4/3.6
3066 (C-HAr), 2928, 2856
−
(C-HAlk), 1634, 1485
N+
C8H17
FeCl
4
(C-CAr), 1455, 1377
[δ(C-HAlk)]
8
227.6
51
0.18
68.5/68.6
9.9/9.7
6.0/6.2
3051 (C-HAr), 2927, 2856
(C-HAlk), 1633, 1478 (C-
N+ C8H17
Cl-
CAr), 1456, 1378 [δ(C-HAlk)]
9
417.8
92
0.14
43.0/43.1
6.4/6.2
3.3/3.4
3055 (C-HAr), 2978, 2843
−
(C-HAlk), 1648, 1515, 1458
N+
C10H21
FeCl
4
(C-CAr), 765, 680
[δ(C-HAlk)]
10
273.6
-
6.72
Коммерческий продукт марки ХЧ. Перекристаллизован
N+ C10H21
Cl-·Η2Ο
из ацетона
мер, в качестве растворителей для органического
и анионы в составе ионных жидкостей вносят зна-
синтеза [16, 17] и экстракции опасных химических
чительный вклад в их термическую стабильность.
веществ [7]. Было показано, что как катионы, так
Например, установлено, что магнитные ионные
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 4 2023
ПОЛУЧЕНИЕ, ТЕРМИЧЕСКИЕ СВОЙСТВА И ЭЛЕКТРОПРОВОДНОСТЬ Р
АСТВОРОВ
595
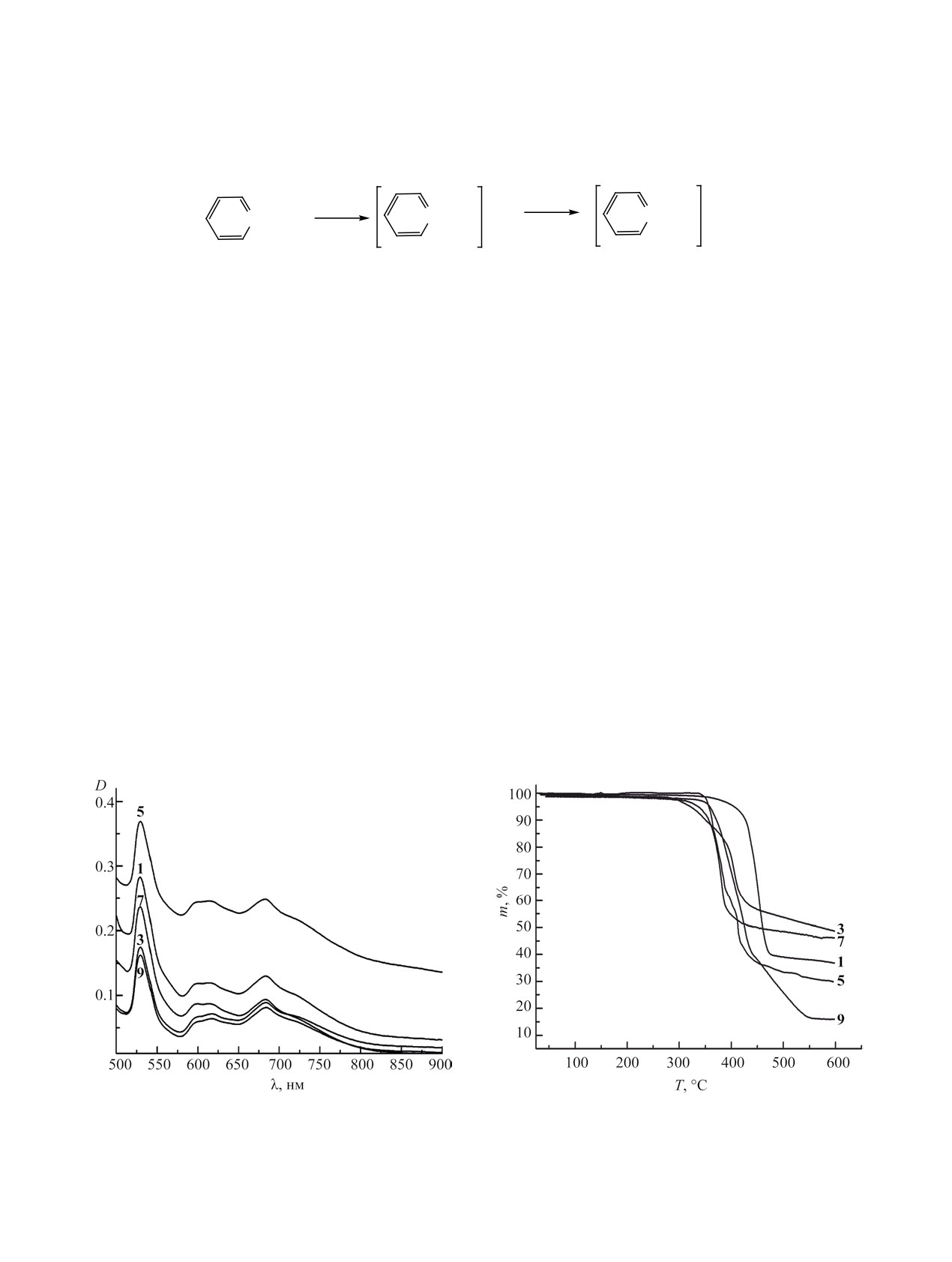
Схема 1.
FeCl3
N+ R
Cl-
N+ R
FeCl−
N + RCl
R = C4H9, (CH2)3CN, CH2C6H5, C8H17, C10H21.
жидкости на основе солей аммония обладают зна-
растворов N-алкилпиридиниевых магнитных ион-
чительно более низкой термической стабильно-
ных жидкостей с тетрахлорферрат(III)-анионом.
стью, чем магнитные ионные жидкости на основе
Исследованные соединения 1-10 были получены
1,3-диалкилимидазолия [18].
методом, описанным ранее (схема 1) [23]. Физи-
ко-химические свойства хлоридов и тетрахлор-
Одним из факторов, ограничивающим крупно-
масштабное применение ионных жидкостей, явля-
ферратов N-алкилпиридиния 1-10 представлены в
табл. 1.
ется их высокая вязкость, что приводит к низкой
подвижности ионов и, как следствие, понижению
Спектры поглощения в видимой области
электропроводности. Добавление органического
(рис. 1) указывают на наличие в составе всех маг-
растворителя, такого как дихлорметан [19], γ-бу-
нитных ионных жидкостей 1-10 аниона FeCl–.
тиролактон [20], пропиленкарбонат [21] или аце-
Спектры тетрахлорферратов 1-10 имеют три ха-
тонитрил [22], позволяет увеличить подвижность
рактеристические полосы поглощения для аниона
ионов и перенос заряда в ионных жидкостях.
FeCl– при 534, 619, 688 нм, что согласуется с лите-
Изучение электропроводности таких систем, а
ратурными данными [5]. Данные полосы поглоще-
также ион-ионных и ион-дипольных взаимодей-
ния отсутствуют у хлорида железа(III).
ствий в смесях ионных жидкостей с органически-
Учитывая различную структуру алкильного
ми растворителями необходимо для достижения
заместителя при атоме азота в катионе N-алкил-
заданных свойств ионных жидкостей.
пиридиния, можно предположить, что они будут
Целью настоящей работы является изучение
обладать различной термической стабильностью.
термической стабильности и электропроводности
Термодеструкция тетрахлорферратов N-алкилпи-
Рис. 1. Спектры поглощения в видимой области
Рис. 2. Термическая стабильность тетрахлорферратов
тетрахлоферратов N-алкилпиридиния 1, 3, 5, 7, 9.
N-алкилпиридиния 1, 3, 5, 7, 9.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 4 2023
596
ЖУРАВЛЕВ и др.
образование неразложившегося остатка, состав и
структура которого была проанализирована нами
ранее [24]. Среди тетрахлорферратов N-алкилпи-
ридиния наибольшей термической стабильностью
обладает соединение с бутильной группой, для
которого наблюдается только 5% потери массы
при 400°С (табл. 2). Температуры разложения для
остальных изученных тетрахлорферратов лежат в
интервале от 310 до 365°С.
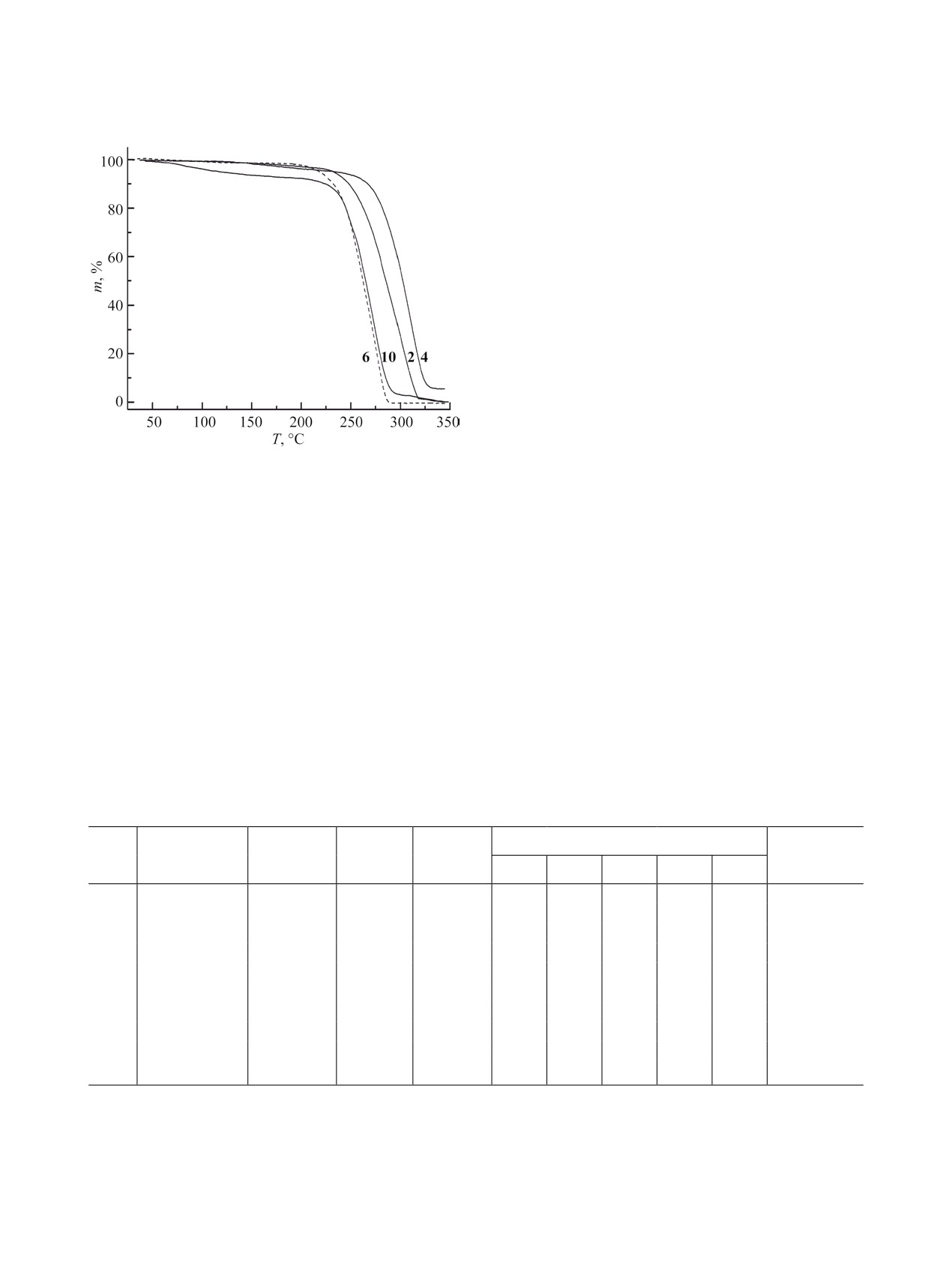
Для установления влияния тетрахлорферрат-
аниона на термическую стабильность исследо-
ванных соединений нами была изучена термиче-
ская стабильность хлоридов N-алкилпиридиния
(рис. 3). Хлориды N-алкилпридиния, как и те-
трахлорферраты, обладают высокой ионностью,
Рис. 3. Термическая стабильность хлоридов N-алкил-
давление их насыщенного пара близко к нулю,
пиридиния 2, 4, 6, 10.
поэтому потеря массы обуславливается их тер-
мической деструкцией. В отличие от тетрахлор-
ферратов хлориды разлагаются в одну стадию с
ридиния представляет собой стадийный процесс,
большей скоростью в интервале 250-330°С с прак-
на что указывают перегибы на кривых потери мас-
тически полной потерей массы. Для N-децилпири-
сы (рис. 2). Температуры разложения для исследу-
динийхлорида 10 наблюдается потеря массы при
емых соединений определяли графически путем
100°С, что обусловлено, по-видимому, отщеплени-
нахождения точки пересечения касательных к ба-
ем кристаллизационной воды.
зовой линии и прямолинейному участку кривой
Температуры разложения ионных жидкостей
потери массы. В общем случае все исследованные
зависят, в первую очередь, от координирующей
тетрахлорферраты N-алкилпридиния стабильны
способности аниона, причем термическая стабиль-
до 300°С и постепенно разлагаются в интервале
ность значительно ниже для высоко координиру-
300-600°С. При этом во всех случаях наблюдали
ющих анионов, таких как галогены [25]. Можно
Таблица 2. Термическая стабильность тетрахлорферратов и хлоридов N-алкилпиридиния 1-10
Потеря массы, %
№
R
Анион
Тразл, °Са
Т50, °Сб
Остаток, %
100
200
300
400
500
1
FeCl–
425
460
0
0
0
5
60
36
C4H9
2
Cl-
258
284
0
2
71
-
-
0
3
FeCl–
310
557
0
0
3
24
47
48
(CH2)3CN
4
Cl-
273
303
0
4
45
-
-
6
5
FeCl–
355
413
0
0
0
41
66
29
CH2C6H5
6
Cl-
234
262
0
2
98
-
-
0
7
FeCl–
357
440
0
0
2
46
52
46
C8H17
8
Cl-
238
263
0
0
98
-
-
0
9
FeCl–
365
425
0
0
3
30
74
16
C10H21
10
Cl-
240
263
3
8
97
-
-
0
а Тразл - температура начала термического разложения.
б Т50 - температура, соответствующая 50%-ной потере массы.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 4 2023
ПОЛУЧЕНИЕ, ТЕРМИЧЕСКИЕ СВОЙСТВА И ЭЛЕКТРОПРОВОДНОСТЬ Р
АСТВОРОВ
597
Ионные жидкости могут полностью или частично
диссоциировать в растворах, т. е. существовать в
растворах как в виде ионов, так и в виде недиссо-
циированных молекул. Отправной точкой для изу-
чения процессов ассоциации в растворах является
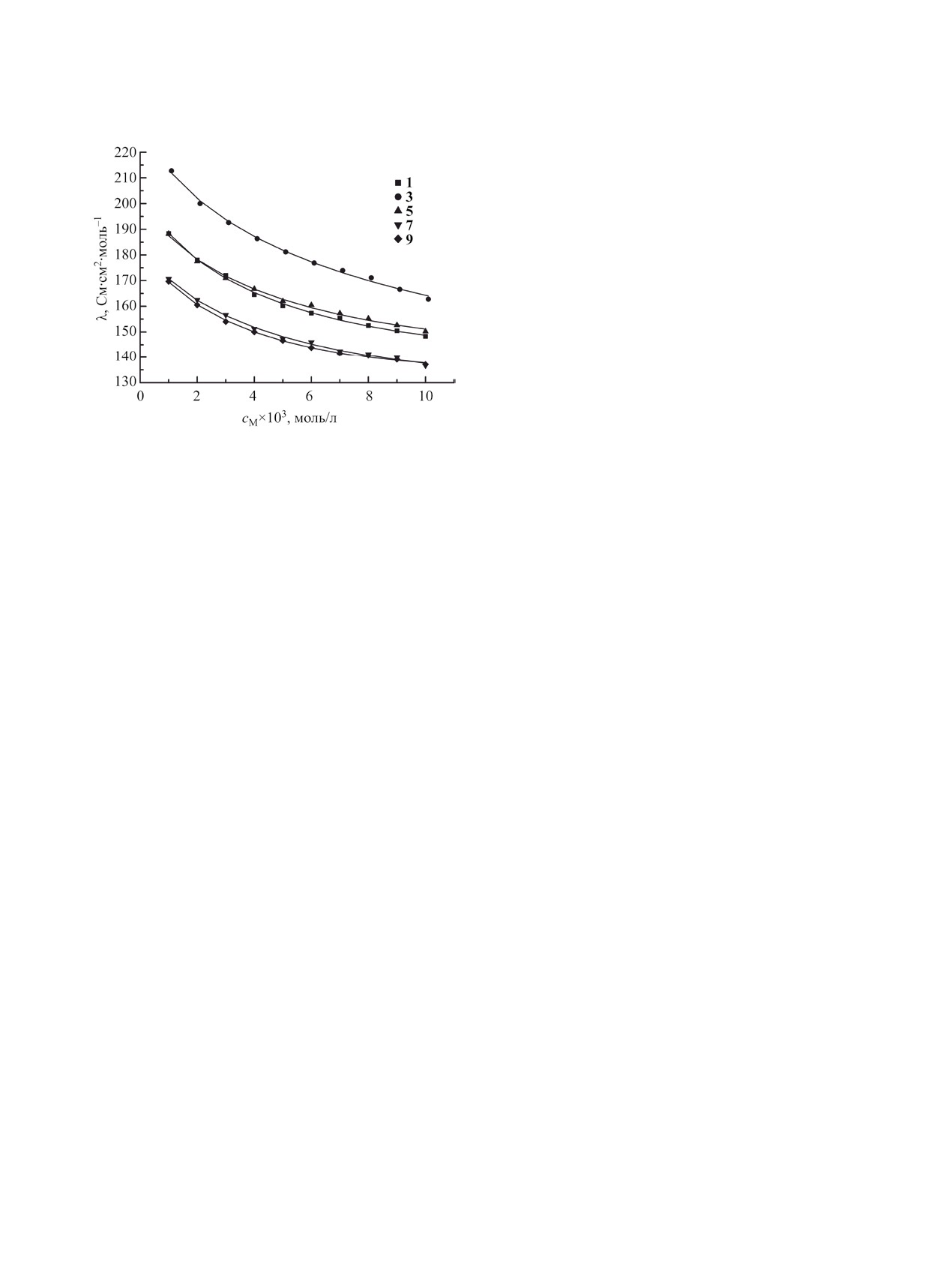
изучение концентрационной зависимости эквива-
лентной электропроводности. В качестве раство-
рителя в данной работе был выбран ацетонитрил
из-за его высокой электрохимической стабильно-
сти, низкой плотности и вязкости. На основе кон-
дуктометрических измерений были построены
зависимости эквивалентной электропроводности
от концентрации для тетрахлорферратов N-алкил-
пиридиния (рис. 4).
Эквивалентная электропроводность разбавлен-
Рис. 4. Зависимости эквивалентной электропровод-
ности растворов тетрахлорферратов N-алкилпиридиния
ных растворов тетрахлорферратов N-алкилпири-
1, 3, 5, 7, 9 от концентрации в ацетонитриле при 25°С.
диния при увеличении концентрации снижается
Линиями обозначена теоретическая электропро-
(рис. 4). Значения эквивалентной электропрово-
водность, рассчитанная по формуле (4), точками -
дности для изученных соединений лежат в интер-
экспериментальные данные.
вале 135-215 См·см2·моль-1. Наибольшей электро-
проводностью из изученных тетрахлорферратов в
исследуемом диапазоне концентраций обладает
предположить, что термический распад как те-
тетрахлорферрат N-бутиронитрилпиридиния
3.
трахлорферратов, так и хлоридов N-алкилпириди-
Растворы тетрахлорферратов N-октил- и N-децил-
ния, протекает по механизму внутримолекулярно-
пиридиния обладают наименьшей электропрово-
го β-элиминирования, включающему образование
дностью с очень близкими значениями, также как
5-центрового переходного состояния с непосред-
и электропроводность растворов тетрахлорферра-
ственным участием аниона [26]. Чем больше раз-
тов N-бутил- и N-бензилпиридиния.
мер аниона, тем труднее ему участвовать в образо-
В случае ионной ассоциации при взаимодей-
вании переходного состояния и тем выше энергия
ствии ионов возможно образование новых за-
переходного состояния. В результате процесс вну-
ряженных частиц, которые вносят свой вклад в
тримолекулярного β-элиминирования при терми-
перенос заряда в растворе. В упрощенном виде
ческом разложении тетрахлорферратов затруднен,
процесс ассоциации ионной жидкости в растворе
и тем самым наблюдается их повышенная терми-
может быть выражен следующими равновесиями
ческая стабильность по сравнению с хлоридами
(1), (2):
N-алкилпиридиния (табл. 2). Исходя из получен-
ных данных, видно, что природа катиона оказыва-
K+(Solv) X−(Solv)
m
n
ет незначительное влияние на термическую ста-
1
K
a
-
бильность как хлоридов, так и тетрахлорферратов
←→K+⋅⋅⋅Solv⋅⋅⋅X
+(n+m-1)Solv,
(1)
N-алкилпиридиния. Однако стоит отметить, что
2
при увеличении длины алкильного заместителя в
-
K
a
K+⋅⋅⋅Solv⋅⋅⋅X
←→K+⋅⋅⋅X−+Solv.
(2)
катионе (от бутиронитрил- к децил-заместителю),
наблюдается повышение температур разложения
Пары обоих типов будут существовать в рас-
для тетрахлорферратов N-алкилпиридиния с 310
творе одновременно и, поскольку оба типа не яв-
до 365°С. Для хлоридов такой зависимости не на-
ляются проводниками, их нельзя различить мето-
блюдается.
дами кондуктометрии. Уравнение для суммарной
Одним из важнейших вопросов химии ионных
константы ассоциации в растворе ацетонитрила
жидкостей является их состояние в растворах.
будет иметь следующий вид (3):
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 4 2023
598
ЖУРАВЛЕВ и др.
-
Значение параметра Дебая для I-I-электролита
K+⋅⋅⋅X−+K+⋅⋅⋅Solv⋅⋅⋅X
1
1
K
=
=
K
+
K
K
2.
(3)
определяется выражением (6) [29].
a
+
-
a
a a
K
(
Solv
)
X
(
Solv
)
m
n
(6)
Cледовательно, величина Ka будет зависеть
от устойчивости обоих ассоциатов K+···X- и
где c - молярная концентрация раствора электро-
K+···Solv···X-.
лита, моль/л.
Для обработки полученных концентрационных
зависимостей эквивалентной электропроводно-
сти могут быть использованы различные уравне-
(7)
ния (Питтса, Фуосса, Онзагера, Квинта, Вилларда
и др.) [27]. Выбор конкретного теоретического
Здесь F - число Фарадея, Кл/моль; е - заряд элек-
уравнения для обработки кондуктометрических
трона, Кл; η0 - вязкость растворителя, Па с.
данных достаточно субъективный, поскольку
большинство этих уравнений дают очень близкие
Сn = f(k′, r) - коэффициенты, выраженные нели-
значения рассчитанных параметров. Одним из та-
нейными зависимостями [31].
ких уравнений, достаточно хорошо описывающих
зависимость эквивалентной электропроводности
t=k'r,
(8)
от концентрации, является уравнение Ли-Уитона
[28] в редакции Петибриджа [29], которое было
где r - параметр наибольшего сближения ионов, м.
использовано нами, а также авторами работы [30]
Обработку кондуктометрических данных для
для расчета констант ионной ассоциации (Ka) и
нахождения искомых параметров (Ka и λ0) прово-
предельной молярной электрической проводимо-
дили путем минимизации функции σ(λ) [27]:
сти (λ0) по экспериментальным кондуктометриче-
ским данным:
(9)
(4)
где x - число экспериментальных точек; y - число
неизвестных параметров.
Стандартную энергию Гиббса ассоциации рас-
Здесь λ - молярная электропроводность электро-
считывали по формуле (10). Результаты расчетов
лита, См·см2·моль-1; λ0 - предельная молярная
представлены в табл. 3.
электропроводность, См·см2·моль-1; α - степень
диссоциации электролита; β = 2q, q - критическое
∆G = -RT Ka
(10)
расстояние Бьеррума (5), м.
При увеличении длины алкильного заместите-
ля в катионе наблюдается снижение предельной
молярной электропроводности (табл. 2). Увели-
(5)
чение размера катиона приводит к снижению его
подвижности в растворе и, тем самым, снижает-
где ε - относительная диэлектрическая проница-
ся его предельная молярная электропроводность.
емость среды; ε0 - электрическая постоянная; k -
Наибольшей предельной электропроводностью
постоянная Больцмана; Т - абсолютная температу-
обладает N-бутиронитрилпиридинийтетрахлор-
ра, K.
феррат. Значения предельной электропроводности
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 4 2023
ПОЛУЧЕНИЕ, ТЕРМИЧЕСКИЕ СВОЙСТВА И ЭЛЕКТРОПРОВОДНОСТЬ Р
АСТВОРОВ
599
Таблица 3. Предельные эквивалентные электропроводности (λ0), константы ионной ассоциации (Ka), стандартные
энергии Гиббса ассоциации (ΔG°) тетрахлорферратов N-алкилпиридиния при 25°С
№
Структура катиона
λ0, См·см2·моль-1
Kа, л/моль
-ΔG°, кДж/моль
1
N+ C4H9
210±1
64±4
10.32±0.06
N+ (CH2)3CN
3
235±2
62±2
10.22±0.03
5
N+ CH2C6H5
207±2
51±5
9.76±0.10
7
N+ C8H18
189±1
50±4
9.72±0.08
9
N+ C10H21
188±1
58±3
10.06±0.05
для тетрахлорферратов N-октил- и N-децилпири-
в токе воздуха, скорость подачи воздуха
-
диния имеют очень близкие значения и совпада-
20 мл/мин, точность измерения температуры
ют в пределах погрешности, также как и значе-
±0.1°С). Элементный анализ проводили на авто-
ния электропроводности для тетрахлорферратов
матическом приборе Hewlett-Packard 185, C,H,N-
N-бутил- и N-бензилпиридиния. Для изученных
Analyser. Электропроводность растворов ионных
ионных жидкостей не наблюдается четкой зависи-
жидкостей измерена на кондуктометре Seven
мости между длиной алкильной цепи в катионе и
Go Pro Mettler Toledo при термостатировании
константами ионной ассоциации. Анализируя дан-
25±0.1°С в ацетонитриле. Относительная погреш-
ные по константам ионной ассоциации и стандарт-
ность измерения электропроводности составляла
ным энергиям Гиббса ассоциации, можно заклю-
не более 3%. Ацетонитрил марки ЧДА предвари-
чить, что наиболее ассоциированными в растворе
тельно сушили путем кипячения и последующей
ацетонитрила являются тетрахлорферраты 1 и 3.
перегонки над P4O10. Чистоту ацетонитрила кон-
тролировали по значению удельной электропро-
Это может быть обусловлено меньшими размерами
катионов, входящими в состав данных тетрахлор-
водности [κ25 (1-3)×10-8 См·см-1]. Отсутствие
галогенид-ионов, которые чаще всего являются
ферратов по сравнению с другими изученными
примесями в ионных жидкостях, контролировали
соединениями, что сказывается на способности их
по отрицательной пробе Бейльштейна. Все ион-
сближения в растворе с тетрахлорферрат-аниона-
ные жидкости сушили в вакууме при 60°С до по-
ми и образования ионных ассоциатов.
стоянной массы. Содержание примеси воды опре-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
деляли методом амперометрического титрования
по Фишеру. Для каждой ионной жидкости готови-
ИК спектры записаны на спектрометре ALPHA
ли серию растворов в концентрационном интерва-
в тонкой пленке между стеклами KBr для жид-
ле 10-2-10-3 моль/л. Измерение электропроводно-
ких соединений и в таблетках KBr - для твердых.
сти каждого раствора проводили 5 раз и находили
Спектры поглощения в видимой области записа-
среднее значение. Удельную электропроводность
ны на спектрофотометре СФ-56 в растворе ацето-
пересчитывали в эквивалентную по формуле (11).
нитрила. Длина оптического пути - 1 см. Данные
дифференциальной термогравиметрии получены
на приборе Netzsch STA 449 F3 (температурный
(11)
интервал 25-600°С, скорость нагрева - 5 град/мин
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 4 2023
600
ЖУРАВЛЕВ и др.
где λ
- эквивалентная электропроводность,
14.
Hayashi S., Saha S., Hamaguchi H. // IEEE
См·см2·моль-1; χ - удельная электропроводность,
Trans. Magn. 2006. Vol. 42. P. 12. doi 10.1109/
См/см; сM - молярная концентрация раствора,
TMAG.2005.854875
моль/л.
15.
Muraoka J., Kamiya N., Ito Y. // J. Mol. Liq. 2013.
Vol. 182. P. 76. doi 10.1016/j.molliq.2013.03.012
ИНФОРМАЦИЯ ОБ АВТОРАХ
16.
Tang Y., Hu X., Guan P., Lin X., Li X. // J. Phys. Org.
Chem. 2014. Vol. 27. P. 498. doi 10.1002/poc.3291
Журавлев Олег Евгеньевич, ORCID: https://
17.
Zakrzewska M.E.,. Paninho A.B, Molho M.F.,
orcid.org/0000-0001-6187-4287
Nunes A.V.M., Afonso C.A.M., Rosatella A.A.,
КОНФЛИКТ ИНТЕРЕСОВ
Lopes J.M., Najdanovic-Visak V. // J. Chem. Thermodyn.
2013. Vol. 63. P. 123. doi 10.1016/j.jct.2013.03.014
Авторы заявляют об отсутствии конфликта
18.
Nacham O., Clark K.D., Yu H., Anderson J.L. // Chem.
интересов.
Mater. 2015. Vol. 27. P. 923. doi 10.1021/cm504202v
19.
Borun A., Bald A. // Ionics. 2016. Vol. 22. P. 859. doi
СПИСОК ЛИТЕРАТУРЫ
10.1007/s11581-015-1613-x
1.
Seddon K.R. // J. Chem. Technol. Biotechnol.
20.
Papovic S., Gadz S., Bester-rogac M., Vranes M. //
1997. Vol. 68. P. 351. doi 10.1002/(SICI)1097-
J. Chem. Thermodyn. 2016. Vol. 102. P. 367. doi
4660(199704)68:4<351::AID-JCTB613>3.0.CO;2-4
10.1016/j.jct.2016.07.039
2.
Hallett J.P. Welton T. // Chem. Rev. 2011. Vol. 111. N 5.
21.
Lam P.H., Tran A.T., Walczyk D.J., Miller A.M., Yu L. //
P. 3508. doi 10.1021/cr1003248
J. Mol. Liq. 2017. Vol. 246. P. 215. doi 10.1016/j.
3.
Carmichael A.J. Seddon K.R.
// J. Phys.
molliq.2017.09.070
Org. Chem.
2000. Vol.
13. P.
591. doi
22.
Timperman L., Galiano H., Lemordant D., Anouti M. //
10.1002/1099-1395(200010)13:10<591::AID-
Electrochem. Commun. 2011. Vol. 13. P. 1112. doi
POC305>3.0.CO;2-2
10.1016/j.elecom.2011.07.010
4.
Clark K.D., Nacham O., Purslow J.A., Pierson S.A.
23.
Журавлев О.Е., Веролайнен Н.В., Ворончихина Л.И. //
Anderson J.L. // Anal. Chim. Acta. 2016. Vol. 934. P. 9.
ЖПХ. 2011. Т. 84. № 7. С. 1086; Zhuravlev O.E.,
doi 10.1016/j.aca.2016.06.011
Verolainen N.V., Voronchikhina L.I. // Russ. J. Appl.
5.
Hayashi S., Hamaguchi H. // Chem. Lett. 2004. Vol. 33.
Chem. 2011. Vol. 84. N 7. P. 1158. doi 10.1134/
N 12. P. 1590. doi 10.1246/cl.2004.1590
S1070427211070068
6.
Yoshida Y., Saito G. // Phys. Chem. Chem. Phys. 2010.
Vol. 12. P. 1675. doi 10.1039/B920046K
24.
Журавлев О.Е., Карпенков А.Ю., Карпенков Д.Ю.,
7.
Deng N., Li M., Zhao L., Lu C., de Rooy S.L.,
Ворончихина Л.И. // ЖОХ. 2015. Т. 85. Вып. 4.
Warner I.M. // J. Hazard. Mater. 2011. Vol. 192. P. 1350.
С. 641; Zhuravlev O.E., Karpenkov A.Yu., Karpen-
doi 10.1016/j.jhazmat.2011.06.053
kov D.Yu., Voronchikhina L.I. // Russ. J. Gen.
8.
Ko N.H., Lee J.S., Huh E.S., Lee H., Jung K.D.,
Chem. 2015. Vol. 85. N 4. P. 882. doi 10.1134/
Kim H.S., Cheong M. // Energy Fuels. 2008. Vol. 22.
S1070363215040209
P. 1687. doi 10.1021/ef7007369
25.
Crosthwaite J.M., Muldoon M.J, Dixon J.K.,
9.
Wang J., Yao H., Nie Y., Bai L., Zhang X., Li J. // Ind.
Anderson J.L., Brennecke J.F. // J. Chem.
Eng. Chem. Res. 2012. Vol. 51. P. 3776.
Thermodynamics. 2005. Vol. 37. P. 559. doi 10.1016/j.
10.
Zhang S., Zhang Y., Wang Y., Liu S., Deng Y. // Phys.
jct.2005.03.013
Chem. Chem. Phys. 2012. Vol. 14. P. 5132. doi 10.1039/
26.
Wyraykowski D., Maniecki T., Garda M., Styezen E.,
C2CP23675C
Warnke Z. // J. Therm. Anal. Calor. 2007. Vol. 90. P. 893.
11.
Bwambok D.K., Thuo M.M., Atkinson M.B.J.,
doi 10.1007/s1097300682079
Mirica K.A., Shapiro N.D., Whitesides G.M. // Anal.
27.
Сафонова Л.П., Колкер А.М. // Усп. хим. 1992.
Chem. 2013. Vol. 85. P. 8442. doi 10.1021/ac401899u
Т. 61. № 9. С. 1748; Safonova L.P., Kolker A.M. // Russ.
12.
Bica K., Gaertner P. // Eur. J. Org. Chem. 2008. Vol.
Chem. Rev. 1992. Vol. 61. N 9. P. 959. doi 10.1070/
2008. N 20. P. 3453. doi 10.1002/ejoc.200800323
13.
Valkenberg M.H, de Castro C., Holderich W.F. // Appl.
RC1992v061n09ABEH001009
Catal. (A). 2001. Vol. 215. P. 185. doi 10.1016/S0926-
28.
Lee W.H., Wheaton R.J. // Ibid.1979. Pt 2. Vol. 75. N 8.
860X(01)00531-2
P. 1128. doi 10.1039/f29797501128
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 4 2023
ПОЛУЧЕНИЕ, ТЕРМИЧЕСКИЕ СВОЙСТВА И ЭЛЕКТРОПРОВОДНОСТЬ Р
АСТВОРОВ
601
29. Pethybridge A.D., Taba S.S. // Ibid.1980. Pt 1. Vol. 76.
32. Журавлев О.Е., Веролайнен Н.В., Ворончихи-
N 9. P. 368. doi 10.1039/F19807600368
на Л.И. // ЖОХ. 2010. Т. 80. № 5. С. 854; Zhurav-
30. Короткова Е.Н. Дис. … канд. хим. наук. Москва,
2016. 164 с.
lev O.E., Verolainen, N.V., Voronchikhina, L.I. // Russ.
31. Чумак В.Л., Максимюк М.Р., Нешта Т.В.,
J. Gen. Chem. 2010. Vol. 80. N 5. P. 1025. doi 10.1134/
Босак Ю.С. // Восточно-Европейский журнал пере-
довых технологий. 2013. Т. 62. № 2/5. С. 59.
S1070363210050294
Preparation, Thermal Properties and Electrical Conductivity
of Solutions of Pyridinium Ionic Liquids
with Tetrachloroferrate Anion
O. E. Zhuravleva,*, A. D. Kaftanova, and G. S. Yulmasova
a Tver State University, Tver, 170002 Russia
*e-mail: pifchem@mail.ru
Received February 19, 2023; revised April 4, 2023; accepted April 5, 2023
Thermal stability of N-alkylpyridinium tetrachloroferrates(III) [C5H5NR]FeCl4 [R = C4H9, (CH2)3CN, CH2C6H5,
C8H17, C10H21] in air in the range of 25-600°C was studied, as well as the thermal stability of N-alkylpyridinium
chlorides. The equivalent electrical conductivity of N-alkylpyridinium tetrachloroferrates(III) in acetonitrile
solution at 25°C was investigated. The ionic association constants Ka, the limiting molar electrical conductivity
(λ0) and the standard Gibbs energy of the association (ΔG°) in acetonitrile solutions were calculated based on
conductometric data by the Lee-Wheaton method.
Keywords: ionic liquids, thermal stability, electrical conductivity, association, acetonitrile
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 4 2023