ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 5, с. 695-710
УДК 547.796.1
СИНТЕЗ И ИССЛЕДОВАНИЕ СВОЙСТВ НОВЫХ
ТЕТРАЗОЛСОДЕРЖАЩИХ ПРОИЗВОДНЫХ
МОРФОЛИН-4-ИЛ-1,3,5-ТРИАЗИНА И
4-МЕТИЛПИПЕРИДИН-1-ИЛ-1,3,5-ТРИАЗИНА
© 2023 г. О. В. Миколайчук1,2,*, А. В. Протас1,2, Е. А. Попова1,2, М. Д. Лутцев1,
Е. Ю. Смирнов3,4, В. А. Голотин1,3, В. А. Островский5, И. В. Корняков6,
К. Н. Семенов1,2,5,6, В. В. Шаройко1,2,6, O. Е. Молчанов2, Д. Н. Майстренко2
1 Первый Санкт-Петербургский государственный медицинский университет имени академика И. П. Павлова,
ул. Л. Толстого 6-8, Санкт-Петербург, 197022 Россия
2 Российский научный центр радиологии и хирургических технологий имени академика А. М. Гранова
Министерства здравоохранения Российской Федерации, Санкт-Петербург, 197758 Россия
3 Государственный научно-исследовательский институт озерного и речного рыбного хозяйства,
Санкт-Петербург, 199004 Россия
4 Институт цитологии Российской академии наук, Санкт-Петербург, 194064 Россия
5 Санкт-Петербургский государственный технологический институт (технический университет),
Санкт-Петербург, 190013 Россия
6 Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*е-mail: olgamedchem@gmail.com
Поступило в редакцию 8 марта 2023 г.
После доработки 4 апреля 2023 г.
Принято к печати 12 апреля 2023 г.
Синтезированы новые тетразолсодержащие производные морфолин-4-ил-1,3,5-триазина и 4-метилпипе-
ридин-1-ил-1,3,5-триазина. Методом МТТ-теста исследована цитотоксическая активность полученных
соединений в отношении опухолевых клеточных линий печени человека Huh-7 и легкого человека А549.
Показано, что данные вещества не проявляют выраженного цитотоксического действия. Наиболее зна-
чительную противоопухолевую активность проявил 1,3,5-триазин, содержащий в качестве заместителей
5-фенилтетразол-2-илацетогидразидный фрагмент и 4-метилпиперидиновый цикл, а также 1,3,5-триазин,
содержащий 5-метил-1H-тетразол-1-илацетогидразидный фрагмент и два морфолиновых цикла. Для дан-
ных соединений методом УФ спектроскопии было изучено взаимодействие с ДНК. Для N’-(4,6-диморфо-
лино-1,3,5-триазин-2-ил)-2-(5-метил-1H-тетразол-1-ил)ацетогидразида определена константа связывания
с ДНК (Kbin 9.02·104 М.-1) и изучена способность ингибировать тирозинкиназный домен поверхностных
рецепторов. Показано, что исследованные тетразолсодержащие производные 1,3,5-триазина не проявля-
ют антиоксидантных свойств в отношении NO-радикалов и не вызывают фотоиндуцированный гемолиз.
Ключевые слова: 1,3,5-триазин, 5-арилтетразолы, 5-метил-1H-тетразол-1-илацетогидразид,
5-фенил-2H-тетразол-2-илацетогидразид, цитотоксическая активность, ингибирующая активность
DOI: 10.31857/S0044460X23050050, EDN: DBSPYI
Производные 1,3,5-триазина проявляют раз-
и др.) и широко используются в современной
личные виды биологической активности (проти-
медицинской химии при разработке разнообраз-
воопухолевую, антибактериальную, противови-
ных активных фармацевтических субстанций [1].
русную, противовоспалительную, фунгицидную
Так, одним из перспективных направлений при-
695
696
МИКОЛАЙЧУК и др.
Схема 1.
O
O
O
O
OH
O
N
N
Ph
N
N
N
N
N
N
N
N
NH
N
N
NH
O NN
N N
N N
N N
N N
N
N
N
N
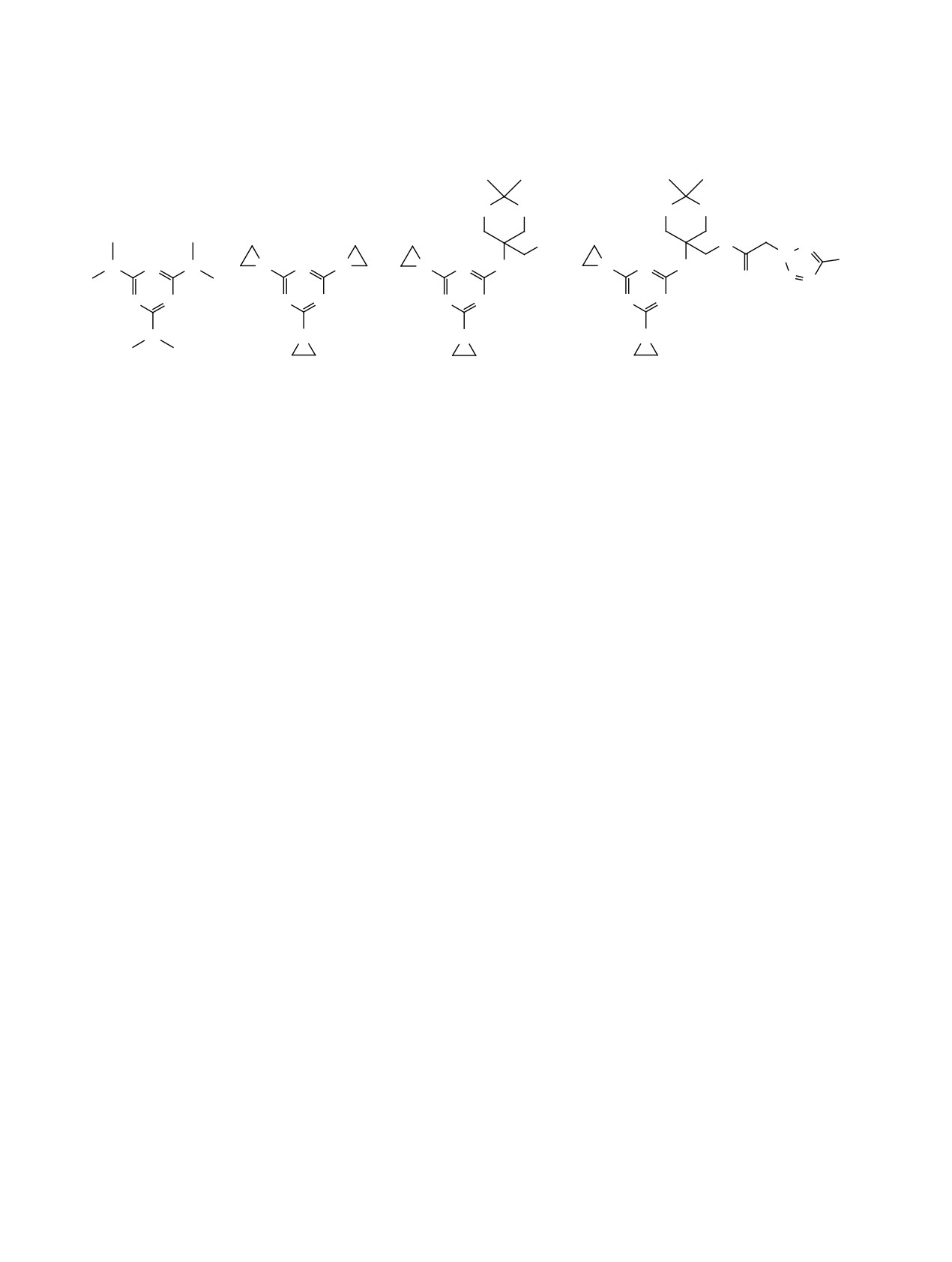
Алтретамин
Третамин
I
II
менения
1,3,5-триазинов является получение
фрагмента. Так, общепризнанным фармакофор-
высокоэффективных цитостатиков [1, 2]. Цито-
ным фрагментом является тетразольный цикл,
токсическая активность
1,3,5-триазинов может
который рассматривают как биоизостерический,
быть обусловлена их действием на различные
метаболически стабильный аналог цис-амидной
биологические мишени опухолевых клеток [3].
или карбоксильной групп [6-9]. Тетразолы явля-
Например, такие производные
1,3,5-триазина,
ются важными фармакофорами и проявляют раз-
как алтретамин (N2,N2,N4,N4,N6,N6-гексаме-
личные виды биологической активности [6-8].
тил-1,3,5-триазин-2,4,6-триамин),
третамин
Cтоит отметить, что к настоящему времени не
(2,4,6-триэтиленимино-1,3,5-триазин),
описаны случаи того, что введение тетразольного
(5-{[4,6-бис(азиридин-1-ил)-1,3,5-триазин-2-ил]-
цикла в структуру биологически активного веще-
амино}-2,2-диметил-1,3-диоксан-5-ил)метанол I,
ства или замена в молекуле субстрата, например,
являются алкилирующими агентами [4] (схема 1).
амидной или карбоксильной группы, теразолиль-
Метаболиты данных веществ образуют ковалент-
ным фрагментом, приводит к увеличению ток-
ные связи с молекулами ДНК в том числе опухоле-
сичности. Более того, известен факт, когда замена
вых клеток, препятствуя репликации ДНК [5].
азидной группы на тетразольный цикл приводит к
существенному снижению токсичности без поте-
Стоит отметить, что в ряде случаев оказывает-
ся эффективным получение гибридных молекул,
ри биологической активности [10]. Однако клю-
чевым моментом в ряде случаев при разработке
содержащих в своей структуре два и более гете-
роциклических фрагмента. Более того, известен
фармацевтических агентов является тот факт, что
введение тетразольного кольца в субстраты делает
факт, когда замена азидной группы на тетразоль-
продукты устойчивыми к действию разрушающих
ный цикл приводит к существенному снижению
ферментов. Это позволяет существенно снизить
токсичности без потери биологической активно-
дозировку препарата и, следовательно, уменьшить
сти [6]. Однако в ряде случаев ключевым момен-
токсическое воздействие на организм [6].
том при разработке фармацевтических агентов
является тот факт, что введение тетразольного
Ранее нами было показано, что введение
кольца в субстраты делает продукты более устой-
5-фенилтетразол-2-илацетильного фрагмента в
чивыми к действию разрушающих ферментов. Это
структуру цитостатика
(5-{[4,6-бис(азиридин-1-
позволяет впоследствии существенно снизить до-
ил)-1,3,5-триазин-2-ил]амино}-2,2-диметил-1,3-
зировку препарата и, следовательно, уменьшить
диоксан-5-ил)метанола 1 привело к увеличению
токсическое воздействие на организм. Стоит от-
противоопухолевой активности полученного
метить, что в ряде случаев оказывается эффектив-
[({5-[4,6-ди(азиридин-1-ил)-1,3,5-триазин-2-ил]-
ным получение гибридных молекул, содержащих
амино}-2,2-диметил-1,3-диоксан-5-ил)метил-2-(5-
в своей структуре два и более гетероциклических
фенил-2H-тетразол-2-ил)]ацетата 2 (схема 1) в от-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
СИНТЕЗ И ИССЛЕДОВАНИЕ СВОЙСТВ
697
Схема 2.
ношении опухолевой клеточной линии SK-HEP-1
p110β, p110γ и p110δ с IC50 16, 44, 5 и 49 нМ. со-
[4].
ответственно. Также 1,3,5-триазин ZSTK 474 при
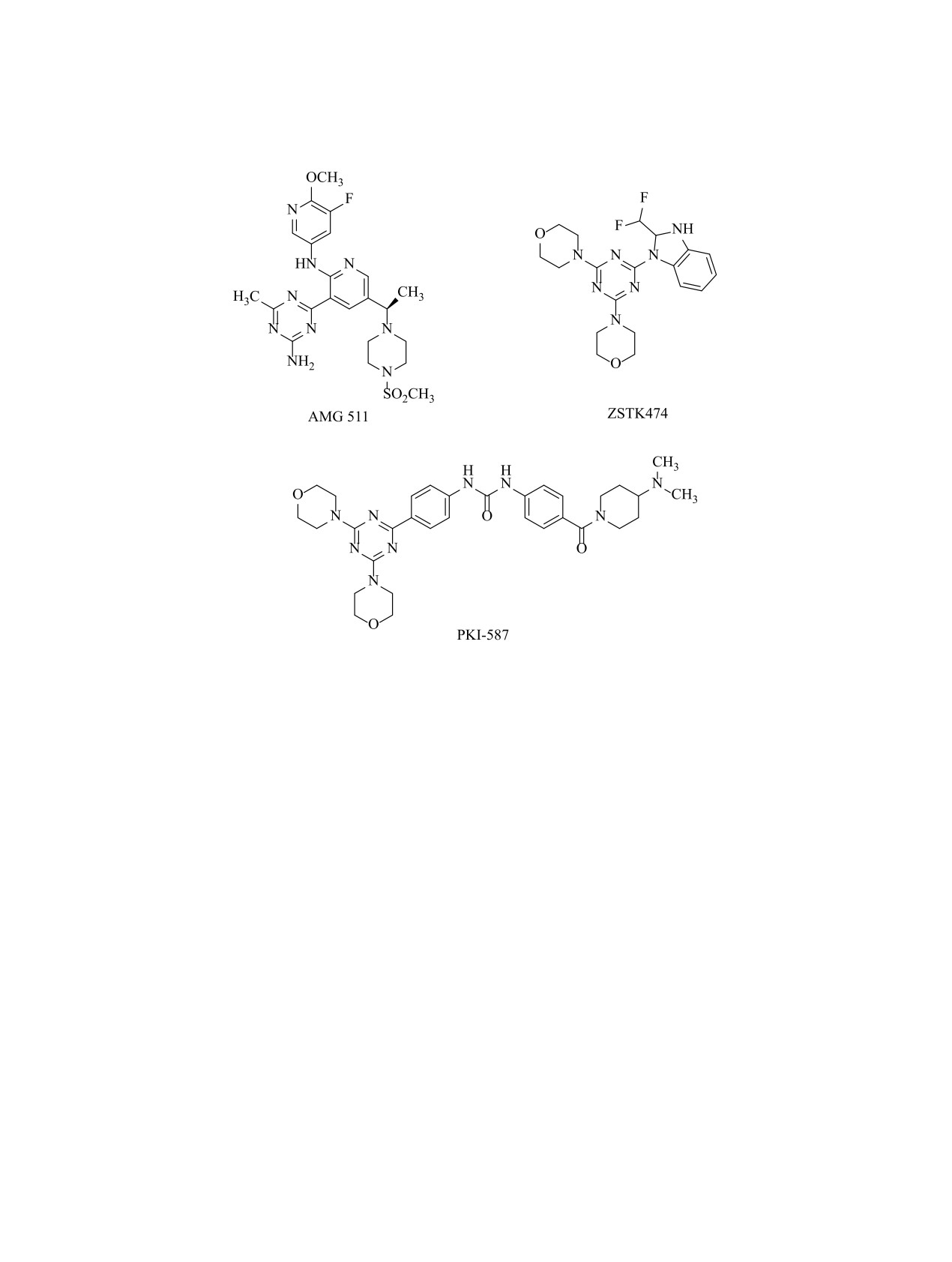
Также в настоящее время активно развивается
пероральном введении показал высокую противо-
направление, связанное с синтезом производных
опухолевую активность за счет подавления фос-
форилирования Akt без токсических эффектов на
1,3,5-триазина, которые являются ингибиторами
киназ. Показано, что цитостатические агенты на
моделях мешей с ксенографтами опухолей чело-
основе 1,3,5-триазинов могут воздействовать на
века [11]. Бисморфолино-1,3,5-триазин PKI-587
опухолевые клетки за счет связывания со специ-
ингибирует pan-PI3K/mTOR (схема 2). Показано,
фическими сайтами киназ, таких как PI3K, EGFR,
что в данных соединениях морфолиновый фраг-
ROCK и др. [2, 11]. Высокую ингибирующую
мент играет важную роль. Атомы кислорода мор-
активность показали производные 1,3,5-триази-
фолиновых циклов участвуют в образовании во-
на, содержащие в качестве заместителей пипери-
дородных связей в ключевой шарнирной области
диновые и морфолиновые фрагменты [12]. Так,
АТФ-связывающего кармана обоих ферментов,
AMG 511, ZSTK 474 (схема 2) ингибиторы PI3K
как фосфоинозитид-3-киназы PI3K пан-класса I,
пан-класса I дошли до стадии клинических ис-
так и mTOR [15].
пытаний [13]. 1,3,5-Триазин AMG 511 продемон-
В данной работе синтезированы и охарактеризо-
стрировал значительную противоопухолевую ак-
ваны новые производные морфолин-4-ил-1,3,5-три-
тивность in vivo, обусловленную блокированием
азина и
4-метилпиперидин-1-ил-1,3,5-триази-
пути PI3K (EC50 228 нг/мл на модели печени мыши)
на, содержащие в
1,3,5-триазиновом цикле в
[11, 14].
качестве заместителей
5-арилтетразолильный,
1,3,5-Триазин ZSTK 474 является АТФ-конку-
5-метил-1H-тетразол-1-илацетогидразидный
и
рентным ингибитором киназ и ингибирует p110α,
5-фенил-2H-тетразол-2-илацетогидразидный
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
698
МИКОЛАЙЧУК и др.
Схема 3.
Cl
Cl
N
N
N
N
N
N
N
R
ацетон, Et3N
Cl
N N
+
N
2-4°C, 5 ч
N
NH
N
Cl
N
Cl
1
2-4
5-7
R
R = Ph [2, 5 (84%)], 2-OH-C6H4 [3, 6 (68%)], 3-NO2-4-OH-C6H3 [4, 7 (55%)].
фрагменты. Методом МТТ-теста исследована ци-
дом 5-фенилтетразол-2-илуксусной кислоты
10
тотоксическая активность полученных соедине-
в диоксане в присутствии K2CO3 были получе-
ний в отношении опухолевых клеточных линий
ны соединения 9 и 11 соответственно, в которых
Huh-7 и А549. Для соединений, показавших наи-
тетразольный цикл связан с 1,3,5-триазином через
большее цитотоксическое действие, методом УФ
линкерную ацетогидразидную группу (cхема 4).
спектроскопии изучено взаимодействие с ДНК.
Взаимодействием цианурхлорида 1 с 4-(три-
Для N′-(4,6-диморфолино-1,3,5-триазин-2-ил)-2-
фторметил)анилином было получено соединение
(5-метил-1H-тетразол-1-ил)ацетогидразида изуче-
12, которое затем было введено в реакции с гидра-
на способность ингибировать тирозинкиназный
зидом 5-метилтетразол-1-илуксусной кислоты 8 и
домен поверхностных трансмембранных рецепто-
гидразидом 5-фенилтетразол-2-илуксусной кисло-
ров клеток линии Huh-7 - EGFR и Her-2. Кроме
ты 10 для синтеза дизамещенных 1,3,5-триазинов
того, для некоторых тетразолсодержащих произ-
13 и 14 соответственно (cхема 5).
водных 1,3,5-триазинов проведено исследование
Полученные соединения 5-7, 9, 11, 13, 14 да-
антиоксидантных свойств.
лее были использованы для синтеза производных
Синтез тетразолсодержащих производных
морфолин-4-ил-1,3,5-триазинов и 4-метилпипери-
морфолин-4-ил-1,3,5-триазина и
4-метилпи-
дин-1-ил-1,3,5-триазинов (cхемы 6, 7). Так, синтез
перидин-1-ил-1,3,5-триазина. Для синтеза за-
соединений 15-20, 22, 23 проводили в ацетоне с
мещенных 1,3,5-триазинов в качестве исходного
добавлением водного раствора NaOH (10 мас%),
реагента использовали доступный цианурхлорид
вводя в реакцию морфолин или 4-метилпипери-
1. Варьируя температурный режим реакции, про-
дин соответственно, и выдерживали реакционную
водили последовательное нуклеофильное заме-
смесь сначала при комнатной температуре в те-
щение атомов хлора цианурхлорида 1 на тетразо-
чение 20 ч (в случае соединений 22, 23 в течение
лильные, морфолиновые и 4-метилпиперидиновые
14 ч), а затем в течение 4 ч при 50°С (табл. 1). При
фрагменты. Так, взаимодействием цианурхлорида
получении 1,3,5-триазина 21 в качестве раствори-
1 с 5-арилтетразолами 2-4 были получены про-
теля использовали диоксан.
изводные 1,3,5-триазина 5-7, содержащие в ци-
Полученные соединения были охарактеризо-
кле 5-арилтетразолильные заместители (схема 3).
ваны методами спектроскопии ЯМР 1Н и 13С{H},
Данные реакции проводили в ацетоне в присут-
масс-спектрометрии и элементного C,H,N-ана-
ствии триэтиламина в соответствии с методикой,
лиза. Структура соединений 9 и 12 также была
описанной нами ранее для синтеза соединения 5,
подтверждена данными РСА. В спектрах ЯМР
увеличив реакционное время с 3 до 5 ч [16].
13С{H} замещенных 1,3,5-триазинов 5-7, 9, 11-23
Реакцией цианурхлорида 1 с гидразидом 5-ме-
в зависимости от типа заместителей наблюдаются
тилтетразол-1-илуксусной кислоты 8 и гидрази-
сигналы атомов углерода триазинового цикла при
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
СИНТЕЗ И ИССЛЕДОВАНИЕ СВОЙСТВ
699
Схема 4.
N
O
N
N
H2N
N
Cl
N
H
8
N
N
H
N
Cl
N
N
N
Ph
H
N
O
K2CO3, диоксан
N N
N
9 (77%)
1
N
0-20oC, 4 ч
H2N NH
N N
Cl
CCDC 2236408 для 9
O
10
N
N
H
N
N
Cl
N
N
N
Ph
H
O
N
N
11 (80%)
Схема 5.
Cl
F3C
8
N
N
H
N
N
N
N N
N
H
H
N
Cl
O
N
H2N
CF3
F3C
K2CO3, диоксан
13 (69%)
N
N
1
20°C, 6 ч
K2CO3, диоксан
Cl
N
N
Cl
H
F3C
2-4oC, 3 ч
N
N
10
H
12 (83%)
N
N
N
N N
N
H
H
N
O N
14 (82%)
Ph
CDCC 2235654 для 12
153.1-172.1 м. д. Для 1,5-дизамещенного тетразо-
ляются при 3.46-3.59 и 3.61-3.78 м. д., 4-метил-
льного цикла в соединениях 9, 13, 19 и 22 прояв-
пиперидиновых циклов - при 1.51-1.72 и 2.59-
ляются сигналы атомов углерода при 153.9, 154.7,
2.91 м. д. В спектрах ЯМР 13С{H} производных мор-
153.7 и 154.3 м. д. соответственно, а для 2,5-диза-
фолин-4-ил-1,3,5-триазина 15, 18-20, 22 и 23 на-
мещенного цикла в соединениях 5-7 , 11, 14, 15-
блюдаются соответствующие сигналы эндоцикли-
18, 20, 21, 23 - при 164.0-165.0 м. д. В спектрах
ческих атомов углерода морфолиновых циклов при
ЯМР 1Н соединений 15, 18-20, 22 и 23 протоны
43.7-48.7 м. д. и 66.4-68.7 м. д., а в производных
метиленовых групп морфолиновых циклов прояв-
4-метилпиперидин-1-ил-1,3,5-триазина 16, 17, 21 -
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
700
МИКОЛАЙЧУК и др.
Таблица 1. Выходы соединений 15-21
№
R1
R2
R3
Выход, %
Ph
15
N
O
Cl
75
N
N
N
N
16
N
75
N
N
N
17
Cl
68
N N
HO
N
N
OH
18
Cl
58
N N
NO2
N
O
N O
H
N
19
N
N
79
N
N
H
N
O
20
72
Ph
O
N
H
N
N
N
21
N
N
54
N
N
H
4-метилпиперидиновых циклов при
30.8-31.2,
тетразол-1-илацетогидразидный фрагмент и мор-
33.9-34.1 и 54.1-56.3 м. д.
фолиновые циклы, а также соединение 21, содер-
жащее
5-фенилтетразол-2-илацетогидразидный
Влияние тетразолсодержащих производных
фрагмент и 4-метилпиперидиновые циклы. При
морфолин-4-ил-1,3,5-триазина и 4-метилпипе-
ридин-1-ил-1,3,5-триазина на выживаемость
инкубации клеточных линий Huh-7 и А549 в тече-
ние 48 ч с соединениями 19 и 21 (с 100.0 мкМ.) вы-
опухолевых клеточных линий Huh-7 и А549. В
живаемость клеток составляла (49±6)% и (51±8)%
данной работе методом МТТ-теста исследована
для соединения 19 и (46±7)% и (48±7)% для соеди-
цитотоксическая активность соединений 15-23 в
нения 21 соответственно.
отношении опухолевых клеточных линий печени
человека Huh-7 и легкого человека А549. Прове-
Исследование взаимодействия тетразолсо-
денные исследования показали, что соединения
держащих производных 1,3,5-триазина 9,
19
15-23 in vitro не проявляют выраженного цито-
и 21 с ДНК методом УФ спектроскопии. Как
токсического действия в отношении исследуемых
отмечено выше, один из возможных механиз-
клеточных линий. Наиболее значительную цито-
мов цитотоксического действия производных
токсическую активность проявил 1,3,5-триазин
1,3,5-триазина основан на взаимодействии дан-
19, содержащий в качестве заместителей 5-метил-
ных соединений или их метаболитов с молеку-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
СИНТЕЗ И ИССЛЕДОВАНИЕ СВОЙСТВ
701
Схема 6.
R1
R1
B, ацетон (диоксан для 21),
N
N
NaOH (водн., 10 мас%)
N
N
20 ч, 20oC; 4 ч, 50oC
R3
N
R2
Cl
N
Cl
5-7, 9, 11
15-21
B = морфолин (15, 18-20) или 4-метилпиперидин (16, 17, 21).
Схема 7.
O
N
морфолин, ацетон,
NaOH (водн., 10 мас%)
F3C
N
N
13 или 14
H
14 ч, 20оС;
N R
4 ч, 50oC
N
N N
H
H
O
22, 23 (52%)
Ph
N
N
R =
N
N
(22);
N (23).
N
N
N
лами ДНК опухолевых клеток, которое приводит
вождаться уменьшением оптической плотности
к повреждению и нарушению репликации ДНК
раствора с бато- или гипсохромным сдвигом поло-
[1, 2]. В данной работе методом УФ спектроскопии
сы спектра поглощения [17-19].
исследовано взаимодействие тетразолсодержащих
На рис. 1 представлены рассчитанные спек-
производных 1,3,5-триазина 9, 19 и 21 с ДНК. На-
тры поглощения ДНК в 0.9%-ных водных рас-
личие в молекуле ДНК хромофорных групп азоти-
творах NaCl при постоянной концентрации ДНК
стых гетероциклических оснований обуславлива-
(5.7 мкM.) и различных концентрациях соединений
ет присутствие в УФ спектрах водных растворов
9 (рис. 1а), 19 (рис. 1б) и 21 (рис. 1в). Установлено,
ДНК в диапазоне от 200 до 350 нм широкой по-
что при увеличении концентрации 1,3,5-триазинов
лосы поглощения с максимумом поглощения при
9, 19 и 21 в УФ спектрах наблюдается гиперхром-
260 нм. Как правило, взаимодействие биологи-
ный эффект. При этом в случае добавления к рас-
чески активного вещества с биополимером в во-
твору ДНК дихлорзамещенного 1,3,5-триазина 9,
дных растворах 0.9% NaCl при pH 7.4 приводит
содержащего
5-метилтетразол-1-илацетогидра-
к характеристичным изменениям в электронных
зидный фрагмент, также наблюдается появление
спектрах поглощения ДНК [17]. Характер данных
максимума поглощения при 343 нм. Таким обра-
спектральных изменений обусловлен типом вза-
зом, принимая во внимание незначительные из-
имодействия вещества с ДНК. Так, бороздочное
менения спектральных характеристик растворов
связывание может приводить к гиперхромному
ДНК, тем не менее нельзя исключать возможность
эффекту, а интеркаляция, наоборот, может сопро-
взаимодействия 1,3,5-триазинов 9, 19 и 21 с биопо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
702
МИКОЛАЙЧУК и др.
Рис. 2. Cпектр поглощения соединения 19 (2.3 мкM.)
при различных концентрациях ДНК (с 3.1-5.2 мкМ.).
лимером с образованием ассоциатов.
Также были получены УФ спектры ДНК при
различных концентрациях (3.1, 3.3, 3.8, 4.7, 5.0,
5.2 мкМ.) в присутствии соединения 19 (2.3 мкM.)
в 0.9%-ном растворе NaCl, pH 7.4 (рис. 2).
Используя полученные данные, для 1,3,5-три-
азина 19 с ДНК была построена зависимость
Вольфа-Шиммера и рассчитаны величины Kbin с
использованием уравнения Вольфа-Шиммера (1)
[20].
(1)
где Kbin - константа связывания; [ДНК] - равновес-
ная концентрация ДНК, εa, εf и εb - коэффициенты
молярной экстинкции (Aнабл/[M]), коэффициент
молярной экстинкции несвязанного соединения 19
и коэффициент молярной экстинкции соединения
19, полностью связанного с ДНК соответственно.
) от [ДНК] является
Зависимость [ДНК]/(εa - εf
Рис. 1. Рассчитанные спектры поглощения ДНК
линейной (y = -0.3961х + 7.855, R2 0.946). Полу-
(с 5.7 мкМ.) в присутствии соединений 9 (а), 19 (б)
и 21 (в) при различных концентрациях (с 0, 0.57-
ченное значение Kbin 9.02×104 М.-1 подтверждает
14.25 мкМ.). Арасч = Анабл - Асоед, где Анабл - наблюдаемое
возможное взаимодействие 1,3,5-триазина 19 с
значение оптической плотности раствора ДНК в при-
ДНК. Принято считать, что при сильном взаимо-
сутствии 1,3,5-триазина 9, 19 или 21; Асоед - значение
действии вещества с ДНК константа связывания
оптической плотности раствора соединения 9, 19 или
21, определенное из зависимости Бугера-Ламберта-
Kbin находится в диапазоне 105-108 М.-1 [21]. Низ-
Бера.
кое значение полученной константы связывания
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
СИНТЕЗ И ИССЛЕДОВАНИЕ СВОЙСТВ
703
Рис. 3. Результаты иммуноблоттинга лизатов клеток
линии Huh-7 после инкубации клеток в течение 6 ч с
Рис. 4. Влияние соединения 9 на захват NO-радикалов
соединением 19 (с 1-50 мкМ.).
(светло-серый) и азида натрия (темно-серый).
может свидетельствовать о возможности неко-
олсодержащие дихлорзамещенные 1,3,5-триазины
валентного бороздочного связывания, как было
5 и 9 не поглощают NO-радикалы и не облада-
показано в работе [21] для пиразолсодержащих
ют антирадикальной активностью в отношении
1,3,5-триазинов.
NO-радикалов (рис. 4). Введение в s-триазиновый
цикл двух 4-метилпиперидиновых (соединение
Исследование ингибирующего действия
16) и морфолиновых заместителей (соединение
1,3,5-триазина 19 в отношении тирозинкиназ-
19) не оказало влияния на связывание NO-радика-
ного домена поверхностных рецепторов. На мо-
дельном соединении 19 была изучена способность
лов. Полученные данные для соединений 9, 16 и
19 аналогичны данным, представленным на рис. 4.
оказывать ингибирующее действие в отношении
фосфорилирования тирозинкиназного домена
Влияние тетразолсодержащих производных
трансмембранных рецепторов клеток Huh-7
-
1,3,5-триазина 19 и 21 на фотоиндуцированный
EGFR и Her-2. Результаты иммуноблоттинга с
гемолиз эритроцитов человека. В связи с тем, что
использованием специфических антител против
биологически активные вещества могут вызывать
pEGFR (Tyr-1068) и pHer-2 (Tyr-877 и Tyr-1248)
гемолиз, который зачастую приводит к анемии,
показали отсутствие выраженного ингибирования
гипертонии и почечной токсичности у пациентов,
фосфорилирования тирозинкиназного домена в
определение гемосовместимости входит в число
присутствии соединения 19 в концентрациях 1 и
основных тестов при определении биосовмести-
10 мкМ. (рис. 3).
мости потенциальных лекарственных средств.
Антиоксидантная активность. Изучение
На рис. 5 представлена концентрационная за-
взаимодействия тетразолсодержащими про-
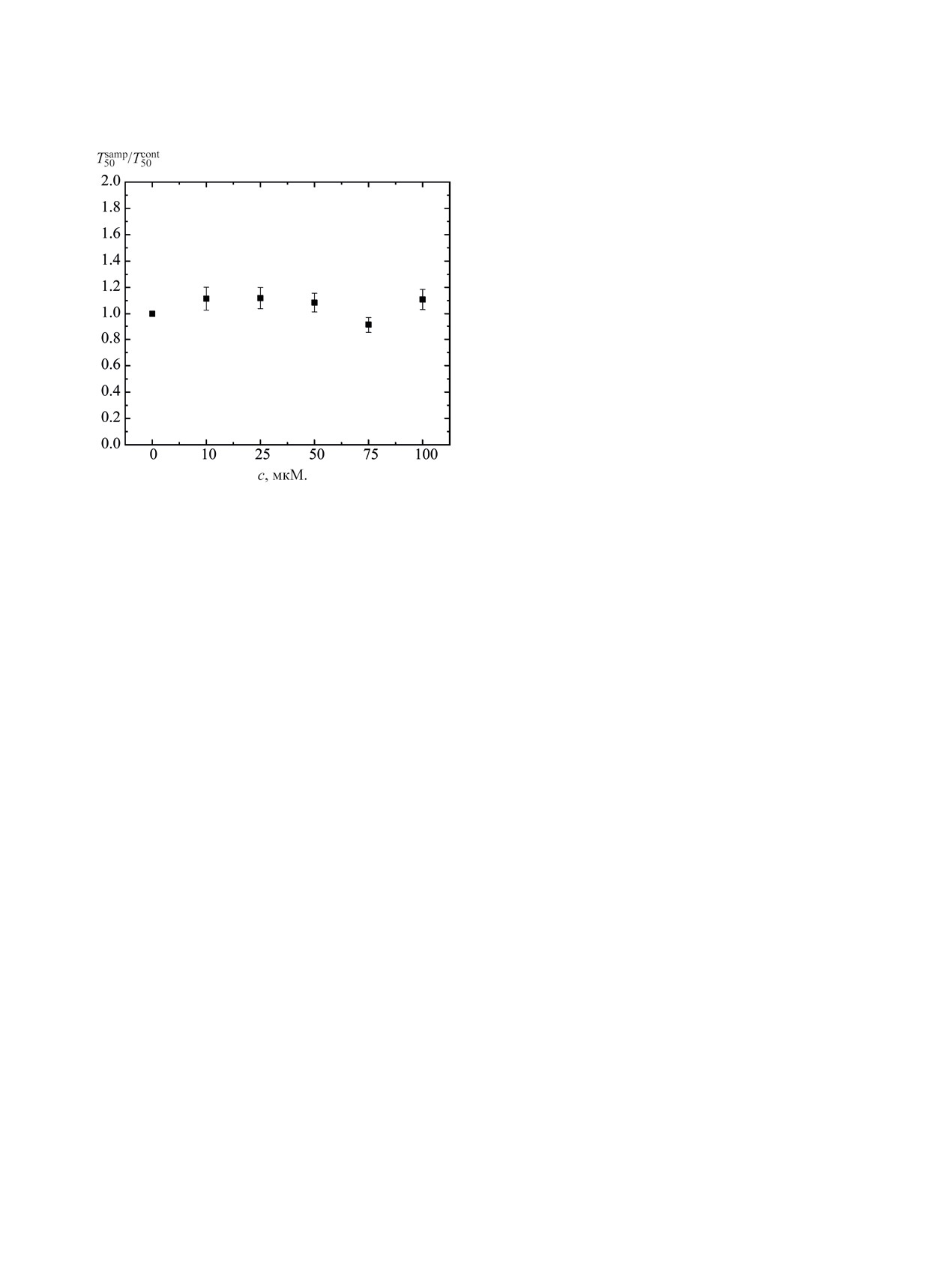
висимость степени фотоиндуцированного гемо-
изводных 1,3,5-триазина 5, 9, 16 и 19 с NO-ра-
лиза от концентрации вещества 21. Аналогичный
дикалами. На модельных соединениях 5, 9, 16 и
характер зависимости также наблюдался для сое-
19 было проведено исследование связывания тет-
динения 19. Таким образом, полученные экспери-
разолсодержащими производными 1,3,5-триазина
ментальные данные свидетельствуют о том, что
NO-радикалов в сравнении с азидом натрия. Полу-
тетразолсодержащие производные 1,3,5-триазина,
ченные данные свидетельствуют о том, что тетраз-
содержащие в качестве заместителей морфолино-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
704
МИКОЛАЙЧУК и др.
да может указывать на нековалентный тип данного
взаимодействия по типу бороздочного связывания.
На примере модельных соединений - тетразолсо-
держащих производных 1,3,5-триазина - показано,
что данные вещества не проявляют антиоксидант-
ных свойств, не вызывают фотоиндуцированный
гемолиз и оказывают незначительное ингибирую-
щее действие в отношении тирозинкиназного до-
мена трансмембранных рецепторов клеток Huh-7 -
EGFR и Her-2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1H и 13C{1H} зарегистриро-
ваны на приборе Bruker Avance III 400 (400.13 и
100.61 МГц соответственно) в СDCl3 и ДМСО-d6
при 25°C. Масс-спектральный анализ выполнен на
приборе Bruker Daltonik GmbH MaXis (Германия).
Рис. 5. Концентрационная зависимость степени фо-
УФ спектры зарегистрированы в диапазоне 200-
тоиндуцированного гемолиза в присутствии вещества
21. с - молярная концентрация соединения 21, Т50samp -
400 нм на спектрофотометре Beckman Coulter DU
время фотоиндуцированного гемолиза 50% эритро-
800 с использованием кварцевых кювет (l 1 см).
цитов в присутствии соединения 21, T50control - время
Общая методика синтеза соединений 5-7. К
фотоиндуцированного гемолиза 50% эритроцитов в
присутствии физиологического раствора.
раствору цианурхлорида (3.3 ммоль) в 40 мл ацето-
на добавляли раствор соответствующего 5-арилте-
тразола (3.6 ммоль) в 20 мл ацетона и триэтиламин
(4.1 ммоль). Реакционную смесь перемешивали
вые циклы 19 и 4-метилпиперидиновые циклы 21,
в течение 5 ч при 2-4°С. По окончании времени
не проявляют антиоксидантной активности и не
выдержки выпавшие в осадок продукты соедине-
оказывают влияния на фотоиндуцированный ге-
ний 5 и 6 отфильтровывали, промывали водой и
молиз.
сушили в токе воздуха. При получении соедине-
ния 7 реакционную смесь по окончании времени
Таким образом, синтезированы и охарактери-
выдержки упаривали при пониженном давлении.
зованы новые тетразолсодержащие производные
Продукт 7 очищали методом колоночной хромато-
морфолин-4-ил-1,3,5-триазина и
4-метилпипе-
графии (хлороформ-метанол, 9.5:0.5).
разин-1-ил-1,3,5-триазина. Наиболее заметный
цитотоксический эффект в отношении опухоле-
2,4-Дихлор-6-(5-фенил-2H-тетразол-2-ил)-
вых клеточных линий Huh-7 и А549 проявили
1,3,5-триазин (5). Выход 0.82 (84%). Описание и
1,3,5-триазин 19, содержащий в качестве заме-
спектральные характеристики соединения 5 со-
стителей 5-метилтетразол-1-илацетогидразидный
впадают с опубликованными в работе [16].
фрагмент и морфолиновые циклы, а также сое-
2-[2-(4,6-Дихлор-1,3,5-триазин-2-ил)-2H-те-
динение 21, содержащее 5-фенилтетразол-2-ила-
тразол-5-ил]фенол (6). Выход 0.7 г (68%), бе-
цетогидразидный фрагмент и 4-метилпипериди-
лые кристаллы, т. пл. 181-183°С. Спектр ЯМР 1H
новые циклы. Показано, что данные соединения
(ДМСО-d6), δ, м. д.: 7.97 д. д (1H, CHPh, J 7.8, 1.6
вызывают изменения спектральных характери-
Гц), 7.42-7.37 м (1H, CHPh), 7.13-6.99 м (1H, CHPh).
стик растворов ДНК, что может свидетельствовать
Спектр ЯМР 13C (ДМСО-d6), δС, м. д.: 168.1 (Cтри-
о взаимодействии их с биополимером. При этом
), 164.3 (CN4), 148.1 (CPh), 131.0 (CHPh), 129.9
азин
значение константы связывания с ДНК (Kbin 9.02×
(CHPh), 120.4 (CPh), 118.3 (CHPh). Найдено, %: C
104 М.-1) для N′-(4,6-диморфолино-1,3,5-триазин-
38.48; H 1.89; N 31.39. C10H5Cl2N7O. Вычислено,
2-ил)-2-(5-метил-1H-тетразол-1-ил)ацетогидрази-
%: C 38.73; H 1.63; N 31.62.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
СИНТЕЗ И ИССЛЕДОВАНИЕ СВОЙСТВ
705
4-[2-(4,6-Дихлор-1,3,5-триазин-2-ил)-2H-те-
8.82 с (1H, NH), 7.77-7.65 м (2H, CHPh), 7.65-7.62
тразол-5-ил]-2-нитрофенол
(7). Выход
0.64 г
м (2H, CHPh). Спектр ЯМР 13C (ДМСО-d6), δС,
(55%), желтые кристаллы, т. пл.
193-195°С.
м. д.: 154.6 (Cтриазин), 153.1 (Cтриазин), 141.6 (CPh),
Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 8.03 с (1H,
128.8 (CPh), 128.6 (CHPh), 126.6 (CHPh),
124.2
CHPh), 7.83 д (1H, CHPh, J 7.7 Гц), 7.38 д (1H, CHPh,
(CF3), 120.9 (CHPh). Найдено, %: C 37.98; H 1.69;
J 7.1 Гц). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.:
N 18.14. C10H5Cl2F3N4. Вычислено, %: C 38.86; H
169.9 (Cтриазин), 169.4 (Cтриазин), 164.3 (CN4), 154.0
1.63; N 18.13. Структура моноклинная, P21/n (no.
(CPh), 138.2 (CHPh), 134.5 (CPh), 126.5 (CPh), 118.0
14), a 7.1447(2) Å, b 8.1567(2) Å, c 19.6791(6) Å, β
(CHPh), 113.6 (CHPh). Найдено, %: C 33.66; H 1.19;
96.337(3)°, V 1139.83(6) Å3, Z 4, T 100(2) K, μ(CuKα)
N 31.47. C10H4Cl2N8O3. Вычислено, %: C 33.82; H
5.463 мм-1, dвыч 1.801 г/см3, 7347 отражений
1.14; N 31.56.
(9.042° ≤ 2θ ≤ 149.98°) из них уникальных 2307
(Rint 0.0327, Rsigma 0.0345). R1 0.0346 [I > 2σ(I)], wR2
Синтез соединений 9, 11 осуществлен в соот-
0.0917. ССDC 2235654.
ветствии с методикой, описанной в работе [16].
Общая методика синтеза соединений 13, 14.
N′-(4,6-Дихлор-1,3,5-триазин-2-ил)-2-(5-ме-
К раствору
4,6-дихлор-N-(4-(трифторметил)фе-
тил-1H-тетразол-1-ил)ацетогидразид
(9). Вы-
нил)-1,3,5-триазин-2-амина 12 (0.6 г, 1.94 ммоль)
ход 1.41 г (77%), белые кристаллы, т. пл. 218-
в 50 мл диоксана при перемешивании прибавляли
220°С. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 5.29
раствор 2.04 ммоль 2-(5-метил-1H-тетразол-1-ил)-
с (2H, CH2), 2.49 с (3H, CH3). Спектр ЯМР 13C
ацетогидразида 9 или N′-(4,6-дихлор-1,3,5-три-
(ДМСО-d6), δС, м. д.: 164.8 (Cтриазин), 164.6 (C=O),
азин-2-ил)-2-(5-фенил-2H-тетразол-2-ил)ацетоги-
161.4 (Cтриазин), 153.9 (CN4), 59.7 (CH2), 8.9 (CH3).
дразида 11 в 40 мл диоксана и 0.3 г (2.17 ммоль)
Масс-спектр, m/z (Iотн, %): 306.0195 [M + H]+.
K2CO3. Полученную смесь выдерживали при ком-
Структура моноклинная, P21 (no. 4), a 4.6421(3) Å,
натной температуре в течение 6 ч. По окончании
b 12.0534(7) Å, c 21.3634(15) Å, β 93.039(6)°, V
времени выдержки реакционную смесь филь-
1193.67(13) Å3, Z 2, T 100.15 K, μ(CuKα) 4.888 мм-1,
тровали и упаривали при пониженном давлении.
dвыч 1.653 г/см3, 9900 отражений (4.142° ≤ 2θ ≤
Очистку продукта проводили методом колоночной
139.976°), из них уникальных 4421 (Rint 0.0687,
хроматографии (хлороформ-метанол, 9.5:0.5).
Rsigma 0.0887). R1 0.0749 [I > 2σ(I)], wR2 0.2111.
N′-(4-Хлор-6-{[4-(трифторметил)фенил]ами-
СCDC 2236408.
но}-1,3,5-триазин-2-ил)-2-(5-метил-1H-тетра-
N′-(4,6-Дихлор-1,3,5-триазин-2-ил)-2-(5-
зол-1-ил)ацетогидразид (13). Выход 0.57 г (69%),
фенил-2H-тетразол-2-ил)ацетогидразид
(11).
белые кристаллы, т. пл. 216-218°С (разл.). Спектр
Выход 1.75 г (80%). Спектральные характеристи-
ЯМР 1H (ДМСО-d6), δ, м. д.: 7.84-7.80 м (2H,
ки соединения 11 совпадают с описанными ранее
CHPh), 7.74-7.71 м (2H, CHPh), 5.40 с (2H, CH2),
[16].
2.41 с (3H, CH3). Спектр ЯМР 13C (ДМСО-d6), δС,
4,6-Дихлор-N-[4-(трифторметил)фенил]-
м. д.: 168.9 (Cтриазин), 164.8 (C=O), 164.5 (Cтриазин),
1,3,5-триазин-2-амин (12). К раствору цианур-
154.7 (CN4), 131.2 (CPh), 129.8 (CHPh), 126.9 (CF3),
хлорида (0.92 г, 4.97 ммоль) в 30 мл диоксана
120.6 (CHPh), 54.3 (CH2), 10.5 (CH3). Найдено, %: C
при 2-4°С при перемешивании прибавляли рас-
40.51; H 2.92; N 31.08. C14H12ClF3N10O. Вычисле-
твор 0.8 г (4.97 ммоль) 4-(трифторметил)анили-
но, %: C 39.22; H 2.82; N 32.67.
на в 30 мл диоксана и 0.6 г K2CO3. Реакционную
N′-(4-Хлор-6-{[4-(трифторметил)фенил]ами-
смесь выдерживали при 2-4°С в течение 3 ч. По
но}-1,3,5-триазин-2-ил)-2-(5-фенил-2H-тетра-
окончании времени выдержки отфильтровыва-
зол-2-ил)ацетогидразид (14). Выход 0.78 г (82%),
ли осадок и упаривали раствор при пониженном
белые кристаллы, т. пл. 220-222°С. Спектр ЯМР
давлении. Проводили экстракцию в системе хло-
1H (ДМСО-d6), δ, м. д.: 10.76 с (1H, NH), 10.25 с
роформ-вода. Органический слой сушили безво-
(1H, NH), 8.00 с (4H, CHPh), 7.85 д (1H, CHPh, J
дным CaCl2 и упаривали при пониженном давле-
7.4 Гц), 7.67 д (1H, CHPh, J 8.4 Гц), 7.55 д (4H, CHPh,
нии. Выход 1.28 г (83%), белые кристаллы, т. пл.
J 17.7 Гц), 5.75 с (2H, CH2). Спектр ЯМР 13C (ДМ-
195-197°С. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.:
СО-d6), δС, м. д.: 168.9 (Cтриазин), 164.8 (C=O), 164.6
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
706
МИКОЛАЙЧУК и др.
(CN4), 164.5 (Cтриазин), 142.8 (CHPh), 131.2 (CHPh),
8.01-7.93 м (1H, CHPh), 7.25-7.05 м (1H, CHPh),
129.8 (CHPh), 129.67 (CHPh), 127.2 (CHPh), 126.8
6.99-6.77 м (2H, CHPh), 2.91-2.78 м (5H, 2CH2,
(CHPh), 126.7 (CHPh), 120.6 (CHPh), 53.9 (CH2). Най-
1CH), 1.65 д. д (4H, J 19.1, 6.1 Гц), 0.91 д (3H, CH3,
дено, %: C 46.49; H 2.88; N 28.54. C19H14ClF3N10O.
J 6.2 Гц). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.:
Вычислено, %: C 49.01; H 2.92; N 27.11.
169.24 (Cтриазин), 168.25 (Cтриазин), 164.02 (CN4),
129.05 (CHPh), 126.55 (CHPh), 119.15 (CHPh), 116.34
Общая методика синтеза соединений 15-21.
(CHPh), 43.70 (CH), 33.98 (CH2), 30.83 (CH2), 22.04
К раствору соединения
5
(6,
7,
9 или
11)
(СH3). Найдено, %: C 55.01; H 3.71; N 29.24.
(1.2 ммоль) в 50 мл ацетона (диоксана при получе-
C16H17N8ClO. Вычислено, %: C 51.55; H 4.60; N
нии 21) добавляли 2.5 ммоль морфолина или 4-ме-
30.06.
тилпиперидина в 5 мл 10%-ного водного раствора
NaOH. Реакционную смесь выдерживали при ком-
4-[2-(4-Хлор-6-морфолино-1,3,5-триазин-
натной температуре в течение 20 ч, затем при 50°С
2-ил)-2H-тетразол-5-ил]-2-нитрофенол
(18).
в течение 4 ч. По окончании времени выдержки
Выход 0.33 г (58%), светло-желтые кристаллы, т.
реакционную смесь упаривали при пониженном
пл. 199-201°С. Спектр ЯМР 1H (ДМСО-d6), δ, м.
давлении. Очистку продукта проводили методом
д.: 8.33 с (1H, CHPh), 7.93 д. д (1H, CHPh, J 19.7,
колоночной хроматографии (хлороформ-метанол,
9.2 Гц), 7.70-7.52 м (1H, CHPh), 3.74 д. д (4H, CH2,
9:1, для соединений 15, 16; хлороформ-метанол,
J 21.0, 4.3 Гц), 3.67-3.51 м (4H, CH2). Спектр
9.5:0.5 для соединений 17, 20, 21).
ЯМР 13C (ДМСО-d6), δС, м. д.: 165.09 (Cтриазин),
164.99 (CN4), 153.69 (CPh), 137.86 (CPh), 126.17
4-[4-Хлор-6-(5-фенил-2H-тетразол-2-ил)-
(CHPh), 119.45 (CHPh), 115.12 (CHPh), 66.5 (CH2),
1,3,5-триазин-2-ил]морфолин (15). Выход 0.39 г
44.0 (CH2). Найдено, %: C 40.89; H 3.54; N 30.04.
(75%), белые кристаллы, т. пл 227-229°С. Спектр
C14H12ClN9O4. Вычислено, %: C 41.44; H 2.98; N
ЯМР 1H (ДМСО-d6), δ, м. д.: 8.05 д. д (2H, CHPh,
31.07.
J 7.5, 1.9 Гц), 7.57 д. д (3H, CHPh, J 5.7, 4.8 Гц),
3.62 д (4H, CH2, J 4.4 Гц), 3.57 д (4H, CH2, J
N′-(4,6-Диморфолино-1,3,5-триазин-2-ил)-
4.1 Гц). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.: 165.8
2-(5-метил-1H-тетразол-1-ил)ацетогидразид
(Cтриазин), 165.0 (Cтриазин), 164.5 (CN4), 129.5 (CPh),
(19). Выход 0.32 г (79%). белые кристаллы, т. пл.
128.7(CPh), 127.2 (CHPh), 126.2 (CHPh), 67.23 (CH2),
255-257°С. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.:
45.34 (CH2). Масс-спектр, m/z: 345.0811 (Iотн, %).
5.25 c (2H, CH2), 3.78-3.64 м (8H, CH2), 3.59-3.46
м (8H, CH2), 2.48 с (3H, CH3). Спектр ЯМР 13C
2,4-Бис(4-метилпиперидин-1-ил)-6-(5-фе-
нил-2H-тетразол-2-ил)-1,3,5-триазин (16). Вы-
(ДМСО-d6), δС, м. д.: 167.5 (Cтриазин), 165.2 (C=O),
153.7 (CN4), 66.5 (CH2), 48.7 (CH2), 8.6 (CH3).
ход 0.39 г (75%), белые кристаллы, т. пл. 212-
Масс-спектр, m/z (Iотн, %): 406.2062 [M + H]+.
214°С (разл.). Спектр ЯМР 1H (ДМСО-d6), δ, м. д.:
7.71-7.59 м (2H, CHPh), 7.51 д. т (3H, CHPh, J 10.4,
N′-(4,6-Диморфолино-1,3,5-триазин-2-ил)-2-
6.8 Гц), 2.82 д. д (4H, CH2, J 22.7, 12.0 Гц), 2.69 т
(5-фенил-2H-тетразол-2-ил)ацетогидразид (20).
(4H, CH2, J 11.9 Гц), 1.72-1.63 м (5H, CH2, CH),
Выход 0.37 г (72%), белые кристаллы, т. пл. 273-
1.62-1.58 м (5H, CH2-, CH), 0.91 с (3H, CH3), 0.89 с
275°С. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 8.14-
(3H, CH3). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.:
7.93 м (2H, CHPh), 7.70-7.43 м (3H, CHPh), 5.57 с
165.8 (Cтриазин), 165.2 (Cтриазин), 164.0 (CN4), 130.3
(2H, CH2), 3.56 уш. с (16H, CH2). Спектр ЯМР 13C
(CPh), 129.0 (CHPh), 128.9 (CHPh), 126.8 (CHPh),
(ДМСО-d6), δС, м. д.: 166.8 (Cтриазин), 165.1 (C=O),
56.3 (CH2), 54.1 (CH2), 33.9 (CH2), 31.2 (CH2), 31.1
164.5 (СN4), 131.2 (CHPh), 129.8 (CHPh), 126.8 (CPh),
(CH2), 22.3 (CH3), 22.0 (CH3). Найдено, %: C 64.21;
66.4 (CH2), 53.9 (CH2), 43.7 (CH2). Масс-спектр,
H 6.69; N 28.11. C22H29N9. Вычислено, %: C 62.98;
m/z (Iотн, %): 468.2211 [M + H]+ .
H 6.97; N 30.05.
N′-[4,6-Бис(4-метилпиперидин-1-ил)-1,3,5-
2-{2-[4-Хлор-6-(4-метилпиперидин-1-ил)-
триазин-2-ил]-2-(5-фенил-2H-тетразол-2-ил)-
1,3,5-триазин-2-ил]-2H-тетразол-5-ил}фенол
ацетогидразид (21). Выход
0.44
(54%), белые
(17). Выход 0.41 г (68%), белые кристаллы, т. пл.
кристаллы, т. пл. 291-293°С. Спектр ЯМР 1H
211-213°С. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.:
(ДМСО-d6), δ, м. д.: 8.63 с (1H, NH), 8.06 д. д (2H,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
СИНТЕЗ И ИССЛЕДОВАНИЕ СВОЙСТВ
707
СНPh, J 7.1, 2.2 Гц), 7.59-7.55 м (3H, СНPh), 5.58 c
Изучение цитотоксичности соединения 15-
(2H, CH2), 2.88-2.59 м (4H, СH2), 1.70-1.51 м (8H,
23. МТТ-Анализ проводили на опухолевых кле-
CH2), 0.89 с (3H, СH3), 0.87 c (3H, CH3). Спектр
точных линиях Huh-7 (гепатокарцинома человека)
ЯМР 13C (ДМСО-d6), δС, м. д.: 169.6 (Cтриазин),
и A549 (аденокарцинома человека) согласно мето-
167.7 (Cтриазин), 164.7 (C=O), 164.5 (CN4), 131.1
дике [22]. Клетки в концентрации 5∙103 на лунку
(CHPh), 129.7 (CHPh), 127.3 (CHPh), 126.8 (CHPh),
помещали в 96-луночный планшет и инкубировали
54.1 (CH2), 43.3 (CH2), 34.1 (CH2), 31.1 (CH2), 22.3
в течение 12 ч в среде DMEM с добавлением 10%
(СH3). Масс-спектр, m/z (Iотн, %): 429.1663 [M +
термически инактивированной фетальной бычьей
H]+.
сыворотки, 1% L-глутамина, 50 Ед/мл пеницилли-
на и 50 мкг/мл стрептомицина. После культивиро-
Общая методика синтеза соединений 22, 23.
вания в лунки добавляли свежую среду DMEM,
К раствору соединения 13 или 14 (1.2 ммоль) в
содержащую различные концентрации соедине-
50 мл ацетона прибавляли раствор 1.5 ммоль мор-
ний 15-23, и планшет затем инкубировали при
фолина в 5 мл 10%-ного водного раствора NaOH.
37°C в увлажненной атмосфере CO2-инкубатора в
Реакционную смесь выдерживали при перемеши-
присутствии 20% O2, 5% CO2. Через 48 ч в лунки
вании при комнатной температуре в течение 14 ч,
добавляли 0.1 мл DMEM и 0.02 мл МТТ-реагента
затем при 50°С в течение 4 ч. По окончании време-
(5 мг/мл) и продолжали инкубировать в течение
ни выдержки реакционную смесь упаривали при
1 ч, после чего удаляли супернатант. Образовав-
пониженном давлении.
шиеся при восстановлении МТТ жизнеспособны-
2-(5-Метил-1H-тетразол-1-ил)-N′-{4-морфо-
ми клетками кристаллы формазана растворяли в
лино-6-[(4-(трифторметил)фенил]амино-1,3,5-
0.1 мл ДМСО и измеряли оптическую плотность
триазин-2-ил}ацетогидразид
(22). Получен в
на планшетном фотометре ALLSHENG AMR-100T
смеси. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 7.44-
при λ 540 нм, вычитая фоновую оптическую плот-
7.41 м (2H, СHPh), 7.34-7.32 м (2H, СHPh), 5.46 с
ность при λ 690 нм.
(2H, CH2), 3.77-3.74 м (4H, СH2), 3.61-3.57 м (4H,
Иммуноблоттинг лизатов клеток Huh-7.
СH2), 2.33 с (3H, CH3). Спектр ЯМР 13C (ДМ-
10%-ный полиакриламидный гель использовали
СО-d6), δС, м. д.: 168.9 (Cтриазин), 164.8 (С=О), 164.5
для белкового электрофореза по стандартной ме-
(Cтриазин), 154.3 (CN4) 126.8 (CHPh), 125.9 (CHPh),
тодике [23]. Для переноса белков с полиакрила-
120.7 (CHPh), 120.6 (CHPh), 66.5 (CH2), 66.1 (CH2),
мидного геля применяли нитроцеллюлозную мем-
54.3 (CH2), 48.9 (CH2), 48.7 (CH2), 10.3 (СH3).
брану с диаметром пор 0.2 мкм (Bio-Rad). Перенос
Масс-спектр, m/z (Iотн, %): 480.1818 [M + H]+.
белков осуществляли в камере (Bio-Rad) при силе
N′-(4-Морфолино-6-{[4-(трифторметил)фе-
тока 0.3 А в течение 2 ч. После блокирования не-
нил]амино}-1,3,5-триазин-2-ил)-2-(5-фенил-
специфических сайтов связывания на мембране с
2H-тетразол-2-ил)ацетогидразид (23). Очистку
использованием 5%-ного обезжиренного молока в
продукта проводили методом колоночной хрома-
буферном растворе PBS-T (PBS + 0.1% Твин-20),
тографии (хлороформ-метанол, 9:1). Выход 0.34 г
мембраны инкубировали со специфическими ан-
(52%), белые кристаллы, т. пл. 196-198°С. Спектр
тителами (в разведении 1/1000), разведёнными в
ЯМР 1H (ДМСО-d6), δ, м. д.: 10.1 c (1H, NH), 9.2 c
том же буферном растворе с молоком в течение
(1H, NH), 8.25 м (2H, CHPh), 7.50 д. д (3H, CHPh, J
ночи [p-HER2 (Tyr1248 и Tyr877) (Cell Signaling),
7.9, 1.2 Гц), 7.47 д. д (2H, CHPh, J 8.3, 1.9 Гц), 7.35
p-EGFR (Tyr1173) (Cell Signaling)]. После трех-
д. д (2H, CHPh, J 7.8, 2.3 Гц), 5.47 с (2H, CH2), 3.68-
кратного промывания с использованием PBS-T
3.63 м (4H, СH2), 3.60-3.57 м (4H, CH2). Спектр
вторичные антитела, конъюгированные с перок-
ЯМР 13C (ДМСО-d6), δС, м. д.: 172.1 (Cтриазин),
сидазой хрена, и хемилюминесцентный субстрат
169.7 (Cтриазин), 168.1 (Cтриазин), 164.4 (C=O), 164.3
для детекции пероксидазы хрена были использо-
(CN4), 131.0 (CHPh), 128 (CHPh), 127 (CHPh), 126.7
ваны в соответствии с инструкцией производителя
(CHPh), 121.1 (CHPh), 124.7 (CHPh), 120.7 (CHPh),
(Bio-Rad). Интенсивность сигнала хемилюминес-
68.7 (CH2), 54.8 (CH2), 44.3 (CH2). Масс-спектр,
ценции детектировали на приборе Chemidoc (Bio-
m/z (Iотн, %): 542.1810 [M + H]+.
Rad).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
708
МИКОЛАЙЧУК и др.
Изучение связывания NO-радикалов с сое-
ном отсеке спектрофотометра в течение 3 мин при
динениями 5, 9, 16 и 19. Для определения степени
37°С и постоянном перемешивании, затем облуча-
связывания NO-радикалов использовали модель-
ли красным лазером Laserland LED-2000 (Besram
ную реакцию Грисса-Илосвая [24, 25]. Для про-
Technology Inc., 659 нм, мощность - 55 мВ, доза
ведения эксперимента реакционную смесь, содер-
облучения - 3.5 Дж/см2). После завершения облу-
жащую 1 мл нитропруссида натрия (с 15 мкM.)
чения регистрировали снижение оптической плот-
и 0.5 мл водного раствора соединений 5, 9, 16 и
ности раствора при 800 нм.
19 инкубировали 150 мин в шейкере-термостате
ИНФОРМАЦИЯ ОБ АВТОРАХ
при 60°С по ранее описанной методике [4]. Затем
к 0.25 мл полученного раствора добавляли 0.5 мл
Миколайчук Ольга Владиславовна, ORCID:
PBS (pH 7.4) и 0.5 мл 1%-ного раствора реактива
Грисса. Полученную смесь инкубировали 30 мин
Голотин Василий Александрович, ORCID:
при комнатной температуре. Образовавшееся ди-
азосоединение определяли спектрофотометриче-
Попова Елена Александровна, ORCID: https://
ским методом при λ 540 нм. В качестве контроля
orcid.org/0000-0003-0507-2647
использовались аналогичные концентрации азида
натрия.
Молчанов Олег Евгеньевич, ORCID: https://
orcid.org/0000-0003-3882-1720
Фотоиндуцированный гемолиз соединений
19 и 21. Эритроциты получали из цитратной крови
Шаройко Владимир Владимирович, ORCID:
путем центрифугирования при 1500 об/мин в тече-
ние 10 мин с последующей трехкратной промыв-
Семёнов Константин Николаевич, ORCID:
кой физиологическим раствором. Далее клетки
стабилизировали не менее суток при 4°С в реак-
тиве Олсвера, который применяется как антикоа-
БЛАГОДАРНОСТЬ
гулянт и состоит из хлорида натрия (0.42%), ли-
Авторы работы выражают благодарность ре-
монной кислоты (0.055%), цитрата натрия (0.8%)
сурсным центрам Санкт-Петербургского государ-
и D-глюкозы (2.05%).
ственного университета «Магнитно-резонансные
Перед использованием эритроциты трижды
методы исследования», «Методы анализа состава
отмывали от реактива Олсвера физиологическим
вещества» и «Рентгенодифракционные методы ис-
раствором, и готовили стандартную суспензию
следования».
клеток в PBS (pH 7.4). Антиоксидантные свой-
ства оценивали с использованием устройства для
ФИНАНСОВАЯ ПОДДЕРЖКА
исследования фотоиндуцированного цитолиза по
Работа выполнена при финансовой поддержке
методике, опубликованной ранее [26]. Согласно
Министерства здравоохранения Российской Фе-
этой методике в экранированной кювете с длиной
дерации (государственное задание по теме «Со-
оптического пути 5 мм готовили инкубационную
здание и оценка противоопухолевой активности
смесь, содержащую 0.1 мл стандартной суспен-
конъюгатов неанелированных 1,3,5-триазинил-те-
зии эритроцитов, 0.6 мл PBS (pH 7.4), 0.08 мл рас-
тразолов с молекулами адресной доставки к мише-
твора с различным содержанием соединений 19
ням клеток опухоли микроокружения»).
и 21 и 0.02 мл фотосенсибилизатора радахлорин
[0.35%-ный раствор для внутривенного введения,
КОНФЛИКТ ИНТЕРЕСОВ
основная субстанция - (7S,8S)-13-винил-5-(кар-
боксиметил)-7-(2-карбоксиэтил)-2,8,12,17-тетра-
Авторы заявляют об отсутствии конфликта
метил-18-этил-7H,8H-порфирин-3-карбоновая
интересов.
кислота]. В качестве контроля использовали инку-
СПИСОК ЛИТЕРАТУРЫ
бационную смесь, содержащую физиологический
раствор. Полученную инкубационную смесь, об-
1. Singla P., Luxami V., Paul K. // Eur. J. Med. Chem. 2015.
щим объемом 0.8 мл, термостатировали в кювет-
Vol. 18. N 102. P. 39. doi 10.1016/j.ejmech.2015.07.037
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
СИНТЕЗ И ИССЛЕДОВАНИЕ СВОЙСТВ
709
2.
Cascioferro S., Parrino B., Spanò V., Carbone A.,
15.
Миколайчук О.В., Протас А.В., Попова Е.А.,
Montalbano A., Barraja P., Diana P., Cirrincione G. //
Молчанов О.Е., Майстренко Д.Н., Островский В.А.,
Eur. J. Med. Chem. 2017. Vol. 15. N 142. P. 523. doi
Павлюкова Ю.Н., Шаройко В.В., Семенов К.Н. //
10.1016/j.ejmech.2017.09.035
ЖОХ. 2022. № 9. С. 1368. doi 10.31857/
3.
Maliszewski D., Drozdowska D. // Pharmaceuticals.
S0044460X22090050; Mikolaichuk O.V., Protas A.V.,
2022. Vol. 15. N 2. P. 221. doi 10.3390/ph15020221
Popova E.A., Molchanov O.E., Maistrenko D.N.,
4.
Миколайчук О.В., Шаройко В.В., Попова Е.А., Про-
Ostrovskii V.A., Pavlyukova Y.N., Sharoyko V.V.,
тас А.В., Фонин А.В., Ануфриков Ю.А., Малко-
Semenov K.N. // Russ. J. Gen. Chem. 2022. Vol. 92.
ва А.М., Шманёва Н.Т., Островский В.А.,
P. 1621. doi 10.1134/S1070363222090055
Семенов К.Н. // Изв. АН. Сер. хим. 2022. № 5.
16.
Sirajuddin M., Ali S., Badshah A. // J. Photochem.
С. 1050; Mikolaichuk O.V., Sharoyko V.V., Popo-
Photobiol. (B). 2013. Vol. 124. P. 1. doi 10.1016/j.
va E.A., Protas A.V., Fonin A.V., Anufrikov Y.A., Malko-
jphotobiol.2013.03.013
va A.M., Shmaneva N.T., Ostrovskii V.A., Molcha-
17.
Миколайчук О.В., Протас А.В., Попова Е.А., Му-
nov O.E., Maistrenko D.N., Semenov K.N. // Russ.
хаметшина А.В., Овсепян Г.К., Трифонов Р.Е. //
Chem. Bull. 2022 Vol. 71. P. 1050. doi 10.1007/s11172-
Изв. АН. Сер. хим. 2018. C. 1312; Mikolaichuk O.V.,
022-3507-1
Protas A.V., Popova E.A., Mukhametshina A.V.,
5.
Konstantinov S.M., Berger M.R. Encyclopedia of
Ovsepyan G.K., Trifonov R.E. // Russ. Chem. Bull.
Molecular Pharmacology. Berlin: Springer, 2008.
2018. Vol. 67. P. 1312. doi 10.1007/s11172-018-2217-1
P. 53. doi 10.1007/978-3-540-38918-7_178
18.
Topală T., Bodoki A., Oprean L., Oprean R. // Farmacia.
6.
Попова Е.А., Трифонов Р.Е., Островский В.А. // Усп.
2014. Vol. 62. P. 1049.
хим. 2019. № 6. С. 644; Popova E.A., Trifonov R.E.,
19.
García-Ramos J.C., Galindo-Murillo R., Cortés-
Ostrovskii V.A. // Russ. Chem. Rev. 2019. Vol. 88.
Guzmán F., Azuara L.R. // J. Mex. Chem. Soc. 2013.
P. 644. doi 10.1070/RCR4864
7.
Островский В.А., Трифонов Р.Е., Попова Е.А. // Изв.
Vol. 57. N 3. P. 245 doi 10.29356/jmcs.v57i3.213
АН. Сер. хим. 2012. Т. 61. С. 765; Ostrovskii V.A.,
20.
Wolfe A., Jr G.H.S., Meehan T. // Society. 2002. Vol.
Trifonov R.E., Popova E.A. // Russ. Chem. Bull. 2012.
26. P. 6392.
Vol. 61. N 4. P. 768. doi 10.1007/s11172-012-0108-4
21.
Raghu M.S., Pradeep Kumar C.B., Prashanth M.K.,
8.
Ostrovskii V.A., Popova E.A., Trifonov R.E. // Compr.
Yogesh Kumar K., Prathibha B.S., Kanthimathi G.,
Heterocycl. Chem. 2022. P. 182. doi 10.1016/B978-0-
Alissa S.A., Alghulikah H.A., Osman S.M. // New
12-818655-8.00131-1
J. Chem. 2021 Vol. 45. P. 13909. doi 10.1039/
9.
Herr R.J. // Bioorg. Med. Chem. 2002. Vol. 10. N 11.
D1NJ02419A
P. 3379. doi 10.1016/S0968-0896(02)00239-0
22.
Mikolaichuk O.V., Popova E.A., Protas A.V.,
10.
Пат. RU (11) 2 124 020(13) C1 (1993). Роспатент //
Rakipov I.T., Nerukh D.A., Petrov A.V., Charykov N.A.,
1998. 22 О 393
Ageev S.V., Tochilnikov G.V., Zmitrichenko I.G.,
11.
Shin-ichi Y., Yasuhisa F., Ichiro K., Hisashi Y.,
Stukov A.N., Semenov K.N, Sharoyko V.V. // J. Mol.
Toshiyuki M., Hiroaki G., Shuichi H., Kanami Y.,
Liq. 2022. Vol. 356. Art. no. 119043. doi 10.1016/j.
Takao Y. // JNCI. 2006. Vol. 98. N 8. P. 545. doi 10.1093/
molliq.2022.119043
jnci/djj133
23.
Laemmli U.K. // Nature. 1970 Vol. 227. N 5259. P. 680.
12.
Miller M.S., Pinson J.A., Zheng Z., Jennings I.G.,
doi 10.1038/227680a0
Thompson P.E. // Bioorg. Med. Chem. Lett. 2013.
24.
Abdelhalim A.O.E., Sharoyko V. V., Meshcheriakov A.A.,
Vol. 23. N 3. P. 802-5. doi 10.1016/j.bmcl.2012.11.076
Martynova S.D., Ageev S.V., Iurev G.O., Mulla H.Al,
13.
Norman M.H., Andrews K.L., Bo Y.X.Y., Booker S.K.,
Petrov A.V., Solovtsova I.L., Vasina L.V., Murin I.V.,
Caenepeel S., Cee V.J., D’Angelo N.D., Freeman D.J.,
Semenov K.N. // Nanomed. Nanotechnol. Biol.
Herberich B.J., Hong F.T., Jackson C.L.M., Jiang J.,
Med. 2020. Vol. 29 P. 102284. doi 10.1016/j.
Lanman B.A., Liu L.B., McCarter J.D., Mullady E.L.,
nano.2020.102284
Nishimura N., Pettus L.H., Reed A.B., Miguel T.S.,
25.
Gaponenko I.N., Ageev S.V., Iurev G.O., Shem-
Smith A.L., Stec M.M., Tadesse S., Tasker A., Aida-
chuk O.S., Meshcheriakov A.A., Petrov A.V., Solovtso-
sani D., Zhu X.C., Subramanian R., Tamayo N.A.,
va I. L., Vasina L.V., Tennikova T.B., Murin I.V.,
Wang L., Whittington D.A., Wu B., Wu T., Wurz R.P.,
Semenov K.N., Sharoyko V.V. // Toxicology in Vitro.
Yang K., Zalameda L., Zhang N., Hughes P.E. // J. Med.
2020. Vol. 62. P. 104683. doi 10.1016/j.tiv.2019.104683
Chem. 2012. Vol. 55. P. 7796. doi 10.1021/jm300846z
14.
Dehnhardt C.M., Venkatesan A.M., Chen Z., Delos-
26.
Galebskaya L.V., Solovtsova I.L., Miroshnikova E.B.,
Santos E., Ayral-Kaloustian S., Brooijmans N., Yu K.,
Mikhailova I.A., Sushkin M.E., Razumny A.V.,
Hollander I., Feldberg L., Lucas J., Mallon R. // Bioorg.
Babina A.V., Fomina V.A. // Biomed. Photonics. 2017.
Med. Chem. Lett. 2011. Vol. 16. P. 4773. doi 10.1016/j.
Vol. 6. N 3. P. 33. doi 10.24931/2413-9432-2017-6-3-
bmcl.2011.06.063
33-38
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
710
МИКОЛАЙЧУК и др.
Synthesis and Study of Some Properties
of New Tetrazole-Containing Derivatives
of Morpholin-4-yl-1,3,5-triazine
and 4-Methylpiperidin-1-yl-1,3,5-triazine
O. V. Mykolaichuka,b,*, A. V. Protasa,b, E. A. Popovaa,b, M. D. Lutseva,
E. Yu. Smirnovc,d, V. A. Golotina,c, V. A. Ostrovskye, I. V. Kornyakovf,
K. N. Semenovab,e,f, V. V. Sharoikoa,b,f, O. E. Molchanovb, and D. N. Maistrenkob
a I.P. Pavlov First St. Petersburg State Medical University, St. Petersburg, 197022 Russia
b Academician A. M. Granov Russian Research Center for Radiology and Surgical Technologies,
Ministry of Health of the Russian Federation, St. Petersburg, 197758 Russia
c State Research Institute of Lake and River Fisheries, St. Petersburg, 199004 Russia
d Institute of Cytology, Russian Academy of Sciences, St. Petersburg, 194064 Russia
e St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
f St. Petersburg State University, Saint Petersburg, 199034 Russia
*e-mail: olgamedchem@gmail.com
Received March 8, 2023; revised April 4, 2023; accepted April 12, 2023
New tetrazole-containing derivatives of morpholin-4-yl-1,3,5-triazine and 4-methylpiperidin-1-yl-1,3,5-tri-
azine were synthesized. Cytotoxic activity of the compounds obtained against human liver tumor cell lines
Huh-7 and human lung A549 was studied by the MTT test. It was shown that these substances do not exhibit
a pronounced cytotoxic effect. The most significant antitumor activity was shown by 1,3,5-triazine containing
5-phenyltetrazol-2-ylacetohydrazide fragment and 4-methylpiperidine ring as substituents, as well as 1,3,5-tri-
azine containing 5-methyl-1H-tetrazol-1-ylacetohydrazide fragment and two morpholine rings. For these
compounds, the interaction with DNA was studied by UV spectroscopy. For N’-(4,6-dimorpholino-1,3,5-triaz-
in-2-yl)-2-(5-methyl-1H-tetrazol-1-yl)acetohydrazide, the DNA binding constant was determined (Kbin 9.02×
104 M.-1) and studied the ability to inhibit the tyrosine kinase domain of surface receptors. It was shown that
the studied tetrazole-containing derivatives of 1,3,5-triazine do not exhibit antioxidant properties with respect
to NO-radicals and do not cause photoinduced hemolysis.
Keywords: 1,3,5-triazine, 5-aryltetrazoles, 5-methyl-1H-tetrazol-1-ylacetohydrazide, 5-phenyl-2H-tetra-
zol-2-ylacetohydrazide, cytotoxic activity, inhibitory activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023