ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 6, с. 835-839
УДК 547.743.1
СИНТЕЗ НОВЫХ ИМИДАЗОЛИДИН-2-ОНОВ
В РЕЗУЛЬТАТЕ РЕАКЦИИ
1-(2,2-ДИМЕТОКСИЭТИЛ)МОЧЕВИН
С С-НУКЛЕОФИЛАМИ
© 2023 г. А. В. Смолобочкин1,*, Е. А. Кузнецова1, А. С. Газизов1,
А. Р. Бурилов1, М. А. Пудовик1
1 Институт органической и физической химии имени А. Е. Арбузова, Федеральный исследовательский центр
«Казанский научный центр Российской академии наук», ул. Академика Арбузова 8, Казань, 420088 Россия
*e-mail: smolobochkin@iopc.ru
Поступило в редакцию 4 апреля 2023 г.
После доработки 19 мая 2023 г.
Принято к печати 21 мая 2023 г.
Кислотно-катализируемая реакция 1-(2,2-диметоксиэтил)мочевин с ароматическими и гетероцикли-
ческими нуклеофилами приводит к образованию новых имидазолидин-2-онов. Предложенный метод
позволяет достаточно легко вводить необходимую фармакофорную группу в положение 4 имидазоли-
динового цикла.
Ключевые слова: ацетали, имидазолидин-2-он, 1-(2,2-диметоксиэтил)мочевина, С-нуклеофилы
DOI: 10.31857/S0044460X23060021, EDN: FJUKMS
Среди биологически активных соединений, не-
ациклических предшественников. Синтез ими-
сомненно, важное место занимают азотсодержа-
дазолидин-2-онов из циклических прекурсоров
щие гетероциклы [1]. Особый интерес вызывают
[18, 19] является менее распространенным, по-
циклические мочевины [2, 3], среди которых ши-
скольку имеет ряд ограничений: многостадий-
роким спектром биологической активности вы-
ность, низкий выход продукта и отсутствие
деляются производные имидазолидин-2-она. Так,
возможности получать большие ряды, что в даль-
фрагмент имидазолидин-2-она входит в структуру
нейшем затруднит поиск потенциально биологи-
антибиотиков азлоциллина и мезлоциллина [4, 5],
чески активных соединений. Циклизация ацикли-
антигипертензивного препарата имидаприла [6],
ческих исходных соединений является основным
нейролептика сертиндола [7]. Также производные
подходом к синтезу имидазолидин-2-онов [20-22].
имидазолидин-2-она обладают противоопухоле-
К преимуществам этого подхода можно отне-
вой [8-10], антилейшманиозной [11, 12], противо-
сти отсутствие необходимости синтеза исходных
микробной [13] активностью, могут быть исполь-
циклических соединений, что уменьшает количе-
зованы для лечения болезни Альцгеймера [14],
ство стадий, значительно упрощается введение
являются ингибиторами протеазы ВИЧ-1 [15], ан-
заместителей в имидазолидиноновый фрагмент.
тагонистами рецепторов 5-HT2C [16] и CCR5 [17].
Недостатком второго подхода является необхо-
Существует достаточно много методов синтеза
димость использования дорогостоящих и труд-
замещенных производных имидазолидин-2-она,
нодоступных катализаторов. Поэтому разработка
которые условно можно разделить на функциона-
новых методов синтеза производных имидазоли-
лизацию готового имидазолидина и циклизацию
дин-2-она является актуальной задачей.
835
836
СМОЛОБОЧКИН и др.
Схема 1.
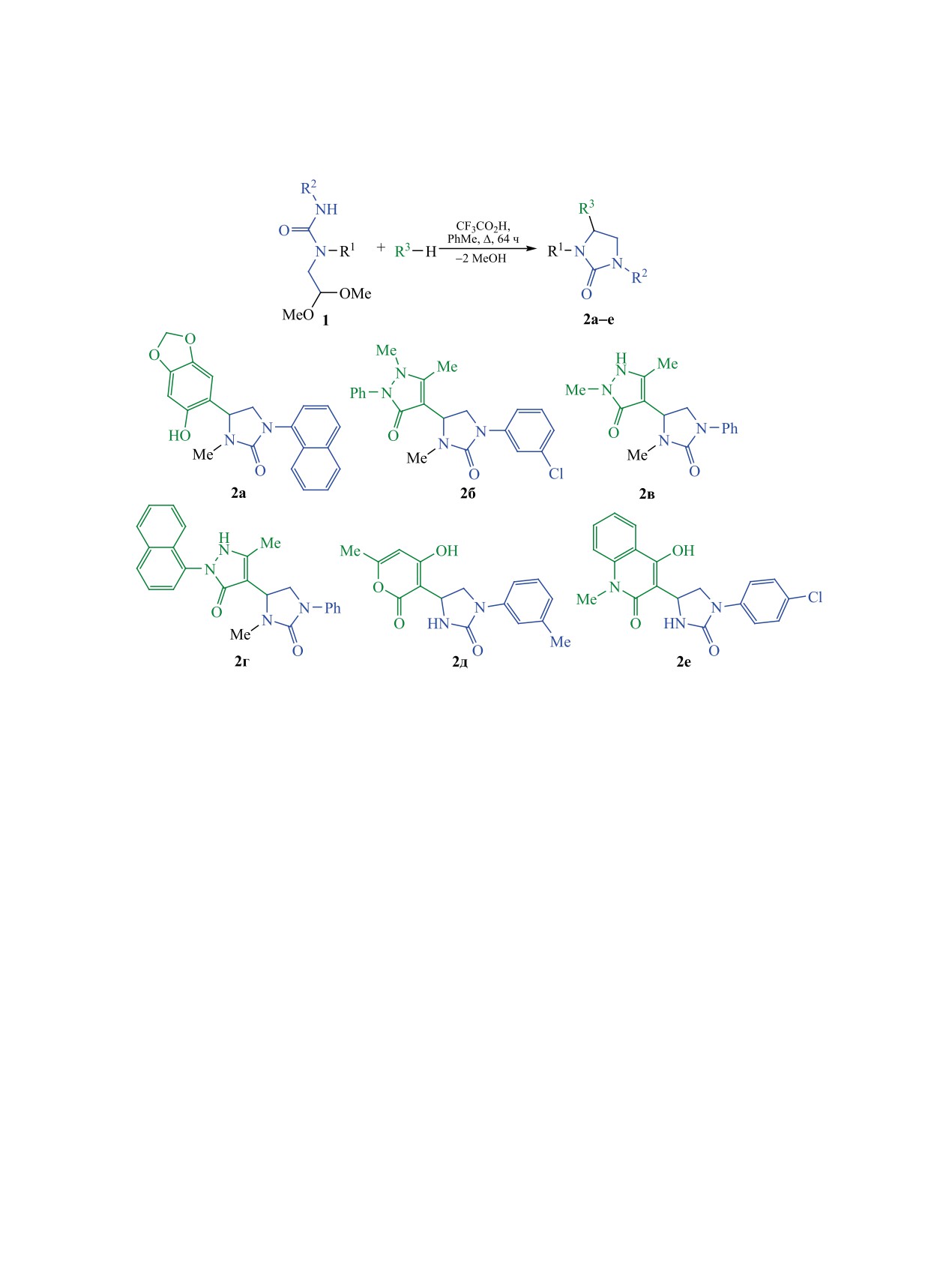
Ранее в нашей лаборатории был разработан
имидазолидин-2-она 2а. Феназон, обладающий
простой метод синтеза замещённых имидазоли-
анальгетической активностью, также вступает в
дин-2-онов на основе кислотно-катализируемой
реакцию с ацеталем с образованием продукта 2б.
реакции 1-(2,2-диметоксиэтил)мочевин с арома-
Аналогично, в этих экспериментальных условиях,
тическими и гетероциклическими нуклеофилами
были синтезированы имидазолидин-2-оны 2в, г.
[23]. Настоящая работа посвящена расширению
Реакции ацеталей 1, содержащих две NH-груп-
границ этого метода, что позволит получать неиз-
пы, с С-нуклеофилами осуществляются аналогич-
вестные ранее производные имидазолидин-2-она.
но. 4-Гидрокси-6-метил-2H-пиран-2-он, входящий
Синтез исходных ацеталей 1 осуществлялся по
в состав антибиотика миксопиронина [25], реаги-
ранее описанному методу [23], заключающемуся
рует с ацеталем, с образованием гетероцикла 2д.
во взаимодействии 2,2-диметоксиэтан-1-амина и
На основе 4-гидрокси-1-метилхинолин-2(1H)-она,
2,2-диметокси-N-метилэтан-1-амина с изоцианата-
обладающего противотуберкулезной активностью
ми в бензоле (схема 1). В качестве С-нуклеофилов
[26], было получено соединение 2е. Следует отме-
были выбраны ароматические и гетероцикличе-
тить, что в реакциях с 1-(2,2-диметоксиэтил)мо-
ские нуклеофилы, проявляющие фармакологиче-
чевинами
4-гидрокси-1-метилхинолин-2(1H)-он
скую активность.
используется в качестве нуклеофила впервые.
Взаимодействие ацеталя 1, содержащего наф-
тильный фрагмент, с 2Н-1,3-бензодиоксол-5-олом,
Состав и строение полученных соединений
известным своей антиоксидантной активностью
подтверждены даннми элементного анализа и
[24], привело к образованию нового производного
спектроскопии ЯМР.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
СИНТЕЗ НОВЫХ ИМИДАЗОЛИДИН-2-ОНОВ
837
Таким образом, в результате проведенного ис-
т. пл. 70-72°C. ИК спектр ν, см-1: 1595, 1667, 1703,
следования нами разработан, простой в реализации
2704. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 2.31
метод получения ранее неизвестных производных
с (3H, CH3), 2.63 с (3H, CH3), 3.13 с (3H, CH3),
имидазолидин-2-она, содержащих в положении 4
3.92-4.08 м (2H, CH2), 4.64-4.72 м (1H, CH), 7.30-
фармакофорную группу, основанный на кислот-
7.34 м (5H, ArH), 7.46-7.53 м (4H, ArH). Спектр
но-катализируемой реакции 1-(2,2-диметоксиэтил)
ЯМР 13С (ДМСО-d6), δC, м. д.: 11.53, 15.63, 33.46,
мочевин с ароматическими и гетероциклическими
41.75, 50.06, 105.46, 119.73, 123.56, 124.80, 125.20,
нуклеофилами. Преимуществом данного подхода
128.14, 129.90, 136.46, 139.64, 141.65, 141.87,
являются использование коммерчески доступных
153.75, 157.99, 163.90. Найдено, %: C 63.71; H
реагентов, а также простота и эффективность реа-
5.48; Cl 9.09; N 14.01. C21H21ClN4O2. Вычислено,
лизации экспериментальной методики.
%: C 63.55; H 5.33; Cl 8.93; N 14.12.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2,5-Диметил-4-(3-метил-2-оксо-1-фенилими-
дазолидин-4-ил)-1,2-дигидро-3H-пиразол-3-он
Спектры ЯМР 1Н и 13С записаны на спектроме-
(2в). Выход 0.17 г (36%), т. пл. 74-77°C. ИК спектр
тре Bruker MSL 400 (400 и 150 МГц) относительно
ν, см-1: 1594, 1659, 1709, 2919, 3067, 3430. Спектр
сигналов остаточных протонов дейтерированного
ЯМР 1Н (ДМСО-d6), δ, м. д.: 2.05 с (3H, CH3), 3.41
ДМСО. ИК спектры зарегистрированы на спек-
с (3H, CH3), 3.70-3.78 м (1H, CH2), 3.94-4.05 м (1H,
трометре Bruker Tensor 27 в таблетках KBr. Эле-
CH2), 4.55-4.66 м (1H, CH), 6.97 т (1H, ArH, 3JHH
ментный анализ выполнен на приборе Carlo Erba
7.4 Гц), 7.29 т (2H, ArH, 3JHH 7.4 Гц), 7.59 д (2H, ArH,
EA 1108. Содержание хлора определено методом
3JHH 7.8 Гц). Спектр ЯМР 13С (ДМСО-d6), δC, м.
Шёнигера. Температуры плавления определены в
д.: 10.50, 17.03, 41.03, 45.24, 52.53, 106.96, 120.09,
стеклянных капиллярах на приборе Stuart SMP 10.
129.45, 131.36, 142.84, 152.36, 159.03, 161.73. Най-
Ацетали 1 были синтезированы по известной
дено, %: C 63.15; H 6.55; N 19.32. C15H18N4O2. Вы-
методике [23].
числено, %: C 62.92; H 6.34; N 19.57.
Общая методика синтеза имидазолидин-2-
5-Метил-4-(3-метил-2-оксо-1-фенилими-
онов 2. К смеси 1.66 ммоль ацеталя 1 в 10 мл то-
дазолидин-4-ил)-2-(нафт-1-ил)-1,2-дигидро-
луола добавляли 1.66 ммоль нуклеофила и 0.19 г
3H-пиразол-3-он (2г). Выход 0.36 г (54%), т. пл.
(1.66 ммоль) трифторуксусной кислоты. Реакци-
85-86°C. ИК спектр ν, см-1: 1598, 1703, 2920,
онную смесь кипятили 64 ч, растворитель удаляли
3057, 3435. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
при пониженном давлении. Остаток промывали
2.21 с (3H, CH3), 2.65 с (3H, CH3), 3.83-3.88 м
10 мл ацетона, полученный белый порошок суши-
(1H, CH2), 4.05-4.11 м (1H, CH2), 4.74-4.83 м (1H,
ли при пониженном давлении.
CH), 6.99 т (1H, ArH, 3JHH 7.1 Гц), 7.30-7.35 м (2Н,
4-(6-Гидроксибензо[d][1,3]диоксол-5-ил)-3-
ArH), 7.45-7.57 м (3Н, ArH), 7.62 д (2H, ArH, 3JHH
метил-1-(нафт-1-ил)имидазолидин-2-он
(2а).
8.0 Гц), 7.91-8.02 м (4Н, ArH). Найдено, %: C
Выход 0.35 г (58%), т. пл. 67-68°C. ИК спектр. ν,
72.50; H 5.65; N 13.86. C24H22N4O2. Вычислено, %:
см-1: 1598, 1671, 2886, 3054, 3139. Спектр ЯМР
C 72.34; H 5.57; N 14.06.
1Н (ДМСО-d6), δ, м. д.: 2.66 с (3H, CH3), 3.50-2.56
м (1H, CH2), 4.12-4.18 м (1H, CH2), 5.03-5.09 м
4-(4-Гидрокси-6-метил-2-оксо-2H-пиран-3-
(1H, CH), 5.95 д (2H, СH2, 2JHH 10.1 Гц), 6.53 с
ил)-1-(м-толил)имидазолидин-2-он (2д). Выход
(1H, ArH), 6.89 с (1H, ArH), 7.48 д (1H, ArH, 3JHH
0.39 г (79%), т. пл. 90-92°C. ИК спектр ν, см-1: 1616,
7.4 Гц), 7.50-7.53 м (2H, ArH), 7.87 д (1H, ArH,
1677, 2937, 3191. Спектр ЯМР 1Н (ДМСО-d6), δ,
3JHH 7.9 Гц), 8.00-8.07 м (3H, ArH). Найдено, %: C
м. д.: 2.23 с (3H, CH3), 2.33 с (3H, CH3), 3.78-3.85 м
69.83; H 5.19; N 7.80. C21H18N2O4. Вычислено, %:
(1H, CH2), 4.02-4.10 м (1H, CH2), 4.63-4.71 м (1H,
C 69.60; H 5.01; N 7.73.
CH), 6.17 с (1H, CH), 6.82 д (1H, ArH, 3JHH 7.6 Гц),
4-[1-(3-Хлорфенил)-3-метил-2-оксоимида-
7.00 с (1H, ArH), 7.16-7.23 м (2H, ArH). Спектр
золидин-4-ил]-1,5-диметил-2-фенил-1,2-диги-
ЯМР 13С (ДМСО-d6), δC, м. д.: 19.83, 20.68, 45.76,
дро-3H-пиразол-3-он (2б). Выход 0.25 г (38%),
50.78, 97.64, 100.27, 118.72, 123.58, 124.91, 128.36,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
838
СМОЛОБОЧКИН и др.
138.08,138.95, 157.35, 162.41, 163.78, 167.85. Най-
3.
Смолобочкин А.В., Газизов А.С., Бурилов А.Р.,
дено, %: C 64.16; H 5.51; N 9.26. C16H16N2O4. Вы-
Пудовик М.А., Синяшин О.Г. // Усп. хим. 2021.
Т. 90. С. 395; Smolobochkin A.V., Gazizov A.S.,
числено, %: C 63.99; H 5.37; N 9.33.
Burilov A.R., Pudovik M.A., Sinyashin O.G. // Russ.
3-(1-(4-Хлорфенил)-2-оксоимидазолидин-
Chem. Rev. 2021. Vol. 90. P. 395. doi 10.1070/RCR4988
4-ил)-4-гидрокси-1-метилхинолин-2(1H)-он
4.
Fu K.P., Neu H.C. // Antimicrob. Agents Chemother.
(2е). Выход 0.13 г (23%), т. пл. 109-110°C. ИК
1978. Vol. 13. P. 930. doi 10.1128/AAC.13.6.930
спектр ν, см-1: 1598, 1706, 2945, 3075, 3430. Спектр
5.
Drusano G.L., Schimpff S.C., Hewitt W.L. // Clin. Infect.
ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.16 с (3H, CH3), 3.86-
Diseases. 1984. Vol. 6. P. 13. doi 10.1093/clinids/6.1.13
3.94 м (1H, CH2), 4.00-4.10 м (1H, CH2), 5.33-5.43
6.
Yamamoto D., Takai S., Jin D., Inagaki S., Tanaka K.,
м (1H, CH), 7.24 д (2H, ArH, 3JHH 8.9 Гц), 7.31 д
Miyazaki M. // J. Mol. Cell. Cardiol. 2007. Vol. 43.
(2H, ArH, 3JHH 9.0 Гц), 7.37 т (1H, ArH, 3JHH 7.5 Гц),
P. 670. doi 10.1016/j.yjmcc.2007.08.002
7.58 т (1H, ArH, 3JHH 7.7 Гц), 8.06 д (1H, ArH, 3JHH
7.
Lewis R., Bagnall A.-M., Leitner M. // Cochrane
7.2 Гц), 8.56 д (1H, ArH, 3JHH 7.0 Гц). Найдено, %:
Database of Systematic Reviews. 2005. N 3. P. 1. doi
C 61.86; H 4.57; Cl 9.80; N 11.21. C19H16ClN3O3.
10.1002/14651858.CD001715.pub2
8.
Lee K.-C., Venkateswararao E., Sharma V.K.,
Вычислено, %: C 61.71; H 4.36; Cl 9.59; N 11.36.
Jung S.-H. // Eur. J. Med. Chem. 2014. Vol. 80. P. 439.
ИНФОРМАЦИЯ ОБ АВТОРАХ
doi 10.1016/j.ejmech.2014.04.048
9.
Lei H., Jiang N., Miao X., Xing L., Guo M., Liu Y.,
Смолобочкин Андрей Владимирович, ORCID:
Xu H., Gong P., Zuo D., Zhai X. // Eur. J. Med.
Chem. 2019. Vol. 171. P. 297. doi 10.1016/j.
Газизов Альмир Сабирович, ORCID: https://
ejmech.2019.03.038
10.
Gagné-Boulet M., Bouzriba C., Chavez Alvarez A.C.,
orcid.org/0000-0001-9899-9606
Fortin S. // J. Mol. Struct. 2022. Vol. 1259. P. 132691.
Бурилов Александр Романович, ORCID: https://
doi 10.1016/j.molstruc.2022.132691
orcid.org/0000-0003-2938-7352
11.
Robert J.-M.H., Sabourin C., Alvarez N., Robert-
Пудовик Михаил Аркадьевич, ORCID: https://
Piessard S., Le Baut G., Le Pape P. // Eur. J. Med.
orcid.org/0000-0002-1557-7967
Chem. 2003. Vol. 38. P. 711. doi 10.1016/S0223-
5234(03)00119-3
Кузнецова Елизавета Александровна, ORCID:
12.
Alvarez N., Robledo S., Velez I.D., Robert J.M.,
Le Baut G., Le Pape P. // J. Enzyme Inhib.
БЛАГОДАРНОСТИ
Med. Chem.
2002. Vol.
17. P.
443. doi
10.1080/1475636021000005749
Авторы выражают благодарность Спектро-ана-
13.
Ammar A.Y., El-Sharief M.A.M.Sh., Ghorab M.M.,
литическому центру Федерального исследователь-
Mohamed A.Y., Ragab A., Abbas Y.S. // Curr. Org. Synth.
ского центра «Казанский научный центр РАН» за
2016. Vol. 13. P. 466. doi 10.2174/1570179412666150
техническую поддержку проведенных исследова-
817221755
ний.
14.
Gupta M., Ojha M., Yadav D., Pant S., Yadav R. // ACS
Chem. Neurosci. 2020. Vol. 11. P. 2849. doi 10.1021/
КОНФЛИКТ ИНТЕРЕСОВ
acschemneuro.0c00403
15.
Kazmierski W.M., Furfine E., Gray-Nunez Y.,
А.Р. Бурилов является членом редколлегии
Spaltenstein A., Wright L. // Bioorg. Med. Chem. Lett.
Журнала общей химии. Остальные авторы заявля-
2004. Vol. 14. P. 5685. doi 10.1016/j.bmcl.2004.08.038
ют об отсутствии конфликта интересов.
16.
Goodacre C.J., Bromidge S.M., Clapham D., King F.D.,
Lovell P.J., Allen M., Campbell L.P., Holland V.,
СПИСОК ЛИТЕРАТУРЫ
Riley G.J., Starr K.R., Trail B.K., Wood M.D. // Bioorg.
1. Vitaku E., Smith D.T., Njardarson J.T. // J. Med. Chem.
Med. Chem. Lett. 2005. Vol. 15. P. 4989. doi 10.1016/j.
2014. Vol. 57. P. 10257. doi 10.1021/jm501100b
bmcl.2005.08.004
2. Casnati A., Motti E., Mancuso R., Gabriele B.,
17.
Rotstein D.M., Gabriel S.D., Manser N., Filonova L.,
Della Ca’ N. // Catalysts. 2019. Vol. 9. P. 28. doi
Padilla F., Sankuratri S., Ji C., DeRosier A., Dioszegi M.,
10.3390/catal9010028
Heilek G., Jekle A., Weller P., Berry P. // Bioorg. Med.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
СИНТЕЗ НОВЫХ ИМИДАЗОЛИДИН-2-ОНОВ
839
Chem. Lett. 2010. Vol. 20. P. 3219. doi 10.1016/j.
na A.D., Syakaev V.V., Lyubina A.P., Amerhanova S.K.,
bmcl.2010.04.077
Voronina J.K. // Molecules. 2021. Vol. 26. P. 4432. doi
18. Li J., Sun Y., Chen Z., Su W. // Synth. Commun. 2010.
10.3390/molecules26154432
Vol. 40. P. 3669. doi 10.1080/00397910903531615
24. Bosebabu B., Cheruku S.P., Chamallamudi M.R.,
19. Kochetkov K.A., Gorunova O.N., Bystrova N.A. //
Molecules. 2023. Vol. 28. P. 602. doi 10.3390/
Nampoothiri M., Shenoy R.R., Nandakumar K.,
molecules28020602
Parihar V.K., Kumar N. // Mini-Rev. Med. Chem. 2020.
20. Hopkins B.A., Wolfe J.P. // Angew. Chem. Int. Ed. 2012.
Vol. 20. P. 988. doi 10.2174/138955752066620031312
Vol. 51. P. 9886. doi 10.1002/anie.201205233
0419
21. Casnati A., Perrone A., Mazzeo P.P., Bacchi A.,
25. Sucipto H., Wenzel S.C., Müller R. // ChemBioChem.
Mancuso R., Gabriele B., Maggi R., Maestri G.,
Motti E., Stirling A., Della Ca’ N. // J. Org. Chem. 2019.
2013. Vol. 14. P. 1581. doi 10.1002/cbic.201300289
Vol. 84. P. 3477. doi 10.1021/acs.joc.9b00064
26. de Macedo M.B., Kimmel R., Urankar D., Gazvoda M.,
22. Sutherell C.L., Thompson S., Scott R.T.W., Hamil-
Peixoto A., Cools F., Torfs E., Verschaeve L., Lima E.S.,
ton A.D. // Chem. Commun. 2012. Vol. 48. P. 9834. doi
Lyčka A., Milićević D., Klásek A., Cos P., Kafka S.,
10.1039/c2cc34791a
Košmrlj J., Cappoen D. // Eur. J. Med. Chem. 2017.
23. Gazizov A.S., Smolobochkin A.V., Kuznetsova E.A.,
Abdullaeva D.S., Burilov A.R., Pudovik M.A., Voloshi-
Vol. 138. P. 91. doi 10.1016/j.ejmech.2017.06.061
Synthesis of New Imidazolidin-2-ones Based on the Reaction
of 1-(2,2-Dimethoxyethyl)urea with C-Nucleophiles
A. V. Smolobochkina,*, E. A. Kuznetsovaa, A. S. Gazizova, A. R. Burilova, and M. A. Pudovika
a Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center “Kazan Scientific Center of the Russian
Academy of Sciences”, Kazan, 420088 Russia
*e-mail: smolobochkin@iopc.ru
Received April 4, 2023; revised May 19, 2023; accepted May 21, 2023
The acid-catalyzed reaction of 1-(2,2-dimethoxyethyl)ureas with aromatic and heterocyclic nucleophiles leads
to the formation of new imidazolidin-2-ones. The proposed method makes it quite easy to introduce the required
pharmacophore group into position 4 of the imidazolidine cycle.
Keywords: acetals, imidazolidin-2-one, 1-(2,2-dimethoxyethyl)urea, С-nucleophiles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023