ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 7, с. 1050-1056
УДК 547.1-304.2;547:642
1,3-ДИПОЛЯРНОЕ ЦИКЛОПРИСОЕДИНЕНИЕ
СТАБИЛЬНОГО АЗОМЕТИНИЛИДА ИЗ НИНГИДРИНА
И L-ПРОЛИНА К ФОСФОРИЛИРОВАННЫМ
АЦЕТИЛЕНАМ
© 2023 г. А. А. Соколов1, Д. М. Егоров1,*, Ю. А. Пронина1, С. М. Рамш1, А. В. Степаков1,2
1 Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
2 Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: diavoly@mail.ru
Поступило в редакцию 28 апреля 2023 г.
После доработки 17 июня 2023 г.
Принято к печати 21 июня 2023 г.
Изучена реакция 1,3-диполярного циклоприсоединения стабильного азометинилида, образованного
из нингидрина и L-пролина, к активированным ацетиленовым фосфонатам. Установлено, что реакции
протекают в мягких условиях с высокой региоселективностью с образованием циклоаддуктов с остовом
спиро[инден-2,3’-пирролизин]-1,3-диона.
Ключевые слова: 1,3-диполярное циклоприсоединение, хлорэтинилфосфонат, этинилдифосфонат,
азометинилид, региоселективность
DOI: 10.31857/S0044460X23070089, EDN: HGDGNN
Реакции циклоприсоединения привлекают
пирролиновый фрагмент, в настоящее активно ис-
большое внимание химиков-синтетиков
[1-5].
следуются [14-18]. Пирролизидиновый фрагмент
Они отличаются исключительной атом-эффек-
является структурной основой целого ряда алкало-
тивностью, позволяют в одну стадию создавать
идов, представляющих интерес вследствие обна-
труднодоступные фрагменты и молекулы [6-8].
руженных полезных свойств: нейропротекторных
Органические соединения, в составе которых при-
[19], антимикробных [20], антиоксидантных [21]
сутствует атом азота, часто выступают в качестве
(схема 1).
основы для создания новых перспективных био-
Исходный стабильный азометинилид 2 получен
логически активных соединений [9-13]. Биологи-
с высоким выходом при конденсации нингидрина
ческие свойства веществ, в состав которых входит
с L-пролином. Существенным преимуществом
Схема 1.
OH
OH
OH HOH
HO
HO H
H
N
N
N
Платинецин
Гелиотридин
Ретронецин
1050
1,3-ДИПОЛЯРНОЕ ЦИКЛОПРИСОЕДИНЕНИЕ СТАБИЛЬНОГО АЗОМЕТИНИЛИДА
1051
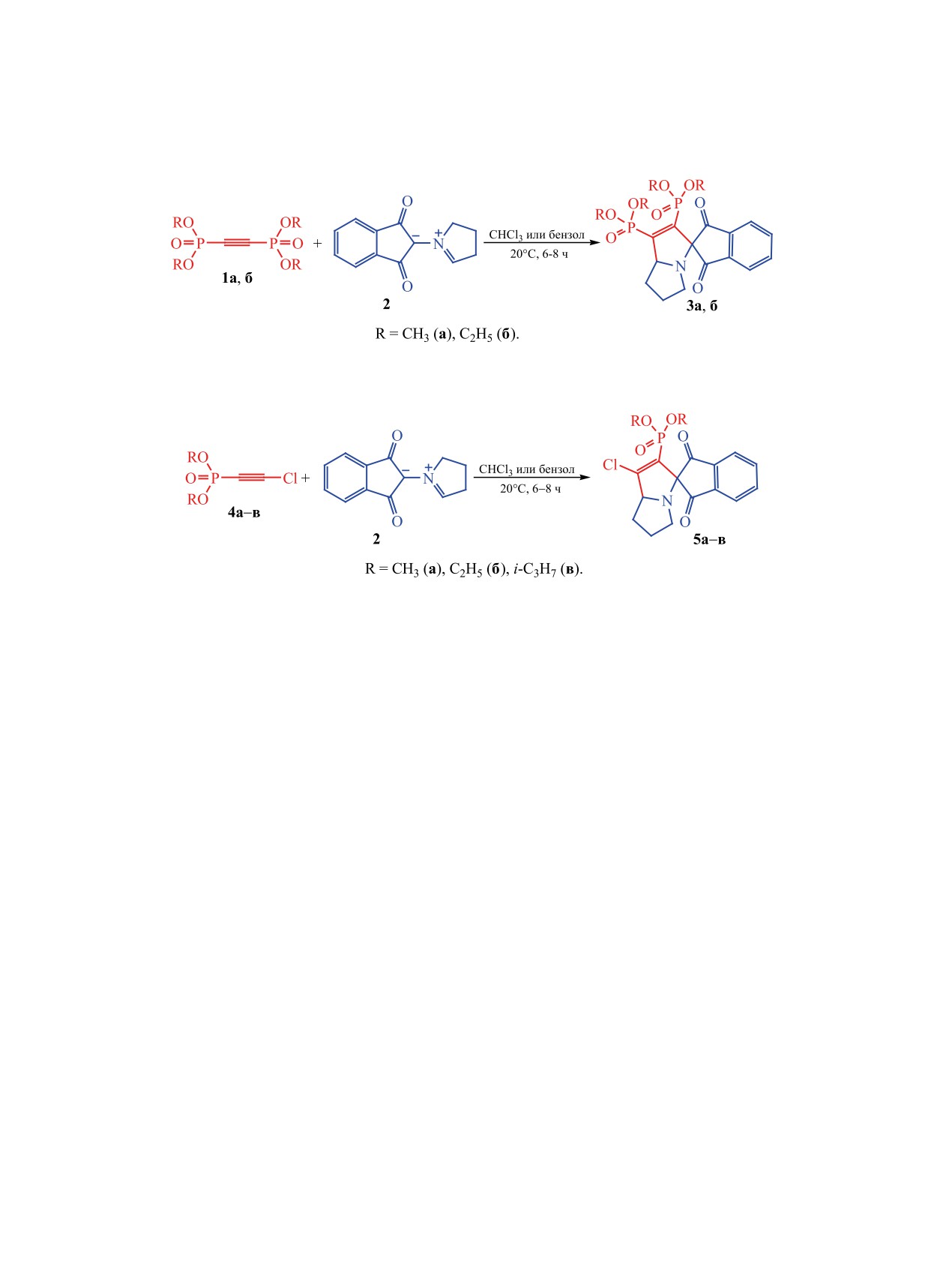
Схема 2.
Схема 3.
данного илида является его высокая реакционная
8-14 ч с образованием спироциклических соеди-
способность и селективность в реакциях с раз-
нений 3a, б c высокими выходами (88 и 89% со-
личными диполярофилами. Ранее было показано,
ответственно, схема 2). При оптимизации условий
что 2 активно реагирует с производными аллена
реакции в качестве растворителей были использо-
и циклопропена (включая газообразные субстра-
ваны хлористый метилен, хлороформ, метанол и
ты), при этом реакции протекают с хорошими вы-
бензол. Лучшие результаты по скорости реакций,
ходами и высокой регио- и стереоселективностью
конверсии исходных соединений и выходу целе-
[22, 23]. Однако к настоящему времени не прово-
вых продуктов были достигнуты при использова-
дились исследования реакционной способности
нии хлороформа и бензола.
азометинилида 2 с ацетиленовыми субстратами.
Взаимодействие азометинилида
2 с диал-
В данной работе исследовано 1,3-диполярное ци-
килхлорэтинилфосфонатами
4а-в проводили в
клоприсоединение стабильного азометинилида 2 к
аналогичных условиях, при этом были получены
диалкилхлорэтинилфосфонатам и тетраалкилэти-
циклоаддукты 5а-в в виде индивидуальных ре-
нилдифосфонатам. Данные ацетиленовые произ-
гиоизомеров с выходами 81-86% (схема 3). Оп-
водные ранее были детально изучены в реакциях
тимальными растворителями также являются
с нуклеофилами [24-31]. Также отметим, что для
хлороформ и бензол, что объясняется лучшей рас-
рассматриваемых ацетиленов были реализованы
творимостью в них исходного азометинилида.
реакция Дильса-Альдера [32, 33], реакции при-
Строение полученных соединений 3 и 5 уста-
соединения азидов [34, 35] и производных солей
навливали на основании данных спектроскопии
N-аминопиридиния [36].
ЯМР на ядрах 1Н, 13С и 31Р. Наибольшие затруд-
Реакция
[3+2]-циклоприсоединения азомети-
нения возникли при установлении строения про-
нилида 2 к тетраалкилэтинилдифосфонатам 1a, б
дуктов циклоприсоединения 5а-в. Отнесение к
протекает при комнатной температуре в течение
соответствующему региоизомеру проведено на
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 7 2023
1052
СОКОЛОВ и др.
Схема 4.
O
O
Cl
Cl
δ
N
O
N
δ
RO
O
Cl
P
O
OR
RO
P
RO OR
P
O
O
O
N
OR
O
O
RO
O
P
RO
RO
N
O
O
O
O
N
P
RO
Cl
Cl
основании анализа спектров ЯМР 1Н и 13С. В про-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
тонных спектрах соединений 5а-с наблюдаются
Спектры ЯМР 1Н, 13С, 31Р сняты на спектроме-
различные химические сдвиги для протонов эфир-
тре Bruker Avance III HD 400 NanoBay на часто-
ных фосфонатных групп, что возможно только в
тах 400.17 (1H), 100.62 (13C), 161.98 МГц (31P).
случае пространственно близкого расположения
Масс-спектроскопические исследования прове-
группы PO(OR)2 к объемному спироциклическо-
дены на приборе Bruker micrOTOF. Температуры
му фрагменту, которое повышает барьер вращения
плавления измерены на столике Кофлера (VEB
вокруг связи С-P. Аналогичная картина наблюда-
Wägetechnik Rapido, PHMK 81/2969).
ется в спектрах 1H ЯМР циклоаддуктов 3a, б.
Тетраметиловый эфир этинилдифосфоновой
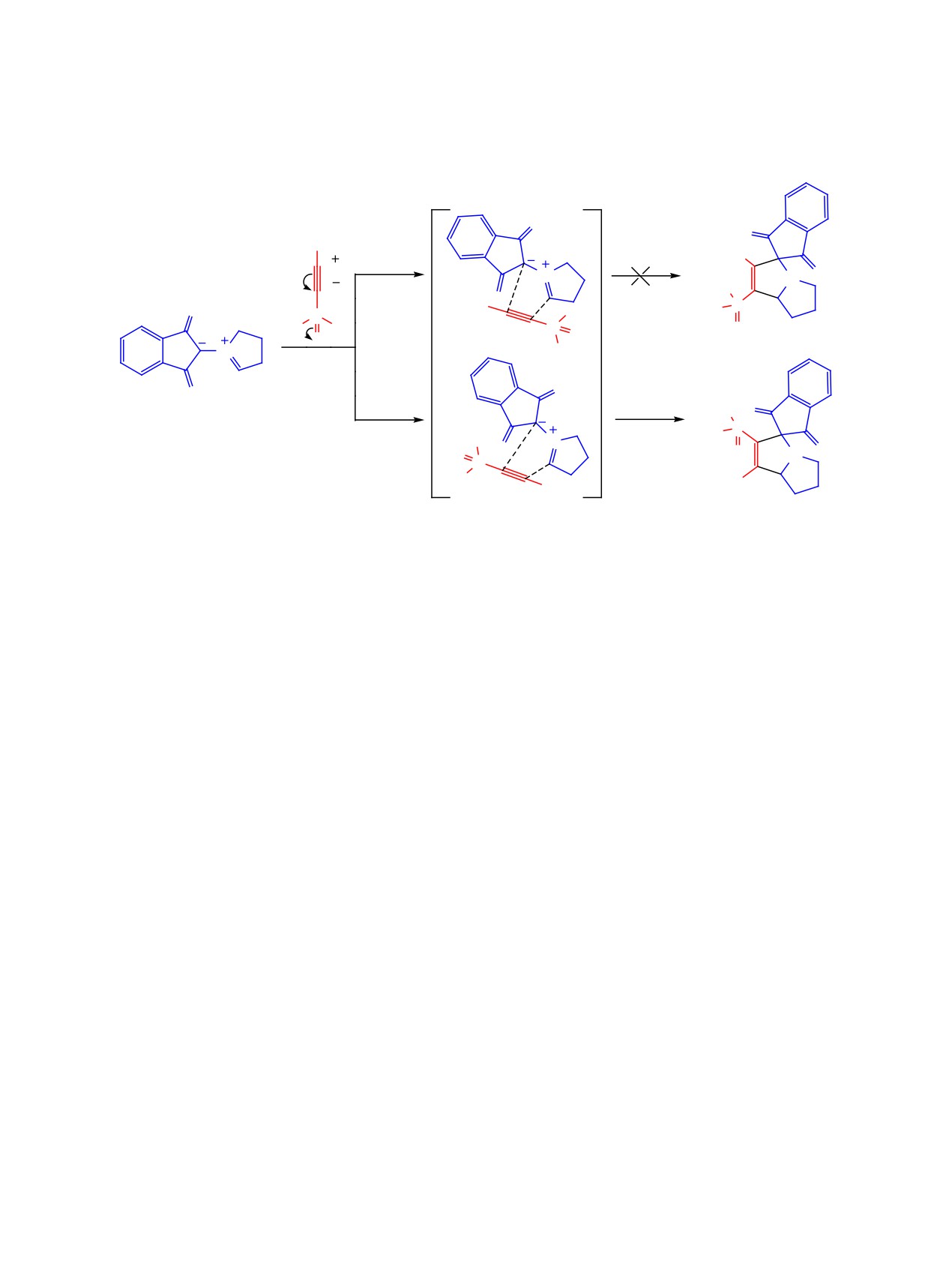
Для исследуемой реакции можно предполо-
кислоты (1а). К 0.25 моля эфирата дихлорацети-
жить согласованный механизм (схема 4). Следует
лена добавляли 24.8 г (0.2 моль) триметилфосфи-
отметить, что при осуществлении контроля за глу-
та. Смесь кипятили в течение 2 ч, затем диэтило-
биной протекания реакции, в спектрах ЯМР 31Р не
вый эфир отгоняли, остаток фракционировали.
наблюдалось сигналов промежуточных продуктов
Выход 21.5 г (89%), т. кип. 121-123°C (1 мм рт. ст.),
или состояний. Полученные данные позволяют
n20 1.4381. Спектр ЯМР 1H (CDCl3), δ, м. д.
отнести исследуемое взаимодействие к реакциям,
(J, Гц): 3.55 д (12H, СН3O, 3JCP 12.2). Спектр ЯМР
протекающим с нормальным электронным распре-
13C (ДМСО-d6), δС, м. д. (J, Гц): 53.91 д (СН3O, 2JCP
делением.
5.0), 87.24 д. д (СP, 1JCP 286.7, 2JCP 39.5). Спектр
Таким образом, впервые продемонстрирована
ЯМР 31P (CDCl3): δР -7.98 м. д.
возможность [3+2]-циклоприсоединения стабиль-
Тетраэтиловый эфир этинилдифосфоно-
ного азометинилида, полученного из нингидрина
вой кислоты (1б) получали аналогично из 33.2 г
и L-пролина, к соединениям ацетиленового ряда.
(0.2 моль) триэтилфосфита. Выход 24.8 г (92%),
Показано, что реакция протекает в мягких услови-
т. кип. 145-147°C (1 мм рт. ст.), n20 1.4442. Спектр
ях с высокой региоселективностью и приводит к
ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 1.23 т (12Н, СН3,
образованию спироконденсированных соединений
3JНН 7.0), 4.06 д. к (8Н, СН2, 3JНН 7.0, 3JНР 7.3).
с остовом спиро[инден-2,3′-пирролизин]-1,3-дио-
Спектр ЯМР 13C (ДМСО-d6), δС, м. д. (J, Гц): 15.89
на с высокими выходами.
д (СН3, 3JCP 6.9), 64.05 д (СН2О, 2JCP 5.9), 88.04 д. д
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 7 2023
1,3-ДИПОЛЯРНОЕ ЦИКЛОПРИСОЕДИНЕНИЕ СТАБИЛЬНОГО АЗОМЕТИНИЛИДА
1053
(СP, 1JCP 268.7, 2JCP 40.0). Спектр ЯМР 31P (CDCl3):
(15 мл) и сушили в вакууме. Выход 94.5%, оран-
δР -10.74 м. д.
жевый порошок. Спектр ЯМР 1H (ДМСО-d6), δ,
м. д. (J, Гц): 2.30 к (2Н, СН2СН2N, 3JНH 8.0), 3.08 м
Диметиловый эфир хлорэтинилфосфоновой
(2Н, СН2СН), 4.92 (2Н, СН2N, 3JНH 8.0), 7.44-7.46
кислоты (4а). К 0.5 моля эфирата дихлорацетиле-
на добавляли при 0-5°C 24.8 г (0.2 моль) триметил-
м (2H, CHAr), 7.51-7.55 м (2H, CHAr), 9.26 с (1H,
фосфита. Смесь выдерживали 0.5 ч при комнатной
CHN). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.: 19.02
(СН2), 32.84 (СН), 58.53 (С-), 119.95 (СНAr), 131.73
температуре и 1 ч при кипении диэтилового эфи-
ра. Избыток эфирата дихлорацетилена удаляли в
(СНAr), 137.21 (ipso-C), 183.69 (C=O).
вакууме, остаток фракционировали. Выход 26.45 г
Общая методика получения соединений 3а, б
(78%), т. кип. 65-66°C (1 мм рт. ст.), n20 1.4558.
и 5a-в. Смесь 1 ммоль диполя 2, 5 мл хлороформа
Спектр ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 3.41 д (6H,
или бензола и 1 ммоль этинилфосфоната переме-
OCH3, 3JHP 12.6 Гц). Спектр ЯМР 13C (ДМСО-d6),
шивали при комнатной температуре. Контроль за
δС, м. д. (J, Гц): 53.17 д (OCH3, 2JCP 6.1), 59.06 д
ходом реакции осуществляли визуально по изме-
(PC, 1JCP 304.3), 79.26 д (CCl, 2JCP 57.2). Спектр
нению окраски реакционной смеси (через 6-8 ч) и
ЯМР 31P (CDCl3): δР -5.98 м. д.
данным спектроскопии ЯМР 31Р. После окончания
Диэтиловый эфир хлорэтинилфосфоно-
реакции отгоняли растворитель. Остаток очищали
вой кислоты (4б) получали аналогично из 33.2 г
с помощью колоночной хроматографии на силика-
(0.2 моль) триэтилфосфита и эфирата дихлора-
геле, элюент - этилацетат-метанол, 95:5.
цетилена. Выход 32.28 г (82%), т. кип. 85-86°C
Тетраметил-(1,3-диоксо-1,3,5′,6′,7′,7a′-гек-
(1 мм рт. ст.), d20 1.1539, n20 1.4473. Спектр ЯМР
сагидроспиро[инден-2,3′-пиррозилин]-1′,2′-ди-
1H (CDCl3), δ, м. д. (J, Гц): 1.00 т (6H, CH3, 3JHH
ил)бисфосфонат (3a). Выход 88%, маслообраз-
8.0 Гц), 3.79 к (4H, OCH2, 3JHH 8.0 Гц). Спектр
ная бесцветная вязкая жидкость. Спектр ЯМР 1H
ЯМР 13C (ДМСО-d6), δС, м. д. (J, Гц): 15.61 д (CH3,
(СDCl3), δ, м. д. (J, Гц): 1.59 м (2H, СН2), 1.77 м
3JCP 6.0), 60.49 д (C1, 1JCP 301.8), 63.07 д (OCH2,
(2Н, СН2), 2.06 м (2H, СН2), 2.67 м (2Н, СH2N),
2JCP 4.0), 77.37 д (C2, 2JCP 32.1). Спектр ЯМР 31P
3.44 д и 3.50 д (6Н, СН3, 3JНP 12.0), 3.73 д (6Н, СН3,
(CDCl3): δР -9.18 м. д.
3JНP 12.0), 4.61 м (1Н, СНN), 7.76 м (2H, CHAr), 7.88
Диизопропиловый эфир хлорэтинилфос-
м (2H, CHAr). Спектр ЯМР 13C (СDCl3), δС, м. д.
фоновой кислоты (4в) получали аналогично из
(J, Гц): 26.35 (СН2), 31.30 (СН2), 48.98 (СН2N),
41.6 г (0.2 моль) триизопропилфосфита и эфира-
52.96 д (СН3, 2JCP 5.0), 53.06 д и 53.12 д (СН3, 2JCP
та дихлорацетилена. Выход 36.1 г (80%), т. кип.
5.5), 78.11 т (СHN, 2JCP 17.1), 83.89 т (СN, 2JCP 18.1),
73-75°C (1 мм рт. ст.), n20 1.4450. Спектр ЯМР 1H
123.37 (C2Ar), 124.19 (C5Ar), 135.86 (C3Ar), 136.15
(CDCl3), δ, м. д. (J, Гц): 0.92 д и 0.94 д (12H, CH3,
(C4Ar), 139.70 д. д (CP, 1JCP 188.2, 2JCP 14.0), 141.46
3JHH 4.0). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.
(C1Ar), 142.05 (C6Ar), 151.59 д. д (CP, 1JCP 186.2, 2JCP
(J, Гц): 22.74 д и 22.97 д (CH3, 3JCP 4.0), 61.74 д (C1,
9.1), 196.27 (C=O), 197.05 д (C=O, 3JCP 1.0). Спектр
1JCP 298.8), 71.60 д (OCH, 2JCP 5.0), 78.17 д (C2, 2JCP
ЯМР 31P (CDCl3), δР, м. д. (J, Гц): 10.25 д (3JPP 14.2),
57.3). Спектр ЯМР 31P (CDCl3): δР -11.81 м. д.
10.54 д (3JPP 14.2). Масс-спектр (HRMS-ESI), m/z:
456.3327 [M + H]+ (вычислено для C19H23NO8P2:
2-(3,4-Дигидро-2H-пиррол-1-илий)-1,3-ди-
456.3332).
оксо-2,3-дигидро-1H-инден-2-ид
(2).
Нинги-
дрин (1.673 г, 9.4 ммоль) растворяли в метаноле
Тетраэтил-(1,3-диоксо-1,3,5′,6′,7′,7a′-гекса-
(7.5 мл), затем при перемешивании медленно до-
гидроспиро[инден-2,3′-пиррозилин]-1′,2′-ди-
бавляли L-пролин (1.081 г, 9.4 ммоль) во избежа-
ил)бисфосфонат (3б). Выход 89%, маслообраз-
ние вспенивания смеси из-за выделения углекис-
ная бесцветная вязкая жидкость. Спектр ЯМР 1H
лого газа. Наблюдалось образование оранжевого
(СDCl3), δ, м. д. (J, Гц): 1.09 т и 1.14 т (6Н, СН3С-
осадка. После добавления L-пролина полученную
Н2О, 3JНН 7.1), 1.38 т (6Н, СН3СН2О, 3JНН 7.0), 1.71
смесь оставляли при перемешивании на ночь, за-
м и 2.18 м (2Н, CH2), 1.92 м (2H, CH2), 2.60 м и 2.78
тем осадок отфильтровывали на фильтре Шотта,
м (2Н, СH2N), 3.98 д. к и 4.01 д. к (4H, СН3СН2О,
промывали холодным абсолютным метанолом
3JНН 7.0, 3JНР 7.3), 4.23 м (4H, СН3СН2О), 4.73 м
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 7 2023
1054
СОКОЛОВ и др.
(1Н, СНN), 7.85 м (2H, CHAr), 8.01 м (2H, CHAr).
δР
8.06 м. д. Масс-спектр (HRMS-ESI), m/z:
Спектр ЯМР 13C (СDCl3), δС, м. д. (J, Гц): 15.84
410.8001 [M + H]+ (вычислено для C19H21ClNO5P:
д и 15.91 д (СН3СН2О, 3JCP 7.0), 16.32 д и 16.38
410.8013).
д (СН3СН2О, 3JCP 6.2), 26.52 (СН2), 31.49 (СН2),
Диизопропил-(1′-хлор-1,3-диоксо-
49.05 (СН2N), 62.65 д (СН3СН2О, 2JCP 5.9), 62.83
1,3,5′,6′,7′,7a′-гексагидроспиро[инден-2,3′-пир-
д и 62.86 д (СН3СН2О, 2JCP 6.0), 78.21 т (СHN, 2JCP
ролизин]-2′-ил)фосфонат
(5в). Выход
85%,
16.9), 84.03 т (СN, 2JCP 18.1), 123.43 (C2Ar), 124.27
маслообразная светло-желтая вязкая жидкость.
(C5Ar), 135.71 (C3Ar), 136.01 (C4Ar), 139.89 д. д (CP,
Спектр ЯМР 1H (ДМСО-d6), δ, м. д. (J, Гц): 1.36
1JCP 188.7, 2JCP 13.6), 141.70 (C1Ar), 142.33 (C6Ar),
м (12H, CH3CHO) 1.82 м (2H, СН2), 2.06 м и 2.22
152.01 д. д (CP, 1JCP 186.6, 2JCP 9.1), 196.60 (C=O),
м (2Н, СН2), 2.81 м (2Н, СH2N), 4.61 м (1Н, СНN),
197.45 д (C=O, 3JCP 1.0). Спектр ЯМР 31P (CDCl3),
4.76 д. септетов (2H, CH3CHO, 3JHP 12.3, 2JHH
δР, м. д. (J, Гц): 7.64 д (3JPP 14.1), 8.00 д (3JPP 14.1).
6.2), 7.94 м (2H, CHAr), 8.05 м (2H, CHAr). Спектр
Масс-спектр (HRMS-ESI), m/z: 512.4409 [M + H]+
ЯМР 13C ЯМР (ДМСО-d6), δС, м. д. (J, Гц): 23.94 м
(вычислено для C23H31NO8P2: 512.4418).
(CH3CHO), 27.00 (СН2), 32.09 (СН2), 48.36 (СН2N),
Диметил-(1′-хлор-1,3-диоксо-1,3,5′,6′,7′,7a′-
71.58 д и 71.68 д (CH3CHO, 2JCP 5.0), 74.67 д (СHN,
гексагидроспиро[инден-2,3′-пирролизин]-
3JCP 13.1), 83.56 д (СN, 2JCP 14.1), 123.75 (C2Ar),
2′-ил)фосфонат (5a). Выход 81%, маслообраз-
124.10 (C5Ar), 134.60 д (CP, 1JCP 192.4), 135.62 д
ная светло-желтая вязкая жидкость. Спектр ЯМР
(CCl, 2JCP 6.5), 136.59 (C3Ar), 136.93 (C4Ar), 141.69
1H (ДМСО-d6), δ, м. д. (J, Гц): 1.79 м (2H, СН2),
(C1Ar), 141.92 (C6Ar), 196.26 (C=O), 198.37 д (C=O,
2.05м и 2.22 м (2Н, СН2), 2.82 м (2Н, СH2N), 3.71 д
3JCP 2.0). Спектр ЯМР 31P (CDCl3): δР 5.50 м. д.
(6Н, СН3О, 3JНP 9.3), 4.60 м (1Н, СНN), 7.94 м (2H,
Масс-спектр (HRMS-ESI), m/z: 438.8522 [M + H]+
CHAr), 8.04 м (2H, CHAr). Спектр ЯМР 13C (ДМ-
(вычислено для C21H25ClNO5P: 438.8539).
СО-d6), δС, м. д. (J, Гц): 26.85 (СН2), 31.86 (СН2),
48.44 (СН2N), 52.81 д и 52.88 д (СН3О, 2JCP 5.5),
ИНФОРМАЦИЯ ОБ АВТОРАХ
74.25 д (СHN, 2JCP 14.1), 83.54 д (СN, 3JCP 14.1),
Пронина Юлия Алексеевна, ORCID: https://
123.82 (C2Ar), 124.19 (C5Ar), 131.44 д (CP, 1JCP 52.3),
orcid.org/0000-0002-6874-5047
136.69 (C3Ar), 137.01 (C4Ar), 137.21 д (CСl, 2JCP 7.0),
141.69 (C1Ar), 141.88 (C6Ar), 195.82 (C=O), 197.79
Егоров Дмитрий Михайлович, ORCID: https://
(C=O). Спектр ЯМР 31P (CDCl3): δР 11.18 м. д.
orcid.org/0000-0003-3744-9306
Масс-спектр (HRMS-ESI), m/z: 382.7463 [M + H]+
Александр Владимирович Степаков, ORCID:
(вычислено для C17H17ClNO5P: 382.7475).
Диэтил-(1′-хлор-1,3-диоксо-1,3,5′,6′,7′,7a′-
Станислав Михайлович Рамш, ORCID: https://
гексагидроспиро[инден-2,3′-пирролизин]-
orcid.org/0000-0003-4613-068X
2′-ил)фосфонат (5б). Выход 86%, маслообраз-
ная светло-желтая вязкая жидкость. Спектр ЯМР
ФИНАНСОВАЯ ПОДДЕРЖКА
1H (ДМСО-d6), δ, м. д. (J, Гц): 1.32 т и 1.36 т (6Н,
Работа выполнена в рамках государственно-
СН3СН2О, 3JНН 8.0), 1.79 м (2H, СН2), 2.05 м и
го задания при поддержке Министерства науки
2.23 м (2Н, СН2), 2.85 м (2Н, СH2N), 4.15 м (4H,
и высшего образования Российской Федерации
СН3СН2О), 4.60 м (1Н, СНN), 7.93 м (2H, CHAr),
(FSEN-2023-0002) с использованием оборудова-
8.03 м (2H, CHAr). Спектр ЯМР 13C (ДМСО-d6), δС,
ния Инжинирингового центра Санкт-Петербург-
м. д. (J, Гц): 16.30 д (СН3СН2О), 26.90 (СН2), 31.96
ского государственного технологического инсти-
(СН2), 48.39 (СН2N), 62.51 д и 62.64 д (СН3СН2О,
тута (технического университета).
2JCP 8.3), 74.39 д (СHN, 2JCP 14.1), 83.53 д (СN, 3JCP
14.1), 123.79 (C2Ar), 124.14 (C5Ar), 133.17 д (CP, 1JCP
КОНФЛИКТ ИНТЕРЕСОВ
192.2), 136.47 д (CСl, 2JCP 7.0), 136.64 (C3Ar), 136.97
(C4Ar), 141.69 (C1Ar), 141.89 (C6Ar), 195.99 (CO),
Авторы заявляют об отсутствии конфликта
198.03 д (C=O, 3JCP 2.0). Спектр ЯМР 31P (CDCl3):
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 7 2023
1,3-ДИПОЛЯРНОЕ ЦИКЛОПРИСОЕДИНЕНИЕ СТАБИЛЬНОГО АЗОМЕТИНИЛИДА
1055
СПИСОК ЛИТЕРАТУРЫ
17.
Chen M., Zhang L., Lu A., Wang X., Si W., Yan J.,
Yang C. // Bioorg. Med. Chem. 2020. Vol. 30. N 21.
1.
Liu J., Liu R., Wei Y., Shi M. // Trends Chem. 2019. Vol. 1.
P. 127519. doi 10.1016/j.bmcl.2020.127519
N 8. P. 779. doi 10.1016/j.trechm.2019.06.012
18.
Tomovic K., Ilic B.S., Smelcerovic A. // J. Med.
2.
Wang J., Blaszczyk S.A., Li X., Tang W. // Chem.
Chem. 2021. Vol. 64. P. 9639. doi 10.1021/acs.
Rev. 2021. Vol. 121. N 1. P. 110. doi 10.1021/acs.
jmedchem.1c00293
chemrev.0c00160
19.
de Silva N.H., Pyreddy S., Blanch E.W., Hügel H.M.,
3.
Adrio J., Carretero J.C. // Chem. Commun. 2019.
Maniam S. // Bioorg. Chem. 2021. Vol. 114. P. 105128.
Vol. 55. P. 11979. doi 10.1039/C9CC05238K
doi 10.1016/j.bioorg.2021.105128
4.
Saeed R., Sakla A.P., Shankaraiah N. // Org.
20.
Kumar N., Inwati G.K., Ahmed E.M., Lal C., Makwana B.,
Biomol. Chem. 2021. Vol. 19. P. 7768. doi 10.1039/
Yadav V.K., Islam S., Ahn H.-J., Yadav K.K., Jeon B.-H. //
D1OB01176F
Catalysts. 2022. Vol. 12. N 2. P. 213. doi 10.3390/
5.
Bilodeau D.A., Margison K.D., Serhan M.,
catal12020213
Pezacki J.P. // Chem. Rev. 2021. Vol. 121. N 12.
21.
L.J. McGaw, V. Steenkamp, J.N. Eloff // J.
P. 6699. doi 10.1021/acs.chemrev.0c00832
Ethnopharmacol. 2007. Vol. 110. P. 16. doi 10.1016/j.
6.
Gui H.-Z., Wei Y., Shi M. // Chem. Asian J. 2020.
jep.2006.08.029
Vol. 15. N 8. P. 1225. doi 10.1002/asia.202000054
22.
Stepakov A.V., Filatov A.S., Boitsov V.M., Lozovskiy S.V. //
7.
Mloston G., Shermolovich Y., Heimgartner H. //
Phosphorus, Sulfur, Silicon, Relat. Elem. 2021.
Materials. 2022. Vol.15. P. 7244. doi 10.3390/
Vol. 197. N 2. P. 67. doi 10.1080/10426507.2021.2017436
ma15207244
23.
Filatov A.S., Wang S., Khoroshilova O.V., Lozov-
skiy S.V., Larina A.G., Boitsov V.M., Stepakov A.V. //
8.
Doyle M.P., Marichev K.O. // Org. Biomol. Chem. 2019.
J. Org. Chem. 2019. Vol. 84. P. 7017. doi 10.1021/acs.
Vol. 17. P. 4183. doi 10.1039/C9OB00478E
joc.9b00753
9.
Bera S., Biswas A., Samanta R. // Chem. Record. 2021.
24.
Erkhitueva E.B., Panikorovskii T.L., Svintsitskaya N.I.,
Vol. 21. N 12. P. 3332. doi 10.1002/tcr.202100061
Trifonov R.Е., Dogadina А.V. // Synlett. 2018. Vol. 29.
10.
Kerru N., Gummidi L., Maddila S., Gangu K.K.,
N 7. P. 933. doi 10.1055/s-0036-1591919
Jonnalagadda S.B. // Molecules. 2020. Vol. 25. N 8.
25.
Egorov D.M., Piterskaya Y.L., Dogadina A.V.,
P.1909. doi 10.3390/molecules25081909
Svintsitskaya N.I. // Tetrahedron Lett. 2015. Vol. 56.
11.
Kachaeva M.V., Obernikhina N.V., Veligina E.S.,
N 12. P. 1552. doi 10.1016/j.tetlet.2015.02.027
Zhuravlova M.Yu., Prostota Y.O., Kachkovsky O.D.,
26.
Babushkina A.A., Dogadina A.V., Egorov D.M.,
Brovarets V.S. // Chem. Heterocycl. Compd. 2019.
Piterskaia J.L., Shtro A.A., Nikolaeva Y.V., Galochki-
Vol. 55. P. 448. doi 10.1007/s10593-019-02478-6
na A.V., Kornev A.A., Boitsov V.M. // Med. Chem. Res.
12.
Mermer A., Keles T., Sirin Y. // Bioorg. Chem. 2021.
2021. Vol. 30. N 12. P. 2203. doi 10.1007/s00044-021-
Vol. 114. P. 105076. doi 10.1016/j.bioorg.2021.105076
02801-x
13.
Денисова Е.И., Липин Д.В., Пархома К.Ю., Девят-
27.
Егоров Д.М., Петросян А.А., Питерская Ю.Л.,
кин И.О., Шипиловских Д.А., Чащина С.В., Махму-
Свинцицкая Н.И., Догадина А.В. // ЖОХ. 2018.
дов Р.Р., Игидов Н.М., Шипиловских С.А. // ЖОрХ.
Т. 88. Вып. 11. С. 1911; Egorov D.M., Petrosyan A.A.,
2021. Т. 57. № 12. С. 1736; Denisova E.I., Lipin D.V.,
Piterskaya Yu.L., Svintsitskaya N.I., Dogadina A.V. //
Parkhoma K.Y., Devyatkin I.O., Shipilovskikh D.A.,
Russ. J. Gen. Chem. 2018. Vol. 88. N 11. P. 2435. doi
Chashchina S.V., Makhmudov R.R., Igidov N.M.,
10.1134/S1070363218110294
Shipilovskikh, S.A. // Russ. J. Org. Chem. 2021.
28.
Krylov A.S., Kaskevich K.I., Erkhitueva E.B.,
Vol. 57. P. 1955. doi 10.1134/s1070428021120083
Svintsitskaya N.I., Dogadina A.V. // Tetrahedron
14.
Gerokonstantis D.T., Nikolaou A., Magkrioti C.,
Lett. 2018. Vol. 59. N 49. P. 4326. doi 10.1016/j.
Afantitis A., Aidinis V., Kokotos G., Minakakis P.M. //
tetlet.2018.10.052
Bioorg. Med. Chem. 2019. Vol. 28. N 2. P. 115216. doi
29.
Krylov A.S., Petrosian A.A., Piterskaya J.L.,
10.1016/j.bmc.2019.115216
Svintsitskaya N.I., Dogadina A.V. // Beilstein J. Org.
15.
Sreekanth K., Jha A. // Russ. J. Gen. Chem. 2020.
Chem. 2019. Vol. 15. P. 1563. doi 10.3762/bjoc.15.159.
Vol. 90. N 1. P. 129. doi 10.1134/S107036322001020X
30.
Журавлева П.А., Колина А.И., Свинцицкая Н.И.,
16.
Kocabaş E., Sarıgüney A.B., Erci F., Çakır-Koç R.,
Догадина А.В. // ЖОХ. 2021. Т. 91. № 10. С. 1594;
Kocabaş H.Ö., Torlak E., Coşkun A. // Biointerface Res.
Zhuravleva P.A., Kolina A.I., Svintsitskaya N.I.,
App. Chem. 2021. Vol. 11. N 4. P. 12178. doi 10.33263/
Dogadina A.V. // Russ. J. Gen. Chem. 2021. Vol. 91.
BRIAC114.1217812185
N 10. P. 2031. doi 10.1134/S1070363221100169
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 7 2023
1056
СОКОЛОВ и др.
31. Дакуо К.Н., Крылов А.С., Свинцицкая Н.И. //
Ionin B.I. // Russ. J. Gen. Chem. 2012. Vol. 82. N 4.
ЖОХ. 2022. Т. 92. № 11. С. 1728; Dakuo K.N.,
P. 652. doi 10.1134/S1070363212040068
Krylov A.S., Svintsitskaya N.I. // Russ. J. Gen.
34. Artyushin O.I., Matveeva E.V., Bushmarinov I.S.,
Chem. 2022. Vol. 92. P. 2267. doi 10.1134/
Odinets I.L. // Arkivoc. 2012. Vol. 2012. P. 252. doi
S107036322211010X
10.3998/ark.5550190.0013.419
32. Титов К.С., Кривчун М.Н., Свинцицкая Н.И. //
35. Zhu S., Zhang Y., Li P., Bi W., Chen X., Zhao Y. //
ЖОХ. 2014. Т. 84. Вып. 10. С. 1748; Titov K.S.,
Phosphorus, Sulfur, Silicon, Relat. Elem. 2017. Vol.
Krivchun M.N., Svintsitskaya N.I. // Russ. J. Gen.
192. N1. P. 1. doi 10.1080/10426507.2016.1223076
Chem. 2014. Vol. 84. N 10. P. 2049. doi 10.1134/
36. Philippov I., Gatilov Yu., Sonina A., Vorob’ev A. //
S107036321410034X
33. Титов К.С., Свинцицкая Н.И., Ионин Б.И. // ЖОХ.
Molecules. 2022. Vol. 27. N 22. P. 7913. doi 10.3390/
2012. Т.82. Вып. 4. С. 566; Titov K.S., Svintsitskaya N.I.,
molecules27227913
1,3-Dipolar Cycloaddition of Stable Azomethine Ylide Based
on Ninhydrin and L-Proline to Phosphorylated Acetylenes
A. A. Sokolova, D. M. Egorova,*, Yu. A. Proninaa, S. M. Ramsha, and A. V. Stepakova,b
aSt. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
b St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: diavoly@mail.ru
Received April 28, 2023; revised June 17, 2023; accepted June 21, 2023
The reaction of 1,3-dipolar cycloaddition of a stable azomethine ylide formed from ninhydrin and L-proline to
activated acetylenic phosphonates was studied. It was found that the reactions proceed under mild conditions
with high regioselectivity with the formation of cycloadducts with a spiro[inden-2,3’-pyrrolysine]-1,3-dione
backbone.
Keywords: 1,3-dipolar cycloaddition, chloroethynylphosphonate, ethynyldiphosphonate, azomethine ylide,
regioselectivity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 7 2023