ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 8, с. 1173-1177
УДК 547.745
СИНТЕЗ 5-АРИЛ-4-АЦИЛ-3-ГИДРОКСИ-
1-КАРБОКСИМЕТИЛ-3-ПИРРОЛИН-2-ОНОВ
ГИДРОЛИЗОМ 5-АРИЛ-4-АЦИЛ-3-ГИДРОКСИ-
1-ЦИАНОМЕТИЛ-3-ПИРРОЛИН-2-ОНОВ
© 2023 г. В. Л. Гейн1,*, Е. А. Булдакова1
1 Пермская государственная фармацевтическая академия, ул. Полевая 2, Пермь, 614990 Россия
*e-mail: geinvl48@mail.ru
Поступило в редакцию 2 мая 2023 г.
После доработки 10 июля 2023 г.
Принято к печати 20 июля 2023 г.
Кислотным гидролизом 5-арил-4-ацил-3-гидрокси-1-цианометил-3-пирролин-2-онов получены
5-арил-4-ацил-3-гидрокси-1-карбоксиметил-3-пирролин-2-оны с выходом 53-79%. Структура полу-
ченных соединений подтверждена спектральными данными (ИК, ЯМР 1Н, 13С) и встречным синтезом.
Ключевые слова: 5-арил-4-ацил-3-гидрокси-1-карбоксиметил-3-пирролин-2-оны, глицин, 5-арил-4-
ацил-3-гидрокси-1-цианометил-3-пирролин-2-оны
DOI: 10.31857/S0044460X23080036, EDN: IXBQGO
Известно, что 1,4,5-тризамещенные тетраги-
дифицирована, что позволяет разнообразить ряды
дропиррол-2,3-дионы, представляющие класс пя-
последних, и, как следствие, расширяет возможно-
тичленных азотсодержащих гетероциклических
сти поиска среди них потенциальных фармаколо-
соединений, обладают широким спектром биоло-
гически активных веществ [8, 13, 14].
гической активности [1]. Ранее сообщалось, что
Исходя из вышеизложенного, такие гете-
данные соединения проявляют такие виды био-
роциклические соединения, как
1,4,5-тризаме-
логической активности, как противоопухолевая
щенные тетрагидропиррол-2,3-дионы являются
[2-5], антибактериальная [5], противовирусная [6]
перспективными кандидатами в лекарственные
и антиоксидантная [7].
средства, а их изучение представляется актуальным.
Не менее важным является и тот факт, что
Ранее мы сообщали о синтезе
4-арил-5-
тризамещенные тетрагидропиррол-2,3-дионы воз-
ацил-3-гидрокси-1-цианометил-3-пирролин-2-
можно получить трехкомпонентной конденсацией
онов [15], которые были изучены в реакциях с
[8-13] - методом, который позволяет значительно
моно- и бинуклеофильными реагентами, и на
сократить время проведения реакции и снизить
основе которых были получены различные ами-
затраты на выделение и очистку промежуточных
нопроизводные тетрагидропиррол-2,3-дионов и
продуктов, что, несомненно, является преимуще-
конденсированные гетероциклические системы
ством с точки зрения синтетической эффективно-
сти и считается оптимальным способом получения
[15, 16]. Следует отметить, что нитрильная группа
структурно сложных и биологически активных
оказалась нейтральной в отношении данных реа-
веществ. Кроме того, благодаря наличию несколь-
гентов, вследствие чего для дальнейшего изучения
ких реакционных центров структура тетрагидро-
реакционной способности цианогруппы в составе
пиррол-2,3-дионов может быть дополнительно мо-
тетрагидропиррол-2,3-дионов 1а-д и синтеза но-
1173
1174
ГЕЙН, БУЛДАКОВА
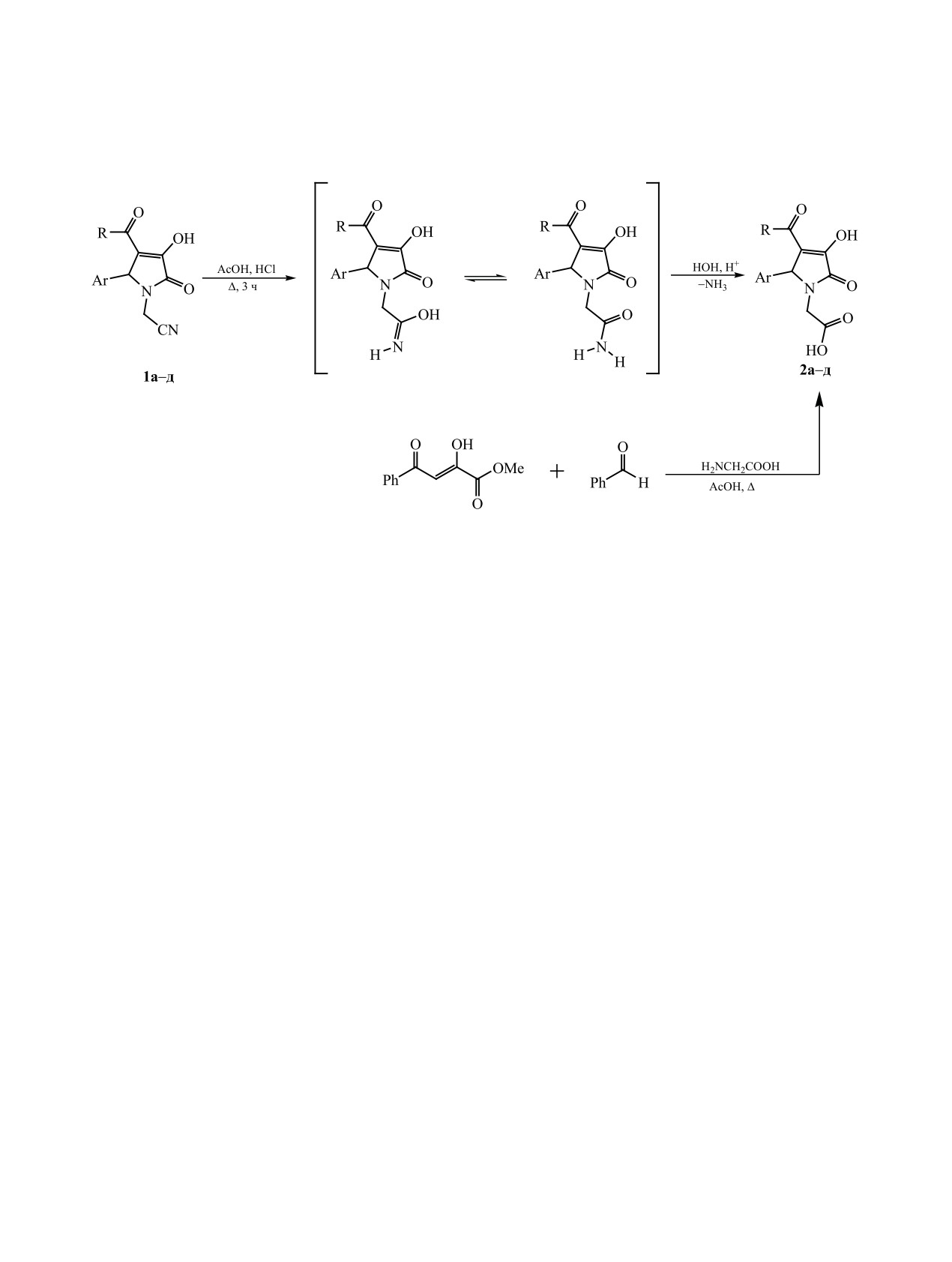
Схема 1.
R = Me, Ar = Ph (2а), 4-EtOC6H4 (2б); R = Ar = Ph (2в); R = 4-NO2C6H4, Ar = Ph (2г), 4-ClC6H4 (2д).
вых производных нами осуществлен их кислот-
В спектрах ЯМР 1Н соединений 2а-д наблюда-
ный гидролиз в смеси уксусной и хлороводород-
ется уширенный синглет протона карбоксильной
ной кислот. Установлено, что реакция протекает
ОН-группы при 12.87-12.93 м. д. Сигналы про-
при кипячении в течение 3 ч и приводит к обра-
тонов двух дублетов карбоксиметильной группы
зованию 5-арил-4-ацил-3-гидрокси-1-карбоксиме-
сдвигаются относительно исходных соединений
тил-3-пирролин-2-онов 2а-д (схема 1).
1а-д в область сильного поля (3.25-3.47 м. д., HAHB
и 4.20-4.30 м. д., HAHB) с КССВ 17.6 Гц. Характе-
Соединения
2а-г представляют собой кри-
сталлические вещества белого цвета; 5-арил-4-
ристичные сигналы метинового протона у атома
ацил-3-гидрокси-1-карбоксиметил-3-пирролин-2-
С5 регистрируются при 5.17-5.52 м. д. В области
оны 2а и 2б растворяются в обычных органиче-
6.27-8.28 м. д. наблюдаются мультиплетные сиг-
ских растворителях, соединения 2в-д - в ДМСО,
налы ароматических протонов. В спектрах ЯМР
ДМФА и диоксане, при нагревании в этаноле, ле-
13C соединений 2а-д присутствуют сигналы ато-
дяной уксусной кислоте, изопропиловом спирте,
мов углерода С=О (188.03-192.34 м. д.), НОС=О
ацетонитриле, и нерастворимые в воде.
(169.26-169.79 м. д.), NC=О (165.43-165.88 м. д.),
=С-ОН (157.71-155.55 м. д.).
В ИК спектрах соединений 2а-д присутствует
широкая интенсивная полоса поглощения валент-
Для окончательного доказательства структу-
ных колебаний карбоксильной ОН-группы (3058-
ры полученных соединений 2а-д нами проведен
3127 см-1), которая перекрывается с полосой ва-
встречный синтез соединения 2в трехкомпонент-
лентных колебаний О-Н енольной формы, а также
ной конденсацией метилового эфира бензоилпи-
полосы поглощения С=О карбоксильной группы
ровиноградной кислоты со смесью бензальдегида
(1734-1741 см-1), групп NC=О (1693-1703 см-1) и
и глицина в ледяной уксусной кислоте (схема 1).
С=О ацильного фрагмента (1659-1669 см-1). В ИК
Физико-химические характеристики и спектраль-
спектре соединения 2д регистрируется узкая поло-
ные данные полученного соединения совпадают с
са поглощения свободного, неассоциированного
таковыми для 1-карбоксиметил-3-пирролин-2-она
енольного гидроксила при 3457 см-1.
2в, полученного нами путем кислотного гидроли-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 8 2023
СИНТЕЗ 5-АРИЛ-4-АЦИЛ-3-ГИДРОКСИ-...
1175
за. Кроме того, образцы, полученные двумя опи-
4-Ацетил-3-гидрокси-1-карбоксиметил-
санными выше методами, не давали депрессии
5-(4-этоксифенил)-3-пирролин-2-он (2б). Выход
температуры плавления в пробе смешанного плав-
0.12 г (63%), т. пл. 232-234°С. ИК спектр, ν, см-1:
ления.
1659 с (C=O), 1697 с (NC=O), 1741 с (HOC=O),
3087 ш (СОOH, СОН). Спектр ЯМР 1Н, δ, м. д.: 2.30
Соединения 2а-д в реакции с хлоридом желе-
с (3Н, СН3), 1.32 т (3Н, ОСН2СН3, J 6.8 Гц), 4.0 к
за(III) дают характерное вишневое окрашивание.
(2Н, ОСН2СН3 J 6.8 Гц), 3.26 д (HAHB, С1Н2, J 17.6
Данный факт, наряду с данными спектров ЯМР,
Гц), 4.20 д (HAHB, С1Н2, J 17.6 Гц), 5.17 с (1Н, С5Н),
доказывает их существование преимуществен-
6.85-7.08 м (4H, СНAr), 11.68 с (1Н, ОНпирролин),
но в енольной форме, которая, по литературным
12.87 (1Н, ОНкарбоксил). Спектр ЯМР 13С, δС, м. д.:
данным [8], стабилизируется за счет образования
15.10, 30.28, 42.01, 60.65, 63.49, 114.89, 127.91,
внутримолекулярной водородной связи с атомом
129.37, 158.89, 165.74, 169.79, 192.34. Найдено, %:
кислорода боковой цепи гетероцикла.
С 60.18; H 5.37; N 4.39. C15H19NO6. Вычислено, %:
Таким образом, гидролиз 4-арил-5-ацил-3-гид-
С 60.39; H 5.63; N 4.58.
рокси-1-цианометил-3-пирролин-2-онов в кислой
4-Бензоил-3-гидрокси-1-карбоксиметил-5-
среде приводит к образованию 1,4,5-тризамещен-
фенил-3-пирролин-2-он
(2в). а. Выход
1.2 г
ных тетрагидропиррол-2,3-дионов, содержащих
(61%), т. пл. 246-248°С. ИК спектр, ν, см-1: 1666
карбоксиметильную группу в положении 1 гетеро-
с (C=O), 1703 с (NC=O), 1734 с (HOC=O), 3058
цикла.
ш (СОOH, СОН). Спектр ЯМР 1Н, δ, м. д.: 3.35
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
д (HAHB, С1Н2, J 17.6 Гц), 4.30 д (HAHB, С1Н2, J
),
17.6 Гц), 5.53 с (1Н, С5Н), 6.27-7.73 м (10H, СНAr
ИК спектры записаны в таблетках KBr (1:100)
11.78
(1Н, ОНпирролин),
12.93
(1Н, ОНкарбоксил).
на ИК Фурье-спектрометре Люмекс ИнфраЛЮМ®
Спектр ЯМР 13C, δС, м. д.: 41.83, 61.36, 120.17,
ФТ-08. Спектры ЯМР 1Н и 13С сняты на приборе
128.06, 128.35, 128.55, 128.62, 132.51, 135.33,
Bruker Avancе III HD (400 и 100 МГц соответствен-
137.75, 150.55, 165.43, 169.26, 189.02. Найдено, %:
но) в ДМCО-d6, внутренний стандарт - ТМС. Эле-
С 67.65; H 4.48; N 4.15. C19H15NO5. Вычислено, %:
ментный анализ проведен на приборе PerkinElmer
С 67.48; H 4.27; N 3.95.
2400. Температуры плавления определены на при-
б. К раствору 0.14 г (2.5 ммоль) глицина в 10 мл
боре Melting Point M-565.
ледяной уксусной кислоты добавляли 0.28 мл
4-Ацетил-3-гидрокси-1-карбоксиметил-
(2.5 ммоль) бензальдегида и 0.52 г (2.5 ммоль)
5-фенил-3-пирролин-2-он
(2a). а. К раствору
метилового эфира бензоилпировиноградной кис-
0.16 г (0.625 ммоль) соединения 1а в 5 мл ледя-
лоты. Реакционную смесь нагревали до полного
ной уксусной кислоты добавляли 5 мл концентри-
растворения всех реагентов и выдерживали при
рованной соляной кислоты. Реакционную смесь
комнатной температуре до образования осадка.
кипятили в течение 3 ч. Выпавший при охлажде-
Выпавший осадок отфильтровывали и перекри-
нии осадок отфильтровывали и перекристаллизо-
сталлизовывали из этилового спирта. Выход 0.61 г
вывали из ацетонитрила. Выход 0.09 г (53%), т. пл.
(73%). Данные ЯМР 1Н и ИК спектров соединений
239-242°С. ИК спектр, ν, см-1: 1662 с (C=O), 1696
2в, полученных методами а и б, совпадают. Проба
с (NC=O), 1737 с (HOC=O), 3065 ш (СООН, СОН).
смешанного плавления не дает депрессии.
Спектр ЯМР 1Н, δ, м. д.: 2.30 с (3Н, СН3), 3.25
3-Гидрокси-1-карбоксиметил-(4-нитробензо-
д (HAHB, С1Н2, J 17.6 Гц), 4.20 д (HAHB, С1Н2, J
ил)-5-фенил-3-пирролин-2-он (2г). Выход 0.23 г
17.6 Гц), 5.22 с (1Н, С5Н), 7.17-7.35 м (5H, СНAr),
(79%), т. пл. 234-236°С. ИК спектр, ν, см-1: 1634
11.65 с (1Н, ОНпирролин), 12.89 (1Н, ОНкарбоксил).
с (C=O), 1667 с (NC=O), 1994 с (HOC=O), 3113
Спектр ЯМР 13С, δС, м. д.: 30.22, 42.13, 61.16,
ш (СОOH, СОН). Спектр ЯМР 1Н, δ, м. д.: 3.37
128.21, 128.65, 128,97, 136,48, 165,88, 169,74,
д (HAHB, С1Н2, J 17.6 Гц), 4.29 д (HAHB, С1Н2, J
192.17. Найдено, %: С 61.09; H 4.76; N 5.09.
18.0 Гц), 5.51 с (1Н, С5Н), 7.30-8.28 м (9H, СНAr),
C14H13NO5. Вычислено, %: С 61.31; H 5.05; N 5.32.
11.91 с (1Н, ОНпирролин), 12.93 (1Н, ОНкарбоксил).
Соединения 2б-д получали аналогично.
Спектр ЯМР 13C, δС, м. д.: 42.44, 61.69, 119.61,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 8 2023
1176
ГЕЙН, БУЛДАКОВА
123.81, 128.39, 128.99, 129.15, 130.24, 135.91,
3.
López-Francés А., Del Corte Х., Serna-Burgos Z.,
143.87, 149.87, 153.71, 165.67, 169.70, 188.03. Най-
Martínez de Marigorta T., Palacios F., Vicario J. //
Molecules. 2022. Vol. 27. N 11. P. 3234. doi 10.3390/
дено, %: С 59.69; H 3.69; N 7.33. C19H14N2O7. Вы-
molecules27113624
числено, %: С 59.87; H 3.85; N 7.12.
4.
Del Corte X, López-Francés A., Villate-Beitia I., Sainz-
3-Гидрокси-1-карбоксиметил-(4-нитробензо-
Ramos M., Martínez de Marigorta E., Palacios F.,
ил)-5-(4-хлорфенил)-3-пирролин-2-он (2д). Вы-
Alonso C., De Los Santos J.M., Pedraz J.L.,
ход 0.36 г (69%), т. пл. 248-251°С. ИК спектр, ν,
Vicario J. // Pharmaceuticals. 2022. Vol. 15. N 5. Р. 511.
см-1: 1669 с (C=O), 1693 с (NC=O), 1736 с (HOC=O),
doi 10.3390/ph15050511
5.
López-Pérez A., Freischem S., Grimm I., Weiergräber O.,
3127 ш (СОOH, СОН), 3457 сл (СОН). Спектр ЯМР
Dingley A. J., López-Alberca M. P., Waldmann H.,
1Н, δ, м. д.: 3.47 д (HAHB, С1Н2, J 17.6 Гц), 4.25 д
Vollmer W., Kumar K., Vuong C. // Antibiotics. 2021.
(HAHB, С1Н2, J 17.6 Гц), 5.52 с (1Н, С5Н), 7.38-8.28
Vol. 10. Р. 529. doi 10.3390/antibiotics10050529
м (18H, СНAr), 12.03 с (1Н, ОНпирролин), 12.93 (1Н,
6.
Liu T., Dai C., Sang H., Chen F., Huang Y., Liao H.,
ОНкарбоксил). Спектр ЯМР 13C, δС, м. д.: 42.61, 61.05,
Liu S., Zhu Q., Yang J. // Eur. J. Med. Chem. 2020.
119.21,
129.07,
130.22,
130.43,
133.53,
135.13,
Vol. 199. Р. 112334. doi 10.1016/j.ejmech.2020.112334
143.92, 149.86, 154.01, 165.72, 169.63, 188.04. Най-
7.
Tran Nguyen N., Viet Dai V., Mechler A., Thi Hoa N., V
дено, %: С 54.76; H 3.14; N 6.72. C19H13 ClN2O7.
Vo Q. // RSC Adv. 2022. Vol. 12. N 38. Р. 24579. doi:
10.1039/d2ra04640g
Вычислено, %: С 54.55; H 2.96; N 6.94.
8.
Гейн В.Л. Тетрагидропиррол- и тетрагидрофу-
ИНФОРМАЦИЯ ОБ АВТОРАХ
ран-2,3-дионы. Пермь: ПГФА, 2004. С. 130.
9.
Nguyen N.T., Dai V.V., Tri N.N., Van Meervelt L.,
Гейн Владимир Леонидович, ORCID: https://
Trung N.T., Dehaen W. // Beilstein J. Org. Chem. 2022.
orcid.org/0000-0002-8512-0399
Vol. 18. N 1. P. 1140. doi 10.3762/bjoc.18.118
10.
Paul S, Das S, Mitra B., Chandra Pariyar G., Ghosh P. //
Булдакова Евгения Анатольевна, ORCID:
RSC Adv. 2023. Vol. 13. N 8. Р. 5457. doi 10.1039/
d2ra08054k
11.
Esmailzadeh S., Setamdideh D. // J. Serb. Chem. Soc.
ФИНАНСОВАЯ ПОДДЕРЖКА
2021. Vol. 86. N 11. P. 1039. doi 10.2298/JSC21
12.
Dutta A., Rohman M.A., Nongrum R., Thongni A.,
Работа выполнена в рамках государ-
Mitra S., Nongkhlaw R. // New J. Chem. 2021. Vol. 45.
ственного задания Пермской государствен-
P. 8136. doi 10.1039/d1nj00343g
ной фармацевтической академии (тема
№
13.
Massaro N.P., Pierce J.G. // Org Lett. 2020. Vol. 22. N 13.
720000Ф.99.1.БН62АБ05000, 2023 г.).
P. 5079. doi 10.1021/acs.orglett.0c01650
14.
Shyshkina M.O., Sakhno Y.I., Radchenko O.V., Shishki-
КОНФЛИКТ ИНТЕРЕСОВ
na S.V., Desenko S.M., Chebanov V.A. // Acta
Авторы заявляют об отсутствии конфликта
Crystallogr. (E). 2021. Vol. 77. N 12. P. 1208. doi
10.1107/S2056989021011312
интересов.
15.
Гейн, В.Л., Булдакова Е.А., Дмитриев М.В. // ЖОрХ.
СПИСОК ЛИТЕРАТУРЫ
2019. Т. 55. № 7. С. 1046; Gein V.L., Buldakova E.A.,
Dmitriev M.V. // Russ. J. Org. Chem. 2018. Vol. 55. N 7
1. Joksimović N., Janković N., Davidović G., Bugarčić Z. //
Р. 951. doi 10.1134/s1070428019070054
Bioorg Chem. 2020. Vol. 105. Р. 104343. doi 10.1016/j.
16.
Гейн, В.Л., Булдакова Е.А., Дмитриев М.В. Мокру-
bioorg.2020.104343
шин И.Г. // ЖОХ. 2020. Т. 90. № 1. С. 50; Gein V.L.,
2. Yuan F., Guochao L., Bin Y. // Acta Pharm. Sin.
Buldakova E.A., Dmitriev M.V. Mokrushin I.G. // Russ.
(B). 2020. Vol. 10. N 7. Р. 1253. doi 10.1016/j.
J. Gen. Chem. 2020. Vol. 90 N 1. P. 34. doi 10.1134/
apsb.2020.01.003
s1070363220010065
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 8 2023
СИНТЕЗ 5-АРИЛ-4-АЦИЛ-3-ГИДРОКСИ-...
1177
Synthesis of 5-Aryl-4-acyl-3-hydroxy-1-carboxymethyl-
3-pyrroline-2-ones by Hydrolysis of 5-Aryl-4-acyl-3-hydroxy-
1-cyanomethyl-3-pyrroline-2-ones
V. L. Geina,* and E. A. Buldakovaa
a Perm State Pharmaceutical Academy, Perm, 614990 Russia
*e-mail: geinvl48@mail.ru
Received May 2, 2023; revised July 10, 2023; accepted July 20, 2023
5-Aryl-4-acyl-3-hydroxy-1-carboxymethyl-3-pyrroline-2-ones were obtained by acid hydrolysis of 5-aryl-4-acyl-
3-hydroxy-1-cyanomethyl-3-pyrrolin-2-ones. Structure of the obtained compounds was confirmed by spectral
data (IR, 1Hб and 13С NMR) and authentic synthesis.
Keywords: 5-aryl-4-acyl-3-hydroxy-1-carboxymethyl-3-pyrroline-2-ones, glycine, 5-aryl-4-acyl-3-hydroxy-
1-cyanomethyl-3-pyrroline-2-ones
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 8 2023