ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 9, с. 1403-1412
УДК 547.1;539.26;546.151;546.175;548.315
ИОДИД И НИТРАТ ТРИС(2,6-ДИМЕТОКСИФЕНИЛ)-
ЭТИЛСТИБОНИЯ: СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА
© 2023 г. И. В. Егорова1,*, В. В. Жидков1, И. Н. Зубакина1, Н. А. Родионова1,
Н. В. Куратьева2, Н. В. Первухина2
1 Благовещенский государственный педагогический университет, ул. Ленина 104, Благовещенск, 675000 Россия
2 Институт неорганической химии имени А. В. Николаева Сибирского отделения Российской академии наук,
Новосибирск, 630090 Россия
*е-mail: bgpu.chim.egorova@mail.ru
Поступило в редакцию 5 июля 2023 г.
После доработки 14 августа 2023 г.
Принято к печати 14 августа 2023 г.
Алкилированием трис(2,6-диметоксифенил)стибина Ar3Sb, где Ar = 2,6-(MeO)2C6H3, иодэтаном
в хлороформе получен [Ar3EtSb]I, реагирующий далее с нитратом свинца(II) с образованием
[Ar3EtSb]NO3·0.75Н2О. Сравнительная характеристика комплексов выполнена методами РСА, ИК
спектроскопии и синхронного термического анализа. Атомы сурьмы в стибониевых катионах имеют
искаженную тетраэдрическую координацию, угол CSbC 106.80(12)-115.22(12)° и 105.33(14)-115.33(14)°.
В кипящем водном растворе [Ar3EtSb]I [Ar3EtSb]NO3·0.75Н2О разлагаются до трис(2,6-диметоксифенил)-
стибина.
Ключевые слова: органические соединения сурьмы, триарилстибин, этилиодид, нитрат свинца(II),
термогравиметрия
DOI: 10.31857/S0044460X23090093, EDN: WYHFPN
Органические соединения сурьмы обладают
R2CHO (R2 = Ph, 4-ClC6H4, 4-MeC6H4, PhCH=CH,
инсектицидной, антибактериальной, антипрото-
пиридин-2-ил, 4-BrC6H4) с последующим гидро-
зойной, противовирусной, фунгицидной, проти-
лизом образующихся продуктов, используется в
вораковой активностью [1-10]. Используются в
синтезе вторичных спиртов [23-25]. Метакрилат
аналитической практике, обладают большим син-
и кротонат тетрафенилсурьмы были использованы
тетическим потенциалом в реакциях арилирования
для получения сурьмасодержащего полистирола
спиртов, фенолов, аминов, хиноксалинонов, бензо-
[26]. Иодид и бромид тетрафенилсурьмы высту-
фуранов, тиофенов, амидирования первичных ами-
пают катализаторами в реакции конденсации ок-
нов [11-19]. Палладий-катализируемая кросс-кон-
сиранов с изоцианатами, карбодиимидами, проте-
денсация дихлорида или диацетата триарилсурьмы
кающей с образованием 3,4-, 3,5-дизамещенных
с органостаннанами или арилборными кислотами
оксазолидин-2-онов и 3,4-дизамещенных оксазо-
и монооксидом углерода позволяет получать раз-
лидин-2-иминов
[27]. Иодид тетрафенилстибо-
нообразные диарилкетоны в мягких условиях
ния - катализатор циклоприсоединения диоксида
[20, 21]. Дибромид трифенилсурьмы - катализа-
углерода к оксетану для селективного получения
тор в синтезе α-дикетонов [22]. Стереоселектив-
триметиленкарбоната [28].
ное присоединение бромидов тетраалкилстибо-
ния общей формулы [(Alk)3SbСН2Е]Br [Alk = Et,
Соли тетраарил- и тетраалкилстибония с хоро-
n-Bu; E = Ph, CH=CH2, CH=CHCO2Et, CO2Me, CN,
шим выходом образуются при взаимодействии пен-
CH=CHR1; R1 = Me, C3H7, CH(CH3)2] к альдегидам
таорганилсурьмы с соответствующими кислотами
1403
1404
ЕГОРОВА и др.
[13]. Менее изучены методы синтеза и свойства со-
[Ar3AlkSb] содержит 2,6-заместители (MeO)2C6H3
лей тетраорганилстибония, содержащих при ато-
и Et. Присутствие в заместителях ароматического
ме сурьмы различные органические заместители
лиганда n-доноров (атомов кислорода) способно
[Ar4-nAlknSb]Х. Основной способ получения сое-
приводить к гипервалентному взаимодействию,
динений [Ar4-nAlknSb]Х (n = 2, 3) - алкилирова-
и, как следствие, увеличению координационно-
ние Ar2AlkSb или ArAlk2Sb алкилгалогенидом.
го числа центрального атома, а также оказывать
Однако долгое время данным способом не удава-
влияние на пространственную упаковку молекул в
лось синтезировать [Ar3AlkSb]Hlg. Поэтому для
кристалле.
получения стибониевых соединений [Аr3МеSb]Х,
Целью данных исследований является разра-
Аr = Ph, Tol, Mes, (3,4-Me)2C6H3, (2,4-Me)2C6H3,
ботка удобного метода синтеза солей тетраорга-
Х = BF4, в качестве алкилирующего агента исполь-
нилстибония, содержащих в ароматических за-
зовали борфториды триметилоксония
[29-31].
местителях катиона [Ar3AlkSb]+ потенциальные
Синтез стибониевых соединений общей формулы
координирующие центры (атомы кислорода ме-
[Ar3AlkSb]Hlg [Ar = 2,6-(MeO)2C6H3; Alk = Me, Et,
токсигрупп), установление их строения и свойств.
n-Bu, СН2СН=СН2; Hlg = Cl, Br, I] описан в работе
Трифенилстибин не вступает в реакцию с
[32].
галогеналканами. Возможность алкилирования
Ранее алкилированием трис(2,6-диметок-
галоидными алкилами трис(2,6-диметоксифенил)-
сифенил)стибина этиловым эфиром иодук-
стибина обусловлена его большей нуклеофиль-
сусной кислоты и 1,4-дииодбутаном нами по-
ностью, связанной с присутствием в фениль-
лучены
[Ar3RSb]n+In-
[Ar
=
2,6-(MeO)2C6H3;
ных заместителях сильных электронодонорных
n = 1, R = Me, (CH2)4I, CH2C(O)OEt; n = 2,
MeО-групп.
R = (CH2)4SbAr3] и [Ar3SbCH2C(O)OEt]2[Hg2I6],
Алкилирование трис(2,6-диметоксифенил)сти-
[Ar3MeSb]2[HgI4]∙DMSO [33]. Границы примени-
бина иодистым этилом (1:1.3 мол.) проводили в
мости алкилгалогенидов для алкилирования три-
хлороформе при комнатной температуре в течение
арилстибина нами успешно расширены на приме-
48 ч (схема 1). Данная реакция в бензоле протека-
ре трис(N,N-диметиламинофенил)стибина
[34].
ет более чем с трехкратным избытком алкилирую-
Строение
[(4-N,N-Me2C6H4)3MeSb]I и
[(4-N,N-
щего агента [32]. Нами показано, что уменьшение
Me2C6H4)3MeSb]2[Hg2I6]·2DMSO установлено ме-
количества этилиодида (~ в 2 раза), по отноше-
тодами РСА и спектроскопии ЯМР.
нию к указанному в работе [32], не снижает вы-
Подавляющее большинство соединений су-
ход продукта реакции. Бесцветные кристаллы
рьмы общей формулы Ar4SbX, строение которых
иодида трис(2,6-диметоксифенил)этилстибония
установлено методом РСА, является производны-
{[2,6-(MeО)2C6H3)3]EtSb}I 1 выделены с выхо-
ми тетрафенилстибония. Соединения, содержа-
дом 94%. Синтез нуклеофила - трис(2,6-диметок-
щие при атоме сурьмы три арильных и алкильный
сифенил)стибина - основан на взаимодействии
заместители, исследованы крайне недостаточно:
хлорида сурьмы(III) с 2,6-диметоксифениллити-
в Кембриджском центре кристаллографических
ем, полученным из 1,3-диметоксибензола и менее
данных они представлены менее, чем 5% от обще-
пирофорного (по сравнению с использованным в
го числа Ar4SbX. Сравнение между собой соедине-
работе [32] бутиллитием) фениллития.
ний тетраорганилстибония позволит определить
влияние природы Ar-, Alk-заместителей, аниона
Реакцией обмена между соединением 1 и ни-
Х- и растворителя на пространственное строение
тратом свинца(II) (схема 1) в этиловом спирте
Ar3AlkSbХ и их свойства. Основой для выявле-
впервые получен нитрат трис(2,6-диметоксифе-
ния закономерностей изменения прочности свя-
нил)этилстибония. Реакционную смесь перемеши-
зей Sb-С в соединениях Ar3AlkSbХ является на-
вали 1 ч при комнатной температуре. Отделение
дежное установление их строения. В связи с этим
осадка иодида свинца(II) проводили его фильтро-
представляет интерес получение и исследование
ванием после созревания в течение двух часов в
строения иодида и нитрата тетраорганилстибо-
маточном растворе. После испарения этанола
ния, в которых структурообразующий фрагмент
наблюдали образование бледно-желтых кристал-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
ИОДИД И НИТР
АТ ТРИС(2,6-ДИМЕТОКСИФЕНИЛ)ЭТИЛСТИБОНИЯ
1405
Схема 1.
Me
Me
Me
O
O
O
EtI
1/2Pb(NO3)2
Sb
Sb
Et
I
Sb
Et
NO3
-1/2PbI2
O
3
3
3
O
O
Me
Me
Me
1
2
лов, которые перекристаллизовывали из смеси
ре соединения 1, 2 количественно разлагаются до
ацетон-ДМФА (1:1) и выделяли в виде гидрата
трис(2,6-диметоксифенил)стибина.
{[(2,6-MeО)2C6H3]3EtSb}NO3·0.75Н2О 2 с выхо-
Согласно данным Кембриджского центра кри-
дом 87%.
сталлографических данных, иодиды тетраор-
Полосы поглощения в ИК спектрах соедине-
ганилстибония
[Me4Sb]I,
[Me4Sb]I3,
[Me4Sb]I8,
ний 1, 2 относили в соответcтвии с данными работ
[Me3EtSb]I3,
[(PhСН2)3МеSb]I,
[(4-N,N-
[33, 35, 36]. Свободное состояние нитратной груп-
Me2C6H4)3MeSb]I, [Ph4Sb]I3 имеют ионное стро-
пы в соединении 2 подтверждается положением
ение. Наименьшее расстояние между атомами
полосы поглощения при 831.5 см-1, относящейся
сурьмы и иода 3.3413(7) Å (сумма ковалентных
к внеплоскостному деформационному колебанию
радиусов данных атомов 2.78 Å [38]) наблюдает-
нитратной группы, и полосы поглощения νas(NO),
ся в искаженной тригонально-бипирамидальной
расщепляющейся на две близкие компоненты
структуре Ph4SbI (угол CaxSbI 173.78°). Структу-
1384.2, 1344.3 см-1. Расщепление полосы погло-
ры нитратов тетраорганилстибония представлены
щения можно объяснить асимметричной сольва-
лишь фенильным производным Ph4SbNO3 и его
тацией нитратных групп, приводящей к искаже-
сольватом с азотной кислотой [39].
нию симметрии D3h, характерной для свободной
Для установления пространственного строения
NO3-группы. Присутствие кристаллизационной
соединений медленной кристаллизацией из хло-
воды подтверждают широкая полоса поглощения
роформа и смеси ацетон-ДМФА были получены
с максимумом при 3435 см-1 (νOH) и полоса по-
монокристаллы соединений 1 и 2, пригодные для
глощения при 1622.5 см-1 [δ(HOH)]. Значение рас-
рентгеноструктурного анализа (табл. 1). Соедине-
щепления νas ~40 см-1 предполагает координацию
ние {[2,6-(MeO)2C6H3)3]EtSb}I 1 кристаллизуется
двух молекул воды [37].
в моноклинной сингонии, {[2,6-(MeO)2C6H3)3]·
Нагревание водных или спиртовых растворов
EtSb}NO3·0.75Н2О
2
- триклинной сингонии.
галогенидов тетраалкилстибония иногда сопро-
Согласно данным РСА, основу кристаллической
вождается частичным разложением с выделени-
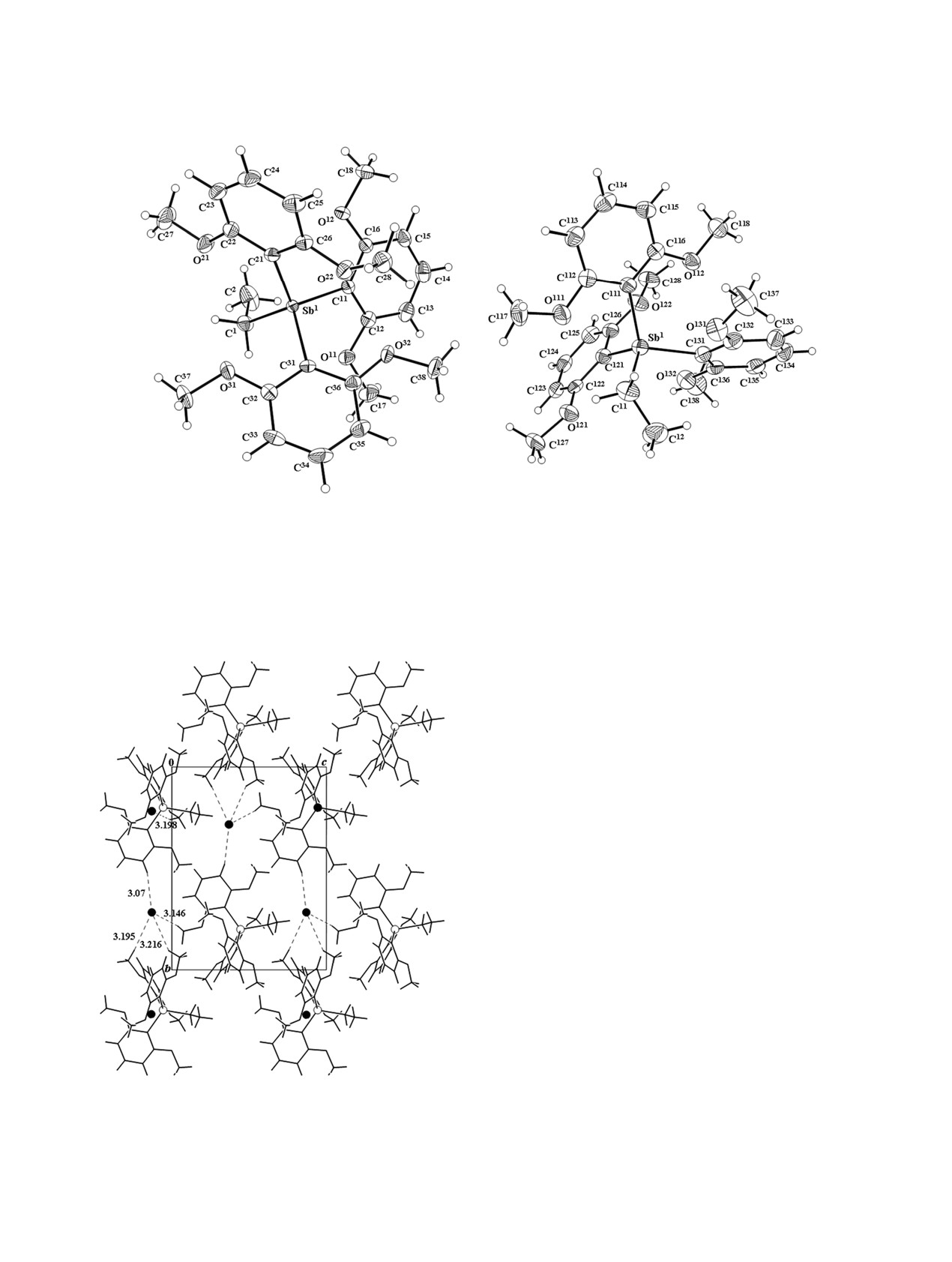
структуры комплексов 1 и 2 составляют катионы
ем галоидного алкила и триалкилстибина. Соли
{[(2,6-MeO)2C6H3]3EtSb}+ и анионы I-, NO3- со-
тетраарилстибония устойчивы при хранении, не-
ответственно (рис. 1-3). В элементарной ячейке
летучи, хорошо растворимы и устойчивы в воде
комплекса 2 присутствуют две пары структурно
[13]. Поскольку в комплексах 1, 2 присутствуют
неэквивалентных ионов.
этильный и арильные заместители при атоме су-
В катионах
{[2,6-(MeO)2C6H3)3]EtSb}+ меж-
рьмы, представляет интерес изучение их стабиль-
атомные расстояния Sb-CEt составляют 2.121(3)
ности и возможности разложения до триарил-
(1), 2.117(3) (2a), 2.123(3) Å (2б), Sb-CAr 2.090(3)-
стибина. Установлено, что комплексы 1, 2, могут
2.094(3)
(1),
2.084(3)-2.092(3)
(2a),
2.094(3)-
быть очищены перекристаллизацией из кипящего
2.101(3) Å (2б) (сумма ковалентных радиусов ато-
этанола. В то же время в кипящем водном раство-
мов Sb и Csp3, Csp2 2.15, 2.12 Å [38]). Длины связей
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
1406
ЕГОРОВА и др.
Таблица 1. Основные кристаллографические параметры и характеристики рентгеноструктурного эксперимента для
соединений 1 и 2
Значение
Параметр
1
2
Брутто формула
C26H32IO6Sb
C26H32NO9Sb·0.75Н2О
М
689.16
637.79
Сингония
Моноклинная
Триклинная
Пространственная группа
Cc
P
1
a, Å
15.1842(4)
10.8288(3)
b, Å
15.5024(5)
14.4773(3)
c, Å
13.1592(4)
19.4688(4)
α, град
76.733(1)
β, град
116.131(1)
80.796(1)
γ, град
72.540(1)
V, Å3
2780.96(14)
2820.16(12)
Z
4
4
dвыч, г/cм3
1.646
1.502
μ(MoKα), мм-1
2.138
1.032
F(000)
1360
1302
Размеры кристалла, мм
0.38×0.28×0.23
0.50×0.25×0.12
Диапазон углов 2θ, град
2.628-27.596
1.080-26.435
Число измеренных отражений
10442
22445
Число независимых отражений
5031 (Rint 0.0248)
11474 (Rint 0.0303)
Полнота сбора данных по θ 25.00°, %
99.6
98.8
S-Фактор по F2
1.061
1.031
R-Фактор по I > 2σ(I)
R1 0.0147, wR2 0.0366
R1 0.0373, wR2 0.0823
R-Фактор по всем отражениям
R1 0.0148, wR2 0.0367
R1 0.0542, wR2 0.0881
Остаточная электронная плотность (max/min), е/Å3
0.504/-0,311
1.306/-0.763
Sb-CAr сокращены, по сравнению с расстояниями
ный заместитель содержит электроноакцептор-
Sb-CPh в иодиде и нитрате тетрафенилсурьмы (dср
ную этоксикарбонильную группу [33].
Sb-CPh 2.116 Å) [39]. Это связано с присутстви-
В соединениях 1, 2 наблюдаются внутримо-
ем в арильном заместителе метоксильных групп,
лекулярные взаимодействия атомов кислоро-
неподеленные электронные пары атомов кисло-
да метокси-групп с атомом сурьмы. Расстояния
рода которых, π-электроны арильных колец, ва-
Sb···O составляют 2.923(3)-3.224(2) (1), 2.914(2)-
кантные d-орбитали атома сурьмы вовлечены в
3.231(2) Å (2), что меньше суммы ван-дер-вааль-
p-π-d-сопряжение. Расстояния Sb-CAr в комплек-
совых радиусов данных атомов (3.58 Å [40]). От-
сах 1 и 2 сравнимы с аналогичными расстояниями
метим, что значения ван-дер-ваальсова радиуса
в [(4-N,N-Me2C6H4)3MeSb]I [2.078(2)-2.087(3) Å],
атома сурьмы, приводимые в различных литера-
[(4-N,N-Me2C6H4)3MeSb]2[Hg2I6]·2DMSO
турных источниках, существенно варьируются:
[2.087(4)-2.091(4) Å], что также обусловле-
2.06 [40], 2.2 [41], 2.24 [42], 2.47 [43] и 2.52 Å
но участием атома азота аминогруппы фениль-
[44]. Атомы сурьмы имеют искаженную тетра-
ного заместителя в p-π-d-сопряжении
[34].
эдрическую координацию, о чем свидетельствуют
Длины связей Sb-CEt в соединениях 1, 2 мень-
значения углов СSbC, находящиеся в интервалах
ше расстояния Sb-CAlk (2.140(4) Å) в катионе
106.80(12)-115.22(12)° (1), 105.70(14)-114.39(14)°
{[2,6-(MeO)2C6H3]3SbCH2C(O)OEt}+, где алкиль-
(2a) и 105.33(14)-115.33(14)° (2б). Искажение об-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
ИОДИД И НИТР
АТ ТРИС(2,6-ДИМЕТОКСИФЕНИЛ)ЭТИЛСТИБОНИЯ
1407
Рис. 1. Общий вид катионов соединений 1 и 2а.
условлено различным объемом органических за-
В структуре 1 катионы образуют искаженные
местителей [2,6-(MeO)2C6H3, Et] и присутствием
гофрированные гексагональные псевдослои в пло-
контактов Sb···O.
скости (110). Анионы I- располагаются в пустотах
гексагональной упаковки. Имеют место межмоле-
кулярные контакты с участием иодид-анионов и
атомов водорода метокси-групп арильных заме-
стителей или фенильных колец (рис. 2).
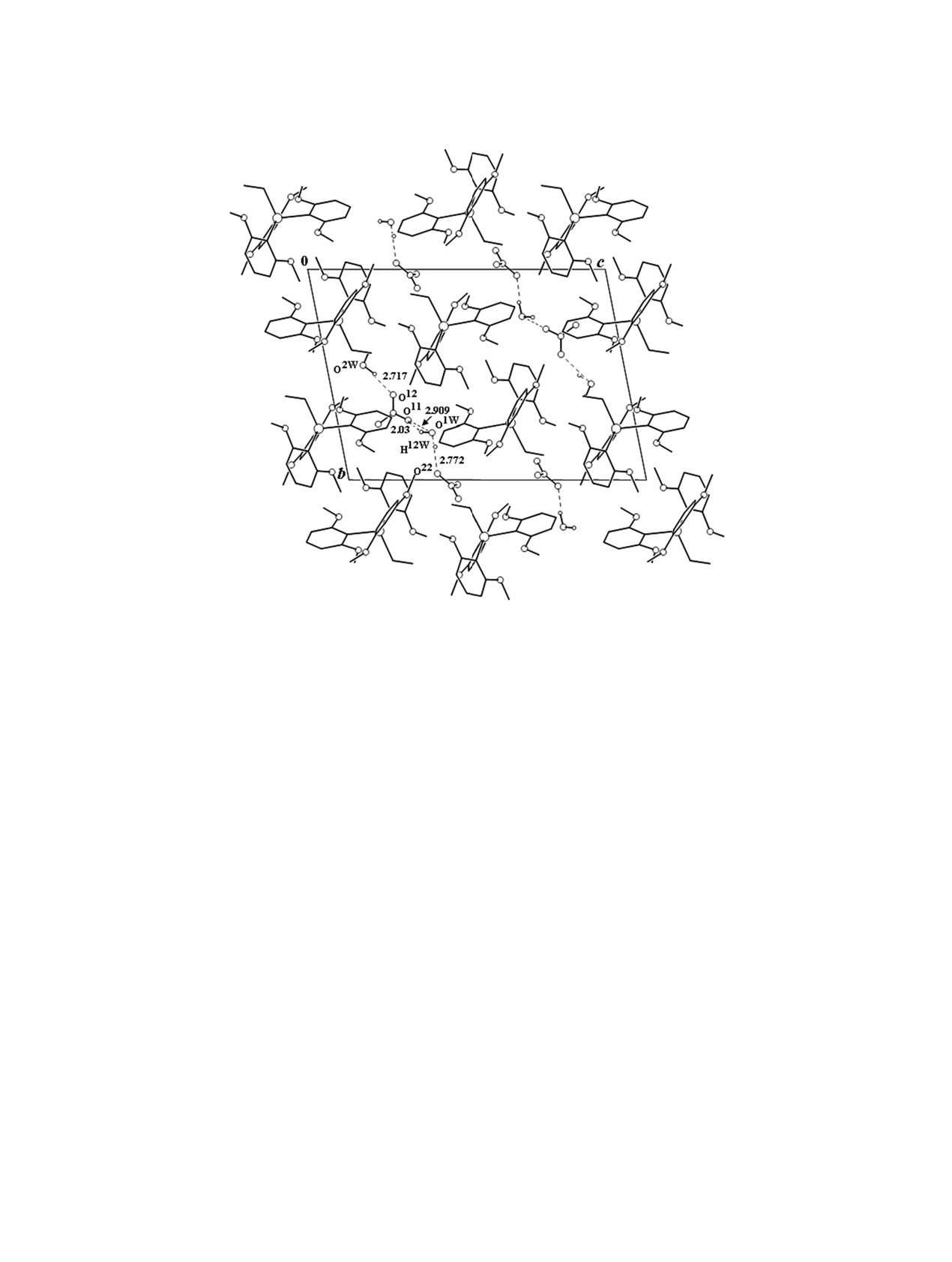
В соединении 2 отсутствует координация меж-
ду атомами сурьмы и кислорода нитратного анио-
на, кратчайшее расстояние составляет 5.880(3) Å.
Аналогичное расстояние в кристаллографически
независимых молекулах нитрата тетрафенилсу-
рьмы, где атом сурьмы имеет искаженную триго-
нально-бипирамидальную координацию, состав-
ляет 2.432(3)-2.600(4) Å [39], сумма ковалентных
радиусов данных атомов 2.05 Å [38]. Атом азота
нитратной группы имеет sp2-гибридизацию [углы
ОNО находятся в интервале 119.2(4)-120.8(4)°
(2a), 118.4(4)-122.2(4)° (2б)]. В структуре четко
наблюдается слоистое упорядочение катионной и
анионной части с чередованием слоев вдоль на-
правления а. Структура дополнительно стабили-
зирована водородными связями, образованными
NO3-анионами и кристаллизационными молекула-
ми воды [О1W…О11 2.909(5) Å, O11…H12W′ 2.03(3) Å,
Рис. 2. Слой структуры соединения 1, проекция на
угол O1W-H12W···O11 153(4)°; О1W···О22′ 2.772(4) Å,
плоскость (100).
O22′···H11W′
1.86(2) Å, угол O1W-H11W···O22′
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
1408
ЕГОРОВА и др.
Рис. 3. Проекция структуры соединения 2 на плоскость (100).
166(4)°; О2W···О12 2.717(9) Å, O12···H22W′ 1.83(5) Å,
ственно при начале плавления, об этом свидетель-
угол O2W-H22W···O12 153(8)°] (рис. 3).
ствует экзотермический пик на кривой ДТА. На
кривой ТГ в интервале 175.0-200.0°С наблюдается
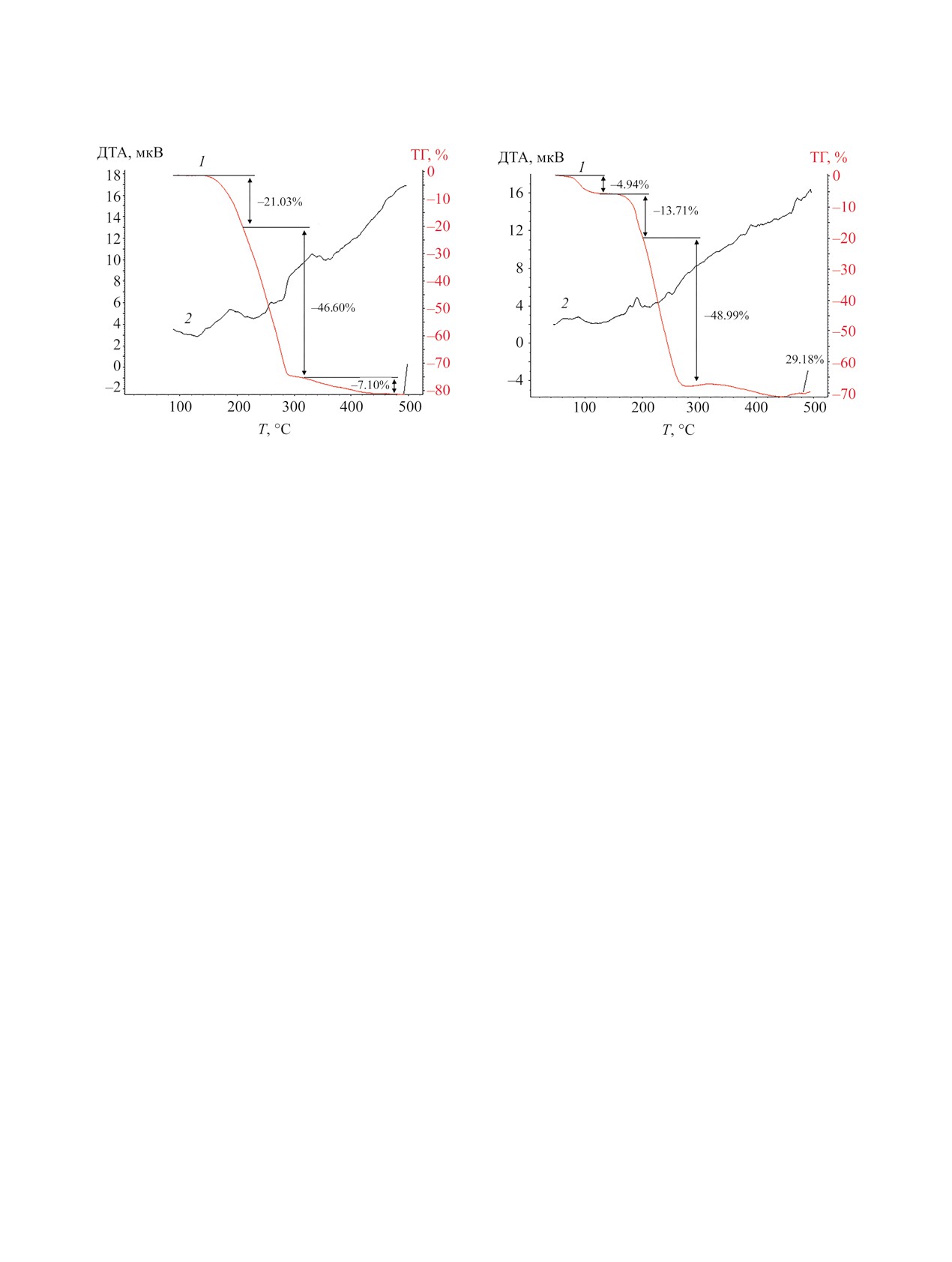
Термическое поведение соединений 1, 2 изуче-
но в воздушной атмосфере методом СТА с одно-
потеря массы 13.71%. Можно предположить, что
временной регистрацией кривых ТГ и ДТА. Для
термическая деструкция соединения на данном
более четкого выявления характеристических то-
этапе протекает с участием нитрат-иона и этиль-
чек было выполнено дифференцирование ТГ-кри-
ного заместителя (расч. 14.28%). На следующем
вой. Термолиз соединения 1 в интервале темпера-
участке термолиз комплекса 2 проходит по ариль-
тур 117.0-212.0°С сопровождается потерей массы
ным заместителям с участием кислорода воздуха
в 21.03%, что указывает на отщепление этильного
(потеря массы составляет 48.92%) и формировани-
и иодидного фрагментов (расч. 22.64%) (рис. 4).
ем оксида сурьмы(III) (остаточная масса 29.18%,
Следующий этап дефрагментации комплекса по
расч. 22.85%).
арильным заместителям отражает основную по-
Увеличение масс остатков объясняется адсорб-
терю массы (46.60%) и включает финальный уча-
цией газов, окислением и карбонизацией исследу-
сток плавной десорбции летучих продуктов термо-
емых веществ. В ИК спектрах продуктов термоли-
лиза (7.10%) с формированием оксида сурьмы(III)
за соединений 1 и 2, охлажденных до комнатной
(остаточная масса 25.42%, расч. 21.15%).
температуры, появляется интенсивная полоса при
Профиль ТГ-кривой соединения 2 свидетель-
~2360 см-1, которая относится к νаs(С=О) в диок-
ствует о дегидратации в 4.94% (расч. 4.24%) при
сиде углерода. Кроме того, присутствуют в не-
70-120°С (рис.
5). Соединение устойчиво до
большом количестве непредельные фрагменты,
175°С. Процесс разложения начинается непосред-
полосы поглощения которых находятся в области
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
ИОДИД И НИТР
АТ ТРИС(2,6-ДИМЕТОКСИФЕНИЛ)ЭТИЛСТИБОНИЯ
1409
Рис. 4. Кривые ТГ (1) и ДТА (2) комплекса 1.
Рис. 5. Кривые ТГ (1) и ДТА (2) комплекса 2.
1740-1590 см-1, алифатические группы СН2, СН3
Управление прибором и обработку спектров осу-
(2851-2966 см-1). Широкая полоса с максимумом
ществляли по программе FSpec (версия 4.0.0.2 для
при 3435 см-1, вероятно, связана с адсорбирован-
Windows, ООО «Мониторинг», Россия). Элемент-
ной на поверхности водой. Очень слабые полосы
ный анализ выполняли на CHN-анализаторе Carlo
поглощения при 1347.4 и 1395.5 см-1 в продукте
Erba (модель 1106). Содержание иода определяли
разложения комплекса 2 относятся к νas(NO). Ин-
гравиметрическим методом в форме PbI2. Термоа-
тенсивная полоса в ИК спектре при 741 см-1 отве-
нализ образцов производили в термогравиметри-
чает за νаs(SbО) колебания в Sb2O3 [45].
ческом анализаторе Linseis STA PT 1000 (TG-DSC/
DTA). Скорость нагрева составляла 3 град/мин до
Таким образом, синтезированы нитрат и иодид
500°С в атмосфере воздуха, скорость потока воз-
трис(2,6-диметоксифенил)этилстибония. Строе-
духа - 20 мл/мин.
ние соединений установлено методом РСА. Катио-
Рентгеноструктурный эксперимент для соеди-
ны {[2,6-(MeO)2C6H3)3]EtSb}+ имеют искаженную
нений 1 и 2 выполнен на дифрактометре Bruker
тетраэдрическую конфигурацию. Метоксигруп-
Nonius X8Apex с 4K CCD детектором с использо-
пы участвуют в нековалентных взаимодействиях
ванием φ- и ω-сканирования. Поправки на погло-
с центральным атомом стибониевого катиона и
щение введены с помощью программы SADABS
иодид-ионами. Структура нитратного комплекса
[46], которая использует многократные измерения
стабилизирована водородными связями, в которые
одних и тех же отражений при разных ориентаци-
вовлечены молекулы воды и нитрат-ионы. Полу-
ях кристалла. Структуры расшифрованы прямым
ченные соединения устойчивы в горячем спирте;
методом и уточнены полноматричным МНК по F2
при кипячении в водном растворе разлагаются с
в анизотропном приближении для неводородных
образованием трис(2,6-диметоксифенил)стибина.
атомов с использованием комплекса программ
Изучен термолиз полученных соединений в окис-
SHELX2014 [47]. Атомы водорода органических
лительной (воздух) среде в области температур
лигандов расставлены геометрически и уточнены
25-500°С.
в приближении жесткого тела. Кристаллографи-
ческие данные и детали дифракционного экспери-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
мента приведены в табл. 1. Структурные данные
ИК спектры (KBr) регистрировали на интерфе-
депонированы в Кембриджском центре кристалло-
ренционном ИК спектрометре с Фурье-преобра-
графических данных [ССDС 2277202 (1), 2277203
зованием ФСМ-2202 в диапазоне 400-4000 см-1.
(2)].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
1410
ЕГОРОВА и др.
Иодид трис(2,6-диметоксифенил)этилстибо-
ИНФОРМАЦИЯ ОБ АВТОРАХ
ния (1). К 2.00 г (3.75 ммоль) трис(2,6-диметок-
Егорова Ирина Владимировна, ORCID: https://
сифенил)стибина [33] в 50 мл хлороформа при
orcid.org/0000-0001-8799-608X
перемешивании по каплям прибавляли раствор
этилиодида, взятого в сверхстехиометрическом
Родионова Наталья Александровна, ORCID:
(~30%) соотношении в 30 мл хлороформа. Смесь
выдерживали при комнатной температуре в те-
Куратьева Наталья Владимировна, ORCID:
чение 48 ч. Растворитель испаряли. Кристаллы
промывали диэтиловым эфиром (3×15 мл) и суши-
ли. Выход 2.43 г (94%), т. пл. 207°С. ИК спектр,
ФИНАНСОВАЯ ПОДДЕРЖКА
ν, см-1: 3063.6 (CAr-H), 2940.7 [νas(СH3)], 2927.2
Работа выполнена при поддержке Министер-
[νas(СH2)], 2872.6 [νs(СH2)], 2839.4 [νs(СH3)], 1587.7
ства науки и высшего образования Российской
[νas(СAr-СAr)],
1472.9
[νs(СAr-СAr)],
1256.8
Федерации (проект № 121031700313-8).
[νаs(СМе-О-СAr], 1105.5 [νs(О-СМе)], 781.0 [ρ(СH2)].
Найдено, %: С 45.18; Н 4.77. C26H32IО6Sb. Вычис-
КОНФЛИКТ ИНТЕРЕСОВ
лено, %: С 45.31; Н 4.68.
Гидрат нитрата трис(2,6-диметоксифенил)-
Авторы заявляют об отсутствии конфликта
этилстибония (2). К 1.00 г (1.450 ммоль) сое-
интересов.
динения 1 в 30 мл этанола при перемешивании
СПИСОК ЛИТЕРАТУРЫ
(1 ч) приливали 30 мл этанола, содержащего
0.24 г (0.725 ммоль) нитрата свинца(II). Смесь вы-
1.
Yadav R.N.P. // Academic Voices. 2013. Vol. 3. N 1.
держивали при комнатной температуре в течение
P. 40. doi 10.3126/av.v3i1.9983
2 ч. Осадок иодида свинца(II) отделяли и промы-
2.
Ma Y.-Q., Yu L., Li J.-S. // Heteroatom Chem. 2002.
вали на фильтре этанолом (2×15 мл). При испаре-
Vol. 13. N 4. P. 299. doi 10.1002/hc.10033
нии растворителя получали бледно-желтые кри-
3.
Khosa M., Mazhar M., Ali S., Shahid K., Malik F. // Turk.
сталлы, которые перекристаллизовывали из смеси
J. Chem. 2006. Vol. 30. P. 345. doi 10.1002/(SICI)1099-
0739(199801)12:1<31::AID-AOC665>3.3.CO;2-6
ацетон-ДМФА. Выход 0.78 г (87%), т. пл. 175°С
4.
Artem’eva E.V., Duffin R.N., Munuganti S., Efre-
(разл.). ИК спектр, ν, см-1: 3078.0 (CAr-H), 2940.7
mov A.N., Andrews P.C., Sharutina O.K., Sharutin V.V. //
[νas(СH3)],
2927.2
[νas(СH2)],
2872.6
[νs(СH2)],
J. Inorg. Biochem. 2022. Vol. 234. P. 111864. doi
2839.4
[νs(СH3)],
1587.7
[νas(СAr-СAr)],
1472.9
10.1016/j.jinorgbio.2022.111864
[νs(СAr-СAr)],
1384.2,
1344.3 νas(NO),
1257.2
5.
Gupta R., Mathur M., Swami A.K., Sharma J., Singh Y. //
[νаs(СМе-О-СAr], 1100.0 [νs(О-СМе)], 831.5 [γ(NO–)],
J. Saudi Chem. Soc. 2017. Vol. 21. P. 67. doi 10.1016/j.
783.4 [ρ(СH2)]. Найдено, %: С 48.83; Н 5.20; N 2.09.
jscs.2014.09.003
C26H32NО9Sb·0.75 H2О. Вычислено, %: С 48.96; Н
6.
Geng H., Hong M., Yang Y., Li D., Li X., Liu F.,
5.29; N 2.20.
Niu M. // J. Coord. Chem. 2015. Vol. 68. P. 2938. doi
Разложение иодида трис(2,6-диметоксифе-
10.1080/00958972.2015.1060322
нил)этилстибония. 0.50 г соединения 1 в 30 мл
7.
Wang G.-C., Xiao J., Yu L., Li J.-S., Cui J.-R.,
воды кипятили в течение 1 ч. Раствор выливали
Wang R.-Q., Ran F.-X. // J. Organomet. Chem. 2004.
Vol. 689. P. 1631. doi 10.1016/j.jorganchem.2004.02.015
в чашки Петри. Растворитель испаряли, твердый
8.
Lei J., Liu Y., Ou Y., Au C.-T., Chen Y., Yin S.-F. // Eur.
остаток сушили, перекристаллизовывали (хло-
J. Med. Chem. 2019. Vol. 177. P. 350. doi 10.1016/j.
роформ-спирт, 1:1). Выделено 0.36 г (93%) трис-
ejmech.2019.05.054
(2,6-диметоксифенил)стибина, т. пл. (162°C) и
9.
Tiekink E.R.T. // Crit. Rev. Oncol. Hematol. 2002.
параметры ИК спектра идентичны характеристи-
Vol. 42. P. 217. doi 10.1016/S1040- 8428(01)00217-7
кам соединения, полученного в работе [33].
10.
Duffin R.N., Werrett M.V., Andrews P.C. // Adv.
Разложение гидрата нитрата трис(2,6-диме-
Inorg. Chem. 2020. Vol. 75. P. 207. doi 10.1016/bs.
токсифенил)этилстибония проводили аналогич-
adioch.2019.10.001
но. Выход трис(2,6-диметоксифенил)стибина со-
11.
Potratz H.A., Rosen J.M. // Anal. Chem. 1949. Vol. 21.
ставляет 0.40 г (96%), т. пл. 162°C.
N 10. P. 1276. doi 10.1021/ac60034a037
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
ИОДИД И НИТР
АТ ТРИС(2,6-ДИМЕТОКСИФЕНИЛ)ЭТИЛСТИБОНИЯ
1411
12.
Willard H.H., Perkins L.R. // Anal. Chem. 1953. Vol. 25.
31.
Henning D., Kempter G., Worlitzer K.-D. // Z. Chem.
N 11. P. 1634. doi 10.1021/ac60083a016
1969. Vol. 9. N 8. P. 306. doi 10.1002/zfch.19690090813
13.
Кочешков К.А., Сколдинов А.П., Землянский Н.Н.
32.
Wada M., Miyake S., Hayashi S., Ohba H., Nobuki S.,
Методы элементоорганической химии. Сурьма,
Hayase S., Erabi T. // J. Organomet. Chem. 1996.
висмут. М.: Наука, 1976. С. 184.
Vol. 507. P. 53. doi 10.1016/0022-328X(95)05716-3
14.
Столярова Т.Е., Шавырин А.С., Фине Ж.П., Фе-
33.
Егорова И.В., Жидков В.В., Гринишак И.П., Багрян-
доров А.Ю. // Изв. АН. Сер. хим. 2003. № 8. С.
ская И.Ю., Первухина Н.В., Ельцов И.В., Курать-
1647; Stolyarova T.E., Shavyrin A.S., Finet J.-P., Fedo-
ева Н.В. // ЖНХ. 2019. Т. 64. № 1. С. 15; Egoro-
rov A.Yu. // Russ. Chem. Bull. 2003. Vol. 52. P. 1736.
va I.V., Zhidkov V.V., Grinishak I.P., Bagryanskaya I.Yu.,
doi 10.1023/A:1026044302134
Pervukhina N.V., El’tsov I.V., Kurat’eva N.V. // Russ. J.
15.
Qin W., Kakusawa N., Wu Y., Yasuike S., Kurita J. //
Inorg. Chem. 2019. Vol. 64. N 1. P. 28. doi 10.1134/
Chem. Pharm. Bull. 2009. Vol. 57. N 4. P. 436. doi
S0036023619010078
10.1248/cpb.57.436
34.
Егорова И.В., Жидков В.В., Гринишак И.П., Родио-
16.
Matsumura M., Nojima H., Kitamura Y., Murata Y.,
нова Н.А., Багрянская И.Ю., Первухина Н.В. // ЖОХ.
Yasuike S. // J. Organometal. Chem. 2023. Vol. 989.
2021. Т. 91. № 7. С. 1100; Egorova I.V., Zhidkov V.V.,
P. 122639. doi 10.1016/j.jorganchem.2023.122639
Grinishak I.P., Rodionova N.А., Bagryanskaya I.Yu.,
17.
Kitamura Y., Murata Y., Iwai M., Matsumura M.,
Pervukhina N.V. // Russ. J. Gen. Chem. 2021. Vol. 91.
Yasuike S. // Molecules. 2021. Vol. 26. P. 97. doi
N 7. P. 1361. doi 10.1134/S1070363221070148
10.3390/molecules26010097
35.
Nakamoto K. Infrared and Raman Spectra of Inorganic
18.
Kitamura Y., Murata Y., Oguri A., Matsumura M.,
and Coordination Compounds. New York: J. Wiley &
Kakusawa N., Naka H., Yasuike S. // Asian J. Org.
Sons, 1986. 484 рр.
Chem. 2019. Vol. 8. P. 138. doi 10.1002/ajoc.201800654
36.
Преч Э., Бюльманн Ф., Аффольтер К.М. Определе-
19.
Nomura R., Wada T., Yamada Y., Matsuda H. // Chem.
ние строения органических соединений. Таблицы
Lett. 1986. Vol. 15. N 11. P. 1901. doi 10.1246/
спектральных данных. М.: Мир, 2013. 438 с.
cl.1986.1901
37.
Goebbert D.J., Garand E., Wende T., Bergmann R.,
20.
Kang S.-K., Ryu H.-C., Lee S.-W. // J. Organomet.
Meijer G., Asmis K.R., Neumark D.M. // J. Phys. Chem.
Chem. 2000. Vol. 610. P. 38. doi 10.1016/S0022-
A. 2009. Vol. 113. P. 7584. doi 10.1021/jp9017103
328X(00)00386-7
38.
Cordero B., Gomez V., Platero-Prats A.E., Reves M.,
21.
Qin W., Yasuike S., Kakusawa N., Kurita J. // J.
Echeverria J., Cremades E., Barragan F., Alvarez S. //
Organomet. Chem. 2008. Vol. 693. P. 2949. doi
J. Chem. Soc., Dalton Trans. 2008. Vol. 21. P. 2832. doi
10.1016/j.jorganchem.2008.05.039
10.1039/B801115J
22.
Akiba K., Ohnari H., Ohkata K. // Chem. Lett. 1985.
39.
Cambridge Structural Database System, Version 5.43,
Vol. 14. N 10. P. 1577. doi 10.1246/cl.1985.1577
2021.
23.
Huang Y.-Z., Liao Y. // J. Org. Chem. 1991. Vol. 56.
40.
Mantina M., Chamberlin A.C., Valero R., Cramer C.J.,
P. 1381. doi 10.1021/jo00004a010
Truhlar D.G. // J. Phys. Chem. 2009. Vol. 113. P. 5806.
24.
Huang Y.-Z., Zhang L.-J., Chen C., Guo G.-Z. //
doi 10.1021/jp8111556
J. Organomet. Chem. 1991. Vol. 412. P. 47. doi
41.
Бацанов С.С. // Неорг. материалы. 2001. Т. 37. № 9.
10.1016/0022-328X(91)86040-W
C. 1031; Batsanov S.S. // Inorg. Mater. 2001. Vol. 37.
25.
Zhang L.-J., Huang Y.-Z., Huang Z.-H. // Tetrahedron
N 9. P. 871. doi 10.1023/A:1011625728803
Lett. 1991. Vol. 32. N 45. P. 6579. doi 10.1016/0040-
42.
Hu S.-Z., Zhou Z.-H., Robertson B.E. // Z. Kristallogr.
4039(91)80226-V
2009. Vol. 224. N 8. P. 375. doi 10.1524/zkri.2009.1158
26.
Гущин А.В., Малеева А.И., Кипелкин Е.В., Тума-
43.
Alvarez S. // Dalton Trans. 2013. Vol. 42. N 24. P. 8617.
нян А.С., Андреев П.В., Овсецина Т.И., Сомов Н.В. //
ЖОХ. 2021. Т. 91. № 2. С. 274; Gushchin A.V., Malee-
doi 10.1039/C3DT50599E
44.
Allinger N.L., Zhou X., Bergsma J. // J. Mol. Struct.
va A.I., Kipelkin E.V., Tumanyan A.S., Andreev P.V.,
Ovsetsina T.I., Somov N.V. // Russ. J. Gen. Chem. 2021.
(Theochem.). 1994. Vol. 312. P. 69. doi 10.1016/S0166-
Vol. 91. N 2. P. 227. doi 10.1134/S1070363221020110
1280%2809%2980008-0
27.
Fujiwara M., Imada M., Baba A., Matsuda H. //
45.
Войт Е.И., Панасенко А.Е., Земнухова Л.А. // ЖСХ.
Tetrahedron Lett. 1989. Vol. 30. P. 739.
2009. Т. 50. № 1. С. 66; Voit E.I., Panasenko A.E.,
28.
Fujiwara M., Baba A., Matsuda H. // J. Heterocycl.
Zemnukhova L.A. // J. Struct. Chem. 2009. Vol. 50. N 1.
Chem. 1989. Vol. 26. Р. 1659. doi 10.1002/
P. 60. doi 10.1007/s10947-009-0008-0
jhet.5570260628
46.
Bruker AXS Inc., APEX2 (Version 1.08), SAINT
29.
Henry M.C., Wittig G. // J. Am. Chem. Soc. 1960.
(Version 7.03), and SADABS (Version 2.11). Bruker
Vol. 82. N 3. P. 563. doi 10.1021/ja01488a017
Advanced X-ray Solutions, Madison, Wisconsin, USA,
30.
Henning D., Kempter G., Ahrens E., Benecke K.D.,
2004.
Paul P. // Z. Chem. 1967. Vol. 7. N 12. P. 463. doi
47.
Sheldrick G.M. // Acta Crystallogr. (A). 2015. Vol. 71.
10.1002/zfch.19670071213
P. 3. doi 10.1107/S2053229614024218
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
1412
ЕГОРОВА и др.
Tris(2,6-dimethoxyphenyl)ethylstibonium Iodide and Nitrate:
Synthesis, Structure, and Some Properties
I. V. Egorovaa,*, V. V. Zhidkova, I. N. Zubakinaa, N. A. Rodionovaa,
N. V. Kuratievab, and N. V. Pervukhinab
a Blagoveschensk State Pedagogical University, Blagoveschensk, 675000 Russia
b Nikolaev Institute of Inorganic Chemistry, Siberian Branch of the Russian Academy of Sciences, Novosibirsk, 630090 Russia
*е-mail: bgpu.chim.egorova@mail.ru
Received July 5, 2023; revised August 14, 2023; accepted August 14, 2023
Alkylation of tris(2,6-dimethoxyphenyl)stibine Ar3Sb, where Ar = 2,6-(MeO)2C6H3, with iodoethane in
chloroform resulted in [Ar3EtSb]I, which further reacted with lead(II) nitrate to form [Ar3EtSb]NO3·0.75Н2О.
The comparative characterization of the complexes was carried out by X-ray diffraction analysis, IR spectros-
copy, and simultaneous thermal analysis. Antimony atoms in stibonium cations have a distorted tetrahedral
coordination [CSbC 106.80(12)-115.22(12)° and 105.33(14)-115.33(14)°]. In a boiling aqueous solution,
[Ar3EtSb]I, [Ar3EtSb]NO3·0.75Н2О decompose to tris(2,6-dimethoxyphenyl)stibine.
Keywords: organic antimony compounds, triarylstibin, ethyliodide, lead(II) nitrate, thermogravimetry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023