ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2021, том 57, № 8, с. 1177-1184
УДК 547.518 + 547
АДАМАНТИЛИРОВАНИЕ АДЕНИНА И РОДСТВЕННЫХ
СОЕДИНЕНИЙ ГИДРОКСИАДАМАНТАНАМИ
В ТРИФТОРУКСУСНОЙ КИСЛОТЕ
© 2021 г. В. В. Ковалев*, Э. А. Шокова, В. А. Тафеенко
ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
Россия, 119991 Москва, Ленинские горы 1/3
*e-mail: kovalev@petrol.chem.msu.ru
Поступила в редакцию 10.04.2021 г.
После доработки 21.04.2021 г.
Принята к публикации 23.04.2021 г.
Показано, что при взаимодействии аденина, N6-метил- и N6,N6-диметиладенинов с гидроксиадамантана-
ми в трифторуксусной кислоте с высокими выходами образуются 9-(3-R-1-адамантил)аденины (R = H,
i-Pr, CH2COOH, 5-урацилил). Строение 9-(1-адамантил)- и N6-метил-9-(1-адамантил)аденинов доказано
методом РСА.
Ключевые слова: аденин, N6-метиладенины, 9-(3-R-1-адамантил)аденины, 1-гидроксиадамантаны,
трифторуксусная кислота
DOI: 10.31857/S0514749221080097
ВВЕДЕНИЕ
цией функциональных групп (амино- [7, 8], тио-
[9] или хлор- [10]) в положениях 2 и 6 пуриново-
Химия адамантана получила значительное
го ядра адамантилсодержащими реагентами. Для
развитие благодаря уникальности его свойств
получения аденинов с адамантильными замести-
и широкого практического использования при
телями в положениях C8 и N9 гетероцикла были
создании функциональных материалов [1], в ме-
использованы реакции циклоконденсации
[11-
дицинской химии [2] и катализе [3]. Среди раз-
13].
нообразных типов адамантилсодержащих со-
единений значительный интерес для медицинской
Ранее нами было показано, что адамантили-
химии и фармакологии представляют адаманти-
рование С- и N-нуклеофилов 1-гидроксиадамана-
лированные нуклеиновые основания и родствен-
ми в среде трифторуксусной кислоты - эффек-
ные им соединения. В настоящее время практи-
тивный метод синтеза С-адамантилированных ге-
чески все известные адамантилированные пири-
тероциклов [14] и N-адамантилированных ами-
мидиновые основания были получены для изу-
дов [15]. В настоящей работе было изучено взаи-
чения их биологической активности и проявили
модействие
3-R-1-гидроксиадамантанов
1а-с
широкий спектр фармакологических свойств [4,
(R = H, CH2COOH, 5-урацилил) и 2-(1-адаман-
5]. Удивительно, но, несмотря на то, что пурино-
тил)-2-пропанола (1d) с аденином 2а и родствен-
вые основания выступают одними из наиболее
ными ему N6-метил- и N6,N6-диметилпроизводны-
распространенных в природе классов азотсодер-
ми
2b, c в среде трифторуксусной кислоты.
жащих гетероциклов [6], сведения о синтезе и
Адамантилирование гетероциклов проводили
свойствах адамантилированных аденинов или их
при мольном соотношении
1-2-CF3COOH
=
аналогов весьма ограничены. В большинстве слу-
1:1.05:10-20 при температуре 80-100°С в течение
чаев такие соединения были получены модифика-
6-11 ч.
1177
1178
КОВАЛЕВ и др.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
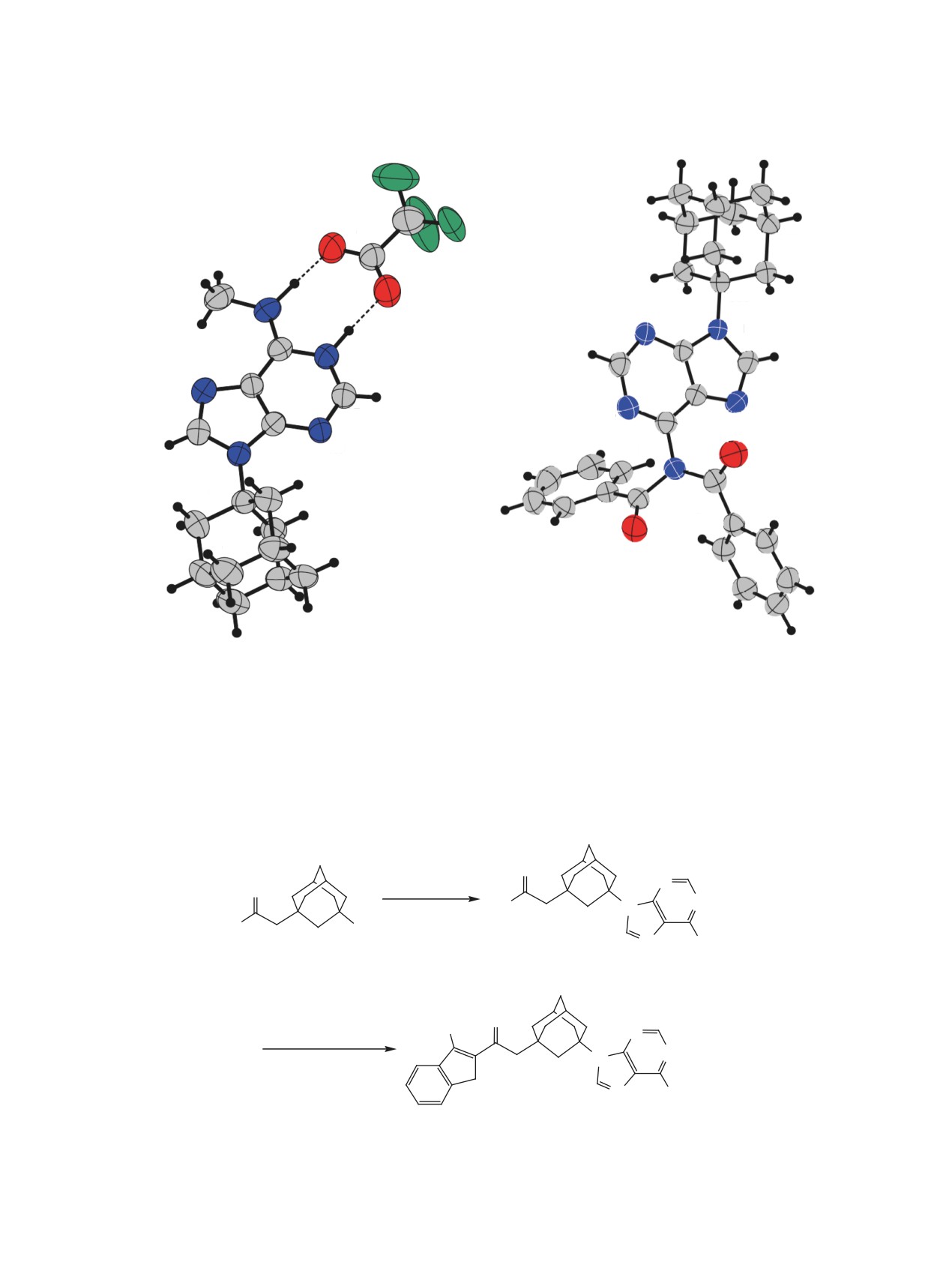
турного анализа (РСА) [17]. Подходящие для РСА
кристаллы удалось вырастить при медленной
Сначала нами было изучено взаимодействие
кристаллизации N6-метиладенина 3b из смеси
аденинов
2а-с с
1-гидроксиадамантаном
(1а).
СHCl3-CF3COOH и N6,N6-дибензоиладенина
4
Место электрофильной атаки в аденине неодно-
из 1,2-диметоксиэтана, соответственно. На рис. 2
значно [16], поэтому трудно заранее было пред-
приведены молекулярные структуры этих соеди-
сказать, по какому нуклеофильному центру - ами-
нений. Ранее 9-(1-адамантил)аденин 3а был по-
ногруппе, атомам азота в положениях 7 и 9 пури-
лучен методом сборки в результате 3-стадийного
нового гетероцикла или атому углерода C8 - будет
синтеза из 4-хлор-5-нитро-6-аминопириимидина и
протекать адамантилирование и окажется ли оно
1-аминоадамантана [12].
селективным (рис. 1).
Затем было показано, что при взаимодействии
Ранее сообщалось [8], что в результате ада-
аденинов 2а-с с 2-(1-адамантил)-2-пропанолом
мантилирования аденина спиртом 1а в трифтор-
(1d) с высокими выходами образуются 9-(3-изо-
уксусной кислоте было получено соединение, ко-
пропил-1-адамантил)аденины
3d-f (схема
1).
торому на основании данных ЯМР спектроскопии
Известно [18], что карбинол 1d при нагревании в
приписали строение N6-(1-адамантил)аденина.
CF3COOH изомеризуется в трифторацетат 3-изо-
Результаты, полученные нами в реакции 1а с аде-
пропил-1-гидроксиадамантана. Очевидно, ада-
нинами 2а-с, приведены на схеме 1 и показали
мантилирование аденина в этом случае протекает
следующее. Реакция протекает региоселективно,
с изомеризацией исходного спирта с промежу-
а возможность адамантилирования N6-метил- и
точным образованием трифторацета
3-изопро-
N6,N6-диметилпроизводных 2b, c свидетельству-
пил-1-гидроксиадамантана А, который и алкили-
ет о том, что атака электрофила проходит по ге-
рует аденины 2а-с.
тероциклу, а не по аминогруппе. Подтверждалось
В этой работе были также синтезированы функ-
это и бензоилированием адамантиладенина 3а,
ционально замещенные адамантиладенины. Так,
в результате которого было получено дибензоил-
в результате взаимодействия
3-гидрокси-1-ада-
производное 4. Из данных спектров ЯМР 1Н и 13С
мантилуксусной кислоты 1b c аденином 2а был
также следовало, что группа CH в положении 8
получен
9-(3-карбоксиметил-1адамантал)аденин
пуринового гетероцикла сохраняется, а значения
(5) (схема 2). Ранее было показано [19], что
химических сдвигов третичного углерода адаман-
(CF3CO)2O/TfOH-активированное ацилирование
танового ядра, связанного с гетероциклом, находи-
ароматических кетонов карбоновыми кислота-
лись в области δ 57-62 м.д. Все это подтверждает
ми - простой и эффективный метод синтеза 1,3-ди-
предположение о том, что адамантилированию
кетонов. Мы использовали эту активирующую си-
подвергается один из атомов азота гетероцикла, а
стему для ацилирования кислотой 5 1-инданона, в
не экзоциклическая аминогруппа.
результате был получен адамантилированный аде-
Направление адамантилирования аденинов в
нин 6 с β-дикарбонильным фрагментом в адаман-
выбранных условиях по N9-положению гетеро-
тановом фрагменте молекулы.
цикла было доказано методом рентгено-струк-
При адамантилировании аденина 2а 5-(3-ги-
дрокси-1-адамантил)урацилом (1c), синтез кото-
рого описан ранее [14], был получен новый тип
1,3-дизамещенных адамантанов - соединение 7 с
двумя комплементарными нуклеиновыми осно-
+
NH2
ваниями в молекуле (схема 3). Известно, что ада-
R
6
5
7
манатан - хорошая молекулярная платформа для
1
N
N
получения супрамолекулярных полимеров [20].
8
2
Структура полученного производного позволяет
N 4 N
9
H
предположить проявление им интересных супра-
3
молекулярных свойств. И хотя нам не удалось по-
Рис. 1. Возможные направления электрофильной ата-
ки в аденине
добрать условия кристаллизации адамантанового
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
АДАМАНТИЛИРОВАНИЕ АДЕНИНА И РОДСТВЕННЫХ СОЕДИНЕНИЙ
1179
Схема 1
X
N
X
N
N
NH
N
OH
N
OC(O)CF3
2a-c,
CF3CO2H
2a-c, CF3CO2H
N
N
∆
∆
R
OH
R
1a, b
3a-f
A
1c
N(COPh)2
PhCOCl/Py
для 3а
N
N
N N
4, 88%
1, R = H (a), CH2CO2H (b); 2, X = NH2 (a), X = NHMe (b), X = NMe2 (c);
3, R = H, X = NH2, 85% (a); R = H, X = NHMe, 71% (b); R = H, X = NMe2, 87% (c);
R = i-Pr, X = NH2, 80% (d); R = i-Pr, X = NHMe, 83% (e); R = i-Pr, X = NMe2, 88% (f).
производного с пуриновым и пиримидиновым
2.50 и 39.52 м.д.; CDCl3: 7.26 и 77.16 м.д., соответ-
основаниями в узловых положениях, было обна-
ственно). Данные РСА для соединений 3b и 5 были
ружено, что это соединение при растворении в
получены с использованием дифрактометра STOE
ДМСО желирует растворитель (5 мг соединения 7
c полупроводниковым детектором Pilatus100K,
в 1 мл ДМСО).
микрофокусным пучком CuKα (1.54086 Å), мно-
гослойным, тонкопленочным, фокусирующим мо-
Строение полученных соединений было дока-
нохроматором. Обработка рентгеновских данных
зано данными спектров ЯМР 1H и 13C и элемент-
проведена с использованием STOEX-AREA 1.67
ного анализа. Полученный дикетон 6 в растворе
пакета программ (STOE&CieGmbH, Darmstadt,
CDCl3 находится практически полностью в еноль-
Германия, 2013). Полученные интегральные ин-
ной форме. Структура енола для этого дикетона
тенсивности обрабатывались программой LANA
подтверждается наличием интенсивного сигнала
(входит в пакет X-Area) для минимизации раз-
α-олефинового четвертичного углерода С(ОН)=С-
ности эквивалентных отражений (multi-scan ме-
С(О) фрагмента при δ ~111.6 м.д. Для минорной
тод). ТСХ-анализ проводили на пластинках Merck
структуры кетонной формы (~5%) наблюдается
DC Alufolien Kieselgel 60 F254, проявитель - УФ
мультиплет протона С(О)СНС(О) фрагмента в об-
(254 нм). Для препаративной колоночной хромато-
ласти м.д. ~3.9 м.д. в спектре ЯМР 1Н.
графии был использован силикагельMerck Kieselgel
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
40/60. Использованные в работе 1-гидроксиадама-
натаны были получены по известным методикам:
Спектры ЯМР 1H (400 МГц) и 13C (100 МГц)
3-карбоксиметил-1-гидроксиадамантан (1b) [21],
были зарегистрированы на спектрометре Bruker
5-(3-гидрокси-1-адамантил)урацил (1c) [14], 2-(1-
Avance 400 в ДМСО-d6 и CDCl3, в качестве внутрен-
адамантил)-2-пропанол (1d) [18].
него стандарта использовали сигналы растворите-
ля. Химические сдвиги измеряли по шкале δ (м.д.)
9-(1-Адамантил)аденин
(3a). Смесь адени-
относительно сигналов растворителя (ДМСО-d6:
на (142 мг, 1.05 ммоль),
1-гидроксиадамантана
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1180
КОВАЛЕВ и др.
C29
F1
C30
C34
F3
C23
O1
C22
C31
C26
C33
C32
F2
C27
C11
C28
C25
O2
N2
N8
C9
N1
C5
N6
N3
C10
C7
C2
6
N3
N
C7
C10
8
C5
N
C9
C21
C20
O2
1
C22
C2 N
C15
C12
N2
C11
C12
C19
C23
C24
C13
1
O
C13
C14
C21
C20
C14
C17
17
C19
C16
C
C16
C18
C15
3b∙СF3COOH
4
Рис. 2. Молекулярные структуры 3b·СF3COOH (CCDC 2032369) и 4 (CCDC 2032371). Эллипсоиды тепловых колебаний
показаны с вероятностью 50%
(152 мг, 1 ммоль) и CF3COOH (1.5 мл, 20 ммоль)
(или метанолом) и сушили. Выход 230 мг (85%),
нагревали в течение 9 ч при 90°С. Реакционную
белое твердое вещество, т.пл. 336-338°C (334-
смесь разлагали водой, выпавший осадок отфиль-
336°С [12]), Rf 0.45 (СHCl3-EtOH, 9:1, v/v). Спектр
тровывали, промывали водой, диэтиловым эфиром
ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 1.74 уш.с
Схема 2
O
N
Аденин
O
HO
N
CF3CO2H, ∆
N
HO
OH
N
NH2
1b
5, 82%
O
HO
1-Инданон
N
N
(CF3CO)2O/TfOH, rt
N
N
NH2
6, 75%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
АДАМАНТИЛИРОВАНИЕ АДЕНИНА И РОДСТВЕННЫХ СОЕДИНЕНИЙ
1181
Схема 3
O
O
N
4
Аденин, CF3CO2H, LiClO
N
HN
OH
HN
N
∆
O N
O N
N
NH2
H
H
1c
7, 79%
(6H, CH2Ad), 2.20 уш.с (3H, CHAd), 2.38 уш.с (6H,
NMe2), 7.78 с (1H, CH), 8.31 с (1H, CН). Спектр
CH2Ad), 8.37 с (1H, CH), 8.41 с (1H, CH), 8.71 уш.с
ЯМР 13С (100 МГц, СDCl3), δ, м.д.: 29.1 (CHAd),
(2H, NH2). Спектр ЯМР 13С (100 МГц, ДМСО-d6),
35.6 (CH2Ad), 38.2 (NHMe2), 40.9 (CH2Ad), 57.3
δ, м.д.: 29.0 (CHAd), 35.4 (CH2Ad), 40.8 (CH2Ad), 58.5
(CAd), 121.2, 135.0, 150.5, 150.6, 154.7. Найдено, %:
(CAd), 119.7, 140.7, 145.4, 148.7, 151.8. Найдено, %:
C 68.35; H 8.05; N 23.10. C17H23N5. Вычислено, %:
C 67.02; H 7.38; N 25.60. C15H19N5. Вычислено, %:
C 68.66; H 7.80; N 23.55. М 297.40.
C 66.89; H 7.11; N 26.00. M 269.34.
9-(3-Изопропил-1-адамантил)аденин
(3d).
N6-Метил-9-(1-адамантил)аденин (3b). По-
Получен из аденина
(142 мг,
1.05 ммоль),
лучен из N6-метиладенина (156 мг, 1.05 ммоль), 1-
2-(1-адамантил)-2-пропанола (194 мг, 1 ммоль)
гидроксиадамантана (152 мг, 1 ммоль) и CF3COOH
и CF3COOH (1.5 мл, 20 ммоль) при нагревании
(1.5 мл, 20 ммоль) при нагревании в течение 7 ч
в течение 9 ч при 90°С аналогично соединению
при
95°С аналогично соединению
3а. Выход
3а. Выход 250 мг (80%), белое твердое вещество,
200 мг (71%), белое кристаллическое вещество.
т.пл. 170-172°C (этанол), Rf 0.45 (СHCl3-EtOH,
т.пл. 273-275°C, Rf 0.55 (СHCl3-EtOH, 9:1, v/v).
9:1). Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ,
Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.:
м.д.: 0.83 д (6H, CHMe2, J 6.8 Гц), 1.30-1.36 (1H,
1.76 уш.с (6H, CH2Ad), 2.21 уш.с (3H, CHAd), 2.39
CHMe2), 1.52 уш.с (4H, CH2Ad), 1.60-1.75 м (2H,
уш.с (6H, CH2Ad), 2.93 уш.с (3H, CH3), 8.29 с (1H,
CH2Ad), 2.11 уш.с (2H, CHAd), 2.26 уш.с (2H), 2.32
CH), 8.34 с (1H, CH), 8.66 уш.с (1H, NH). Спектр
уш.с (4H, CH2Ad), 8.38 с (1H, CH), 8.44 с (1H, CH),
ЯМР 13С (100 МГц, СDCl3 + CF3COOD, 19:1, v/v),
8.69 уш.с (2H, NH2). Спектр ЯМР 13С (100 МГц,
δ, м.д.: 29.0 (CHAd), 31.0 (Me), 35.3 (CH2Ad), 41.0
ДМСО-d6), δ, м.д.: 16.4 (CHMe2), 29.1 (CHAd), 35.2
(CH2Ad), 59.7 (CAd), 119.4, 139.6, 141.8, 146.8, 149.8.
(CH2Ad), 36.7 (CHMe2), 36.8 (CH2Ad), 37.2 (CH2Ad),
Найдено, %: C 67.48; H 7.81; N 24.51. C16H21N5.
40.5 (CH2Ad), 42.8 (CH2Ad), 59.5 (CAd), 119.7, 140.6,
Вычислено, %: C 67.82; H 7.47; N 24.71. M 283.37.
145.6, 148.8, 151.9. Найдено, %: C 68.55; H 8.44; N
22.90. C18H25N5. Вычислено, %: C 69.42; H 8.09; N
Кристаллографические данные: C16H21N5·
CF3CO2H,
(397.40), триклинная сингония Р-1,
22.49. М 311.42.
a 7.2455(3) Å, b 7.7150(4) Å, c 17.1022(8) Å,
N6-Метил-9-(3-изопропил-1-адамантил)аде-
α
101.502(4)°, β
95.939(4)°, γ
90.327(4)°, V
нин (3e). Получен из N6-метиладенина (156 мг,
931.43(8) Å3, Z 2, dвыч 0.998 г/см3.
1.05 ммоль), 2-(1-адамантил)-2-пропанола (194 мг,
N6,N6-Диметил-9-(1-адамантил)аденин
(3c).
1 ммоль) и CF3COOH (1.5 мл, 20 ммоль) при на-
Получен из N6,N6-диметиладенина
(171 мг,
гревании в течение 9 ч при 90°С аналогично со-
1.05 ммоль),
1-гидроксиадамантана
(152 мг,
единению 3а. Выход 270 мг (83%), белое твер-
1 ммоль) и CF3COOH (0.75 мл, 10 ммоль) при
дое вещество, т.пл. 122-124°C (этанол), Rf 0.55
нагревании в течение 4 ч при 80°С аналогично
(СHCl3-EtOH, 9:1, v/v). Спектр ЯМР 1H (400 МГц,
соединению 3а. Выход 260 г (87%), белое твер-
ДМСО-d6), δ, м.д.: 0.83 д (6Н, CHMe2, J 7.8 Гц),
дое вещество, т.пл. 168-170°C (этанол), Rf 0.65
1.31 м (1H, CHMe2), 1.51 уш.с (2H, CH2Ad), 1.59-
(СHCl3-EtOH, 9:1, v/v). Спектр ЯМР 1H (400 МГц,
1.74 м (4H, CH2Ad), 2.10 уш.с (2H, CHAd), 2.25
СDCl3), δ, м.д.: 1.76-1.85 м (6H, CH2Ad), 2.24 уш.с
уш.с (2H), 2.31 уш.с (4H, CH2Ad), 2.99 уш.с (3H,
(3H, CHAd), 2.43 уш.с (6H, CH2Ad), 3.51 уш.с (6H,
NHMe), 8.35 с (1H, CH), 8.36 с (1H, CH), 8.78 уш.с
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1182
КОВАЛЕВ и др.
(1H, NHMe). Спектр ЯМР 13С (100 МГц, СDCl3), δ,
Кристаллографические данные: C29H27N5O2
м.д.: 16.0 (CHMe2). 29.1 (CHAd), 30.8 (NHMe), 35.1
(477.56), моноклинная сингония, С
2/с, a
(CH2Ad), 36.7 (CH2Ad), 36.9 (CHMe2), 37.0 (CH2Ad),
26.761(3) Å, b 7.7197(9) Å, c 24.4205(19) Å, α
40.7 (CH2Ad), 43.1 (CH2Ad), 60.5 (CAd), 119.2, 138.9,
90°, β 103.617(8)°, γ 90°, V 4903.2(9) Å3, Z 8, dвыч
141.8, 149.7, 150.2. Найдено, %: C 70.35; H 8.75; N
1.294 г/см3.
22.01. C19H27N5. Вычислено, %: C 70.12; H 8.36; N
9-(3-Карбоксиметил-1-адамантил)аденин
21.52. М 325.43.
(5). Получен из аденина (142 мг, 1.05 ммоль),
N6,N6-Диметил-9-(3-изопропил-1-адаман-
3-карбоксиметил-1-гидроксиадамантана (210 мг,
тил)аденин (3f). Получен из N6,N6-диметиладе-
1 ммоль) и CF3COOH (1.5 мл, 20 ммоль) при 110°С
нина (171 мг, 1.05 ммоль), 2-(1-адамантил)-2-про-
в течение 12 ч. Реакционную смесь разлагали во-
панола (194 мг, 1 ммоль) и CF3COOH (1.2 мл,
дой и нейтрализовали до рН 7.0 концентрирован-
15 ммоль) при нагревании в течение 6 ч при
ным водным раствором NH3, осадок отфильтро-
90°С аналогично соединению 3а. Выход 300 мг
вывали, промывали водой, диэтиловым эфиром и
(88%), белое твердое вещество, т.пл. 132-134°C,
сушили. Выход 270 г (82%), белое твердое веще-
Rf 0.65 (СHCl3-EtOH, 9:1, v/v). Спектр ЯМР 1H
ство, т.пл. 175-177°C, Rf 0.20 (СHCl3-EtOH, 9:1,
(400 МГц, ДМСО-d6), δ, м.д.: 0.83 д (6H, CHMe2, J
v/v). Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.:
7.8 Гц), 1.31 м (1H, CHMe2), 1.51 уш.с (2H, CH2Ad),
1.68-1.55 м (6H, CH2Ad), 2.09 с (2H, CH2COOH),
1.60-1.75 м (4H, CH2Ad), 2.10 уш.с (2H, CHAd),
2.23 уш.с (6H, CH2Ad), 2.39-2.36 м (2H, CHAd),
2.20-2.40 м (6H, CH2Ad), 3.43 уш.с (6H, NMe2),
8.35 с (1H, CHPur), 8.36 с (1H, CHPur), 8.61 уш.с
8.12 с (1H, CH), 8.19 с (1H, CH). Спектр ЯМР 13С
(2H, NH2). Спектр ЯМР 13С (100 МГц, ДМСО-d6),
(100 МГц, ДМСО-d6), δ, м.д.: 16.4 (CHMe2), 29.2
δ, м.д.: 29.0 (CHAd), 34.1 (CH2Ad), 34.7 (CAd), 40.0
(CHAd), 35.4 (CH2Ad), 36.6 (CH2Ad), 36.9 (CHMe2),
(CH2Ad), 45.2 (CH2Ad), 47.3 (CH2CO), 59.0 (CAd),
37.3 (CH2Ad), 40.3 (CH2Ad), 42.6 (CH2Ad),
58.3
119.6, 140.2, 146.0, 148.8, 152.3, 172.2 (COОН).
(CAd), 120.8, 136.9, 150.4, 150.6, 154.4. Найдено, %:
Найдено, %: C 62.05; H 6.75; N 21.10. C17H21N5O2.
C 70.35; H 8.95; N 20.30. C20H29N5. Вычислено, %:
Вычислено, %: C 62.37, H 6.47, N 21.39. М 327.38.
C 70.76; H 8.61; N 20.63. М 339.48.
2-{2-[3-(6-Амино-9H-пурин-9-ил)-1-ада-
N6,N6-Дибензоил-9-(1-адамантил)аденин (4).
мантил]ацетил}-1-инданон (6). Раствор соеди-
Смесь 0.27 г (1 ммоль) 9-(1-адамантил)аденина 3а,
нения 5 (100 мг, 0.3 ммоль) и инданона (80 мг,
0.26 мл (2.3 ммоль) бензоилхлорида и 10 мл пи-
0.6 ммоль) в трифоруксусном ангидриде (1.95 мл,
ридина перемешивали 6 ч при кипячении. После
14 ммоль) перемешивали при комнатной темпе-
окончания реакции реакционную смесь вылива-
ратуре 20 мин, затем добавляли TfOH (50 мкл,
ли в воду (10 мл). Через 1 ч образовавшийся оса-
0.57 ммоль) и полученную смесь выдерживали
док отфильтровали, промывали водой, сушили.
еще 2 ч. Реакционную смесь упаривали, разлага-
Продукт очищали перекристаллизацией из изо-
ли водой и экстрагировали CH2Cl2. Экстракт про-
пропилового спирта. Выход 420 мг (88%), белое
мывали 5% NaHCO3, водой и сушили над MgSO4,
кристаллическое вещество, т.пл. 253-255°C (изо-
растворитель отгоняли в вакууме, полученный
пропанол), Rf 0.80 (СHCl3-EtOH, 9:1, v/v). Спектр
остаток очищали хроматографированием на SiO2
ЯМР 1H (400 МГц, CDCl3), δ, м.д.: 1.85-1.78 м
(CH2Cl2-MeOH, 98:2, v/v). Выход 100 мг (75%),
(6H, CH2Ad), 2.28 уш.с (3H, CHAd), 2.45 уш.с (6H,
светло-желтое твердое вещество, т.пл. 135-137°C,
CH2Ad), 7.35-7.31 м (4Hаром), 7.47-7.43 м (2Hаром),
Rf 0.45 (СHCl3-EtOH, 9:1, v/v). Спектр ЯМР 1H
7.86-7.83 м (4Hаром), 8.14 с (1H, CHPur), 8.62 с (1H,
(400 МГц, CDCl3), δ, м.д.: 1.71-1.84 м (6H, CH2Ad),
CHPur). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м.д.:
2.34 уш.с (6Н, CH2Ad), 2.42-2.46 м (4Н, CH2CO,
29.5 (CHAd), 36.0 (CH2Ad), 41.5 (CH2Ad), 59.0 (CAd),
CHAd), 3.62 c (2H, CH2), 5.96 уш.с (2Н, NH2), 7.41
127.8, 128.6, 129.4, 132.8, 134.40, 142.3, 150.8,
т (1H, J 7.4 Гц), 7.48 д (1H, J 7.6 Гц), 7.56 т (1H,
151.7, 153.5, 172.4 (CO). Найдено, %: C 72.35; H
J 7.4 Гц), 7.83 д (1H, J 7.6 Гц), 7.68 с (1H), 8.30 с
6.95; N 14.10. C29H27N5O2. Вычислено, %: C 72.94;
(1H). Спектр ЯМР 13С (100 МГц, CDCl3), δ, м.д.:
H 5.70; N 14.66. М 477.57.
29.2 (CHAd), 30.3 (CH2), 34.7 (CAd), 36.6 (CH2Ad),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
АДАМАНТИЛИРОВАНИЕ АДЕНИНА И РОДСТВЕННЫХ СОЕДИНЕНИЙ
1183
40.3 (CH2Ad), 41.0 (CH2Ad), 46.1 (CH2Ad),
47.1
ФОНДОВАЯ ПОДДЕРЖКА
(CH2CO), 58.3 (CAd), 111.6 [C=C(OH)], 120.5 (CPur),
Работа выполнена в рамках государственного
123.0 (CHаром), 125.4 (CHаром), 127.0 (CHаром),
задания «Нефтехимия и катализ. Рациональное
132.8 (CHаром), 137.3 (Cаром), 137.9 (Cаром), 147.6
использование углеродсодержащего сырья»,
(Cаром), 149.8 (CPur), 151.1 (CPur), 155.2 (CPur), 175.3
№ 121031300092-6.
(C=C(OH)), 193.5 (CO). Найдено, %: C 70.35; H
КОНФЛИКТ ИНТЕРЕСОВ
6.35; N 15.33. C26H27N5O2. Вычислено, %: C 70.73;
H 6.16; N 15.86. М 441.52.
Авторы заявляют об отсутствии конфликта ин-
тересов.
5-[3-(6-Амино-9H-пурин-9-ил)-1-адаман-
тил]урацил
(7).
Смесь аденина
(213 мг,
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
1.5 ммоль),
5-(3-гидрокси-1-адамантил)урацила
Дополнительные материалы доступны на
(262 мг, 1 ммоль), CF3COOH (1.5 мл, 20 ммоль) и
LiClO4 (5 мг) нагревали в течение 15 ч при 110°С.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Реакционную смесь разлагали водой, образовав-
шийся осадок отфильтровывали, промывали во-
Ковалев Владимир Васильевич, ORCID: http://
дой и растворяли в 1н. NaOH (3 мл). Раствор на-
orcid.org/0000-0003-4473-1107
гревали при 50°C в течение 1 ч, охлаждали и после
Шокова Эльвира Александровна, ORCID: http://
подкисления раствора до рН 8.0 образовавшийся
orcid.org/0000-0003-3065-637X
осадок отфильтровали, промывали водой и суши-
ли. Выход 300 мг (79%), серый порошок, т.пл. 238-
Тафеенко Виктор Александрович, ORCID:
240°C, Rf 0.15 (СHCl3-EtOH, 9:1, v/v). Спектр ЯМР
1H (400 МГц, ДМСО-d6), δ, м.д.: 1.71-2.00 м (6H,
СПИСОК ЛИТЕРАТУРЫ
CH + CH2Ad), 2.20-2.40 м (6H, CH2Ad), 2.52 уш.с
1. Nasrallah H., Hierso J.-C. Chem. Mater. 2019, 31,
(2H, CHAd), 7.06 с (1H, CH), 7.12 с (2H, NH2), 8.10
619-642. doi 10.1021/acs.chemmater.8b04508
с (1H, CH), 8.17 с (1H, CH), 10.70 уш.с (1H, NH),
2. Wanka L., Iqbal K., Schreiner P.R. Chem. Rev. 2013,
10.95 уш.с (1H, NН). Спектр ЯМР 13С (100 МГц,
113, 3516-3604. doi 10.1021/cr100264t
ДМСО-d6), δ, м.д.: 29.0 (CHAd), 34.9 (CAd), 36.3
3. Agnew-Francis K.A., Williams C.M. Adv. Synth. Catal.
(CH2Ad), 38.2 (CH2Ad), 43.1 (CH2Ad), 57.8 (CAd),
2016, 358, 675-700. doi 10.1002/adsc.201500949
118.2, 120.1, 136.9, 138.0, 149.6, 150.9, 151.4, 156.2
4. Шокова Э.А., Ковалев В.В. Хим.-фарм. ж. 2013, 47,
(CO), 163.4 (CO). Найдено, %: C 60.35; H 5.95; N
32-48. [Shokova E.A., Kovalev V.V. Pharm. Chem. J.
25.40. C19H21N7O2. Вычислено, %: C 60.15; H 5.58,
2013, 47, 264-280.] doi 10.1007/s11094-013-0942-1
N 25.84. М 379.42.
5. Шокова Э.А., Ковалев В.В. Хим.-фарм. ж. 2016, 50,
ВЫВОДЫ
84-96. [Shokova E.A., Kovalev V.V. Pharm. Chem. J.
2016, 50, 63-75.] doi 10.1007/s11094-016-1400-7
Было изучено адамантилирование аде-
6. Rosemeyer H. Chem. Biodiv. 2004, 1, 361-401. doi
нина и родственных ему соединений
3-R-1-
10.1002/cbdv.200490033
гидроксиадамантанами и
2-(1-адамантил)про-
7. Aigami K., Inamoto Y., Takaishi N., Hattori K.,
панолом-2 в среде трифторуксусной кислоты.
Takatsuki A., Tamura G. J. Med. Chem. 1975, 18, 713-
Показано, что в результате реакции с высокими
721. doi 10.1021/jm00241a015
выходами образуются 9-(3-R-1-адамантил)адени-
8. Kazimierczuk Z., Orzeszko A. Helv. Chim. Acta.
ны. Направление реакции адамантилирования по
1999,
82,
2020-2027. doi
10.1002/(sici)1522-
положению 9 пуринового гетероцикла доказано
2675(19991110)82:11<2020::aid-hlca2020>3.0.co;2-P
методом РСА. Впервые получены адамантилиро-
9. Maurin J.K., Lasek W., Gorska A., Switaj T.,
ванные аденины с функциональными (карбокси-
Jakubowska A.B., Kazimierczuk Z. Chem. Biodiv.
метильными, β-дикарбонильными и пиримидино-
2004, 1, 1498-1512. doi 10.1002/cbdv.200490110
выми) заместителями в адамантановом в фрагмен-
10. Rouchal M., Necas M., Vicha R. Acta Crystallogr., Sect.
те молекулы.
E. 2009, 65, o1268. doi 10.1107/S1600536809016596
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021
1184
КОВАЛЕВ и др.
11. Kavai I., Mead L.H., Drobniak J., Zakrzewski S.F.
17. CCDC 2032369 (3b·CF3COOH) и CCDC 2032371
J. Med. Chem. 1975, 18, 272-275. doi 10.1021/
(5) содержат кристаллографические данные для
jm00237a012
данной статьи. Эти данные доступны: https://
12. Young R.C., Jones M., Milliner K.J., Rana K.K.,
Ward J.G. J. Med. Chem. 1990, 33, 2073-2080. doi
18. Kovalev V., Shokova E., Rozov A. Tetrahedron. 1996,
10.1021/jm00170a00
52, 3983-3990. doi 10.1016/S0040-4020(96)00062-2
13. Dejmek M., Kovačková S., Zborníková E., Hřebabec-
19. Kim J.K., Shokova E., Tafeenko V., Kovalev V.
ký H., Šála M., Dračínský M., Nencka R. RSC Adv.
Beilstein J. Org. Chem. 2014, 2270-2278. doi 10.1039/
2012, 2, 6970. doi 10.1039/c2ra20842c
D0OB01228A
14. Shmailov A., Alimbarova L., Shokova E., Tafeenko V.,
20. Kumar M., Berkson Z.J., Clark R.J., Shen Y., Pris-
Vatsouro I., Kovalev V. Tetrahedron. 2010, 66, 3058-
co N.A., Zheng Q., Zeng Z., Zheng H., McCus-
3064. doi 10.1016/j.tet.2010.02.043
ker L.B., Palmer J.C., Chmelka B.F., Rimer J.D. J. Am.
15. Shokova E., Mousoulou T., Lyzikov Yi., Kovalev V.
Chem. Soc. 2019, 141, 20155-20165. doi 10.1021/
Synthesis. 1997, 1034-1040. doi 10.1055/s-1997-1304
jacs.9b09697
16. Joule J.A., Mills K. Heterocyclic Chemistry. 5th Edn.
21. Bott K. Chem. Ber. 1968, 101, 564-573. doi 10.1002/
Manchester: Wiley, 2010, 516.
cber.19681010225
Adamantylation of Adenine and Related Compounds
with Hydroxyadamantanes in Trifluoroacetic Acid
V. V. Kovalev*, E. A. Shokova, and V. A. Tafeenko
Lomonosov Moscow State University, Leninskie gory, 1/3, Moscow, 119991 Russia
*e-mail: kovalev@petrol.chem.msu.ru
Received April 10, 2021; revised April 21, 2021; accepted April 23, 2021
The adamantylation of adenine, N6-methyl- and N6,N6-dimethyladenines with 3-R-1-hydroxyadamantanes (R =
H, i-Pr, CH2COOH, 5-uracilyl) in trifluoroacetic acid gave high yields of 9- (3-R-1- adamantyl) adenines. The
structures of 9-(1-adamantyl)- and N6-methyl-9-(1-adamantyl) adenines were proved by XRD.
Keywords: adenine, N6-methyladenines, 3-R-1-hydroxyadamantanes, trifluoroacetic acid, 9-(3-R-1-adamantyl)-
adenines
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 57 № 8 2021